ISOLASI DAN IDENTIFIKASI BAKTERI POTENSIAL
PROBIOTIK PADA SALURAN PENCERNAAN
IKAN MAS (Cyprinus carpio)
Isolation and Identification Potential Probiotic Bacteria in Digestive Tract of Goldfish (Cyprinus carpio)
Mikha Febryana Samosir(1), Dwi Suryanto(2), Desrita(2)
1) Program Studi Manajemen Sumberdaya Perairan, Fakultas Pertanian, Universitas
Sumatera Utara, (email : [email protected])
2) Staf Pengajar Program Studi Manajemen Sumberdaya Perairan, Fakultas
Pertanian, Universitas Sumatera Utara
ABSTRACT
Probiotics are beneficial microbes to improve microbial balance in the digestive tract. The aims of this study was to isolate the potential probiotic bacteria in Goldfish (Cyprinus carpio). This study was conducted from May to October 2016 at the Fish Quarantine, Quality Control and Safety of Fishery Class I Medan I, Kuala Namu Medan. The isolation and identification of bacteria was carried out based on morphology and biochemistry tests. The result showed that the potential probiotic bacteria in the digestive tract of C. carpio was Micrococcus
varians, Staphylococcus arlettae and Bacillus firmus.
Keywords : C. carpio, identification, isolation, probiotic.
PENDAHULUAN
Seiring dengan meningkatnya jumlah penduduk yang diimbangi dengan kesadaran pentingnya kandungan protein yang terkandung pada ikan, maka permintaan produk akan perikanan semakin meningkat. Salah satu produk perikanan air tawar yang mempunyai permintaan pasar yang luas adalah Ikan Mas (Cyprinus carpio).
Dalam upaya memenuhi permintaan pasar, maka perlu dilakukan upaya budidaya secara intensif, namun dalam budidaya secara intensif sering dihadapkan pada beberapa kendala seperti terjadinya serangan bakteri patogen terutama pada stadia larva yang menimbulkan penurunan kualitas dan
tingkat produksi pada usaha pembenihan ikan, bahkan kematian dan kegagalan panen dapat terjadi.
Hingga kini, metode yang paling sering dilakukan dalam penanggulangan penyakit patogenik pada ikan adalah penggunaan bahan kimia atau antibiotik. Metode ini merupakan metode yang cukup efektif untuk menghambat bahkan membunuh mikroorganisme patogen, akan tetapi metode ini sangat beresiko karena beberapa bahan kimia yang digunakan dapat menimbulkan resistensi sehingga dikategorikan tidak ramah lingkungan dan residu antibiotik dapat terakumulasi pada ikan yang dapat membahayakan manusia yang mengkonsumsinya.
2 Salah satu alternatif pemecahan untuk menanggulangi permasalahan tersebut adalah pengunaan bakteri probiotik sebagai agen biokontrol pada perikanan. Dasar pendekatan ini adalah senyawa-senyawa racun yang dihasilkan pada metabolisme bakteri probiotik seperti asam laktat, hidrogen peroksida, bakteriosin yang bersifat antimikroba dan antibiotik mampu menekan atau menghambat pertumbuhan bakteri patogen melalui produksi senyawa antimikroba, memperbaiki keseimbangan mikroba di dalam saluran pencernaan, memberikan pengaruh positif terhadap fisiologi dan kesehatan inangnya, mestimulasi sistem imun dan memperbaiki kualitas air (Irianto, 2005).
Tujuan Penelitian
1. Untuk mengetahui bakteri yang berpotensi sebagai probiotik pada saluran pencernaan Ikan Mas (C. carpio).
2. Untuk mengetahui apakah bakteri potensial probiotik yang berhasil diidentifikasi bersifat antagonistik terhadap bakteri uji patogen Aeromonas hydrophila.
METODE PENELITIAN Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Mei – Oktober 2016, Isolasi dan Identifikasi bakteri dilakukan di Balai Karantina Ikan, Pengendalian Mutu dan Keamanan Hasil Perikanan (BKIPM) Kelas I Medan I, Jalan Karantina Ikan, Kualanamu Medan.
Alat yang digunakan pada penelitian ini adalah inkubator,
laminar air flow, autoclave,
erlenmeyer, vortex stirrer,
aluminium foil, lampu bunsen,
cawan Petri, tabung reaksi, rak tabung, jarum ose, pipet tetes, mikroskop, cover glass, paper disk, timbangan digital, mortal porselen, kapas, gelas beaker, pisau, kamera digital, sarung tangan, masker, kertas label, dan alat tulis.
Bahan yang digunakan pada penelitian ini yaitu Ikan Mas (Cyprinus carpio), isolat bakteri patogen Aeromonas hydrophila,
media Tryptone Soya Agar (TSA), media de Mann Rose Agar (MRSA), media Triple Sugar Iron Agar (TSIA), media Lysine Iron Agar (LIA), media Gelatin, media Urea, kmedia Sulfid Indol Motility (SIM), media Strach Agar, media Skim Milk
Agar (SMA), kertas Oxidase media Methly Red, media Voges Proskaurt
(VP), media Simmons Citrate, media gula-gulaan (glukosa, laktosa, manitol, maltosa dan sukrosa), kertas Oxidase Test Strip, reagen Kovac, methyl red, kristal violet, iodine,
safranin, alkohol 95%, akuades, hidrogen peroksida (H2O2) 3%,
alkohol, larutan fisiologis (NaCl 0,9 %) dan larutan Mc Farland.
Pelaksanaan Penelitian
Penelitian akan dilakukan dengan isolasi lambung dan usus Ikan Mas pada media MRSA, kemudian dilakukan uji hidrolisis kasein, hidrolisis pati dan uji penghambatan bakteri uji patogen
Aeromonas hydrophila untuk mendapatkan bakteri potensial probiotik. Setelah itu dilakukan identifikasi bakteri berdasarkan uji pewarnaan Gram dan uji Biokimia. Pengambilan Sampel
Ikan dibedah secara aseptis untuk diambil organ pencernaannya yaitu lambung dan usus, kemudian dimasukkan kedalam larutan
3 fisiologis (NaCl 0.9%). Selanjutnya, lambung dan usus dihancurkan atau dihaluskan dengan menggunakan mortar porselen. Sampel yang telah dihaluskan, kemudian dilakukan pengenceran berseri 10-1 sampai 10-5. Metode seri pengenceran yang dilakukan yaitu dengan mengambil sebanyak 1 ml sampel, dimasukkan ke dalam tabung reaksi yang berisi 9 ml akuades steril lalu dihomogenisasi menggunakan vortex
stirrer selama 2-4 menit sehingga
didapat pengenceran 10-1, untuk mendapatkan pengenceran 10-2
dilakukan dengan mengambil 1 ml dari pengenceran 10-1 dimasukkan ke dalam tabung reaksi yang berisi 9 ml akuades steril, demikian seterusnya dilakukan seri pengenceran hingga 10-5. Pengenceran 10-5 diambil 1 ml kemudian dimasukkan ke dalam cawan Petri yang telah berisi
medium MRSA dengan
menggunakan metode cawan sebar (spread plate), kemudian diinkubasi pada suhu 35°C selama 24 jam.
Setelah inkubasi selama 24 jam, koloni dengan penampakan morfologi yang berbeda dari warna, bentuk, tepian, dan elevasi pada medium MRSA kemudian diambil dan dimurnikan (diisolasi) pada media baru MRSA dengan menggunakan metode cawan gores dengan beberapa tahap sampai didapatkan koloni bakteri tunggal sebagai isolat murni, kultur diinkubasi pada suhu 35°C selama 24 jam. Selanjutnya, dilakukan seleksi sebagai kandidat probiotik dengan melakukan serangkaian uji hidrolisis pati (amilum) dan uji hidrolisis kasein (protein) serta melakukan uji penghambatan bakteri potensial probiotik terhadap bakteri patogen
Aeromonas hydrophila.
Uji Hidrolisis Pati (Amilum)
Suspensi bakteri hasil biakan murni diambil satu ose dan digoreskan pada cawan yang berisi media Strach Agar, dan diinkubasi pada suhu 35°C selama 24 jam. Setelah inkubasi, dilakukan uji iodine dengan cara meneteskan iodine pada permukaan agar yang berisi isolat. Uji hidrolisis pati positif ditandai dengan adanya zona kuning bening di sekeliling isolat.
Uji Hidrolisis Kasein (Protein) Suspensi bakteri hasil biakan murni diambil satu ose dan digoreskan pada cawan yang berisi media Skim Milk Agar (SMA), dan diinkubasi pada suhu 35°C selama 24 jam. Uji hidrolisis protein positif ditandai dengan adanya zona bening di sekeliling koloni (Fardiaz, 1992). Uji Penghambatan Bakteri Uji Patogen
Metode yang digunakan adalah metode cawan sebar (spread
plate). Bakteri uji patogen dan
bakteri potensial probiotik disuspensikan hingga kekeruhannya sama dengan larutan suspensi Mc
Farland yaitu 108 CFU/ml. Bakteri uji patogen diisolasi kedalam cawan petri yang berisi media TSA dengan teknik cawan sebar (spread plate), kemudian paper disk yang telah direndam ke dalam kultur cair isolat bakteri potensial probiotik ditanam dengan cara ditekan ke atas media TSA. Selanjutnya inkubasi pada suhu 35°C selama 24 jam. Setelah inkubasi diamati adanya zona bening pada media.
4 Identifikasi Spesies Bakteri Potensial Probiotik
Karakterisasi Morfologi Isolat Isolat bakteri murni diidentifikasi morfologi selnya dengan menggunakan uji pewarnaan gram dan pengamatan bentuk bakteri secara mikroskopik. Pewarnaan gram dilakukan dengan membersihkan kaca objek dengan alkohol dan disterilkan pada nyala api bunsen, kemudian diambil isolat bakteri dengan jarum ose dan dioleskan pada
object glass. Isolat bakteri kemudian
ditetesi kristal violet dan dibiarkan selama 1 menit, selanjutnya dicuci dengan air mengalir dan dianginkan hingga kering. Isolat bakteri kemudian ditetesi kembali dengan larutan iodine dan dibiarkan selama 1 menit, kemudian dicuci dengan air mengalir dan dianginkan hingga kering. Selanjutnya isolat bakteri ditetesi alkohol 95% selama 30 detik, kemudian dialiri air dan dianginkan hingga kering. Isolat bakteri kemudian ditetesi safranin selama 30 detik dan dicuci dengan air mengalir dan dikering anginkan, kemudian dilakukan pengamatan dengan menggunakan mikroskop. Bakteri gram positif ditandai dengan warna ungu sedangkan bakteri gram negatif ditandai dengan warna merah muda Bakteri yang tumbuh kemudian diamati bentuk selnya secara mikroskopik pada kaca preparat sehingga dapat diketahui bentuknya (kokus, batang atau spiral).
Identifikasi Berdasarkan Uji Biokimia
Uji Motilitas
Sebanyak satu ose isolat bakteri ditusukkan ke medium uji SIM dan diinkubasi selama 24 jam pada suhu 29ºC.
Uji positif ditandai dengan pertumbuhan bakteri yang menyebar, maka bakteri tersebut bergerak (motil) dan bila pertumbuhan bakteri tidak menyebar, maka bakteri tersebut tidak bergerak (non motil) (Sudarsono, 2008).
Uji Katalase
Sebanyak 2 tetes H2O2 3%
diletakkan pada object glass steril. Isolat bakteri diambil menggunakan jarum ose steril, kemudian dipindahkan ke atas kaca objek dan dicampurkan.
Uji positif ditandai dengan terbentuknya gelembung-gelembung oksigen dan uji negatif ditandai dengan tidak adanya perubahan atau gelembung-gelembung oksigen pada isolat bakteri (Hadioetomo, 1993). Uji Oksidase
Sebanyak satu ose isolat bakteri digoreskan pada kertas
Oxidase Test Strip. Tunggu selama 1
menit, lalu amati hasilnya.
Uji positif ditandai dengan perubahan warna menjadi biru violet dan uji negatif ditandai dengan tidak adanya perubah warna pada kertas
oxidase test strip.
Uji TSIA
Sebanyak satu ose isolat bakteri diinokulasi ke dalam media TSIA dengan cara menusuk tegak lurus pada bagian butt (tusuk) dan cara zig zag pada bagian slant (miring) dan diinkubasi selama 24 jam pada suhu 29ºC.
Perubahan warna kemudian diamati, apabila bagian slant
berwarna merah dan butt berwarna kuning maka bakteri mampu memfermentasi glukosa, sedangkan apabila bagian slant dan butt keduanya berwarna kuning maka
5 bakteri mampu memfermentasi sukrosa dan laktosa (Yusuf, 2009). Uji Gelatin
Sebanyak satu ose isolat bakteri diinokulasikan pada media cair Gelatin dan diinkubasi selama 24 jam pada suhu 29ºC.
Uji positif ditandai dengan media cair tetap mencair apabila telah diletakkan di dalam lemari es selama beberapa menit dan uji negatif ditandai dengan membekunya media gelatin jika diletakkan di dalam lemari es.
Uji Urea
Sebanyak satu ose isolat bakteri diinokulasi secara zig-zag pada permukaan agar miring media Urea dan diinkubasi selama 24 jam pada suhu 29ºC.
Uji positif ditandai dengan berubahnya warna medium menjadi biru dan uji negatif ditandai dengan tidak terjadinya perubahan warna pada media (Sudarsono, 2008). Uji Citrat
Sebanyak satu ose isolat bakteri diinokulasi secara zig-zag pada permukaan agar miring media
Simmons Citrate dan diinkubasi
selama 24 jam pada suhu 29ºC. Uji positif ditandai dengan berubahnya warna medium menjadi biru dan uji negatif ditandai dengan tidak terjadinya perubahan warna pada media (Sudarsono, 2008). Uji MR
Sebanyak satu ose isolat bakteri diinokulasi ke dalam media MR-VP dan diinkubasi selama 24 jam pada suhu 29ºC. Setelah inkubasi selama 24 jam, media ditambahkan 3-4 tetes indikator metil
red.
Uji positif ditandai dengan perubahan warna medium menjadi merah, artinya terbentuk asam dan uji negatif ditandai dengan tidak adanya perubahan warna pada media (Hadioetomo, 1993).
Uji LIA
Sebanyak satu ose isolat bakteri diinokulasi secara tusuk lalu zig-zag pada permukaan agar miring media LIA dan diinkubasi selama 24 jam pada suhu 29ºC.
Uji positif ditandai dengan berubahnya warna medium menjadi ungu dan uji negatif ditandai dengan tidak terjadinya perubahan warna pada media (Sudarsono, 2008). Uji Gula-Gulaan
Sebanyak satu ose isolat bakteri diinokulasikan ke dalam tabung-tabung reaksi yang berisi medium fermentasi glukosa, arabinosa, sorbitol, manitol, inositol dan sukrosa, dan diinkubasi selama 24 jam pada suhu 29ºC.
Uji positif ditandai dengan berubahnya warna medium menjadi kuning dan apabila dalam tabung terdapat gelembung, berarti fermentasi tersebut menghasilkan gas (CO2).
Analisis Data
Data yang telah diperoleh dianalisis secara deskriptif dengan mendeskripsikan secara sistematis dan akurat secara ilmiah. Hasil uji terhadap isolat-isolat yang diperoleh, dilakukan upaya identifikasi bakteri berdasarkan karakter biokimia sesuai dengan tabel biokimia dengan berpedoman pada buku “Bergey’s
Manual of Determinative Bacteriology 8th Edition.
6 Hasil dan Pembahasan
Hasil
Bakteri Potensial Probiotik Pada Lambung dan Usus Ikan Mas
Dari penelitian yang telah dilakukan, diperoleh hasil bahwa jumlah isolat bakteri potensial probiotik dari isolasi lambung dan usus Ikan Mas (Cyprinus carpio) ditemukan sebanyak 4 isolat bakteri, yaitu terdapat 2 isolat bakteri dari hasil isolasi pada lambung dan 2 isolat bakteri dari hasil isolasi pada usus. Hasil tersebut diperoleh setelah dilakukan uji untuk menyeleksi seluruh isolat yang ditemukan dari lambung dan usus Ikan Mas (C. carpio) sehingga diperoleh isolat bakteri yang memang merupakan potensial probiotik yaitu sebanyak 4 isolat murni.
Morfologi Koloni dan Sel Bakteri Potensial Probiotik Pada Ikan Mas Isolat-isolat bakteri potensial probiotik yang ditemukan dari hasil isolasi lambung dan usus Ikan Mas (C. carpio) dapat dilihat dari morfologi koloni meliputi tepian, elevasi dan warna koloni. Adapun ciri-ciri morfologi dari keempat koloni yang berhasil diperoleh dapat dilihat pada Tabel 1. Berdasarkan Tabel 1 dapat dijelaskan bahwa ke-4 jenis bakteri memiliki kemiripan pada tepian dan elevasi, yaitu bertepi licin dan berelevasi cembung, sedangkan pada warna dan bentuk memiliki perbedaan yaitu ke-2 isolat bakteri memiliki warna putih kekuningan dan 2 isolat lainnya memiliki warna putih.
Tabel 1. Morfologi Koloni Isolat Bakteri Potensial Probiotik Pada Ikan Mas
Kode Isolat
Koloni Morfologi Sel
Tepian Elevasi Warna Gram Bentuk LIM-01 Licin Cembung Putih Kekuningan + Kokus LIM-02 Licin Cembung Putih Kekuningan + Kokus
UIM-01 Licin Cembung Putih + Kokus
UIM-02 Licin Cembung Putih + Basil
Pengamatan morfologi pada sel isolat bakteri potensial probiotik yang diperoleh dari Ikan Mas perlu dilakukan dengan pewarnaan Gram dan uji Biokimia untuk mengidentifikasi bakteri potensial probiotik pada Ikan Mas. Pewarnaan gram dilakukan secara mikroskopik dengan pembesaran 100x didapat hasil pewarnaan Gram dari ke-4
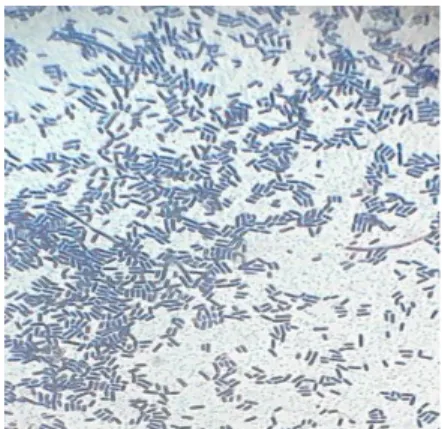
isolat bakteri yaitu berwarna ungu yang merupakan Gram positif karena mampu mengikat kristal violet. 1 dari 3 isolat bakteri tersebut berbentuk basil atau batang, sedangkan yang lainnya berbentuk kokus atau bulat. Hasil pewarnaan gram dari isolat bakteri potensial probiotik dapat dilihat pada Gambar 2.
7
Gambar 2. Bentuk Sel dari Isolat (a) UIM-01 (b) UIM-02 Karakterisasi dan Identifikasi
Bakteri Potensial Probiotik Pada Ikan Mas
Hasil pengamatan morfologi sel baik pewarnaan Gram dan uji biokimia dari ke-4 isolat bakteri
dapat dilihat pada Tabel 2. Hasil uji Biokimia dari ke-4 bakteri yang diperoleh diidentifikasi menurut buku Bergey’s Manual of
Determinative Bacteriology 8th Edition oleh Holt dkk., (1994).
Tabel 2. Karakterisasi Isolat Bakteri Probiotik Potensial Pada Ikan Mas
Karaterisasi Bakteri
Isolasi Bakteri
LIM-01 LIM-02 UIM-01 UIM-02
Motilitas - - - -
Katalase + + + +
Oksidase + + - -
TSIA A/A A/A K/K K/K
Gelatin - - - - Urea - - - - Citrat - - - - MR + + + + LIA - - - - Glukosa + + + + Arabinosa - - - - Sorbitol - - - - Manitol + + + + Inositol + + + + Sukrosa - - + + Spesies Bakteri Micrococcus varians Micrococcus varians Staphylococcus
arlettae Bacillus firmus
Hasil karakterisasi dan identifikasi ke-4 isolat bakteri isolat dengan kode LIM-01 dan LIM-02 merupakan
Micrococcus varians, isolat dengan
kode UIM-01 merupakan
Staphylococcus arlattae dan isolat
dengan kode UIM-02 merupakan
Bacillus firmus.
Identifikasi bakteri dilakukan dengan teknik konvensional yaitu dengan membandingkan bakteri yang sedang diidentifikasi dengan bakteri yang telah teridentifikasi sebelumnya. Bila tidak terdapat bakteri yang ciri-cirinya 100% mempunyai kemiripan ciri-ciri, maka dilakukan pendekatan terhadap
8 bakteri yang memiliki ciri-ciri yang paling menyerupai. Oleh karena itu teknik identifikasi dengan metode konvensional akan selalu menghasilkan suatu bakteri tertentu yang sudah teridentifikasi sebelumnya dan tidak akan dapat menemukan spesies baru (Bergey, 1994).
Hidrolisis Pati (Amilum) dan Kasein (Protein) Pada Isolat Bakteri
Uji hidrolisis pati (amilum) dan kasein (protein) terhadap isolat bakteri dilakukan untuk mengetahui
kemampuan bakteri dalam menguraikan enzim amilase dan protease yang merupakan tahap awal dalam seleksi seluruh isolat bakteri untuk mendapatkan kandidat bakteri yang berpotensi probiotik pada Ikan Mas. Uji hidrolisis dilakukan dengan menggoreskan masing-masing koloni bakteri pada media uji pati (amilum) dan kasein (protein) kemudian ditandai dengan terbentuknya zona bening. Kemampuan isolat-isolat bakteri dalam menghidrolisis pati (amilum) dan kasein (protein) dapat dilihat pada Tabel 3.
Tabel 3. Kemampuan Isolat Kandidat Probiotik Menghidrolisis Pati dan Kasein
Kode Isolat Hidrolisis
Kasein Pati LIM-01 + - LIM-02 + - UIM-01 + - UIM-02 + -
Gambar 3. Hidrolisis Kasein (a) UIM-01 (b) UIM-02 Indikasi Penghambatan Bakteri
Aeromonas hydrophila
Isolat-isolat bakteri yang mampu menghidrolisis pati (amilum) dan kasein (protein) selanjutnya diuji tantang dengan bakteri Aeromonas
hydrophila untuk mengetahui adanya
indikasi penghambatan terhadap bakteri A. hydrophila. Uji tersebut
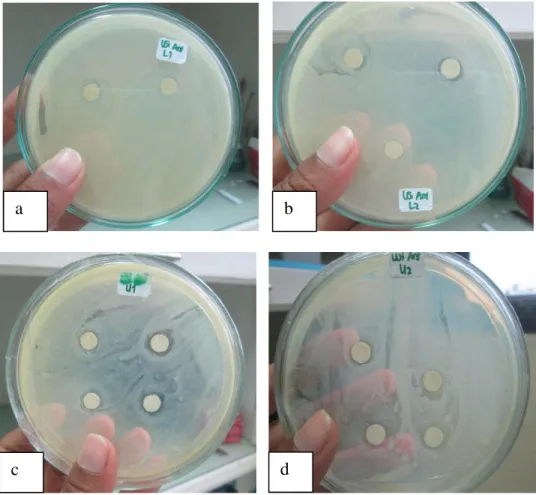
bertujuan untuk memastikan bahwa ke-4 isolat bakteri tersebut merupakan isolat bakteri yang berpotensi probiotik pada Ikan Mas (C. carpio). Indikasi penghambatan isolat bakteri potensial probiotik terhadap bakteri patogen A. hydrophila dapat dilihat pada Gambar 4.
9
Gambar 4. Indikasi Penghambatan bakteri A.hydrophila (a) M. varians (b) M. varians (c) S. arlattae (d) B. firmus
Indikasi penghambatan pada bakteri patogen A. hydrophilla menunjukkan bahwa empat isolat dari hasil isolasi saluran pencernaan Ikan Mas menghasilkan zona bening di sekitar
paperdisk yang menunjukkan bahwa
isolat bakteri yang berpotensi sebagai probiotik tersebut mampu menghambat pertumbuhan bakteri uji patogen A. hydropilla.
Besarnya daerah zona bening di sekitar paper disk yang dihasilkan tiap-tiap isolat berbeda-beda berdasarkan tingkat daya hambat bakteri terhadap bakteri uji. Berdasarkan Gambar 4, nilai indikasi hambatan untuk bakteri M. varians sebesar 2 mm, bakteri S. arlattae sebesar 2 mm dan bakteri B. firmus sebesar 3 mm.
Pembahasan
Bakteri Potensial Probiotik Pada Lambung dan Usus Ikan Mas
Dari hasil isolasi yang dilakukan pada lambung dan usus Ikan Mas didapatkan isolat murni sebanyak 4 isolat. Lambung dan usus tersusun oleh mikroba yang bersifat memberikan dampak bagi peningkatan keseimbangan mikroba dan mampu menghancurkan bakteri patogen pengganggu sistem pencernaan. Hal ini sesuai dengan Lestari (2012) yang menyatakan bahwa jenis bakteri yang dominan dalam saluran pencernaan dapat mempengaruhi pertumbuhan dan perkembangan ikan sehingga dapat meningkatkan kualitas ikan. Bakteri yang terdapat di dalam saluran
c d
10 pencernaan ikan menghasilkan enzim yang mampu digunakan dalam mendegradasi nutrisi dalam pakan. Beberapa mikroflora dalam saluran pencernaan dapat melindungi usus dari serangan bakteri patogen dan merangsang pembentukan imunitas. Morfologi Koloni dan Sel Bakteri Potensial Probiotik Pada Ikan Gurami
Berdasarkan hasil pengamatan koloni dari ke-4 isolat bakteri potensial probiotik pada tabel 2 diketahui, bahwa morfologi pada ke-4 isolat bakteri memiliki kemiripan pada tepian dan elevasi, dimana ke-4 isolat bakteri tersebut memiliki tepian licin, dan elevasi cembung sedangkan pada memiliki sedikit perbedaan dimana pada isolat pada lambung bewarna putih kekuningan dan isolat pada usus berwarna putih.
Hasil pengamatan morfologi sel dari ke-4 isolat bakteri melalui pewarnaan Gram menunjukkan bahwa 3 isolat bakteri tersebut memiliki bentuk sel kokus dan 1 isolat bakteri berbentuk basil. Masing-masing bakteri merupakan Gram positif yang mampu mempertahankan kristal violet pada pewarnaan Gram (Gambar 3). Bakteri Gram positif merupakan bakteri yang memiliki dinding sel yang tebal dan membran sel selapis sehingga pada saat bakteri mengalami dehidrasi dengan pemberian alkohol 96% pori-porinya akan mengkerut yang menyebabkan warna utama (kristal violet) tidak bisa keluar.
Karakterisasi dan Identifikasi Bakteri Potensial Probiotik Pada Ikan Mas
Hasil uji biokimia pada kode LIM-01 dan LIM-02 menunjukkan hasil yang sama yaitu negatif untuk uji gelatin, urea, citrat, LIA, arabinosa, sorbitol dan sukrosa dan positif untuk uji katalase, oksidase, MR, manitol, dan inositol serta TSIA bernilai acid. Dari hasil tersebut selanjutnya dilakukan penentuan spesies berdasarkan buku Bergey’s
Manual of Determinative Bacteriology 8th Edition yang menyimpulkan bahwa bakteri tersebut merupakan Micrococcus varians. Hal ini sesuai dengan Holt
dkk., (1994) yang menyatakan bahwa bakteri Micrococcus sp. memiliki ciri-ciri yaitu koloni berwarna putih dan berbentuk bulat dengan tepian timbul. Sel berdiameter 0,5-2,0 μm dalam bentuk sepasang, empat pasang, atau kelompok tidak tetap, tidak membentuk rantai, Gram positif, tidak motil, metil red positif, katalase positif dan oksidase positif, suhu optimum pertumbuhan pada 30-37ºC dan tumbuh baik pada NaCl 1-7%.
Hasil uji biokimia pada isolat lainnya yaitu dengan kode UIM-01 ditemukan sedikit perbedaan hasil pada uji biokimia kode LIM-01 dan LIM-02 yaitu pada hasil uji oksidase dan sukrosa yang bernilai positif, dan TSIA yang bernilai alkali. Adapun hasil uji biokimia pada kode isolat UIM-01 yaitu positif untuk katalase, MR, glukosa, manitol, inositol, dan sukrosa, negatif untuk motilitas, oksidase, gelatin, urea, citrat, LIA, arabinosa dan sorbitol serta TSIA yang bernilai alkali. Dari hasil tersebut menyatakan bahwa isolat tersebut merupakan Staphylococcus
11 Feliatra dkk., (2004) yang menyatakan bahwa bakteri
Staphylococcus sp. merupakan bakteri yang memiliki koloni berwarna putih susu atau agak krem, berbentuk bulat, tepian timbul, sel bentuk bola, diameter 0,5-1,5 μm, berpasangan, dan dalam kelompok tidak teratur, Gram positif, katalase positif, oksidase negatif, metil red positif, tumbuh optimum pada suhu 30-37°C dan tumbuh baik pada NaCl 1-7%
Hasil uji biokimia pada kode isolat UIM-02 memiliki hasil yang sama pada kode isolat UIM-01 kecuali morfologi bentuk isolat yang merupakan basil (batang). Adapun hasil uji biokimia pada kode isolat UIM-02 yaitu positif untuk katalase, MR, glukosa, manitol, inositol, dan sukrosa, negatif untuk motilitas, oksidase, gelatin, urea, citrat, LIA, arabinosa dan sorbitol serta TSIA yang bernilai alkali. Dari hasil tersebut dan dilakukan pengidentifikasian spesies berdasarkan buku Bergey’s Manual
of Determinative Bacteriology 8th Edition maka disimpulkan bahwa
bakteri tersebut merupakan Bacillus
firmus. Hal ini sesuai dengan Holt
dkk., (1994) yang menyatakan bahwa bakteri Bacillus sp. memiliki ciri-ciri yaitu koloni berwarna putih kekuningan, motil dengan flagel peritrik, endospora oval, kadang-kadang bundar atau silinder dan sangat resisten pada kondisi yang tidak menguntungkan, Gram positif, katalase positif, indol negatif dan mampu memfermentasi glukosa dan sukrosa. Tersebar luas pada bermacam-macam habitat dan sedikit spesies yang patogen. Suhu tumbuh optimum pada 28ºC-35ºC.
Bacillus firmus merupakan
bakteri potensial probiotik yang
berhasil diisolasi dari usus Ikan Mas. Bakteri B. firmus dapat dikatakan sebagai probiotik karena bakteri ini mampu hidup dan bertahan serta berkembang biak di dalam saluran pencernaan ikan dan dapat hidup dan berkembang di dalam air wadah pemeliharaan ikan. Hal ini sesuai dengan Irianto (2005) yang menyatakan bahwa probiotik B.
firmus merupakan bakteri fakultatif
aerob yang menyukai kondisi lingkungan yang cukup oksigen sehingga pertumbuhannya menjadi lebih baik. Probiotik B. firmus merupakan bakteri pelarut fosfat dan dapat menghasilkan fitohormon sehingga bakteri ini mampu memanfaatkan pakan dan menguraikannya menjadi bentuk yang lebih sederhana, kemampuan inilah sering dimanfaatkan untuk penguraian substrat polimer organik, memperbaiki kualitas air, mengurai jumlah bakteri patogen melalui penyeimbang populasi mikrorganisme serta meningkatkan kesehatan dan pertumbuhan ikan. Hidrolisis Pati (Amilum) dan Kasein (Protein) Pada Isolat Bakteri
Uji hidrolisis protein dilakukan untuk mengetahui kemampuan bakteri dalam menguraikan enzim protease. Uji ini ditandai dengan terbentuknya zona bening disekeliling bakteri yang ditanam pada media Skim Milk Agar yang mengandung kasein yang dapat dipecah oleh mikroorganisme proteolitik.
Uji hidrolisis pati (amilum) dilakukan untuk mengetahui kemampuan bakteri dalam menguraika karbohidrat. Hidrolisis dari pati dapat terjadi dengan bantuan enzim amilase yang akan
12 mengubah amilum menjadi maltosa. Uji hidrolisis pati ditandai dengan terbentuknya zona bening setelah diteteskan iodine pada isolat bakteri. Hal ini terjadi karena molekul pati merupakan molekul yang larut dalam air dan memberikan warna biru apabila tercampur dengan larutan iodin dan akan membentuk zona bening apabila menghidrolisis pati. Dari hasil penelitian diperoleh bahwa isolat bakteri potensial probiotik yang diperoleh berasal dari genus Bacillus, Micrococcus dan Staphylococcus.
melalui uji yang telah dilakukan. Isolat probiotik menghasilkan zona bening pada uji hidrolisis protein yang artinya isolat bakteri tersebut memiliki kemampuan dalam menguraikan protein di dalam saluran pencernaan. Hal ini sesuai dengan Fardiaz (1992) yang menyatakan bahwa bakteri Bacillus
firmus merupakan bakteri potensial
probiotik yang mempunyai sifat fisiologis menarik karena mempunyai kemampuan dalam mendegradasi senyawa organik seperti protein, selulosa, hidrokarbon dan agar, serta mampu menghasilkan antibiotik.
Indikasi Penghambatan Bakteri Aeromonas hydrophila
Micrococcus varians
merupakan bakteri potensial probiotik pada Ikan Mas
(C. carpio) karena mampu menghambat pertumbuhan
Aeromonas hydrophila yang merupakan bakteri patogen yang sering menyerang ikan dengan nilai indikasi penghambatan yaitu 2 mm. Keberhasilan probiotik M. varians dalam mengatasi dan mencegah serangan A. hydrophila disebabkan oleh kemampuan menyeimbangkan
populasi mikroba pada media budidaya tidak dapat menyebabkan sakit bagi ikan. Penelitian yang dilakukan oleh Osman dkk., (2010) tentang penggunaan spesies
Micrococcus sp. sebagai antibakteri
dan imunostimulan terhadap Ikan Nila (Oreochromis niloticus),
menyatakan bahwa bakteri
Micrococcus sp. merupakan bakteri
yang memiliki efek antagonis pada bakteri patogen A. hydrophila secara
in vitro serta mendukung tingkat
kelangsungan hidup ikan nila pada uji in vivo.
Staphylococcus arlettae
merupakan bakteri potensial probiotik yang berhasil diisolasi pada usus Ikan Mas (C. carpio). Pada uji indikasi penghambatan terhadap bakteri patogen Aeromonas hydrophilla, bakteri ini mampu
menghambat pertumbuhan bakteri patogen dengan terbentuknya zona bening disekitar paper disk sebesar 2 mm. Bakteri S. arlettae belum dapat dikatakan bakteri potensial probiotik karena menurut Austin (1999) bakteri ini merupakan bakteri yang bersifat patogen pada manusia dan hewan. Akan tetapi pada penelitan yang dilakukan Syabani dkk., (2015) tentang frekuensi penambahan bakteri Staphylococcus sp. pada media pemeliharaan benih Ikan Lele Dumbo mampu menghasilkan kelangsungan hidup 93,33 % lebih baik dibandingkan dengan media pemeliharaan yang tidak diberikan bakteri Staphylococcus sp. Sebagaimana disebutkan oleh Gomes dkk., (2000) yang menyatakan bahwa bakteri probiotik tidak semestinya disebut sebagai agensia pengendali biologis karena probiotik tidak harus menyerang agensia patogen tetapi dapat pula dalam perbaikan air. Oleh sebab itu isolat bakteri S. arlettae
13 perlu penanganan selanjutnya bila dijadikan probiotik baik skala labortaorium dan lapangan.
Bacillus firmus merupakan
bakteri potensial probiotik yang berhasil ditemukan pada usus Ikan Mas (C. carpio) karena menunjukkan adanya zona bening pada uji penghambatan pertumbuhan bakteri patogen Aeromonas hydrophila
dengan nilai indikasi penghambatan yaitu 3 mm. Hal ini sesuai dengan penelitian yang dilakukan oleh Harjuno dkk., (2016) tentang studi B.
firmus dalam menghadapi A. hydrophila pada media budidaya
menyatakan bahwa daya uji zona hambat pada bakteri B. firmus terbukti mampu untuk menghambat pertumbuhan A. hydrophila secara in
vitro dengan jarak 3 mm.
Kesimpulan dan Saran Kesimpulan
1. Bakteri potensial probiotik yang didapatkan pada saluran pencernaan Ikan Mas (Cyprinus
carpio) yaitu Micrococcus varians, Staphylococcus arlettae
dan Bacillus firmus.
2. Isolat bakteri potensial yang berhasil diidentifikasi menunjukkan indikasi penghambatan terhadap bakteri patogen A. hydrophila dengan nilai hambatan yaitu 2 mm dan 3 mm.
Saran
Identifikasi isolat bakteri potensial probiotik masih berdasarkan karakterisasi secara manual, sehingga seharusnya perlu dilakukan karakterisasi secara molekuler dan perlu dilakukan lebih lanjut terhadap ikan dalam uji daya hambat secara in vivo dengan pemberian isolat bakteri potensial
probiotik pada media air ikan dan pembaharuan menjadi pakan ikan. DAFTAR PUSTAKA
Austin, D. 1999. Pengaruh Perbedaan Dosis Aplikasi Probiotik Terhadap Respon Imun Non Spesifik Ikan Mas (Cyprinus carpio) dengan Uji Tantang Bakteri Aeromonas salmonicida. Universitas Lampung. Lampung.
Fardiaz, D. 1992. Mikrobiologi Pangan I. Gramedia. Jakarta. Gomez, G. B., A. Roque and J. F.
Turnbull. 2000. The Use and Selection of Probiotic Bacteria for Use in the Culture of Larval Aquatic Organisme. Journal
Aquaculture 191: 259-270. Hadioetomo, R. S. 1993.
Mikrobiologi Dasar dalam Praktek Teknilk dan Prosedur Dasar Laboratorium. Penerbit Gramedia. Jakarta.
Harjuno, I. P., Z. Sucitra dan A. M. Lusisastuti. 2016. Pengaruh Penambahan Bakteri Probiotik (Bacillus firmus) pada Media Pemeliharaan Terhadap Ketahanan Benih Lele Dumbo (Clarias
gariepinus) yang Diinfeksi
Bakteri A. hydrophila.
Program Sarjana, Univeristas Padjajaran. Bandung.
Holt, J. G., N. R. Krieg., P. H. A. Sneath dan S. T. William. 1994. Bergey’s Manual of Determinative Bacteriology. Lippicolt William and Wilkins. New York.
14 Irianto, A. 2005. Probiotik
Akuakultur. Gadjah Mada University Press. Yogyakarta. Lestari, N. W. 2012. Isolasi dan Karakterisasi Bakteri Dari Saluran Pencernaan Ikan Sidat (Anguilla nicolor bicolor) dan Potensi Sebagai
Probiotik. Universitas Sebelas Maret. Surakarta.
Osman, M. K., S. Sumawidjaja dan A. S. L. Hardjosworo. 2010. Studi Karakterisasi dan Patologi Aeromonas hydrophila pada Ikan Lele Dumbo (Clarias gariepinus). Makalah Falsafah Sains. Program Pasca Sarjana, Institiut Pertanian Bogor. Bogor.
Sudarsono, A. 2008. Isolasi dan Karakterisasi Bakteri pada Ikan Laut dalam Spesies Ikan Gindara (Lepidocibium
flavobronneum). Institut Pertanian Bogor. Bogor. Syabani, N., Y. Ayi., R. Ike., dan M.
L. Angela. 2015. Frekuensi Penambahan Probiotik
Bacillus sp. dan
Staphylococcus sp. pada Media Pemeliharaan Benih Ikan Lele Dumbo (Clarias
gariepinus) Untuk Ketahanan
Terhadap Aeromonas hydrophila. Jurnal Perikanan
dan Kelautan 6 (2): 130-140 Yusuf. A. 2009. Analisis Risiko
Agens Hayati untuk Pengendalian Patogen pada Tanaman. Universitas Indonesia. Jakarta.