ISOLASI DAN IDENTIFIKASI BAKTERI POTENSIAL PROBIOTIK PADA SALURAN PENCERNAAN
IKAN MAS (Cyprinus carpio)
MIKHA FEBRYANA 120302027
PROGRAM STUDI MANAJEMEN SUMBERDAYA PERAIRAN FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
2017
ISOLASI DAN IDENTIFIKASI BAKTERI POTENSIAL PROBIOTIK PADA SALURAN PENCERNAAN
IKAN MAS (Cyprinus carpio)
SKRIPSI
MIKHA FEBRYANA 120302027
PROGRAM STUDI MANAJEMEN SUMBERDAYA PERAIRAN FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
2017
ISOLASI DAN IDENTIFIKASI BAKTERI POTENSIAL PROBIOTIK PADA SALURAN PENCERNAAN
IKAN MAS (Cyprinus carpio)
SKRIPSI
MIKHA FEBRYANA 120302027
Skripsi Sebagai Satu Diantara Beberapa Syarat untuk Memperoleh Gelar Sarjana Perikanan di Program Studi Manajemen Sumberdaya Perairan
Fakultas Pertanian Universitas Sumatera Utara
PROGRAM STUDI MANAJEMEN SUMBERDAYA PERAIRAN FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
2017
LEMBAR PENGESAHAN
Judul Penelitian : Isolasi dan Identifikasi Bakteri Potensial Probiotik Pada Saluran Pencernaan Ikan Mas (Cyprinus carpio)
Nama : Mikha Febryana
NIM : 120302027
Program Studi : Manajemen Sumberdaya Perairan
Disetujui Oleh, Komisi Pembimbing
Prof. Dr. Dwi Suryanto, M.Sc Desrita, S.Pi, M.Si Ketua Anggota
Mengetahui
Dr. Ir. Yunasfi, M.Si
Ketua Program Studi Manajemen Sumberdaya Perairan
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Saya yang bertanda tangan di bawah ini : Nama : Mikha Febryana
NIM : 120302027
Menyatakan bahwa skripsi saya yang berjudul “Isolasi dan Identifikasi Bakteri Potensial Probiotik pada Saluran Pencernaan Ikan Mas (Cyprinus carpio)”
adalah benar hasil karya saya sendiri dan belum dijadikan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan di dalam teks dan dicantumkan dalam bagian akhir skripsi ini.
Medan, Januari 2017
Mikha Febryana NIM. 120302027
ABSTRAK
MIKHA FEBRYANA. Isolasi dan Identifikasi Bakteri Potensial Probiotik pada Saluran Pencernaan Ikan Mas (Cyprinus carpio). Dibimbing oleh DWI SURYANTO dan DESRITA.
Probiotik merupakan mikroba menguntungkan yang bermanfaat untuk memperbaiki keseimbangan mikroba di dalam saluran pencernaan. Isolasi bakteri probotik dilakukan dengan tujuan untuk mendapatkan bakteri yang berpotensi sebagai probiotik pada ikan mas (Cyprinus carpio). Penelitian ini dilakukan pada bulan Mei ― Oktober 2016 di Laboratorium Stasiun Karantina Ikan, Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas I Medan I, Kuala Namu Medan. Isolasi dan identifikasi bakteri dilakukan melalui test morfologi dan biokimia, dan data yang diperoleh dianalisa secara deksriptif. Hasil penelitian menunjukkan bahwa bakteri probiotik pada organ pencernaan C. carpio terdiri dari Micrococcus varians, Staphylococcus arlettae dan Bacillus firmus.
Kata Kunci : C. carpio, identifikasi, isolasi, probiotik.
ABSTRACT
MIKHA FEBRYANA. Isolation and Identification of Potential Probiotic Bacteria in digestive tract of mackerel (Cyprinus carpio). Supervised by DWI SURYANTO and DESRITA.
Probiotics are beneficial microbes to improve microbial balance in the digestive tract. Isolation of probiotic bacteria aims to obtain the potential probiotic bacteria in mackerel (Cyprinus carpio). This study was conducted from May to October 2016 at the Fish Quarantine, Quality Control and Safety of Fishery Class I Medan I, Kuala Namu Medan. The isolation and identification of bacteria was carried out through morphology and biochemistry tests, and the data obtained were analysed descriptively. The result of the study indicated the probiotic bacteria in the digestive tract of C. carpio was composed by Micrococcus varians, Staphylococcus arlettae and Bacillus firmus.
Keywords: C. carpio, identification, isolation, probiotic
RIWAYAT HIDUP
Penulis dilahirkan di Medan pada tanggal 28 Februari 1995 dari ayah London Samosir dan ibu Hotmahita Silalahi.
Penulis merupakan anak pertama dari tiga bersaudara.
Pendidikan formal yang pernah ditempuh oleh penulis adalah Sekolah Dasar (SD) Budi Murni 6 Medan pada tahun 2000 – 2006, Sekolah Menengah Pertama (SMP) Negeri 12 Medan pada tahun 2006 – 2009 dan Sekolah Menengah Atas (SMA) Budi Murni 1 Medan pada tahun 2009 – 2012. Penulis diterima di program studi Manajemen Sumberdaya Perairan, Fakultas Pertanian, Universitas Sumatera Utara (MSP FP USU) pada tahun 2012 melalui jalur ujian tertulis Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN).
Penulis aktif dalam berbagai kegiatan organisasi diantaranya sebagai anggota Himpunan Mahasiswa Perikanan Indonesia (HIMAPIKANI), sebagai anggota Ikatan Mahasiswa Manajemen Sumberdaya Perairan Universitas Sumatera Utara (IMASPERA USU) periode 2012 – 2016, anggota Unit Ikatan Mahasiswa Katolik USU (IMK-USU). Penulis juga melaksanakan Praktik Kerja Lapangan (PKL) di Balai Karantina Ikan, Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas II, Tanjung Balai Asahan pada tahun 2015.
Untuk menyelesaikan studi di Program Studi Manajemen Sumberdaya Perairan, Fakultas Pertanian, Universitas Sumatera Utara, penuis melaksanakan penelitian dengan judul skripsi “Isolasi dan Identifikasi Bakteri Potensial Probiotik Pada Saluran Pencernaan Ikan Mas (Cyprinus carpio)” yang
KATA PENGANTAR
Puji dan syukur penulis ucapkan kehadirat Tuhan Yang Maha Esa atas segala berkat dan kasih-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Isolasi dan Identifikasi Bakteri Potensial Probiotik Pada Saluran Pencernaan Ikan Mas (Cyprinus carpio)”. Skripsi ini merupakan satu diantara beberapa syarat untuk dapat memperoleh gelar Sarjana Perikanan (S. Pi) di Program Studi Manajemen Sumberdaya Perairan, Fakultas Pertanian, Universitas Sumatera Utara.
Penulis mengucapkan terimakasih yang sebesar-besarnya kepada:
1. Kedua orang tua tercinta, Ayahanda London Samosir dan Ibunda Hotmahita Silalahi yang telah banyak memberi dukungan doa, moril dan materil kepada penulis.
2. Bapak Prof. Dr. Dwi Suryanto, M.Sc Ketua Komisi Pembimbing, Ibu Desrita, S.Pi, M.Si selaku Anggota Komisi Pembimbing dan Bapak Dr. Ir. Yunasfi, M. Si selaku Ketua Program Studi dalam penulisan skripsi ini.
3. Bapak dan Ibu staff pengajar di Program Studi Manajemen Sumberdaya Perairan Fakultas Pertanian Universitas Sumatera Utara.
4. Bapak Hasbullah Iwansyah Hakim, S.St.Pi, M.Si, Bapak Ali Akbahri, M.Si selaku pegawai laboratorium Balai Karantina Ikan Kualanamu Kelas I Medan I yang telah membimbing dalam penelitian.
5. Saudara/i penulis Asti Desmaria Samosir dan Aldi Syaputra Samosir.
6. Kepada teman-teman Bill Maulana Bidawi, Bintang Juniarta Sibuea, Dinarta Pardede, S.Pi, Dewi Susanty, S.Pi, Linda Arti Br Gurning, S.Pi, Nathasya Zaharuddin, S.Pi, Putri Permata Sari Sirait, S.Pi, Ratna Dewi Sinaga, S.Pi, Ruth Aprilyanti Napitupulu, S.Pi, Yessy Christanty Saragih, S.Pi, seperjuangan MSP stambuk 2012 yang telah membantu penulis selama perkuliahan seta dukungan semangat kepada penulis selama penelitian.
7. Kepada teman-teman Ruth Aprilyanti Napitupulu, S.Pi, Meirani Ritonga, S.Pi, Linda Arti Gurning, S.Pi, Fajar Prasetya Kembaren, S.Pi yang telah membantu penulis dalam pelaksaanaan penelitian.
8. Kepada teman-teman Ruth Christiani Saragih, Priski Sianipar, S.Pd, Roy Tarigan, S.St, Natalia Napitupulu, Monica Situmorang, S.St, Rini Ginting, S.E, Ferdinand Jonri Nainggolan, S.Psi yang telah memberikan semangat dan doa kepada penulis.
Akhir kata penulis berharap semoga skripsi ini dapat bermanfaat sebagai dasar penelitian selanjutnya dan dapat menjadi sumber informasi bagi pihak-pihak yang membutuhkan untuk kemajuan ilmu pengetahuan, khususnya bidang kelautan dan perikanan.
Medan, Januari 2017
Penulis
DAFTAR ISI
Halaman
ABSTRAK ... i
ABSTRACT ... i
RIWAYAT HIDUP ... iii
KATA PENGANTAR ... iv
DAFTAR ISI ... vi
DAFTAR GAMBAR ... viii
DAFTAR TABEL ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN Latar Belakang ... 1
Rumusan Masalah ... 3
Kerangka Pemikiran ... 3
Tujuan Penelitian ... 5
Manfaat Penelitian ... 5
TINJAUAN PUSTAKA Bakteri Pada Ikan ... 6
Probiotik ... 7
Bakteri Probiotik ... 10
Genus Bacillus ... 11
Genus Carnobacterium ... 12
Genus Lactobacillus... 12
Genus Lactococcus ... 13
Genus Staphylococcus ... 14
Genus Eubacterium ... 14
Genus Micrococcus ... 15
Genus Bifidobacterium ... 16
METODE PENELITIAN Waktu dan Tempat Penelitian ... 18
Alat dan Bahan Penelitian ... 19
Prosedur Penelitian ... 20
Pengambilan Sampel ... 20
Pembuatan Stok Kultur ... 21
Uji Hidrolisis Pati (Amilum) ... 21
Uji Hidrolisis Kasein (Protein) ... 21
Uji Penghambatan Bakteri Uji Patogen ... 22
Identifikasi Spesies Bakteri Potensial Probiotik ... 22
Karakterisasi Morfologi Isolat ... 23
Identifikasi Berdasarkan Uji Biokimia ... 23
Uji Katalase ... 23
Uji Motilitas ... 23
Uji Indol ... 24
Uji Metil Red ... 24
Uji Simmons Citrate ... 25
Uji TSIA ... 25
Uji Gula-gulaan ... 25
Analisis Data ... 25
HASIL DAN PEMBAHASAN Hasil ... 25
Bakteri Potensial Probiotik pada Lambung dan Usus Ikan ... 25
Morfologi Koloni dan Sel Bakteri Potensial Probiotik Ikan .. 25
Karakterisasi dan Identifikasi Bakteri Potensial Probiotik .... 27
Hidrolisis Pati (Amilum) dan Kasein (Protein) ... 28
Indikasi Penghambatan Bakteri Aeromonas hydrophila ... 29
Manfaat Penelitian ... 30
Bakteri Potensial Probiotik pada Lambung dan Usus Ikan ... 30
Morfologi Koloni dan Sel Bakteri Potensial Probiotik Ikan .. 31
Karakterisasi dan Identifikasi Bakteri Potensial Probiotik .... 32
Hidrolisis Pati (Amilum) dan Kasein (Protein) ... 36
Indikasi Penghambatan Bakteri Aeromonas hydrophila ... 37
KESIMPULAN DAN SARAN Kesimpulan ... 41
Saran ... 41 DAFTAR PUSTAKA
DAFTAR GAMBAR
No. Teks Halaman
1. Kerangka Pemikiran Penelitian ... 4
2. Bentuk Sel Isolat ... 26
3. Hidrolisis Kasein ... 28
4. Indikasi Penghambatan bakteri A. hydrophila ... 29
DAFTAR TABEL
No. Teks Halaman
1. Morfologi Koloni Isolat Bakteri Potensial Probiotik Pada Ikan Mas ... 26 2. Karakterisasi Isolat Bakteri Probiotik Potensial Pada Ikan Mas ... 27 3. Kemampuan Isolat Kandidat Probiotik Menghidrolisis Pati dan Kasein 28
DAFTAR LAMPIRAN
No. Teks Halaman
1. Prosedur Penelitian... 45
2. Alat Penelitian ... 46
3. Proses Isolasi ... 48
4. Proses Pemanenan Bakteri dan Uji Penghambatan A. hydrophila ... 50
PENDAHULUAN
Latar Belakang
Seiring dengan meningkatnya jumlah penduduk yang diimbangi dengan kesadaran pentingnya kandungan protein yang terkandung pada ikan, maka permintaan produk akan perikanan semakin meningkat. Salah satu produk perikanan air tawar yang mempunyai permintaan pasar yang luas adalah ikan Mas (Cyprinus carpio).
Ikan Mas (C. carpio) merupakan salah satu jenis ikan air tawar yang mempunyai nilai ekonomi tinggi karena sangat digemari baik didalam maupun diluar negeri. Permintaan pasar yang terus menerus meningkat, memberikan peluang bagi Indonesia untuk meningkatkan produksinya. Dalam upaya memenuhi permintaan pasar, maka perlu dilakukan upaya budidaya secara intensif, namun dalam budidaya secara intensif sering dihadapkan pada beberapa kendala.
Kendala terbesar yang selalu dihadapi pada kegiatan budidaya adalah terjadinya serangan bakteri patogen terutama pada stadia larva. Serangan bakteri patogen ini menimbulkan penurunan kualitas dan tingkat produksi pada usaha pembenihan ikan, bahkan kematian dan kegagalan panen dapat terjadi. Rukyani (1993) melaporkan bahwa akibat adanya serangan penyakit, hanya sekitar 40%
dari seluruh areal pertambakan di Indonesia yang masih beroperasi sehingga menimbulkan kerugian yang cukup besar.
Hingga kini, metode yang paling sering dilakukan dalam penanggulangan penyakit patogenik pada ikan adalah penggunaan bahan kimia atau antibiotik.
Metode ini merupakan metode yang cukup efektif untuk menghambat bahkan membunuh mikroorganisme patogen, akan tetapi metode ini sangat beresiko karena beberapa bahan kimia yang digunakan dapat menimbulkan resistensi terhadap bakteri patogen karena bahan kimia tersebut tidak mudah terurai secara alami, sehingga dikategorikan tidak ramah lingkungan. Antibiotik biasanya diberikan melalui makanan, perendaman atau penyuntikan, sehingga residu antibiotik dapat terakumulasi pada ikan yang dapat membahayakan manusia yang mengkonsumsinya.
Untuk menjawab permasalahan tersebut, maka pengunaan bakteri probiotik sebagai agen biokontrol pada perikanan merupakan salah satu alternatif pemecahan untuk menanggulangi permasalahan tersebut. Dasar pendekatan ini adalah senyawa-senyawa racun yang dihasilkan pada metabolisme bakteri probiotik seperti asam laktat, hidrogen peroksida, bakteriosin yang bersifat antimikroba dan antibiotik mampu menekan atau menghambat pertumbuhan bakteri patogen melalui produksi senyawa antimikroba, memperbaiki keseimbangan mikroba didalam saluran pencernaan, memberikan pengaruh positif terhadap fisiologi dan kesehatan inangnya, mestimulasi sistem imun dan memperbaiki kualitas air (Irianto, 2005).
Prinsip dasar kerja probiotik adalah pada saat stadia larva, karena pada stadia ini ikan sudah hidup di lingkungan yang banyak sekali bakteri patogen, akan tetapi saluran pencernaan dan sistem imun belum berkembang. Moriaty (1998) menyebutkan bahwa probiotik merupakan bakteri yang dimasukkan dengan berbagai cara kedalam saluran pencernaan dan tetap hidup untuk memperbaiki kesehatan.
Perumusan Masalah
Berdasarkan pada latar belakang diatas, perumusan masalah yang dapat diambil adalah :
1. Apa sajakah bakteri yang berpotensi sebagai probiotik pada saluran pencernaan ikan Mas (C. carpio)?
2. Apakah bakteri potensial probiotik yang berhasil diidentifikasi bersifat antagonistik terhadap bakteri uji patogen?
Kerangka Pemikiran
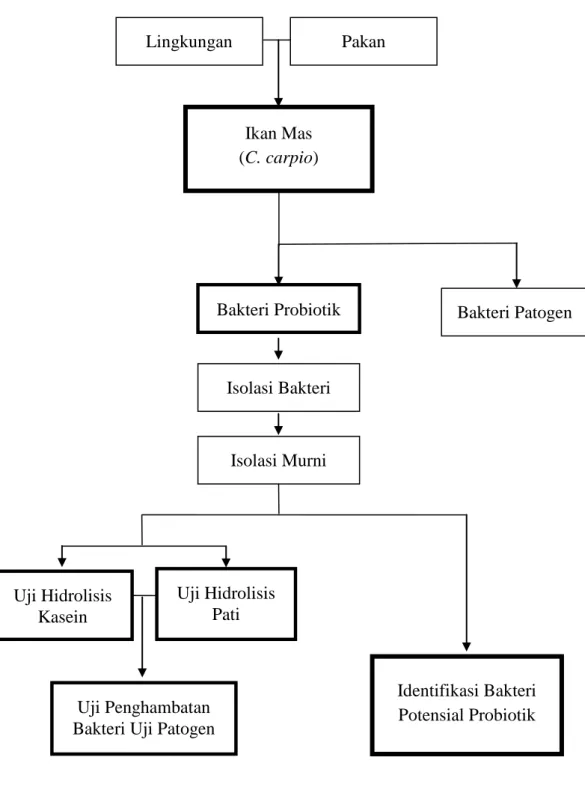
Penggunaan probiotik yang bekerja melalui mekanisme tertentu untuk melawan patogen dan meningkatkan penyerapan bahan organik pada pencernaan ikan, saat ini dipandang sebagai langkah alternatif. Beberapa tahun terakhir probiotik sebagai salah satu produk bioteknologi telah digunakan secara meluas pada manusia dan hewan namun informasi dari aplikasi probiotik pada bidang akuakultur masih sangat terbatas. Oleh karena itulah, dalam penelitian ini dilakukan analisis keberadaan bakteri probiotik dalam saluran pencernaan ikan Mas (C. carpio) yang mampu dijadikan sebagai agen biokontrol dalam mengendalikan aktivitas bakteri patogen dan memperbaiki kualitas air. Isolat bakteri yang di peroleh dari saluran pencernaan ikan Mas (C. carpio) diharapkan mampu menjadi kandidat bakteri yang memiliki potensi probiotik terbaik dalam memperbaiki kualitas air dan mengendalikan serangan maupun perkembangan dari bakteri patogen. Kerangka pemikiran dapat dilihat pada Gambar 1.
Gambar 1. Kerangka Pemikiran Penelitian Tujuan Penelitian
Adapun tujuan dari dilaksanakannya penelitian ini adalah :
1. Untuk mengetahui bakteri yang berpotensi sebagai probiotik pada saluran pencernaan ikan Mas (C. carpio).
Lingkungan Pakan
Ikan Mas (C. carpio)
Bakteri Probiotik Bakteri Patogen
Isolasi Bakteri
Isolasi Murni
Identifikasi Bakteri Potensial Probiotik Uji Hidrolisis
Kasein
Uji Hidrolisis Pati
Uji Penghambatan Bakteri Uji Patogen
2. Untuk mengetahui apakah bakteri potensial probiotik yang berhasil diidentifikasi bersifat antagonistik terhadap bakteri uji patogen.
Manfaat Penelitian
Manfaat dari penelitian ini adalah memberikan informasi ilmiah tentang apa saja jenis bakteri yang berpotensi sebagai kandidat probiotik pada saluran pencernaan ikan Mas (C. carpio) sehingga dapat diaplikasikan dalam menghambat bakteri patogen pada ikan serta memberikan pengetahuan bagi peneliti dalam pengembangan probiotik terhadap kelangsungan hidup ikan budidaya.
TINJAUAN PUSTAKA
Bakteri Pada Ikan
Bakteri pada ikan dapat dijumpai pada permukaan tubuh eksternal dan saluran pencernaan. Sebagian bakteri bersifat patogen, sedangkan sejumlah bakteri lainnya menguntungkan bagi ikan karena membantu pencernaan, mensintesa vitamin-vitamin serta mendekomposisi materi organik di perairan (Irianto, 2005).
Pada ikan terdapat bakteri yang membantu dalam menguraikan rantai panjang karbohidrat, protein, dan lemak yang menyusun pakan yang diberikan sehingga mampu mempermudah pencernaan lanjutan dan penyerapan oleh saluran pencernaan ikan. Kemampuan ini diperoleh karena adanya enzim-enzim khusus yang dimiliki oleh bakteri untuk memecah ikatan tersebut misalnya amilase, selulase dan lipase. Enzim tersebut biasanya tidak dimiliki oleh ikan dan makhluk air lainnya. Pemanfaatan dari enzim inilah yang mendasari kerja probiotik bagi ikan (Feliatra, dkk., 2004).
Jenis bakteri yang dominan dalam saluran pencernaan dapat mempengaruhi pertumbuhan dan perkembangan ikan sehingga dapat meningkatkan kualitas ikan. Bakteri menghasilkan enzim yang mampu digunakan dalam mendegradasi nutrisi dalam pakan. Bakteri tersebut memainkan peranan penting bagi kesehatan melalui beberapa cara seperti efeknya terhadap morfologi saluran pencernaan, nutrisi, patogen, dan immunitas. Beberapa mikroflora dalam saluran pencernaan dapat melindungi usus dari serangan bakteri patogen dan merangsang pembentukan imunitas (Lestari, 2012).
Menurut Gosh, dkk., (2007), ikan mendapatkan bakteri yang menempati saluran pencernaan dari air dan makanan yang mengandung populasi bakteri.
Saluran pencernaan ikan memberikan kondisi yang baik bagi pertumbuhan bakteri karena kaya akan nutrisi dan bakteri menghasilkan enzim-enzim. Adanya enzim- enzim ini menciptakan hubungan timbal balik yang saling menguntungkan antara bakteri dengan inangnya. Pemecahan molekul-molekul kompleks menjadi molekul sederhana jelas akan mempermudah pencernaan lanjutan dan penyerapan oleh saluran pencernaan ikan. Disisi lain, mikroorganisme pelaku pemecah ini mendapat keuntungan berupa energi yang diperoleh dari hasil perombakan melalui kompleks tersebut.
Probiotik
Probiotik didefinisikan sebagai produk yang tersusun oleh biakan mikroba atau pakan alami mikroskopik yang bersifat menguntungkan dan memberikan dampak bagi peningkatan keseimbangan mikroba saluran usus hewan inang.
Probiotik dianggap menguntungkan karena menghambat kolonisasi intestinum oleh mikroba yang bersifat merugikan baik melalui mekanisme kompetisi nutrien maupun kompetisi ruang serta mampu memproduksi senyawa-senyawa yang bersifat antimikrobial. Probiotik bersifat menguntungkan bagi inangnya karena mampu memperbaiki nutrisi dengan memproduksi vitamin-vitamin, detoksikasi pangan maupun melalui aktivitas enzimatis (Fuller, 1987).
Probiotik adalah organisme atau substansi yang mendukung keseimbangan jumlah mikroorganisme dalam pencernaan ikan. Pada stadia larva, ikan sudah hidup di lingkungan yang banyak sekali bakteri patogen, pada waktu tersebut
saluran pencernaan dan sistem imun belum berkembang sehingga sebetulnya bakteri probiotik sangat diperlukan pada waktu stadia larva (Vadstein, 1977).
Pada saat memilih mikroorganisme yang akan dijadikan probiotik, persyaratan yang harus dimiliki oleh mikroba probiotik adalah tidak bersifat patogen atau mengganggu inang, tidak bersifat patogen bagi konsumen (manusia dan hewan lainnya), tidak mengganggu keseimbangan ekosistem setempat, mikroba hendaklah dapat dan mudah dipelihara serta diperbanyak, dapat hidup dan bertahan serta berkembang biak di dalam usus ikan, dapat dipelihara dalam media yang memungkinkan untuk diintroduksikan ke dalam usus ikan, dan dapat hidup dan berkembang di dalam air wadah pemeliharaan ikan (Feliatra, dkk., 2004).
Probiotik merupakan salah satu strategi yang efektif bersama aplikasi vaksin dan immunostimulant (masing-masing mempunyai fungsional tersendiri dalam menyehatkan ikan dan memproteksi terhadap serangan penyakit) dalam menyehatkan ikan budidaya sehingga mampu memproteksi diri terhadap serangan penyakit. Probiotik memproteksi ikan budidaya melalui mekanisme menghasilkan senyawa kimia yang mempunyai aktivitas bakterisidal atau bakteriostatik terhadap populasi bakteri lain, khususnya bakteri yang bersifat merugikan (termasuk patogen) (Gomez, dkk., 2007). Keberadaan probiotik ini didalam usus inang (baik pada permukaan usus maupun didalam lumen berperan sebagai pelindung (barier) terhadap proliferasi (pertumbuhan) patogen diantaranya melalui mekanisme produksi senyawa yang mampu menghambat pertumbuhan patogen (Subagiyo dan Ali, 2011).
Probiotik dalam media budidaya perikanan, berfungsi sebagai pengatur kondisi mikrobiologi di air atau sedimen, membantu atau memperbaiki kualitas air, meningkatkan keragaman mikroorganisme dalam air atau sedimen serta meningkatkan kesehatan ikan dengan menghambat efek bakteri patogen. Bakteri probiotik dapat meningkatkan kesehatan ikan dan memperbaiki kualitas air serta digunakan sebagai pakan tambahan sehingga dapat memacu pertumbuhan dan mencegah terjadinya serangan penyakit. Bakteri probiotik apabila masuk kedalam tubuh ikan, udang dan moluska akan berfungsi sebagai immunostimulan yang dapat meningkatkan daya tahan tubuh terhadap bakteri patogen (Susanto, dkk., 2005).
Mekanisme kerja dari bakteri probiotik yaitu kemampuan probiotik untuk bertahan hidup dalam saluran pencernaan dan menempel pada sel-sel usus adalah sesuatu yang diinginkan. Hal ini merupakan tahap pertama untuk berkolonisasi, dan selanjutnya dapat dimodifikasi untuk sistem imunisasi/kekebalan hewan inang. Kemampuan menempel yang kuat pada sel-sel usus ini akan menyebabkan mikroba-mikroba probiotik berkembang dengan baik dan mikroba-mikroba patogen tereduksi dari sel-sel usus hewan inang, sehingga perkembangan organisme-organisme patogen yang menyebabkan penyakit tersebut dalam saluran pencernaan akan mengalami hambatan. Mikroorganisme probiotik mampu mengatur beberapa aspek dari sistem kekebalan hewan inang. Kemampuan mikroba probiotik mengeluarkan toksin yang mereduksi/menghambat perkembangan mikroba-mikroba patogen dalam saluran pencernaan, merupakan suatu kondisi yang dapat meningkatkan kekebalan hewan inang. Toksin yang dihasilkan tersebut merupakan antibiotik bagi mikroba patogen, sehingga penyakit
yang ditimbulkan oleh mikroba patogen tersebut akan bekurang dan dapat hilang atau sembuh dengan sendirinya. Hal ini akan memberikan keuntungan terhadap kesehatan hewan inang sehingga tahan terhadap serangan penyakit (Yulvizar, dkk., 2014).
Prinsip dasar kerja probiotik adalah pemanfaatan kemampuan mikroorganisme dalam memecah atau menguraikan rantai panjang karbohidrat, protein dan lemak yang menyusun pakan yang diberikan. Kemampuan ini diperoleh karena adanya enzim-enzim khusus yang dimiliki oleh mikroba untuk memecah ikatan tersebut. Enzim tersebut biasanya tidak dimiliki oleh ikan dan makhluk air lainnya. Kalaupun ada kuantitas dan kualitasnya dalam jumlah terbatas. Pemecahan molekul-molekul kompleks ini menjadi molekul sederhana jelas akan mempermudah pencernaan lanjutan dan penyerapan oleh saluran pencernaan ikan. Di sisi lain, mikroorganisme pelaku pemecah ini mendapat keuntungan berupa energi yang diperoleh dari hasil perombakan molekul kompleks tersebut (Effendi, 2002). Selanjutnya dinyatakan, hubungan simbiosis mutualisme tidak mustahil ada di ekosistem perairan. Data hasil penelitian menunjukkan bahwa populasi mikroorganisme di dalam usus ikan mencapai 107 sel per gram isi usus. Sebagian dari mereka merupakan penghuni sejati usus, mereka dapat tumbuh dan berkembang biak pada usus tersebut (Feliatra, dkk., 2004).
Bakteri Probiotik
Beberapa jenis bakteri sebagai kandidat probiotik ada 9 spesies bakteri yaitu Bacillus sp., Carnobacterium sp., Lactococcus sp., Eubacterium sp.,
Pseudomonas sp., Bifidobacterium sp., Staphylococcus sp., Micrococcus sp., Carnoacterium sp (Feliatra, dkk., 2014).
Genus Bacillus
Bacillus sp. merupakan salah satu bakteri yang diyakini mampu untuk meningkatkan daya cerna ikan. Menurut Fardiaz (1992), bakteri ini mempunyai sifat dapat mengeksresikan enzim protease, lipase dan amilase. Genus Bacillus mempunyai sifat fisiologis yang menarik karena tiap-tiap jenis mempunyai kemampuan yang berbeda-beda, diantaranya mampu mendegradasi senyawa organik seperti protein, pati, selulosa, hidrokarbon dan agar. Bakteri ini juga mampu menghasilkan antibiotik, berperan dalam nitrifikasi dan dentrifikasi, sebagai pengikat nitrogen dan bersifat khemolitotrof, aerob atau fakutatif anaerob, asidofilik, psikoprifilik, atau thermofilik.
Bacillus sp. merupakan bakteri berbentuk batang, tergolong bakteri gram positif, motil, menghasilkan spora yang biasanya resisten pada panas, bersifat aerob (beberapa spesies bersifat anaerob fakultatif), katalase positif, dan oksidasi bervariasi. Tiap spesies berbeda dalam penggunaan gula, sebagian melakukan fermentasi dan sebagian tidak (Barrow, 1993).
Bacillus sp. mempunyai ciri-ciri morfologi sebagai berikut warna koloni putih susu atau agak krem, bentuk koloni bulat dengan tepian keriput. Sel adalah bentuk batang dan lurus, berukuran 0,5-2,5 x 1,2-10 μm, dan sering tersusun dalam bentuk sepasang atau rantai, dengan ujung bundar atau empat persegi, optimum pada suhu 33-37ºC dan tumbuh baik pada NaCl 1-3%. Bakteri ini juga memiliki endospora yang berbetuk oval, kadang-kadang bundar atau silinder dan sangat resisten pada kondisi yang tidak menguntungkan. Mereka tidak lebih dari
satu spora per sel dan sporulasi tidak tahan pada udara terbuka. Bakteri ini bersifat aerobik atau fakultatif anaerobik (Holt, dkk., 1994).
Genus Carnobacterium
Bakteri yang mendekati genus ini mempunyai ciri-ciri morfologi antara lain warna koloni putih susu atau agak krem, bentuk koloni bulat, tepian berlekuk, sel lurus, batang ramping, berukuran 0,5-0,7 x 1,0- 2,0 μm, berbentuk tunggal atau dalam bentuk pasangan dan kadang-kadang dalam bentuk rantai yang pendek, Gram + dan dapat bergerak atau motil. Carnobacteria adalah katalase negatif, oksidase positif, metil red positif, tumbuh optimum pada suhu 30°C dan tumbuh baik pada NaCl 1-7% (Feliatra, dkk., 2004).
Bakteri ini merupakan bakteri Gram +, dapat atau tidak dapat bergerak dan tidak berspora, produksi kimia dengan heterofermentatif, memproduksi sebagian besar L (+) laktat dari glukosa. Mereka tumbuh pada 10°C tapi tidak dapat tumbuh pada suhu 45ºC dan optimum pada suhu 30°C (Holt, dkk., 1994).
Genus Lactobacillus
Bakteri yang mendekati genus ini mempunyai ciri-ciri yaitu memiliki warna koloni putih susu atau agak krem, bentuk koloni bulat dengan tepian seperti wol. Sel berbentuk batang dan biasanya tetap, berukuran 0,5-1,2 x 1,0-10,0 μm.
Mereka biasanya berbentuk batang panjang tapi kadang-kadang hampir bulat, biasanya bentuk rantai yang pendek, Gram +, tidak motil, oksidase positif, katalase negatif, metil red positif, optimum pada suhu 30-370C dan tumbuh baik pada NaCl 3-7% (Feliatra, dkk., 2004).
Bakteri dari Genus ini merupakan bakteri yang tergolong lactic acid yang dapat merubah laktosa dan gula-gula lainnya menjadi asam laktat. Selanjutnya
menurut Nikoskelainen, dkk., (2001), yang menggunakan Lactobacillus rhamnosus terhadap ikan rainbow trout dapat menurunkan mortalitas dan saat uji tantang dengan Aeromonas salmonicida. Bakteri Lactobacillus bulgaricus adalah bakteri probiotik karena telah lolos dari uji klinis, enzimnya mampu mengatasi intoleransi terhadap laktosa, menormalkan komposisi bakteri saluran pencernaan serta meningkatkan sistem kekebalan tubuh (Waspodo, 2011).
Genus Lactococcus
Bakteri yang mendekati genus ini mempunyai ciri-ciri morfologi sebagai berikut: warna koloni putih susu atau agak krem, bentuk koloni bundar atau bulat besar, sel berbentuk bola yang berukuran 0,5-1,2 x 0,5-1,5 μm, berpasangan dan membentuk rantai pendek dalam media cair, endospora tidak terbentuk, Gram +, tidak motil. Kemampuan untuk menghasilkan katalase dan oksidase adalah negatif, sedangkan uji metil red memberikan hasil positif. Suhu optimum untuk pertumbuhan bakteri genus ini adalah 30-37°C dan dan tumbuh baik pada 1-3%
NaCl (Feliatra, dkk., 2004).
Bakteri ini tergolong bakteri Gram +, fakultatif anaerob, tidak motil, tanpa kapsul, kemampuan memproduksi katalase dan oksidase negatif, tumbuh pada suhu 10°C, optimum pada suhu 30°C tapi tidak dapat tumbuh pada suhu 45°C, tumbuh baik dengan 0,5% NaCl. Bakteri ini memanfaatkan senyawa kimia dengan menguraikannya secara fermentasi. Salah satunya adalah memfermentasikan karbohidrat dengan produk yang dihasilkan sebagian besar adalah L (+) asam laktat tapi tidak dalam bentuk gas. Untuk pertumbuhannya, bakteri ini memerlukan syarat-syarat gizi yang lengkap. Biasanya banyak terdapat
di pabrik pengolahan susu dan produk makanan dari tumbuh-tumbuhan (Holt, dkk., 1994).
Genus Staphylococcus
Bakteri yang mendekati genus ini mempunyai ciri-ciri morfologi sebagai berikut: warna koloni putih susu atau agak krem, bentuk koloni bulat, tepian timbul, sel bentuk bola, diameter 0,5-1,5 μm, terjadi satu demi satu, berpasangan, dan dalam kelompok tidak teratur, Gram +, tidak motil, katalase positif, oksidase negatif, metil red positif, tumbuh optimum pada suhu 30-37°C dan tumbuh baik pada NaCl 1-7% (Feliatra, dkk., 2004).
Bakteri Staphylococcus sp. merupakan bakteri Gram +, tidak berspora, tidak motil, fakultatif anaerob, kemoorganotrofik, dengan dua pernapasan dan metabolisme fermentatif. Koloni biasanya buram, bisa putih atau krem dan kadang-kadang kuning keorangeorangean. Bakteri ini katalase positif dan oksidase negatif, sering mengubah nitrat menjadi nitrit, rentan lisis oleh lisostafin tapi tidak oleh lisozim. Biasanya tumbuh dengan 10% NaCl. Sebagian besar terdapat pada kulit dan mukosa membran dari vertebrata berdarah panas. Akan tetapi sering diisolasi dari produk makanan, debu dan air. Beberapa spesies ada yang patogen pada manusia dan hewan (Holt, dkk., 1994).
Genus Eubacterium
Bakteri yang mendekati genus ini mempunyai ciri-ciri morfologi sebagai berikut: warna koloni putih susu atau agak krem, bentuk koloni tidak beraturan dan menyebar, Gram +, bentuk sel batang, katalase negatif, oksidase positif, motil, metil red positif, suhu optimum pertumbuhan pada suhu 30-37ºC dan tumbuh baik pada NaCl 3-7% (Feliatra dkk., 2004).
Bakteri Eubacterium sp. biasanya bersel batang, Gram + dan ukuran tidak menentu, beragam sekali antara spesies (0,2-2,0 x 0,3-10 μm) dan bukan bentuk filamen. Spesies berubah bentuk dari bulat ke bentuk batang yang panjang. Sel biasanya tidak menentu, sering gembung atau ujungnya lonjong dan kadang- kadang membengkok. Mereka biasanya tersusun satu-satu, berpasangan atau dalam rantai, Gram + dalam kultur muda, motilitas berubah-ubah (tidak tetap), tidak ada spora, anaerob sempurna, membutuhkan teknik anaerobik untuk pertumbuhan dan membutuhkan media yang kaya akan nutrisi, koloni biasanya agak cembung atau flat, kemoorganotrofik, metabolisme fermentatatif, beberapa memecahkan karbohidrat. Produk dari metabolisme adalah glukosa atau pepton.
Biasanya campuran dari asam masuk dalam jumlah besar dari butirat, asetik atau formik dengan kelihatan gas H2
Genus Micrococcus
, indole dan katalase negatif, dan oksidase positif.
Mungkin menghasilkan nitrat dan gelatin mungkin cair. Terdapat dalam rongga perut dari hewan, feses, produk tumbuhan dan hewan, dan tanah. Beberapa spesies sering patogen pada vertebrata (Holt, dkk., 1994).
Bakteri Micrococcus mampu hidup pada saluran pencernaan ikan. Bakteri Micrococcus bersifat non patogen dan memberikan efek yang menguntungkan bagi ikan. Sifat menguntungkan dari bakteri Micrococcus dapat digunakan untuk probiotik dalam mencegah penyakit pada ikan (Verschere, dkk., 2000).
Micrococcus dapat ditemukan dalam berbagai jenis lingkungan, pada dasarnya bakteri ini dapat bertumbuh dengan baik pada lingkungan dengan konsentrasi air yang kurang dan tinggi kadar garamnya. Bakteri golongan ini tidak
menghasilkan spora, namun sel Micrococcus dapat bertahan hidup dalam kurun waktu yang relatif panjang (Greenblatt, dkk., 2004).
Bakteri yang mendekati genus ini mempunyai ciri-ciri morfologi sebagai berikut: warna koloni kuning, bentuk koloni bulat tepian timbul. Sel bentuk bola, diameter 0,5-2,0 μm, dalam bentuk sepasang, empat pasang, atau kelompok tidak tetap, tidak bentuk rantai, Gram +, tidak motil, katalase positif, oksidase negatif, metil red positif, suhu optimum pertumbuhan pada 30-37ºC dan tumbuh baik pada NaCl 1-7% (Feliatra, dkk., 2004).
Bakteri Micrococcus sp. merupakan bakteri Gram + dan biasanya jarang motil, tidak berspora, aerobik, biasanya koloni bercorak dari kuning atau merah, kemoorganotrof, dengan metabolisme pernapasan, sering memproduksi sedikit atau tidak ada asam dari karbohidrat. Biasanya tumbuh pada media yang sederhana. Katalase positif dan kadang oksidase positif, meskipun sangat jarang.
Biasanya halotoleran, tumbuh pada 5% NaCl berisi sitokrom dan tahan terhadap lisostafin. Bakteri ini tumbuh optimum pada suhu 25-37ºC, terjadi terutama pada kulit mamalia dan dalam tanah, tetapi biasanya diisolasi dari produk makanan dan udara (Holt, dkk., 1994).
Genus Bifidobacterium
Bakteri Bifidobacterium sp. ini Gram +, tersusun satu satu, bentuk pasangan, tersusun dalam bentuk V, kadang-kadang bentuk rantai, bentuk pagar sel paralel. Kadang-kadang melihatkan bentuk bulat besar (gembung), stain sering tidak tetap, tidak motil, tidak berspora, bukan asam lemak, anaerob. Sebagian kecil spesies dapat tumbuh di udara dengan CO2 10%, tidak tumbuh di bawah pH 4,5 atau di atas pH 8,5, kemoorganotrof, aktif memfermentasi karbohidrat, dengan
memproduksi sebagian besar asetik dan asam laktik dengan perbandingan 3:2;
tidak memproduksi CO2
Bakteri Bifidobacterium sangat efektif untuk melawan bakteri yang merugikan atau patogen yang masuk dari luar maupun bakteri yang merugikan dalam saluran pencernaan seperti Shigella dysenteria, Salmonella typhosa, Staphylococcus aureus, E. coli, dan bakteri lainnya. Karena bakteri ini memproduksi zat zat yang bersifat asam lemak rantai pendek terutama asam asetat dan laktat, dan bisa juga menghasilkan zat bersifat antibiotik (Silalahi, 2001).
, butirik dan asam propionik, katalase negatif (bukan positif ketika tumbuh atau berkembang di udara dengan penambahan CO2), dan oksidase positif. Biasanya membutuhkan macam-macam vitamin. Tumbuh optimum pada suhu 37-41ºC. Tumbuh dan berkembang dalam mulut dan saluran usus vertebrata darah panas, dan insekta, dalam sewage, dan biasanya tidak patogen (Holt, dkk., 1994).
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Mei sampai dengan Oktober 2016 di Stasiun Karantina Ikan, Pengendalian Mutu dan Keamanan Hasil Perikanan (SKIPM) Kelas I Medan I, Kuala Namu Medan. Prosedur Penelitian dapat dilihat pada Lampiran 1.
Alat dan Bahan Penelitian
Alat yang digunakan dalam penelitian ini adalah inkubator, laminar air flow, autoclave, erlenmeyer, vortex stirrer, aluminium foil, lampu bunsen, cawan petri, tabung reaksi, rak tabung, jarum ose, pipet tetes, mikroskop, cover glass, paper disk, timbangan digital, mortar porselen, gelas beaker, pisau, kamera digital, sarung tangan, masker, kertas label, dan alat tulis. Alat penelitian dapat dilihat pada Lampiran 2.
Bahan yang digunakan dalam penelitian ini adalah ikan Mas (Cyrpnus carpio), isolat bakteri patogen Aeromonas hydrophila, media Tryptone Soya Agar (TSA), media Triple Sugar Iron Agar (TSIA), media Sulfid Indol Motility (SIM), media Strach Agar, media Skim Milk Agar (SMA), media Methly Red, media Voges Proskaurt (VP), media Simmons Citrate, media gula-gulaan (glukosa, laktosa, manitol, maltosa dan sukrosa), reagen Kovac, methyl red, kristal violet, iodine, safranin, alkohol 95%, akuades, hidrogen peroksida (H2O2) 3%, alkohol, larutan fisiologis (NaCl 0,9 %) dan larutan Mc Farland. Bahan penelitian dapat dilihat pada Lampiran 2.
Prosedur Penelitian Pengambilan Sampel
Ikan dibedah secara aseptis untuk diambil organ pencernaannya (lambung dan usus), kemudian dimasukkan kedalam larutan fisiologis (NaCl 0.9%) pada pH 2 dengan tujuan hanya bakteri probiotik yang dapat tumbuh dan berkembang pada pH tersebut. Selanjutnya, lambung dan usus dihancurkan atau dihaluskan dengan menggunakan mortar porselen. Sampel yang telah dihaluskan, kemudian dilakukan pengenceran berseri 10-1 sampai 10-5
Metode seri pengenceran yang dilakukan yaitu dengan mengambil sebanyak 1 ml sampel, dimasukkan ke dalam tabung reaksi yang berisi 9 ml akuades steril lalu dihomogenisasi menggunakan vortex stirrer selama 2-4 menit sehingga didapat pengenceran 10
.
-1, untuk mendapatkan pengenceran 10-2 dilakukan dengan mengambil 1 ml dari pengenceran 10-1 dimasukkan ke dalam tabung reaksi yang berisi 9 ml akuades steril, demikian seterusnya dilakukan seri pengenceran hingga 10-5. Pengenceran 10-4 dan 10-5
Setelah inkubasi selama 24 jam, koloni dengan penampakan morfologi yang berbeda dari warna, bentuk, tepian, dan elevasi pada medium TSA kemudian diambil dan dimurnikan (diisolasi) pada media baru TSA dengan menggunakan metode cawan gores dengan beberapa tahap sampai didapatkan koloni bakteri tunggal sebagai isolat murni, kultur diinkubasi pada suhu 35°C selama 24 jam.
masing-masing diambil 1 ml kemudian dimasukkan ke dalam cawan petri yang telah berisi medium TSA dengan menggunakan metode cawan sebar (spread plate), kemudian diinkubasi pada suhu 35°C selama 24 jam. Proses isolasi bakteri dapat dilihat pada Lampiran 3.
kemampuan mendegradasi protein dan karbohidrat dengan melakukan serangkaian uji hidrolisis pati (amilum) dan uji hidrolisis kasein (protein) serta melakukan uji penghambatan bakteri potensial probiotik terhadap bakteri patogen untuk mengetahui bakteri potensial probiotik yang berhasil didapatkan mampu menghambat bakteri patogen yang sering menyerang ikan budidaya.
Uji Hidrolisis Pati (Amilum)
Suspensi bakteri hasil biakan murni diambil satu ose dan digoreskan pada cawan yang berisi media Strach Agar, dan diinkubasi pada suhu 37°C selama 24 jam. Setelah inkubasi, dilakukan uji iodine dengan cara meneteskan iodine pada permukaan agar yang berisi isolat. Uji hidrolisis pati positif ditandai dengan adanya zona kuning bening di sekeliling isolat yang mengindikasikan enzim amilase diproduksi oleh isolat sehingga di daerah tersebut amilum sudah dihidrolisis (Cappucino, 1983).
Uji Hidrolisis Kasein (Protein)
Suspensi bakteri hasil biakan murni diambil satu ose dan digoreskan pada cawan yang berisi media Skim Milk Agar (SMA), dan diinkubasi pada suhu 37°C selama 24 jam. Uji hidrolisis protein positif ditandai dengan adanya zona bening di sekeliling koloni yang menunjukkan bahwa bakteri tersebut mempunyai aktivitas proteolitik (Fardiaz, 1992).
Uji Penghambatan Bakteri Uji Patogen
Metode yang digunakan adalah metode cawan sebar (spread plate).
Bakteri uji patogen dan bakteri potensial probiotik disuspensikan hingga kekeruhannya sama dengan larutan suspensi Mc Farland yaitu 108 CFU/ml.
Bakteri uji patogen diisolasi kedalam cawan petri yang berisi media TSA dengan
teknik cawan sebar (spread plate), kemudian paper disk yang telah direndam kedalam kultur cair isolat bakteri potensial probiotik ditanam dengan cara ditekan ke atas media TSA. Selanjutnya inkubasi pada suhu 35°C selama 24 jam. Setelah inkubasi diamati adanya indikasi penghambatan dengan terbentuknya zona bening pada media yang berarti menunjukkan kemampuan menghambat bakteri uji patogen (Aryati dan Hambali, 2004). Uji penghambatan bakteri uji patogen dapat dilihat pada Lampiran 4.
Identifikasi Spesies Bakteri Potensial Probiotik Karakterisasi Morfologi Isolat
Isolat bakteri murni diidentifikasi morfologi selnya dengan menggunakan uji pewarnaan gram dan pengamatan bentuk bakteri secara mikroskopik.
Pewarnaan gram dilakukan dengan membersihkan kaca objek dengan alkohol dan disterilkan pada nyala api bunsen, kemudian diambil isolat bakteri dengan jarum ose dan dioleskan pada object glass. Isolat bakteri kemudian ditetesi kristal violet dan dibiarkan selama 1 menit, selanjutnya dicuci dengan air mengalir dan dianginkan hingga kering. Isolat bakteri kemudian ditetesi kembali dengan larutan iodine dan dibiarkan selama 1 menit, kemudian dicuci dengan air mengalir dan dianginkan hingga kering. Selanjutnya isolat bakteri ditetesi alkohol 95% selama 30 detik, kemudian dialiri air dan dianginkan hingga kering. Isolat bakteri kemudian ditetesi safranin selama 30 detik dan dicuci dengan air mengalir dan dikering anginkan, kemudian dilakukan pengamatan dengan menggunakan mikroskop.
Bakteri gram positif ditandai dengan warna ungu yang menunjukkan bahwa bakteri tersebut mampu mengikat warna kristal violet, sedangkan bakteri gram negatif ditandai dengan warna merah muda yang menunjukkan bahwa bakteri tersebut tidak mampu mengikat warna kristal violet dan hanya terwarnai oleh safranin (pewarna tandingan) (Hadioetomo, 1993). Bakteri yang tumbuh kemudian diamati bentuk selnya secara mikroskopik pada kaca preparat sehingga dapat diketahui bentuknya (kokus, batang atau spiral).
Identifikasi Berdasarkan Uji Biokimia Uji Katalase
Sebanyak 2 tetes H2O2
Uji positif ditandai dengan terbentuknya gelembung-gelembung oksigen yang menunjukkan bahwa organisme yang bersangkutan menghasilkan enzim katalase yang mengubah hidrogen peroksida menjadi air dan oksigen dan uji negatif ditandai dengan tidak adanya perubahan atau gelembung-gelembung oksigen pada isolat bakteri (Hadioetomo, 1993).
3% diletakkan pada object glass steril. Isolat bakteri diambil menggunakan jarum ose steril, kemudian dipindahkan ke atas kaca objek dan dicampurkan.
Uji Motilitas
Sebanyak satu ose isolat bakteri ditusukkan ke medium uji SIM dan diinkubasi selama 24 jam pada suhu 29ºC.
Uji positif ditandai dengan pertumbuhan bakteri yang menyebar, maka bakteri tersebut bergerak (motil) dan bila pertumbuhan bakteri tidak menyebar
hanya berupa satu garis, maka bakteri tersebut tidak bergerak (non motil) (Sudarsono, 2008).
Uji Indol
Sebanyak satu ose isolat bakteri diinokulasi kedalam medium uji SIM dan diinkubasi selama 24 jam pada suhu 29ºC. Setelah inkubasi ditambahkan 10-12 tetes reagen Kovac.
Uji positif ditandai dengan terbentuknya lapisan berwarna merah di bagian atas biakan dan uji negatif jka lapisan berwarna kuning (Hadioetomo, 1993).
Uji MR
Sebanyak satu ose isolat bakteri diinokulasi kedalam media MR-VP dan diinkubasi selama 24 jam pada suhu 29ºC. Setelah inkubasi selama 24 jam, media ditambahkan 3-4 tetes indikator metil red.
Uji positif ditandai dengan perubahan warna medium menjadi merah, artinya terbentuk asam dan uji negatif ditandai dengan tidak adanya perubahan warna pada media (Hadioetomo, 1993).
Uji Simmons Citrate
Sebanyak satu ose isolat bakteri diinokulasi secara zig-zag pada permukaan agar miring media Simmons Citrate dan diinkubasi selama 24 jam pada suhu 29ºC.
Uji positif ditandai dengan berubahnya warna medium menjadi biru dan uji negatif ditandai dengan tidak terjadinya perubahan warna pada media (Sudarsono, 2008).
Uji TSIA
Sebanyak satu ose isolat bakteri diinokulasi kedalam media TSIA dengan cara menusuk tegak lurus pada bagian butt (tusuk) dan cara zig zag pada bagian slant (miring) dan diinkubasi selama 24 jam pada suhu 29ºC.
Perubahan warna kemudian diamati, apabila bagian slant berwarna merah dan butt berwarna kuning maka bakteri mampu memfermentasi glukosa, sedangkan apabila bagian slant dan butt keduanya berwarna kuning maka bakteri mampu memfermentasi sukrosa dan laktosa (Yusuf, 2009).
Uji Gula-gulaan
Sebanyak satu ose isolat bakteri diinokulasikan ke dalam tabung-tabung reaksi yang berisi medium fermentasi glukosa, laktosa, manitol, maltosa dan sukrosa, dan diinkubasi selama 24 jam pada suhu 29ºC.
Uji positif ditandai dengan berubahnya warna medium menjadi kuning dan apabila dalam tabung terdapat gelembung, berarti fermentasi tersebut menghasilkan gas (CO2
Analisis Data
).
Data yang telah diperoleh dianalisis secara deskriptif dengan mendeskripsikan secara sistematis dan akurat secara ilmiah. Hasil uji terhadap isolat-isolat yang diperoleh, dilakukan upaya identifikasi bakteri berdasarkan karakter biokimia sesuai dengan tabel biokimia dengan berpedoman pada buku
“Cowan amd Steels’s Manual for The Identification of Medical Bacteria” dan Bergey’s Manual of Determinative Bacteriology 8th Edition.
HASIL DAN PEMBAHASAN
Hasil
Bakteri Potensial Probiotik Pada Lambung dan Usus Ikan Mas
Dari penelitian yang telah dilakukan, diperoleh hasil bahwa jumlah isolat bakteri potensial probiotik dari isolasi lambung dan usus ikan Mas (Cyprinus carpio) ditemukan sebanyak 4 isolat bakteri, yaitu terdapat 2 isolat bakteri dari hasil isolasi pada lambung dan 2 isolat bakteri dari hasil isolasi pada usus. Hasil tersebut diperoleh setelah dilakukan uji untuk menyeleksi seluruh isolat yang ditemukan dari lambung dan usus ikan Mas (C. carpio) sehingga diperoleh isolat bakteri yang memang merupakan potensial probiotik yaitu sebanyak 4 isolat murni.
Morfologi Koloni dan Sel Bakteri Potensial Probiotik Pada Ikan Mas
Isolat-isolat bakteri potensial probiotik yang ditemukan dari hasil isolasi lambung dan usus ikan Mas (C. carpio) dapat dilihat dari morfologi koloni meliputi tepian, elevasi dan warna koloni. Adapun ciri-ciri morfologi dari keempat koloni yang berhasil diperoleh dapat dilihat pada Tabel 1. Berdasarkan Tabel 1 dapat dijelaskan bahwa ke-4 jenis bakteri memiliki kemiripan pada tepian dan elevasi, yaitu bertepi licin dan berelevasi cembung, sedangkan pada warna dan bentuk memiliki perbedaan yaitu ke-2 isolat bakteri memiliki warna putih kekuningan dan 2 isolat lainnya memiliki warna putih.
Tabel 1. Morfologi Koloni Isolat Bakteri Potensial Probiotik Pada Ikan Mas
Kode Isolat Koloni Morfologi Sel
Tepian Elevasi Warna Gram Bentuk
LIM-01 Licin Cembung Putih Kekuningan + Kokus LIM-02 Licin Cembung Putih Kekuningan + Kokus
UIM-01 Licin Cembung Putih + Kokus
UIM-02 Licin Cembung Putih + Basil
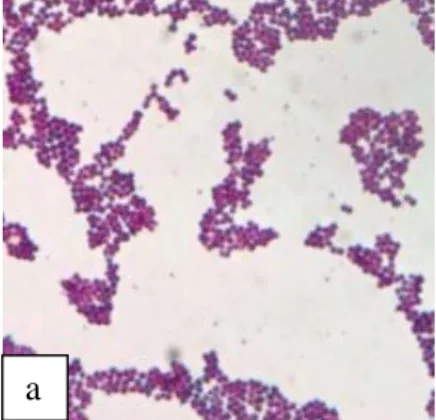
Pengamatan morfologi pada sel isolat bakteri potensial probiotik yang diperoleh dari ikan Mas perlu dilakukan dengan pewarnaan Gram dan uji biokimia untuk mengidentifikasi bakteri potensial probiotik pada ikan Mas. Pewarnaan gram dilakukan secara mikroskopik dengan pembesaran 100x kemudian didapat hasil pewarnaan Gram dari ke-4 isolat bakteri yaitu berwarna ungu yang merupakan Gram positif karena mampu mengikat kristal violet. 1 dari 3 isolat bakteri tersebut berbentuk basil atau batang, sedangkan yang lainnya berbentuk kokus atau bulat. Hasil pewarnaan Gram dari isolat bakteri potensial probiotik dapat dilihat pada Gambar 3.
Gambar 2. Bentuk Sel dari Isolat (a) UIM-01 (b) UIM-02
Karakterisasi dan Identifikasi Bakteri Potensial Probiotik Pada Ikan Mas Hasil pengamatan morfologi sel baik pewarnaan Gram dan uji biokimia dari ke-4 isolat bakteri dapat dilihat pada Tabel 2. Hasil uji Biokimia dari ke-4
a b
bakteri yang diperoleh diidentifikasi menurut buku Bergey’s Manual of Determinative Bacteriology 8th Edition oleh Holt dkk., (1994).
Tabel 2. Karakterisasi Isolat Bakteri Probiotik Potensial Pada Ikan Mas Karakterisasi
Bakteri
Isolat Bakteri
LIM-01 LIM-02 UIM-01 UIM-02
Motilitas - - - -
Katalase + + + +
Oksidase + + - -
TSIA A/A A/A K/K K/K
Gelatin - - - -
Urea - - - -
Citrat - - - -
MR/VP + + + +
LIA - - - -
Glukosa + + + +
Arabinosa - - - -
Sorbitol - - - -
Manitol + + + +
Inositol + + + +
Sukrosa - - + +
Spesies Bakteri Micrococcus varians
Micrococcus varians
Staphylococcus arlettae
Bacillus firmus Keterangan: (+) positif, (-) negatif, (A) Acid, (K) Alkali
Hasil karakterisasi dan identifikasi ke-4 isolat bakteri dengan kode isolat LIM-01 dan LIM-02 mirip dengan Micrococcus varians, isolat dengan kode isolat UIM-01 mirip dengan Staphylococcus arlattae dan isolat dengan kode isolat UIM-02 mirip dengan Bacillus firmus.
Identifikasi bakteri dilakukan dengan teknik konvensional dengan membandingkan bakteri yang sedang diidentifikasi dengan bakteri yang telah teridentifikasi sebelumnya. Bila tidak terdapat bakteri yang ciri-cirinya 100%
mempunyai kemiripan ciri-ciri, maka dilakukan pendekatan terhadap bakteri yang memiliki ciri-ciri yang paling menyerupai. Oleh karena itu teknik identifikasi dengan metode konvensional akan selalu menghasilkan suatu bakteri tertentu yang
sudah teridentifikasi sebelumnya dan tidak akan dapat menemukan spesies baru (Bergey, 1994).
Hidrolisis Pati (Amilum) dan Kasein (Protein) Pada Isolat Bakteri
Uji hidrolisis pati (amilum) dan kasein (protein) terhadap isolat bakteri dilakukan untuk mengetahui kemampuan bakteri dalam menguraikan enzim amilase dan protease yang merupakan tahap awal dalam seleksi seluruh isolat bakteri untuk mendapatkan kandidat bakteri yang berpotensi probiotik pada ikan Mas. Uji hidrolisis dilakukan dengan menggoreskan masing-masing koloni bakteri pada media uji pati (amilum) dan kasein (protein) kemudian ditandai dengan terbentuknya zona bening. Kemampuan isolat-isolat bakteri dalam menghidrolisis pati (amilum) dan kasein (protein) dapat dilihat pada Tabel 3.
Tabel 3. Kemampuan Isolat Kandidat Probiotik Menghidrolisis Pati dan Kasein
Kode Isolat Hidrolisis
Kasein Pati/Amilum
LIM-01 + -
LIM-02 + -
UIM-01 + -
UIM-02 + -
Gambar 3. Hidrolisis Kasein (a) UIM-01 (b) UIM-02 Zona Bening
a
b
Indikasi Penghambatan Bakteri Aeromonas hydrophila
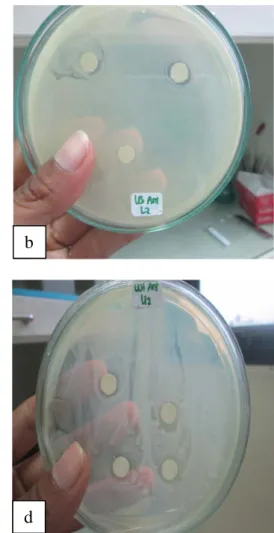
Isolat-isolat bakteri yang mampu menghidrolisis pati (amilum) dan kasein (protein) selanjutnya diuji tantang dengan bakteri Aeromonas hydrophila untuk mengetahui adanya indikasi penghambatan terhadap bakteri A. hydrophila. Uji tersebut bertujuan untuk memastikan bahwa ke-4 isolat bakteri tersebut merupakan isolat bakteri yang berpotensi probiotik pada ikan Mas (C. carpio) karena menunjukkan adanya indikasi penghambatan terhadap bakteri patogen A. hydrophila. Indikasi penghambatan isolat bakteri potensial probiotik terhadap bakteri patogen A. hydrophila dapat dilihat pada Gambar 5.
Gambar 4. Indikasi Penghambatan bakteri A. hydrophila (a) M. varians (b) M. varians (c) S. arlattae (d) B. firmus
a b
c d
Indikasi penghambatan pada bakteri patogen A. hydrophila menunjukkan empat isolat dari hasil isolasi saluran pencernaan ikan Mas menghasilkan zona bening di sekitar paperdisk yang menunjukkan bahwa isolat bakteri yang berpotensi sebagai probiotik tersebut mampu menghambat pertumbuhan bakteri uji patogen A. hydrophila.
Besarnya daerah zona bening di sekitar paper disk yang dihasilkan tiap-tiap isolat berbeda-beda berdasarkan tingkat daya hambat bakteri terhadap bakteri uji. Berdasarkan Gambar 4, nilai indikasi hambatan untuk bakteri M.
varians sebesar 2mm, bakteri S. arlattae sebesar 2 mm dan bakteri B. firmus sebesar 3 mm.
Pembahasan
Bakteri Potensial Probiotik Pada Lambung dan Usus Ikan Mas
Pengendalian penyakit bakterial yang umum dilakukan dengan pemakaian antibiotik atau bahan kimia sudah tidak diperbolehkan lagi. Hal ini dikarenakan antibiotik dapat menjadikan patogen-patogen menjadi resisten, berdampak negatif terhadap kesehatan konsumen berupa residu antibiotik dan menimbulkan kontaminasi terhadap lingkungan perairan. Sistem pengendalian penyakit yang ramah lingkungan haruslah dimunculkan, maka probiotik dipandang sebagai langkah alternatif yang berperan sebagai kontrol biologis yang digunakan sebagai musuh alami bakteri patogen.
Isolasi bakteri pada penelitian ini dilakukan untuk mendapatkan bakteri potensial probiotik pada ikan Mas (C. carpio). Isolasi dilakukan pada lambung dan usus ikan mas (cyprinus carpio) yang belum terkena antibiotik ataupun bahan
kimia lainnya dalam proses pembudidayaan agar kandidat bakteri probiotik yang ditemukan pada lambung dan usus ikan Mas (Cyprinus carpio) tidak merupakan bakteri dari hasil penggunaan antibiotik melainkan murni yang terdapat pada lambung dan usus ikan Mas.
Bakteri probiotik merupakan bakteri yang aman dan relatif menguntungkan dalam saluran pencernaan yaitu lambung dan usus ikan.
Lambung dan usus tersusun oleh mikroba yang bersifat memberikan dampak bagi peningkatan keseimbangan mikroba. Bakteri ini menghasilkan zat yang tidak berbahaya bagi inang tetapi justru menghancurkan bakteri patogen pengganggu sistem pencernaan. Dari hasil isolasi dan pemurnian didapatkan sebanyak 4 isolat, yaitu terdapat 2 isolat bakteri pada lambung dan 2 isolat dari hasil isolasi usus.
Hal ini sesuai dengan Lestari (2012) yang menyatakan bahwa jenis bakteri yang dominan dalam saluran pencernaan dapat mempengaruhi pertumbuhan dan perkembangan ikan sehingga dapat meningkatkan kualitas ikan. Bakteri yang terdapat didalam saluran pencernaan ikan menghasilkan enzim yang mampu digunakan dalam mendegradasi nutrisi dalam pakan. Bakteri tersebut memainkan peranan penting bagi kesehatan melalui beberapa cara seperti efeknya terhadap morfologi saluran pencernaan, nutrisi, patogen, dan immunitas. Beberapa mikroflora dalam saluran pencernaan dapat melindungi usus dari serangan bakteri patogen dan merangsang pembentukan imunitas.
Morfologi Koloni dan Sel Bakteri Potensial Probiotik Pada Ikan Mas
Berdasarkan hasil pengamatan koloni dari ke-4 isolat bakteri potensial probiotik pada tabel 2 diketahui, bahwa morfologi pada ke-4 isolat bakteri
memiliki kemiripan pada tepian dan elevasi, dimana ke-4 isolat bakteri tersebut memiliki tepian licin, dan elevasi cembung. Ke-4 isolat tersebut berasal dari isolasi lambung sebanyak 2 isolat dengan kode isolat LIM-01 dan LIM-02 serta 2 isolat dari hasil isolasi usus dengan kode isolat UIM-01 dan UIM-02 dan untuk warna ke-4 isolat bakteri tersebut memiliki sedikit perbedaan dimana pada isolat kode LIM-01 dan LIM-02 berwarna putih kekuningan dari hasil isolasi lambung dan isolat kode UIM-01 dan UIM-02 berwarna putih dari hasil isolasi usus.
Hasil pengamatan morfologi sel dari ke-4 isolat bakteri melalui pewarnaan Gram menunjukkan bahwa 3 isolat bakteri tersebut memiliki bentuk sel kokus dan 1 isolat bakteri berbentuk basil. Masing-masing bakteri merupakan gram positif yang mampu mempertahankan kristal violet pada pewarnaan Gram (Gambar 3).
Bakteri gram positif merupakan bakteri yang memiliki dinding sel yang tebal dan membran sel selapis sehingga pada saat bakteri mengalami dehidrasi dengan pemberian alkohol 96% pori-porinya akan mengkerut yang menyebabkan warna utama (kristal violet) tidak bisa keluar.
Karakterisasi dan Identifikasi Bakteri Potensial Probiotik Pada Ikan Mas Probiotik telah diketahui memiliki potensi untuk meningkatkan ketahanan tubuh dan memperbaiki kualitas air. Pada saluran pencernaan ikan, terdapat sedikitnya sembilan bakteri yang berfungsi membantu meningkatkan kecernaan pakan. Adapun jenis bakteri tersebut adalah Lactococcus sp., Carnobacterium sp., Stapylococcus sp., Bacillus sp., Eubacterium sp., Pseudomonas sp., Lactobacillus sp., Micrococcus sp., dan Bifidobacterium sp., bakteri-bakteri tersebut sering digunakan sebagai kandidat probiotik (Feliatra dkk., 2004).
Berdasarkan hasil penelitian yang dilakukan, isolat bakteri yang berpotensi probiotik yang berhasil ditemukan berjumlah 4 isolat dengan kode LIM-01, LIM- 02, UIM-01, dan UIM-02 (Tabel 1), yang memiliki ciri morfologi yang sama yaitu tepian licin dan elevasi datar tetapi memiliki sedikit perbedaan pada warna yaitu isolat LIM-01 dan LIM-02 berwarna putih-kekuningan dan isolat UIM-01 dan UIM-02 bewarna putih. Setelah melakukan pengamatan morfologi koloni, selanjutnya dilakukan tahap uji biokimia untuk menentukan spesies bakteri potensial probiotik dan ditemukan hasil uji biokimia pada ke-4 isolat bakteri tersebut.
Hasil uji biokimia pada kode LIM-01 dan LIM-02 menunjukkan hasil yang sama yaitu negatif untuk uji gelatin, urea, citrat, LIA, arabinosa, sorbitol dan sukrosa dan positif untuk uji katalase, oksidase, MR/VP, manitol, dan inositol serta TSIA bernilai acid. Dari hasil tersebut selanjutnya dilakukan penentuan spesies berdasarkan buku Bergey’s Manual of Determinative Bacteriology 8th Edition yang menyimpulkan bahwa hasil pada kode LIM-01 dan LIM-02 adalah Micrococcus varians. Hal ini sesuai dengan Holt et al. (1994) yang menyatakan bahwa bakteri Micrococcus sp. memiliki morfologi gram positif, jarang motil dan kebanyakan non motil, koloni berwarna kekuningan, tumbuh pada media yang sederhana, katalase positif, indol negatif, ada yang mampu memfermentasi glukosa dan ada yang mampu memfermentasi laktosa dan sukrosa, tumbuh optimum pada suhu 25ºC-37ºC.
Bakteri M. varians yang berhasil diisolasi dari saluran pencernaan ikan Mas adalah 2 isolat. Bakteri M. varians merupakan bakteri potensial probiotik yang berasal dari hasil isolasi pada lambung ikan Mas. Hal ini sesuai dengan
penelitian yang dilakukan oleh Saifudin, dkk (2015) yang menyatakan bahwa M.
varians merupakan bakteri yang berhasil diisolasi dari lambung ikan Mas dan memiliki antibakteri terhadap bakteri lain serta mampu menghidrolisis kasein dan lemak meskipun masih diperlukan penanganan selanjutnya bila sebagai probiotik baik skala laboratorium maupun lapangan.
Hasil uji biokimia pada isolat lainnya yaitu dengan kode UIM-01 ditemukan sedikit perbedaan hasil pada uji biokimia kode LIM-01 dan LIM-02 yaitu pada hasil uji oksidase dan sukrosa yang bernilai positif, dan TSIA yang bernilai alkali. Adapun hasil uji biokimia pada kode isolat UIM-01 yaitu positif untuk katalase, MR/VP, glukosa, manitol, inositol, dan sukrosa, negatif untuk motilitas, oksidase, gelatin, urea, citrat, LIA, arabinosa dan sorbitol serta TSIA yang bernilai alkali. Dari hasil tersebut menyatakan bahwa isolat dengan kode UIM-01 merupakan Staphylococcus arlettae. Hal ini sesuai dengan Holt et al.
(1994) yang menyatakan bahwa bakteri Staphylococcus sp. gram positif, motilitas berubah-ubah, kebanyakan motil, warna koloni putih susu atau krem. Bakteri ini memiliki katalase positif dan oksidase negatif, sering mengubah nitrit menjadi nitrat, mampu memfermentasi laktosa dan sukrosa, tumbuh optimum pada temperatur 37ºC. Beberapa spesies ada yang patogen pada manusia dan hewan.
Hasil uji biokimia pada kode isolat UIM-02 memiliki hasil yang sama pada kode isolat UIM-01 kecuali morfologi bentuk isolat yang merupakan basil (batang). Adapun hasil uji biokimia pada kode isolat UIM-02 yaitu positif untuk katalase, MR/VP, glukosa, manitol, inositol, dan sukrosa, negatif untuk motilitas, oksidase, gelatin, urea, citrat, LIA, arabinosa dan sorbitol serta TSIA yang bernilai alkali. Dari hasil tersebut dilakukan pengidentifikasian spesies berdasarkan buku
Bergey’s Manual of Determinative Bacteriology 8th Edition dan menyimpulkan bahwa kode isolat UIM-02 merupakan Bacillus firmus. Hal ini sesuai dengan Holt et al. (1994) yang menyatakan bahwa bakteri Bacillus firmus memiliki ciri-ciri morofologi yaitu gram positif, motil dengan flagel peritrik, endospora oval, kadang-kadang bundar atau silinder dan sangat resisten pada kondisi yang tidak menguntungkan. Warna koloni putih susu sampai kekuningan dengan tepian berombak, katalase positif, indol negatif dan mampu memfermentasi glukosa dan sukrosa. Tersebar luas pada bermacam-macam habitat dan sedikit spesies yang patogen. Suhu tumbuh optimum pada 28ºC-35ºC.
B. firmus merupakan bakteri potensial probiotik yang berhasil diisolasi dari usus ikan Mas. Bakteri B. firmus dapat dikatakan sebagai probiotik karena bakteri ini mampu hidup dan bertahan serta berkembang biak di dalam saluran pencernaan ikan dan dapat hidup dan berkembang di dalam air wadah pemeliharaan ikan. Hal ini sesuai dengan Irianto (2005) yang menyatakan bahwa probiotik B. firmus merupakan bakteri fakultatif aerob lebih menyukai kondisi lingkungan yang cukup oksigen sehingga pertumbuhannya menjadi lebih baik.
Probiotik B. firmus merupakan bakteri pelarut fosfat dan dapat menghasilkan fitohormon sehingga bakteri ini mampu memanfaatkan pakan dan menguraikannya menjadi bentuk yang lebih sederhana. Dengan kemampuan inilah maka Bacillus seringkali dimanfaatkan untuk penguraian substrat polimer organik, memperbaiki kualitas air, mengurai jumlah bakteri patogen melalui penyeimbang populasi mikroba serta meningkatkan kesehatan dan pertumbuhan inang seperti ikan.
Hidrolisis Pati (Amilum) dan Kasein (Protein) Pada Isolat Bakteri
Prinsip dasar kerja probiotik adalah pemanfaatan kemampuan mikroorganisme dalam memecah atau menguraikan rantai panjang karbohidrat, protein dan lemak yang menyusun pakan yang diberikan. Kemampuan ini diperoleh karena adanya enzim-enzim khusus yang dimiliki oleh mikroba untuk memecah ikatan tersebut. Menurut Effendi (2002), pemecahan molekul-molekul kompleks ini menjadi molekul sederhana jelas akan mempermudah pencernaan lanjutan dan penyerapan oleh saluran pencernaan ikan. Di sisi lain, mikroorganisme pelaku pemecah ini mendapat keuntungan berupa energi yang diperoleh dari hasil perombakan molekul kompleks tersebut.
Uji hidrolisis protein dilakukan untuk mengetahui kemampuan bakteri dalam menguraikan enzim protease. Uji ini ditandai dengan terbentuknya zona bening disekeliling bakteri yang ditanam pada media Skim Milk Agar yang mengandung kasein yang dapat dipecah oleh mikroorganisme proteolitik.
Uji hidrolisis pati (amilum) dilakukan untuk mengetahui kemampuan bakteri dalam menguraikan karbohidrat. Hidrolisis dari pati dapat terjadi dengan bantuan enzim amilase yang akan mengubah amilum menjadi maltosa. Uji hidrolisis pati ditandai dengan terbentuknya zona bening setelah diteteskan iodine pada isolat bakteri. Hal ini terjadi karena molekul pati merupakan molekul yang larut dalam air dan memberikan warna biru apabila tercampur dengan larutan iodin dan akan membentuk zona bening apabila menghidrolisis pati.
Dari hasil penelitian diperoleh bahwa isolat bakteri potensial probiotik yang diperoleh berasal dari genus Bacillus, Micrococcus, dan Staphylococcus melalui uji yang telah dilakukan. Isolat probiotik menghasilkan zona bening pada
uji hidrolisis protein yang artinya isolat bakteri tersebut memiliki kemampuan dalam menguraikan protein di dalam saluran pencernaan. Hal ini sesuai dengan Fardiaz (1992) yang menyatakan bahwa bakteri B. firmus merupakan bakteri potensial probiotik yang mempunyai sifat fisiologis menarik karena mempunyai kemampuan dalam mendegradasi senyawa organik seperti protein, selulosa, hidrokarbon dan agar, serta mampu menghasilkan antibiotik. Selain itu bakteri ini juga menunjukkan kemampuan dan ketahanan dalam menghadapi kondisi lingkungannya, misalnya ketahanan terhadap panas, asam, dan kadar garam, serta mempunyai kemampuan enzimatik, diantaranya dalam menghasilkan enzim amilase, protease dan lipase.
Indikasi Penghambatan Bakteri Aeromonas hydrophila
Produksi senyawa antimikroba sering dijadikan seleksi probiotik yaitu dengan melakukan uji indikasi penghambatan terhadap bakteri patogen, dimana variabel yang dilihat yaitu terjadinya penghambatan pertumbuan mikroba patogen.
Kemampuan bakteri probiotik dalam menghmbatan pertumbuhan bakteri patogen adalah metabolisme bakteri probiotik dalam menghasilkan asam laktat mampu untuk menghmbat berbagai macam mikroba patogen. Berdasarkan hasil penelitian dengan uji penghambatan Aeromonas hydrophila, diperoleh hasil bahwa ke-4 isolat menunjukkan indikasi penghambatan bakteri A. hydrophila dengan daya hambat masing-masing isolat yaitu M. varians 2 mm, S. arlettae 2 mm dan B.
firmus 3 mm.
Uji penghambatan bakteri patogen terhadap kandidat bakteri probiotik yang ditemukan di dalam lambung dan usus ikan menggunakan bakteri patogem
Aeromonas hydrophila. Bakteri ini merupakan bakteri yang paling sering menyerang ikan karena termasuk bakteri patogen oportunistik yang hampir selalu terdapat di air dan seringkali menimbulkan penyakit apabila ikan dalam kondisi yang kurang baik seperti adanya bercak merah pada ikan dan kerusakan pada kulit, insang dan organ dalam.
Uji penghambatan bakteri patogen biasanya dilakukan secara in vitro. Uji tersebut dapat dilakukan dengan beberapa metoda. Berdasarkan penelitian yang dilakukan, uji penghambatan bakteri patogen A.hydrophila menggunakan metoda paper disk, dimana paper disk yang telah ditanam isolat bakteri kandidat probiotik selanjutnya di letakkan di atas media yang telah disebar isolat bakteri patogen A.hydrophila, zona bening yang terbentuk disekeliling paper disk berisi kultur probiotik menunjukkan terjadinya penghambatan. Hal ini sesuai dengan Irianto (2003) yang menyatakan bahwa metode paper disk merupakan metoda yang cukup baik dan cukup kuat manakala daya penghambatannya terlihat baik dibandingkan metoda goresan pararel atau silang yang memiliki banyak kelemahan karena pembentukan isolat probiotik dan pertumbuan bakteri patogen tidak signifikan.
M. varians merupakan bakteri potensial probiotik pada ikan Mas (C. carpio) karena mampu menghambat pertumbuhan A. hydrophila yang merupakan bakteri patogen yang sering menyerang ikan dengan nilai indikasi penghambatan yaitu 2 mm. Keberhasilan probiotik M. varians dalam mengatasi dan mencegah serangan A. hydrophila disebabkan oleh kemampuan menyeimbangkan populasi mikroba pada media budidaya. Proses penghambatan pertumbuhan A. hydrophila pada media budidaya juga dapat melalui kompetisi