3
BAB II STUDI PUSTAKA
1.1. Tinjauan Pustaka 1.1.1. Kanker Payudara
Sel kanker dapat timbul apabila telah terjadi mutasi genetik sebagai akibat dari adanya kerusakan DNA pada sel normal. Kanker adalah sel tubuh yang mengalami mutasi (perubahan) dan tumbuh tidak terkendali serta membelah lebih cepat dibandingkan dengan sel normal. Sel kanker tidak mati setelah usianya cukup, melainkan tumbuh terus dan bersifat invasif sehingga sel normal tubuh dapat terdesak atau malah mati (Kemenkes RI, 2015). Kanker payudara adalah keganasan pada payudara yang berasal dari sel kelenjar, saluran kelenjar, serta jaringan penunjang payudara, namun tidak termasuk kulit payudara (Depkes RI, 2009).
Kanker payudara terdiri dari dua tipe utama yaitu, karsinoma duktal dan karsinoma lobular (Bashar, et al., 2014). Berdasarkan data dari Sistem Informasi Rumah Sakit tahun 2010, kanker payudara adalah jenis kanker tertinggi pada pasien rawat jalan maupun rawat inap mencapai 12.014 orang (28,7%) (Kementerian Kesehatan RI, 2019). Pada tahun 2013, lebih dari 60.000 orang didiagnosis kanker payudara di Indonesia. Walaupun prevalensi kejadian kanker payudara di Indonesia lebih rendah dari beberapa negara seperti Australia, Selandia Baru dan Jepang, tetapi angka mortalitas akibat penyakit ini di Indonesia lebih tinggi daripada negara-negara tersebut (Youlden, et al., 2014).
Faktor risiko terjadinya kanker payudara dibedakan menjadi dua, yaitu faktor yang dapat dicegah dan faktor yang tidak dapat dicegah. Faktor yang dapat dicegah di antaranya yaitu: berat badan berlebih, kurang berolahraga, dan makanan yang tidak sehat. Adapun faktor yang tidak dapat dicegah antara lain: riwayat menstruasi, paparan estrogen berlebihan, dan riwayat keluarga. Oleh karenanya belum diketahui adanya terapi preventif yang pasti untuk kanker payudara. Namun setiap wanita memiliki kesempatan untuk memperkecil risiko terjadinya kanker payudara (Lakshmi, et al., 2012).
Gejala umum kanker payudara adalah adanya benjolan pada payudara yang dapat diraba dan biasanya semakin mengeras, tidak beraturan, serta terkadang menimbulkan nyeri. Gejala lain yang tampak, misalnya perubahan bentuk dan ukuran, kerutan pada kulit payudara sehingga tampak menyerupai kulit jeruk, adanya cairan tidak normal berupa nanah, darah, cairan encer, atau air susu pada ibu tidak hamil atau tidak sedang menyusui yang keluar dari puting susu. Gejala kanker payudara umumnya juga tampak dari adanya pembengkakan di salah satu payudara, tarikan pada puting susu atau puting susu terasa gatal, serta nyeri. Pada kanker payudara stadium lanjut, dapat timbul nyeri tulang, pembengkakan lengan, ulserasi kulit, atau penurunan berat badan (Suryaningsih & Sukaca, 2009).
Pertumbuhan jaringan payudara dipengaruhi oleh beberapa hormon, yaitu hormon prolaktin, hormon pertumbuhan, hormon progesteron, serta hormon estrogen (Suryaningsih & Sukaca, 2009). Paparan hormon estrogen secara berlebihan dapat memicu pertumbuhan sel secara tidak normal pada bagian tertentu (Dinkes Provinsi Sumatera Barat, 2019). Mekanisme terjadinya kanker payudara oleh paparan estrogen masih menjadi kontroversi karena terjadinya kanker payudara oleh paparan estrogen belum diketahui secara pasti disebabkan karena stimulasi estrogen terhadap pembelahan sel epitel atau karena disebabkan oleh estrogen dan metabolitnya yang secara langsung bertindak sebagai mutagen (Sandra, 2011). Tingginya paparan estrogen dapat disebabkan oleh beberapa keadaan, yaitu tidak pernah melahirkan atau melahirkan pertama kali pada usia lebih dari 35 tahun, tidak menyusui, menopause pada usia >50 tahun, pemakaian kontrasepsi hormonal dalam jangka waktu yang lama, serta menarche pada usia <12 tahun.
1.1.2. Sorgum (Sorghum bicolor L.)
Menurut United States Departement Of Agriculture (2019), tanaman sorgum memiliki taksonomi sebagai berikut :
Kingdom : Plantae Divisio : Magnoliophyta Class : Monocotyledon Ordo : Cyperales
Famili : Poaceae Genus : Sorgum
Species : Sorghum bicolor L. Moench
Gambar 2.1 Tanaman Sorgum (Sorgum bicolor L.) (Sumber : Dokumentasi pribadi) Keunikan daun sorgum terdapat pada sel penggerak yang terletak di sepanjang tulang daun. Sel ini dapat menggulung daun secara cepat bila terjadi kekeringan, untuk mengurangi transpirasi. Pelepah daun melekat pada ruas dan menyelimuti batang, agak tebal dan semakin tipis di pinggir, dengan lebar sekitar 25-30 cm atau beragam, bergantung varietas, bagian dalamnya berwarna putih dan mengkilat, sedangkan bagian luar berwarna hijau dan berlapis lilin. Permukaan pelepah licin hingga berambut (du Plessis, 2008).
Hampir seluruh tanaman sorgum memiliki kandungan senyawa fenolik, dimana jumlahnya hadir dalam kultivar tertentu yang dipengaruhi oleh genotipe dan lingkungan dimana ia tumbuh. Selain itu, faktor-faktor yang sama ini mempengaruhi warna, bentuk, dan kualitas gizi biji-bijinya. Di antara beberapa tanaman sereal, sorgum memiliki kandungan senyawa fenolik tertinggi yang mencapai hingga 6% (b / b) dalam beberapa varietas.Kelas utama senyawa fenolik sorgum adalah fenol sederhana, asam hidroksibenzoat, asam hidroksisinamat, flavonoid (flavanol, flavon, flavanon, isoflavon dan antosianin), kalkon, auron (hispidol), hidroksikumarin, lignan, hidrokstilben dan poliflavan (proantosianidin
dan pro-deoksiantosianidin). Namun, penelitian mengenai efek anti kanker dari senyawa fenolik sorgum secara in vitro jarang dilakukan. Salah satu penelitian mengenai efektivitas kandungan fenolik dari tanaman sorgum yang baru ditemukan oleh Suganyadevi, et al., (2013), dimana menggunakan sel kanker MCF-7 untuk menguji aktivitas antiproliferasi pada biji sorgum merah dan menunjukkan signifikan dalam menghambat pertumbuhan sel MCF-7 dengan IC50 sebesar 300 μg/ml.
Pada tahap inisiasi, fenolik dapat menghambat aktivasi prokarsinogen dengan menghambat enzim metabolisme fase I, seperti sitokrom P450 dan juga memfasilitasi detoksifikasi dan eliminasi karsinogen dengan induksi enzim metabolisme fase II seperti glutathione S-transferase (GST), NAD (P) H quinine oxidoreductase (NQO), dan UDP-glucuronyl-transferase (UGT). Selain itu juga dapat membatasi pembentukan sel-sel yang diinisiasi dengan merangsang perbaikan DNA (Chen, 2014).
1.1.3. Ekstraksi Ultrasonik
Ekstraksi ultrasonik merupakan teknik yang dikenal dengan sonokimia yaitu pemanfaatan efek gelombang ultrasonik untuk mempengaruhi perubahan-perubahan yang terjadi pada proses kimia. Keuntungan utama ekstraksi gelombang ultrasonik antara lain waktu yang digunakan relatif cepat, penggunaan pelarut minimal, dan efisien (Melecchi, 2006). Kekurangan dari metode sonikasi adalah hasil ekstraksi membutuhkan proses pemurnian lebih lanjut. Ekstraksi ultrasonik dapat menyebabkan gangguan fisik baik pada dinding maupun membran sel biologis serta penurunan ukuran partikel. Efek tersebut berdampak pada penetrasi pelarut yang lebih baik terhadap material sel yang pada akhirnya akan meningkatkan laju perpindahan massa pada jaringan serta memfasilitasi perpindahan senyawa aktif dari sel ke pelarut (Novak, et al., 2008).
Prinsip kerja ekstraksi ultrasonik adalah perambatan gelombang ultrasonik dari sumber getaran sonikator dalam medium pelarut secara longitudinal. Menurut Santos, et al., (2009), meningkatnya suhu pada proses sonikasi dapat membantu memutus interaksi yang kuat dari molekul air yang meliputi gaya Van der Waals, ikatan hidrogen, daya tarik menarik dipol antara molekul zat terlarut, dan bagian
aktif dalam molekul air. Walaupun energi gelombang ultrasonik mampu meningkatkan suhu medium, namun peningkatannya hanya sedikit sehingga metode ini masih tergolong kedalam metode non termal.
1.1.4. Skrining Fitokimia
Skrining fitokimia merupakan tahap pendahuluan dalam suatu penelitian fitokimia yang bertujuan untuk memberikan gambaran tentang golongan senyawa yang terkandung dalam tanaman yang sedang diteliti. Metode skrining fitokimia dilakukan dengan melihat reaksi pengujian warna dengan menggunakan suatu pereaksi warna. Hal penting yang berperan penting dalam skrininng fitokimia adalah pemilihan pelarut dan metode ekstraksi (Kristanti & Alfinda, 2008)
Pendekatan skrining fitokimia meliputi analisis kualitatif kandungan kimia dalam tumbuhan atau bagian tumbuhan (akar, batang, daun, bunga, buah, biji), terutama kandungan metabolit sekunder yang bioaktif, yaitu alkaloid, antrakinon, flavonoid, glikosida jantung, kumarin, saponin (steroid dan triterpenoid), tanin (polifenolat), minyak atsiri (terpenoid), iridoid, dan sebagainya. Adapun tujuan utama dari pendekatan skrining fitokimia adala untuk mensurvei tumbuhan untuk mendapatkan kandungan bioaktif atau kandungan yang berguna untuk pengobatan. Skrining fitokimia ini dilakukan dengan dua macam uji, yaitu uji tabung dan uji kromatografi. Uji tabung digunakan sebagai uji pendahuluan untuk mengetahui macam senyawa yang terdapat dalam serbuk tumbuhan yang belum diketahui. Sedangkan uji kromatografi digunakan sebagai penegas jenis senyawa dari uji tabung yang dilakukan sebelumnya. Dalam praktikum ini uji kromatografi dilakukan dengan Kromatografi Lapis Tipis (KLT) (Livrosdeamor, 2019)
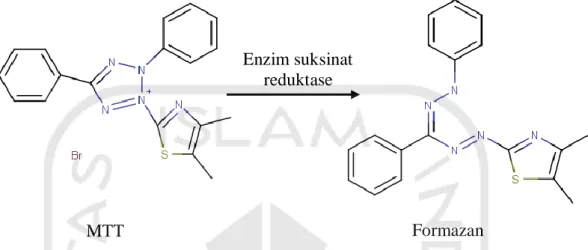
1.1.5. Uji Microtetrazolium (MTT)
Metode umum yang digunakan untuk uji sitotoksik adalah metode perhitungan langsung (direct counting) dengan menggunakan biru tripan (trypan blue) dan metode MTT. Uji MTT assay merupakan salah satu metode yang digunakan dalam uji sitotoksik. Metode ini merupakan metode kolorimetrik dimana pereaksi MTT ini merupakan garam tetrazolium yang dapat dipecah menjadi kristal formazan oleh sistem suksinat tetrazolium reduktase yang terdapat dalam jalur respirasi sel pada mitokondria yang aktif pada sel yang masih hidup. Kristal
formazan ini memberi warna ungu yang dapat dibaca absorbansinya dengan menggunakan ELISA reader (Pamilih, 2009).
Gambar 2.2 Prinsip Uji Sitotoksik Menggunakan Metode MTT Assay (Brescia, et al., 2009) Uji sitotoksik digunakan untuk menentukan parameter nilai IC50. Nilai IC50 menunjukkan nilai konsentrasi yang menghasilkan hambatan proliferasi sel sebesar 50% dan menunjukkan potensi ketoksikan suatu senyawa terhadap sel. Nilai ini merupakan patokan untuk melakukan uji pengamatan kinetika sel. Nilai IC50 dapat menunjukkan potensi suatu senyawa sebagai sitotoksik. Semakin besar harga IC50 maka senyawa tersebut semakin tidak toksik. Akhir dari uji sitotoksisitas dapat memberikan informasi % sel yang mampu bertahan dihidup, sedangkan pada organ target memberikan informasi langsung tentang perubahan yang terjadi pada fungsi sel secara spesifik (Pamilih, 2009).
1.1.6. Cell Line
Sel T47D merupakan continous cell line yang diisolasi dari jaringan tumor duktal payudara seorang wanita berusia 54 tahun. Continous cell line sering dipakai dalam penelitian kanker secara in vitro karena mudah penangannya, memiliki kemampuan replikasi yang tidak terbatas, homogenitas yang tinggi serta mudah diganti dengan frozen stock jika terjadi kontaminasi (CCRC, 2019). Sel T47D memiliki morfologi seperti sel epitel. Sel ini dikulturkan dalam media DMEM + 10% FBS + 2 mM L-Glutamin, diinkubasi dalam CO2 inkubator 5% dan suhu 37°C. Sel vero berasal dari ginjal kera hijau afrika (Cercopithecus aethiops). Sel ini homolog dengan sel tubuh manusia dan mudah dibiakkan. Sel vero yang sehat berbentuk triangular dan akan berubah menjadi bentuk
Enzim suksinat reduktase
round-off jika berinteraksi dengan senyawa yang memiliki aktivitas sitotoksik. Viabilitas atau mortalitasnya dapat dianalisis dengan mudah menggunakan metode uji methylthiazol-2-yl-2,5-diphenyl tetrazolium bromide (MTT). Metode ini banyak digunakan untuk mengevaluasi keamanan makanan dan obat (Liao, et al., 2010).
Media kultur buatan yang digunakan untuk menumbuhkan sel di luar tubuh organisme dibuat semirip mungkin dengan cairan biologis pada saat sel berada dalam tubuh organisme. Keterbatasan teknik kultur sel antara lain dalam pembuatan kultur sel memerlukan keahlian dan keterampilan khusus yang menjamin bahwa seluruh mata rantai prosedur pembuatannya terkontrol secara aseptis. Media yang digunakan adalah media M199 untuk sel vero dan media Roswell Park Memorial
Institute (RPMI) 1640 untuk pengujian sel T47D. Formula medium 199 mengandung garam Earle’s dan L-glutamin dan tidak mengandung natrium bikarbonat. Medium RPMI mengandung fosfat dalam jumlah besar dan diformulasi untuk digunakan dalam lingkungan atmosfer dengan 5% CO2 dan digunakan dalam bentuk bebas serum untuk pertumbuhan sel limfoid. Untuk mendapatkan pertumbuhan sel yang optimal, media kultur ditambahkan serum. Serum yang biasa digunakan dalam kultur adalah serum anak sapi (calf serum), serum fetus sapi (foetal bovine serum), serum kuda dan serum manusia (Andiana, et al., 2017).
1.2.Landasan Teori
Penyakit kanker merupakan salah satu penyakit yang menjadi momok bagi masyarakat, terutama adalah kanker payudara. D.I. Yogyakarta menjadi peringkat pertama di Indonesia sebagai tingkat prevalensi kanker payudara tertinggi sebesar 4,1%. Indonesia termasuk dalam negara yang memiliki keanekaragaman hayati tinggi, seperti tanaman Sorgum (Sorghum bicolor L.). Daun sorgum diketahui mengandung metabolit sekunder yang dapat dimanfaatkan dalam bidang kesehatan. Salah satu kandungan utama yang penting yaitu dari golongan fenol berupa 3-deoksiantosianin. Antosianin dalam daun sorgum telah banyak diteliti dan terbukti memiliki aktivitas seperti antioksidan, pencegah kelainan jantung koroner dengan sistem pencegahan penyempitan pembuluh arteri, dan pencegah kanker.
Suganyadevi, et al., (2013) melaporkan bahwa 3-deoxyanthocyanin diisolasi dari biji sorgum merah memiliki aktivitas sitotoksik pada sel kanker payudara.
Penelitian dari Suganyadevi, et al., (2013) juga menunjukkan bahwa senyawa fenolik berupa 3 - deoksiantosianidin yang diisolasi dari sorgum memiliki aktivitas antiproliferatif pada sel kanker payudara yaitu MCF-7 dengan IC50 sebesar 300 μg/ml. Oleh sebab itu, dibuat inovasi berupa antikanker payudara pada sel T47D yang berasal dari ekstrak daun sorgum. Metode yang digunakan dalam penelitian ini adalah MTT assay dengan menguji aktivitas sitotoksik pada ekstrak daun sorgum pada sel T47D dan dibandingkan dengan sel Vero. Diharapkan dengan adanya dari penelitian ini adalah menjadi salah satu inovasi pengobatan herbal dalam kanker payudara dengan memanfaatkan kandungan antioksidan yang terdapat pada ekstrak daun sorgum.
1.3.Hipotesis
1. Ekstrak daun sorgum diduga memiliki senyawa fenolik yang dapat digunakan untuk menghambat pertumbuhan sel T47D.
2. Konsentrasi hambatan (IC50) dari ekstrak etil asetat daun sorgum terhadap sel kanker payudara T47D diduga kurang dari 300 μg/ml.