BAB IV
HASIL DAN PEMBAHASAN
4.1. Penelitian Secara In Vitro
a. Isolasi Bakteri Pelarut Fosfat Asal Tanah
Penelitian secara in vitro dilakukan dengan mengambil sampel tanah dari sekitar rizosfer tanaman jagung sebagai sumber isolat bakteri pelarut fosfat (BPF) yang diperoleh dari Lahan milik CV. Meori Agro Jl.Atang Sanjaya KM 4 Pasir Gauk, Bogor.
Isolasi mikrob dari sampel tanah dilakukan menggunakan larutan fisiologis dan dilakukan seri pengenceran bertingkat kemudian diukur kemampuannya dalam melarutkan fosfat pada medium Pikovskaya padat. Tidak semua mikrob tersebut menghasilkan zona berwarna terang jernih atau zona bening. BPF yang tumbuh pada medium Pikovskaya padat akan melarutkan fosfat yang ditandai dengan adanya zona berwarna terang jernih atau zona bening yang mengelilingi koloni bakteri tersebut (Gambar 8). Hal ini disebabkan adanya pelarutan fosfat dari Ca3(PO4)2
Sebanyak 6 isolat BPF yang menghasilkan zona bening dimurnikan pada medium Pikovskaya padat (Gambar 9) dan disimpan dalam medium agar miring (stock culture) untuk digunakan dalam pengujian selanjutnya.
yang terdapat dalam medium.
b. Pengujian Kualitatif dan Kuantitatif Isolat Bakteri Asal Tanah
Pengujian pelarutan fosfat secara kuantitatif dan kualitatif terhadap isolat bakteri asal tanah dilakukan sebagai pembanding terhadap tiga isolat bakteri koleksi CV. Meori agro. Sebanyak 6 isolat bakteri pelarut fosfat (BPF) yang telah diperoleh selanjutnya dilakukan pengujian kemampuan bakteri pelarut fosfat (BPF) dalam melarutkan fosfat pada medium Pikovskaya padat dan cair serta pengukuran indeks pelarutan fosfat (IP). Hasil dari pengamatan pada penelitian ini dapat dilihat dalam Tabel 4 berikut ini :
Tabel 4. Kemampuan Bakteri Pelarut Fosfat dalam Melarutkan Fosfat pada Medium Pikovskaya Padat dan Cair
Dari Tabel 4 tampak bahwa isolat bakteri T9 memiliki nilai Indeks Pelarutan (IP) fosfat paling besar dari seluruh bakteri yang diukur yaitu sebesar 3,47. Isolat bakteri T9 pun memiliki hasil pelarutan P pada media pikovskaya cair paling
Nama Isolat Rata-rata Diameter Koloni (mm) Rata-rata Diameter Zona Bening (mm) Indeks Pelarutan (IP) Rata-rata P Terlarut (ppm) Warna Koloni Isolat T2 8,50 20,00 2,35 4,4 Putih Kekuningan Isolat T3 6,75 12,25 1,81 2,8 Putih Kekuningan Isolat T4 8,50 14,00 1,64 1,5 Putih Kekuningan Isolat T6 9,25 19,25 2,08 1,2 Kuning Kecoklatan
Isolat T8 5,50 18,00 3,27 2,5 Putih Susu
Isolat T9 5,25 18,25 3,47 4,9 Kuning
Kecoklatan
Gambar 9. Pemurnian bakteri pelarut fosfat pada medium Pikovskaya padat
besar dari seluruh bakteri yang diukur yaitu sebesar 4,9 ppm. Hal ini menunjukkan bahwa isolat bakteri T9 memiliki kualitas paling baik diantara 5 isolat bakteri lain yang berasal dari tanah yang diuji kemampuannya dalam melarutkan fosfat. Hasil ini berbeda dengan isolat bakteri T8 yang meskipun memiliki nilai IP yang tidak berbeda jauh dengan isolat bakteri T9 yaitu 3,27 namun dalam hal melarutkan fosfat pada media pikovskaya cair, isolat bakteri T8 hanya mampu melarutkan fosfat sebesar 2,5 ppm. Sedangkan nilai IP yang paling kecil terdapat pada isolat bakteri T4 yaitu sebesar 1,64 dan dalam hal pelarutan fosfat pada media pikovskaya cair juga hanya mampu melarutkan fosfat sebesar 1,5 ppm.
Hal ini menunjukkan bahwa kemampuan isolat bakteri dalam melarutkan fosfat tidak selalu dilihat berdasarkan lebar dari zona bening. Menurut Rachmiati (1995) besar kecilnya kemampuan bakteri dalam melarutkan P dari fosfat tak larut ditunjukkan oleh adanya luas daerah bening di sekitar isolat pada cawan petri. Tatiek (1991) juga mengemukakan bahwa daerah bening pada media padat tidak dapat menunjukkan kemampuan setiap bakteri untuk menyumbangkan jumlah fosfat terlarut, meskipun luas sempitnya daerah bening dapat menunjukkan besar kecil bakteri melarutkan fosfat sukar larut.
Berdasarkan pengujian secara kualitatif dan kuantitatif di atas maka dipilih satu mikrob unggul (paling baik) yang berasal dari tanah yaitu isolat bakteri T9. Pengujian selanjutnya menggunakan empat isolat bakteri yaitu satu isolat bakteri asal tanah (isolat bakteri T9) dan 3 isolat bakteri koleksi CV. Meori Agro (PS4, J2 dan P2).
Gambar 11. DNA genom bakteri c. Identifikasi Bakteri
Isolasi DNA
Isolasi DNA bakteri digunakan sebagai awal untuk mendapatkan informasi genetik 4 isolat bakteri terpilih. Isolat bakteri asal tanah yang diidentifikasi secara molekuler merupakan isolat terpilih yang memiliki hasil IP, pelarutan fosfat pada media pikovskaya cair dan kandungan enzim fosfatase yang tinggi yaitu isolat bakteri T9 sehingga, terdapat empat isolat bakteri yang akan diidentifikasi secara molekuler. Sel bakteri yang telah ditumbuhkan kemudian disentrifugasi untuk memisahkan supernatan dan pelet kemudian diresuspensi menggunakan bufer TE. Bufer TE mengandung lysozyme yang berfungsi sebagai perusak dinding sel. Sodium dodekil sulfat (SDS) 10% yang digunakan dalam isolasi DNA merupakan sejenis deterjen yang dapat digunakan untuk merusak membran sel, hal ini mengakibatkan sel mengalami lisis. Kotoran (debris) sel yang disebabkan oleh pengrusakan sel oleh lysozyme dan SDS dibersihkan dengan cara dibolak-balik sehingga yang tertinggal hanya molekul nukleotida (DNA dan RNA). Untuk menghilangkan protein dari larutan digunakan larutan isoamil (mengikat protein dan sebagian kecil RNA) dan kloroform (membersihkan protein dan polisakarida dari larutan) (Muladno, 2002). Pengambilan fase yang mengandung DNA pada bagian atas dilakukan dengan sangat hati-hati. Selanjutnya DNA dipresipitasi menggunakan etanol absolut 70%. DNA akan terlihat berwarna bening dan kental di dalam tabung Eppendoff (Gambar 11).
1
2000 bp 1000 bp
Elektroforesis Gel Agarosa
DNA yang telah berhasil diisolasi kemudian dilakukan pengujian untuk mendeteksi keberadaan DNA tersebut menggunakan elektroforesis pada gel agarosa (Gambar 12).
Amplifikasi Gen 16S rRNA
Hasil amplifikasi PCR isolat bakteri menggunakan primer 16S rRNA (Gambar 13) menghasilkan satu amplikon atau produk PCR berukuran sekitar 1500 bp. Primer yang digunakan dalam proses PCR ini, yaitu 16F27 (5’-AGA GTT TGA TCM TGG CTC AG- 3’) dan 16R1492 (5’- TAC GGY TAC CTT GTT ACG ACT T-3’). Selanjutnya amplikon ini disekuen untuk mengetahui urutan nukleotida pada gen 16S rRNA masing-masing isolat.
Gambar 12. Hasil elektroforesis DNA genom bakteri
Keterangan : 1 = 1 kb DNA ladder marker 2 = isolat P2 3 = isolat J2 4 = isolat PS4 5 = isolat T9 3 4 5
Gambar 13. Hasil amplifikasi gen 16S rRNA
Keterangan : 1 = 1 kb DNA ladder marker 2 = isolat P2 3 = isolat J2 4 = isolat PS4 5 = isolat T9 1 2 3 4 5 1500 bp 1 2 3 4 5
Homologi Isolat Bakteri Dengan Program FASTA
Berdasarkan hasil analisis sekuen gen 16S rRNA pada program FASTA diketahui homologi spesies dari empat isolat bakteri yang diuji. Isolat bakteri koleksi CV. Meori Agro dengan kode P2 memiliki kemiripan sebesar 100% dengan Pseudomonas aeruginosa strain QZX-A , isolat bakteri koleksi CV. Meori Agro dengan kode J2 memiliki kemiripan sebesar 99,3% dengan Bacillus subtilis strain PARZ2, dan isolat bakteri koleksi CV. Meori Agro dengan kode PS4 memiliki kemiripan sebesar 100% dengan Burkholderia sp. strain AH83. Sedangkan Isolat asal tanah yaitu isolat bakteri T9 memiliki kemiripan sebesar 99% dengan Burkholderia sp. strain A-3. Hasil analisis sekuen gen 16S rRNA dari tiga isolat BPF pada data GenBank terdapat pada Lampiran 11.
d. Pengujian Kualitatif dan Kuantitatif Isolat Bakteri Koleksi
Sebanyak 3 isolat bakteri koleksi CV. Meori Agro yang sudah diremajakan dilakukan pengujian dalam melarutkan fosfat pada medium Pikovskaya padat dan cair serta pengukuran indeks pelarutan fosfat (IP). Hasil dari pengamatan pada penelitian ini dapat dilihat dalam Tabel 5 berikut ini :
Tabel 5. Kemampuan Bakteri Pelarut Fosfat dalam Melarutkan Fosfat pada Medium Pikovskaya Padat dan Cair
Sama halnya dengan pengujian yang dilakukan pada isolat bakteri asal tanah, isolat bakteri koleksi pun diukur nilai IP dan kemampuannya dalam melarutkan fosfat. Hasil yang didapat pada pengukuran tersebut seperti yang terlihat pada tabel di atas menunjukkan bahwa Burkholderia sp. PS4memiliki nilai IP paling besar diantara isolat bakteri koleksi lainnya yaitu sebesar 1,56. Namun untuk kemampuannya dalam melarutkan fosfat pada media pikovskaya cair
Nama Isolat Rata-rata Diameter Koloni (mm) Rata-rata Diameter Zona Bening (mm) Indeks Pelarutan (IP) Rata-rata P Terlarut (ppm) Warna Koloni Burkholderia sp. PS4 10,25 16,00 1,56 0,8 Kuning
Bacillus subtilis J2 8,00 9,00 1,12 0,9 Putih
Kekuningan
Pseudomonas
aeruginosa P2 7,25 11,25 1,55 1,3
Putih Kekuningan
Burkholderia sp. PS4 memiliki nilai yang paling rendah yaitu sebesar 0,8 ppm. Lain halnya dengan Pseudomonas aeruginosa P2 yang memiliki kemampuan dalam melarutkan fosfat terlarut paling besar tetapi nilai IP tidak berbeda jauh dengan Burkholderia sp. PS4. Setiap spesies bakteri mempunyai kemampuan secara genetik yang berbeda dalam menghasilkan asam-asam organik baik dalam jumlah maupun jenisnya selama pertumbuhan. Jumlah dan jenis asam-asam organik inilah yang berperan dalam menentukan tingginya pelarutan P (Tatiek, 1991).
d. Pengujian Bakteri Pelarut Fosfat dalam Menghasilkan Enzim Fosfatase Setelah dilakukan pengujian kemampuan isolat bakteri dalam melarutkan fosfat pada medium Pikovskaya padat dan cair, kemudian dilakukan pengujian kemampuan kesembilan isolat bakteri (6 isolat asal tanah dan 3 isolat koleksi) dalam menghasilkan enzim fosfatase (Gambar 15). Hasil dari pengamatan pada penelitian ini dapat dilihat dalam Gambar 15 berikut ini :
Pada Gambar 15 diketahui bahwa nilai aktivitas enzim paling tinggi dari isolat-isolat asal tanah dimiliki oleh Burkholderia sp. T9 yaitu sebesar 0,268 ppm dan paling kecil dimiliki oleh isolat bakteri T8 yaitu sebesar 0,112 ppm. Sedangkan untuk isolat koleksi, nilai aktivitas enzim paling tinggi dimiliki oleh Burkholderia sp. PS4 yaitu sebesar 0,127 ppm dan paling rendah dimiliki oleh Bacillus subtilis J2 yaitu sebesar 0,058 ppm. Enzim fosfatase berperan utama dalam melepaskan fosfat dari ikatan P-organik. Enzim ini banyak dihasilkan oleh mikrob tanah, terutama yang bersifat heterotrof (Havlin et al., 1999). Enzim fosfatase merupakan komplek enzim terpenting di dalam tanah yang berfungsi melarutkan fosfat organik menjadi fosfat tersedia bagi tanaman. Enzim tersebut akan dihasilkan secara dominan pada kondisi ketersediaan fosfor rendah. Peningkatan aktivitas enzim fosfatase dapat terinduksi ketika jumlah P terbatas dalam media tanam, hal ini juga mencirikan akan tingginya kebutuhan P (Salvin et al., 2000). Berdasarkan hal tersebut Burkholderia sp. T9 (asal tanah) dan isolat koleksi Burkholderia sp. PS4 dapat dikatakan memiliki kemampuan paling baik dalam melarutkan P-organik yang terikat sehingga apabila diaplikasikan ke dalam tanah dapat meningkatkan efisiensi penyerapan fosfat oleh tumbuhan.
0,058 0,127 0,126 0,112 0,268 0,166 0,132 0,128 0,136 0 0,05 0,1 0,15 0,2 0,25 0,3 J2 PS4 P2 T8 T9 T3 T4 T6 T2 K on se n tr as i F os for ( p p m) Isolat Bakteri Nilai tertinggi Nilai terendah Nilai terendah Nilai tertinggi
e. Kurva Standar Bakteri
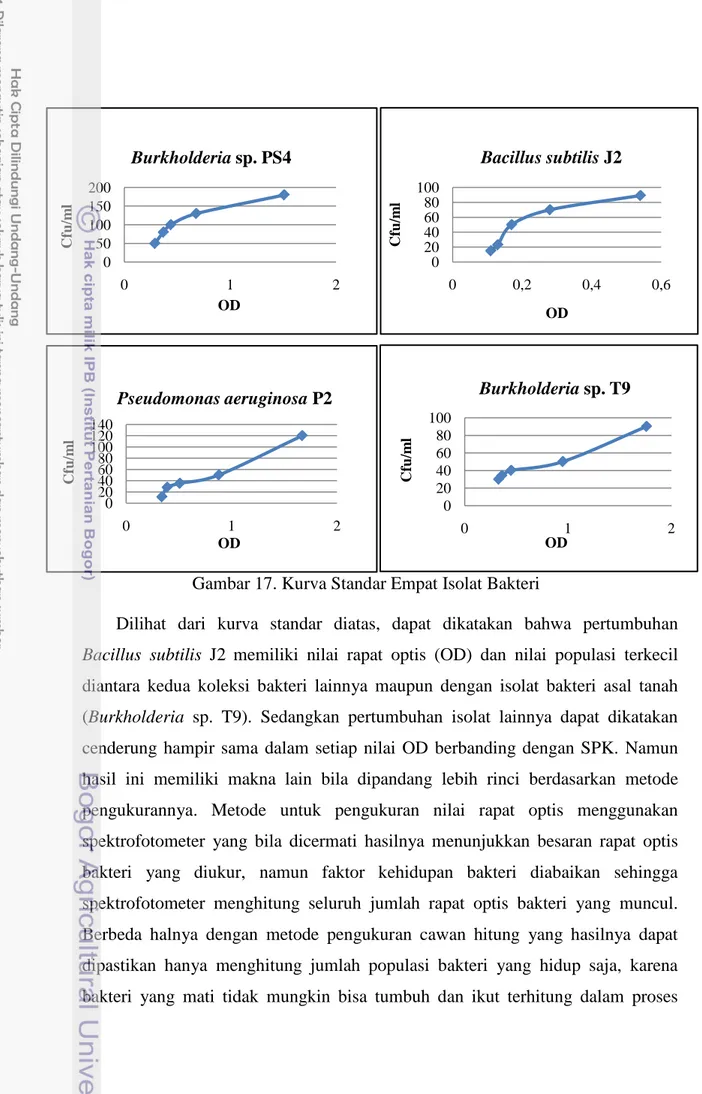
Keempat isolat bakteri yaitu satu isolat bakteri asal tanah (Burkholderia sp. T9) dan 3 isolat bakteri koleksi CV. Meori Agro (Burkholderia sp. PS4, Bacillus subtilis J2 dan Pseudomonas aeruginosa P2) diamati pertumbuhan populasinya (Gambar 17). Hal ini dilakukan untuk memudahkan teknik inokulasi pada percobaan selanjutnya. Kurva ini menyatakan hubungan antara nilai rapat optis suspensi mikrob dengan populasi bakteri, yang dinyatakan dengan satuan pembentuk koloni (SPK) yang ditentukan dengan cawan hitung, sehingga didapatkan persamaan Y=a+bx, dimana Y= Jumlah populasi dalam cawan petri dan X= nilai rapat optis suspensi mikrob. Inokulasi mikrob untuk percobaan selanjutnya dapat menggunakan persamaan tersebut sehingga dapat diperoleh jumlah sel mikrob yang sama.
Dilihat dari kurva standar diatas, dapat dikatakan bahwa pertumbuhan Bacillus subtilis J2 memiliki nilai rapat optis (OD) dan nilai populasi terkecil diantara kedua koleksi bakteri lainnya maupun dengan isolat bakteri asal tanah (Burkholderia sp. T9). Sedangkan pertumbuhan isolat lainnya dapat dikatakan cenderung hampir sama dalam setiap nilai OD berbanding dengan SPK. Namun hasil ini memiliki makna lain bila dipandang lebih rinci berdasarkan metode pengukurannya. Metode untuk pengukuran nilai rapat optis menggunakan spektrofotometer yang bila dicermati hasilnya menunjukkan besaran rapat optis bakteri yang diukur, namun faktor kehidupan bakteri diabaikan sehingga spektrofotometer menghitung seluruh jumlah rapat optis bakteri yang muncul. Berbeda halnya dengan metode pengukuran cawan hitung yang hasilnya dapat dipastikan hanya menghitung jumlah populasi bakteri yang hidup saja, karena bakteri yang mati tidak mungkin bisa tumbuh dan ikut terhitung dalam proses
Gambar 17. Kurva Standar Empat Isolat Bakteri
0 50 100 150 200 0 1 2 C fu /ml OD Burkholderia sp. PS4 0 20 40 60 80 100 0 0,2 0,4 0,6 C fu /ml OD Bacillus subtilis J2 0 20 40 60 80 100 120 140 0 1 2 C fu /ml OD Pseudomonas aeruginosa P2 0 20 40 60 80 100 0 1 2 C fu /ml OD Burkholderia sp. T9
pengukuran populasi. Dengan kata lain, masa hidup optimal Bacillus subtilis J2 berlangsung lebih singkat dibandingkan tiga isolat bakteri lainnya, karena setelah diukur dengan menggunakan spektrofotomer menunjukkan hasil rapat optis yang tinggi, namun ketika diuji dengan metode cawan hitung hasil populasinya menunjukkan bahwa Bacillus subtilis J2 tidak serapat hasil perhitungan spektrofotometer.
4.6. Uji Antagonis Isolat bakteri
Pengujian antagonis keempat isolat bakteri yaitu satu isolat bakteri asal tanah (Burkholderia sp. T9) dan 3 isolat bakteri koleksi CV. Meori Agro (Burkholderia sp. PS4, Bacillus subtilis J2 dan Pseudomonas aeruginosa P2) dilakukan dengan metode silang pada cawan petri. Pada Gambar 18 dapat dilihat pengujian antagonis antara 2 isolat bakteri, 3 isolat bakteri dan 4 isolat bakteri berbeda jenis yang ditumbuhkan dalam satu cawan petri. Hasil dari pengujian ini menunjukkan bahwa tidak terjadi aktivitas penghambatan dari pertumbuhan masing-masing bakteri. Hal ini berarti bahwa jika isolat bakteri ditumbuhkan bersamaan dalam satu media maka masing-masing isolat bakteri akan tetap tumbuh dan tidak saling menghambat. Hasil pertumbuhan dari setiap isolat bakteri yang ditumbuhan bersamaan dalam satu media baik 2, 3, dan 4 isolat bakteri berbeda menunjukkan hasil pertumbuhan yang sama dengan pertumbuhan setiap bakteri secara tunggal dalam media.
4.2. Penelitian Secara In Vivo
Penelitian secara in vivo dilakukan di rumah kaca. Sawi sendok ditumbuhkan pada media tumbuh berupa tanah dan pupuk kandang kemudian diberikan penambahan isolat bakteri secara tunggal maupun kombinasi serta variasi dosis pupuk SP-36 kemudian dilihat pertumbuhannya sesuai dengan peubah yang diamati yaitu jumlah daun, tinggi tanaman dan lebar daun setiap minggu selama 5 minggu. Hasil pengamatan yang ditampilkan selanjutnya berdasarkan minggu ke-5 setelah tanam yang dianggap mewakili seluruh perlakuan penelitian.
Gambar 18. Pengujian Antagonis dari 2, 3 dan 4 Isolat Bakteri Pada Cawan Petri Keterangan:
(a) Burkholderia sp. PS4 (b) Bacillus subtilis J2;
(c) Pseudomonas aeruginosa P2; (d) Burkholderia sp. T9;
(e) Antagonis 2 dan 3 jenis isolat bakteri; (f) Antagonis 2 dan 4 jenis isolat bakteri
a b c d
a. Jumlah Daun Tanaman Sawi sendok
Hasil pengamatan jumlah daun tanaman sawi sendok pada minggu ke-5 ditunjukkan pada Tabel 6 di bawah ini :
Tabel 6. Pengaruh pemberian isolat bakteri dan variasi dosis pupuk terhadap jumlah daun (helai/tanaman) pada minggu ke-5 setelah tanam (MST)
Kombinasi Bakteri
Dosis Pemupukan Fosfat (kg/ha)
Rata-rata 50 75 100 Kontrol 6,6 6,0 6,6 6,4 Bacillus subtilis J2 6,3 7,0 6,3 6,5 Pseudomonas aeruginosa P2 7,3 6,6 6,6 6,8 Burkholderia sp. PS4 7,6 6,3 7,6 7,2 Burkholderia sp. T9 7,3 6,3 6,6 6,7 J2+P2 4,3 5,6 8,3 6,1 J2+PS4 7,0 6,3 6,0 6,4 J2+T9 6,3 5,3 6,3 6,0 P2+PS4 8,0 8,0 6,6 7,5 P2+T9 5,5 6,6 5,5 5,5 PS4+T9 7,3 7,3 6,6 6,4 J2+P2+PS4 8,0 7,0 7,0 7,3 J2+P2+T9 6,3 8,0 6,0 6,7 P2+PS4+T9 6,0 7,6 5,6 7,1 J2+PS4+T9 6,0 6,0 7,0 6,3 P2+J2+PS4+T9 6,0 5,6 7,0 6,2 Rata-rata 6,6 6,5 6,6
Pada minggu ke-5 kombinasi bakteri P2+PS4 meningkatkan rata-rata jumlah daun pada tanaman sawi sendok paling besar dibandingkan kontrol yaitu sebesar 17,18% dari rata-rata 6,4 helai/tanaman menjadi 7,5 helai/tanaman. Sedangkan Gambar 19. Pertumbuhan Tanaman Sawi sendok Pada 3 Minggu Setelah Tanam
rata-rata jumlah daun paling kecil ditunjukkan oleh kombinasi bakteri P2+T9 yaitu sebesar 5,5 helai/tanaman. Efektivitas BPF dalam melarutkan unsur P yang terikat sangat berkaitan erat dengan cara beradaptasi dari BPF dengan lingkungannya. Dikemukakan oleh Subba Rao (1982), bahwa lingkungan yang baik dan cocok untuk jenis BPF tertentu akan meningkatkan aktivitasnya dalam mengeluarkan asam-asam organik, enzim dan hormon-hormon tumbuh untuk melarutkan unsur P tanah. Pada tahap perlakuan pupuk SP-36 minggu ke-5 semua perlakuan pupuk memberikan hasil yang relatif sama terhadap rata-rata jumlah daun yaitu antara 6,5 – 6,6 helai/tanaman.
b. Tinggi Tanaman Sawi Sendok
Hasil pengamatan tinggi tanaman sawi sendok pada minggu ke-5 ditunjukkan pada Tabel 7 di bawah ini :
Tabel 7. Pengaruh pemberian isolat bakteri dan variasi dosis pupuk terhadap tinggi tanaman (cm/tanaman) pada minggu ke 5 setelah tanam (MST).
*angka-angka yang diikuti oleh huruf yang sama dalam satu baris menunjukkan perbedaan yang tidak nyata menurut DMRT 5%
Hasil pengamatan pada minggu 5 menunjukkan bahwa rata-rata tinggi tanaman sawi sendok paling besar diperlihatkan oleh kontrol sebesar 27,7 cm/tanaman. Sedangkan pada minggu ke-5 perlakuan pupuk 100% dapat memberikan pengaruh yang lebih baik sebesar 7,23% terhadap rata-rata tinggi tanaman dibandingkan
Kombinasi Bakteri
Pemupukan Fosfat (kg/ha)
Rata-rata 50 75 100 Kontrol 29,0 28,0 26,2 27,7 Bacillus subtilis J2 23,5 23,6 23,3 23,5 Pseudomonas aeruginosa P2 28,3 22,0 25,0 25,1 Burkholderia sp. PS4 30,6 21,3 23,4 25,1 Burkholderia sp. T9 27,5 22,6 26,7 25,6 J2+P2 18,6 28,3 30,3 24,2 J2+PS4 27,5 18,1 25,8 23,8 J2+T9 21,9 21,5 25,8 23,0 P2+PS4 28,0 22,6 24,3 25,0 P2+T9 25,1 16,8 19,0 20,3 PS4+T9 16,5 25,3 24,6 22,1 J2+P2+PS4 24,8 19,1 29,1 24,3 J2+P2+T9 23,5 18,0 22,5 21,3 P2+PS4+T9 28,3 23,1 20,6 24,0 J2+PS4+T9 22,7 17,6 27,6 22,6 P2+J2+PS4+T9 21,0 20,1 29,0 23,3 Rata-rata 21,8B 23,5B 25,2A
dengan perlakuan pupuk 75% dan sebesar 15,59% dibandingkan dengan perlakuan pupuk 50% . Buntan (1992) menjelaskan fosfor merupakan bahan makanan utama yang digunakan oleh semua organisme untuk energi dan pertumbuhan diantaranya untuk pertumbuhan sel, pembentukan akar halus dan rambut akar, dan memperkuat tegakan batang agar tanaman tidak mudah rebah.
c. Lebar Daun Tanaman Sawi Sendok
Hasil pengamatan lebar daun sawi sendok pada minggu ke-5 ditunjukkan pada Tabel 8 di bawah ini :
Tabel 8. Pengaruh pemberian isolat bakteri dan variasi dosis pupuk terhadap lebar daun (cm/tanaman) pada minggu ke-5 setelah tanam (MST).
Kombinasi Bakteri
Pemupukan Fosfat (kg/ha)
Rata-rata
50 75 100
Kontrol 7,0 abcB 5,7 abcB 6,0 abcA 6,2
Bacillus subtilis J2 5,8 abcB 6,4 abcB 5.,5 abcA 5,9
Pseudomonas aeruginosa P2
4,8 abcB 6,5 abcB 5,1 abcA 5,4
Burkholderia sp. PS4 5,9 aB 7,0 aB 6,7 aA 6,5
Burkholderia sp. T9 5,4 abcB 6,4 abcB 6,1 abcA 5,9 J2+P2 4,9 abcB 3,3 abcB 8,0 abcA 5,4 J2+PS4 3,6 abcB 6,7 abcB 6,3 abcA 5,5 J2+T9 4,9 abcB 4,3 abcB 5,9 abcA 5,0 P2+PS4 4,6 abcB 6,7 abcB 5,4 abcA 5,5 P2+T9 4,3 cB 5,2 cB 4,3 cA 4,6 PS4+T9 5,9 cB 3,4 cB 4,8 cA 4,7 J2+P2+PS4 4,8 abcB 5,5 abcB 7,2 abcA 5,8 J2+P2+T9 4,0 abcB 5,4 abcB 5,8 abcA 5,1 P2+PS4+T9 6,2 abB 6,6 abB 6,4abA 6,4 J2+PS4+T9 3,9 bcB 4,2 bcB 6,2bcA 4,8 P2+J2+PS4+T9 4,6 abcB 4,6 abcB 6,7 abcA 5,6
Rata-rata 5,0 5,5 6,1
*angka-angka yang diikuti oleh huruf kecil yang sama dalam satu kolom dan huruf besar yang sama dalam satu baris menunjukkan perbedaan yang tidak nyata menurut DMRT 5%
Hasil interaksi perlakuan bakteri dan dosis pemupukan paling baik pada minggu 5 dalam mempengaruhi lebar daun tanaman sawi sendok diperlihatkan oleh perlakuan Burkholderia sp. PS4 dengan dosis pemupukan 75 kg/ha yaitu sebesar 7,0 cm/tanaman atau lebih baik dari perlakuan kontrol sebesar 0,22%.
Menurut Wijaya (2008) pada tanaman yang kekurangan P pertumbuhan luas daun akan terhambat, karena terjadi penurunan tekanan hidrolik akar,
menghambat pembelahan sel dan pembesaran sel. Terhambatnya pertumbuhan disebabkan oleh sintesis karbohidrat yang tidak berjalan secara optimal. P juga berperan dalam pelebaran daun sehingga dengan daun yang lebar, maka akan semakin banyak cahaya yang diserap, dengan begitu akan mempengaruhi kelangsungan proses fotosintesis.
Penggabungan beberapa jenis bakteri dengan dosis yang sama, diasumsikan juga akan mengakibatkan terjadi persaingan antar bakteri dalam memenuhi kebutuhan energinya. Bakteri yang digabungkan terkadang dapat bersifat patogen terhadap bakteri lain, sehingga bakteri yang lemah akan mati dan total populasinya akan semakin menurun. Husen (2004) melaporkan bahwa, interaksi beberapa bakteri yang hidup pada wadah yang sama terkadang ada yang bersifat patogen, yang dapat menurunkan populasi bakteri yang lain. Hal ini akan sangat mempengaruhi kemampuan bakteri tersebut dalam meningkatkan pertumbuhan tanaman. Bakteri dengan total populasi yang lebih besar akan lebih dominan pengaruhnya terhadap pertumbuhan tanaman.
d. Berat Basah Tanaman Sawi Sendok
Hasil perlakuan bakteri yang paling baik dalam mempengaruhi rata-rata berat basah tanaman sawi sendok diperlihatkan oleh perlakuan Burkholderia sp. PS4 sebesar 18,3 gram/tanaman. Pada perlakuan variasi dosis pupuk 50% dan 75% menunjukkan hasil yang tidak berbeda nyata. Tetapi perlakuan pupuk 100% lebih tinggi dalam mempengaruhi berat basah tanaman sawi sendok dibandingkan dengan perlakuan pupuk 50% dan 75%. Sehingga dapat dikatakan bahwa perlakuan pupuk 100% berpengaruh paling baik pada berat basah tanaman sawi sendok.
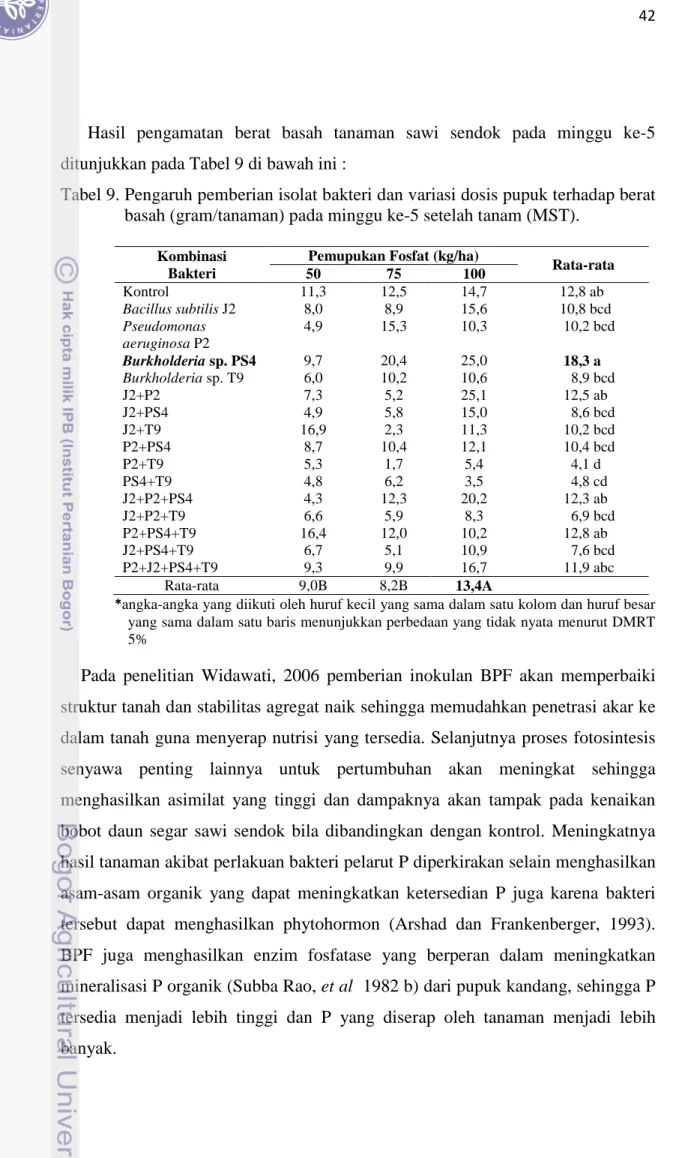
Hasil pengamatan berat basah tanaman sawi sendok pada minggu ke-5 ditunjukkan pada Tabel 9 di bawah ini :
Tabel 9. Pengaruh pemberian isolat bakteri dan variasi dosis pupuk terhadap berat basah (gram/tanaman) pada minggu ke-5 setelah tanam (MST).
Kombinasi Bakteri
Pemupukan Fosfat (kg/ha)
Rata-rata 50 75 100 Kontrol 11,3 12,5 14,7 12,8 ab Bacillus subtilis J2 8,0 8,9 15,6 10,8 bcd Pseudomonas aeruginosa P2 4,9 15,3 10,3 10,2 bcd Burkholderia sp. PS4 9,7 20,4 25,0 18,3 a Burkholderia sp. T9 6,0 10,2 10,6 8,9 bcd J2+P2 7,3 5,2 25,1 12,5 ab J2+PS4 4,9 5,8 15,0 8,6 bcd J2+T9 16,9 2,3 11,3 10,2 bcd P2+PS4 8,7 10,4 12,1 10,4 bcd P2+T9 5,3 1,7 5,4 4,1 d PS4+T9 4,8 6,2 3,5 4,8 cd J2+P2+PS4 4,3 12,3 20,2 12,3 ab J2+P2+T9 6,6 5,9 8,3 6,9 bcd P2+PS4+T9 16,4 12,0 10,2 12,8 ab J2+PS4+T9 6,7 5,1 10,9 7,6 bcd P2+J2+PS4+T9 9,3 9,9 16,7 11,9 abc Rata-rata 9,0B 8,2B 13,4A
*angka-angka yang diikuti oleh huruf kecil yang sama dalam satu kolom dan huruf besar yang sama dalam satu baris menunjukkan perbedaan yang tidak nyata menurut DMRT 5%
Pada penelitian Widawati, 2006 pemberian inokulan BPF akan memperbaiki struktur tanah dan stabilitas agregat naik sehingga memudahkan penetrasi akar ke dalam tanah guna menyerap nutrisi yang tersedia. Selanjutnya proses fotosintesis senyawa penting lainnya untuk pertumbuhan akan meningkat sehingga menghasilkan asimilat yang tinggi dan dampaknya akan tampak pada kenaikan bobot daun segar sawi sendok bila dibandingkan dengan kontrol. Meningkatnya hasil tanaman akibat perlakuan bakteri pelarut P diperkirakan selain menghasilkan asam-asam organik yang dapat meningkatkan ketersedian P juga karena bakteri tersebut dapat menghasilkan phytohormon (Arshad dan Frankenberger, 1993). BPF juga menghasilkan enzim fosfatase yang berperan dalam meningkatkan mineralisasi P organik (Subba Rao, et al 1982 b) dari pupuk kandang, sehingga P tersedia menjadi lebih tinggi dan P yang diserap oleh tanaman menjadi lebih banyak.
*angka-angka yang diikuti oleh huruf kecil yang sama dalam satu kolom dan huruf besar yang sama dalam satu baris menunjukkan perbedaan yang tidak nyata menurut DMRT 5%
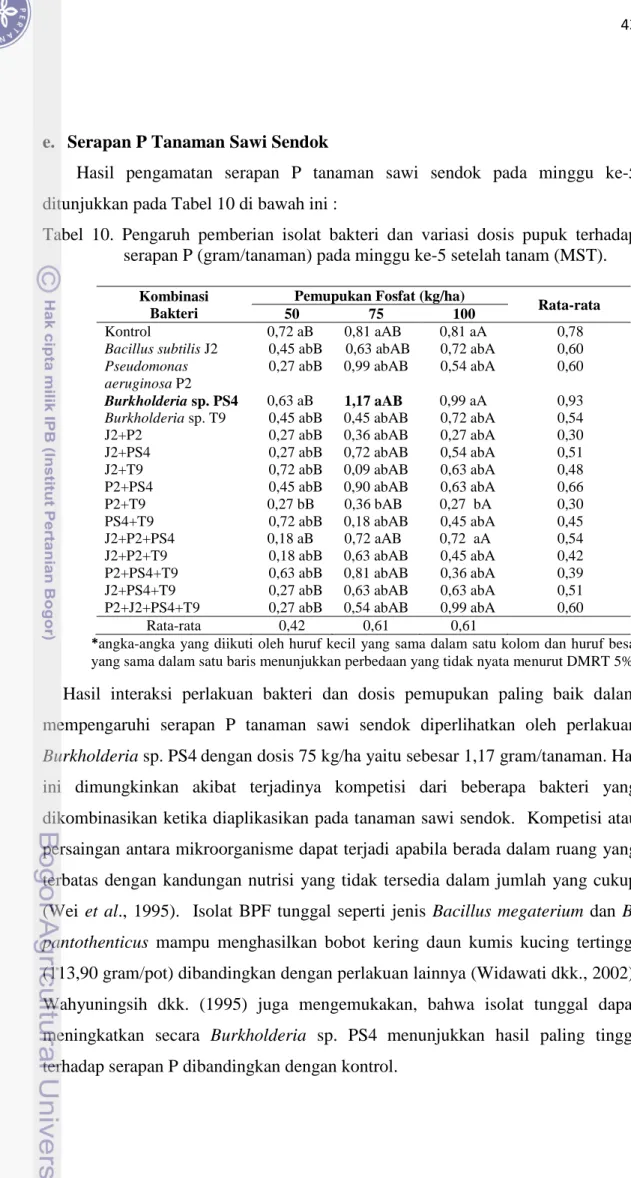
e. Serapan P Tanaman Sawi Sendok
Hasil pengamatan serapan P tanaman sawi sendok pada minggu ke-5 ditunjukkan pada Tabel 10 di bawah ini :
Tabel 10. Pengaruh pemberian isolat bakteri dan variasi dosis pupuk terhadap serapan P (gram/tanaman) pada minggu ke-5 setelah tanam (MST).
Kombinasi Bakteri
Pemupukan Fosfat (kg/ha)
Rata-rata
50 75 100
Kontrol 0,72 aB 0,81 aAB 0,81 aA 0,78
Bacillus subtilis J2 0,45 abB 0,63 abAB 0,72 abA 0,60
Pseudomonas aeruginosa P2
0,27 abB 0,99 abAB 0,54 abA 0,60
Burkholderia sp. PS4 0,63 aB 1,17 aAB 0,99 aA 0,93
Burkholderia sp. T9 0,45 abB 0,45 abAB 0,72 abA 0,54 J2+P2 0,27 abB 0,36 abAB 0,27 abA 0,30 J2+PS4 0,27 abB 0,72 abAB 0,54 abA 0,51 J2+T9 0,72 abB 0,09 abAB 0,63 abA 0,48 P2+PS4 0,45 abB 0,90 abAB 0,63 abA 0,66 P2+T9 0,27 bB 0,36 bAB 0,27 bA 0,30 PS4+T9 0,72 abB 0,18 abAB 0,45 abA 0,45 J2+P2+PS4 0,18 aB 0,72 aAB 0,72 aA 0,54 J2+P2+T9 0,18 abB 0,63 abAB 0,45 abA 0,42 P2+PS4+T9 0,63 abB 0,81 abAB 0,36 abA 0,39 J2+PS4+T9 0,27 abB 0,63 abAB 0,63 abA 0,51 P2+J2+PS4+T9 0,27 abB 0,54 abAB 0,99 abA 0,60
Rata-rata 0,42 0,61 0,61
Hasil interaksi perlakuan bakteri dan dosis pemupukan paling baik dalam mempengaruhi serapan P tanaman sawi sendok diperlihatkan oleh perlakuan Burkholderia sp. PS4dengan dosis 75 kg/ha yaitu sebesar 1,17 gram/tanaman. Hal ini dimungkinkan akibat terjadinya kompetisi dari beberapa bakteri yang dikombinasikan ketika diaplikasikan pada tanaman sawi sendok. Kompetisi atau persaingan antara mikroorganisme dapat terjadi apabila berada dalam ruang yang terbatas dengan kandungan nutrisi yang tidak tersedia dalam jumlah yang cukup (Wei et al., 1995). Isolat BPF tunggal seperti jenis Bacillus megaterium dan B. pantothenticus mampu menghasilkan bobot kering daun kumis kucing tertinggi (113,90 gram/pot) dibandingkan dengan perlakuan lainnya (Widawati dkk., 2002).
Wahyuningsih dkk. (1995) juga mengemukakan, bahwa isolat tunggal dapat meningkatkan secara Burkholderia sp. PS4 menunjukkan hasil paling tinggi terhadap serapan P dibandingkan dengan kontrol.
*angka-angka yang diikuti oleh huruf kecil yang sama dalam satu kolom dan huruf besar yang sama dalam satu baris menunjukkan perbedaan yang tidak nyata menurut DMRT 5%
Bakteri yang berasal dari tanah yaitu Burkholderia sp. T9 pada penelitian secara in vitro menunjukkan hasil paling baik dalam pelarutan fosfat dibandingkan dengan tiga isolat bakteri koleksi. Tetapi pada penelitian secara in vivo kemampuan Burkholderia sp. T9 dalam melarutkan fosfat yang terikat menjadi menurun. Hal ini disebabkan adanya mikrob indigenus yang berasal dari media tanam yang tidak dapat hidup bersinergis Burkholderia sp. T9 sehingga kemampuannya dalam melarutkan fosfat menurun. Sedangkan tiga isolat bakteri koleksi memiliki keunggulan dalam pengaplikasiannya pada media tanam yaitu diisolasi sebagai antagonis terhadap penyakit sehingga lebih mampu mengatasi mikrob indigenus.
f. Analisis P Dalam Jaringan Tanaman
Hasil pengamatan P dalam jaringan tanaman sawi sendok pada minggu ke-5 ditunjukkan pada Tabel 11 di bawah ini :
Tabel 11. Pengaruh pemberian isolat bakteri dan variasi dosis pupuk terhadap P dalam jaringan (%) pada minggu ke-5 setelah tanam (MST).
Kombinasi Bakteri
Pemupukan Fosfat (kg/ha)
Rata-rata
50 75 100
Kontrol 1,5 abcdB 1,4 abcdB 1,2 abcdA 1,4
Bacillus subtilis J2 0,8 bcdB 0,8 bcdB 1,3 bcdA 1,0
Pseudomonas aeruginosa P2
0,5 bcdB 1,8 bcdB 1,0 bcdA 1,1
Burkholderia sp. PS4 1,3 abcB 1,9abcB 1,5 abcA 1,5
Burkholderia sp. T9 1,1 bcdB 1,1 bcdB 1,4 bcdA 1,2 J2+P2 0,8 abB 0,6 abB 3,5 abA 1,6
J2+PS4 0,6 bcdB 1,4 bcdB 1,3 bcdA 1,1
J2+T9 1,5 bcdB 0,2 bcdB 1,3 bcdA 1,0
P2+PS4 1,0 abcdB 1,7 abcdB 1,4 abcdA 1,3 P2+T9 0,5 dB 0,7 dB 0,6 dA 0,6 PS4+T9 0,7 dB 0,4 dB 0,8 dA 0,7 J2+P2+PS4 1,0 abcdB 0,7 abcdB 2,1 abcdA 1,3 J2+P2+T9 0,4 bcdB 1,3 bcdB 0,9 bcdA 0,9 P2+PS4+T9 1,3 aB 1,5 aB 3,3 aA 2,0 J2+PS4+T9 0,5 bcdB 0,5 bcdB 1,3 bcdA 0,8 P2+J2+PS4+T9 0,6 bcdB 0,6 bcdB 1,8 bcdA 1,0
Hasil interaksi perlakuan bakteri dan dosis pemupukan paling baik dalam mempengaruhi P dalam jaringan tanaman sawi sendok diperlihatkan oleh perlakuan kombinasi bakteri bakteri P2+PS4+T9 dengan dosis 100 kg/ha yaitu sebesar 3,3%. Han dan Lee (2005) melaporkan bahwa mikrob tanah seperti bakteri Pseudomonas sp. dan Bacillus sp. dapat mengeluarkan asam-asam organik seperti asam formiat, asetat, dan laktat yang bersifat dapat melarutkan bentuk-bentuk sukar larut. Asam-asam organik yang dikeluarkan oleh bakteri ini dapat membentuk khelat (kompleks stabil) dengan kation-kation pengikat P di alam tanah seperti Al3+ dan Fe3+. Khelat tersebut dapat menurunkan reaktivitas ion-ion tersebut sehingga menyebabkan pelarutan fosfat yang efektif sehingga dapat diserap oleh tanaman.
g. Analisis P Dalam Tanah
Hasil pengamatan P tanah pada minggu ke-5 ditunjukkan pada Tabel 12 di bawah ini :
Tabel 12. Pengaruh pemberian isolat bakteri dan variasi dosis pupuk terhadap P dalam tanah (ppm) pada minggu ke-5 setelah tanam (MST).
Kombinasi Bakteri
Pemupukan Fosfat (kg/ha)
Rata-rata
50 75 100
Kontrol 6,0 ghC 7,5 ghB 6,8 ghA 6,8
Bacillus subtilis J2 10,4 cdefC 8,9 cdefB 11,6 cdefA 10,3
Pseudomonas aeruginosa P2
6,8 ghC 7,7 ghB 7,8 ghA 7,4
Burkholderia sp. PS4 7,2 fghC 9,8 fghB 8,1 fghA 8,4
Burkholderia sp. T9 4,6 hC 5,7 hB 8,4 hA 6,2 J2+P2 6,9 defC 15,1 defB 8,6 defA 10,2 J2+PS4 8,8 cdefC 14,9 cdefB 7,5 cdefA 10,4 J2+T9 6,8 abcC 5,5 abcB 26,7 abcA 13,0 P2+PS4 6,7 efghC 9,1 efghB 10,3 efghA 8,7 P2+T9 12,3 aC 13,0 aB 20,7 aA 15,3 PS4+T9 5,9 efgC 10,5 efgB 10,6 efgA 9,0 J2+P2+PS4 13,2 bcdeC 8,1 bcdeB 12,6 bcdeA 11,3 J2+P2+T9 13,7 abC 12,6 abB 14,0 abA 13,4 P2+PS4+T9 5,9 efghC 9,6 efghB 10,4 efghA 8,6 J2+PS4+T9 8,1 abcdC 12,0 abcdB 18,3 abcdA 12,8 P2+J2+PS4+T9 10,1 bcdC 15,8 bcdB 11,3 bcdA 12,4
Rata-rata 8,3 10,4 12,1
*angka-angka yang diikuti oleh huruf kecil yang sama dalam satu kolom dan huruf besar yang sama dalam satu baris menunjukkan perbedaan yang tidak nyata menurut DMRT 5%
Hasil interaksi perlakuan bakteri dan dosis pemupukan paling baik dalam mempengaruhi P dalam tanah diperlihatkan oleh perlakuan kombinasi bakteri P2+T9 dengan dosis 100 kg/ha yaitu sebesar 20,7 ppm. Aktivitas pelarut fosfat oleh bakteri tetap tergantung pada lingkungannya, seperti jenis vegetasi, kelembaban, suhu, aerasi, dan reaksi tanah (Supriyo et al., 1992). Taha (1969) mengemukakan bahwa faktor kimia dan fisik tanah, serta vegetasi, rotasi tanaman dan kondisi lingkungan sangat mempengaruhi keberadaan bakteri. Terjadinya hal tersebut memang tidak terlepas dari fungsi timbal balik antara tanaman dan mikrob tanah indigenus dan yang terkandung dalam inokulan yang diinokulasikan pada tanaman. Menurut Hakim et al., (1986) unsur fosfor sangat penting karena terlibat langsung hampir pada seluruh proses kehidupan, oleh karena itu unsur P diperlukan dalam peningkatan produksi pertanian.