LAPORAN PRAKTIKUM KIMIA ANORGANIK ACARA I
PEMBUATAN DAN PENGENCERAN LARUTAN SERTA REAKSI ASAM BASA
Disusun oleh:
Nikmatul Khoeriyah A1M013006
Elmas Tahira A1M013015
Dewi Rizqiyati A1M013024
Hesti Sabriani A1M013061
Qothrotul Himmah R A1M013047
Ahmad Hanif F A1M013053
Arista Savira R A1M013058
KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN UNIVERSITAS JENDERAL SOEDIRMAN
FAKULTAS PERTANIAN ILMU DAN TEKNOLOGI PANGAN
BAB I PENDAHULUAN
A. Latar Belakang
Hampir semua materi kimia berkaitan dengan larutan. Larutan adalah salah satu aspek kajian ilmu kimia. Larutan campuran zat-zat yang homogen yang memiliki komposisi merata atau serba sama diseluruh bagian volumenya. Suatu larutan mengandung satu zat terlarut atau lebih dari satu pelarut. Zat terlarut merupakan komponen yang jumlahnya sedikit, seadangkan pelarut adalah komponen yang terdapat dalam jumlah yang banyak .
Dalam ilmu kimia, pengertian larutan ini sangat penting karena hampir semua reaksi kimia terjadi dalam bentuk larutan. Larutan dapat didefinisikan sebagai campuran serba sama dari dua komponen atau lebih yang saling berdiri sendiri. Disebut campuran karena terdapat molekul-molekul, atom-atom atau ion-ion dari dua zat atau lebih.
Larutan dikatakan homogen apabila campuran zat tersebut komponen-komponen penyusunnya tidak dapat dibedakan satu dengan yang lainnya lagi. Misalnya larutan gula dengan air dimana kita tidak dapat lagi melihat dari bentuk gulanya, hal ini karena larutan sudah tercampur secara homogen. Dalam pembuatan larutan dengan konsentrasi tertentu sering dihasilkan konsentrasi yang tidak tepat dengan yang diinginkan, untuk itu diperlukan praktikum dan pada praktikum acara ini akan dilaksanakan acara pembuatan larutan NaOH, H2SO4, serta pengencerannya.
Dalam pembuatan larutan tidak boleh dilakukan sembarangan. Jika salah sedikit, praktikum akan menimbulkan bahaya untuk praktikan. Salah satu aspek penting dalam pembuatan larutan adalah kosentrasi larutan. Konsentrasi dalam suatu larutan didefinisikan sebagai jumlah solute yang ada dalam sejumlah larutan atau pelarut. Konsentrasi dapat dinyatakan dalam beberapa cara. Antara lain molaritas, molalitas, normalitas dan sebagainya.
B. Tujuan
Tujuan percobaan praktikum ini yaitu:
BAB II
TINJAUAN PUSTAKA
Larutan didefinisikan sebagai zat homogen yang merupakan campuran dari dua komponen atau lebih, yang dapat berupa gas, cairan, atau padatan. Larutan gas dibuat dengan mencampurkan satu gas dalam gas lainnya. Larutan cairan dibuat dengan melarutkan gas, cairan, atau padatan dalam suatu cairan. Larutan padatan adalah padatan-padatan dalam mana satu komponen terdistribusi tak beraturan pada atom atau molekul dari komponen lainnya (Sastrohamidjojo, 2001).
Komposisi dan sifat fase suatu larutan berbeda dengan air murni. Larutan merupakan campuran yang terdiri dari dua bahan. Larutan terbagi menjadi larutan homogen dan larutan heterogen. Larutan homogen mempunyai sifat-sifat yang sama diseluruh cairan, sedangkan larutan heterogen merupakan campuran dua fase dan memiliki sifat-sifat yang tidak seragam (Achmadi, 2004).
Larutan adalah campuran molekul (atom atau ion dalam beberapa hal), biasanya molekul-molekul pelarut agak berjauhan dalam larutan dibanding dalam pelarut murni. Sehingga pembentukan larutan dapat dibuat sebagai suatu proses hipotesis berikut: pertama, jarak antara molekul-molekul meningkat menjadi jarak rata-rata yang ditampilkan dalam larutan. Tahap ini memerlukan penyerapan energi untuk melampaui gaya-gaya intermolekul kohesi. Tahap ini disertai dengan peningkatan entalpi, reaksinya adalah endoterm. Dalam tahap endoterm kedua, pemisahan yang sama terhadap molekul-molekul terlarut terjadi. Tahap ketiga dan terakhir adalah membiarkan molekul-molekul pelarut dan terlarut untuk bercampur. Gaya tarik intermolekul diantara molekul tak sejenis menyebabkan pelepasan energi, entalpi menurun dalam tahap ini (Achmadi,2004).
Untuk menentukan sifat pelarut suatu senyawa dapat diketahui dari perubahan temperatur air sebelum dan sesudah. Bila temperaturnya naik, pelarut tersebut bersifat eksoterm. Sedangkan jika temperaturnya turun, maka pelarutnya bersifat endoterm (Schaum,1998).
Unsur terpenting yang menentukan keadaan bahan dalam larutan adalah pelarut. Komponen yang jumlahnya lebih sedikit dinamakan zat terlarut. Larutan yang menggunakan air sebagai pelarut dinamakan larutan dalam air atau aqueous. Larutan yang mengandung zat terlarut dalam jumlah banyak dinamakan larutan pekat. Jika jumlah zat terlarut sedikit, larutan tersebut dinamakan larutan encer. Istilah larutan biasanya mengandung arti pelarut cair dengan cairan, padatan, atau gas sebagai zat terlarut. Larutan dapat pula berbentuk padat dan gas. Karena molekul-molekul gas terpisah jauh, molekul-molekul dalam campuran gas berbaur secara acak, semua campuran gas adalah larutan (Achmadi,2004).
Dalam larutan padat, pelarutnya adalah zat padat. Kemampuan membentuk larutan padat sering terdapat pada logam dan larutan padat ini dinamakan alloy. Dalam larutan padat tertentu, atom terlarut menggantikan beberapa atom pelarut dalam kisi kristal. Larutan ini dinamakan larutan substitusional, yang ukuran atom pelarut dan terlarutnya kira-kira sama. Dalam larutan padat lain atom terlarut dapat mengisi kisi atau lubang dalam kisi-kisi pelarut. Pembentukan larutan padat interstisial terjadi apabila atom terlarut cukup kecil untuk memasuki lubang-lubang diantara atom-atom pelarut (Achmadi,2004).
Konsentrasi larutan merupakan cara untuk menyatakan hubungan kuantitatif antara zat terlarut dan pelarut. Konsentrasi merupakan jumlah zat tiap satuan volume (besaran intensif), larutan encer berupa julah zat terlarut sangat sedikit, dan larutan pekat adalah jumlah zat terlarut sangat banyak. Cara menyatakan konsentrasi antara lain bisa dengan molar, molal, persen, fraksi mol, bagian persejuta (ppm), dan lain-lain. Untuk bagian persejuta (ppm) adalah massa komponen larutan (g) per 1 juta gram larutan. Untuk pelarut air, 1 ppm setara dengan 1 mg/liter, sedangkan persen berat, menyatakan jumlah gram berat zat terlarut dalam larutan 100 gram (Ratna,2009).
satuan volume disebut persen volume/volume. Masih ada kemungkinan lain yaitu campuran satuan massa dan volume. Misalnya jika zat terlarut diukur berdasarkan massa dan kuantitas larutan berdasarkan volume, dapat digunakan istilah persen massa/volume. Jika konsentrasi larutan diberikan berdasarkan persen tanpa penjelasan lebih lanjut mengenai massa/massa, volume/volume, massa/volume, maka yang dimaksud adalah persen massa (Achmadi,2004).
Pada konsentrasi molar (Molaritas), dicatat bahwa:
1. Stoikiometri reaksi kimia didasarkan pada jumlah nisbi atom, ion, atau molekul yang bereaksi. 2. Banyak reaksi kimia yang dilakukan dalam larutan. Karena alasan ini konsentrasi dinyatakan
berdasarkan jumlah partikel terlarut, atau konsentrasi molar (Achmadi,2004).
Konsentrasi dari suatu larutan menunjukkan berapa banyak jumlah suatu zat terlarut dalam larutan tersebut. Nilai dari konsentrasi suatu larutan dapat dinyatakan dalam beberapa satuan, antara lain: molaritas, normalitas, persen berat, persen volume, fraksi mol, bagian per sejuta (ppm). Molaritas menyatakan banyaknya jumlah mol suatu zat terlarut per liter satuan, sedangkan normalitas menyatakan jumlah ekuivalen zat terlarut yang ada dalam setiap liter larutan. Persen berat menyatakan banyaknya zat terlarut (dalam satuan gram). Molaritas, normalitas, persen berat, persen volume dapat dinyatakan seperti:
1. Molaritas
Pada peristiwa pengenceran jumlah mol zat terlarut tetap sehingga berlaku rumus: V1 . M1 = V2 . M2
Keterangan:
V1 = Volume sebelum pengenceran V2 = Volume setelah pengenceran M1 = Molaritas sebelum pengenceran
Persen volume menyatakan jumlah liter zat terlarut dalam 100 liter larutan. 4. Persen Berat
BAB III
Ditimbang labu takar 50 ml kosong ( a garam ), dan diisi labu takar 50 ml dengan aquades sampai kira-kira 3/4nya, dan ditimbangnya ( b gram, kemudian diukur suhunya (t1) ).
Ditimbang gelas ukur kosong ( c gram ), diisi 1ml H2SO4 pekat ke dalam gelas ukur dan ditimbangnya ( d gram ) dan di ukur volumenya, serta diukur suhu dengan termometer ( t2 )
Dituangkan H2SO4 pekat secara pelan-pelan dan hati-hati ke dalam labu takar, dituangkan 50 ml aquades ke dalam labu takar, lalu dikocok agar homogen, menimbang larutan H2SO4 yang terjadi ( e gram ) kemudian
2. Pembuatan Larutan NaOH
Ditentukan sifat pelarutnya asam sulfat dan konsentrasinya dalam satuan % ( w/w ), % ( v/v ), molalitas, molaritas, PPM dan fraksi mol.
Ditimbang 2 butir ( kurang lebih 0,3 gram ) NaOH dan diarutkan dalam gelas piala dengan sedikit air.
Dirasakan larutan apakah merasa lebih panas, tetap atau lebih dingin dari sebelumnya
Dipindahkan larutan tersebut kedalam labu takar 50 ml. Dibilas gelas piala dengan aquades
Diencerkan dan ditempatkan sampai tanda tera,dikocok supaya homogen
3. Pengenceran Larutan H2SO4
Diambil 5 ml larutan H2SO4 yang telah dibuat pada prosedur A menggunakan pipet, dimasukannya ke dalam labu takar 50 ml.
BAB IV
HASIL DAN PEMBAHASAN A. Hasil Pengamatan
Pembuatan Larutan H2SO4
No. Bahan yang ditimbang Berat Suhu
Pembuatan Larutan NaOH
No. Bahan yang ditimbang Berat
1. 2 butir NaOH
Pelarut NaOH 0,3 gr1 gr
2 Gelas Piala
H2SO4 (pekat) + H2O(l) H2O (l) + H2SO4 (encer)
B. Pembahasan
Dalam praktikum ini, ada tiga percobaan yang dilakukan. Percobaan 1 adalah pembuatan H2SO4. Percobaan 2 adalah pembuatan NaOH. Sedangkan percobaan 3 adalah pengenceran H2SO4. Berikut ini adalah uraian dari ketiga percobaan.
Sebelum H2SO4 dibuat, labu ukur 50 ml kosong ditimbang terlebih dahulu dandidapatkan beratnya 37,5 gram. Selanjutnya, labu diisi air ¾ bagian, ditimbang dan didapatkan beratnya 73,5 gram. Labu berisi air diukur suhunya dan didapatkan suhu larutan 320 C. Setelah itu, gelas ukur kosong diambil, ditimbang, dan didapatkan berat 46,3 gram. Gelas tersebut diisi 1 ml H2SO4, ditimbang, dan didapat berat 48, 3 gram. Suhu larutan tersebut yaitu 390 C ketika diukur dengan termometer. Terakhir, larutan H2SO4 ditambahkan akuades hingga batas tera (volume larutan 50 ml), ditimbang dan didapatkan beratnya 85, 2 gram dengan suhu 370 C.
Ketika kosentrasi dihitung, didapatkan molaritas H2SO4 0,408 M, sedangkan molalitas H2SO4 0,445 m. Di sisi lain, % H2SO4 dalam larutan (w/w) sebanyak 4,184 %, sedangkan %pelarutnya 95, 815 %. Dalam satuan v/v, % H2SO4 dalam larutan sebanyak 2 %, dan % pelarutnya 98%. Kemudian, larutan dihitung ppmnya dan didapat ppm larutan H2SO4 yaitu 0,418 x10-6 ppm. Setelah itu, fraksi mol dihitung. Fraksi mol H2SO4 adalah 0,0078, sedangkan fraksi mol air yaitu 0,9922.
H2SO4 merupakan asam kuat, cairannya tidak berwarna dan dapat bercampur dalam semua perbandingan. Asam sulfat mempunyai banyak kegunaan dan merupakan salah satu produk utama industri kimia. Kegunaan utamanya termasuk pemrosesan bijih mineral, sintesis kimia, pemrosesan air limbah dan pengilangan minyak. Pembuatan larutan H2SO4 merupakan penggunaan dari prinsip pengenceran larutan. Reaksi yang terjadi :
Asam sulfat pekat dapat bertindak sebagai dehidrator. Dehidrator adalah suatu kemampuan menarik air dari suatu senyawa yang mengandung atom-atom H dan O. Sebagai contoh asam sulfat yang ditambahkan ke dalam alkohol primer, akan membentuk alkena jika direaksikan pada 1800 C.
Adapun sifat fisika dan kimia yaitu
Keadaan fisik dan penampilan: Cairan. (Cairan berminyak tebal.) Bau: berbau, namun memiliki bau tersedak ketika panas.
Rasa: rasa asam Ditandai. (Strong.) Berat Molekul: 98,08 g / mol Warna: tak berwarna.
pH (1% soln / air): Asam.
Titik Didih: 270 ° C (518 ° F) - 340 deg. C terurai pada 340 deg. C
Melting Point: -35 ° C (-31 ° F) menjadi 10,36 deg. C (93% sampai 100% kemurnian) Spesifik Gravity: 1,84 (Air = 1)
Densitas Uap: 3.4 (Air = 1)
Properti Dispersi: Lihat kelarutan dalam air.
Kelarutan: Mudah larut dalam air dingin. Sulfat larut dalam air dengan pembebasan banyak panas. Larut dalam etil alkohol.
Pembuatan NaOH diawali dengan menimbang 2 butir NaOH Kristal dan mendapat berat sebanyak 0,3 gram. Kemudian, gelas piala 50 ml kosong ditimbang, didapatkan beratnya 47,6, dan dimasukan NaOH kristal didalamnya. Lalu, gelas piala dimasukan sedikit air, ditimbng kembali, serta didapat beratnya 47,6 gram. Ketika dipegang larutan terasa hangat. Selanjutnya, larutan dipindahkan ke labu takar 50 ml, diisi aquades sampai batas tera, sedangkan gelas piala dibilas aquades.
Ketika dihitung, molaritas NaOH yaitu 0,15 M. dalam satuan w/v, %NaOH dalam larutan sebanyak 0,6 %, sedangkan %aquades sebanyak 2 %. Selanjutnya, % larutan tersebut yaitu 2,6 %.
Natrium hidroksida dikenal sebagai soda kaustik atau sodium hidroksida, adalah sejenis basa logam kaustik. Natrium Hidroksida terbentuk dari oksida basa. Natrium hidroksida membentuk larutan alkalin yang kuat ketika dilarutkan ke dalam air. Ia digunakan di berbagai macam bidang industri, kebanyakan digunakan sebagai basa dalam proses produksi bubur kayu dan kertas, tekstil, air minum, sabun dan deterjen. Natrium hidroksida adalah basa yang paling umum digunakan dalam laboratorium kimia.
Natrium hidroksida murni berbentuk putih padat dan tersedia dalam bentuk pelet, serpihan, butiran ataupun larutan jenuh 50%. Ia bersifat lembap cair dan secara spontan menyerap karbon dioksida dari udara bebas. Ia sangat larut dalam air dan akan melepaskan panas ketika dilarutkan. Ia juga larut dalam etanol dan metanol, walaupun kelarutan NaOH dalam kedua cairan ini lebih kecil daripada kelarutan KOH. Ia tidak larut dalam dietil eter dan pelarut non-polar lainnya. Larutan natrium hidroksida akan meninggalkan noda kuning pada kain dan kertas.
Adapun sifat fisika dan kimia NaOh yaitu :
Keadaan fisik dan penampilan: Solid. (Deliquescent padat.) Bau: berbau.
Molekul Berat: 40 g / mol Warna: Putih.
pH (1% soln / air): [. Dasar] 13,5 Titik Didih: 1388 ° C (2530,4 ° F) Melting Point: 323 ° C (613,4 ° F) Spesifik Gravity: 2.13 (Air = 1)
Properti Dispersi: Lihat kelarutan dalam air. Kelarutan: Mudah larut dalam air dingin.
H2SO4 + H2O H3O+ +
HSO4-HSO4- + H2O H3O+ +
SO42-Pengenceran larutan H2SO4 menggunakan larutan H2SO4 yang telah dbuat. Sebelum mengencerkan, kosentrasi larutan harus diketahui terlebih dahulu. Adapun kosentrasi H2SO4 awal yaitu 0,4 M. Setelah itu, 5 ml H2SO4 diambil dengan pipet dan dimasukan ke dalam labu takar 50 ml. Labu tersebut diisi air sampai batas tera serta dikocok supaya homogen. Setelah itu, kosentrasi H2SO4 akhir dihitung dan didapatkan kosentrasinya 0,04 M.
H2SO4 diencerkan terlebih dahulu supaya bahaya yang ditimbulkan ketika larutan digunakan semakin kecil. Hal ini disebabkan asam sulfat mempunyai sifat korosif. Sifat H2SO4 yang korosif akan diperburuk oleh reaksi eksotermik dengan air. Reaksi larutan tersebut dengan air akn menimbulkan percikan. Percikan ini bisa menimbulkan luka bakar pada kulit. Ketika H2SO4 encer dilarutkan dalam air, reaksi yang terjadi hanyalah seperti reaksi asam biasa. Namun, jika H2SO4 pekat dilarutkan dalam air maka akan timbul reaksi redoks.
Korosif adalah sifat kimia sangat reaktif yang dapat menyebabkan kerusakan nyata atau kerusakan permanen pada benda biasanya logam, namun dapat juga terhdap kulit, jaringan, mata dan bagian lain dari tubuh jika terjadi kontak fisik. Karat dan oksidasi elektrokimia adalah bentuk-bentuk korosif yang terjadi pada logam, tetapi ini terjadi pada jangka waktu yang lama.
Asam sulfat adalah bahan yang paling dikenal memiliki sifat korosif kuat. Senyawa asam dan basa lain sebagian besar memiliki sifat korosif terutama asam dan basa kuat, contoh asam adalah Asam klorida (HCl) sedangkan untuk korosif basa adalah natrium hidroksida (NaOH) dan basa alkali lain.
(C6H12O6)n 6n C + 6n H2O
Karena hidrasi asam sulfat secara termodinamika difavoritkan, asam sulfat adalah zat pendehidrasi yang sangat baik dan digunakan untuk mengeringkan buah-buahan. Afinitas asam sulfat terhadap air cukuplah kuat sedemikiannya ia akan memisahkan atom hidrogen dan oksigen dari suatu senyawa. Sebagai contoh, mencampurkan pati (C6H12O6)n dengan asam sulfat pekat akan menghasilkan karbon dan air yang terserap dalam asam sulfat (yang akan mengencerkan asam sulfat):
Efek ini dapat dilihat ketika asam sulfat pekat diteteskan ke permukaan kertas. Selulosa bereaksi dengan asam sulfat dan menghasilkan karbon yang akan terlihat seperti efek pembakaran kertas. Reaksi lain dapat terjadi pada kayu yang akan menghitam/mengarang bila diteteskan asam sufat, pada beberapa jenis kayu dapat membentuk sumur bila diteteskan pada permukaannya. Pada gula pasir efek yang ditimbulkan gula tersebut akan menjadi karbon berpori-pori yang mengembang dan mengeluarkan aroma seperti karamel.
Asam sulfat memang berbahaya bila terkena pada jaringan seperti kulit, efek yang ditimbulkan akibat sifat asam sulfat sebagai senyawa korosif dan penarik air yang kuat dapat menyebabkan kulit seperti terkena luka bakar.
Luka bakar akibat asam sulfat berpotensi lebih buruk daripada luka bakar akibat asam kuat lainnya, hal ini dikarenakan adanya tambahan kerusakan jaringan dikarenakan senyawa H dan O dari jaringan ditarik sebagai H2O (dehidrasi) dan juga akan terjadi kerusakan termal sekunder akibat pelepasan panas oleh reaksi asam sulfat dengan air.
Bahaya akan semakin meningkat seiring dengan meningkatnya konsentrasi asam sulfat. Namun, bahkan asam sulfat encer (sekitar 1 M, 10%) akan dapat mendehidrasi kertas apabila tetesan asam sulfat tersebut dibiarkan dalam waktu yang lama. Oleh karenanya, larutan asam sulfat yang sama atau lebih dari 1,5 M diberi label “CORROSIVE” (korosif), dan larutan lebih besar dari 0,5 M dan lebih kecil dari 1,5 M diberi label “IRRITANT” (iritan).
SO2 + H2O → H2SO4
BAB V
PENUTUP
A. Kesimpulan
Dari percobaan ini dapat disimpulkan sebagai berikut :
1. Pada proses pembuatan larutan H2SO4 dan NaOH tejadi reaksi eksoterm, yaitu perpindahan panas dari sistem ke lingkungan
2. Konsentrasi H2SO4 pekat hasil percobaan adalah 0,408 3. Konsentrasi larutan NaOH dari percobaan adalah 0,15 M 4. Konsentrasi pengenceran larutan adalah 4 x 10-2 M B. Saran
DAFTAR PUSTAKA
Keenan, Charles W, dkk. 1991. Ilmu Kimia Untuk Universitas. Jakarta : Erlangga. Oxtoby. 2001. Prinsip-Prinsip Kimia Modern.Jilid I. Jakarta : Erlangga.
Achmadi, Suminar. 2004. Kimia Dasar. Jakarta : Erlangga.
Brady, J. E. 1999. Kimia Universitas Asas dan Struktur. Jakarta : Bina Rupa Aksara. Sastrojamidjojo, Harjono. 2005. Kimia Dasar. Jakarta : Gajah Mada Press.
Schaum. 1998. Kimia Dasar Seri Schaum. Jakarta : ITB.
LAMPIRAN
Nikmatul Kh. (A1M013006)
- Bab 1 (Latar belakang, tujuan) - Bab 4 (Pembahasan)
Dewi Rizqiyati (A1M013024) - Bab 2 (Tinjauan Pustaka) - Bab 4 (Hasil Pengamatan) - Bab 5 (Saran)
Ahmad Hanif Fajarudin (A1M013053)
LAPORAN PRAKTIKUM KIMIA ANORGANIK ACARA II
STOIKIOMETRI REAKSI
Disusun oleh:
Nikmatul Khoeriyah A1M013006
Elmas Tahira A1M013015
Dewi Rizqiyati A1M013024
Hesti Sabriani A1M013061
Qothrotul Himmah R A1M013047
Ahmad Hanif F A1M013053
Arista Savira R A1M013058
KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN UNIVERSITAS JENDERAL SOEDIRMAN
FAKULTAS PERTANIAN ILMU DAN TEKNOLOGI PANGAN
BAB 1 PENDAHULUAN
A. Latar Belakang
Reaksi kimia biasanya antara dua campuran zat, bukannya antar dua zat murni. Suatu bentuk yang paling lazim dan campuran adalah larutan reaksi kimia tlah mempengaruhi kehidupan kita. Di alam sebagian besar reaksi berlangsung dalam larutan air. Sebagai contoh cairan tubuh kita, tumbuhan maupun hewan, merupak larutan dari berbagai jenis zat. Dalam tanah pun reaksi pada umumya berlangsung dalam lapisan tipis lerutan yang diabsorbsi pada padatan.
Adapun contoh di kehidupan kita sehari-hari yang menggunakan reaksi kimia seperti, makanan yang kita konsumsi setiap saat setelah dicerna diubah menjadi tenaga tubuh. Nitrogen dan hydrogen bergabung membentuk ammonia yang digunakan sebagai pupuk. Bahan bakar dan plastik dihasilkan oleh minyak bumi, pati tanaman dalam daun disintesis dan dan O oleh pengaruh sinar matahari. Pelajaran yang berkaitan dengan reaksi kimia lazim dikenal sebagi “stokiometri”. Stokiometri adalah bagian ilmu kimia yang mempelajar hubungan kunatitatif antara zat yang berkaitan dalam reaksi kimia.
Bila senyawa dicampur untuk bereaksi maka sering tercampur secara kuantitatif stokiometri, artinya semua reaktan habis pada saat yang sama. Namun demikian terdapat suatu reaksi dimana salah satu reaktan habis, sedangkan yang lain masih tersisa. Reaktan yang habis disebut pereaksi pembatas. Dalam setiap persoalan stokiometri, perlu untuk menentukan reaktan yang mana yang terbatas untuk mengetahui jumlah produk yang dihasilkan. Oleh karena itu percobaan ini dilakukan. Diharapkan kita mengerti tentang pereaksi pembatas dan pereaksi sisa.
B. Tujuan
- Menentukan koefisien reaksi berdasarkan pembentukan endapan dan perubahan temperatur.
BAB II
TINJAUAN PUSTAKA
Suatu reaksi kimia adalah proses dimana ikatan atom di dalam molekul-molekul zat-zat yang bereaksi dipecahkan, diikuti oleh penyusunan kembali dari atom-atom tersebut dalam kombinasi molekul baru. Dengan perkataan lain, timbul zat kimia baru dan yang lama hilang, tetapi atom atomnya tetap sama. (Harijono.1987:103)
Reaksi kimia secara umum dapat dibagi menjadi 2 kelompok besar, yaitu reaksi asam-basa dan reaksi redoks. Secara garis besar, terdapat perbedaan yang mendasar antara kedua jenis reaksi tersebut, yaitu pada reaksi redoks terjadi perubahan bilangan oksidasi (biloks), sedangkan pada reaksi asam-basa tidak ada perubahan biloks. Kedua kelompok reaksi kimia ini dapat dikelompokkan ke dalam 4 tipe reaksi: Sintesis, Dekomposisi, Penggantian Tunggal, dan Penggantian Ganda.(Yusuf.2011)
Stoikiometri berasal dari kata yunani, stoicheion (unsure) dan mettrein (mengukur), berarti mengukur unsur. Pengertian unsur-unsur dalam hal ini adalah partikel-partikel atom, ion, molekul atau electron yang terdapat dalam unsur atau senyawa yang terlibat dalam reaksi kimia. Stoikiometri yang menyangkut cara untuk menimbang dan menghitung spesi-spesi kimia atau dengan kata lain, stoikiometri adalah kajian tentang hubungan-hubungan kuantitatif dalam reaksi kimia.(Achmad.1996:2)
Stoikiometri reaksi adalah penentuan perbandingan massa unsur-unsur dalam senyawa dalam pembentukan senyawanya. Pada perhitungan kimia secara stoikiometri, biasanya diperlukan hukum-hukum dasar ilmu kimia.(Brady,1986)
Hukum kimia adalah hukum alam yang relevan dengan bidang kimia. Konsep paling fundamental dalam kimia adalah hukum konservasi massa, yang menyatakan bahwa tidak terjadi perubahan kuantitas materi sewaktu reaksi kimia biasa. (Hiskia,1991)
Menurut (Syabatini, 2008) Hukum-hukum dasar ilmu kimia adalah sebagai berikut: a) Hukum Boyle
Boyle menemukan bahwa udara dapat dimanfaatkan dan dapat berkembang bila dipanaskan. Akhirya ia menemukan hukum yang kemudian terkenal sebagai hukum Boyle:” bila suhu tetap, volume gas dalam ruangan tertutup berbanding terbalik dengan tekananya”
P1.V1 = P2.V2
b) Hukum Lavoiser disebut juga Hukum Kekekalan Massa
Hukum kekekalan massa atau dikenal juga sebagai hukum Lomonosov-Lavoisier adalah suatu hukum yang menyatakan massa dari suatu sistem tertutup akan konstan meskipun terjadi berbagai macam proses di dalam sistem tertutup. Massa zat sebelum dan sesudah reaksi adalah sama (tetap/konstan). Pernyataan yang umum digunakan untuk menyatakan hukum kekekalan massa adalah massa dapat berubah bentuk tetapi tidak dapat diciptakan atau dimusnahkan. Untuk suatu proses kimiawi di dalam suatu sistem tertutup, massa dari reaktan harus sama dengan massa produk. Pada beberapa peristiwa radiasi, dikatakan bahwa terlihat adanya perubahan massa menjadi energi. Hal ini terjadi ketika suatu benda berubah menjadi energi kinetik/energi potensial dan sebaliknya. Karena massa dan energi berhubungan, dalam suatu sistem yang mendapat/mengeluarkan energi, massa dalam jumlah yang sangat sedikit akan tercipta/hilang dari sistem. Namun demikian, dalam hampir seluruh peristiwa yang melibatkan perubahan energi, hukum kekekalan massa dapat digunakan karena massa yang berubah sangatlah sedikit.
c) Hukum Perbandingan Tetap (H.Proust)
Dalam kimia, hukum perbandingan tetap atau hukum Proust (diambil dari nama kimiawan Perancis Joseph Proust) adalah hukum yang menyatakan bahwa suatu senyawa kimia terdiri dari unsur-unsur dengan perbandingan massa yang selalu tepat sama. Dengan kata lain, setiap sampel suatu senyawa memiliki komposisi unsur-unsur yang tetap.
“Perbandingan massa unsur-unsur dalam suatu persenyawaan kimia selalu tetap.”
d) Hukum Gay Lussac
Menyatakan bahwa volume gas nyata apapun sangat kecil dibandingkan dengan volume yang ditempatinya. Bila anggapan ini benar, volume gas sebanding dengan jumlah molekul gas dalam ruang tersebut. Jadi, massa relatif yakni massa molekul atau massa atom gas, dengan mudah didapat.
“Dalam suatu reaksi kimia gas yang diukur pada P dan T yang sama volumenya berbanding lurus dengan koefisien reaksi atau mol, dan berbanding lurus sebagai bilangan bulat dan sederhana.”
e) Hukum Boyle – Gay Lussac
"Bagi suatu kuantitas dari suatu gas ideal (yakni kuantitas menurut beratnya) hasil kali dari volume dan tekanannya dibagi dengan temperatur mutlaknya adalah konstan". Untuk n1 = n2, maka P1.V1 / T1 = P2.V2 / T2
f) Hukum Dalton disebut juga Hukum Kelipatan Perbandingan
“Jika dua unsur dapat membentuk satu atau lebih senyawa, maka perbandingan massa dari unsur yang satu yang bersenyawa dengan jumlah unsur lain yang tertentu massanya akan merupakan bilangan mudah dan tetap.”
g) Hukum Avogadro
“Gas-gas yang memiliki volum yang sama, pada temperatur dan tekanan yang sama, memiliki jumlah partikel yang sama pula.”
h) Hukum Gas Ideal PV = nRT
Persamaan ini dikenal dengan julukan hukum gas ideal alias persamaan keadaan gas ideal.
Keterangan :
P = tekanan gas (N/m2) R = konstanta gas universal (R = 8,315 J/mol.K) V = volume gas (m3) T = suhu mutlak gas (K)
\
Campuran tersebut dibiarkan agar endapan yang terbentuk berada di dasar gelas beker.
Tinggi endapan yang terbentuk diukur menggunakan mistar (agar akurat diterapkan satuan mili-meter)
Lakukan cara yang sama dengan langkah 1-3 seperti diatas untuk percobaan berikut, dengan mengubah volume pereaksi masing-masing tetapi volume total
tetap 30ml, yaitu:
- 10 ml NaOH 0,1 M dan 20 ml CuSO4 0,1 M
- 15 ml NaOH 0,1 M dan 15 ml CuSO4 0,1 M
- 20 ml NaOH 0,1 M dan 20 ml CuSO4 0,1 M
]
\\
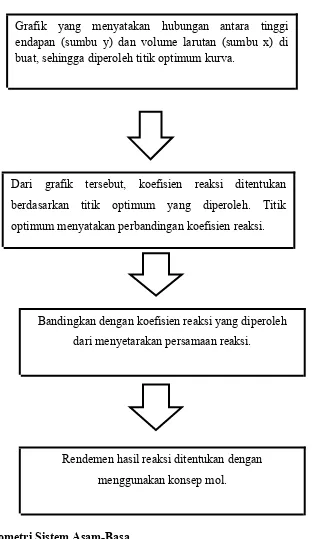
2. Stoikiometri Sistem Asam-Basa
Grafik yang menyatakan hubungan antara tinggi endapan (sumbu y) dan volume larutan (sumbu x) di buat, sehingga diperoleh titik optimum kurva.
Dari grafik tersebut, koefisien reaksi ditentukan berdasarkan titik optimum yang diperoleh. Titik optimum menyatakan perbandingan koefisien reaksi.
Bandingkan dengan koefisien reaksi yang diperoleh dari menyetarakan persamaan reaksi.
Rendemen hasil reaksi ditentukan dengan menggunakan konsep mol.
\
Kedua campuran tersebut dicampur hingga volume total 30ml, temperatur campuran diukur dan suhu maksimum
yang konstan (Ta) dicatat.
Lakukan cara yang sama untuk percobaan berikut dengan mengubah volume pereaksi masing-masing hingga volume
total campuran adalah 30ml, yaitu :
- 10ml NaOH 1,0 M dan 20ml HCl 1,0 M
- 15ml NaOH 1,0 M dan 15ml HCl 1,0 M
- 20ml NaOH 1,0 M dan 10ml HCl 1,0 M
- 25ml NaOH 1,0 M dan 5ml HCl 1,0 M
Dibuat grafik yang menyatakan hubungan antara perubahan temperatur (sumbu y) dan volume asam/basa (sumbu x)
Koefisien reaksi ditentukan berdasarkan titik optimum yang diperoleh dari grafik diatas. Titik optimum
Dibandingkan dengan koefisien reaksi yang diperoleh dari menyetarakan persamaan reaksi
5 10 15 20 25 0
2 4 6 8 10 12 14
5 10 15 20 25
0 0.5 1 1.5 2 2.5 3 3.5
Grafk warna stoikiometri pengendapan
Volume NaOH
w
a
rn
5 10 15 20 25
Stoikiometri adalah perhitungan kimia yang menyangkut hubungan kuantitatif zat yang terlibat dalam reaksi. Reaksi stoikiometri adalah suatu reaksi kimia dimana pereaksi dalam reaksi tersebur habis bereaksi, sehingga tidak ada mol sisa dalam pereaksi atau tidak ada pereaksi pembatas. Dala suatu reaksi juga terdapat reaksi eksoterm dan endoterm. Reaksi eksoterm apabila kalor berpindah dari system ke lingkungan sehingga suhu disekitar larutan menjadi panas sedangkan reaksi endoterm adalah apabila kalor berpindah dari lingkungan ke sisitem, sehingga suhu system menjadi lebih dingin.
Apabila suatu larutan berbeda dicampurkan biasanya terjadi perubahan sifat fisik, seperti perubahan warna, suhu, bentuk, dan lain – lain. Dalam parktikum ini yang dibahas adalah perubahan suhu. Suhu terendah dari suatu campuran disebut titik minimum sedangkan suhu tertinggi dari suatu campuran disebut titik maksimum. Biasanya titik maksimum didapat apabila reaksi tersebut adalah stoikiometri.
Reaksi pembatas adalah prediksi yang habis lebih dahulu apabila zat-zat yang direaksikan tidak ekuivalen, maka salah satu prediksi yang lain bersisa jumlah reaksi bergantung pada jumlah pereaksi yang habis terlebih dahulu. Reaksi sisa merupakan reaktan yang tidak habis bereaksi dan masih bersisa.
Hubungan antara suhu dan reaksi stoikiometri adalah suhu akan mencapai titik maksimum atau nilai maksimum bila reaksi tersebut adalah reaksi stoikiometri.
Karakteristik HCl antara lain HCl sangat larut dalam pelarut air dengan membentuk larutan asam kuat. HCl adalah asam monoprotik, yang berarti bahwa ia dapat berdisosiasi melepaskan satu H+¿¿ hanya sekali. Dalam larutan asam klorida H+¿¿ bergabung dengan
molekul air membentuk ion hidronium, H3O+¿¿.
Karakteristik NaOH antara lain NaOH membentuk larutan alkalin yang kuat ketika dilarutkan ke dalam air. NaOH murni berbentuk putih padat, serpihan, bentuk pelet, butiran ataupun larutan jenuh 50%. Ia bersifat lembab cair dan secara spontan menyerap
karbondioksida dari udara bebas. Ia sangat larut dalam air dan akan melepaskan panas ketika dilarutkan.
Karakteristik CuSO4: warna tembaga (II) sulfat berwarna biru berasal dari hidrasi air
ketika tembaga (II) sulfat dipanaskan dengan air, maka kristalnya akan terdehidrasi dan berubah warana menjadi hijau abu-abu. Tembaga (II) sulfat bereaksi dengan HCl, CuSO4yang
warnanya biru akan berubah menjadi hijau karena pembentukan tetraklorokuprat (II). Pada reaksi 2NaOH + CuSO4Na2SO4 + Cu(OH¿2 , anion SO42−¿¿ bergabung dengan
suatu unsur membentuk garam, maka sebagian besar garam yang berbentuk berupa garam yang larut. Termasuk ketika anion sulfat bereaksi dengan Na. Sementara hidroksida (OH−¿ ¿) hanya larut dalam air hanya jika ia ada dalam bentuk LiOH , NaOH, KOH, Ba(OH¿2, Ca(OH
¿2, dan Sr(OH¿2. Sehingga ketika OH−¿ ¿ bereaksi dengan Cu membentuk Cu(OH¿2 akan
terbentuk senyawa yang tidak larut dalam air (mengendap). Jadi endapan yang terbentuk dari reaksi NaOH dan CuSO4 adalah Cu(OH¿2. Dalam percobaan, Cu(OH¿2 berbentuk endapan
berwarna gelap (hitam kebiruan) yang teksturnya lembek seperti lumpur. Sementara larutannya berwarna biru kehijauan. Warna tersebut, didapat dari CuSO4 yang memang
Warna endapan berbeda-beda tergantung pada volume NaOH yang dilarutkan, semakin banyak NaOH yang terlarut warnanya semakin gelap. Endapan 20ml NaOH + 10ml CuSO4
benar-benar menghasilkan endapan tertinggi sesuai literatur.
Pada percobaan pertama, yaitu stoikiometri sistem NaOH dengan CuSO4. Pertama-tama
NaOH dicampur dengan larutan CuSO4. Setelah kedua larutan dicampurkan, diamati
perubahan warna dan tinggi endapan yang terbentuk. Pencampuran larutan-larutan selalu menghasilkan volumeyang sama 30ml.
Pada saat larutan 5ml NaOH 0,1M dicampurkan dengan 25ml CuSO4 0,1M, terjadi
endapan setinggi 1mm dengan warna endapan biru muda. Pada saat mencampurkan 10ml NaOH 0,1M dengan 20ml CuSO4 0,1M , terjadi endapan setinggi 3mm, dengan warna biru
muda juga. Ketika 0,1M NaOH sebanyak 15ml dicampurkan dengan 15ml NaOH 0,1M, dihasilkan endapan 4mm, dengan warna biru muda. Pada saat 20ml NaOH 0,1M dicampurkan 10ml, terjadi endapan setinggi 12cm dengan warna hitam, sedangkan 25ml NaOH 0,1M dicampurkan 5ml CuSO4 0,1M dihasilkan endapan setinggi 5mm, dengan warna hitam.
Dari hasil yang diperoleh maka dapat diketahui jika semakin banyak volume NaOH yang dicampurkan akan akan menghasilkan warna yang semakin gelap. Sebaliknya, jika volume NaOH yang dicampurkan semakin sedikit warna endapan/larutan semakin bening atau cerah. Ditambah lagi, semakin banyak volume NaOH yang dicampur, semakin tinggi endapannya. Namun, ketinggian tersebut terus naik sampai mencapai titik optimum.
Pada percobaan kedua, yaitu stoikiometri sistem NaOH 1M dengan HCl 1M. Pertama-tama NaOH dicampur dengan larutan HCl. Setelah larutan dicampur, diamati perubahan suhu campuran larutan.
Pada saat larutan 5ml NaOH 1M dicampur dengan 25ml HCl 1M, suhu larutan yang terjadi 31℃ , ketika 10ml NaOH 1M dicampur 20ml HCl 1M , suhu larutan 33℃. Kemudian, 15ml NaOH 1M dicampur 15ml HCl 1M, suhu larutan 33℃. Ketika 20ml NaOH 1M
dicampur 10ml HCl 1M dihasilkan larutan bersuhu 31℃. Sedangkan yang terakhir ketika 5ml NaOH 1M+25ml HCl 1M dihasilkan larutan dengan suhu 31℃.
BAB V PENUTUP
A. Kesimpulan
Perubahan suhu, warna dan endapan (wujud) dapat terjadi jika 2 zat dicampurkan.
Pada stoikiometri system perubahan temperature dipengaruhi oleh besarnya volume campuran. Dan pada stoikiometri asam basa perubahan suhu tidak dipengaruhi oleh volume.
Reaksi stokiometri adalah reaksi yang pereaksinya habis bereaksi membentuk hasil reaksi/produk.
B. Saran
DAFTAR PUSTAKA
Ahmad, Hiskia. 1985. Kimia Dasar (modul 1-5). Jakarta : UT
Syabatini, Annisa. 2008. Hukum-hukum Stoikiometri.Jakarta:Erlangga
Brady, J.E dan Humiston. 1986. General Chemistry. New York: John Willey and Sons. Djojodiharjo,Harijono.1987.Termodinamika Teknik Aplikasi dan
Termodinamika Statistik.Jakarta:PT. Gramedia
Luscua,Achmad.1996.Stoikiometri Energitika Kimia.Bandung:PT Citra Aditya Bakti Sutrisno.1986.Materi Pokok Fisika.Jakarta:Karvaika
Yusuf.2011. Stoikiometri.Jakarta:PT.Gramedia Syukri,S. 1999. Kimia Dasar 1. Bandung: ITB
LAMPIRAN
Elmas Tahira (A1M013015)
- Bab 1 (Latar belakang, tujuan) - Bab 2 (Tinjauan Pustaka)
- Bab 3 (Alat Bahan, Prosedur Kerja)
Arista Savira R (A1M013058)
LAPORAN PRAKTIKUM KIMIA ANORGANIK ACARA IV
STANDARISASI LARUTAN NaOH 0,1 M SERTA PENGGUNAANNYA DALAM PENETAPAN KADAR ASAM CUKA PERDAGANGAN
Disusun oleh:
Nikmatul Khoeriyah A1M013006
Elmas Tahira A1M013015
Dewi Rizqiyati A1M013024
Hesti Sabriani A1M013061
Qothrotul Himmah R A1M013047
Ahmad Hanif F A1M013053
Arista Savira R A1M013058
KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN UNIVERSITAS JENDERAL SOEDIRMAN
FAKULTAS PERTANIAN ILMU DAN TEKNOLOGI PANGAN
BAB I PENDAHULUAN
A. Latar Belakang
Asidimetri dan Alkalimetri adalah analisis kuantitatif volumetri berdasarkan reaksi netralisasi. Keduanya dibedakan pada larutan standarnya. Analisis tersebut dilakukan dengan cara titrasi. Pada titrasi asam asetat dengan NaOH (sebagai larutan standar) akan dihasilkan garam yang berasal dari asam dan basa kuat. Garam natrium ini akan terurai sempurna karena senyawa itu adalah garam, sedang asam asetat akan terhidrolisis oleh air.
Ion asetat akan terhidrolisis oleh molekul air, menghasilkan molekul asam asetat dan ion hidroksi. Oleh karena itu, larutan garam dari basa kuat dan asam lemah seperti natrium asetat, akan bersifat basa dalam air (pH>7). Apabila garam tersusun dari basa lemah dan asam kuat, larutan garamnya akan bersifat asam (pH<7) sedangkan garam ang tersusun dari asam dan basa kuat, larutan dalam air akan bersifat netral (pH=7).
Pada analisis asam asetat dalam cuka perdagangan akan diperoleh informasi apakah kadar yang tertulis sudah benar atau belum. Analisis dilakukan dengan menitrasi larutan asam asetat perdagangan dengan larutan NaOH standar.
Larutan asam dan basa dapat kita temukan di dalam kehidupan sehari-hari. Manfaat dari kedua larutan tersebut dapat dipakai secara optimal apabila digunakan dalam kadar yang cukup. Perolehan larutan serta kadarnya dapat dilakukan dengan reaksi kimia contohnya titrasi. Maka dari itu, praktikum ini sangat dianjurkan untuk dilakukan agar penggunaan larutan asam maupun basa dapat berdampak baik bagi kehidupan.
B. Tujuan
BAB II
TINJAUAN PUSTAKA
Larutan didefinisikan sebagai campuran homogen antara dua atau lebih zat yang terdispersi baik sebagai molekul, atom maupun ion yang komposisinya dapatbervariasi. Larutan dapat berupa gas, cairan atau padatan. Larutan encer adalah larutan yang mengandung sejumlah kecil solute, relatif terhadap jumlah pelarut.Sedangkan larutan pekat adalah larutan yang mengandung sebagian besar solute.Solute adalah zat terlarut, sedangkan solvent (pelarut) adalah medium dalam manasolute terlarut. Pada umumnya zat yang digunakan sebagai pelarut adalah air, selainair yang berfungsi sebagai pelarut adalah alkohol amoniak, kloroform, benzena,minyak, asam asetat (Syabatini,2007).
Ada dua komponen yang penting dalam suatu larutan, yaitu pelarut dan zatyang dilarutkan dalam pelarut tersebut, zat yang dilarutkan itu disebut zat terlarut.Apabila dua atau lebih komponen dicampurkan dan membentuk campuran homogen,larutan yang dihasilkan dapat berfase gas, larutan cair dan padat. Kosentrasi larutanmenyatakan banyaknya zat terlarut dalam suatu larutan. Apabila zat terlarut banyak sekali, sedangkan pelarutnya sedikit, maka dapat dikatakan bahwa larutan itu pekatatau kosentrasinya sangat tinggi. Sebaliknya bila zat yang terlarut sedikit sedangkanpelarutrnya sangat banyak, maka dapat dikatakan larutan itu encer atau kosentrasinyasangat rendah (Agustian,2008).
titrasi. Ketelitian dalam penentuan titik akhir titrasi sangat mempengaruhi hasil analisis pada suatu senyawa (Shochichah,2010).
Titrasi adalah proses mengukur volume larutan yang terdapat dalam buret yangditambahkan ke dalam larutan lain yang diketahui volumenya sampai terjadi reaksi sempurna. Atau dengan perkataan lain untuk mengukur volume titran yangdiperlukan untuk mencapai titik ekivalen. Titik ekivalen adalah saat yangmenunjukkan bahwa ekivalen perekasi-pereaksi sama. Di dalam prakteknya titik ekivalen sukar diamati, karena hanya meruapakan titik akhir teoritis atau titik akhirstoikometri. Hal ini diatasi dengan pemberian indikator asam-basa yang membantusehingga titik akhir titrasi dapat diketahui. Titik akhir titrasi meruapakan keadaan dimana penambahan satu tetes zat penitrasi (titran) akan menyebabkan perubahanwarna indikator. Kadua cara di atas termasuk analisis titrimetri atau volumetrik.Selama bertahun-tahun istilah analisis volumetrik lebih sering digunakan dari padatitrimetrik. Akan tetatpi, dilihat dari segi yang kita, “titrimetrik” lebih baik, karena
BAB III
METODE PRAKTIKUM
A. Alat dan Bahan 1. Alat
Labu ukur 100 ml
Buret 50 ml
Erlenmeyer
Pipet ukur 2. Bahan
Asam oksalat
Larutan NaOH
Asam cuka perdagangan
Indikator P.P
B. Cara kerja
1. Penentuan molaritas NaOH
Ditimbang 1,26 g asam oksalat, dimasukan ke dalam labu ukur 100 ml dan ditambah dengan airsuling hingga volume tepet 100 ml
Satu buret disiapkan dan di cuci, diisi larutan asam oksalat yang telah disiapkan.
Dituang 10 ml larutan NaOH ke dalam erlenmeyer, ditambah 10 ml air suling dalam 1-2 tetes indikator P.P
2. Penetapan Kadar Asam cuka perdagangan Titrasi dilakukan 3kali
Diambil 10 ml larutan asam cuka perdagangan dengan pipet ukur, kemudian dimasukan dalam labu ukur kapasitas 100 ml dan diencerkan hingga volume 100 ml
Diambil 10 ml larutan encer, dimasukan ke dalam erlenmeyer ukuran 125 ml dan di tambah 2 tetes inikator PP
Larutan ini di tritasi dengan larutan NaOH standar hingga terjadi perubahan warna
Titrasi dilakukan 3 kali
BAB IV
Ditambahkan 10 ml aquades Menjadi larutan NaOH
3 Larutan NaOh Ditambahkan indikator PP 2 tetes yang dimasukkan/diteteskan ke dalam erlenmeyer yang berisi
2. Penetapan kadar asam cuka perdagangan
1. Larutan asam
Larutan asam cuka setelah di tetesi PP dan dititrasi berubah menjadi warna merah muda
B. Pembahasan
Pada titrasi larutan NaOH dengan asam oksalat menggunakan indikator Phenoptalein (PP) karena indikator ini akan mengalami perubahan warna apabila telah melewati titik ekuivalen yaitu ang sering disebut dengan titik akhir titrasi dan mempunyai jangkauan pH antara 8,0-9,6 . phenoptalein akan berubah menjadi merah muda ketika larutan mencapai pH sekitar 8,2 atau lebih. Perubahan warna indikatorphenoptalein akan tidak bewarna (bening) jika berada dalam larutan asam dan akan berubah warna menjadi merah muda dalam larutan basa. Sehingga indikator PP adalah indikator yang paling tepat digunakan untuk memperkecil kesalahan pada titrasi larutan NaOH dengan asam oksalat.
Pada praktikum ini saat indikator PP diteteskan pada larutan asam, larutan tetap bening (tidak berwarna menandakan bahwa larutan bersifat asam). Dan saat ditambahkan larutan basa tetes demi tetes terjadi perubahan warna menjadi merah muda, namun tidak lama kemudian mengallami perubahan warna lagi menjadi bening. Hal ini menandakan belum tercapai titik ekuivalen. Baru pada saat volume basa yang diteteskan (dalam hal ini NaOH) terjadi perubahan warna indikator menjadi merah muda sepenuhnya dan inilah yang disebut titik ekuivalen.
Untuk menetralkan NaOH 1 M dibutuhkan 5,6 ml asam oksalat. Reaksi kimia :
2 NaOH + H2C2O4 Na2C2O4 + 2 H2O 0,002 0,01
Ma. 100 = 4. 10 Ma = 40/100 = 0,4
Untuk menganalisis asam cuka dalam cuka perdagangan dapat dilakukan dengan titrasi netralisasi. Titrasi ini merupakan titrasi alkalimetri, proses titrasi dengan larutan standar basa untuk mentitrasi asam bebas. Dalam titrasi ini digunakan buret yang berukuran 25 mL dengan tingkat ketelitian 0,05 mL. Set alat titrasi ditunjukkan pada Gambar 02.
Terlebih dahulu perlu ditentukan perkiraan konsentrasi asam cuka yang akan dititrasi tersebut. Pada label asam cuka yang digunakan tercantum kadar asam cuka 25%. Persen yang
dimaksud adalah persen berat/volum (b/v). Dalam perhitunngan diasumsikan (massa jenis) asam cuka perdagangan tersebut = 1 gram/mL.
Karena dalam titrasi ini, digunakan standar NaOH yang konsentrasinya + 0,1 N sehingga larutan asam cuka ini perlu diencerkan terlebih dahulu agar konsentrasinya menjadi + 0,1 N. Dalam percobaan ini dilakukan 40 kali pengenceran asam cuka (dari volume 25 mL menjadi 1000 mL).
A. Kesimpulan
Berdasarkan praktikum yang telah dilakukan dapat diperoleh kesimpulan :
1. Penentuan molaritas larutan NaOH dengan larutan standar asam oksalat disebut dengan Asidimetri.
2. Molaritas NaOH yang digunakan adalah 0,001 M sedangkan volume asam oksalat yang digunakan untuk titrasi sampai mencapai titik ekuivalen adalah 5,6 ml.
3. Penetapan kadar asam cuka perdagangan disebut Alkalimetri. 4. Molaritas asam cuka sesuai pengenceran yaitu 0,4 M
B. Saran
Berdasarkan praktikum yang telah dilaksanakan sebaiknya mahasiswa mengetahui sekaligus memahami materi yang berkaitan dengan praktikum misalnya rumus titrasi ataupun penyetaraan reaksi sehingga pada saat praktikum tidak menyita waktu. Kedua, sebaiknya pembagian dan koordinasi mengenai praktikum lebih diperhatikan agar semua mahasiswa paham akan praktikum yang dilaksanakan dan dapat mengaplikasikan ke dalam kehidupan dan mengetahui manfaatnya.
Achmad, Hiskia. 2001. Elektrokimia dan Kinetika Kimia. Bamdung: PT. Citra Aditya Bakti.
Agustian. 2008. “ Membuat Larutan
Standar” ,http://www.scribd.com/doc/16383799/ Membuat-Larutan-Standar,Diakses2 Oktober 2011.
Arif. 2008. “Asidimetri”,http://arifqbio.multiply.com/journal/item/7,Diakses2 Oktober2011.
Chang, Raymond. 2007. Chemistry Ninth Edition. New York: Mc Graw Hill.
Mulyono. 2006. Membuat Reagen Kimia di Laboratorium. Jakarta : PT Bumi Aksara. Shochichah. 2010. “Standardisasi Larutan NaOH dan Penentuan Asam
CukaPerdagangan”,http://shochichah.blogspot.com/2010/04/StandardisasiLarutan NaOH dan.html, Diakses 2 Oktober 2011.
Syabatini, Annisa. 2007.”Pembuatan dan Penentuan Konsentrasi Larutan”,http:// annisanfushie.wordpress.com/2008/09/29/74/ , Diakses 2 Oktober 2011.
Pembagian tugas penyusunan Laporan Acara IV Qothrotul Himmah R. (A1M013047)
1. Pendahuluan (Tujuan) 2. Tinjauan Pustaka
3. Metode Praktikum (alat dan bahan, cara kerja) 4. Tabel Hasil Praktikum
Hesti sabriani (A1M013061)
1. Pendahuluan (Latar Belakang)
2. Tabel Hasil Praktikum (Mengisi data hasil praktikum) 3. Pembahasan