commit to user
PERAN N-ACETYLCYSTEINE TERHADAP HEPATOTOKSISITAS
PADA PENDERITA TUBERKULOSIS PARU TERAPI OBAT
ANTITUBERKULOSIS
T E S I S
RUDI SATRIAWAN NIM : S6006003
PROGRAM PENDIDIKAN DOKTER SPESIALIS PULMONOLOGI DAN ILMU KEDOKTERAN RESPIRASI FAKULTAS KEDOKTERAN UNIVERSITAS SEBELAS MARET
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
ii
Penelitian ini dilakukan di bagian Pulmonologi dan Ilmu Kedokteran
Respirasi Fakultas Kedokteran Universitas Sebelas Maret /
Rumah Sakit Umum Daerah Dr. Moewardi Surakarta
Pimpinan : Dr. Eddy Surjanto, dr. SpP(K)
Pembimbing : Prof. Dr. Suradi, dr. SpP(K). MARS
Dr. Reviono, dr. SpP(K)
PENELITIAN INI MILIK
BAGIAN PULMONOLOGI DAN ILMU KEDOKTERAN RESPIRASI
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
iv Syukur kepada Allah SWT atas ridlo, rahmat dan karunia-Nya sehingga penulis dapat
menyelesaikan tesis ini sebagai persyaratan akhir pendidikan spesialis di bagian Pulmonologi
dan Ilmu Kedokteran Respirasi Fakultas Kedokteran Universitas Sebelas Maret Surakarta.
Bantuan, bimbingan dan pengarahan dari para guru, keluarga, teman sejawat PPDS paru,
karyawan medis dan non medis, serta para pasien yang berpartisipasi selama pendidikan dan
penelitian ini sangat menentukan penulis dalam menyelesaikan pendidikan dan tesis ini.
Penghargaan setinggi-tingginya penulis sampaikan kepada :
Prof. Dr. Suradi, dr. SpP(K), MARS
Ketua program studi PPDS Pulmonologi dan Ilmu Kedokteran Respirasi Fakultas Kedokteran
Universitas Sebelas Maret sebagai pembimbing utama penelitian ini yang telah memberikan
bimbingan, dorongan, saran dan kritik yang positif. Penulis mengucapkan terimakasih
sebesar-besarnya atas ilmu dan petunjuk yang telah diberikan selama penulis menjalani pendidikan.
Semoga Allah SWT memberikan banyak pahala dan karunia kepada beliau.
Dr. Reviono, dr. SpP(K)
Selaku pembimbing II penelitian yang telah banyak meluangkan waktu disela kesibukannya
sebagai Pembantu Dekan II di Fakultas Kedokteran UNS, yang telah memberikan bimbingan,
saran dan kritik sehingga tesis ini lebih baik. Terima kasih penulis ucapkan atas bimbingan, saran
commit to user ix
BACKGROUND: Isoniazid, rifampicin and pyrazinamide are essential components of the
strategy directly observed treatment short-course (DOTS) for tuberculosis control adopted by the World Health Organization (WHO) and all three have the potential hepatotoxic. Some studies conclude N-acetylcysteine (NAC) protects against drug-induced hepatitis induced by combination treatment isoniazid, rifampicin and pyrazinamide. Hepatoprotection of NAC may be by acting as a glutathione synthesis. The purpose of this study was to determine the role of NAC against on hepatotoxicity antituberculosis drug therapy in patients with pulmonary tuberculosis.
METHODS: This type of research is experimental study, with takes the subject of 60 patients
with pulmonary tuberculosis of new cases that met inclusion and exclusion criteria in Dr. Moewardi hospital, BKPM Klaten, and health centers throughout the city of Surakarta in May-June 2012. The subjects were divided into control group (n = 30) who received therapy for rifampicin, isoniazid, pyrazinamide, and ethambutol, and the treatment group (n = 30) received the same therapy plus NAC. All the subjects conducted follow-up for 14 days. Examination of serum levels of aspartate aminotransferase (AST), serum alanine aminotransferase (ALT), and total glutathione were done before treatment and day 15 of therapy, also if the patient shows (p = 0.000). Mean AST in the control group increased from 24.27 ± 8.88 to 39.70 ± 56.48 after
14 days therapy. Mean AST levels in the treatment group increased from 20.97 ± 5.09 to 21.50 ± 11.75 after 14 days therapy. Mean AST levels were not statistically significantly different both in the control group (p = 0.131), as well as the treatment group (p = 0.796). Mean ALT levels in the control group before therapy 19.67 ± 8.87 increased to 41,67 ± 58.87 after 14 days therapy. They were statistically differed significant (p = 0.042). Mean ALT levels in the treated group decreased from 19.73 ± 12.71 to 17.37 ± 14.89 after 14 days therapy. They were statistically
differ not significant (p = 0.316).
CONCLUSION: Administration of NAC contributed to the increase of total glutathione levels
in patients with pulmonary tuberculosis who received antituberculosis drugs therapy.
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
vii Soehartono dan ibunda Siti Harmiati (almh) atas asuhan, didikan, pengorbanan dan doa untuk
kesuksesan ananda. Terima kasih penulis sampaikan kepada bapak Eddy Mulyono dan ibu
Suharni atas semangat, arahan, himbauan dan tauladan yang telah diberikan selama ini. Ucapan
terimakasih juga kepada istri tersayang Wahyu Nur Ambarwati yang senantiasa setia, dan
mendukung segala upaya penulis menyelesaikan pendidikan. Kepada buah hati tersayang Ishmah
Nur Faizah dan Muhammad Satrio Azi terimakasih penulis ucapkan karena telah menambah
inspirasi dan semangat dalam menyelesaikan pendidikan.
Rasa hormat dan terima kasih penulis sampaikan kepada Windu Prasetya, dr. SpP,
Chrisrianto EN, dr. SpP, Yani Purnamasari, dr. SpP, Ni Nyoman Priantini, dr. SpP, Ikalius, dr.
SpP, Kenyorini, dr. SpP, Allen Wydisanto, dr. SpP, I Wayan Agus Putra, dr. SpP, Joko Susilo,
dr. SpP, Enny S Sarjono, dr. SpP, Rianasari, dr. SpP, Juli Purnomo, dr. SpP, Munawar Gani, dr.
SpP, Niwan Tristanto Martika, dr. SpP, Sofyan Budi Raharjo, dr. SpP, Novita Tjahyaningsih, dr.
SpP, Dyah Turunsih, dr. SpP, Rita Kesuma, dr. SpP, Slamet Nugroho, dr., Fadlia Yulistiana, dr.
dan seluruh rekan PPDS Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS/RSUD Dr.
Moewardi Surakarta.
Penghargaan dan terima kasih penulis sampaikan kepada semua rekan perawat
poliklinik (Mbak Krisni, Mbak Harti, Bu Pur, Pak Kuswanto) dan bangsal rawat paru di RS Dr
M, RSP Ario Wirawan Salatiga, BKPM Klaten, BKPM Magelang, BKPM Pati, BKPM
Semarang, BKPM Ambarawa serta rekan kerja di SMF paru (mas Waluyo, mbak Yamti, mas
Arif, mbak Anita, mbak Ira dan mas Harnoko) atas bantuan dan kerjasamanya selama ini.
Sebagai kata akhir penulis mohon maaf atas segala kesalahan, kelalaian dan
kekurangan selama menjalani pendidikan di bagian Pulmonologi. Semoga Allah SWT
memberikan rahmat dan ridho-Nya sehingga ilmu dan pengalaman yang penulis peroleh dapat
bermanfaat bagi agama, negara dan semua manusia.
Surakarta, Juli 2012
commit to user viii
LATAR BELAKANG: Isoniazid, rifampisin dan pirazinamid adalah komponen esensial strategi
directly observed treatment, short-course (DOTS) untuk mengontrol tuberkulosis yang disahkan oleh World Health Organization (WHO) dan ketiganya memiliki potensi hepatotoksik. Beberapa penelitian menyimpulkan N-acetylcysteine (NAC) melindungi terhadap drug induced hepatitis yang diinduksi oleh pengobatan kombinasi isoniazid, rifampisin dan pirazinamid. Efek hepatoproteksi NAC karena perannya sebagai prekursor sintesis glutathione. Tujuan penelitian ini adalah mengetahui peran NAC terhadap hepatotoksisitas OAT pada penderita TB paru.
METODE: Jenis penelitian adalah eksperimental, dengan mengambil subyek sebanyak 60 orang
penderita tuberkulosis paru (TB paru) kasus baru yang memenuhi kriteria inklusi dan eksklusi di RSUD Dr. Moewardi, BKPM Klaten, dan Puskesmas di seluruh wilayah Kota Surakarta pada bulan Mei – Juni 2012. Subyek terbagi dalam kelompok kontrol (n = 30) yang mendapat terapi rifampisin, isoniazid, pirazinamid, dan etambutol, kelompok perlakuan (n = 30) mendapat terapi yang sama ditambah NAC. Dilakukan follow up selama 14 hari. Pemeriksaan kadar serum aspartate aminotransferase (AST), serum alanine aminotransferase (ALT), dan glutathione total dilakukan sebelum terapi dan hari ke 15 terapi, juga bila penderita menunjukkan gejala klinis hepatotoksisitas.
HASIL: Kadar rerata glutathione total kelompok kontrol sebelum terapi 118,64 ± 68,78 naik
menjadi 228,74 ± 179,01 setelah 14 hari terapi. Kadar rerata glutathione total pada kelompok perlakuan sebelum terapi 145,54 ± 90,46 naik menjadi 418,98 ± 174,35 setelah 14 hari terapi. Keduanya secara statistik bermakna baik pada kelompok kontrol maupun kelompok perlakuan (p = 0,000). Kadar rerata AST kelompok kontrol 24,27 ± 8,88 naik menjadi 39,70 ± 56,48 setelah 14 hari terapi. Kadar rerata AST kelompok perlakuan 20,97 ± 5,09 naik menjadi 21,50 ± 11,75 setelah 14 hari terapi. Secara statistik tidak berbeda bermakna baik pada kelompok kontrol (p = 0,131), maupun kelompok perlakuan (p = 0,796). Kadar rerata ALT pada kelompok kontrol sebelum terapi 19,67 ± 8,87 naik menjadi 41,67 ± 58,87 setelah 14 hari terapi.Secara statistik berbeda bermakna (p = 0,042). Kadar rerata ALT kelompok perlakuan 19,73 ± 12,71 turun menjadi 17,37 ± 14,89 setelah 14 hari terapi.Secara statistik berbeda tidak bermakna (p = 0,316).
KESIMPULAN: Pemberian NAC berperan terhadap peningkatan kadar glutathione total pada
penderita TB paru dengan terapi OAT.
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012 X SAMPUL DEPAN
SAMPUL DALAM……….. i
PENETAPAN PANITIA PENGUJI……… ii
LEMBAR PENGESAHAN………... iii
UCAPAN TERIMAKASIH……….. iv
RINGKASAN……… viii
ABSTRACT……… ix
DAFTAR ISI……….. x
DAFTAR TABEL……… xiii
DAFTAR GAMBAR……… xiv
DAFTAR LAMPIRAN……… xv
BAB I. PENDAHULUAN Latar belakang………. 1
Rumusan masalah……….. 3
Tujuan penelitian……….. 4
Manfaat penelitian………... 4
BAB II. TINJAUAN PUSTAKA Epidemiologi hepatitis imbas obat antituberkulosis……….. 6
Definisi ………. 7
Metabolisme obat ……… 8
Mekanisme hepatotoksisitas ………. 9
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012 xi
Manifestasi klinik hepatotoksisitas imbas obat antituberkulosis ………. 24
Peran N-acetylcysteine mencegah hepatotoksisitas ……….. 25
N-acetylcysteine sebagai prekursor glutathione ……… 26
Sintesis glutathione ……….. 29
Fungsi antioksidan glutathione ……….. 31
Fungsi detoksifikasi glutathione ……… 33
Kerangka konsep ……… 34
Hipotesis penelitian ………. 37
BAB III. BAHAN DAN METODOLOGI PENELITIAN Desain penelitian ………. 38
Tempat dan waktu penelitian ……… 38
Populasi ……….. 38
Ciri-ciri sampel ……….. 38
Pemilihan sampel ………. 39
Cara kerja penelitian ……… 40
Alur penelitian ………. 41
Teknik pemeriksaan ………. 42
Analisis data ………. 45
Definisi operasional ……….. 45
BAB IV. HASIL PENELITIAN 1. Karakteristik subyek penelitian ……….. 47
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012 xii
1. Karakteristik subyek penelitian ………. 51
2. Perbandingan kadar AST, ALT, dan glutathione total ……….. 52
BAB VI. SIMPULAN DAN SARAN ………. 56
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012 xiii
Halaman
Tabel 1. Definisi hepatotoksisitas menurut WHO………. 8
Table 2. Karakteristik subyek ………... 48
Table 3. Nilai mean ± SD dari AST, ALT, dan glutathione total ………. 49
Table 4. Perbandingan mean ± SD sebelum terapi dan setelah 14 hari terapi …..49
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012 xiv
Halaman Gambar 1. Mekanisme hepatotoksisitas imbas obat ………. 11
Gambar 2. Tiga langkah umum DILI ……….. 14
Gambar 3. Metabolisme isoniazid ……… 20
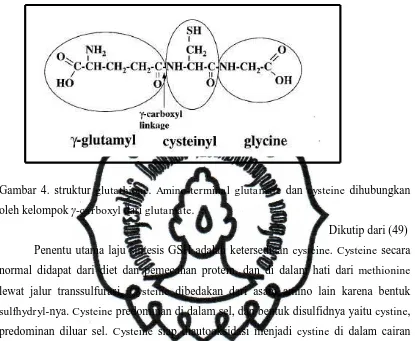
Gambar 4. Struktur glutathione ……… 30
Gambar 5. Fungsi antioksidan glutathione ………... 31
Gambar 6. Jalur mercapturic ………... 33
Gambar 7. Kerangka konsep ……….. 36
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012 xv Halaman
Lampiran 1. Lembar penjelasan kepada penderita……….. I
Lampiran 2. Lembar persetujuan mengikuti penelitian ……….. IV
Lampiran 3. Lembar data penderita ……… V
Lampiran 4. Lembar isian panitia Kelaikan Etik RSUD Dr. Moewardi ……… VII
Lampiran 5. Lembar Kelaikan Etik ……… XI
Lampiran 6. Lembar Data hasil penelitian ……… XII
commit to user
Tuberkulosis (TB) merupakan pandemik global dan prevalensinya mengalami
peningkatan. Jumlah terbesar kasus terjadi di daerah Asia Tenggara, sekitar sepertiga
dari prevalensi global.1 Indonesia berada di urutan ke lima (0,35 – 0,52 juta) jumlah
kasus paling banyak di tahun 2009 setelah India (1,6 – 2,4 juta), China (1,1 – 1,5 juta),
Afrika Selatan (0,40 – 0,59 juta), dan Nigeria (0,37 – 0,55 juta).2
Isoniazid, rifampisin dan pirazinamid adalah komponen esensial dari strategi
directly observed treatment, short-course (DOTS) untuk mengontrol tuberkulosis yang
disahkan oleh World Health Organization (WHO) dan ketiganya diketahui memiliki
potensi hepatotoksik.3 Ketiganya sangat efektif, tetapi hepatotoksisitas adalah masalah
penting. Hepatotoksisitas kadangkala dapat diprediksi dan dose dependent, tetapi
kebanyakan idiosinkratik.1 Usia, jenis kelamin, alkoholisme, penyakit hati kronik, status
hepatitis B carrier, status asetilator dan nutrisi diduga sebagai faktor predisposisi pada
penelitian awal.4 Hepatotoksisitas adalah kemungkinan terjadi keadaan hepatotoksik
karena zat atau obat.
Peristiwa hepatotoksik karena obat antituberkulosis bervariasi. Insidensinya
lebih sering di negara berkembang dengan range dari 8% - 39% dibanding negara maju
yaitu 3% - 4%, dengan regimen yang sama.1,4 Sharifzadeh et al melaporkan insidensi
27,7% di Iran.5 Satu penelitian terbaru dari Singapura melaporkan insidensi 5,3% dan
penelitian di Malaysia 9,7%.1 Penelitian oleh Prihatini D dan kawan-kawan di
Indonesia pada April 2003 - September 2004, penelitian di Karachi, Pakistan pada Juli
2004 - Juli 2005, penelitian di Peshawar pada Juli 2007 - Juni 2008, dan penelitian di
Jamshoro pada Juli 2007 - Agustus 2008 melaporkan mayoritas pasien terjadi
hepatotoksisitas dalam waktu 14 hari setelah mulai terapi OAT.6-9 Hepatotoksisitas
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
2 muda (13-40 tahun) yaitu 25,8 % dibanding 14,4 % pada penelitian di Karachi, Juli
2004 - Juli 2005.8 Hal ini juga didukung oleh penelitian – penelitian di Peshawar, Juli
2007 – Juni 2008, dan di Jamshoro, Juli 2007 – Agustus 2008 (usia ≥ 35 tahun
dibanding ≤ 35 tahun).6,9
Peningkatan transaminase asimptomatik biasa terjadi selama terapi
antituberkulosis, tetapi hepatotoksisitas menjadi fatal bila tidak diketahui dari awal dan
terapi tidak dihentikan.11-14 Mekanisme hepatotoksik karena terapi antituberkulosis
belum sepenuhnya dimengerti. Sodhi et aldikutip dari5 mengemukakan stress oksidatif
sebagai kemungkinan mekanisme cidera hati imbas isoniazid (INH) dan rifampisin (R).
Dikemukakan bahwa dengan meningkatkan sistem pertahanan antioksidatif selular,
dalam hal ini glutathione, sel-sel menjadi terlindung dalam melawan cidera oksidatif
yang dihasilkan berbagai macam obat dan bahan kimia.5,15
Hepatotoksik karena isoniazid bukan hipersensitivitas atau reaksi alergi, paling
mungkin disebabkan oleh metabolit toksik dan dianggap idiosinkratik.14 Penelitian
terbaru menyatakan bahwa hidrazin kemungkinan besar penyebab hepatotoksik.14,16
Rifampisin adalah penginduksikuat sistem sitokrom P-450 hepatik pada hati dan usus,
penggunaan kombinasi rifampisin dan isoniazid dihubungkan dengan peningkatan
risiko hepatotoksisitas.14,17-19 Efek samping utama pirazinamid adalah
hepatotoksisitas.18 Mekanisme toksisitas karena pirazinamid tidak diketahui. Apakah
toksisitas disebabkan oleh pirazinamid atau metabolitnya juga tidak diketahui.14
Etambutol dan streptomisin dilaporkan tidak memiliki efek hepatotoksik.16
Penanda dini hepatotoksisitas adalah peningkatan enzim-enzim transaminase
dalam serum yang terdiri dari aspartate aminotransferase (AST) yang disekresikan
secara paralel dengan alanine aminotransferase (ALT) yang merupakan penanda lebih
spesifik untuk mendeteksi kerusakan hati.7 World health organization (WHO)
mengklasifikasikan hepatotoksisitas menjadi 4 gradasi. Grade I ditandai dengan
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
3
grade III ALT meningkat 5,1 – 10 kali normal, dan grade IV bila ALT meningkat > 10
kali normal.7,14
Glutathione (GSH) adalah antioksidan endogen utama dan N-acetylcysteine
(NAC) adalah prekursor GSH. Efek paling menguntungkan pemberian NAC adalah
kemampuannya sebagai sumber sulfhydryl sehingga dapat menstimulasi sintesis
glutathione, meningkatkan aktivitas glutathione-S-transferase, meningkatkan
detoksifikasi dan berperan sebagai pengikat radikal bebas serta berinteraksi dengan
reactive oxygen species (ROS).15 Beberapa penelitian pada binatang dan manusia
menyimpulkan bahwa NAC melindungi terhadap drug induced hepatitis yang diinduksi
oleh pengobatan kombinasi isoniazid, rifampicin dan pyrazinamid. Menurut mereka
efek hepatoproteksi NAC karena perannya sebagai prekursor sintesis glutathione.5,18
Penelitian mengenai efek protektif NAC terhadap hepatotoksisitas yang
diinduksi oleh OAT pernah dilakukan oleh Baniasadi S et al di Iran pada tahun 2010.
Penelitian tersebut membandingkan kadar serum AST dan ALT pada penderita TB paru
yang diterapi OAT tanpa pemberian NAC dengan kadar serum AST dan ALT penderita
TB paru dengan terapi OAT ditambah NAC. Penelitian tersebut tidak memeriksa kadar
glutathione pada subyek penelitian. Memperhatikan keadaan tersebut berikut dilakukan
penelitian membandingkan kadar serum AST, ALT dan glutathion total pada penderita
TB paru terapi OAT ditambah pemberian NAC dengan kadar serum AST, ALT dan
kadar glutathion pada penderita TB paru terapi OAT tanpa ditambah NAC.
1.2. RUMUSAN MASALAH
Rumusan masalah pada penelitian ini adalah:
1. Adakah peran NAC terhadap kadar glutathione total pada penderita tuberkulosis
paru terapi obat antituberkulosis?
2. Adakah peran NAC terhadap kadar serum ASTpada penderita tuberkulosis paru
terapi obat antituberkulosis?
3. Adakah peran NAC terhadap kadar serum ALT pada penderita tuberkulosis
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
4
1.3. TUJUAN PENELITIAN
Tujuan umum
Mengetahui peran NAC terhadap hepatotoksisitas terapi obat antituberkulosis
pada penderita TB paru.
Tujuan khusus
1. Mengetahui peran NAC terhadap kadar glutathione total penderita TB paru
terapi obat antituberkulosis.
2. Mengetahui peran NAC terhadap kadar serum AST penderita TB paru terapi
obat antituberkulosis.
3. Mengetahui peran NAC terhadap kadar serum ALT penderita TB paru terapi
obat antituberkulosis.
1.4. MANFAAT PENELITIAN
Manfaat praktis:
1. Dapat diketahui peran NAC terhadap faktor risiko hepatotoksisitas pada
penderita TB paru terapi obat antituberkulosis.
2. Dapat dipertimbangkan pemberian NAC pada penderita TB paru terapi obat
antituberkulosis untuk membantu mencegah hepatitis imbas obat.
Manfaat teoretis:
Pemberian NAC diharapkan dapat meningkatkan kadar glutathione sehingga dapat
berperan untuk mencegah hepatotoksisitas pada penderita TB paru dengan terapi obat
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
5
BAB II
TINJAUAN PUSTAKA
Tuberkulosis (TB) adalah problem kesehatan yang penting di dunia. Pandemik
TB terjadi di negara berkembang dan insiden ini meningkat karena ko-infeksi dengan
human immunodeficiency virus (HIV).6 Kasus TB diperkirakan terjadi 9,4 juta ( range
8,9 – 9,9 juta) di seluruh dunia ( ekuivalen dengan 137 kasus per 100.000 populasi)
pada tahun 2009. Jumlah kasus terbanyak di tahun 2009 terjadi di Asia (55%) dan
Afrika (30%), proporsi kasus lebih kecil terjadi di wilayah Eastern Mediterranian
(7%), wilayah Eropa (4%), dan wilayah Amerika (3%).2
Pengobatan TB saat ini menggunakan beberapa obat antituberkulosis dalam
bentuk kombinasi. Obat TB utama (first line) saat ini adalah rifampisin (R), isoniazid
(H), pirazinamid (Z), etambutol (E), dan streptomisin (S). Obat TB lain (second line)
adalah kanamisin, kapreomisin, amikasin, kuinolon, sikloserin, etionamid, dan
para-amino salisilat (PAS) digunakan jika terjadi multidrug resistance (MDR).21-24
Komponen esensial dari strategi directly observed treatment, short-course
(DOTS) untuk mengontrol tuberkulosis yang disahkan oleh World Health Organization
(WHO) adalah isoniazid, rifampisin dan pirazinamid, ketiganya diketahui memiliki
potensi hepatotoksik.3 Mekanisme dasar hepatotoksisitas imbas obat antituberkulosis
dan faktor predisposisi perkembangan hal tersebut belum sepenuhnya dimengerti. Usia,
jenis kelamin, alkoholisme, penyakit hati kronik, status hepatitis B carrier, status
asetilator dan nutrisi diduga sebagai faktor predisposisi pada penelitian awal.4
Prevalensi drug induced liver injury (DILI) pada TB diperkirakan meningkat,
insidennya dilaporkan lebih rendah di negara maju yaitu 3 – 4% dibandingkan negara
berkembang yaitu 8 – 39% dengan regimen yang sama. Para peneliti menduga diantara
obat-obat anti-TB hepatotoksik, pirazinamid (Z) diduga paling toksik terutama pada
pasien dengan penyakit hati kronik.6 Angka DILI yang lebih tinggi di negara
berkembang mungkin karena perbedaan ras dan status nutrisi membuat mereka lebih
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
6
N-acetylcysteine (NAC) sering digunakan jika keseimbangan
oksidan-antioksidan intraselular menjadi perhatian.25 Sodhi et aldikutip dari5 mengemukakan stress
oksidatif sebagai kemungkinan mekanisme cidera hati imbas isoniazid (INH) dan
rifampisin (R). Dikemukakan bahwa dengan meningkatkan sistem pertahanan
antioksidatif selular, dalam hal ini glutathione, sel-sel menjadi terlindung dalam
melawan cidera oksidatif yang dihasilkan berbagai macam obat dan bahan kimia.5,15
Mereka menyimpulkan bahwa pemberian NAC pada pasien TB bisa meningkatkan
jumlah glutathione dan respons imun pasien. Hepatoproteksi oleh NAC mungkin
karena perannya sebagai prekursor sintesis glutathione.5
1.1. EPIDEMIOLOGI HEPATITIS IMBAS OBAT ANTITUBERKULOSIS
Efek buruk tersering terapi antituberkulosis adalah hepatotoksisitas, reaksi kulit,
gangguan gastrointestinal dan neurologis. Hepatotoksisitas karena obat antituberkulosis
(OAT) menyebabkan morbiditas dan mortalitas yang substansial dan mengurangi
keefektifan terapi. Insidensi DILI selama pengobatan TB dilaporkan bervariasi antara
2% - 28%.11-14 Penelitian banyak dilakukan di Eropa, Asia, dan Amerika Serikat,
kejadiannya bervariasi diantara berbagai bagian dunia.14
Suatu penelitian meta-analisis penggunaan kombinasi regimen OAT pada
dewasa menunjukkan tingkat kejadian toksisitas hati 2,6% dengan isoniazid dan
rifampisin bersamaan, tetapi hanya 1,1% dengan rifampisin saja, dan 1,6% dengan
isoniazid saja. Kontribusi pirazinamid terhadap perkembangan hepatitis imbas obat
selama pengobatan TB tampak masih kontroversial pada laporan terdahulu. Penelitian
terakhir telah lebih menyokong potensi hepatotoksisitas pirazinamid. Penelitian di India
menemukan penambahan pirazinamid pada terapi isoniazid dan rifampisin prosentase
hepatitis imbas obat signifikan lebih tinggi dibanding kelompok kontrol (70% vs 42%).
Penelitian di Singapura, semua pasien dengan hepatitis imbas obat fatal didapatkan
pirazinamid pada regimennya.26
Penelitian di Malaysia oleh Marzuki et aldikutip dari 1 melaporkan kejadian
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
7 kejadian 9,5%. Risiko hepatotoksisitas berdasarkan pada data empat penelitian di India
yaitu 11,5% dibanding 4,3% di negara maju. Beberapa studi melaporkan bahwa risiko
hepatitis imbas OAT meningkat sesuai pertambahan usia, insiden tertinggi terjadi pada
orang usia lebih 50 tahun.4
Penelitian oleh Prihatini D dan kawan-kawan di Indonesia pada April 2003
sampai September 2004 melaporkan peningkatan alanine aminotransferase (ALT)
serum terjadi pada minggu kedua akibat kombinasi OAT dengan rifampisin dosis tinggi
terjadi dalam waktu yang sama dengan rifampisin dosis standar.7 Penelitian di Karachi,
Pakistan pada Juli 2004 sampai Juli 2005 melaporkan mayoritas pasien terjadi
hepatotoksisitas dalam waktu 14 hari setelah mulai terapi.8 Penelitian lain di Pakistan
pada Agustus 2009 sampai Agustus 2010, prevalensi hepatitis imbas OAT adalah
14,38%. Pasien yang diteliti berjumlah total 1161 orang, terdiri dari 589 laki-laki dan
572 perempuan. Kejadian hepatotoksisitas lebih banyak pada perempuan (15,39%)
dibanding laki-laki (13,58%).12
2.2. DEFINISI
Definisi hepatotoksisitas berubah-ubah dan telah digunakan definisi
berbeda-beda. Definisi hepatitis imbas OAT adalah pengobatan yang menimbulkan peningkatan
serum alanine aminotransferase (ALT) lebih dari tiga atau lima kali upper limit of
normal (ULN), dalam empat minggu pengobatan tuberkulosis, dengan atau tanpa gejala
hepatitis. Penghentian penggunaan obat menyebabkan penurunan ALT. Berat
hepatotoksisitas digolongkan sesuai WHO Toxicity Classification Standarts sesuai
tabel 1. 14,16,17,27
British Thoracic Society (BTS) dan American Thoracic Society (ATS)/ Center
of Disease Control and Prevention (CDCP)/ Infectious Disease Society of America
(IDSA) telah merekomendasikan bahwa pengobatan yang potensial hepatotoksis harus
dihentikan jika serum ALT melebihi lima kaliULN (dengan atau tanpa gejala) atau tiga
kali ULN dengan jaundice dan/atau gejala hepatitis. Monitor ketat fungsi hati
commit to user
Kenaikan progresif ALT dan kadar bilirubin jauh lebih berbahaya. Beberapa
penulis menyarankan menghentikan obat-obatan hepatotoksik jika tingkat ALT
meningkat tiga kali atau lebih dibandingkan dengan normal, sementara yang lain
merekomendasikan lima kali. Drug-Induced Hepatitis dapat diklasifikasikan
berdasarkan potensi masing-masing OAT yang menyebabkan hepatotoksisitas.10
2.3. METABOLISME OBAT
Sebagian besar obat masuk melalui saluran cerna. Hati terletak diantara
permukaan absorbtif saluran cerna dan organ target obat, hati berperan sentral dalam
metabolisme obat. Hepatotoksisitas imbas obat merupakan komplikasi potensial yang
hampir selalu ada pada setiap obat yang diberikan, karena hati merupakan pusat
disposisi metabolik dari semua obat dan bahan-bahan asing yang masuk tubuh.28
Setelah pemberian obat secara oral banyak obat diserap secara utuh oleh usus
kecil dan dibawa melalui sistem portal ke hati, tempat obat mengalami metabolisme
ekstensif.29 Hati memetabolisme hampir setiap obat atau racun yang masuk ke dalam
tubuh. Sebagian besar obat bersifat lipofilik sehingga mampu menembus membran sel
intestinal. Obat kemudian diubah menjadi hidrofilik melalui proses biokimiawi dalam
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
9 Biotransformasi hepatik ini melibatkan jalur oksidatif terutama melalui sistem enzim
sitokrom P-450. Jalur klasik metabolisme obat terjadi dalam dua fase. Fase pertama
biasanya melibatkan transfer molekular oksigen terjadi reaksi oksidasi, reduksi atau
hidroksilasi, tidak semua obat menjalani langkah ini, dan beberapa obat dapat langsung
menjalani fase kedua.28,30,31
Sitokrom P-450 mengkatalisis reaksi pada fase pertama (terletak dalam
retikulum endoplasma halus hati). Reaksi ini dapat mengakibatkan pembentukan
metabolit yang jauh lebih beracun dibanding substrat induk dan dapat mengakibatkan
cidera pada hati. Sebagian besar produk bersifat sementara dan sangat reaktif. Sebagai
contoh metabolit paracetamol yaitu N-acetyl-p-benzoquinone (NAPQI) adalah toksik
terhadap hati. 28,30,31
Fase kedua meliputi jalur glukoronidasi, sulfasi, asetilasi, dan konjugasi
glutathione sehingga akan meningkatkan kelarutan obat untuk membentuk
senyawa/bahan yang siap dikeluarkan dari tubuh. Jalur protein transporter seluler
memfasilitasi pengeluaran senyawa/bahan tersebut ke dalam empedu atau sistem
sirkulasi. Obat dengan berat molekul tinggi akan dikeluarkan dalam empedu dan ginjal
mengeluarkan obat dengan molekul yang lebih kecil. Aktivitas transporter dan enzim
dipengaruhi oleh faktor-faktor endogen seperti irama sirkadian, hormon, sitokin, status
penyakit, faktor genetik, jenis kelamin, etnis, umur, dan status nutrisi, begitu juga oleh
obat-obatan atau bahan kimia eksogen.17,30,32
2.4. MEKANISME HEPATOTOKSISITAS
Reaksi obat diklasifikasikan sebagai reaksi yang dapat diduga (intrinsik) dan
yang tidak dapat diduga (idiosinkratik). Reaksi intrinsik atau reaksi obat yang dapat
diperkirakan terjadi pada semua orang yang mengalami akumulasi obat pada jumlah
tertentu. Cidera hati dapat disebabkan oleh obat itu sendiri atau metabolit obat.27,32
Reaksi idiosinkratik dapat dibagi menjadi hipersensitivitas atau imunoalergik
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
10 hipersensitivitas, suatu respons yang ditandai dengan demam, kemerahan pada kulit,
dan eosinofilia suatu respons imun yang ditandai dengan periode laten yang pendek
satu sampai empat minggu. Obat atau metabolit obat yang berikatan kovalen dengan
protein dapat mendatangkan produk antibodi spesifik atau sel T dikenal sebagai hapten
obat atau epitop spesifik pada molekul carrier.33 Hal ini sesuai hapten hipotesis:
molekul kecil tidak imunogenik, tetapi bila berikatan secara ireversibel pada protein
maka protein termodifikasi dapat menginduksi respons imun berupa reaksi
hipersensitivitas.34 Idiosinkratik metabolik adalah tipe reaksi yang terjadi melalui reaksi
tak langsung metabolit obat. Respons bervariasi dan dapat terjadi dalam seminggu atau
lebih dari setahun kemudian. Toksisitas isoniazid dipertimbangkan masuk dalam
kelompok ini. Reaksi idiosinkratik tergantung pada idiosinkrasi pejamu (terutama
pasien yang menghasilkan respons imun terhadap antigen, dan kecepatan pejamu
memetabolisme penyebab).28,32
Mekanisme jejas hati imbas obat yang mempengaruhi protein-protein transport
pada membran kanalikuli dapat terjadi melalui mekanisme apoptosis hepatosit imbas
empedu. Terjadi penumpukan asam-asam empedu di dalam hati karena gangguan
transport pada kanalikuli yang meghasilkan translokasi fassitoplasmic ke membran
plasma, tempat reseptor ini mengalami pengelompokan sendiri dan memicu kematian
sel melalui apoptosis. Selain itu banyak reaksi hepatoseluler melibatkan sistem
sitokrom P-450 yang mengandung heme dan menghasilkan reaksi-reaksi energi tinggi
yang dapat membuat ikatan kovalen obat dengan enzim, sehingga menghasilkan ikatan
baru yang tak punya peran. Kompleks obat-enzim ini bermigrasi ke permukaan sel di
dalam vesikel-vesikel untuk berperan sebagai imunogen-imunogen sasaran serangan
sitolitik ke sel T, merangsang respons imun multifaset yang melibatkan sel-sel T
sitotoksik dan berbagai sitokin. Obat-obat tertentu menghambat fungsi mitokondria
dengan efek ganda pada beta-oksidasi dan enzim-enzim rantai respirasi.
Metabolit-metabolit toksik yang dikeluarkan dalam empedu dapat merusak epitel saluran empedu.
Cidera pada hepatosit dapat terjadi akibat toksisitas langsung, terjadi melalui konversi
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
11 (biasanya oleh obat atau metabolitnya berlaku sebagai hapten untuk mengubah protein
sel menjadi imunogen).28,32,35 Lebih jelas diterangkan pada gambar 1.
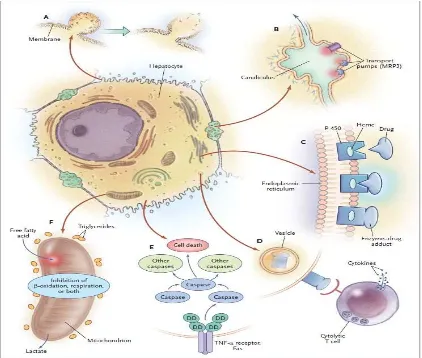
Gambar 1: mekanisme hepatotoksisitas imbas obat
Dikutip dari ( 34 )
Terdapat pula model DILI yang mengedepankan tiga langkah penting yang
berurutan. Hal ini juga meliputi jalur intrinsik dan ekstrinsik yang menekankan peran
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
12
Tiga langkah umum model drug-induced liver injury seperti diterangkan pada
gambar 2 meliputi:35
1. Mekanisme awal toksisitas: stress sel langsung, perusakan mitokondrial langsung,
dan reaksi imun spesifik.
Metabolit obat atau obat utama menyebabkan stress sel langsung, gangguan
fungsi mitokondria atau memicu reaksi imun spesifik. Molekul obat relatif kecil seperti
tidak mungkin menimbulkan respons imun, tetapi melalui reaksi biotransformasi dapat
terbentuk molekul obat yang mengikat enzim sehingga cukup besar sebagai target
imun. Ikatan tersebut bermigrasi ke permukaan hepatosit sehingga menginduksi
pembentukan antibodi. Sistem enzim paling penting yang memetabolisme obat untuk
membentuk metabolit reaktif hepatotoksik adalah famili polymorphic cytochrome P450
(CYP450) yang memediasi metabolisme obat fase 1(oksidasi). Metabolisme obat fase 2
(konjugasi) bisa juga menghasilkan metabolit hepatotoksik.34,35
Metabolit reaktif dapat menyebabkan stress sel awal melalui mekanisme luas
termasuk deplesi glutathione atau dapat juga melekat pada enzim, lipid, asam nukleat,
dan struktur sel lain. Selanjutnya metabolit reaktif atau obat induk bisa secara spesifik
menghambat fungsi hepatoseluler lain seperti apikal bile salt efflux pump (BSEP).
Metabolit reaktif atau obat induk menghambat rantai respirasi mitokondria
menyebabkan deplesi adenosine triphosphat (ATP) dan peningkatan konsentrasi
reactive oxygen species (ROS), menghambat β- oksidasi menyebabkan steatosis,
kerusakan DNA mitokondrial atau mengganggu replikasi, atau langsung menyebabkan
mitochondrial permeability transition (MPT).35
Respons imun spesifik sel T cytotoxic dengan pelepasan sitokin-sitokin
inflamasi dapat ditimbulkan oleh metabolit reaktif yang berikatan kovalen dengan
protein dan kemudian membentuk neo-antigen (pembentukan hapten). Presentasi major
histocompatibility complex (MHC) yang tergantung pada antigen presenting cell
mengaktifkan pembentukan antibodi melawan hapten atau autoantibodi melawan
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
13
2. Direct and death receptor – mediated pathways leading to mitochondrial
permeability transition
Stress sel awal dan atau reaksi imun spesifik dapat menyebabkan MPT melalui
dua jalur utama yaitu jalur intrinsik diinisiasi oleh stress sel berat, atau jalur ekstrinsik
yaitu kematian tak langsung receptor-amplified yang dipicu oleh stress sel ringan dan
atau reaksi imun spesifik. Stress intraseluler berat mengaktivasi jalur reticulum
endoplasmic, permeabilisasi lysosomal, atau c-jun N-terminal kinase (JNK) dalam jalur
intrinsik. Berikutnya terjadi aktivasi protein pro-apoptotik (misal: Bax, Bak, Bad) dan
menghambat protein anti-apoptotik (misal: Bcl-2, Bcl-xl) dari famili Bcl-2 kemudian
mengaktivasi MPT.34,35
Tumor necrosis factor dan FasL berikatan ke death receptors intraseluler, dan
TNF/Fas receptor-associated death domain proteins (TRADD/FADD) akan
mengaktivasi inisiator caspase 8. Aktivasi death-receptor complex juga disebut death-
inducing signaling complex (DISC). Inisiator caspase 8 dapat memulai apoptosis
melalui aktivasi langsung efektor caspase 3, 6 dan 7, tetapi jalur langsung ini terlalu
lemah di dalam hepatosit untuk memediasi apoptosis. Oleh karena itu diperlukan
mekanisme amplifikasi yaitu caspase 8 mengaktivasi protein pro-apoptotik Bcl-2 (misal
Bid), hal ini menyebabkan MPT.34,35
3. Apoptosis dan nekrosis
Apoptosis atau kematian sel yang terprogram merupakan suatu komponen yang
normal pada perkembangan dan pemeliharaan kesehatan organisme multiselular.
Kematian sel merupakan respons terhadap berbagai stimulus dan selama apoptosis sel
dikontrol serta diregulasi, sel yang mati kemudian difagosit oleh makrofag. Apoptosis
berbeda dengan nekrosis, pada nekrosis terjadi kematian sel tidak terkontrol. Nekrosis
merupakan kematian sel yang terjadi pada organisme hidup yang dapat disebabkan oleh
cidera atau infeksi. Nekrosis terjadi perubahan pada inti yang akhirnya dapat
menyebabkan inti menjadi lisis dan membran plasma menjadi ruptur, sedangkan pada
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
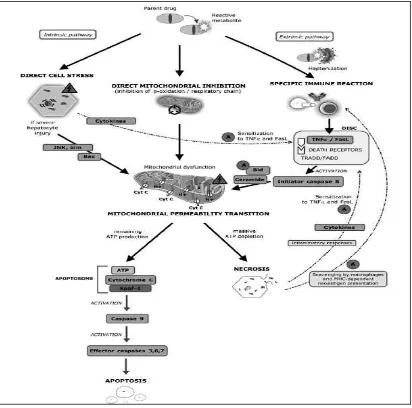
14 Gambar 2: tiga langkah umum DILI
Dikutip dari (35 )
Mitochondrial permeability transition menyebabkan nekrosis atau apoptosis
bergantung pada availabilitas ATP. Aktivasi hepatosit oleh aktivator caspase 8 melalui
jalur ekstrinsik tidak cukup secara langsung mengaktivasi apoptosis, tetapi amplifikasi
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
15 kemudian mengarah ke jalur apoptotik yang diaktivasi oleh ATP yang masih cukup.
Nekrosis terjadi jika tidak tersedia ATP yang diperlukan untuk energi jalur apoptotik.
Beberapa mekanisme amplifikasi pokok (A) bisa memainkan peran penting pada
tingkat berbeda untuk peristiwa idiosinkratik hepatotoksisitas.35
Kelemahan fungsi mitokondria dan produksi energi menyebabkan apoptosis
atau nekrosis sel. Mitochondrial permeability transition memberi influx masif proton
melalui membran dalam mitokondria, sehingga menghentikan sintesis ATP
mitokondria. Deplesi ATP mitokondria dihasilkan dari MPT (atau mekanisme langsung
kerusakan mitokondria seperti disebut diatas) menyebabkan ekspansi matriks dan
permeabilisasi membran luar mitokondria dan ruptur dengan pelepasan cytochrome c
dan protein pro-apoptotik mitokondrial lain dari ruang intermembran ke dalam
cytosol.34,35
Nekrosis berkembang jika cidera awal terlalu berat sehingga MPT cepat terjadi
dalam semua mitokondria, atau jika mekanisme lain menyebabkan deplesi ATP
mitokondria yang cepat, menghambat jalur apoptotik. Hal ini khas untuk hepatotoksin
yang langsung menyebabkan stress sel awal yang parah. Nekrosis sel juga bisa
disebabkan oleh aktivasi jalur ekstrinsik karena tidak adanya ATP. Penggelembungan
sel dan lisis yang mengikuti kerusakan berat fungsi sel menandai nekrosis. Sel nekrotik
menginduksi respons inflamasi termasuk pelepasan sitokin, penting karena bisa
meningkatkan cidera awal melalui sensitisasi seputar hepatosit dan karena itu
menyebabkan kerusakan kolateral lebih lanjut.34,35
Perbedaan antara apoptosis dan nekrosis tidak selalu jelas. Apoptosis dan
nekrosis bisa dianggap sebagai spektrum yang berlanjut. Lebih lanjut beberapa
kontroversi ada di seputar mekanisme pasti dan pencetus hepatotoksik apoptosis
termasuk peran MPT.32 Disimpulkan bahwa mitokondria berada di pusat mati dan hidup
dalam hepatotoksisitas. Mereka dapat menjadi target langsung toksisitas awal.
Mitochondrial permeability transition memainkan peran kunci dalam sinyal selanjutnya
dari jalur intrinsik dan ekstrinsik. Mitokondria membentuk suplai ATP sel paling
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
16 kerusakan mitokondria yang luas akhirnya menentukan apakah hepatosit mati karena
apoptosis atau nekrosis.35
2.5. FAKTOR RISIKO KELAINAN HEPATOSELULAR IMBAS OBAT
Terdapat beberapa faktor risiko kelainan hepatoselular imbas obat antara lain
ras, usia tua, perempuan, malnutrisi, infeksi human immunodeficiency virus (HIV),
penyakit hati yang mendasari, penyalahgunaan alkohol, penggunaan obat hepatotoksik
lain.11,13
1. Ras dan genetik
Beberapa obat memiliki toksisitas berbeda berdasarkan ras/suku bangsa. Ras dan
genetik mungkin berperan penting. Beberapa polimorfisme genetik pada enzim-enzim
metabolisme obat yang dihubungkan dengan hepatotoksisitas imbas obat antara lain
status asetilator lambat, genotipe glutathione S-transferase M1 homozygote null dan
genotipe cytochrome P4502E1 c1/c1 (CYP2E1 c1/c1).13 Status setilator lambat dan
intermediate banyak terdapat pada populasi orang Afrika (Sabbagh et al. 2008;
Matimba et al. 2009). Hampir 95% orang kulit hitam Afrika Selatan memiliki genotipe
CYP2E1 c1/c1 (Chelule et al. 2006). Beberapa penelitian tersebut menduga bahwa
‘genotipe risiko tinggi’ yang berhubungan dengan hepatotoksisitas imbas obat banyak
terdapat diantara bangsa Afrika.11 Penelitian di China oleh Shang P et al tahun
2007/2008 menjelaskan insidensi kelainan hati imbas obat anti tuberkulosis adalah
2,55% pada bangsa China.13 Prevalensi 9,7% terdapat pada bangsa Malaysia dari hasil
penelitian oleh Marzuki et al.1
2. Umur
Orang tua berisiko lebih tinggi cidera hati karena clearance menurun, interaksi
antar obat, aliran darah ke hati berkurang, dan menurunnya volume hati.27 Penelitian
oleh Mahmood K et al di Karachi, Pakistan tahun 2005 menyebutkan pasien usia tua
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
17 dibanding 26 dari 180 orang atau 14,4%)21 Penelitian oleh Zaman R di Bahawalpur,
Pakistan tahun 2010 menyebutkan prevalensi hepatotoksisitas karena OAT paling
tinggi pada orang tua (> 50 tahun) yaitu 17,54%.12
3. Seks
Meskipun alasan tidak diketahui, reaksi obat pada hati lebih sering terjadi pada
perempuan.7 Penelitian oleh Mahmood K et al di Karachi, Pakistan tahun 2005
menyebutkan perempuan lebih rentan dibanding laki-laki (41 dari 156 orang atau
26,3% dibanding 36 dari 183 orang atau 19,7%).8 Penelitian Zaman R di Bahawalpur,
Pakistan tahun 2010 menyebutkan prevalensi hepatotoksisitas karena OAT pada
laki-laki 13,58% dan 15,39% pada perempuan.12
4. Konsumsi alkohol
Sering mengkonsumsi alkohol membuat rentan terhadap keracunan obat karena
alkohol menyebabkan cidera hati yang mengubah metabolisme obat.27 Penelitian
Mahmood et al di Karachi, Pakistan tahun 2005 menyebutkan pasien dengan konsumsi
alkohol lebih berisiko (25%) dibanding tanpa konsumsi alkohol (19,6%).24
5. Penyakit hati
Pasien dengan penyakit hati kronis mengalami peningkatan risiko cidera hati.
Pasien dengan infeksi HIV yang koinfeksi dengan virus hepatitis B atau C akan
meningkatkan risiko untuk efek hepatotoksik apabila diobati dengan terapi
antiretroviral. Pasien dengan sirosis berisiko mengalami peningkatan dekompensasi
dengan obat beracun.27 Penelitian Zaman R di Bahawalpur, Pakistan tahun 2010
menyebutkan pasien carrier hepatitis B atau C 100% berkembang hepatotoksisitas
karena OAT.8 Penelitian oleh Anand AC di India tahun 2002 menghasilkan data
kejadian disfungsi hati lebih tinggi pada pasien dengan infeksi kronis virus hepatitis B
yang mendapat OAT (37,5%) dibanding pasien tidak terinfeksi virus hepatitis B
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
18 6. Komorbiditas lain
Penderita acquired immune deficiency syndrome (AIDS), penderita kekurangan
gizi rentan terhadap reaksi obat karena penyimpanan glutathione rendah.27 Penelitian
Marzuki et al di Malaysia tahun 2005 menemukan bahwa penderita HIV positif
merupakan faktor risiko signifikan berkembang hepatitis imbas OAT.1
2.6. HEPATOTOKSISITAS IMBAS OBAT ANTITUBERKULOSIS
Penyebab TB diketahui lebih dari satu abad dan selama hampir 50 tahun sudah
ditemukan berbagai macam obat yang efektif untuk mengatasi, tetapi masalah TB dunia
sekarang lebih besar dari sebelumnya. Hal ini diperkirakan karena hubungan antara TB
dengan infeksi HIV serta terjadinya multiple drug resistant tuberkulosis (TB-MDR).36
Efek samping dan toksisitas obat juga ancaman untuk dokter dan pasien dalam
melanjutkan terapi.16
Efek Hepatotoksik Obat Antituberkulosis
Kebanyakan obat antituberkulosis larut dalam lemak dan eliminasinya
memerlukan biotransformasi menjadi senyawa larut dalam air. Biotransformasi tersebut
sebagian besar terjadi pada fase hepatik I dan II yang memerlukan enzim
biotransformasi. Reaksi fase I terjadi oksidasi atau demetilasi, dilakukan oleh enzim
cytochrome P-450 (CYP-450). Hasil oksidasi obat tidak terlalu larut dalam air dan
membutuhkan metabolisme lebih lanjut. Reaksi fase I sering menghasilkan metabolit
toksik. Sebagian besar senyawa larut dalam air diikat oleh glukoronidasi atau sulfat
menghasilkan metabolit non-toksik yang mudah dieliminasi pada reaksi fase II. Tahap
metabolik untuk detoksifikasi melibatkan glutathione, yang mengikat senyawa beracun
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
19
Isoniazid
Isoniazid merupakan hidrazid dari isonicitinic acid, menghambat sintesis
mycolic acid komponen penting dinding sel mikobakteri. Isoniazid mudah diabsorbsi
pada pemberian oral maupun parenteral. Kadar puncak dicapai dalam waktu 1-2 jam
setelah pemberian per oral. Isoniazid mengalami asetilasi di hati dan kecepatan
metabolisme isoniazid dipengaruhi oleh faktor genetik yang secara bermakna
mempengaruhi kadar obat dalam plasma dan waktu paruh.37,38 Tingkat asetilasi manusia
ditentukan secara genetik dan dibagi menjadi asetilasi tipe lambat dan cepat.17
Keterlibatan arus asetilasi pada toksisitas isoniazid masih kontroversial. Penelitian awal
menunjukkan bahwa asetilator cepat lebih rentan terhadap perkembangan
antituberculosis drug-induced hepatotoxicity (ATDH). Penelitian terbaru menunjukkan
pada asetilator lambat berkembang ATDH lebih sering dan juga lebih berat dibanding
asetilator cepat. Asetilasi lambat lebih banyak isoniazid terhidrolisis langsung menjadi
hidrazin dan asetilhidrazin yang dapat diubah menjadi hidrazin.14,17
Penggunaan isoniazid pada penderita yang menunjukkan kelainan fungsi hati
akan menyebabkan bertambah parahnya kerusakan hati. Umur merupakan faktor yang
sangat penting untuk memperhitungkan risiko efek toksik isoniazid pada hati.
Kerusakan hati jarang terjadi pada penderita yang berumur dibawah 35 tahun. Kelainan
terbanyak adalah enzim transaminase yang meningkat. Hepatitis karena pemberian
isoniazid terjadi 4-8 minggu setelah pengobatan dimulai.37,38
Hepatotoksisitas karena isoniazid bukan hasil dari hipersensitivitas atau reaksi
alergi dan paling mungkin disebabkan oleh metabolit toksik. Hepatotoksisitas karena
isoniazid dianggap idiosinkratik. Reaksi idiosinkratik dapat mempengaruhi setiap
sistem organ dengan dimediasi Imunoglobulin E. Merupakan sindrom reaktif metabolit
yaitu metabolit reaktif yang dihasilkan lebih berperan dibanding obat itu sendiri.
Sindrom reaktif metabolit dapat pulih pada sebagian besar penderita.14
Jalur metabolik utama metabolisme INH adalah asetilasi oleh enzim hati
N-acetyl transferase 2 (NAT2). Isoniazid terasetilasi menjadi asetilisoniazid dan kemudian
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
20
terasetilasi menjadi hidrazin, atau menjadi diasetilhidrazin, seperti terlihat pada
gambar 3.14,17
Isoniazid sebagian kecil secara langsung dihidrolisis menjadi asam isonikotinat
dan hidrazin. Sebagian besar penelitian sebelumnya telah difokuskan pada hipotesis
bahwa asetilhidrazin adalah metabolit toksik isoniazid. Penelitian terbaru menyatakan
bahwa hidrazin kemungkinan besar menjadi penyebab hepatotoksisitas. Toksisitas
hidrazin telah digambarkan sejak awal tahun 1908 dan diketahui menyebabkan
kematian sel yang irreversible. Kerusakan hati yang terjadi dapat menjadi progresif dan
menyebabkan hepatitis fatal pada beberapa pasien.14,16
Gambar 3. Metabolisme isoniazid
Dikutip dari (14)
Rifampisin menunjukkan peningkatan reaksi idiosinkratik metabolik
hepatoselular pada pasien yang mendapat isoniazid, mungkin oleh peningkatan
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
21 nonspesifik menyerupai hepatitis virus dengan nekrosis nonzonal, dan masif pada lebih
dari 10% kasus berat. Subacute hepatic necrosis dapat terlihat pada 30% kasus.17
Penelitian terhadap genetik manusia menunjukkan bahwa pasien dengan
homozigot cytochrome P450 2E1 c1/c1(CYP2E1 c1/c1) host gene polymorphisme,
yang memiliki peningkatan aktivitas cytochrome P450 2E1, memiliki risiko
hepatotoksisitas lebih tinggi, khususnya asetilator lambat. Genetik CYP2E1 c1/c1
dikaitkan dengan aktivitas gen CYP2E1 yang lebih tinggi dan dapat menyebabkan
produksi hepatotoksin yang lebih tinggi. Penelitian pada tikus menunjukkan bahwa
isoniazid dan hidrazin menginduksi aktivitas CYP2E1. Isoniazid memiliki efek inhibisi
terhadap aktivitas CYP1A2, 2A6, 2C19, dan 3A4.57. Gen CYP1A2 diperkirakan
terlibat dalam detoksifikasi hidrazin. Isoniazid dapat menginduksi toksisitasnya,
kemungkinan disebabkan oleh induksi atau inhibisi enzim-enzim di atas.14,17
Rifampisin
Rifampisin adalah antibiotik derivat rifamisin dihasilkan oleh Steptomyces
mediterranei terutama digunakan sebagai obat anti tuberkulosis. Kadar puncak dalam
plasma tercapai setelah 2-4 jam pemberian rifampisin per oral. Rifampisin setelah
diserap dari saluran cerna cepat diekskresi melalui empedu dan kemudian mengalami
sirkulasi enterohepatik. Obat ini cepat mengalami deasetilasi sehingga dalam waktu
enam jam hampir semua obat yang berada dalam empedu berbentuk diasetil rifampisin
yang mempunyai aktivitas antibakteri penuh. Waktu paruh eliminasi rifampisin
bervariasi antara 1,5 – 5 jam dan memanjang bila ada kelainan fungsi hati. Penderita
tuberkulosis mengalami efek toksik kurang dari 4% dengan pemberian dosis biasa.
Efek samping paling sering muncul adalah ruam kulit, demam, mual, dan muntah.38
Jalur utama metabolisme rifampisin adalah deasetilasi menjadi deasetil
rifampisin dan secara terpisah terhidrolisis menghasilkan rifampisin 3-formil.
Rifampisin dapat menyebabkan disfungsi hepatoselular pada awal pengobatan yang
sembuh tanpa penghentian obat. Mekanisme rifampisin-induced hepatotoxicity tidak
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
22
Rifampisin mengaktifkan hepatocyte pregnane X receptors, menyebabkan
induksi sitokrom. Rifampisin juga menginduksi uridine
diphosphate-glucuronosyl-transferase dan transport P-glycoprotein yang terlibat dalam metabolisme obat lain.
Rifampisin adalah penginduksi kuat sistem sitokrom P-450 hepatik pada hati dan usus
sehingga meningkatkan metabolisme banyak senyawa lain. Penggunaan kombinasi
rifampisin dan isoniazid dihubungkan dengan peningkatan risiko hepatotoksisitas.
Rifampisin menginduksi isoniazid hidrolase sehingga plasma half life acetyl isoniazid
diperpendek dan cepat berubah menjadi metabolit aktif. Produksi hidrazin lebih cepat
dan lebih banyak ketika rifampisin dikombinasikan dengan isoniazid (terutama pada
asetilator lambat), maka terjadi toksisitas yang lebih tinggi. Pajanan hidrazin
menyebabkan pengurangan adenosine triphosphate (ATP), menghambat enzim
mitokondrial succinate dehydrogenase yang mengurangi fungsi mitokondria.
Selanjutnya hidrazin menyebabkan toksisitas dengan terlibat dalam sejumlah proses
metabolik seperti glukoneogenesis dan glutamine synthetase. Metabolisme hidrazin
diperkirakan meliputi produksi radikal bebas yang menginduksi toksisitas selular baik
oleh ikatan kovalen pada makromolekul jaringan atau dengan menginisiasi proses
autooksidatif seperti peroksidasi lipid in vivo. Integritas sel dipengaruhi oleh stress
oksidatif ketika produksi oksidan aktif melebihi mekanisme pertahanan antioksidan.
Penambahan hidrazin menginduksi peningkatan pembentukan ROS kemudian disfungsi
mitokondria dan atau menghambat sistem antioksidan. Rifampisin juga berinteraksi
dengan obat anti retroviral dan mempengaruhi tingkat plasma obat-obatan serta risiko
hepatotoksik.14,17-19
Pirazinamid
Waktu paruh (t½) pirazinamid lebih panjang dibanding isoniazid atau rifampisin,
mendekati 10 jam. Pasien dengan penyakit hepatik, t½ meningkat menjadi 15 jam.
Pirazinamid sebagai turunan asam nikotinik, dideamidasi menjadi pyrazinoic acid di
dalam hati dan sebagian dimetabolisme menjadi 5-hydroxy-pyrazinoic acid oleh xantine
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
23 mungkin dibentuk selama metabolisme pirazinamid. Pirazinamid mudah diserap di usus
dan tersebar luas ke seluruh tubuh. Ekskresi pirazinamid terutama melalui filtrasi
glomerulus. Pyrazinoic acid aktif mengalami hidroksilasi menjadi hydroyirazinoic acid
yang merupakan metabolit utama. Ginjal membersihkan metabolit pirazinamid,
diperlukan intermittent dosing pada pasien insufisiensi renal.4,17
Efek samping utama pirazinamid adalah hepatotoksisitas. Hepatotoksisitas
dapat terjadi sesuai dosis terkait dan dapat terjadi setiap saat selama terapi.16
Mekanisme toksisitas karena pirazinamid tidak diketahui. Enzim yang berperan dalam
toksisitas pirazinamid, dan apakah toksisitas disebabkan oleh pirazinamid atau
metabolitnya juga tidak diketahui. Pirazinamid menghambat aktivitas beberapa
isoenzim sitokrom P-450 (2B, 2C, 2E1, 3A) pada tikus tetapi penelitian di mikrosom
hati manusia menunjukkan bahwa pirazinamid tidak memiliki efek inhibisi terhadap
isoenzim sitokrom P-450.14 Pirazinamid menurunkan kadar nicotinamide acetyl
dehydrogenase pada hati tikus, hal ini mungkin menghasilkan spesies radikal bebas
yang diperkirakan berperan dalam mekanisme cidera untuk isoniazid dan pirazinamid,
sebab ada beberapa persamaan dalam struktur molekuler. Pasien yang sebelumnya
mendapat reaksi hepatotoksik dengan isoniazid mendapat reaksi lebih berat dengan
pemberian rifampisin dan pirazinamid.17
Etambutol
Etambutol dilaporkan tidak memiliki efek hepatotoksik, tetapi ada sedikit
laporan hepatotoksisitas dengan etambutol dalam pengobatan TB. Tes fungsi hati
abnormal telah dilaporkan pada beberapa pasien yang menggunakan etambutol
dikombinasi dengan OAT lain. Kombinasi ini yang menyebabkan hepatotoksisitas.16
Etambutol diserap ke dalam saluran pencernaan sebanyak 70-80% pada
pemberian secara oral. Kadar puncak dalam plasma dicapai dalam waktu 2-4 jam
setelah pemberian. Waktu paruh eliminasi 3-4 jam. Lima puluh persen etambutol yang
dikonsumsi, diekskresi dalam bentuk asal melalui urin, 10% sebagai metabolit, berupa
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
24 menimbulkan efek samping. Dosis harian sebesar 15 mg/kg BB/hari menimbulkan efek
toksik yang minimal. Dosis ini kurang dari 2% penderita akan mengalami efek samping
yaitu penurunan ketajaman penglihatan, ruam kulit, dan demam.38
Streptomisin
Waktu paruh streptomisin pada orang dewasa normal 2-3 jam dan dapat sangat
memanjang pada penderita gagal ginjal. Hampir semua streptomisin berada dalam
plasma setelah diserap dari tempat suntikan. Streptomisin diekskresi melalui filtrasi
glomerulus. Sekitar 50-60% dosis streptomisin yang diberikan secara parenteral
diekskresi dalam bentuk utuh dalam waktu 24 jam pertama. Ototoksisitas lebih sering
terjadi pada penderita, streptomisin dilaporkan tidak memiliki efek hepatotoksik.
6,14,19,24
2.7. MANIFESTASI KLINIS HEPATOTOKSISITAS IMBAS OBAT ANTI
TUBERKULOSIS
Gambaran klinis hepatoksisitas imbas obat sulit dibedakan secara klinis dengan
penyakit hepatitis atau kolestasis dengan etiologi lain. Riwayat pemakaian obat-obat
atau substansi-substansi hepatotoksik lain harus dapat diungkap. Cidera hati mungkin
timbul atau memerlukan waktu beberapa minggu atau bulan. Cidera hati dapat berupa
nekrosis hepatosit, kolestasis, disfungsi hati. Gambaran klinis pada hepatitis kronis
akibat virus atau autoimun, tidak dapat dibedakan dengan hepatitis kronis akibat obat,
baik secara klinis maupun histologis, sehingga pemeriksaan serologis virus sering
dipakai untuk mengetahui perbedaannya.32
Presentasi klinis hepatitis akibat OAT mirip dengan hepatitis virus akut. Obat
antituberkulosis bisa menyebabkan hepatotoksisitas dengan tingkat gejala yang
bervariasi dari asimptomatik hingga simptomatik seperti keletihan, demam, hilang
selera makan, mual, muntah, anoreksia, jaundice, sklera ikterik, pusing, kencing warna
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
25
akut.16 Pasien TB yang sedang dalam pengobatan OAT menunjukkan gejala hepatitis
akut maka dapat dijadikan acuan diagnosis hepatotoksisitas imbas OAT telah
terjadi.16,27,31
Cidera pada hati baik akut atau kronis akhirnya menghasilkan peningkatan
konsentrasi serum aminotransferase. Aspartate aminotransferase (AST) dan alanine
aminotransferase (ALT) adalah enzim-enzim yang mengkatalisis transfer grupα-amino
dari aspartate dan alanine ke grup α-keto dari ketoglutaric acid untuk membentuk
oxaloacetic acid dan pyruvic acid, yang memberi kontribusi penting pada siklus citric
acid.19 Kedua aminotransferase terdapat pada konsentrasi tinggi di dalam hati.
Aspartate aminotransferase (AST) juga secara difus digambarkan di dalam jantung,
otot skeletal, ginjal, otak, dan sel darah merah, ALT berada dalam konsentrasi rendah di
dalam otot skeletal dan ginjal, peningkatan serum ALT lebih spesifik untuk kerusakan
hati. Alanine aminotransferase berlokasi hanya di dalam sitoplasma selular di hati,
berada di cytosolic (20% dari aktivitas total) dan mitokondria (80% dari aktivitas
total).19,35 Clearance aminotransferase dibawa keluar dari hati oleh sel sinusoidal.
Waktu paruh ALT di dalam sirkulasi sekitar 47 jam dan untuk AST sekitar 17 jam.19
2.8. PERAN N-ACETYLCYSTEINE MENCEGAH HEPATOTOKSISITAS
Penelitian pada binatang telah menunjukkan bahwa isoniazid dan rifampisin
menginduksi cidera oksidatif dapat dicegah dengan N-acetylcysteine (NAC) yang
membantu mekanisme pertahanan antioksidan selular.5 N-acetyl-cysteine bahan untuk
sintesis glutathione, menghambat cidera hati karena isoniazid pada tikus, dengan
hubungan yang tidak diketahui pada manusia.17 Observasi efek hepatoprotektif N
-acetylcysteine pada tikus yang diobati dengan isoniazid dan rifampisin lebih
mendukung keterlibatan stres oksidatif. Pasien TB dengan antituberculosis
drug-induced hepatitis (ATDH) memiliki penurunan kadar glutathione plasma dan kadar
malondialdehid lebih tinggi, yang merupakan parameter dari sebuah stress oksidatif,
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
26 Satu penelitian telah melaporkan perbaikan histopatologi hati dan pengurangan
stress oksidatif oleh NAC pada non-alcoholic fattysteatosis (NASH) pada tikus model.
Penelitian baru telah melaporkan penurunan signifikan steatosis hati dan fibrosis pada
pasien dengan NASH yang mendapat metformin dan NAC. Kemampuan NAC
mengeblok perkembangan lipid peroksidase ditunjukkan dalam pencegahan onset
non-alcoholic fatty liver disease (NAFLD) dengan pemberian S-nitroso-N-acetylcysteine
pada tikus dan perbaikan histologi hati pada tikus dengan NASH setelah terapi NAC.25
2.9. N-ACETYLCYSTEINE SEBAGAI PREKURSOR GLUTATHIONE
N-acetylcysteine (NAC) dikenal sebagai antioksidan kimia nontoksik digunakan
mengobati berbagai gangguan.15 N-acetylcysteine adalah bentuk modifikasi dari asam
amino cysteine, dengan atom nitrogen dari grup amino ditempelkan ke grup acetyl.
Rumus kimianya adalah C5H9NO3S, berat molekul 163,2 g/mol. Bentuk N-acetyl dari
cysteine mempermudah penyerapan oleh tubuh. Obat bisa diberikan secara oral,
intravena, dan melalui nebulizer respiratorik. N-acetylcysteine diserap cepat setelah
pemberian secara oral baik pada binatang maupun manusia. Konsentrasi plasma
maksimum dicapai 2-3 jam setelah pemberian dan waktu paruh 6,3 jam.39-41
Metabolisme ekstensif NAC terjadi di hati dan usus kecil tempat terjadi
deasetilasi. Deasetilasi adalah proses enzimatik esensial untuk membentuk glutathione.
Metabolisme pada manusia terutama dikatalisis oleh enzim acylase I (N-acylamino acid
amidohydrolase) termasuk kelompok enzim acylase, yaitu enzim cytosolic yang
mengkatalisis deasetilasi N-acyl-L-amino acids sehingga menghasilkan asam lemak dan
asam amino.42 Setelah dideasetilasi, NAC menjadi L-cysteine, masuk ke dalam sel dan
berperan sebagai prekursor sintesis glutathione. Cysteine yang terbentuk bergabung
dengan glutamate membentuk glutamylcysteine dikatalisis oleh enzim
glutamate-cysteine ligase. Selanjutnya glutamylcysteine bergabung dengan glycine membentuk
glutathione (GSH) dengan dikatalisis enzim glutathione synthase. N-acetylcysteine
commit to user
Bagian Pulmonologi dan Ilmu Kedokteran Respirasi FK UNS / RSUD Dr.Moewardi, 2012
27 hepatik. Deasetilasi sangat efisien, dalam sirkulasi vena porta, konsentrasi metabolit
300 - 500% lebih tinggi dibanding obat induk.42-46
Peran klinis utama NAC adalah pengobatan overdosis acetaminophen.
Acetaminophen dimetabolisme oleh hati, menghasilkan N-acetylbenzoquinoneimine
(NAPQI) yang menyebabkan deplesi glutathione hepatik. Pemberian NAC mengisi lagi
persediaan glutathione dan mengurangi cidera hati. Pengobatan efektif terutama jika
diberikan dalam 10 jam dari overdosis.41 Kecuali penggunaan NAC untuk keracunan
acetaminophen tidak ada antidotum spesifik terhadap setiap obat.31
Dosis besar NAC biasanya diberikan untuk merespons overdosis acetaminophen
yaitu loading dose 140 mg/kg dilanjutkan dosis maintenance 70 mg/kg tiap 4 jam
sampai acetaminophen serum tidak terdeteksi. Dosis tersebut dapat menyebabkan mual,
muntah, gangguan gastrointestinal, rash, pruritus, angioedema, bronkospasme,
takikardi, hipotensi atau hipertensi, tetapi kejadian-kejadian tersebut jarang.47,48
Efek antioksidan secara langsung dan tak langsung ditunjukkan oleh NAC. Efek
langsung ini adalah interaksi dengan kelompok elektrofilik [radikal hidroksil (-OH)]
reactive oxygen species (ROS). Interaksi dengan ROS ini menyebabkan pembentukan
intermediate thiol NAC, dengan NAC disulfide sebagai hasil akhir utama. Efek
antioksidan tak langsung NAC berhubungan dengan perannya sebagai prekursor
glutathione. Glutathione adalah tripeptida yang terbuat dari glutamic acid, cysteine, dan
glycine. Pemeliharaan adekuat kadar glutathione intraseluler penting untuk
menanggulangi efek buruk zat toksik.41,43
Glutathione memainkan peran kunci dalam pertahanan seluler melawan
kerusakan oksidatif. Glutathione tidak dapat masuk sel hepatik, karena itu harus
disintesis in situ dari prekursornya glycine, glutamate, dan cysteine. Komponen cysteine
terbatas, dan kelompok sulfhidril cysteine memberikan glutathione kekuatan
antioksidan.41 Ketersediaan asam amino untuk pengaturan sintesis glutathione adalah
faktor fundamental. Glutamic acid dan glycine tersedia berlimpah-limpah dalam tingkat
seluler, tetapi tidak demikian dengan cysteine, maka sintesis glutathione bergantung