PETAI (Parkia speciosa Hassk.) TERHADAP Staphylococcus aureus dan Escherichia coli Aloysius Ade Pratama
118114150
INTISARI
Penyakit infeksi merupakan salah satu faktor penyebab kematian di seluruh dunia. Selain virus dan jamur, bakteri juga dapat menyebabkan infeksi diantaranya, Staphylococcus aureus dan Escherichia coli. Kulit batang pohon petai (Parkia speciosa) mengandung alkaloid dan fenolik. Biji petai sering digunakan masyarakat sebagai makanan sedangkan kulit batang pohon petai jarang digunakan. Oleh sebab itu, perlu dilakukan penelitian terkait dengan distribusi senyawa dalam kulit batang pohon petai dan potensi senyawa tersebut sebagai antibakteri.
Penelitian ini bertujuan untuk mengetahui aktivitas antibakteri ekstrak etanol kulit batang pohon petai yang dilanjutkan dengan menentukan Kadar Hambat Minimum (KHM) dan Kadar Bunuh Minimum (KBM) terhadap Staphylococcus aureus dan Escherichia coli. Pengujian aktivitas antibakteri menggunakan metode difusi padat dan penentuan KHM dan KBM menggunakan metode dilusi cair. Jenis penelitian ini termasuk eksperimental murni.
Data yang diperoleh dianalisis menggunakan Shapiro Wilk untuk distribusi data,
Levene Test untuk homogenitas data, Kruskal Wallis untuk mengetahui perbedaan bermakna secara menyeluruh, dan Mann-Whitnney untuk mengetahui kebermaknaan antar konsentrasi, kontrol positif dan kontrol negatif.
Hasil penelitian menunjukkan bahwa ekstrak etanol kulit batang pohon petai mampu menghambat bakteri Staphylococcus aureus tetapi tidak mampu menghambat Escherichia coli. KHM dari ekstrak etanol kulit batang pohon petai terhadap bakteri Staphylococcus aureus sebesar 21,875% dan KBM pada konsentrasi 21,875% belum diperoleh.
Infection disease is one of the causes of death in the world. In addition to viruses and fungi, bacteria also can cause infections such Staphylococcus aureus and Escherichia coli. The tree bark of Parkia speciosa contain the alkaloid and phenolic. Parkia speciosa seeds are often used by people as food, while the tree bark of Parkia speciosa is rarely used. Therefore, it is necessary to do research related to the distribution of compounds in the tree bark of Parkia speciosa and the potential of these compounds as antibacterial.
This study aims to determine the antibacterial activity of ethanol extract of the tree bark of Parkia speciosa, followed by determining the Minimum Inhibition Concentration (MIC) and Minimum Bactericidal Concentration (MBC) against Staphylococcus aureus and
Escherichia coli. Testing of antibacterial activity using solid diffusion method and determination of MIC and MBC using liquid dilution method. This type of research is purely experimental.
The data obtained were analyzed using Shapiro Wilk to see the data distribution, Levene Test for viewing data homogeneous, Kruskal Wallis for knowing the significant differences overall, and the Mann-Whitnney to determine the significance between concentration, positive and negative control. The results showed that the ethanol extract of the tree bark of Parkia speciosa is able to inhibit Staphylococcus aureus but are not capable of inhibiting Escherichia coli. MIC of an ethanol extract of the tree bark of Parkia speciosa
obtained against bacteria Staphylococcus aureus is 21,875% and MBC of this concentrations has not been obtained.
1
UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL KULIT BATANG POHON PETAI (Parkia speciosa Hassk.) TERHADAP Staphylococcus aureus
dan Escherichia coli
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Farmasi
Oleh:
Aloysius Ade Pratama NIM : 118114150 FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL KULIT BATANG POHON PETAI (Parkia speciosa Hassk.) TERHADAP Staphylococcus aureus
dan Escherichia coli
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Farmasi
Oleh:
Aloysius Ade Pratama NIM : 118114150
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iii
v
Halaman Persembahan
“TERJADILAH PADAKU SETURUT KEHENDAK-MU”
“Aku ingin mendaki puncak tantangan, menerjang batu granit kesulitan,
menggoda mara bahaya, dan memecahkan misteri dengan sains. Aku ingin menghirup berupa-rupa pengalaman lalu terjun bebas menyelami labirin lika-liku
hidup yang ujungnya tak dapat disangka. Aku mendamba kehidupan dengan kemungkinan-kemungkinan yang bereaksi satu sama lain seperti benturan molekul uranium: meletup tak terduga-duga, menyerap, mengikat, mengganda,
berkembang, terurai, dan berpencar ke arah yang mengejutkan. Aku ingin kehidupan yang menggetarkan, penuh dengan penaklukan.
(Andrea Hirata-Edensor)
Aku persembahkan karyaku ini untuk:
Tuhan Yesus dan Bunda Maria,
Bapa, mama beserta adikku
vii PRAKATA
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala perlindungan dan berkat, kasih dan sayang, serta tuntunan yang diberikan
sehingga skripsi berjudul “UJI AKTIVITAS ANTIBAKTERI EKSTRAK
ETANOL KULIT BATANG POHON PETAI (Parkia speciosa Hassk.) TERHADAP Staphylococcus aureus dan Escherichia coli” dengan baik dan lancar.
Penulis menyadari bahwa penulisan skripsi ini tidak terlepas dari berbagai pihak. Kesempatan ini, penulis pergunakan untuk mengungkapkan rasa terima kasih kepada:
1. Ibu Aris Widayati, M. Si., Ph.D., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma.
2. Bapak Yohanes Dwiatmaka, M. Si. selaku dosen pembimbing skripsi yang telah membimbing, mendampingi dan memberikan arahan, evaluasi serta kritik dan saran mulai dari pembuatan proposal penelitian hingga penulisan skripsi ini selesai.
3. Ibu Dr. Yustina Sri Hartini, M. Si., Apt. selaku dosen penguji yang telah meluangkan waktu untuk memberi kritik dan saran selama penulisan skripsi. 4. Ibu Damiana Sapta Candrasari, S. Si., M. Sc. selaku dosen penguji yang telah
meluangkan waktu untuk memberi kritik dan saran selama penulisan skripsi. 5. Ibu Agustina Setiawati, M. Sc., Apt. selaku Kepala Penanggungjawab
viii
6. Ibu Maria Dwi Budi Jumpowati, S. Si. atas masukan dan arahan dalam bidang Mikrobiologi.
7. Bapak Ir. Ignatius Aris Dwiatmoko, M. Sc. atas masukan dan arahan dalam bidang statistik.
8. Bapak Mukminin, Bapak Wagiran, Bapak Kunto, Bapak Parlan, serta semua laboran yang telah membantu selama proses penelitian di laboratorium.
9. Anisetus Ratnasari Jebarus, Sabrina Handayani Tambun dan Metta Maurilla atas bantuannya baik tenaga maupun ide-ide cemerlangnya serta motivasi dalam suka dan duka selama penelitian di laboratorium.
10.Keluargaku tercinta, Bapak Matius Daryono, Mama Dra. M.M Iin Sarkinah, Adikku tercinta Veronika Yuli Indarwati yang selalu memberikan dukungan, doa, kasih sayang, dan semangat kepada penulis.
11.Teman-teman FKK dan FST 2011 atas doa dan dukungan.
12.Semua pihak yang tidak dapat penulis sebutkan satu per satu sehingga penulis dapat menyelesaikan tugas akhir ini dengan baik.
Penulis menyadari bahwa naskah skripsi ini masih banyak kekurangan dengan keterbatasan yang ada sehingga penulis membuka diri terhadap semua kritik dan saran dari semua pihak yang membangun untuk kemajuan diri dan ilmu pengetahuan. Akhir kata, penulis berharap semoga naskah skripsi ini dapat bermanfaat bagi semua pihak terutama di bidang Farmasi.
ix DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... iv
HALAMAN PERSEMBAHAN ... v
PERNYATAAN KEASLIAN KARYA ... vi
PRAKATA ... vii
DAFTAR ISI ... ix
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
INTISARI ... xvii
ABSTRACT ... xviii
BAB I PENGANTAR ... 1
A. LATAR BELAKANG ... 1
1. Permasalahan ... 3
2. Keaslian Penelitian ... 4
3. Manfaat Penelitian ... 5
B. TUJUAN PENELITIAN ... 6
x
2. Tujuan Khusus ... 6
BAB II PENELAAHAN PUSTAKA ... 7
A. Petai ... 7
B. Staphylococcus aureus ... 8
1. Morfologi dan Fisiologi ... 8
2. Patogenesis ... 9
C. Escherichia coli ... 10
1. Morfologi dan Fisiologi ... 10
2. Patogenesis dan Gejala Penyakit ... 10
D. Ekstraksi ... 11
E. Alkaloid ... 14
F. Fenolik ... 15
G. Terpenoid ... 16
H. Flavonoid ... 17
I. Metode Pengujian Aktivitas Antibakteri ... 18
1. Metode Difusi ... 18
2. Metode Dilusi ... 19
J. Landasan Teori ... 19
K. Hipotesis ... 21
BAB III METODE PENELITIAN ... 23
A. Jenis dan Rancangan Penelitian ... 23
B. Variabel dan Defenisi Operasional ... 23
xi
2. Definisi Operasional ... 23
C. Bahan dan Alat Penelitian ... 24
D. Tata Cara Penelitian ... 25
1. Determinasi Kulit Batang Pohon Petai ... 25
2. Pengumpulan Kulit Batang Pohon Petai ... 26
3. Pengeringan dan Pembuatan Serbuk Kulit Batang Pohon Petai .... 26
4. Penetapan Susut Pengeringan Pada Serbuk Kulit Batang Pohon Petai ... 26
5. Pembuatan Ekstak Etanol Kulit Batang Pohon Petai ... 27
6. Identifikasi Kandungan Senyawa Kimia Kulit Batang Pohon Petai Dengan Uji Tabung ... 28
7. Uji Identifikasi Bakteri ... 30
8. Uji Potensi Ekstrak Etanol Kulit Batang Pohon Petai Terhadap S. aureus dan E. coli ... 31
9. Analisis Hasil ... 33
BAB IV HASIL DAN PEMBAHASAN ... 35
A. Determinasi dan Pengumpulan Tanaman ... 35
B. Pembuatan Serbuk Simplisia Kulit Batang Pohon Petai ... 36
C. Penetapan Susut Pengeringan Serbuk Kulit Batang Pohon Petai ... 37
D. Pembuatan Ekstak Etanol Kulit Batang Pohon Petai ... 38
E. Skrining Fitokimia ... 40
xii
Terhadap S. aureus dan E. coli ... 51
H. Pengukuran Kadar Hambat Minimum (KHM) dan Kadar Bunuh Minimum (KBM) Ekstrak Etanol Kulit Batang Pohon Petai Terhadap S. Aureus Dengan Metode Dilusi Cair ... 59
BAB V KESIMPULAN DAN SARAN ... 64
A. Kesimpulan ... 64
B. Saran ... 64
DAFTAR PUSTAKA ... 65
LAMPIRAN ... 70
xiii
DAFTAR TABEL
Tabel I. Bobot Tetap Ekstrak Etanol Kulit Batang Pohon Petai ... 39 Tabel II. Hasil Pengamatan Uji Tabung Terhadap Larutan Uji Ekstrak
Kulit Batang Pohon Petai ... 40 Tabel III. Diameter Zona Hambat Yang Dihasilkan Seri Konsentrasi Ekstrak Etanol Kulit Batang Pohon Petai, Kontrol Positif dan Kontrol Negatif Terhadap S. aureus ... 53 Tabel IV. Kriteria Kekuatan Aktivitas Antibakteri ... 54 Tabel V. Kriteria Kekuatan Aktivitas Antibakteri Ekstrak Etanol Kulit Batang
Pohon Petai Terhadap Staphylococcus aureus ... 54 Tabel VI. Hasil Mann Withney – Wilcoxon Test Diameter Zona Hambat Seri
Konsentrasi Ekstrak Etanol, Kontrol Negatif dan Positif ... 56 Tabel VII. Hasil Pengukuran Absorbansi Pada Uji KHM dan KBM Ekstrak
xiv
DAFTAR GAMBAR
Gambar 1. Struktur Fenol ... 16
Gambar 2. Ekstrak Etanol Kulit Batang Pohon Petai ... 39
Gambar 3. Uji Pendahuluan ... 41
Gambar 4. Uji Saponin ... 42
Gambar 5. Uji Flavonoid ... 43
Gambar 6. Larutan Uji Pada Uji Alkaloid ... 43
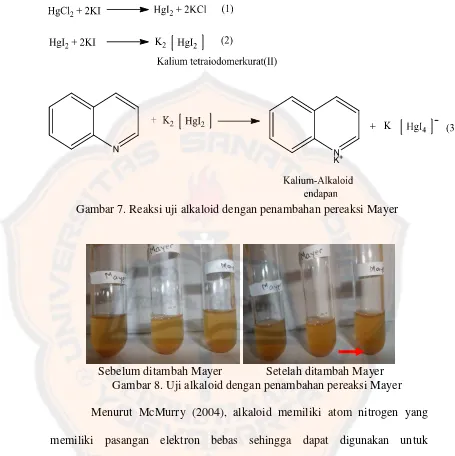
Gambar 7. Reaksi Uji Alkaloid dengan Penambahan Pereaksi Mayer ... 44
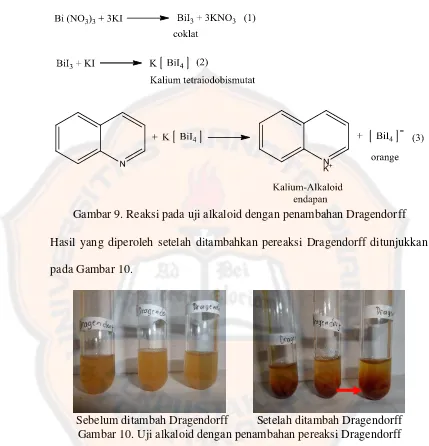
Gambar 8. Uji Alkaloid dengan Penambahan Mayer ... 45
Gambar 9. Reaksi Uji Alkaloid dengan Penambahan Pereaksi Dragendorff ... 45
Gambar 10. Uji Alkaloid dengan Penambahan Dragendorff ... 46
Gambar 11. Uji Tanin ... 47
Gambar 12. Uji Fenolik ... 48
Gambar 13. Uji Terpenoid ... 49
xv
DAFTAR LAMPIRAN
Lampiran 1. Surat Keterangan Keaslian Tanaman Petai
(Parkia speciosa Hassk.) ... 69
Lampiran 2. Surat Izin Melakukan Penelitian di Laboratorium Balai Kesehatan Yogyakarta ... 70
Lampiran 3. Sertifikat Hasil Uji Staphylococcus aureus ATCC 25923 ... 71
Lampiran 4. Sertifikat Hasil Uji Escherichia coli ATCC 25922 ... 72
Lampiran 5. Pereaksi-Pereaksi yang Digunakan Untuk Uji Fitokimia ... 73
Lampiran 6. Hasil Uji Identifikasi Staphylococcus aureus ... 74
Lampiran 7. Uji Identifikasi Bakteri Escherichia coli ... 77
Lampiran 8. Uji Aktivitas Antimikroba Difusi Sumuran Terhadap Staphylococcus aureus ... 80
Lampiran 9. Uji Aktivitas Antimikroba Difusi Sumuran Terhadap Escherichia coli ... 82
Lampiran 10. Hasil Pengukuran Diameter Zona Hambat Ekstrak Etanol Kulit Batang Pohon Petai ... 84
xvi INTISARI
Penyakit infeksi merupakan salah satu faktor penyebab kematian di seluruh dunia. Selain virus dan jamur, bakteri juga dapat menyebabkan infeksi diantaranya, Staphylococcus aureus dan Escherichia coli. Kulit batang pohon petai (Parkia speciosa) mengandung alkaloid dan fenolik. Biji petai sering digunakan masyarakat sebagai makanan sedangkan kulit batang pohon petai jarang digunakan. Oleh sebab itu, perlu dilakukan penelitian terkait dengan distribusi senyawa dalam kulit batang pohon petai dan potensi senyawa tersebut sebagai antibakteri.
Penelitian ini bertujuan untuk mengetahui aktivitas antibakteri ekstrak etanol kulit batang pohon petai yang dilanjutkan dengan menentukan Kadar Hambat Minimum (KHM) dan Kadar Bunuh Minimum (KBM) terhadap
Staphylococcus aureus dan Escherichia coli. Pengujian aktivitas antibakteri menggunakan metode difusi padat dan penentuan KHM dan KBM menggunakan metode dilusi cair. Jenis penelitian ini termasuk eksperimental murni.
Data yang diperoleh dianalisis menggunakan Shapiro Wilk untuk distribusi data, Levene Test untuk homogenitas data, Kruskal Wallis untuk mengetahui perbedaan bermakna secara menyeluruh, dan Mann-Whitnney
untuk mengetahui kebermaknaan antar konsentrasi, kontrol positif dan kontrol negatif.
Hasil penelitian menunjukkan bahwa ekstrak etanol kulit batang pohon petai mampu menghambat bakteri Staphylococcus aureus tetapi tidak mampu menghambat Escherichia coli. KHM dari ekstrak etanol kulit batang pohon petai terhadap bakteri Staphylococcus aureus sebesar 21,875% dan KBM pada konsentrasi 21,875% belum diperoleh.
xvii ABSTRACT
Infection disease is one of the causes of death in the world. In addition to viruses and fungi, bacteria also can cause infections such Staphylococcus aureus and Escherichia coli. The tree bark of Parkia speciosa contain the alkaloid and phenolic. Parkia speciosa seeds are often used by people as food, while the tree bark of Parkia speciosa is rarely used. Therefore, it is necessary to do research related to the distribution of compounds in the tree bark of Parkia speciosa and the potential of these compounds as antibacterial.
This study aims to determine the antibacterial activity of ethanol extract of the tree bark of Parkia speciosa, followed by determining the Minimum Inhibition Concentration (MIC) and Minimum Bactericidal Concentration (MBC) against Staphylococcus aureus and Escherichia coli. Testing of antibacterial activity using solid diffusion method and determination of MIC and MBC using liquid dilution method. This type of research is purely experimental.
The data obtained were analyzed using Shapiro Wilk to see the data distribution, Levene Test for viewing data homogeneous, Kruskal Wallis for knowing the significant differences overall, and the Mann-Whitnney to determine the significance between concentration, positive and negative control. The results showed that the ethanol extract of the tree bark of Parkia speciosa is able to inhibit Staphylococcus aureus but are not capable of inhibiting Escherichia coli. MIC of an ethanol extract of the tree bark of
Parkia speciosa obtained against bacteria Staphylococcus aureus is 21,875% and MBC of this concentrations has not been obtained.
1 BAB I
PENGANTAR
A. Latar Belakang
Penyakit infeksi merupakan salah satu penyakit yang sering diderita oleh masyarakat, seperti infeksi saluran kemih, pernapasan, pencernaan dan infeksi lainnya. Penyebab timbulnya penyakit infeksi adalah bakteri, virus dan jamur. Penyakit infeksi yang umumnya dialami oleh masyarakat Indonesia adalah diare dan pneumonia. Menurut hasil Riskesdas (2007), pneumonia merupakan penyebab kematian nomor dua pada balita (13,2%) setelah diare (17,2%). Penyakit diare merupakan penyebab kematian nomor satu pada bayi (31,4%) dan pada balita (25,2%), sedangkan pada golongan semua umur merupakan penyebab kematian yang keempat (13,2%).
Menurut Mardiastuti, Karuniawati, Kiranasari, Ikaningsih, dan Kadarsih, (2007) salah satu bakteri yang menyebabkan diare adalah bakteri Escherichia coli
dan penyakit infeksi saluran pernapasan umumnya disebabkan oleh bakteri
Staphylococcus aureus. Pada penelitian ini Staphylococcus aureus dan
Escherichia coli digunakan sebagai bakteri uji karena Staphylococcus aureus
peneliti melakukan eksplorasi bahan alam yang berpotensi sebagai antibakteri yaitu petai.
Berkaitan dengan distribusi senyawa dalam bagian tanaman petai dan potensi senyawa tersebut sebagai antibakteri, maka perlu dilakukan penelitian terkait distribusi kandungan senyawa aktif pada bagian tanaman petai lainnya seperti kulit batang pohon. Untuk mengetahui distribusi senyawa aktif pada kulit batang pohon petai maka peneliti melakukan penyarian menggunakan penyari yang sesuai untuk mempermudah menyari senyawa yang diduga berpotensi sebagai antibakteri tersebut di atas berdasarkan kelarutannya. Menurut Agnes, Lois, Aning, dan Nani (2013), salah satu pelarut yang dapat digunakan sebagai penyari adalah etanol. Etanol digunakan sebagai penyari karena dapat menyari senyawa yang bersifat semi polar sampai polar sehingga kandungan kimia yang diharapkan dapat tersari dengan baik sesuai dengan kepolarannya. Berdasarkan potensi antibakteri yang terdapat pada tanaman petai, maka tanaman petai dapat digunakan sebagai bahan baku dalam pembuatan antibiotik baru.
1. Permasalahan
a. Kandungan kimia apa saja yang terkandung dalam ekstrak etanol kulit batang pohon petai yang bermanfaat sebagai antibakteri?
b. Apakah ekstrak etanol kulit batang pohon petai memiliki aktivitas antibakteri terhadap Staphylococcus aureus dan Escherichia coli ?
c. Berapa kadar hambat minimum (KHM) dan kadar bunuh minimum (KBM) ekstrak etanol kulit batang pohon petai terhadap Staphylococcus aureus dan
2. Keaslian penelitian
Sejauh pengamatan penulis, penelitian dengan judul “Uji Aktivitas
Antibakteri Ekstrak Etanol Kulit Batang Pohon Petai (Parkia speciosa Hassk.) Terhadap Staphylococcus aureus Dan Escherichia coli” belum pernah
dilakukan. Penelitian sebelumnya yang berkaitan dengan uji aktivitas antibakteri kulit buah petai yaitu:
a. Uji aktivitas antibakteri ekstrak biji petai terhadap pertumbuhan bakteri
Helicobacter pylori dan Escherichia coli (Sakunpak dan Panichayupakaranant, 2012).
b. Potensi antibakteri ekstrak metanol biji petai terhadap Helicobacter pylori,
ekstrak etil asetat biji Parkia speciosa Hassk terhadap Eschericia coli, suspensi air biji petai menghambat pertumbuhan Aeromonas hydrophila,
Staphylococcus aureus, Streptococcus agalactiae, Streptococcus anginosus, dan Vibrio parahaemolyticu (Kamisah, dkk., 2013).
c. Aktivitas antibakteri ekstrak kulit petai (Parkia speciosa Hassk.) terhadap bakteri Escherichia coli dan Staphylococcus aureus (Kurnawati, 2014).
d. Fraksinasi ekstrak kulit petai berpotensi antioksidan (Mahardika, 2013). Hasil uji identifikasi pada penelitian tersebut adalah kulit petai mengandung alkaloid, flavonoid, saponin, dan tanin.
Perbedaan penelitian yang dilakukan oleh penulis dengan penelitian lainnya adalah pada penelitian yang dilakukan oleh Sakunpak dan Panichayupakaranant (2012) menggunakan biji petai yang diekstraksi dengan etil asetat; sedangkan penelitian yang dilakukan penulis menggunakan kulit batang pohon petai yang diekstraksi dengan etanol 70%. Penelitian yang dilakukan Kamisah, dkk (2013) dilakukan di Malaysia menggunakan biji petai dengan penyari metanol, etil asetat dan air; sedangkan penelitian yang dilakukan penulis berada di Indonesia dengan penyari etanol. Selain itu, penelitian yang dilakukan Kurnawati (2014), serbuk kulit petai diekstraksi dengan ultrasonikasi secara bertingkat dengan pelarut n-heksana, etil asetat, dan etanol 70%; sedangkan penelitian yang dilakukan penulis menggunakan metode ekstraksi maserasi mekanik (shaker) dengan etanol 70% dan sampel yang digunakan adalah kulit batang pohon petai yang diambil di Kabupaten Sleman.
3. Manfaat penelitian a. Manfaat teoritis
Penelitian ini diharapkan dapat mengembangkan khasanah ilmu pengetahuan khususnya di bidang kesehatan tentang penggunaan kulit batang pohon petai yang berkhasiat sebagai antibakteri.
b. Manfaat praktis
penyakit infeksi yang disebabkan oleh Staphylococcus aureus dan
Escherichia coli.
B. Tujuan Penelitian 1. Tujuan umum
Tujuan umum dari penelitian ini adalah untuk mengetahui aktivitas antibakteri ekstrak etanol kulit batang pohon petai terhadap
Staphylococcus aureus dan Escherichia coli. 2. Tujuan khusus
a. Mengetahui kandungan kimia yang terdapat dalam ekstrak etanol kulit batang pohon petai yang bermanfaat sebagai antibakteri.
b. Mengetahui kadar hambat minimal (KHM) dan kadar bunuh minimal (KBM) dari ekstrak etanol kulit batang pohon petai terhadap
7 BAB II
PENELAAHAN PUSTAKA
A. Petai
1. Menurut Plantamor (2008) diklasifikasikan sebagai berikut: Kingdom : Plantae
Subkingdom : Tracheobionta Super Divisi : Spermatophyta Divisi : Magnoliophyta
Kelas : Magnoliopsida
Sub Kelas : Rosidae
Ordo : Fabales
Famili : Fabaceae
Genus : Parkia
Spesies : Parkia speciosa Hassk. 2. Uraian tanaman
muda dan belum mekar bewarna hijau. Setelah dewasa, bunga petai berubah menjadi warna kuning. Batang pohon berwarna coklat dan keras. Kulit buah berbentuk polong panjang dan pipih. Biji tersusun rapi dalam polong yang menggantung di pohon dan pada setiap polong terdapat 10-18 biji. Akar tanaman petai berbentuk tunggang dan berwarna coklat (Adi, 2008).
3. Kandungan kimia
Tanaman petai mengandung zat kimia seperti alkaloid, saponin, terpenoid, fenolik, flavonoid dan tanin. Beberapa dari senyawa tersebut berpotensi sebagai antibakteri. Bagian tanaman petai seperti kulit batang pohon petai mengandung alkaloid dan fenolik (Kamisah, dkk, 2013).
B. Staphylococcus aureus 1. Morfologi dan fisiologi
Staphylococcus aureus termasuk dalam family Micrococcaceae dan termasuk dalam golongan bakteri Gram positif. Bakteri ini berbentuk bulat sedangkan koloni mikroskopiknya berbentuk seperti buah anggur. Koloni bakterinya dapat ditemukan di saluran hidung dan di bagian tubuh yang lain. Bakteri ini bersifat anaerob fakultatif dan menghasilkan enzim katalase. Bakteri Staphylococcus aureus dapat tumbuh dalam larutan NaCl 15 %.
optimumnya adalah 350C. Staphylococcus aureus memiliki daya tahan paling kuat diantara semua bakteri yang tidak membentuk spora. Pada agar miring, Staphylococcus aureus dapat hidup hingga berbulan-bulan, baik dalam lemari es maupun pada suhu kamar. Dalam keadaan kering pada benang, kertas, kain, dan dalam nanah, bakteri ini dapat hidup selama 6-14 minggu (Radji, 2009).
2. Patogenesis
C. Escherichia coli 1. Morfologi dan fisiologi
Escherichia coli merupakan bakteri Gram negatif yang banyak ditemukan pada ileum caudal, termasuk dalam famili Enterobacteriaceae, berbentuk batang pendek (kokobasil), memiliki flagel, berukuran 0,4 - 0,7 µm x 1,4 µm. Pada lingkungan yang kurang baik dapat membentuk spora, dan merupakan mikroba anaerob fakultatif. Escherichia coli akan bersifat patogen apabila berada di luar saluran pencernaan dan pada saat kondisi tubuh lemah (Radji, 2009).
2. Patogenesis dan gejala penyakit
Kolonisasi Escherichia coli dalam saluran cerna biasa terjadi setelah 40 hari dilahirkan. Escherichia coli dapat bertahan dan melekat di usus besar selama beberapa bulan bahkan beberapa tahun. Perubahan populasi bakteri Escherichia coli dapat terjadi dalam periode yang lama, hal ini terjadi setelah infeksi usus atau setelah penggunaan kemoterapi atau antimikroba yang dapat membunuh flora normal (Radji, 2009).
Escherichia coli menjadi penyebab infeksi manusia, seperti infeksi saluran kemih, infeksi saluran meningitis pada neonates, dan infeksi
adanya adhesin, invasion, jenis toksin yang diproduksi, dan kemampuan mengatasi pertahanan tubuh hospes (Radji, 2009).
Infeksi Escherichia coli sering kali berupa diare yang disertai darah, kejang perut, demam, dan terkadang dapat menyebabkan gangguan pada ginjal. Sekitar 2-7% infeksi Escherichia coli pada beberapa penderita, misalnya anak-anak di bawah 5 tahun dan orang tua, dapat menimbulkan komplikasi yang disebut dengan sindrom uremik hemolitik. Sebagian besar penyakit yang disebabkan oleh infeksi Escherichia coli ditularkan melalui makanan yang tidak dimasak dan daging yang terkontaminasi. Penularan penyakit ini dapat terjadi melalui kontak langsung dan biasanya terjadi di tempat yang memiliki sanitasi dan lingkungan yang kurang bersih (Radji, 2009).
D. Ekstraksi
Jenis-jenis metode ekstraksi yang dapat dilakukan diantaranya adalah ekstraksi menggunakan pelarut, yakni:
1. Cara dingin
a. Maserasi adalah proses penyarian simplisia menggunakan pelarut dan dilakukan beberapa kali penggojogan atau pengadukan pada suhu kamar (ruang). Secara teknologi maserasi termasuk ekstraksi dengan prinsip metode pencapaian konsentrasi pada keseimbangan. Maserasi kinetik adalah proses maserasi yang pengadukannya dilakukan secara kontinyu (terus-menerus). Remaserasi merupakan pengulangan penambahan pelarut. Pengulangan penambahan pelarut dilakuakan setelah penyaringan maserat pertama dan seterusnya.
b. Perkolasi adalah metode ekstraksi yang menggunakan pelarut selalu baru sampai sempurna (exhaustive extraction) yang umumnya dilakukan pada temperature ruang. Proses ekstraksi terdiri dari tahapan pengembangan bahan, tahap maserasi bahan dan tahap perkolasi sebenarnya (penetesan / penampungan ekstrak). Tahapan ini dilakukan terus-menerus sampai diperoleh perkolat (ekstrak) yang jumlahnya 1-5 kali bahan.
2. Cara panas
pengulangan proses pada residu 3-5 kali sehingga proses refluks ini termasuk proses ekstraksi sempurna.
b. Sokhlet merupakan metode ekstraksi yang menggunakan pelarut yang selalu baru yang umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinyu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
c. Digesti adalah maserasi kinetik dengan pengadukan berkala pada suhu yang lebih tinggi dari suhu ruang (kamar), yaitu secara umum dilakukan pada 40-500C.
d. Infus merupakan ekstraksi dengan menggunakan air sebagai pelarut pada suhu penangas air mendidih, suhu terukur 96- 980C selama waktu tertentu (15-20 menit).
e. Dekok adalah metode infusa yang memerlukan waktu yang lebih lama (lebih dari 30 menit) dan titik didihnya sampai titik didih air (1000C). f. Destilasi uap adalah ekstraksi senyawa kandungan yang menguap
E. Alkaloid
Alkaloid merupakan suatu golongan senyawa organik yang banyak ditemukan di alam. Alkaloid dapat ditemukan dalam berbagai bagian tumbuhan seperti biji, daun, ranting dan kulit batang. Semua alkaloid mengandung paling sedikit satu atom nitrogen yang biasanya bersifat basa dan dalam sebagian besar atom nitrogen ini merupakan bagian dari cincin heterosiklik (Lenny, 2006).
Menurut Soegihardjo (2013), peran alkaloid dalam tumbuhan antara lain berperan dengan keberadaan asam organik tertentu, misalnya alkaloid opium berhubungan dengan adanya asam mekonat, alkaloid kinkona terkait dengan asam kuinat dan kinkotonat. Selain itu, alkaloid berperan dalam berperan dalam hubungannya dengan oksigen in statu nascendi (oksigen singlet) yang berbahaya bagi organisme hidup, hal ini dibuktikan dengan adanya sinar UV yang kuat pada tumbuhan akan meningkatkan biosintesis alkaloid. Selain itu, menurut Robinson (1991), alkaloid berfungsi sebagai senyawa antibakteri. Mekanisme alkaloid sebagai antibakteri adalah dengan mengganggu komponen penyusun peptidoglikan pada sel bakteri sehingga lapisan dinding selnya tidak terbentuk secara utuh dan menyebabkan kematian sel.
pekat, asam nitrat pekat, dan fluoresensi. Kelarutan alkaloid dalam farmasi sangat penting karena perbedaan kelarutan antara alkaloid bebas dan garamnya, terutama berkaitan dengan isolasinya dari bahan tumbuhan. Alkaloid bebas umumnya sedikit larut dalam air, tetapi larut dalam pelarut organik, sedangkan kebalikannya pada garamnya kecuali garam sulfas kinina yang kelarutannya dalam air (1 : 1000), sedangkan kinina hidroklorida larut dalam air kurang dari satu bagian (Soegihardjo, 2013).
F. Fenolik
Menurut Fessenden (1986), fenolik merupakan senyawa yang banyak ditemukan pada tumbuhan. Fenolik memiliki cincin aromatik dengan satu atau lebih gugus hidroksi (OH-) dan gugus-gugus penyerta lainnya. Senyawa ini diberi nama berdasarkan nama senyawa induknya, fenol. Fenol biasanya dikelompokkan berdasarkan jumlah atom karbon pada kerangka penyusunnya.
antibakterinya adalah dengan membentuk senyawa kompleks terhadap protein ekstraseluler yang mengganggu integritas membrane sel bakteri.
[image:36.612.103.531.168.565.2]OH
Gambar 1. Struktur fenol
G. Terpenoid
Terpenoid adalah golongan hidrokarbon yang banyak ditemukan dalam tumbuhan terutama pada getah dan vakuola selnya. Semua senyawa golongan terpen atau terpenoid dan turunannya termasuk hasil metabolit sekunder. Terpen atau terpenoid mempunyai aktivitas antibakteri, antivirus dan antiprotozoa (Salni, Hanifa, dan Ratna, 2011).
H. Flavonoid
Flavonoid adalah suatu golongan senyawa fenol terbesar yang ditemukan di alam. Flavonoid memiliki warna merah, ungu, biru, dan sebagai zat kuning yang terkandung dalam tumbuhan. Senyawa ini memiliki struktur dasar karbon yang terdiri dari 15 atom karbon, dimana dua cincin benzen (C6) terikat pada rantai propana (C3) sehingga terbentuk susunan C6-C3-C6 (Lenny, 2006).
Flavonoid memiliki beberapa gugus hidroksil, gula dan flavonoid adalah senyawa polar sehingga flavonoid cukup larut dalam pelarut polar seperti etanol, metanol, butanol, aseton, dimetilsulfoksida (DMSO), dimetilformamida (DMF), air dan lain-lain. Senyawa ini juga memiliki aktivitas antibakteri (Subramani, 2002; Rosidah dan Afizia, 2012).
Mekanisme antibakteri dari flavonoid adalah membentuk senyawa kompleks dengan protein ekstraseluler dan larut sehingga dapat merusak membran sel bakteri dan senyawa intraseluler pun ikut keluar (Nuria, Arvin, Sumantri, 2009). Selain itu, flavonoid dapat merusak permeabilitas dinding sel bakteri (Sabir, 2008).
I. Metode Pengujian Aktivitas Antibakteri
1. Metode difusi
Metode difusi merupakan metode yang digunakan untuk mengukur potensi antibakteri berdasarkan pengamatan luas zona jernih yang terbentuk di sekitar tempat penginokulasian obat/ekstrak karena terdifusinya obat/ekstrak (Jawetz, Melnick, Brooks, dan Adelberg, 2005). Terdapat beberapa cara metode difusi, salah satunya ialah metode sumuran Kirby Bauer. Metode ini merupakan metode untuk menguji senyawa kimia yang terkandung dalam tanaman yang berpotensi sebagai antimikroba berdasarkan pada ukuran zona inhibisi pertumbuhan kultur bakteri di sekitar disk yang diresapi dengan obat antimikroba. Metode ini dilakukan dengan membuat lubang pada agar padat yang telah diinokulasi dengan bakteri (Mpila, Fatimawai, dan Weny, 2012). Jumlah dan letak lubang sumuran disesuaikan dengan tujuan penelitian, kemudian lubang sumuran diinjeksikan dengan ekstrak yang akan diuji. Setelah dilakukan inkubasi, pertumbuhan bakteri diamati untuk melihat ada tidaknya daerah hambatan di sekeliling lubang (Kusmayanti dan Agustini, 2007).
2. Metode dilusi
Prinsip metode dilusi adalah antibiotik diencerkan sehingga diperoleh beberapa macam kadar. Pada dilusi cair, setiap kadar sampel obat ditambahkan pada suspensi bakteri pada media kemudian diukur dengan spektrofotometri UV-VIS (UVmini-1240 UV-Vis Spectrophotometer
ditambahkan suspensi bakteri dan ekstrak. Pada dilusi padat setiap kadar obat dicampur dengan media agar kemudian ditanami bakteri. Pengamatannya dengan melihat ada tidaknya pertumbuhan bakteri atau tingkat kesuburan bakteri. Metode dilusi ini dapat digunakan untuk menentukan KHM dan KBM (Jawetz, dkk., 2005).
J. Landasan Teori
Penyakit infeksi merupakan salah satu penyakit yang sering diderita oleh masyarakat. Penyebab timbulnya penyakit infeksi adalah bakteri, virus dan jamur. Bakteri yang menimbulkan infeksi antara lain Staphylococcus aureus dan Escherichia coli. Oleh sebab itu, perlu dilakukan eksplorasi bahan alam yang memiliki potensi antibakteri dengan efek samping lebih kecil karena bahan alam mudah tersedia secara terus-menerus.
aureus dan Escherichia coli. Oleh sebab itu, peneliti melakukan eksplorasi bahan alam menggunakan tanaman yang sama yaitu petai yang berasal dari Kabupaten Sleman, Yogyakarta dengan bagian kulit batang pohon petai. Menurut Nitisapto dan Siradz (cit., Mahatriny, Payani, Oka dan Astuti, 2014), faktor lingkungan tanaman yang berbeda dapat mempengaruhi hasil metabolit sekunder tanaman. Faktor-faktor lingkungan yang dapat mempengaruhi adalah iklim, cahaya matahari, suhu, lingkungan atmosfer (CO2, O2, dan kelembaban), lingkungan perakaran (sifat kimia dan fisika tanah) dan ketersediaan air di dalam tanah.
Untuk mendapatkan senyawa kimia yang terkandung dalam kulit batang pohon petai maka dapat dilakukan dengan metode maserasi menggunakan penyari yang sesuai sehingga mempermudah menyari senyawa kimia tersebut berdasarkan kelarutannya. Salah satu pelarut yang digunakan sebagai penyari senyawa kimia yang terkandung dalam kulit batang pohon petai adalah etanol. Menurut Agnes, dkk (2013), etanol dapat digunakan sebagai penyari karena dapat menarik senyawa kimia yang bersifat semi polar sampai polar sehingga kandungan kimia yang diharapkan dapat tersari dengan optimal sesuai dengan kepolarannya.
hasilnya ditunjukkan dengan kadar terendah dari ekstrak etanol kulit batang pohon petai yang mampu menghambat dan membunuh pertumbuhan bakteri
Staphylococcus aureus dan Escherichia coli.
Penelitian terkait adanya aktivitas antibakteri ekstrak etanol kulit batang pohon petai terhadap Staphylococcus aureus dan Escherichia coli
diharapkan dapat memberikan informasi kepada masyarakat dan perkembangan ilmu pengetahuan mengenai manfaat kulit batang pohon petai sebagai salah satu terapi alternatif penyakit infeksi yang disebabkan oleh
Staphylococcus aureus dan Escherichia coli.
K. Hipotesis
Kandungan senyawa kimia yang terdapat dalam kulit batang pohon petai yang memiliki aktivitas antibakteri adalah senyawa alkaloid, fenolik, saponin, tanin, flavonoid. Ekstrak etanol kulit batang pohon petai memiliki aktivitas antibakteri terhadap Staphylococcus aureus dan Escherichia coli,
22 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk jenis penelitian eksperimental murni, dengan rancangan acak lengkap pola satu arah. Penelitian dilakukan di Laboratorium Farmakognosi-Fitokimia dan Laboratorium Mikrobiologi Fakultas Farmasi Universitas Sanata Dharma, Laboratorium Mikrobiologi Balai Kesehatan Yogyakarta.
B. Variabel dan Definisi Operasional 1. Variable Penelitian
a. Variabel bebas : konsentrasi ekstrak etanol kulit batang pohon petai.
b. Variabel tergantung : diameter zona hambat.
c. Variabel pengacau terkendali : asal tanaman, cara ekstraksi, waktu lamanya inkubasi, suhu inkubasi, jenis mikroba uji, volume larutan uji yang diinokulasikan, umur tanaman. 2. Definisi Operasional
menggambarkan zona hambat pertumbuhan bakteri, dibandingkan dengan kontrol negatif (DMSO 5%).
b. Kulit batang pohon petai adalah kulit batang pohon petai yang berwarna cokelat dari pohon yang berumur 3-5 tahun berasal dari Kabupaten Sleman, Yogyakarta.
c. Zona hambat adalah zona jernih di sekitar sumuran pada media pertumbuhan Staphylococcus aureus dan Escherichia coli, dilihat dari kejernihan media yang dibandingkan dengan kontrol negatif (DMSO). d. Kadar Hambat Minimum (KHM) adalah kadar terendah dari ekstrak
etanol kulit batang pohon petai yang dapat menghambat pertumbuhan bakteri Staphylococcus aureus dan Escherichia coli.
e. Kadar Bunuh Minimal (KBM) adalah kadar terendah dari ekstrak etanol kulit batang pohon petai yang dapat membunuh pertumbuhan bakteri
Staphylococcus aureus dan Escherichia coli.
C. Bahan dan Alat Penelitian 1. Bahan
70% (Mediss), Amoksisilin (BERNOFARM), DMSO 5% (Merck), larutan
Mac Farland 0,5 (1,5.108 CFU), aquadest steril. 2. Alat
Alat-alat yang digunakan adalah spektrofotometer UV-Vis (UVmini-1240 UV-Vis Spectrophotometer Shimadzu), Microbiological Safety Cabinet, moisture balance (HG53 Halogen Moisture Analyzer), Platform Shaker
(Innova 2100 New Brunswick Scientific), autoclave, rotary vacuum evaporator (Buchi Labortechnik AG CH-9230), timbangan digital, waterbath
(Memmert), mikropipet (Socorex), Bunsen, jarum ose, flakon, kertas saring, kuvet, alat-alat gelas (PYREX dari Laboratorium Mikrobiologi dan Farmakognosi Fitokimia Fakultas Farmasi Sanata Dharma), pipet tetes, cawan petri, batang pengaduk, inkubator (Heraeus), sendok, pelubang sumuran diameter 6 mm.
D. Tata Cara Penelitian 1.Determinasi kulit batang pohon petai
2.Pengumpulan bahan kulit batang pohon petai
Sampel yang digunakan adalah kulit batang pohon petai yang diambil dari Kabupaten Sleman. Kulit batang pohon petai yang diambil berwarna cokelat.
3.Pengeringan dan pembuatan serbuk bahan
Kulit batang pohon petai yang telah diperoleh, dicuci bersih dari kotoran dengan menggunakan air mengalir. Kulit batang pohon petai dipotong menjadi beberapa bagian lalu dikeringkan. Pengeringan dihentikan ketika kulit batang pohon petai mudah remuk saat diremas lalu dilanjutkan dengan proses penyerbukan menggunakan mesin penggiling kopi hingga halus. Setelah serbuk didapatkan lalu serbuk diayak menggunakan ayakan tepung. Serbuk yang telah halus dimasukkan dalam toples yang tertutup rapat dan disimpan dalam lemari penyimpanan.
pemanasan yang merupakan hasil susut pengeringan serbuk kulit batang pohon petai. Hasil pengukuran dinyatakan dalam persen.
5.Pembuatan ekstak etanol kulit batang pohon petai
6.Identifikasi kandungan senyawa kimia kulit batang pohon petai dengan uji tabung
a. Pembuatan larutan uji fitokimia
Pembuatan larutan uji untuk uji fitokimia dilakukan dengan cara
melarutkan sebanyak 500 mg ekstrak etanol 70% kulit batang pohon petai
dilarutkan dalam 50 mL etanol 70%.
b. Skrinning Fitokimia 1)Uji pendahuluan
Dua gram serbuk kulit batang pohon petai ditambahkan dengan 20
mL aquadest lalu dipanaskan di atas waterbath selama lebih kurang 15
menit, lalu disaring. Hasil positif yang diperoleh apabila larutan menjadi
berwarna merah hingga kuning dan saat penambahan KOH LP, warna larutan
menjadi lebih intensif menunjukkan adanya senyawa yang mengandung
kromofor dengan gugus hidrofilik.
2)Uji Saponin
Sebanyak 100 mg serbuk kulit batang pohon petai ditambahkan 10
mL aquadest ke dalam tabung reaksi, ditutup dan dikocok selama 30 detik.
Tabung dibiarkan dalam posisi tegak selama 30 menit. Apabila terbentuk
buih dari permukaan cairan dan setelah lebih kurang 30 menit ditetesi lebih
kurang 1 tetes HCl 2 N, busa tidak hilang maka menunjukkan adanya
3)Uji Flavonoid
Sebanyak 3 mL larutan uji ditetesi dengan NaOH LP lebih kurang 2
tetes, terjadi pembentukan intensitas warna kuning. Penambahan HCL
membuat intensitas warna kuning berubah. Perubahan ini mengindikasikan
adanya flavonoid (Jones and Kinghorn, 2006).
4)Uji Alkaloid
Sebanyak 2 mL larutan uji diuapkan di atas porselin dan penangas air
lebih kurang 5 menit, lalu sisanya dilarutkan dengan 5 mL HCl 2 N.
Kemudian, larutan yang diperoleh dibagi dalam 3 tabung reaksi yaitu : blanko
(larutan uji yang telah diuapkan dan ditambah HCL 2N), blanko ditambah 3
tetes pereaksi Dragendorff, dan blanko ditambah 3 tetes peraksi Mayer.
Apabila terdapat endapan jingga setelah ditambah pereaksi Dragendorff dan
endapan kuning setelah ditambahkan pereaksi Mayer menunjukkan adanya
alkaloid (Jones and Kinghorn, 2006).
5)Uji Tanin
Sebanyak 1 mL larutan uji dilarutkan dengan larutan FeCl3 10% lebih
kurang 3 tetes. Adanya tanin ditunjukkan dengan terbentuknya warna biru tua
atau hitam kehijauan (Jones and Kinghorn, 2006).
6)Uji Fenolik
Sebanyak 3 mL larutan uji ditambahkan beberapa tetes (lebih kurang 6
tetes) larutan FeCl3 1%. Hasil positif berwarna hijau, merah, ungu atau hitam
7)Uji Terpenoid
Sebanyak 2,5 mL larutan uji dicampur dengan 1 mL kloroform dan
ditambah 1,5 mL H2SO4 pekat secara hati-hati (lewat dinding). Hasil positif
ditunjukkan dengan larutan menjadi warna coklat kemerahan pada
permukaan dalam larutan (Edeoga, Okwu, dan Mbaebre, 2005).
7.Uji identifikasi bakteri
a. Staphylococcus aureus
Bakteri ditanam di media geolitik, diinkubasi selama 24 jam pada suhu 370C. Bakteri diisolasi dari media geolitik ke media Enrich, diinkubasi selama 2 x 24 jam pada suhu 37 0C. Jika terdapat endapan hitam dengan kabut putih diduga bakteri Staphylococcus aureus. Kemudian, diambil 1-2 ose bakteri, diinokulasi ke dalam media gula (glukosa, laktosa, manitol, maltosa, sakarosa), media NA miring, media Simons Citrate (SC), media Sulfure Indole Motil
(SIM) dan diinkubasi selama 24 jam. Pengecatan Gram dilakukan setelah inkubasi selama 24 jam pada suhu 370C.
b. Escherichia coli
Bakteri ditanam ke media penyubur Brilliant Green Lactose Blue
selama 24 jam. Pada media isolasi setelah 24 jam diketahui tersangka
Escherichia coli dengan timbulnya warna hijau. Kemudian, bakteri diambil 1-2 ose, diinokulasi ke dalam media gula (laktosa, glukosa, sakarosa, manitol, maltosa), NA, SC (Simon Citrate), SIM (Sulfur Indol Motil) dan diinkubasi selama 24 jam. Setelah 24 jam diinkubasi, dilakukan pengecatan Gram.
8.Uji potensi ekstrak etanol kulit batang pohon petai terhadap S. aureus dan E. coli.
a. Pembuatan variasi konsentrasi larutan uji
Sebanyak 2,5 gram ekstrak kental kulit batang pohon petai ditimbang kemudian dilarutkan dengan 5 mL DMSO 5% sehingga diperoleh konsentrasi 50%. Konsentrasi 50% diencerkan sehingga diperoleh konsentrasi 25%; 12,5%; 6,25%; 3,125%. Kontrol negatif yang digunakan dalam penelitian ini adalah DMSO 5% dan kontrol positif yang digunakan adalah amoksisilin 125 mg/ 5 mL untuk S. aureus dan E. coli.
b. Pembuatan suspensi bakteri uji
c. Uji aktivitas antibakteri dengan metode difusi sumuran
Sebanyak 15 mL MHA steril dituang ke dalam cawan petri steril dan dibiarkan memadat. Media MHA yang telah memadat pada cawan petri kemudian dapat di streak menggunakan cotton bud steril yang sebelumnya dicelup dahulu ke dalam suspensi bakteri uji secara merata. Metode ini menggunakan metode Kirby Bauer (Mpila, dkk, 2012). Sumuran dibuat dengan menggunakan pelubang sumuran no. 6 sebanyak 7 lubang sumuran pada media yang telah padat dan ditumbuhi bakteri uji. Ekstrak etanol kulit batang pohon petai dengan variasi konsentrasi (50%; 25%; 12,5%; 6,25%; 3,125%), kontrol negatif (DMSO 5%), dan kontrol positif (Amoksisilin 125 mg/5 mL) dimasukkan pada lubang sumuran sebanyak 50 µL. Media uji yang telah berisi ekstrak, control positif dan kontrol negatif diinkubasi selama 24 jam pada suhu 370C lalu diamati dan diukur diameter zona hambat yang dihasilkan. Zona hambat yang terbentuk diukur dengan penggaris. Dalam uji aktivitas antibakteri ini dilakukan replikasi sebanyak 3 kali replikasi.
d. Penentuan KHM dan KBM dengan metode dilusi cair
dilakukan dengan membuat suspensi bakteri yang kekeruhannya disetarakan dengan larutan Mac Farland 0,5 (1,5 x 108 CFU). Dari suspensi tersebut, diambil 200 µL, ditambah dengan larutan uji yang berisi ekstrak etanol kulit batang pohon petai dengan konsentrasi tertentu dan dicampur rata dengan 5 mL MHB. Setelah itu diukur nilai absorbansinya menggunakan spektrofotometer UV-Vis ( 480 nm) sebelum inkubasi dan setelah inkubasi selama 24 jam pada suhu 37 0C. Hasil selisih dari absorbansi tersebut digunakan sebagai nilai Optical Density
(OD). Kemudian konsentrasi ekstrak etanol kulit batang pohon petai yang mempunyai nilai ∆ OD = 0 akan ditegaskan ke dalam media MHA padat, diinkubasi selama 24 jam pada suhu 370C, lalu diamati pertumbuhan bakteri. Apabila pada media MHA tumbuh koloni bakteri maka konsentrasi ekstrak etanol kulit batang pohon petai tersebut menghambat pertumbuhan bakteri (KHM) dan jika media MHA tersebut tidak terdapat pertumbuhan bakteri maka konsentrasi ekstrak etanol kulit batang pohon petai membunuh pertumbuhan bakteri (KBM). Penentuan KHM dan KBM dengan metode dilusi cair dilakukan 3 kali replikasi.
E. Analisis Hasil
kelompok ekstrak etanol kulit batang pohon petai, kontrol negatif (DMSO 5%), dan kontrol positif (Amoksisilin 125 mg/ 5 mL). Selanjutnya, dilakukan analisis
post hoc menggunakan Mann-Whitnney Test.
Data yang didapat berupa diameter zona hambat, dianalisis secara statistik menggunakan uji Kruskal Wallis untuk mengetahui perbedaan bermakna antara kelompok ekstrak etanol kulit batang pohon petai, kontrol negatif (DMSO 5%), dan kontrol positif (Amoksisilin 125 mg/ 5 mL). Selanjutnya, dianalisis post hoc
dengan Mann-Withney WilcoxonTest.
Nilai KHM dan KBM yang didapat dianalisis secara deskriptif. Nilai KHM dan KBM yang diperoleh dengan metode dilusi cair dan diukur kekeruhannya dengan melihat absorbansi menggunakan spektrofotometer UV-Vis sehingga didapatkan nilai optical density (OD). Nilai KHM dan KBM diperoleh jika nilai
∆ OD = 0 yakni absorbansi setelah inkubasi dikurangi absorbansi sebelum
34 BAB IV
HASIL DAN PEMBAHASAN
Penelitian ini secara umum mempunyai tujuan untuk mengetahui aktivitas antibakteri ekstrak etanol kulit batang pohon petai terhadap S. aureus dan E. coli. Selain itu, penelitian ini juga bertujuan untuk mengetahui kandungan senyawa kimia yang terdapat dalam ekstrak etanol kulit batang pohon petai, mengetahui kadar hambat bakteri dari ekstrak etanol kulit batang pohon petai terhadap S. aureus dan E. coli.
A. Determinasi dan Pengumpulan Tanaman
memiliki permukaan yang keras. Kebenaran tanaman yang digunakan dibuktikan dengan surat keterangan dari CV Merapi Farma Herbal yang terdapat dalam lampiran 1. Berdasarkan surat keterangan tersebut, didapatkan bahwa tanaman yang dipakai dalam penelitian ini adalah benar petai (Parkia speciosa Hassk.).
B. Pembuatan Serbuk Simplisia Kulit Batang Pohon Petai Kulit batang pohon petai yang telah diperoleh, dicuci bersih dari kotoran dengan menggunakan air mengalir untuk menghilangkan pengotor yang mungkin masih ada. Kulit batang pohon petai dipotong menjadi beberapa bagian lalu dikeringkan. Pengeringan dihentikan ketika kulit batang pohon petai mudah remuk saat diremas lalu dilanjutkan dengan proses penyerbukan menggunakan mesin penggiling kopi. Pengeringan dilakukan untuk menurunkan kandungan air yang terdapat dalam kulit batang pohon petai agar tidak mudah ditumbuhi kapang dan bakteri. Selain itu, apabila kandungan air dalam kulit batang pohon petai masih tinggi, dapat mendorong enzim mengubah kandungan kimia menjadi produk lain yang tidak memiliki efek farmakologi seperti senyawa aslinya
(Pramono, 2005; Ma’mun, 2006). Beberapa enzim perusak kandungan kimia
Setelah itu serbuk dimasukkan dalam toples yang tertutup rapat dan disimpan dalam ruangan penyimpanan.
C. Penetapan susut pengeringan pada serbuk kulit batang pohon petai
Dalam penelitian, penetapan kadar air tidak dilakukan karena belum diketahui apakah serbuk kulit batang pohon petai hanya mengandung air dalam bentuk serapan atau tidak. Oleh sebab itu, dilakukan susut pengeringan. Alasan dilakukan susut pengeringan dalam penelitian ini adalah untuk mengetahui kandungan air yang terdapat dalam serbuk kulit batang pohon petai dan dapat digunakan untuk menetapkan jumlah semua jenis bahan yang mudah menguap dan hilang pada kondisi tertentu (proses pengeringan) (Departemen Kesehatan Republik Indonesia, 1995). Susut pengeringan umumnya dinyatakan sebagai nilai persen terhadap bobot awal.
yang terdapat dalam serbuk yang diteliti. Persyaratan yang ditetapkan oleh Menteri Kesehatan Republik Indonesia 2009 untuk susut pengeringan adalah nilai susut pengeringan kurang dari 10%. Dalam penelitian dilakukan tiga kali replikasi dan diperoleh rata-rata susut pengeringan dalam serbuk kulit batang pohon petai sebesar 6,75 %. Hal ini menunjukkan bahwa serbuk kulit batang pohon petai yang digunakan dalam penelitian ini telah memenuhi persyaratan yang telah ditetapkan yaitu tidak lebih dari 10 %.
D. Pembuatan Ekstrak Etanol Kulit Batang Pohon Petai
petai tidak ditumbuhi oleh kapang dan jamur dibuktikan dengan ekstrak yang didapat dalam penelitian ini (Gambar 2).
Proses ekstraksi dibantu dengan penggojogan menggunakan shaker. Penggojogan ini bertujuan agar seluruh serbuk dapat kontak dengan pelarut sehingga senyawa yang berpotensi sebagai antibakteri dapat tersari. Penggojogan juga mempercepat waktu ektraksi dibandingkan jika serbuk hanya direndam. Ekstraksi dengan metode ini dapat disebut sebagai ekstraksi mekanik.
Serbuk kulit batang pohon petai yang telah ditimbang terlebih dahulu dibasahi dengan pelarut. Apabila sudah terbasahi seluruhnya, ditambahkan pelarut sampai ketinggian pelarut ± 2 cm dari permukaan serbuk pada Erlenmeyer. Penggojogan menggunakan shaker dilakukan selama 2 x 24 jam kemudian disaring menggunakan kertas saring dengan bantuan pompa vacuum.
Pompa vacuum berfungsi untuk membantu proses ekstraksi.
Hasil saringan (filtrat) kemudian dimasukkan ke dalam labu alas bulat untuk dipekatkan menggunakan vacuum rotary evaporator. Suhu yang digunakan pada proses evaporasi ini adalah 70 0C sampai terbentuk cairan kental. Prinsip kerja rotary vacum evaporator adalah destilasi, yaitu memisahkan cairan penyari dan zat tersari dengan cara penurunan tekanan pada labu alas bulat dan pemutaran labu alas bulat sehingga pelarut dapat menguap lebih cepat di bawah titik didih. Apabila setelah proses pemekatan masih tersisa filtrat yang cukup banyak, maka pemekatan bisa dibantu dengan pemanasan di atas
filtrat ditampung dalam cawan porselin kemudian ditimbang dan setiap 1 jam ditimbang hingga diperoleh bobot tetap. Menurut Depkes RI (1995), bobot tetap adalah selisih penimbangan dari dua kali penimbangan berturut-turut setelah pemanasan di atas waterbath selama satu jam dan tidak lebih dari 0,5 mg tiap gram sisa yang ditimbang. Penimbangan dilakukan setelah 1 jam ekstrak diuapkan. Bobot tetap ekstrak ditunjukkan pada tabel I.
Tabel I. Bobot Tetap Ekstrak Etanol Kulit Batang Pohon Petai Keterangan Bobot (g)
Selisih bobot
(mg)
Penimbangan awal 12,24 - -
1 jam pemanasan 12,24 0 0
2 jam pemanasan 12,24 0 0
Ekstrak etanol kulit batang pohon petai yang telah diperoleh dilanjutkan dengan menentukan rendemen. Penentuan rendemen memiliki tujuan untuk mengukur efektivitas jenis pelarut yang digunakan untuk mengekstrak kandungan kimia yang terkandung dalam kulit batang pohon petai. Semakin besar nilai rendemen yang diperoleh semakin efektif pelarut yang digunakan ketika dilakukan ekstraksi. Hasil rendemen yang didapat dalam penelitian ini sebesar 24,52%.
E. Skrining Fitokimia
Tujuan dilakukan skrining fitokimia dalam penelitian adalah untuk mengetahui kandungan bioaktif atau kandungan senyawa kimia yang berfungsi sebagai antibakteri. Pada penelitian, skrining perlu dilakukan untuk mengetahui senyawa yang berpotensi sebagai antibakteri, seperti : alkaloid, polifenol, flavonoid, tanin, dan lain-lain. Analisis kualitatif yang digunakan dalam penelitian adalah uji tabung. Tujuan dilakukan uji tabung adalah untuk mengetahui kandungan kimia yang terdapat dalam kulit batang pohon petai. Uji tabung yang dilakukan dalam penelitian meliputi uji pendahuluan, uji saponin, uji flavonoid, uji alkaloid, uji tanin, uji fenolik dan uji terpenoid terdapat pada tabel II. Hasil yang diperoleh Kurniawati (2014) menyatakan bahwa kulit petai mengandung golongan senyawa kimia seperti alkaloid, terpenoid, saponin, dan tanin yang berpotensi sebagai antibakteri.
Tabel II. Hasil pengamatan uji tabung terhadap larutan uji ekstrak kulit batang pohon petai
No Pengujian Pengamatan Hasil
1 Uji pendahuluan Warna lebih pekat +
2 Uji saponin Tidak terbentuk buih/busa -
3 Uji flavonoid Warna kuning +
4 Uji alkaloid Adanya endapan +
5 Uji tanin Tidak terdapat warna hijau -
6 Uji fenolik Terdapat warna ungu kehitaman +
7 Uji terpenoid Terdapat warna merah +
[image:60.612.109.531.237.668.2]1. Uji pendahuluan
Uji pendahuluan merupakan uji tahap awal yang menggambarkan adanya kemungkinan senyawa spesifik seperti flavonoid, tanin, alkaloid, saponin, fenolik, terpenoid dan sebagainya (Arisandi, 1990 cit. Anwar, 2014). Tujuan dilakukan uji pendahuluan adalah untuk mengetahui kandungan kimia yang terkandung dalam ekstrak etanol kulit batang pohon petai. Pada uji pendahuluan (Gambar 3), serbuk kulit batang pohon petai yang telah dilarutkan dengan etanol 70% dipanaskan lalu ditambahkan dengan KOH LP sehingga menghasilkan warna kuning yang lebih intensif (kuning pekat). Hal ini menunjukkan bahwa kulit batang pohon petai mengandung kromofor seperti tanin, flavonoid, alkaloid dan lain-lain.
[image:61.612.105.527.245.583.2]
Sebelum ditambah KOH LP Setelah ditambah KOH LP Gambar 3. Uji Pendahuluan
2. Uji saponin
berikatan dengan suatu aglikon hidrofobik (sapogenin) berupa triterpenoid, steroid alkaloid. Saponin bersifat polar dan dapat larut dalam pelarut air. Saponin juga bersifat nonpolar karena memiliki gugus hidrofobik yaitu aglikon (Suparjo, 2008 cit. Marliana dan Chairul, 2011).
Gugus hidrofil dan hidrofobik ini akan membentuk misel. Ketika misel terbentuk maka gugus hidrofil akan menghadap ke dalam dan gugus hidrofobik akan menghadap keluar dan fenomena ini tampak seperti busa. Sifat ini menyerupai surfaktan/sabun yang berfungsi dapat menurunkan tegangan permukaan antara udara dengan air yang berupa emulsi gas dalam air (Robinson, 1995). Hasil yang diperoleh pada uji saponin (Gambar 4) adalah tidak terbentuk buih. Dalam uji saponin, tidak terbentuk buih setelah serbuk dilarutkan dalam aquadest kemudian digojog selama 30 detik.
[image:62.612.104.528.235.595.2]
Gambar 4. Uji saponin (a) sebelum penggojogan; (b) setelah penggojogan
3. Uji flavonoid
Dalam uji flavonoid menurut, penambahan natrium hidroksida akan melarutkan flavonoid yang merupakan senyawa polifenol yang memiliki sifat asam lemah (Kumalasari dan Sulistyani, 2011). Ekstrak yang mengandung flavonoid ketika ditambahkan dengan natrium hidroksida akan menghasilkan warna kuning (Syajid, 2008). Dalam uji ini menunjukkan hasil positif yang dibuktikan dengan terbentuknya warna kuning. Hasil positif ini menunjukkan bahwa kulit batang pohon petai mengandung flavonoid. Hasil positif penelitian ini ditunjukkan pada Gambar 5.
[image:63.612.106.525.277.584.2]
(a) (b) (c)
Gambar 5. Uji Flavonoid (a) Larutan uji sebelum ditambahkan NaOH dan KCl ; (b) Setelah ditambahkan NaOH ; (c) Setelah ditambahkan KCl
4. Uji alkaloid
Sebelum diuapkan Setelah diuapkan Gambar 6. Larutan uji pada uji alkaloid
[image:64.612.102.527.112.643.2]Gambar 7. Reaksi uji alkaloid dengan penambahan pereaksi Mayer
Gambar 9. Reaksi pada uji alkaloid dengan penambahan Dragendorff Hasil yang diperoleh setelah ditambahkan pereaksi Dragendorff ditunjukkan pada Gambar 10.
5. Uji tanin
Dalam uji ini penambahan larutan FeCl3 10% bertujuan untuk bereaksi dengan salah satu gugus hidroksi yang terdapat pada senyawa tanin. Tujuan digunakan pereaksi FeCl3 secara umum adalah untuk mengidentifikasi senyawa fenol termasuk tanin. Hasil positif dari uji tannin setelah penambahan larutan FeCl3 ditunjukkan dengan adanya warna hijau (Marlinda, Meiske, dan Audy, 2012).
[image:67.612.105.518.240.592.2]
Sebelum ditambah FeCl3 10% Setelah ditambah FeCl3 10% Gambar 11. Uji Tanin
Hasil yang diperoleh dalam uji tanin adalah tidak menunjukkan warna hijau ketika ditetesi larutan FeCl3 10% sehingga kulit batang pohon petai tidak mengandung tanin. Hasil yang diperoleh dalam uji tanin ditunjukkan pada Gambar 11.
6. Uji fenolik
terbentuk diduga senyawa besi (III) heksa fenolat sehingga hasil positif dari uji ini menunjukkan adanya gugus OH aromatik. Warna yang terbentuk ketika besi (III) klorida bereaksi dengan sampel yang diuji. Dalam uji ini, ion Fe3+ mengalami hibridisasi orbital d2sp3. Berdasarkan hasil hibridisasi tersebut, ion Fe3+ mempunyai 6 orbital kosong yang dapat diisi oleh gugus pendonor pasangan electron dimana gugus pendonor pasangan elektron pada senyawa fenolik berasal dari pasangan elektron bebas dari atom oksigen. Fenolik memiliki fungsi penting dalam transport elektron pada fotosintesis, memiliki aktivitas sitokinin, pemacu pertumbuhan, mampu menyerap sinar UV serta memiliki aktivitas antiinflamasi (Ardiansyah, 2007; Marliana dan Chairul, 2011). Hasil uji fenolik pada penelitian (Gambar 12) menunjukkan adanya warna ungu kehitaman setelah ditambahkan dengan larutan FeCl3 1% sehingga kulit batang pohon mengandung senyawa fenolik.
[image:68.612.106.529.247.660.2]
Gambar 12. Uji Fenolik, larutan uji (a) belum ditambahkan FeCl3 1%; dan (b) sudah ditambahkan FeCl3 1%.
7. Uji terpenoid
Analisis senyawa dalam uji terpenoid ini berdasarkan pada kemampuan senyawa membentuk warna ketika bereaksi dengan H2SO4 pekat. Senyawa terpenoid larut dalam kloroform dan akan menghasilkan warna merah ketika ditambahkan dengan H2SO4 pekat. Hasil dalam uji ini (Gambar 13) menunjukkan adanya warna merah yang terdapat pada permukaan larutan uji sehingga kulit batang pohon petai mengandung terpenoid.
[image:69.612.107.514.276.534.2]
Larutan uji ditambah kloroform ditambah H2SO4 Gambar 13. Uji Terpenoid
F. Identifikasi Bakteri
Menurut Kismiyati, Sri, Wahid dan Rahayu (2009), tujuan dilakukan uji gula-gula dalam penelitian adalah untuk mendeterminasi kemampuan bakteri dalam mendegradasi gula dan menghasilkan asam organik yang berasal dari tiap jenis gula, yaitu glukosa, laktosa, manitol, maltosa, dan sakarosa. Menurut Rostinawati (2008), hasil positif yang diperoleh pada uji gula-gula ditunjukkan dengan adanya perubahan warna media gula-gula menjadi kuning dari warna media sebelumnya. Hasil yang diperoleh pada uji gula-gula dalam penelitian adalah media gula-gula tersebut berubah warna menjadi warna kuning setelah diinkubasi selama 24 jam, baik pada bakteri S. aureus maupun E. coli.
Produk metabolit yang dihasilkan dari triptofan adalah indol, asam urat dan ammonia.
Menurut Dewi (2010) bakteri S. aureus memiliki bentuk coccus dan berwarna ungu ketika dilakukan pengecatan Gram. Hasil yang diperoleh dari uji identifikasi bakteri uji menunjukkan bahwa S. aureus memiliki sel berbentuk bulat (coccus) dan koloninya menyerupai buah anggur serta berwarna ungu dapat dilihat pada lampiran no. 6. Menurut Purwohadisantoso, Elok dan Ella, (2009), bakteri E. coli memiliki bentuk batang pendek dan menghasilkan warna merah ketika dilakukan pengecatan Gram. Hasil yang didapat dari uji identifikasi bakteri uji menunjukkan bahwa pada bakteri E. coli memiliki warna merah muda, selnya berbentuk batang (basil) dapat dilihat pada lampiran no. 7. Berdasarkan pustaka yang diacu (Purwohadisantoso, Elok dan Ella, 2009), (Dewi, 2010) dan hasil yang diperoleh oleh penulis dalam penelitian ini menunjukkan bahwa bakteri uji yang digunakan adalah benar bakteri S. aureus
dan E. coli.
ditempatkan dalam media padat yang sebelumnya sudah diinokulasikan bakteri uji. Senyawa uji akan berdifusi ke dalam media dan akan menghambat pertumbuhan bakteri.
Ekstrak etanol kulit batang pohon petai disiapkan terlebih dahulu lalu dilarutkan menggunakan DMSO karena DMSO dapat melarutkan ekstrak etanol kulit batang pohon petai dan aman digunakan untuk uji aktivitas antibakteri sebab tidak menunjukkan adanya zona hambat ketika diujikan pada bakteri S. aureus dan E. coli. Menurut Alfath, Vera, dan Sunnati (2013) DMSO juga digunakan sebagai pelarut karena DMSO dapat berfungsi sebagai pelarut yang cepat menyerap ke dalam ekstrak tanpa merusak ekstrak.
Pembuatan variasi konsentrasi (3,125%; 6,25%; 12,5%; 25%; 50%) dengan melarutkan ekstrak etanol kulit batang pohon petai sebesar 2,5 gram dalam 5 mL DMSO 5% (konsentrasi 50%). Konsentrasi 50% merupakan konsentrasi paling besar. Konsentrasi paling besar ini akan menentukan empat konsentrasi di bawahnya. Empat konsentrasi tersebut ditentukan dengan pengenceran sebesar setengah dari konsentrasi sebelumnya.
Escherichia coli dengan metode difusi disk. Selain itu, dalam penelitian yang dilakukan Nauman dan Muhammad (2003) dalam penelitiannya terkait skrinning ekstrak metanol air terhadap aktivitas antibakteri dengan kontrol negatif adalah DMSO 100% dengan bakteri uji Staphylococcus aureus, Bacillus cereus, Corynebacterium bovis, Pasturella multocida dan Escherichia coli. Hasil yang diperoleh dari penelitian di atas dengan kontrol negatif adalah DMSO 5%, 10%, dan 100% adalah DMSO tidak dapat menghambat pertumbuhan bakteri uji.
Oleh sebab itu, peneliti melakukan orientasi menggunakan DMSO dengan konsentrasi terkecil yaitu 1 %, 2%, dan 5% untuk melarutkan ekstrak etanol kulit batang pohon petai dan digunakan sebagai kontrol pelarut. Hasil yang diperoleh adalah DMSO 1% dan 2% belum bisa melarutkan ekstrak etanol kulit batang pohon petai sebaik mungkin, sedangkan DMSO 5% dapat melarutkan ekstrak etanol kulit buah petai dengan baik dan tidak menghambat pertumbuhan bakteri. DMSO dengan konsentrasi 5% sudah dapat melarutkan ekstrak etanol kulit batang pohon petai maka pada konsentrasi DMSO di atas 5% sudah pasti dapat melarutkan ekstrak etanol kulit batang pohon petai. Pembuatan variasi konsentrasi dilakukan untuk mengetahui konsentrasi minimum dari ekstrak etanol kulit batang pohon petai dalam menghambat pertumbuhan bakteri S. aureus dan E. coli. Hasil yang diperoleh Kurniawati (2014) menyatakan bahwa ekstrak etanol kulit petai tidak memiliki aktivitas antibakteri terhadap S. aureus
Tabel III menunjukkan bahwa ekstrak etanol kulit batang pohon petai hanya mampu menghambat pertumbuhan bakteri S. aureus sedangkan tidak mampu menghambat pertumbuhan bakteri E. coli. Ekstrak etanol kulit batang pohon petai mampu menghambat pertumbuhan bakteri S. aureu