DEKOLORISASI PEWARNA TEKSTIL SINTETIS AZO OLEH BAKTERI HALOTOLERAN DAN IDENTIFIKASI
MENGGUNAKAN 16S rRNA
SKRIPSI
DEBY EVELIN HUTAGALUNG 120805007
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2018
UNIVERSITAS SUMATERA UTARA
BAKTERI HALOTOLERAN DAN IDENTIFIKASI MENGGUNAKAN 16S rRNA
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
DEBY EVELIN HUTAGALUNG 120805007
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2018
UNIVERSITAS SUMATERA UTARA
i
PERNYATAAN ORISINALITAS
DEKOLORISASI PEWARNA TEKSTIL SINTETIS AZO OLEH BAKTERI HALOTOLERAN DAN IDENTIFIKASI
MENGGUNAKAN 16S rRNA
SKRIPSI
Saya mengajukan bahwa skripsi ini adalah buah hasil karya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Oktober 2018
Deby Evelin Hutagalung 120805007
UNIVERSITAS SUMATERA UTARA
ii Judul : Dekolorisasi Pewarna Tekstil Sintetis Azo oleh
Bakteri Halotoleran dan Identifikasi Menggunakan 16S rRNA
Kategori : Skripsi
Nama : Deby Evelin Hutagalung
Nomor Induk Mahasiswa : 120805007 Program Studi : Sarjana Biologi
Fakultas : MIPA-Universitas Sumatera Utara
Disetujui di Medan, Oktober 2018
Komisi Pembimbing
Dosen Pembimbing 2 Dosen Pembimbing 1
Dr. Saleha Hannum, M.Si. Dra. Nunuk Priyani, M.Sc.
NIP : 197108312000122001 NIP : 196404281996032001
Ketua Program Studi
Dr. Saleha Hannum, M.Si.
NIP : 197108312000122001
UNIVERSITAS SUMATERA UTARA
iii
DEKOLORISASI PEWARNA TEKSTIL SINTETIS AZO OLEH BAKTERI HALOTOLERAN DAN IDENTIFIKASI
MENGGUNAKAN 16S rRNA
ABSTRAK
Pewarna sintetis telah lama digunakan dalam industri tekstil seperti dalam pembuatan permadani, batik, kosmetik dan obat-obatan. Penggunaan pewarna sintetis tertutama pewarna azo dalam industri tekstil dinilai lebih efisien dibanding dengan pewarnaan alami. Tingginya pemakaian zat warna pada kegiatan industri tekstil akan berdampak pada peningkatan jumlah bahan pencemar dalam limbah cair yang dihasilkan pada akhirnya dibuang ke lingkungan. Pewarna tekstil azo adalah pewarna yang sulit diuraikan secara alami di lingkungan. Penelitian ini bertujuan untuk mengetahui potensi bakteri halotoleran dalam mendekolorisasi zat pewarna tekstil azo. Isolat diisolasi dari laut di sekitar pulau Mursala, desa Tapian Nauli, kecamatan Tapanuli Tengah. Dari hasil skrinning diperoleh 2 isolat yang memiliki kemampuan dekolorisasi cukup tinggi yaitu isolat DH2 dan DH3. Uji dekolorisasi secara kuantitatif dilakukan pada media MSM cair yang telah ditambahkan zat pewarna dengan variasi perlakuan pH: 6, 7 dan 8, konsentrasi zat warna 600, 800 dan 1000 ppm serta kadar salinitas media 0%, 5% dan 10%. Kondisi optimum untuk proses dekolorisasi tertinggi ditunjukkan oleh isolat DH2 pada pH 6, konsentrasi zat warna 600 ppm dan kadar salinitas 5% dengan persentase sebesar 49,64%, selama 12 hari. Hasil identifikasi menggunakan gen 16S rRNA diketahui bahwa isolat DH2 menunjukkan 97% kesamaan dengan Stenotrophomonas pavanii strain LMG 25348 Kata kunci: Azo, Bakteri Halotoleran, Dekolorisasi, Stenotrophomonas pavanii
UNIVERSITAS SUMATERA UTARA
iv
HALOTOLERANT BACTERIA AND IDENTIFICATION USED BY 16S rRNA
ABSTRACT
Textile dye has been used in textile industry to produce carpet, batik, cosmetics as well as pharmaceutical products. Utilizing of textile dye especially azo dye in textile industries is more efficient than natural dye. The high production of textile increases liquid wastes. If the liquid waste is not treated properly and discharged directly to environment, it causes pollution that could harm both organism and the environment itself. Azo textile dye is difficult to be degraded in the naturally environment. The aim of this research is to study the potency of halotolerant bacteria to decolorize azo textile dye. The isolates which were isolated from the sea around of Mursala Island, Tapian Nauli village, Central Tapanuli district. In this research, the highest percentage of decolorization were shown by 2 isolates, DH2 and DH3. The quantitative decolorization test was performed in MSM liquid media which were amended by three different pH variations: 6, 7 and 8; Three different azo concentrations which were: 600, 800 dan 1000 ppm and three different salinity of media which were: 0 %, 5%, and 10%. The optimum conditions for isolate to degrade azo dye was shown by isolate DH2 at pH 6, salinity 5% and azo concentration of 600 ppm which was 49.64%. Based on 16S rRNA gene, it was known that DH2 was identified to close to Stenotrophomonas pavanii strain LMG 25348 with homology of 97%.
Keywords: Azo, Decolorization, Halotolerant bacteria, Stenotrophomonas pavanii
UNIVERSITAS SUMATERA UTARA
v
PENGHARGAAN
Puji dan syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa atas kasih dan karunia-Nya penulis dapat menyelesaikan skripsi yang berjudul “Dekolorisasi Pewarna Tekstil Sintetis Azo oleh Bakteri Halotoleran dan Identifikasi Menggunakan 16S rRNA”. Skripsi ini dibuat sebagai salah satu syarat untuk meraih gelar Sarjana Sains pada Fakultas MIPA USU Medan.
Pada kesempatan ini penulis menyampaikan terima kasih yang tak terhingga kepada orang tua terkasih dan tersayang ayahanda Mujur Hutagalung dan ibunda Rosmawaty Sigalingging yang tiada henti memberikan doa, semangat, perhatian, kasih sayang maupun pengorbanan yang begitu besar kepada penulis. Tidak lupa penulis juga menyampaikan rasa terima kasih kepada abang Zetmico Marolop Hutagalung dan abang Ponedi Hutagalung atas dorongan semangat, doa maupun dukungan materi dan moral. Kepada adik-adik tersayang Herman Hutagalung dan Kevin Hutagalung yang selalu memberikan semangat kepada penulis.
Terima kasih yang begitu besar penulis sampaikan kepada ibu Dra. Nunuk Priyani, M.Sc selaku dosen pembimbing I dan dosen pembimbing akademik (PA) yang telah banyak memberikan arahan, bimbingan, waktu, tenaga, pikiran serta semangat selama masa penelitian dan penulisan skripsi maupun selama masa perkuliahan. Terima kasih kepada ibu Dr. Saleha Hannum, M.Si selaku dosen pembimbing II dan ketua Departemen Biologi FMIPA USU atas arahan, bimbingan, waktu, tenaga maupun semangat kepada penulis. Ucapan terima kasih juga penulis sampaikan kepada ibu Dr. It Jamilah, M. Sc dan bapak Dr. Salomo Hutahaean, M, Si.
Selaku dosen penguji yang telah banyak memberikan masukan dan arahan dalam penyempurnaan skripsi ini. Terima kasih kepada ibu Nurhasni Muluk, Ibu Rosalina Ginting, Bang Ewin, Kak Siti dan Kak Pia selaku staf pegawai Departemen Biologi FMIPA USU.
Terimakasih juga penulis sampaikan kepada teman-teman seperjuangan Wilda Hutagalung, Naomi Clara Pangaribuan, Triyas Johana Simarmata, Evi Manjorang, Rita Sari Magdalena Pardosi, Firda Novita, Aditya Bungsu, Agustono Hutahaean, dan Freddy Silalah atas kebersamaan dan semangat selama penelitian dan penulisan skripsi ini. Kepada Boby Pranoto Hutabarat yang telah bersedia
UNIVERSITAS SUMATERA UTARA
vi teman-teman AOC 2012. Terima kasih kepada persekutuan keluarga besar Kristen Biologi (PKBKB). Kepada abang dan kakak tingkat 2011. Terima kasih juga penulis ucapkan kepada abang asuh (Doni Tua Hutahaean dan lainnya) dan adek asuh 2014 (Indah Fiyar Nduru, Randi dan lainnya). Kepada adik tingkat 2013 (Arta, Nadya, Fattia, Johannes dan lainnya). Terima kasih juga kepada para sahabat Henni, Octa, Mira, Rotua, Christin, Henny, Devi, dek Janet, Rikardo, Rahmat.
Akhirnya dengan penuh ketulusan dan kerendahan hati, penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh karena itu penulis mengharapkan kritik dan saran yang bersifat membangun demi kesempurnaan skripsi ini. Demikian yang dapat penulis sampaikan dalam skripsi ini, semoga bermanfaat dan dapat menambah pengetahuan pembaca.
Medan, Oktober 2018
Deby Evelin Hutagalung
UNIVERSITAS SUMATERA UTARA
vii
DAFTAR ISI
Halaman
PERNYATAAN ORISINALITAS i
PENGESAHAN SKRIPSI ii
ABSTRAK iii
ABSTRACT iv
PENGHARGAAN v
DAFTAR ISI vii
DAFTAR TABEL ix
DAFTAR GAMBAR x
DAFTAR LAMPIRAN xi
BAB 1. PENDAHULUAN
1.1 Latar Belakang 1
1.2 Perumusan Masalah 2
1.3 Tujuan Penelitian 3
1.4 Manfaat Penelitian 3
BAB 2. TINJAUAN PUSTAKA
2.1 Zat Warna 4
2.2 Zat Warna Azo 5
2.3 Dekolorisasi Zat Warna dengan Metode Biologi 5
2.4 Limbah Cair Industri Tekstil 6
2.5 Bakteri Halotoleran 7
2.6 Gen 16S rRNA 8
2.7 Metode Spektrofotometri 8
BAB 3. METODOLOGI PENELITIAN
3.1 Waktu dan Tempat Penelitian 9
3.2 Sampling 9
3.3 Isolasi Bakteri 9
3.4 Karakterisasi Bakteri secara Morfologi dan Uji Biokimia 9 3.5 Uji Potensial Dekolorisasi Pewarna Azo 11
3.6 Uji Degradasi Pewarna Azo 12
3.7 Pengukuran Persentase Degradasi Zat Warna Azo 12 3.8 Identifikasi Bakteri Halotoleran Berdasarkan Gen 12
Penyandi 16S rRNA BAB 4. HASIL DAN PEMBAHASAN
4.1 Karakteristik Morfologi Bakteri Dari Air Laut 15 4.2 Uji Potensial pada Media Cair Minimum Salt Medium 17
(MSM)
4.3 Pengaruh Variasi Perlakuan pH, Konsentrasi Zat 19 Warna dan Kadar Salinitas Terhadap Persentase
Kemampuan Dekolorisasi Isolat DH2
UNIVERSITAS SUMATERA UTARA
viii Warna dan Kadar Salinitas Terhadap Persentase
Kemampuan Dekolorisasi Isolat DH3
4.5 Pengaruh Variasi Perlakuan pH, Konsentrasi Zat 24 Warna dan Kadar Salinitas Terhadap Jumlah Pertumbuhan Koloni Bakteri DH2
4.6 Pengaruh Variasi Perlakuan pH, Konsentrasi Zat 26 Warna dan Kadar Salinitas Terhadap Jumlah Pertumbuhan Koloni Bakteri DH3
4.7 Identifikasi Bakteri Halotoleran Berdasarkan 28 Gen Penyandi 16S rRNA
BAB 5. KESIMPULAN DAN SARAN
5.1 Kesimpulan 31
5.2 Saran 31
DAFTAR PUSTAKA 32
UNIVERSITAS SUMATERA UTARA
ix
DAFTAR TABEL
Nomor Tabel
Judul Halaman
4.1 Karakteristik Morfologi Bakteri dari Air Laut 15 4.2 Karakteristik Biokimia dan Sifat Gram Bakteri 16
4.3 Uji Potensial Isolat Bakteri Halotoleran 17
4.4 Rata-Rata Daya Dekolorisasi Isolat DH2 Terhadap Variasi Perlakuan
19
4.5 Rata-Rata Daya Dekolorisasi Isolat DH3 Terhadap Variasi Perlakuan
22
4.6 Jumlah Pertumbuhan Koloni Bakteri Isolat DH2 Terhadap Variasi Perlakuan
24
4.7 Jumlah Pertumbuhan Koloni Bakteri Isolat DH3 Terhadap Variasi Perlakuan
26
4.8 Hasil Analisa BLASTn Isolat DH2 29
UNIVERSITAS SUMATERA UTARA
x Nomor
Gambar
Judul Halaman
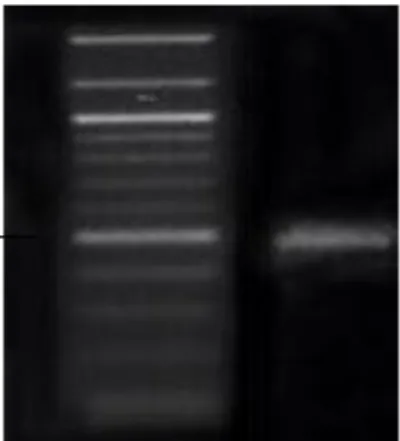
1 Visualisasi DNA genom bakteri halotoleran pada media gel agarose 1% (1=Isolat DH2)
28
2 Hasil elektroforesis amplifikasi PCR dengan gen 16S rRNA. (1=Marker 1 Kb; 2=DNA isolat DH2)
29
UNIVERSITAS SUMATERA UTARA
xi
DAFTAR LAMPIRAN
Nomor Lampiran
Judul Halaman
1 Diagram Alir Penelitian 37
2 Profil Fasta Hasil Sekuensing Gen 16S rRNA Isolat Bakteri Terpilih
38
3 Hasil Analisa BLASTn Gen 16S rRNA Isolat DH2
39
UNIVERSITAS SUMATERA UTARA
PENDAHULUAN
1.1 Latar Belakang
Pewarna sintetis sudah lama digunakan dalam industri tekstil seperti dalam pembuatan permadani, benang, batik maupun kosmetik. Penggunaan pewarna sintetis dalam industri tekstil dinilai lebih efisien dibanding dengan pewarna alami karena daya ikatnya yang kuat pada serat kain, lebih praktis, efisien dan ketersediaannya juga terjamin. Tingginya pemakaian zat pewarna pada kegiatan industri tekstil akan berpengaruh terhadap dampak pada peningkatan jumlah bahan pencemar dalam limbah cair yang dihasilkan dan akan dibuang ke lingkungan (Nugroho dan Ikbal, 2005).
Zat warna yang terkandung pada limbah akan mencemari lingkungan perairan yang berdampak pada berkurangnya nilai estetika suatu perairan serta dapat menghalangi penetrasi sinar matahari yang akan mengganggu kehidupan biota air.
Akibat yang ditimbulkan dari pembuangan limbah cair yang belum diolah terlebih dahulu akan mengganggu keseimbangan ekosistem. Sehingga untuk mencegah hal tersebut terjadi perlu dilakukan pengolahan limbah terlebih dahulu sebelum dibuang ke lingkungan.
Pengolahan limbah secara konvensional tidak efisien dalam mengurangi senyawa rekalsitran pewarna sintesis yang bersifat non biodegradable. Senyawa rekalsitran yang terdapat pada pewarna azo akan menjadi sumber penyakit apabila terlalu lama berada di lingkungan karena sifatnya yang karsinogen dan mutagenik maka perlu dicari alternatif yang efektif dalam menguraikan limbah tersebut di lingkungan (Christina, 2007). Untuk mengurangi kandungan senyawa rekalsitran dilakukan proses pengolahan limbah dengan menggunakan metode kimia maupun fisika diantaranya adalah : adsorpsi, tansformasi kimia, insenerasi, fotokatalis maupun ozonasi. Semua metode tersebut efektif dalam mengurangi dampak yang ditimbulkan dari pembuangan effluent (Banat et al., 1996; De Moraes et al., 2000).
Pengolahan limbah dengan menggunakan bahan kimia dikhawatirkan akan menimbulkan permasalahan baru yang diakibatkan oleh residu-residu senyawa kimia
UNIVERSITAS SUMATERA UTARA
2
yang akan terakumulasi selama proses pengolahan limbah. Pengolahan limbah dengan menggunakan metode fisika dibutuhkan biaya yang cukup besar untuk menyiapkan alat dan teknologinya. Dengan semakin berkembangnya ilmu pengetahuan para peneliti mulai tertarik pada pengolahan limbah dengan menggunakan agen biologi khususnya bakteri yang mampu mendegradasi zat warna pada limbah cair industri tekstil. Disamping itu biodegradasi dengan menggunakan metode biologi dinilai lebih ramah lingkungan.
Sejauh ini telah banyak dilakukan penelitian tentang bakteri yang mampu mendegradasi pewarna tekstil karena di dalam limbah cair pewarna tersebut mengandung banyak nutrisi organik yang dapat digunakan untuk pertumbuhan bakteri. Beberapa penelitian tentang penggunaan bakteri pendegradasi pewarna sintetis diperoleh beberapa jenis mikroorganisme diantaranya adalah : Alcaligenes eutrophus, Bacillus subtilis, Klebsiella pneumonia, Pseudomonas stutzeri, dan sphingomonas sp. (Stolz, 2001).
Selain mengandung nutrisi organik limbah cair industri tekstil mempunyai kadar salinitas yang tinggi sehingga bakteri halotoleran dapat tumbuh pada kondisi yang kurang menguntungkan dan bakteri ini juga dapat digunakan untuk mengurangi kadar toksisitas logam berat pada suatu lingkungan serta bioremediasi pencemaran oli (Delille et al., 1998; Margesin and Schinner, 2001) maupun pencemaran yang diakibatkan oleh senyawa oxyanion (Nriagu, and Payna, 1988;
Kinkle et al., 1994). Namun, penggunaan bakteri halotoleran dalam dekolorisasi limbah cair pewarna masih jarang dilakukan. Dengan demikian, tujuan dilakukannya penelitian ini adalah untuk mengetahui peranan bakteri halotoleran dalam mendegradasi zat warna sintetis.
1.2 Perumusan Masalah
Isolasi bakteri halotoleran dari pulau Mursala dalam dekolorisasi pewarna sintetis belum pernah dilakukan. Isolat bakteri halotoleran tersebut diharapkan mampu berpotensi dalam mengurangi kadar zat warna tekstil sintetis komersil. Isolat yang paling potensial dalam dekolorisasi zat warna akan diidentifikasi dengan menggunakan gen penyandi 16S rRNA dan diharapkan isolat yang diperoleh dapat dikembangkan lebih lanjut.
UNIVERSITAS SUMATERA UTARA
1.3 Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah :
a. Mengisolasi dan menguji kemampuan isolat bakteri yang paling potensial dalam dekolorisaasi zat warna sintetis komersil
b. Untuk mengetahui jenis atau spesies dari bakteri halotoleran yang terpilih sebagai isolat potensial berdasarkan gen penyandi 16S rRNA
1.4 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat menjadi acuan data dan sumber informasi mengenai bakteri yang mampu dalam dekolorisasi zat warna yang berasal dari air laut di sekitar pulau Mursala dalam skala laboratorium sehingga didapatkan bakteri yang paling potensial dan untuk selanjutnya dapat digunakan dalam pengurangan warna (decolorization) limbah cair industri tekstil sekaligus mengurangi dampak cemaran pewarna tekstil dan lebih aman saat dibuang ke lingkungan.
UNIVERSITAS SUMATERA UTARA
BAB 2
TINJAUAN PUSTAKA
2.1 Zat Warna
Zat pewarna adalah senyawa organik tidak jenuh dengan gugus kromofor pembawa warna dan gugus ausokrom yang merupakan pengikat antara kromofor dan serat inertnya. Gugus kromofor merupakan gugus yang menyebabkan warna dapat menyerap panjang gelombang secara selektif (Bajpai et al., 1993).
Gugus kromofor (pembawa warna) memiliki beberapa nama gugus dan daya ikat warna terhadap serat yang akan diwarnai diantaranya adalah nitroso, nitro, grup azo, grup karbonil, grup karbon-nitrogen, dan grup karbon sulfur sedangkan daya ikat gugus ausokrom terdiri dari dua golongan, yaitu: golongan kation : -NII2: NIIR;
-NR2 seperti –NR2CI dan golongan anion : -SO3H3; -OH, -COOH seperti –O; -SO3. Nitrogen yang terkandung dalam senyawa hidrokarbon aromatik, senyawa turunan fenol dan senyawa-senyawa hidrokarbon lain yang mengandung nitrogen akan membentuk warna yang sesuai dengan gugus kromofor (Manurung et al., 2004).
Senyawa organik rantai panjang adalah senyawa yang terdapat pada pewarna tekstil dan berdasarkan struktur kimianya zat pewarna tekstil dibedakan menjadi beberapa jenis (Nugroho dan Ikbal, 2005). Penggolongan zat warna menurut “Colours Index”
volume 3 menggolongkan zat warna tersebut berdasarkan perbedaan sistem kromofornya misalnya zat warna Azo, Antrakuinon, Ftalosia, Nitroso, Indigo, Benzodifuran, Okazin, Polimetil, Di- dan Tri-Aril, Karbonium, Polisiklik, Aromatik Karbonil, Quionftalen, Sulfer, Nitro, Nitrosol dan lain-lain (Heaton, 1994).
Sedangkan Berdasarkan metode aplikasinya, pewarna sintetik dapat dikelompokkan menjadi pewarna asidik, pewarna alkalin, pewarna langsung, pewarna disperse, pewarna mordant, pewarna reaktif, pewarna sulfur, pewarna vat dan pewarna azo yang tidak larut (Carmen and Daniela, 2012).
Produksi zat pewarna tekstil dari tahun ke tahun terus meningkat seiring dengan naiknya permintaan pasar. Hal ini juga berkaitan dengan semakin berkembangnya industri tekstil dan industri lainnya yang membutuhkan zat pewarna.
UNIVERSITAS SUMATERA UTARA
2.2 Zat Warna Azo
Zat warna azo banyak juga digunakan untuk pencelupan kain dimana persentase penggunaannya dalam industri tekstil hampir sebesar 70% (Carliell, 1995). Selain itu zat warna azo merupakan jenis zat warna sintetis yang cukup penting dalam industri tekstil karena lebih dari 50% zat warna dalam daftar Colours Index zat warna azo mempunyai lingkungan warna yang sangat luas diantaranya adalah warna kuning, merah, jingga, biru, AL (Navy Blue), violet dan hitam hanya warna hijau yang sangat terbatas (Manurung et al., 2004).
Zat warna reaktif azo menurut kriteria Uni Eropa untuk bahan berbahaya adalah tergolong rendah. Zat warna azo umumnya mempunyai LD (Lethal Dosis)50
sebesar 250-200 mg/kg berat badan dan hanya sedikit yang mempunyai LD50 dibawah 250 mg/kg berat badan. Toksisitas akut zat warna azo relatif rendah namun dampak yang ditimbulkan zar warna tersebut pada perairan dapat mengganggu aktifitas fotosintesis mikroorganisme yang mengakibatkan berkurangnya kandungan oksigen pada badan air akibat terhambatnya penetrasi sinar matahari (Sastrawidana, 2008).
Struktur kompleks aromatik yang dimiliki zat warna azo menjadikannya bersifat rekalsitran dan stabil sehingga sulit untuk dibiodegradasi dan xenobiotik dialam (Stolz, 2001: Singh et al., 2015). Selain sulit dibiodegradasi zat warna azo memiliki sifat toksik, mutagenik dan beberapa diantaranya dapat bersifat karsinogenik.
2.3 Dekolorisasi Zat Warna dengan Metode Biologi
Dekolorisasi adalah metode biologi yang dimaksudkan sebagai penghilang zat warna (Koneman, 1994). Metode biologi mempunyai tiga mekanisme yang dapat dilakukan pada tahap dekolorisasi yaitu biodegradasi, bioakumulasi dan biosorpsi.
Ketiga metode tersebut telah dibuktikan memiliki potensial dalam menghilang zat warna yang terdapat pada limbah pewarna tekstil (Padmesh et al., 2005).
Biodegradasi adalah pengolahan limbah yang ramah lingkungan dengan biaya yang lebih murah dibanding dengan metode fisika dan kimia karena dalam biodegradasi yang menggunakan agen biologi yang memliki kemampuan dalam mendegradasi/dekolorisasi senyawa non degradable.
UNIVERSITAS SUMATERA UTARA
6
Penelitian perombakan zat warna ini berawal dari penemuan hasil metabolisme hewan mamalia yang diberi makanan campuran zat warna azo. Zat warna azo yang masuk ke dalam pencernaan hewan ini direduksi oleh mikroflora yang berada di dalam saluran pencernaan pada kondisi anaerobik. Ikatan azo yang direduksi ini menghasilkan produk samping (intermediat) yaitu turunan amino azo benzen yang dikhawatirkan karsinagen. Meyer (1981) menjelaskan bahwa reduksi azo dikatalisa oleh enzim azo reduktase di dalam liver sama dengan reduksi azo oleh mikroorganisme yang ada di dalam pencemaran pada kondisi anaerobik. Dari hasil penelitian-penelitian inilah berkembang penelitian lanjutan perombakan zat warna secara anaerobik. Selanjutnya biodegradasi zat warna dengan kondisi anaerobik ini cukup potensial untuk merombak zat warna tekstil.
Penggunaan mikroorganisme dalam mendegradasi zat warna sintetis adalah dengan memutus rantai siklik ataupun ikatan rangkapnya (Bergbauer et al., 1991).
Mikroorganisme yang digunakan untuk mendegradasi zat warna bakteri akan menghasilkan enzim dan mengubah struktur kimia polutan menjadi lebih sederhana sehingga tingkat toksisitasnya rendah. Enzim yang dihasilkan bakteri kemudian akan digunakan untuk mendegradasi zat warna (Yanu, 2013). Proses biodegradasi yang dilakukan pada pewarna juga akan mengubah struktur kimiawi pada gugus kromofor atau ausokrom maupun pada kedua gugus tersebut (Glenn and Gold, 1983) terjadi proses reduksi dimana ikatan N-N yang terdapat pada pewarna azo digantikan oleh HN-HN dari NH2.
Enzim reduktif yang dihasilkan beberapa strain bakteri yang spesifik berfungsi memutus ikatan N-N yang akan digantikan oleh 2 molekul dari NH2.
Produk yang dihasilkan dalam proses reduksi adalah 2 amino aromatik yang akan menyebabkan tidak terserapnya cahaya pada spectrum visible yang menandakan bahwa terjadinya proses reduksi dan proses dekolorisasi pewarna azo (Tan and Field, 2001).
2.4 Limbah Cair Industri Tekstil
Karakteristik air limbah tekstil adalah mempunyai intensitas warna berkisar 50 - 2500 skala Pt-Co, nilai COD 150-12000 mg/L dan nilai BOD mencapai 80-6000 mg/L (Azbar, 2004). Tingginya intensitas warna pada air limbah tekstil disebabkan
UNIVERSITAS SUMATERA UTARA
karena sekitar 40% dari zat warna reaktif azo yang digunakan dalam proses pencelupan kain terbuang sebagai limbah sedangkan kandungan bahan organik sangat tinggi terkait dengan bahan-bahan yang digunakan dalam proses tekstil seperti enzim, detergen, zat warna dan bahan-bahan tambahan lainnya. Parameter COD dan BOD yang dimiliki air limbah tekstil jauh di atas baku mutu jika ditinjau dari KepMen LH No.51/MENLH/10/1995 tentang baku mutu limbah cair bagi kegiatan industri yaitu 100-300 mg/L untuk COD dan 50-150 mg/L untuk BOD. Untuk itu, air limbah industri tekstil harus diolah terlebih dahulu sebelum dibuang ke lingkungan.
Masalah paling umum yang ditimbulkan dari menjamurnya industri tekstil di Indonesia adalah masalah pembuangan limbah cair industri tekstil ke badan-badan air tanpa pengolahan yang memadai. Limbah cair industri tekstil tersebut mengandung berbagai komponen yang berbahaya baik bagi lingkungan maupun bagi manusia yang memanfaatkan badan-badan air di sekitar industri tekstil (Greenpeace, 2013). Limbah cair yang berasal dari proses pencelupan merupakan masalah utama yang menyebabkan pencemaran air dan tanah karena karakteristik fisik dan kimianya yang memberikan dampak negatif terhadap lingkungan. Menurut Hood dan Suryo (1982) zat pencemar dalam buangan cair industri dapat digolongkan menjadi empat kelompok, yaitu zat pencemar yang mengapung (floating pollutan), zat pencemar yang melayang (suspended pollutant), zat pencemar yang larut (dissolved pollutant) dan zat pencemar yang terendap (settleable pollutant). Zat pencemar yang proses pencelupan penambahan dengan menggunakan bahan kimia dapat membantu penyempurnaan melekatnya zat warna.
2.5 Bakteri Halotoleran
Bakteri halotoleran adalah mikroorganisme ekstrimofil yang dapat tumbuh secara optimal di lingkungan dengan konsentrasi garam yang tinggi. Bakteri halotoleran dapat tumbuh secara optimal dengan kadar garam atau tanpa kadar garam yang tinggi. Kadar garam (NaCl) habitat bakteri halotoleran berkisar antara 2%
(setara dengan 0,3 M) hingga 30% (setara dengan 5 M) (Ford, 1993; Ventosa and Nieto, 1995). Perairan samudera salinitasnya berkisar antara 34-35 ppm sedangkan di perairan pantai salinitasnya bisa turun rendah.
UNIVERSITAS SUMATERA UTARA
8
Sebaliknya di daerah dengan penguapan yang kuat, salinitas bisa sangat tinggi (Nontji, 1987). Untuk melindungi aktivitas metabolisme bakteri halotoleran pada habitat dengan salinitas tinggi (2% - 30%) tersebut dan mencegah hilangnya air dari dalam sel maka bakteri halotoleran mengakumulasi compatible solute.
Compatible solute didefinisikan sebagai molekul organik terlarut, sifatnya netral, berat molekulnya kecil dan tidak bercampur dengan metabolisme sel yang menjaga sel agar tetap dalam kondisi isotonis (Roβler dan Mϋller, 2002).
2.6 Gen 16S rRNA
Ribosomal RNA adalah RNA yang terdapat pada ribosom makhluk hidup yang berperan dalam sintesis protein (Clarridge, 2004). Pada organisme prokariotik sendiri ada tiga macam rRNA, yaitu 23S rRNA (S=Svedberg units; 2900 nukleotida), 16S rRNA (1550 nukleotida) dan 5S rRNA. Molekul 16S rRNA memiliki informasi genetik yang lebih mudah dianalisis. Molekul 23S rRNA struktur sekunder dan tersiernya cukup panjang yang berpengaruh terhadap sulitnya analisis, sedangkan molekul 5S rRNA urutan basanya terlalu pendek sehingga tidak ideal dalam analisis statistika (Madigan et al, 2010).
2.7 Metode Spektrofotometri
Metode yang digunakan untuk mengukur nilai absorban dekolorisasi zat warna pada percobaan ini adalah metode spektrofotometri. Prinsip kerja dari metode ini adalah pengukuran absorban yang diakibatkan adanya penyerapan sinar oleh bahan yang dianalisis pada panjang gelombang tertentu. Jika suatu radiasi elektromagnetik menimpa suatu materi dan pada materi tersebut terjadi absorpsi selektif dimana materi akan menyerap komponen radiasi pada panjang gelombang yang berbeda dan dalam jumlah yang berbeda pula (Sastrohamidjojo, 2001).
Berdasarkan panjang gelombang untuk pengukuran, spektrofotometri absorpsi dibedakan menjadi 2 yakni spektrofotometri ultraviolet tampak (UV-Vis) dan spektrofotometer inframerah (UV-IR). Spektofotometer UV-Vis memiliki spektrum di daerah UV sama dengan panjang gelombang cahaya 200-400 nm sedangkan pada daerah sinar tampak sama dengan panjang gelombang cahaya 400-
800 nm (Sastrohamidjojo, 2001).
UNIVERSITAS SUMATERA UTARA
METODOLOGI PENELITIAN
3. 1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan April 2017 sampai Maret 2018 di laboratorium Mikrobiologi Departemen Biologi Fakultas Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan.
3.2 Sampling
Sampling dilakukan dengan cara mengambil sampel air laut disekitar pulau Mursala, desa Tapian Nauli, kecamatan Tapanuli Tengah yang diambil secara acak dari beberapa titik sampling dengan menggunakan botol winkler. Air laut yang telah diambil dimasukkan ke dalam cool box yang berisi es untuk selanjutnya dibawa ke laboratorium.
3.3 Isolasi Bakteri
Bakteri diisolasi dari air laut yang telah dikoleksi dari laut sekitar pulau Mursala. Air laut diambil sebanyak 1 ml dan diinokulasikan ke dalam labu erlenmeyer yang berisi media Nutrient Broth (NB). Media inokulum diinkubasi pada inkubator bergoyang dengan kecepatan 130 rpm dan suhu 300 C selama 24 jam.
Selanjutnya media inokulum diambil 0,1 ml dan dimasukkan ke dalam tabung yang berisi 9,9 ml akuades steril. Isolat diencerkan sampai 10-8. Lalu isolat dengan pengenceran 10-6, 10-7 dan 10-8 diambil sebanyak 0,1 ml dan diinokulasikan ke dalam cawan petri yang berisi media Zobell yang telah memadat lalu diratakan dengan menggunakan Joy stick dan diinkubasi selama 24 jam. Dilakukan teknik biakan murni (Forgacs, 2004).
3.4 Karakterisasi Bakteri secara Morfologi dan Uji Biokimia
Karakterisasi bakteri secara morfologi dan uji biokimia diantaranya adalah uji motilitas, uji katalase, uji pewarnaan Gram, uji Triple Sugar Iron Agar (TSIA), uji
UNIVERSITAS SUMATERA UTARA
10
sitrat (Cappucino and Sherman, 2005). Uji biokimia yang dilakukan untuk memperkuat identifikasi bakteri adalah uji sitrat (Abbot et al., 2003).
a. Uji Motilitas
Isolat bakteri diambil dengan jarum ose, kemudian isolat bakteri diinokulasikan dengan cara ditusukkan tegak lurus satu kali pada medium semi solid (SIM Agar) lalu diinkubasi pada suhu 25 0C - 28 0C selama 18-24 jam. Bakteri yang bersifat motil akan tumbuh menyebar tidak hanya pada daerah yang ditusuk (Cappucino and Sherman, 2005).
b. Uji Katalase
Preparat ulas bakteri dibuat stok kultur sebanyak satu ose, kemudian ditambahkan 2-3 tetes reagen H2O2 pada preparat. Hasil positif apabila terbentuk gelembung gas dan hasil negatif apabila tidak terbentuk gas.
c. Uji Pewarnaan Gram
Gelas objek dibersihkan dengan menggunakan alkohol 70% dan diberi label.
Diteteskan akuades pada permukaan gelas objek. Kemudian isolat bakteri diambil dengan jarum ose steril, kemudian isolat dicampur dengan akuades dan diulas secara merata pada permukaan gelas objek. Selanjutnya dilakukan fiksasi panas dengan cara melewatkan preparat di atas api. Sediaan mikroskopik yang sudah kering ditetesi dengan Kristal violet secara merata dan didiamkan selama satu menit. Kemudian larutan lugol diteteskan pada preparat sampai merata dan didiamkan maksimal selama 30 detik. Selanjutnya preparat dicuci dengan akuades dan dikeringkan.
Kemudian larutan safranin diteteskan pada preparat sampai merata dan didiamkan selama dua menit. Selanjutnya preparat dicuci dengan akuades dan dikeringkan (Cappucino and Sherman, 2005). Diamati isolat bakteri menggunakan mikroskop compound Nikon eclipse 50i. Isolat Bakteri yang termasuk Gram (+) ditunjukkan dengan sel bakteri berwarna ungu sedangkan bakteri Gram (-) sel bakteri berwarna merah.
UNIVERSITAS SUMATERA UTARA
d. Uji Triple Sugar Iron Agar (TSIA)
Isolat bakteri diambil sebanyak 1 ose dari masing-masing stok kultur kemudian diinokulasikan dengan cara digoreskan pada media TSIA. Selanjutnya diinkubasi selama 2-3 x 24 jam pada suhu 37 0C. perubahan yang diamati setelah inkubasi adalah warna media kuning menandakan asam, warna media menjadi merah menandakan media mmenjadi basa, warna media menjadi hitam menandakan terbentuknya H2S dan bila media terangkat menandakan bahwa mikroba tersebut mampu untuk memproduksi gas.
e. Uji Sitrat
Isolat bakteri diambil dengan menggunakan jarum ose lalu isolat diinokulasikan pada medium simmon’s citrate miring. Selanjutnya kultur diinkubasi pada suhu 37 0C selama 48 jam. Uji positif ditandai dengan perubahan media dari hijau menjadi biru dan warna hijau menunjukkan reaksi negatif (Cappucino and Sherman, 2005).
3.5 Uji Potensial Dekolorisasi Pewarna Azo
Sepuluh isolat bakteri yang didapat dari hasil isolasi kemudian dilakukan uji skrinning untuk mendapatkan isolat potensial dalam mendekolorisasi zat warna tekstil azo. Masing-masing isolat bakteri subkultur dibuat suspensi absorbansi/kekeruhan standard McFarland (OD600 = 0,1) yang diukur dengan spektrofotometer. Lalu suspensi isolat bakteri diambil sebanyak 500 µl dan diinokulasikan ke dalam labu erlenmeyer 100 ml yang berisi media MSM cair + pewarna azo. Konsentrasi pewarna azo, kadar salinitas dan pH yang digunakan untuk skrinning dekolorisasi adalah 600 ppm, 5 % dan pH 6. Selanjutnya mulut labu erlenmeyer ditutup dengan kapas steril dan keseluruhan labu Erlenmeyer dibungkus dengan aluminium foil. Labu erlenmeyer kemudian diinkubasi pada inkubator bergoyang dengan kecepatan 130 rpm dan suhu 300 C selama 12 hari. Setelah 12 hari kemudian diukur konsentrasi zat warna dengan menggunakan spektofotometer pada panjang gelombang zat warnanya adalah merah (482 nm).
UNIVERSITAS SUMATERA UTARA
12
3.6 Uji Degradasi Pewarna Azo
Variasi perlakuan uji degradasi memiliki parameter pH, konsentrasi zat warna dan kadar salinitas. Rentang pH yang digunakan adalah pH6, 7 dan 8. Untuk menyesuaikan pH asam ditambahkan HCL sedangkan untuk pH basa dapat ditambahkan dengan NaOH. Rentang konsentrasi zat warna yaitu 600, 800 dan 1000 ppm dan rentang kadar salinitas adalah sebesar 0%, 5% dan 10% dari 40,5 g NaCl.
Uji degradasi dilakukan dengan metode Nyoman (2010) yang telah dimodifikasi.
Masing-masing isolat terpilih yang telah dibuat suspensi absorbansi/kekeruhan standard McFarland (OD600 = 0,1). Suspensi isolat yang terpilih kemudian diambil sebanyak 500 µL dan diinokulasikan ke dalam labu Erlenmeyer 100 mL yang berisi media MSM cair + pewarna azo (Merah) yang telah dibuat variasi parameternya.
Selanjutnya mulut labu erlenmeyer ditutup dengan kapas steril dan keseluruhan labu Erlenmeyer dibungkus dengan aluminium foil. Labu Erlenmeyer kemudian diinkubasi pada inkubator bergoyang dengan kecepatan 130 rpm dan suhu 300 C selama 12 hari. Setelah 12 hari kemudian diukur konsentrasi zat warna dengan menggunakan spektofotometer pada panjang gelombang zat warnanya adalah merah (482 nm).
3.7 Pengukuran Persentase Degradasi Zat Warna Azo
Pengukuran menggunakan spektrofotometer (Techom UV Vis 1100, Jepang), diperoleh data absorbansi zat warna azo dalam sampel. Setelah konsentrasi zat warna azo dari masing-masing sampel sudah diketahui, selanjutnya menentukan % efisensi degradasinya. Persen efisiensi degradasi pewarna azo (%E) dapat dihitung dengan menggunakan rumus di bawah ini.
% E = Nilai Serapan Awal – Nilai Serapan Akhir x100 % Nilai Serapan Awal
3.8 Identifikasi Bakteri Halotoleran Berdasarkan Gen Penyandi 16S rRNA a. Isolasi Genom Bakteri
Isolasi DNA bakteri halotoleran dilakukan melalui proses freeze and thaw.
Tabung eppendorf 1,5 ml diisi dengan 100 µl akuabidest dalam kondisi aseptis, kemudian kultur bakteri murni yang berumur 24 jam diambil sebanyak 1 ose dan
UNIVERSITAS SUMATERA UTARA
diinokulasikan ke dalam tabung eppendorf tersebut. Selanjutnya suspensi sel dibekukan pada suhu -10oC sampai larutan mengkristal lalu dicairkan pada suhu 90oC selama 10 menit. Pengulangan siklus dilakukan sebanyak 5 kali untuk efisiensi pemecahan sel (Choi, Y et al., 1998) yang dimodifikasi (Nursyirwani & Kathy, 2007).
b. Isolasi Fragmen 16S rRNA
DNA hasil isolasi digunakan untuk amplifikasi gen 16S rRNA yang dilakukan dengan mesin Polymerase Chain Reaction (PCR) (Veriti® 96-Well Thermal Cycler 4375786, Applied Biosystems, Singapore) dengan primer universal spesifik 16S rRNA untuk prokariot, yaitu 63f (5’-CAG GCC TAA CAC ATG CAA GTC-3’) dan 1387r (5’-GGG CGG WGT GTA CAA GGC-3’) (Merchesi et al., 1998).
Untuk membuat campuran reaksi PCR dengan volume 25 µl, bahan-bahan berikut dimasukkan ke dalam tabung eppendorf 0,2 ml: Master Mix 2X 12,5 µl, primer 63f 10 (pmol/µl) 1 µl , primer 1387r 10 (pmol/µl) 1 µl, DNA template 2 µl, Nuclease Free Water 8,5 µl sehingga volume total 25 µl. Kemudian mesin PCR diprogramkan dan dijalankan berdasarkan suhu: untuk proses pradenaturasi 94 oC selama 2 menit, denaturasi 92 oC selama 30 detik, annealing 60 oC selama 30 detik, elongasi atau perpanjangan primer 72 oC selama 1 menit, dan post PCR 72 oC selama 5 menit. Ketiga proses ini dijalankan sebanyak 35 siklus. Hasil PCR divisualisasi melalui proses elektroforesis.
c. Sekuensing dan Analisis Sekuensing
Gel elektroforesis disiapkan dengan 1% agarosa (1 gram agarosa dalam 100 ml TAE 1X), dipanaskan dan distirer sampai larut, didinginkan kemudian dituang pada alat elektroforesis yang sudah dirakit dan dibiarkan hingga memadat. Setelah memadat, dilepaskan sisir cetakan elektroforesis secara perlahan kemudian, wadah yang sudah berisi gel diberi larutan peyangga TAE 1X hingga batas yang ditentukan.
Kemudian masing-masing sampel dimasukkan pada sumur-sumur gel. Pada waktu elektroforesis diberikan marker atau penanda molekul DNA 1 kb. Elektroforesis dilakukan pada kondisi 80 volt dan 500 mA selama 60 menit, gel hasil elektroforesis
UNIVERSITAS SUMATERA UTARA
14
diangakat dan direndam pada lauran EtBr 1% selama 5 menit, selanjutnya gel elektroforesis dibilas dalam akuades selama 10 menit, kemudian diangkat dan dideteksi dengan UV-transluminator.
DNA hasil amplifikasi dikirim ke PT. Biosains Medika Indonesia, Jakarta Selatan untuk dimurnikan dan disekuen oleh Macrogen, Seoul, South Korea dengan Automated DNA sequencer (ABI 3730xl DNA Analyzer, Applied Biosystems). Data sekuen dibandingkan dengan data di GenBank pada database The National Center for Biotechnology Information (NCBI), menggunakan program Basic Local Alignment Search Tool (BLAST).
UNIVERSITAS SUMATERA UTARA
HASIL DAN PEMBAHASAN
4.1 Karakteristik Morfologi Bakteri dari Air Laut
Bakteri hasil isolasi dibuat kultur murni untuk dapat dikarakterisasi morfologinya diantaranya adalah meliputi bentuk, tepi, elevasi, warna dan bentuk penataan koloni bakteri serta pewarnaan gram bakteri. Pengamatan morfologi dilakukan pada kultur yang telah diinkubasi selama 24 jam dan dihasilkan data seperti yang ditunjukan pada Tabel 4.1 berikut.
Tabel 4.1 Karakteristik Morfologi Bakteri dari Air Laut
Isolat bakteri
Morfologi koloni
Bentuk Tepi Elevasi Warna Penataan
DH 1 Irregular Entire Flat Putih Streptococcus
DH 2 Filamentous Filamentous Flat Putih Streptococcus
DH 3 Irregular Lobate Flat Putih Streptococcus
DH 4 Irregular Irregular Flat Putih kekuningan Monobacil
DH 5 Circular Entire Raised Putih Streptococcus
DH 6 Circular Entire Flat Putih Monococcus
DH 7 Irregular Entire Convex Putih Streptococcus
DH 8 Circular Entire Raised Putih Streptobacil
DH 9 Irregular Filamentous Flat Putih Monobacil DH 10 Circular Entire Raised Putih kekuningan Monobacil
Hasil isolasi bakteri air laut didapatkan 10 isolat dengan karakteristik bentuk morfologi irregular ada 5 isolat, 1 isolat filamentous dan 4 circular dimana tepi koloni isolat yang didapat ada 6 isolat yang mempunyai tepi entire, 2 isolat dengan tepi filamentous, 1 isolat dengan tepi lobate, 1 dengan tepi irregular. Sedangkan elevasi isolat yang didapat ada 6 isolat yang mempunyai elevasi flat, 3 isolat dengan elevasi raised dan 1 isolat dengan elevasi convex. Warna isolat yang didapat hampir semuanya berwarna putih kecuali untuk isolat DH4 dan DH10 yang mempunyai warna putih kekuningan. Penataan bakteri terdapat 6 isolat dengan bentuk penataan bulat (coccus) dengan penataan sel yang berbeda-beda yaitu 5 isolat streptococcus dan 1 isolat monococcus. Sedangkan untuk 4 isolat yang tersisa bentuk penataannya adalah batang (bacil) dengan penataan sel 3 isolat monobacil dan 1 isolat streptobacil. Menurut Aninditia et al., (2013) parameter morfologi koloni sel dalam
UNIVERSITAS SUMATERA UTARA
16
media pertumbuhan yang diamati berupa warna, bentuk, ukuran dan letak koloni dalam medium merupakan salah satu cara yang masih diperlukan dalam menentukan jenis bakteri.
Isolat bakteri yang telah dikarakterisasi morfologinya kemudian dilanjutkan dengan uji biokimia yang meliputi uji hidrolisis pati, uji hidrolisis gelatin, uji sitrat, uji hidrogen sulfida dan fermentasi, uji motilitas dan uji katalase serta pewarnaan gram. Pengujian terhadap media spesifik masing-masing uji akan menunjukkan akifitas biokimia yang berbeda apabila isolat bakterinya berbeda. Hasil pengujian biokimia menunjukkan bahwa isolat bakteri yang didapat memiliki karakteristik biokimia yang berbeda seperti disajikan pada Tabel 4.2 berikut.
Tabel 4.2 Karakteristik Biokimia dan Sifat Gram Bakteri
Isolat Bakteri
Uji Biokimia
Hidrogen Sulfida & Fermentasi Gula
Hidrolisis Pati Hidrolisis Gelatin Sitrat Slunt Butt Motillitas Katalase Gram
DH 1 + - - Kuning Kuning + + -
DH 2 + - + Merah Kuning - + -
DH 3 + - - Merah Kuning + - +
DH 4 + - + Kuning Kuning + - +
DH 5 + - - Merah Kuning + - -
DH 6 + - + Kuning Kuning + - -
DH 7 + - - Merah Kuning + + -
DH 8 - - - Merah Kuning + - +
DH 9 + - - Merah Kuning + + -
DH 10 - - - Merah Kuning + + +
Hasil pengujian biokmia dan sifat Gram bakteri yang telah dilakukan menunjukkan bahwa kesepuluh isolat yang didapat merupakan bakteri yang berbeda.
Dari kesepuluh isolat tersebut diharapkan memiliki karakteristik metabolisme sel yang berbeda.
Berdasarkan data di atas didapat 6 isolat bakteri yang memiliki karakteristik Gram negatif dan 4 isolat bakteri Gram positif. Bakteri Gram negatif mempunyai komposisi dinding sel dengan membran luar yang tersusun dari membran lipid yang bersifat nonpolar dan sedikit peptidoglikan. Berbeda dengan bakteri Gram positif
UNIVERSITAS SUMATERA UTARA
yang mempunyai mempunyai peptidoglikan yang tebal serta polisakarida dan asam amino pada peptidoglikan bersifat sangat polar.
4.2 Uji Potensial pada Media Cair Minimum Salt Medium (MSM)
Isolat-isolat yang telah dikarakterisasi secara morfologi dan uji biokima selanjutnya dilakukan uji skrinning untuk mengetahui potensial atau tidaknya isolat dalam menguraikan zat warna azo. Isolat diuji pada media 45,5 ml MSM cair + zat warna yang mengandung kadar garam sebesar 5% dengan penambahan zat warna dengan konsentrasi 600 ppm dan pH 6 serta penambahan suspense bakteri sebanyak 500 µl. Pada tahap uji potensial isolat yang mempunyai kemampuan dalam menguraikan zat warna azo akan diuji pada perlakuan selanjutnya. Persentase penguraian zat warna dapat dilihat pada Tabel 4.3 berikut.
Tabel 4.3 Uji Potensial Isolat Bakteri Halotoleran
No. Kode Isolat Daya Dekolorisasi (%)
1. DH1 3,03
2. DH2 19,40
3. DH3 7,26
4. DH4 1,39
5. DH5 5,31
6. DH6 -1,27
7. DH7 -1,13
8. DH8 -0,97
9. DH9 1,43
10. DH10 -0,60
Hasil uji potensial menunjukkan bahwa dari kesepuluh isolat yang didapat dari hasil isolasi awal memiliki kemampuan yang berbeda dalam mendekolorisasi zat warna tekstil. Kemampuan bakteri dalam menguraikan zat warna tekstil sangat berbeda antara isolat satu dengan yang lainnya. Ada beberapa bakteri yang mampu menguraikan zat warna tekstil dan ada juga bakteri yang tidak mampu menguraikan zat warna.
Berdasarkan Tabel 4.3 di atas didapatkan dua isolat yang potensial dalam dekolorisasi zat warna yaitu isolat DH2 dan DH3 dengan daya dekolorisasi masing- masing 19,4 % dan 7,26%. Hasil ini diperoleh dengan pengukuran dengan menggunakan sperktofotometer. Namun, ada beberapa isolat yang tidak mampu
UNIVERSITAS SUMATERA UTARA
18
dalam mendekolorisasi zat warna diantaranya adalah isolat DH6, DH7, DH8 dan DH10.
Isolat DH2 memiliki daya dekolorisasi tertinggi yang mengindikasikan bahwa bakteri tersebut lebih mampu menyesuaikan diri pada kondisi lingkungan yang tidak melimpah akan nutrisi. Bakteri mampu memanfaatkan zat organik yang terdapat pada zat warna tekstil. Aklimatisasi bakteri terhadap lingkungan baru pada waktu inkubasi hari ke-3, mampu ditolerir bakteri dengan baik, sehingga pertumbuhan bakteri halotoleran terus meningkat. Sedangkan untuk uji skrinning pada isolat bakteri DH6, DH7, DH8 dan DH 10 tidak terjadi dekolorisasi yang ditandai dengan semakin meningkatnya absorbansi. Absorbansi yang tinggi pada akhir pengamatan (hari ke-12) disebabkan oleh tingginya pertumbuhan koloni bakteri sehingga media yang berisi bakteri semakin keruh namun tidak diikuti dengan produksi enzim yang potensial dalam degradasi zat warna. Menurut Nugroho et al (2006), bahwa berbagai macam jenis bakteri mempunyai mekanisme kerja yang signifikan dalam menggunakan substrat, sehingga bakteri hanya bisa mendegradasi senyawa-senyawa spesifik dalam kisaran yang terbatas. Dalam mendekolorisasi pewarna, mikroorganisme membutuhkan kondisi lingkungan yang ideal untuk tumbuh. Kondisi lingkungan yang berpengaruh antara lain konsentrasi substrat, komposisi medium, konsentrasi pewarna, pH, sumber karbon, ketersediaan oksigen, dan nitrogen (Chang et al., 2001; Kapdan et al., 2003; Mendez-Paz et al. 2005).
UNIVERSITAS SUMATERA UTARA
4.3 Pengaruh Variasi Perlakuan pH, Konsentrasi Zat Warna dan Kadar Salinitas Terhadap Persentase Kemampuan Dekolorisasi Isolat DH2 Isolat terpilih dari hasil skrinning kemudian diuji lebih lanjut dengan variasi pH, konsentrasi zat warna dan kadar salinitas. Hasil dari perlakuan tersebut ditunjukkan pada Tabel 4.4 berikut.
Tabel 4.4 Rata-rata Daya Dekolorisasi Isolat DH2 Terhadap Variasi Perlakuan
Konsentrasi Zat Warna
(ppm)
Kadar Salinitas
(%)
Rata-Rata Absorbansi (nm)
Daya Dekolorisasi
(%) Hari Pengamatan Ke-
0 3 6 9 12
pH 6
600 0 1,69 1,67 1,62 1,59 1,49 11,69
5 2,17 2,08 1,97 1,82 1,74 19,67
10 2,67 2,50 2,33 2,25 1,94 27,09
800 0 2,14 2,08 2,04 2,02 1,99 7,26
5 2,24 1,89 1,81 1,79 1,68 24,84
10 2,78 2,48 2,24 1,20 2,18 21,55
1000 0 3,42 3,26 3,22 3,19 3,15 7,91
5 3,72 3,60 3,44 3,43 3,40 8,42
10 3,44 3,39 3,13 3,00 2,84 17,28
pH 7
600 0 1,86 1,81 1,72 1,71 1,70 8,49
5 1,76 1,53 1,38 1,34 0,98 44,48
10 2,39 2,22 2,18 2,14 2,09 12,46
800 0 1,73 1,57 1,36 1,29 1,22 29,28
5 1,89 1,62 1,47 1,32 1,27 32,48
10 1,91 1,89 1,88 1,85 1,83 4,17
1000 0 2,22 2,12 2,04 1,94 1,93 13,23
5 2,47 2,35 2,30 2,25 2,24 9,24
10 2,29 2,14 2,04 1,99 1,77 22,74
pH 8
600 0 2,38 2,33 2,29 2,27 2,22 6,86
5 2,17 1,52 1,51 1,47 1,09 49,64
10 2,38 2,35 2,30 2,29 2,28 4,24
800 0 1,90 1,77 1,75 1,66 1,61 15,22
5 1,82 1,66 1,57 1,54 1,50 17,91
10 2,03 1,99 2,19 2,11 2,10 -3,85
1000 0 2,26 1,75 1,73 2,19 2,18 3,52
5 2,46 2,41 2,38 2,35 2,32 5,65
10 2,58 2,60 2,53 2,51 2,47 4,18
UNIVERSITAS SUMATERA UTARA
20
Berdasarkan Tabel 4.4 dapat dilihat bahwa pengukuran aktivitas dekolorisasi dengan variasi parameter pH yang dilakukan pada kondisi awal, hari ke- 3 sampai hari ke- 12 dari beberapa variasi antara pH, konsentrasi zat warna dan kadar salinitas dengan menggunakan isolat DH2 menunjukan adanya penurunan warna dalam setiap interval waktu.
Penurunan zat warna pada hari ke -12 dengan daya dekolorisasi yang tertinggi diantaranya masing-masing adalah pada perlakuan kombinasi perlakuan variasi dengan pH 8, konsentrasi azo 600 ppm dan salinitas 5% ; pH 7, 600 ppm, 5%
dan pH 7, 800 ppm, 5% dengan daya dekolorisasi masing-masing adalah sebesar 49,64%, 44,48% dan 32,48%. Diantara semua perlakuan hasil terbaik diperoleh pada pH 8, konsentrasi azo 600 ppm dan salinitas 5% dengan penurunan 49,64%.
Pengaruh konsentrasi zat warna terhadap proses pengurangan zat warna umumnya berbanding terbalik, semakin tinggi konsentrasi zat warna maka kemampuan untuk menguraikan zat warna semakin berkurang. Berkurangnya kemampuan bakteri dalam mendekolorisasi zat warna disebabkan oleh adanya senyawa logam berat yang terkandung di dalam zat warna tekstil. Sehingga jika konsentrasi zat warna semakin tinggi maka kadar toksisitasnya juga meningkat. Hal ini dapat dilihat pada Tabel 4.4 bahwa kemampuan bakteri halotoleran semakin berkurang seiring dengan bertambahnya konsentrasi zat warna yang mengindikasikan bahwa toksisitas zat warna tersebut cukup tinggi sehingga dapat menghambat pertumbuhan bakteri. Menurut Hala et al (2010) mikroorganisme umumnya memiliki mekanisme perlindungan terhadap logam beracun untuk mempertahankan kehidupannya. Mekanisme ini melibatkan pembentukan logam dengan protein dalam membran sel, sehingga logam berat yang terkandung dalam pada zat warna tekstil tidak terakumulasi tanpa mengganggu pertumbuhan bakteri.
Proses reduksi terjadi karena rantai transport elektron intraselular ke mediator, yang mengakibatkan penghilangan warna. Kemungkinan lainnya adalah bakteri berinteraksi antara sistem transpor elektron intraseluler dan ekstraseluler pewarna melalui elektron mentransfer protein dalam membran luar (Brige et al., 2008).
Namun, konsentrasinya zat warna yang semakin tinggi mengakibatkan konsentrasi logam yang terakumulasi pun akan semakin tinggi. Akumulasi dari logam berat dari zat warna yang terlalu tinggi dapat menghambat pertumbuhan sel karna sistem
UNIVERSITAS SUMATERA UTARA
perlindungan organisme tidak mampu lagi mengurangi efek toksisitas logam yang terkandung pada zat pewarna. Lade et al (2015) juga melaporkan proses dekolorisasi oleh menggunakan bakteri konsorsium seperti kombinasi bakteri gram negatif Providencia rettgerei strain HSLi dan Pseudomonas sp. Sebagai kultur awal untuk mendegradasi limbah cair pewarna tekstil secara aerob.
Nutrien yang cocok untuk pertumbuhan bakteri dapat ditentukan oleh kondisi fisik lingkungan seperti air, oksigen, suhu dan pH. Selain kondisi fisik tersebut kadar salinitas sangat mempengaruhi pH dalam suatu perairan dimana kelarutan oksigen dan gas-gas akan berkurang seiring dengan meningkatnya salinitas. Penambahan garam juga berpengaruh terhadap banyaknya ion Cl- yang terionisasi yang dapat berbahaya bagi sel bakteri karena akan mengurangi kelarutan oksigen dalam air sehingga bakteri menjadi lebih sensitif terhadap karbondioksida (Fardiaz, 1985).
Walaupun demikian bakteri halotoleran dapat bertahan pada medium garam dengan konsentrasi tertentu mampu untuk menahan tekanan osmotik dari luar sehingga tidak mengalami lisis (Kushner, 1968). Adanya dekolorisasi dipengaruhi hasil dari aktivitas metabolisme mikroba. Hasil aktivitas dekolorisasi oleh beberapa kultur bakteri menghasilkan nilai yang berbeda-beda. Hal tersebut dapat disebabkan oleh zat warna Azo bukan merupakan substrat yang baik untuk aktivitas azoreductase pada beberapa kultur sehingga zat warna Azo akan lebih sulit untuk diangkut ke dalam sel bakteri dan karena adanya gugus fungsi yang terdapat dalam pewarna Azo tersebut. Studi terbaru menunjukkan bahwa adanya gugus fungsi dalam struktur pewarna azo misalnya gugus orto, meta, dan para dapat mempengaruhi kerentanan terhadap dekolorisasi atau proses penghilangan warna (Hsueh et al. 2009).
Menurut Hames dan Hooper (2005) faktor-faktor utama yang mempengaruhi aktivitas enzim adalah konsentrasi enzim, konsentrasi substrat, pH, suhu, senyawa inhibitor dan aktivator. Menurut Wilkolazka et al. (2002) dekolorisasi dapat diduga terjadi karena adanya aktivitas metabolisme dengan enzim sistematik dan adanya proses adsorbsi yang berfungsi untuk menghilangkan senyawa aromatik dan senyawa organik yang terlarut.
UNIVERSITAS SUMATERA UTARA
22
4.4 Pengaruh Variasi Perlakuan pH, Konsentrasi Zat Warna dan Kadar Salinitas Terhadap Persentase Kemampuan Dekolorisasi DH3
Isolat DH 3 yang diberi perlakuan variasi pH, konsentrasi zat warna dan kadar salinitas menunjukkan bahwa terjadinya pengurangan zat warna. Hasilnya ditunjukkan pada Tabel 4.5 berikut.
Tabel 4.5 Rata-rata Daya Dekolorisasi DH3 Terhadap Variasi Perlakuan
Konsentrasi Zat Warna (ppm)
Kadar Salinitas
(%)
Rata-Rata Absorbansi (nm)
Daya Dekolorisasi (%) Hari Pengamatan Ke-
0 3 6 9 12
pH 6
600 0 1,38 1,34 1,31 1,28 1,28 7,25
5 1,88 1,77 1,76 1,67 1,44 23,40
10 1,97 1,88 1,84 1,83 1,82 7,61
800 0 2,65 2,54 2,43 2,40 2,33 12,08
5 2,50 2,32 2,29 2,27 2,22 11,24
10 2,37 2,24 2,18 1,92 1,78 24,89
1000 0 2,64 2,58 2,46 2,43 2,40 9,07
5 2,77 2,74 2,65 2,58 2,44 11,91
10 2,69 2,67 2,61 2,57 2,56 4,83
pH 7
600 0 1,77 1,60 1,57 1,54 1,53 13,60
5 1,67 1,63 1,54 1,56 1,45 13,18
10 1,93 1,83 1,82 1,79 1,78 7,55
800 0 1,88 1,78 1,63 1,56 1,46 22,49
5 1,95 1,94 1,92 1,89 1,88 3,52
10 2,13 2,07 2,04 2,02 1,98 6,75
1000 0 3,28 2,21 3,16 3,11 3,10 5,56
5 3,63 3,40 3,39 3,28 3,26 10,40
10 3,32 3,26 3,21 3,06 2,92 12,03
pH 8
600 0 2,53 2,47 2,42 2,40 2,33 7,91
5 2,28 2,24 2,21 2,22 2,13 6,58
10 2,46 2,33 2,29 2,26 2,15 12,60
800 0 2,31 2,26 2,24 2,22 2,01 13,03
5 2,06 2,01 1,99 1,97 1,95 5,34
10 3,19 2,67 2,62 2,61 2,60 18,43
1000 0 3,23 3,02 2,95 2,75 2,6 19,50
5 3,36 3,26 3,23 3,21 3,18 5,36
10 3,38 3,33 3,24 3,24 3,21 5,03
UNIVERSITAS SUMATERA UTARA
Berdasarkan Tabel 4.5 dapat dilihat bahwa pengukuran aktivitas dekolorisasi dengan variasi parameter pH yang dilakukan pada kondisi awal, hari ke- 3 sampai hari ke- 12 dari beberapa variasi antara pH, konsentrasi zat warna dan kadar salinitas dengan menggunakan isolat DH3 menunjukan adanya penurunan warna dalam setiap interval waktu. Penurunan zat warna pada hari ke -12 dengan daya dekolorisasi yang paling tinggi diantaranya adalah pada variasi perlakuan pH 6, 600 ppm, 5% sebesar 23,40% dan pH 6, 800 ppm, 10% sebesar 24,89%. Selanjutnya, pada perlakuan variasi dengan pH 7, 800 ppm, 0% adalah sebesar 22,49%.
Perlakuan dengan menggunakan isolat DH3 menunjukkan bahwa semakin tinggi konsentrasi zat warna maka semakin rendah pula daya dekolorisasinya seperti yang terdapat dalam Tabel 4.5 dengan konsentrasi zat warna 1000 ppm. Persentase daya dekolorisasi yang tertinggi pada konsentrasi tersebut hanya 12,03% sedangkan yang paling rendah 4,83%. Namun, pada beberapa kondisi variasi konsentrasi zat warna 800 ppm justru mempunyai persentase pengurangann zat warna tertinggi yakni 24, 89% diikuti oleh konsentrasi zat warna 600 ppm 23,40%. Kadar salinitas optimum isolat DH3 terdapat pada kadar salinitas 10 % meskipun untuk beberapa kadar salinitas lainnya seperti 0% dan 5% mempunyai kemapuan dekolorisasi pada berbagai konsentrasi zat warna.
Perlakuan pH yang menunjukkan daya dekolorisasi paling tinggi terdapat pada pH 6 dengan daya dekolorisasi 24,89% tetapi kondisi pH ini juga mempunyai daya dekolorisasi yang paling rendah pada konsentrasi zat warna 1000 ppm dengan kadar 4,83%. Proses penguraian zat warna sangat dipengaruhi oleh pH. Menurut Prescott et al., (2008) umumnya enzim bekerja optimum pada rentang pH 6-8. Secara umum, kelompok mikroba memiliki karakteristik pH yang berbeda. Meskipun mikroorganisme tumbuh dalam kisaran pH yang luas dan jauh dari optimum, terdapat batas-batas toleransi pada pertumbuhannya. Menurut Aditiawati (2003), laju pertumbuhan bakteri tergantung dengan kondisi substratnya. Apabila kondisi substratnya sesuai, maka laju pertumbuhannya akan dominan, sebaliknya apabila kondisi substrat tidak sesuai maka laju pertumbuhannya akan lambat.
UNIVERSITAS SUMATERA UTARA