UJI DAYA ANTIOKSIDAN MENGGUNAKAN RADIKAL 1,1-DIFENIL-2-PIKRILHIDRAZIL DAN PENETAPAN KANDUNGAN FENOLIK
TOTAL FRAKSI ETIL ASETAT EKSTRAK ETANOL KULIT JERUK MANIS (Citrus sinensis (L.) Osbeck)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh : Augustinus Teti NIM : 098114121
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
i
UJI DAYA ANTIOKSIDAN MENGGUNAKAN RADIKAL 1,1-DIFENIL-2-PIKRILHIDRAZIL DAN PENETAPAN KANDUNGAN FENOLIK
TOTAL FRAKSI ETIL ASETAT EKSTRAK ETANOL KULIT JERUK MANIS (Citrus sinensis (L.) Osbeck)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh : Augustinus Teti NIM : 098114121
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
vi
HALAMAN PERSEMBAHAN
“When you walk through a storm keep your head up high and don’t be
afraid of the dark. At the end of the storm is a golden sky and the sweet
silver song of lark. Walk on through the wind, walk on through the rain,
tho’ your dream be tossed and blown. Walk
on, walk on with hope in your
heart.
And you’ll never walk alone.”
-Oscar H.-
-
“It’s fine to talk and it’s even okay to have
fun, but when we’re doing something, do it
properly”
vii PRAKATA
Puji syukur kepada Tuhan atas semua berkat dan penyertaan-Nya kepada
penulis sehingga penulis dapat menyelesaikan skripsi yang berjudul “UJI DAYA
ANTIOKSIDAN MENGGUNAKAN RADIKAL
1,1-DIFENIL-2-PIKRILHIDRAZIL DAN PENETAPAN KANDUNGAN FENOLIK TOTAL FRAKSI ETIL ASETAT EKSTRAK ETANOL KULIT JERUK MANIS (Citrus sinensis (L.) Osbeck)” ini dengan baik. Laporan akhir ini disusun untuk memenuhi salah satu syarat guna memperoleh gelar Sarjana Farnasi Universitas
Sanata Dharma Yogyakarta.
Dalam proses penelitian dan penyusunan skripsi ini tidak lepas dari
bantuan dan dukungan dari semua pihak sehingga skripsi ini dapat terselesaikan
dengan baik. Oleh karena itu, dengan segala kerendahan hati atas segala bantuan
yang telah diberikan, penulis ingin mengucapkan terima kasih kepada:
1. Ipang Djunarko, M.Sc., Apt. selaku Dekan Fakultas Farmasi Universitas
Sanata Dharma.
2. Yohanes Dwiatmaka, M.Si. selaku Dosen Pembimbing yang telah
memberikan bantuan dan bimbingan selama rancangan, pengusulan skripsi,
saat dilakukan penelitian dan selama penulisan skripsi dengan kesabaran dan
penuh perhatian.
3. Prof. Dr. C. J. Soegihardjo, Apt., sebagai Dosen Penguji atas pengarahan,
viii
4. Dra. M.M. Yetty Tjandrawati, M.Si. sebagai Dosen Penguji sekaligus Dosen
Pembimbing Akademik atas pengarahan, kritik, saran yang membangun dan
kesediaannya menguji skripsi ini.
5. Segenap laboran Laboratorium Farmakognosi-Fitokimia (Mas Wagiran) dan
Kimia Analisis Instrumental (Mas Bimo) atas segala bantuan selama penulis
melakukan penelitian di laboratorium.
6. Wisnu dan Ozy sebagai teman seperjuangan, atas segala kritik, saran, bantuan
selama mengerjakan skripsi ini, baik selama di laboratorium maupun pada
saat penyusunan naskah.
7. Danu, Kael, Felix, Julio, Nindy dan Nio “Kodrat” sebagai tim antioksidan
2009 atas segala bantuan dan masukan yang sangat berarti dalam penyusunan
skripsi ini.
8. Victor, Agnes, Novia, Ina, Topan, Leo, Jo, Netty dan Jimmy atas segala
canda tawa, bantuan, dan kenangan tidak terlupakan selama bekerja di
laboratorium.
9. Tri “Tejo” Pamulatsih (seksi konsumsi) atas segala bantuan, dukungan, serta
pemberi informasi penting di saat mendesak.
10. Tabita Ribka Alvianita, atas pinjaman laptopnya selama pelaksanaan ujian.
11. Yansen Nama Hada, atas bantuannya sebagai perkap selama persiapan ujian.
12. Haris, Arvi, dan Laras atas keikhlasannya memberikan waktu ujian mereka
untuk dipakai.
13. Chelsea F.C., my best football team, atas segala tontonan menarik dan
ix
14.Krisna House beserta seluruh penghuninya, atas segala kekonyolan,canda
tawa dan kebersamaan yang tidak terlupakan.
15.Febrin Nessy Triana, The Special One, yang merupakan sumber inspirasi,
atas segala kesabaran dalam membimbing, mengajarkan, mengarahkan,
selama proses pengerjaan skripsi ini, dimulai dari pengerjaan di laboratorium
sampai selesai penyusunan naskah, dan akhirnya bisa melaksanakan ujian
bersama. Terima kasih telah memberi warna dalam hidup.
16.Teman-teman Farmasi 2009, atas kebersamaan yang tidak terlupakan selama
empat tahun.
17.Semua pihak yang tidak bisa saya sebutkan satu per satu.
Penulis menyadari bahwa dalam penulisan skripsi ini banyak kesalahan
dan kekurangan mengingat keterbatasan kemampuan dan pengetahuan penulis.
Untuk itu penulis mengharapkan saran dan kritik yang membangun dari semua
pihak. Akhir kata semoga laporan ini dapat berguna bagi pembaca.
Yogyakarta, Juli 2013
x
DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
PERNYATAAN KEASLIAN KARYA ... iv
PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS ... v
HALAMAN PERSEMBAHAN ... vi
PRAKATA ... viii
DAFTAR ISI ... x
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvii
xi
B. Radikal Bebas dan Antioksidan ... 7
1. Radikal bebas ... 7
2. Defenisi antioksidan ... 7
3. Mekanisme antioksidan ... 8
4. Penggolongan antioksidan ... 8
5. Manfaat antioksidan ... 10
C. Metode DPPH ... 10
D. Ekstraksi ... 11
E. Spektrofotometri ... 13
F. Validasi Metode Analisis ... 14
G. Landasan Teori ... 16
H. Hipotesis ... 17
BAB III METODOLOGI PENELITIAN ... 18
A. Jenis dan Rancangan Penelitian ... 18
B. Variabel Penelitian ... 18
C. Defenisi Operasional ... 18
D. Bahan Penelitian ... 18
E. Alat Penelitian ... 19
F. Tata Cara Penelitian ... 19
1. Pemilihan dan pengumpulan sampel ... 19
2. Pembuatan simplisia ... 19
3. Ekstraksi dan fraksinasi simplisia ... 20
4. Uji pendahuluan ... 20
5. Penetapan kadar fenolik dalam ekstrak ... 21
6. Penetapan aktivitas antioksidan ... 22
BAB IV HASIL DAN PEMBAHASAN ... 24
xii
B. Hasil Pengumpulan Bahan ... 24
C. Hasil Ekstraksi Sampel ... 25
D. Hasil Uji Pendahuluan ... 28
1. Uji fenolik ... 28
2. Uji aktivitas antioksidan ... 29
E. Hasil Optimasi Metode Penetapan Kandungan Fenolik Total ... 30
1. Penentuan OT penetapan kandungan fenolik total ... 30
2. Penetapan maksimum penetapan kandungan fenolik total ... 31
F. Hasil Validasi Metode Penetapan Kandungan Fenolik Total ... 32
1. Presisi penetapan kandungan fenolik total ... 32
2. Linearitas penetapan kandungan fenolik total ... 33
3. Spesifitas penetapan kandungan fenolik total ... 33
G. Hasil Estimasi Kandungan Fenolik Total ... 34
H. Hasil Optimasi Metode Uji Aktivitas Antioksidan ... 37
1. Penentuan maksimum metode uji aktivitas antioksidan ... 38
2. Penentuan OT metode uji aktivitas antioksidan ... 39
I. Hasil Validasi Metode Uji Aktivitas Antioksidan ... 40
1. Presisi metode uji aktivitas antioksidan ... 42
2. Linearitas metode uji aktivitas antioksidan ... 44
3. Spesifitas metode uji aktivitas antioksidan ... 45
J. Hasil Penentuan Aktivitas Antioksidan Dengan Radikal DPPH .... 46
BAB V KESIMPULAN DAN SARAN ... 50
A. Kesimpulan ... 50
B. Saran ... 50
xiii
LAMPIRAN ... 55
xiv
DAFTAR TABEL
Tabel I. Tingkat kekuatan antioksidan dengan metode DPPH
(Armala, 2009) ... 11
Tabel II. Rentang kesalahan yang diperbolehkan (Harmita, 2004) ... 15
Tabel III. Rentang CV yang masih dapat diterima (Harmita, 2004) ... 16
Tabel IV. Hasil presisi asam galat dari beberapa parameter ... 33
Tabel V. Hasil pengukuran seri baku asam galat ... 36
Tabel VI. Hasil penetapan kandungan fenolik total fraksi etil asetat ekstrak etanol kulit jeruk manis ... 36
Tabel VII. Hasil presisi aktivitas antioksidan standar rutin ... 43
Tabel VIII. Hasil presisi aktivitas antioksidan fraksi etil asetat ... 43
Tabel IX. Hasil aktivitas antioksidan rutin dengan metode DPPH ... 44
Tabel X. Hasil aktivitas antioksidan fraksi etil asetat ekstrak etanol kulit jeruk manis dengan metode DPPH ... 45
Tabel XI. Hasil perhitungan IC50 rutin dan fraksi etil asetat ekstrak etanol kulit jeruk manis ... 47
xv
DAFTAR GAMBAR
Gambar 1. Buah jeruk manis ... 6
Gambar 2. Struktur rutin ... 10
Gambar 3. Hasil uji pendahuluan fenolik (A = kontrol positif [asam galat] + reagen fenol Folin-Ciocalteu, B =,larutan uji [fraksi etil asetat ekstrak etanol kulit jeruk manis] + reagen fenol Folin-Ciocalteu, C = kontrol negatif [blanko reagen fenol Folin-Ciocalteu]) ... 29
Gambar 4. Hasil uji pendahuluan aktivitas antioksidan (A = kontrol positif [rutin], B = kontrol negatif [blanko DPPH], C = larutan uji [fraksi etil asetat ekstrak etanol kulit jeruk manis] + DPPH) ... 30
Gambar 5. Kurva penentuan OT penetapan kandungan fenolik ... 31
Gambar 6. Kurva persamaan regresi linear penetapan kadar fenolik total ... 32
Gambar 7. Reaksi asam galat dengan molibdenum, komponen dari reagen Folin-Ciocalteu (Nunes, et al., 2012) ... 35
Gambar 8. Struktur asam galat ... 35
Gambar 9. Gugus kromofor dan auksokrom DPPH ... 38
Gambar 10. Grafik penentuan OT larutan rutin ... 39
Gambar 11. Grafik penentuan OT fraksi etil asetat ... 40
xvi
Gambar 13. Kurva persamaan regresi linear aktivitas antioksidan
fraksi etil asetat ekstrak etanolik kulit jeruk manis ... 42 Gambar 14. Hasil uji normalitas data rutin ... 48 Gambar 15. Hasil uji normalitas data fraksi etil asetat ekstrak etanol
xvii
DAFTAR LAMPIRAN
Lampiran 1. Gambar buah jeruk manis dari Purwokerto, Jawa
Tengah... 56
Lampiran 2. Bobot fraksi etil asetat ekstrak etanol kulit jeruk manis ... 56
Lampiran 3. Data penimbangan penetapan kandungan fenolik total .... 57
Lampiran 4. Optimasi penetapan kandungan fenolik total ... 58
Lampiran 5. Penetapan Kandungan fenolik total ... 60
Lampiran 6. Data penimbangan uji aktivitas antioksidan ... 62
Lampiran 7. Data perhitungan konsentrasi larutan DPPH, larutan
pembanding rutin, dan larutan uji ... 63
Lampiran 8. Optimasi metode uji aktivitas antioksidan ... 64
Lampiran 9. Uji akitivitas antioksidan dengan menggunakan radikal
DPPH ... 67
Lampiran 10. Perhitungan nilai IC50 rutin dan Fraksi etil asetat ekstrak
etanol kulit jeruk manis ... 69
xviii
INTISARI
Antioksidan merupakan senyawa yang menghambat reaksi oksidasi dengan mengikat radikal bebas. Akibatnya, kerusakan sel oleh radikal bebas dapat dihambat. Kulit jeruk manis diketahui memiliki senyawa fenolik. Senyawa tersebut beraktivitas antioksidan. Penelitian ini dilakukan untuk menentukan aktivitas antioksidan serta kandungan fenolik total fraksi etil asetat ekstrak etanol kulit jeruk manis. Pengujian aktivitas antioksidan menggunakan radikal 1,1-difenil-2-pikrilhidrazil (DPPH) dan dinyatakan dengan nilai Inhibition Concentration 50 (IC50). Keberadaan senyawa beraktivitas antioksidan akan mengubah warna larutan DPPH dari ungu menjadi kuning. DPPH memiliki maksimum di 515 nm. Ketika elektronnya berpasangan oleh keberadaan senyawa antioksidan, maka absorbansinya menurun secara stokiometri sesuai jumlah elektron yang diambil.
Kandungan fenolik total ditentukan dengan metode Folin-Ciocalteu dan dinyatakan dengan nilai massa ekuivalen asam galat (mg ekivalen asam galat per g fraksi air). Senyawa fenolik akan dioksidasi oleh pereaksi fenol Folin-Ciocalteu dalam suasana basa sehingga terbentuk larutan dengan warna biru. Larutan tersebut memiliki maksimum di 750 nm.
Hasil penelitian menunjukkan bahwa fraksi etil asetat ekstrak etanol kulit jeruk manis mempunyai aktivitas antioksidan lemah dengan nilai IC50 sebesar 292,09 ± 0,379 g/mL. Kandungan fenolik total sebesar 25,81 ± 0,314 mg ekivalen asam galat per g fraksi etil asetat.
xix ABSTRACT
Antioxidants are compounds that inhibit oxidation reactions by binding to free radicals. As a result, the cell damage by free radicals can be inhibited. Sweet orange peel phenolic compounds known to possess. This study was conducted to determine the antioxidant activity and total phenolic content of ethyl acetate fraction of ethanol extract of sweet orange peel. Radical antioxidant activity assays using 1,1-diphenyl-2-pikrilhidrazil (DPPH) and expressed by the value Inhibition Concentration 50 (IC50). The existence of active antioxidant compounds DPPH solution will change color from purple to yellow. DPPH has a maximum at 515 nm. When the electron pairs by the presence of antioxidant compounds, the absorbance decreases corresponding stoichiometric number of electrons captured. Total phenolic content was determined by Folin-Ciocalteu method and expressed by the value of the mass of gallic acid equivalents (mg gallic acid equivalents per g fraction of water). Phenolic compounds will be oxidized by the Folin-Ciocalteu phenol reagent under alkaline conditions, forming a blue solution. The solution has a maximum at 750 nm.
The results showed that the ethyl acetate fraction of ethanol extract of sweet orange peel has a weak antioxidant activity with IC50 values of 292,09 ± 0.379 µg/mL. Total phenolic content of 25.81 ± 0.314 mg gallic acid equivalents per g of ethyl acetate fraction.
1
BAB I
PENGANTAR
A. Latar Belakang
Tanpa disadari, dalam tubuh manusia terbentuk radikal bebas secara terus
menerus, baik melalui proses metabolisme sel normal maupun akibat respon
terhadap pengaruh dari luar tubuh, seperti paparan polusi lingkungan, ultraviolet,
dan asap rokok. Radikal bebas adalah atom atau molekul yang memiliki elektron
tidak berpasangan (unpaired electron). Adanya elektron yang tidak berpasangan
menyebabkan senyawa tersebut sangat reaktif mencari pasangan elektron, dengan
cara menyerang dan mengikat elektron molekul sekitarnya misalnya protein, asam
lemak tak jenuh, dan lipoprotein, serta unsur DNA termasuk karbohidrat. Dari
molekul-molekul target tersebut, yang paling rentan terhadap serangan radikal
bebas adalah asam lemak tak jenuh. Senyawa radikal bebas di dalam tubuh dapat
merusak asam lemak tak jenuh ganda pada membran sel sehingga dinding sel
menjadi rapuh, merusak basa DNA sehingga mengacaukan sistem genetika, dan
berlanjut pada pembentukan sel kanker (Salganik, 2001; Winarsi, 2007). Selain
itu radikal bebas dalam tubuh dapat memicu munculnya berbagai penyakit
degeneratif, seperti kardiovaskuler, penuaan dini (Palmer dan Kitchin, 2010), dan
osteoporosis akibat dari perusakan sel secara oksidatif (Winarsi, 2007).
Antioksidan merupakan senyawa pemberi elektron (electron donor) atau
reduktan dan merupakan senyawa yang dapat menghambat reaksi oksidasi
dihambat (Winarsi, 2007). Penambahan antioksidan ke dalam formulasi makanan
juga efektif mengurangi oksidasi lemak yang menyebabkan ketengikan, toksisitas,
dan destruksi biomolekul makanan (Decker, 1998).
Saat ini antioksidan alami lebih diminati dibandingkan antioksidan sintetik
karena dianggap lebih aman. Antioksidan sintetik seperti BHT (butylatedhidroxy
toluene) dan BHA (butylated hidroxy anisole) telah diragukan keamanannya
karena memiliki efek samping yang besar dan dapat menyebabkan kerusakan hati.
Hal ini menyebabkan antioksidan alami menjadi alternatif yang sangat dibutuhkan
oleh masyarakat saat ini (Rohdiana, 2001; Sunarni, 2005).
Buah jeruk manis mengandung betakaroten dan bioflavonoid yang dapat
memperkuat dinding pembuluh darah kapiler, sedangkan kulit jeruk manis banyak
mengandung pektin yang dapat membantu menurunkan kadar kolesterol jahat
(LDL) dan meningkatkan kolesterol baik (HDL) (Anonim, 2011).
Untuk mengetahui aktivitas antioksidan dari kulit jeruk manis dipilih
metode DPPH. Metode DPPH memberikan informasi reaktivitas senyawa yang
diuji dengan suatu radikal stabil. DPPH memberikan serapan kuat pada panjang
gelombang 517 nm dengan warna violet gelap (Sunarni, 2005). Metode ini
sederhana untuk dikerjakan, mudah, cepat dan peka. Aktivitas antioksidan dari
suatu senyawa dapat diketahui dari penurunan absorbansi DPPH yang terjadi
akibat penambahan senyawa tersebut (Zuhra, et al., 2008).
1. Permasalahan
a. Berapakah kandungan fenolik total fraksi etil asetat ekstrak etanol kulit jeruk manis?
b. Berapakah nilai aktivitas antioksidan fraksi etil asetat ekstrak etanol kulit jeruk manis dengan menggunakan radikal bebas DPPH yang dinyatakan dengan IC50?
2. Keaslian penelitian
Sejauh penelusuran pustaka yang dilakukan oleh penulis, belum pernah dilakukan penelitian mengenai seberapa besar daya antioksidan serta penetapan kadar fenolik total ekstrak etanol kulit jeruk manis dengan fraksi etil asetat.
3. Manfaat penelitian
a. Manfaat teoritis. Hasil dari penelitian ini diharapkan dapat memberikan sumbangan pada perkembangan ilmu pengetahuan dalam bidang farmasi, khususnya tentang aktivitas antioksidan yang dimiliki kulit jeruk manis, sehingga dapat menjadi acuan untuk penelitian selanjutnya.
b. Manfaat metodologis. Penelitian ini dapat dijadikan acuan metode uji aktivitas antioksidan menggunakan radikal bebas DPPH dan
penentuan kadar fenolik total pada suatu bahan tumbuhan.
mengenai potensi kulit jeruk manis sebagai salah satu sumber
antioksidan alami.
B. Tujuan Penelitian
1. Tujuan umum. Tujuan umum penelitian ini adalah menguji aktivitas
antioksidan menggunakan radikal bebas DPPH dan menetapkan kadar
fenolik total menggunakan metode Folin-Ciocalteu dari fraksi etil
asetat ekstrak etanol kulit jeruk manis.
2. Tujuan khusus.
a) Mengetahui kadar fenolik total fraksi etil asetat ekstrak etanol kulit
jeruk manis yang dinyatakan dengan massa ekivalen asam galat.
b) Mengetahui nilai aktivitas antioksidan fraksi etil asetat ekstrak
etanol kulit jeruk manis dengan menggunakan radikal bebas DPPH
5
BAB II
PENELAAHAN PUSTAKA
A. Jeruk Manis
1. Morfologi tumbuhan
Tanaman jeruk manis mempunyai batang yang dapat mencapai ketinggian 6 meter, bercabang banyak, tajuk daun bundar, dan umumnya berbuah satu kali dalam satu tahun. Daunnya bertangkai, tangkai daunnya bersayap, dan berbau sedap.
Bunga jeruk manis berukuran agak besar yang mempunyai kelopak bunga membentuk cawan, tangkai bunganya berwarna putih atau kuning dengan daun bunga sebanyak lima helai, dan mempunyai 20-30 benang sari.
Sub-kelas : Rosidae
Ordo : Sapindales
Famili : Rutaceae
Genus : Citrus L.
Spesies : Citrus sinensis (L.)Osbeck
(USDA, 2013).
Gambar 1. Buah jeruk manis 3. Habitat dan penyebaran
Jeruk manis merupakan tanaman asli melayu tetapi sekarang
penyebarannya sangat luas hampir disemua daerah tropis dan subtropis di dunia.
Temperatur optimum antara 25-300C namun ada yang masih dapat tumbuh normal
pada 380C. Kelembaban optimum untuk pertumbuhan tanaman ini sekitar 70-80%
(Rukmana, 2003).
Pada tahun 1920, jeruk manis dikembangkan secara komersial di
dan negara-negara lainnya. Di Indonesia, tanaman jeruk manis ditanam di berbagai
daerah, seperti Jawa Barat, Jawa Tengah, dan Sumatera Utara (Rukmana, 2003).
B. Radikal bebas dan Antioksidan
1. Radikal bebas
Radikal bebas adalah atom atau molekul yang memiliki elektron tidak
berpasangan (unpaired electron). Adanya elektron yang tidak berpasangan
menyebabkan senyawa tersebut sangat reaktif mencari pasangan, dengan cara
menyerang dan mengikat elektron molekul yang berada di sekitarnya. Target
utama radikal bebas adalah protein, asam lemak tak jenuh dan lipoprotein, serta
unsur DNA termasuk karbohidrat. Dari molekul-molekul target tersebut, yang
paling rentan terhadap serangan radikal bebas adalah asam lemak tak jenuh.
Senyawa radikal bebas di dalam tubuh dapat merusak asam lemak tak jenuh ganda
(polyunsaturated fat) pada membran sel sehingga dinding sel menjadi rapuh,
merusak basa DNA sehingga mengacaukan sistem genetika, dan berlanjut pada
pembentukan sel kanker (Winarsi, 2007).
2. Definisi antioksidan
Antioksidan merupakan senyawa pemberi elektron (electron donor) atau
reduktan. Senyawa ini memiliki berat molekul kecil tetapi mampu menginaktivasi
berkembangnya reaksi oksidasi, dengan cara mencegah terbentuknya radikal.
Antioksidan juga merupakan senyawa yang dapat menghambat reaksi oksidasi
dengan mengikat radikal bebas. Akibatnya kerusakan sel dapat dihambat
Kebanyakan antioksidan (misalnya tokoferol) digunakan sebagai
pengawet dalam berbagai produk (misalnya dalam lemak, minyak dan produk
makanan untuk menunda ketengikan dan perubahan-perubahan yang tidak
diinginkan, dalam karet untuk menunda oksidasi). Pengertian antioksidan yang
lebih relevan secara biologis ialah senyawa alami atau sintetik yang ditambahkan
ke dalam produk untuk mencegah atau menunda kerusakan yang disebabkan oleh
udara (Huang, Ou, dan Prior, 2005).
3. Mekanisme antioksidan
Secara garis besar, mekanisme penangkapan radikal bebas dapat
dibedakan menjadi dua macam, yaitu secara enzimatik dan non-enzimatik. Enzim
yang dapat berperan sebagai antioksidan adalah superoksida dismutase, katalase,
glutation peroksidase, dan glutation reduktase (Winarsi, 2007).
Secara non-enzimatik, senyawa antioksidan bekerja melalui empat cara,
yaitu sebagai berikut:
a. Penangkap radikal bebas, misalnya vitamin C dan vitamin E,
b. Pengkelat logam transisi, misalnya EDTA,
c. Inhibitor enzim oksidatif, misalnya aspirin dan ibuprofen, dan
d. Kofaktor enzim antioksidan, misalnya selenium sebagai kofaktor glutation
peroksidase (Huang, et al., 2005).
4. Penggolongan antioksidan
Menurut sumbernya, antioksidan dapat digolongkan menjadi dua macam,
yaitu antioksidan sintetik dan alami (Gulcin, Uguz, Oktay, Beydemir, dan
a. Antioksidan sintetik
Antioksidan sintetik merupakan antioksidan yang dibuat melalui sintesis
secara kimia, contohnya: tert-Butylhydroquinone (tBHQ), butylated
hydroxyanisole (BHA), butylated hydroxytoluene (BHT), dan propil galat (PG)
(Gulcin, et al., 2004). tBHQ dan BHA telah lama digunakan untuk mencegah
oksidasi dari produk makanan sehingga dapat menstabilkan produk tersebut
(nutrisi, rasa, maupun warna). Dalam konsentrasi yang tinggi, tBHQ dapat
menyebabkan kanker (Gharavi, Haggarty, dan El-Kadi, 2007).
b. Antioksidan alami
Antioksidan alami merupakan antioksidan yang diproduksi langsung oleh
tanaman maupun tubuh, contohnya: senyawa polifenol, flavonoid, tanin, enzim
katalase, glutation peroksidase, dan superoksid dismutase. Glutation peroksidase
bekerja dengan cara mengubah H2O2 menjadi H2O dan O2, sedangkan superoksid
dismutase bekerja dengan cara mengkatalisis reaksi dismutasi dari radikal anion
superoksida menjadi H2O2 (Percival, 1998; Gulcin, etal., 2004; Winarsi, 2007 ).
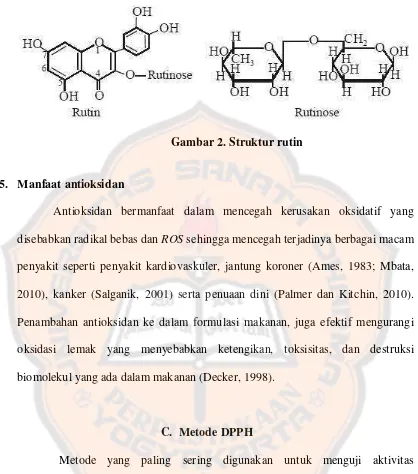
Contoh lain senyawa antioksidan alami adalah rutin (Gambar 2).
Senyawa ini bekerja jika moietas gula diketahui melebihi aktivitas flavonoid.
Antioksidan ini diduga dapat mencegah serangan lipid membran. Rutin
menunjukkan kerjanya sebagai inhibitor peroksidasi lipid yang bergantung pada
Gambar 2. Struktur rutin
5. Manfaat antioksidan
Antioksidan bermanfaat dalam mencegah kerusakan oksidatif yang
disebabkan radikal bebas dan ROS sehingga mencegah terjadinya berbagai macam
penyakit seperti penyakit kardiovaskuler, jantung koroner (Ames, 1983; Mbata,
2010), kanker (Salganik, 2001) serta penuaan dini (Palmer dan Kitchin, 2010).
Penambahan antioksidan ke dalam formulasi makanan, juga efektif mengurangi
oksidasi lemak yang menyebabkan ketengikan, toksisitas, dan destruksi
biomolekul yang ada dalam makanan (Decker, 1998).
C. Metode DPPH
Metode yang paling sering digunakan untuk menguji aktivitas
antioksidan adalah dengan menggunakan radikal bebas DPPH (Shivaprasad, et al.,
2005). Tujuannya adalah mengetahui parameter konsentrasi yang memberikan
50% efek aktivitas antioksidan (IC50). Hal ini dapat dicapai dengan cara
menginterpretasikan data eksperimental dari metode tersebut (Molyneux, 2004).
mendonorkan atom hidrogen, dapat berguna untuk pengujian aktivitas antioksidan
komponen tertentu dalam suatu ekstrak (Dinis, Maderia, dan Almeida, 1994).
DPPH memberikan serapan kuat pada 517 nm. Ketika elektronnya
menjadi berpasangan oleh keberadaan penangkap radikal bebas, maka
absorbansinya menurun secara stokiometri sesuai jumlah elektron yang diambil.
Keberadaan senyawa antioksidan dapat mengubah warna larutan DPPH dari ungu
menjadi kuning (Dehpour, Ebrahimzadeh, Fazel, dan Mohammad, 2009).
Metode DPPH merupakan metode yang mudah, cepat, dan sensitif untuk
pengujian aktivitas antioksidan senyawa tertentu atau ekstrak tanaman (Koleva,
van Beek, Linssen, de Groot, dan Evstatieva, 2002; Prakash, Rigelhof, dan Miller,
2010).
Menurut Armala (2009), tingkat kekuatan antioksidan senyawa uji
menggunakan metode DPPH dapat digolongkan menurut nilai IC50 (Tabel I).
Tabel I. Tingkat kekuatan antioksidan dengan metode DPPH (Armala, 2009) Intensitas Nilai IC50
Penyarian atau ekstraksi merupakan suatu peristiwa perpindahan massa
zat aktif yang semula berada di dalam sel kemudian ditarik oleh cairan penyari
sehingga zat aktif larut dalam cairan penyari. Pada umumnya penyarian akan
bertambah baik jika permukaan simplisia yang bersentuhan dengan penyari
Ekstrak adalah sediaan pekat yang diperoleh dengan cara mengekstraksi
zat aktif dari simplisia nabati atau hewani menggunakan pelarut yang sesuai,
selanjutnya pelarut diuapkan sampai semua atau hampir semua pelarut menguap
(Departemen Kesehatan, 1995).
Dalam memilih cairan penyari, seseorang harus mempertimbangkan
banyak faktor. Cairan penyari yang baik harus memenuhi kriteria berikut ini.
(1) Murah dan mudah diperoleh,
(2) stabil secara fisika dan kimia,
(3) selektif,
(4) tidak mempengaruhi zat berkhasiat, dan
(5) diperbolehkan oleh peraturan yang berlaku
(Departemen Kesehatan, 1986).
Metode penyarian yang digunakan tergantung dari wujud dan kandungan
zat dari bahan yang akan disari. Cara penyarian dapat dibedakan menjadi :
infundasi, maserasi, perkolasi, dan penyarian berkesinambungan (Departemen
Kesehatan, 1986).
Maserasi merupakan cara penyarian yang sederhana. Maserasi dilakukan
dengan cara merendam serbuk simplisia dalam cairan penyari sehingga cairan
penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang
mengandung zat aktif di dalam sel dengan yang di luar sel mengakibatkan
pendesakan larutan terpekat dari dalam sel ke luar sel. Peristiwa tersebut berulang
sehingga terjadi keseimbangan konsentrasi antara larutan di luar sel dan di dalam
teknik ini, cairan dibagi menjadi dua kemudian seluruh serbuk simplisia
dimaserasi dengan cairan penyari pertama, sesudah diendaptuangkan dan diperas,
ampas dimaserasi lagi dengan cairan penyari kedua (Departemen Kesehatan,
1986).
E. Spektrofotometri
Spektrofotometri adalah salah satu teknik analisis fisika-kimia yang
mengamati tentang interaksi atom atau molekul dengan radiasi elektromagnetik
(Mulja dan Suharman, 1995).
Senyawa yang mempunyai gugus kromofor apabila mengalami interaksi
dengan radiasi elektromagnetik pada daerah UV-Vis (200-800 nm) maka akan
menghasilkan transisi elektromagnetik dan spektra absorbansi. Spektra absorbansi
tersebut dapat digunakan untuk analisis kuantitatif dikarenakan jumlah radiasi
elektromagnetik yang diserap sebanding dengan jumlah molekul penyerapnya.
Spektrum UV mempunyai absorbansi antara 100 400 nm, sedangkan spektrum
visibel atau tampak mempunyai absorbansi antara 400-800 nm (Fessenden dan
Fesenden, 1995).
Hukum Lambert-Beer menyatakan bahwa intensitas yang diteruskan oleh
larutan zat penyerap berbanding lurus dengan tebal dan konsentrasi larutan.
A= ε bc
Harga ε adalah karakteristik untuk molekul atau ion penyerap dalam pelarut
bahwa penentuan absorbansi akan menghasilkan konsentrasi jika ε dan b
diketahui (Sastrohamidjojo, 2001).
F. Validasi Metode Analisis
Validasi metode analisis adalah suatu tindakan penilaian terhadap
parameter tertentu, berdasarkan percobaan laboratorium, untuk membuktikan
bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya (Harmita,
2004).
Paramater-parameter validasi metode analisis yang diperlukan untuk
menilai kesahihan metode analisis antara lain meliputi akurasi, presisi, linearitas,
dan spesifisitas. Akurasi metode analisis adalah ukuran yang menunjukkan derajat
kedekatan hasil analisis dengan kadar analit yang sebenarnya. Akurasi dinyatakan
sebagai persen perolehan kembali (recovery) baku yang ditambahkan. Kriteria
akurasi sangat bergantung kepada konsentrasi baku dalam matriks sampel dan
pada keseksamaan metode. Akurasi ditentukan dengan % recovery (Harmita,
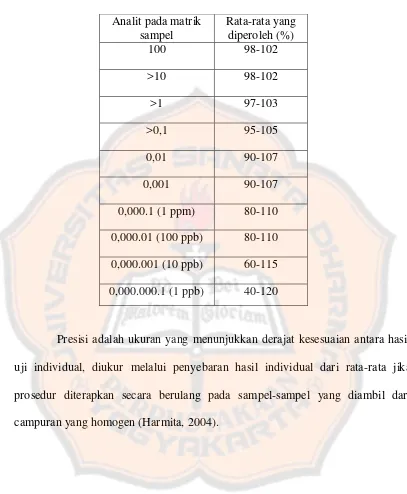
Tabel II. Rentang kesalahan yang diperbolehkan (Harmita, 2004) Analit pada matrik
sampel
Rata-rata yang diperoleh (%)
100 98-102
>10 98-102
>1 97-103
>0,1 95-105
0,01 90-107
0,001 90-107
0,000.1 (1 ppm) 80-110
0,000.01 (100 ppb) 80-110
0,000.001 (10 ppb) 60-115
0,000.000.1 (1 ppb) 40-120
Presisi adalah ukuran yang menunjukkan derajat kesesuaian antara hasil
uji individual, diukur melalui penyebaran hasil individual dari rata-rata jika
prosedur diterapkan secara berulang pada sampel-sampel yang diambil dari
Presisi dinyatakan dalam standar deviasi atau koefisien variasi. Tabel
berikut merupakan syarat presisi yang dapat diterima berdasarkan kadar analit.
Tabel III. Rentang CV yang masih dapat diterima (Harmita, 2004) Analit pada matrik
Linieritas pada suatu metode analisis dari suatu prosedur analisis
merupakan kemampuannya untuk mendapatkan hasil uji yang secara langsung
proporsional dengan konsentrasi (jumlah) analit di dalam sampel. Persyaratan data
linieritas yang bisa diterima jika memenuhi nilai koefisien korelasi (r) > 0,999
(Mulja dan Hanwar, 2003).
Spesifisitas merupakan kemampuan suatu metode untuk mengukur
dengan akurat respon analit diantara seluruh komponen sampel yang mungkin ada
dalam matriks sampel (Mulja dan Hanwar, 2003).
G. Landasan Teori
Buah jeruk manis mengandung betakaroten dan bioflavonoid yang dapat
memperkuat dinding pembuluh darah kapiler dan dapat berfungsi sebagai
antioksidan. Antioksidan berguna untuk menangkal radikal bebas dengan cara
menjadi tidak reaktif. Antioksidan alami lebih aman digunakan dibandingkan
antioksidan sintesis.
Metode pengujian antioksidan yang umum digunakan terutama untuk
senyawa dari bahan alam adalah metode DPPH. Metode ini menggunakan sumber
radikal bebas berupa senyawa 1,1-difenil-2-pikrilhidrazil (DPPH). Metode ini
memiliki kelebihan yaitu mudah, cepat, dan sensitif untuk pengujian aktivitas
antioksidan senyawa tertentu atau ekstrak tanaman.
Kandungan fenolik total dapat ditentukan dengan reagen Folin-Ciocalteu.
Adanya senyawa fenolik dalam sampel uji akan mereduksi reagen
fosfomolibdat-fosfotungstat menjadi produk berwarna biru. Intensitas warna biru yang dihasilkan
sebanding dengan kandungan fenolik yang terdapat dalam sampel.
H. Hipotesis
18
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk penelitian eksperimental dengan tahapan penelitian sebagai berikut :
a. Pemilihan dan pengumpulan sampel b. Pembuatan simplisia
c. Ekstraksi dan fraksinasi simplisia d. Penetapan aktivitas antioksidan
e. Penetapan kadar fenolik total dalam ekstrak
B. Variabel Penelitian
Variabel bebas : konsentrasi ekstrak sampel Variabel tergantung : IC50
C. Definisi Operasional
Ekstrak kulit jeruk manis adalah ekstrak kental yang diperoleh dari hasil proses
maserasi dengan menggunakan pelarut etanol.
D. Bahan Penelitian
berupa metanol dan natrium karbonat. Bahan pro analitik (Sigma) berupa DPPH (2,2-diphenyl-1-picrylhydrazyl), rutin, asam galat, dan pereaksi Folin-Ciocalteu. Bahan kualitas teknis (Brataco Chemica), yaitu wash bensin dan etil asetat.
E. Alat Penelitian
Alat yang digunakan dalam penelitian ini adalah alat-alat gelas (Pyrex-Germany dan Iwaki), corong pisah, corong buchner, ayakan, vortex (Junke & Kunkel), waterbath (Labo-tech, Heraeus), maserator, vacuum rotary evaporator (Buchii rotavapor) dan spektrofotometer uv-visibel (Shimadzu mini 1240).
F. Tata Cara Penelitian
1. Pemilihan dan pengumpulan sampel
Pengumpulan sampel kulit jeruk diambil langsung di perkebunannya di daerah Purwokerto, Jawa Tengah dengan memilih jeruk dengan usia tertentu yang merupakan usia konsumsi dari buah jeruk tersebut.
2. Pembuatan simplisia
3. Ekstraksi dan fraksinasi simplisia
Sebanyak 30 g serbuk simplisia kulit jeruk dimasukkan ke dalam bejana maserasi, ditambah dengan etanol sampai terendam sempurna dan dicampur homogen. Campuran dimaserasi pada suhu ruangan selama tiga hari. Filtrat diperoleh melalui penyaringan menggunakan kertas saring kasar dengan bantuan corong Buchner dan pompa vakum. Ampas penyaringan diremaserasi dengan etanol kembali selama tiga hari. Kemudian filtrat dicampur dengan filtrat terdahulu. Keseluruhan filtrat diuapkan pelarutnya dengan vacuum rotary evaporator sehingga diperoleh ekstrak etanol kental kulit jeruk.
Ekstrak etanol kental kulit jeruk dilarutkan dalam 100 ml air hangat dan dilakukan ekstraksi cair-cair menggunakan wash bensin dengan perbandingan larutan ekstrak : wash bensin (1:1 v/v), dihasilkan fraksi air dan wash bensin. Kemudian fraksi air diekstraksi kembali menggunakan etil asetat, sehingga didapatkan fraksi air dan fraksi etil asetat. Fraksi etil asetat diuapkan dengan vacuum rotary evaporator sehingga didapatkan ekstrak kering etil asetat. Parameter kekeringan ekstrak adalah ketika sudah didapatkan bobot tetap yaitu dengan cara ekstrak hasil evaporasi dipanaskan di atas waterbath hingga bobotnya tidak berubah lagi. Ekstrak ini yang digunakan untuk analisis selanjutnya.
4. Uji pendahuluan
Ciocalteu yang telah diencerkan dengan akuades (1:1 v/v) ke dalam
tabung reaksi. Diamkan selama 2 menit. Tambahkan 7,5 ml larutan
natrium karbonat 1 M. Kemudian amati warna larutan tersebut.
b) Uji aktivitas antioksidan. Sebanyak 1 ml larutan stok DPPH dimasukkan ke dalam tiga tabung reaksi. Ditambahkan masing masing
dengan 1 ml metanol p.a, larutan pembanding rutin 50 g/mL dan
larutan uji 305 g/mL. Selanjutnya larutan tersebut ditambahkan dengan
3 ml metanol p.a. Larutan tersebut kemudian divortex 20 detik.
Diamkan selama 30 menit. Kemudian amati warna pada larutan tersebut.
5. Penetapan kadar fenolik dalam ekstrak
a) Pembuatan larutan asam galat. Dibuat larutan asam galat dengan
konsentrasi 1.000 g/mL dalam aquades : metanol p.a (1:1). Diambil
c) Validasi metode penetapan kandungan fenolik total. Hasil pengujian kemudian divalidasi berdasarkan parameter presisi (% CV), linearitas (nilai r), serta spesifitas (spektra kontrol).
d) Estimasi kandungan fenolik total larutan uji. Larutan uji diambil 0,5 ml lalu dimasukkan ke dalam tabung reaksi dan dilanjutkan sebagaimana perlakuan pada pembuatan kurva baku asam galat. Kandungan fenolik total dinyatakan sebagai massa ekivalen asam galat (mg ekivalen asam galat per gram fraksi etil asetat).
6. Penetapan aktivitas antioksidan
a) Pembutan larutan DPPH 0,4 mM. Sebanyak 3,94 mg serbuk DPPH dimasukkan ke dalam labu takar 25 ml, lalu ditambahkan metanol hingga batas tanda. Dihomogenkan dengan bantuan vortex untuk melarutkan DPPH. Larutan harus selalu dibuat baru.
b) Pembuatan larutan rutin 0,250 mg/ml. Sebanyak 2,5 mg rutin dimasukkan dalam labu takar 10 ml, masukkan metanol hingga batas tanda. Ambil sejumlah larutan stok rutin masukkan dalam labu takar, tambahkan metanol hingga batas tanda hingga diperoleh konsentrasi larutan pembanding 12,25; 19,25; 26,25; 33,25; dan 40,25 g/mL.
d) Penentuan panjang gelombang serapan maksimum. Pada tiga buah labu ukur 10 ml, dimasukan masing-masing 0,5; 1,0; 1,5 ml larutan DPPH.
Ditambahkan larutan tersebut dengan metanol p.a hingga tanda batas.
Larutan tersebut kemudian divortex selama 20 detik. Diamkan selama
OT. Lalu dilakukan scanning panjang gelombang serapan maksimum
dengan spektrofotometer visibel pada panjang gelombang 400-600 nm.
e) Penentuan operating time. Sebanyak 2,0 ml larutan DPPH 0,4 mM dimasukkan ke dalam labu takar 10,0 ml, tambahkan larutan stok rutin 2 ml kemudian tambahkan metanol hingga batas tanda. Larutan dihomogenkan dengan cara divortex. Setelah itu baca absorbansinya
pada maksimum tiap 5 menit selama 1 jam. Tentukan operating time
reaksi.
f) Penentuan aktivitas antioksidan. 2,0 ml larutan DPPH 0,4 mM dimasukkan ke dalam labu takar 10,0 ml kemudian ditambahkan 2,0 ml larutan uji atau pembanding yang telah diketahui konsentrasinya. Tambahkan metanol hingga batas tanda. Larutan divortex dan didiamkan selama operating time. Baca absorbansinya pada maksimum. Aktivitas antioksidan dihitung dengan rumus:
% aktivitas antioksidan =
24
BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Determinasi Tanaman
Determinasi merupakan syarat pertama dan langkah awal yang dilakukan
dalam suatu penelitian dengan menggunakan tanaman. Determinasi tanaman ini
bertujuan untuk mengetahui dan memastikan kebenaran identitas tanaman yang
akan digunakan dalam penelitian serta untuk menghindari terjadinya kesalahan
dalam pengambilan sampel untuk analisis fitokimia. Berdasarkan hasil
determinasi tanaman jeruk manis yang dilakukan di Laboratorium
Farmakognosi-Fitokimia Fakultas Farmasi Universitas Sanata Dharma, telah dibuktikan bahwa
tanaman yang digunakan untuk penelitian adalah Citrus sinensis (L.)Osbeck.
B. Hasil Pengumpulan Bahan
Buah jeruk manis diperoleh dari daerah Purwokerto, Jawa tengah pada
bulan September 2012. Pengambilan bahan berasal dari satu tempat, hal ini untuk
menghindari variasi kandungan senyawa aktif tanaman. Buah jeruk manis yang
digunakan adalah buah yang sedang dalam usia matang berwarna hijau
kekuningan. Buah jeruk manis dipetik pada pagi hari agar senyawa fenolik yang
terdapat pada tanaman belum termetabolisme menjadi bentuk metabolit sekunder
C. Hasil Ekstraksi Sampel
Ekstraksi bertujuan menarik kandungan kimia yang diinginkan dari
sampel dengan menggunakan pelarut tertentu dimana komponen yang diinginkan
dapat larut di dalamnya. Sampel yang digunakan dalam proses ekstraksi adalah
kulit jeruk manis.
Preparasi kulit jeruk manis yang digunakan dalam proses ekstraksi ini
diawali dengan pengeringan terhadap kulit jeruk manis yang diperoleh. Proses
pengeringan dilakukan menggunakan oven pada suhu 500 C selama 24 jam.
Kemudian, kulit jeruk manis yang sudah kering diblender untuk memperluas
permukaan serbuk yang bersentuhan dengan cairan penyari dan mengurangi
ketebalan lapisan kulit sehingga mempermudah proses ekstraksi dan memudahkan
penembusan oleh pelarut/cairan penyari.
Untuk mengekstraksi senyawa fenolik dalam bahan tumbuhan dapat
dilakukan dengan pelarut polar seperti etanol, metanol, aseton, dimetilsulfoksida,
dimetilformamida, dan air (Markham, 1988). Alasan tidak digunakan pelarut
aseton, dimetilsulfoksida, dimetilformamida, dan air adalah senyawa fenolik lebih
larut dalam campuran larutan alkohol dengan air daripada pelarut polar lainnya
(Bruneton, 1999). Pelarut metanol tidak digunakan karena memiliki efek toksik
yang lebih tinggi daripada etanol (Armala, 2009). Pelarut n-butanol tidak
digunakan karena n-butanol lebih non polar serta struktur dari n-butanol lebih
besar sehingga n-butanol kurang begitu bisa masuk ke dalam sel-sel kulit jeruk
Proses maserasi dilakukan dengan penyari etanol dan menggunakan
bantuan alat shaker. Metode maserasi dipilih karena memiliki kelebihan
dibanding metode lainnya. Selain sederhana dan mudah dilakukan, metode ini
tidak membutuhkan panas sehingga stabilitas senyawa fenolik yang terekstrasi
dari sampel dapat terjaga. Alat shaker digunakan bertujuan untuk membantu
proses maserasi yang lebih efektif karena dengan alat tersebut penyari lebih dapat
kontak langsung ke dalam sel-sel daripada jika didiamkan saja. Maserasi
dilakukan selama tiga hari, dan setelah itu cairan penyari dipisahkan dari
ampasnya menggunakan corong Buchner yang dilapisi kertas saring dan dengan
bantuan pompa vakum untuk mempercepat dan memaksimalkan hasil
penyaringan. Ampas hasil penyarian kemudian diremaserasi menggunakan etanol.
Remaserasi ini bertujuan untuk memaksimalkan hasil penyarian.
Senyawa-senyawa yang kemungkinan belum tersari karena sudah jenuhnya penyari dapat
tersari pada proses remaserai ini sehingga akan dihasilkan lebih banyak
senyawa-senyawa yang tersari dari sampel.
Ekstrak etanol yang diperoleh diuapkan pelarutnya menggunakan alat
vacuum rotary evaporator sampai hampir semua etanol menguap. Prinsip alat ini
yaitu penguapan dengan pengurangan tekanan. Jika tekanan uap suatu cairan sama
dengan tekanan atmosfer di sekelilingnya maka cairan tersebut akan mendidih,
sehingga dengan adanya pengurangan tekanan pada alat di bawah tekanan
atmosfer akan menyebabkan cairan mendidih di bawah titik didih normalnya.
Ekstrak kental etanol kulit jeruk manis yang didapat kemudian dilarutkan
ekstrak etanol. Selanjutnya dipartisi menggunakan pelarut washbensin, sehingga
fraksi air berada di bagian bawah dan fraksi washbensin berada di bagian atas. Hal
tersebut dikarenakan berat jenis air (0,996) lebih besar daripada berat jenis
washbensin (0,730) (Departemen Kesehatan, 1995). Proses partisi atau ekstraksi
cair-cair ekstrak etanol ini dilakukan sebanyak tiga kali agar lebih efektif sampai
lapisan washbensin terlihat bening yang menandakan tidak ada lagi senyawa
fenolik yang tertarik ke dalam washbensin. Partisi ini dilakukan dengan
perbandingan pelarut air : washbensin 1:1 (v/v). Bagian yang polar akan
cenderung larut dalam air sedangkan bagian yang non polar akan larut dalam
washbensin. Dalam fraksi washbensin akan diperoleh senyawa-senyawa kimia
yang tidak diinginkan seperti lipid dan klorofil sehingga fraksi ini tidak
diperlukan untuk proses penelitian tahap selanjutnya.
Fraksi air hasil partisi dengan washbensin kemudian dilakukan partisi
atau ekstraksi cair-cair kembali dengan pelarut etil asetat dengan perbandingan
pelarut 1:1 (v/v). Pada partisi air-etil asetat ini fraksi air akan berada pada bagian
bawah dan fraksi etil asetat berada pada bagian atas karena BJ air (0,996) lebih
besar dibandingkan BJ etil asetat (0,898). Proses partisi ini juga dilakukan secara
berulang sampai lapisan atau bagian etil asetat terlihat bening. Fraksi air dan
fraksi etil asetat yang diperoleh dipisahkan dan fraksi etil asetat selanjutnya
diuapkan pelarutnya dengan vacuum rotary evaporator kemudian dipanaskan di
dalam oven hingga kental atau sampai bobot tetap sehingga didapatkan fraksi
akan digunakan untuk uji aktivitas antioksidan dan ditetapkan kandungan fenolik
totalnya.
Pada penelitian ini digunakan fraksi etil asetat karena peneliti ingin
melihat aktivitas antioksidan dari senyawa fenolik yang berada pada fraksi etil
asetat. Senyawa fenolik dapat berbentuk glikosida yang bersifat polar dan dalam
bentuk aglikon yang lebih non polar, sehingga ada kemungkinan senyawa fenolik
dapat larut dalam air maupun etil asetat. Penyimpanan fraksi ini dilakukan dengan
menggunakan cawan porselen yang ditutup dengan allumunium foil kemudian
ditempatkan dalam eksikator untuk menjaga kestabilan senyawa dalam fraksi dari
pengaruh cahaya maupun kelembapan lingkungan.
D. Hasil Uji Pendahuluan 1. Uji fenolik
Uji ini memakai prinsip reaksi oksidasi-reduksi pada suasana basa.
Tujuan uji ini adalah untuk mengetahui secara kualitatif adanya kandungan
senyawa fenolik dalam fraksi etil asetat ekstrak etanol kulit jeruk manis. Dalam
suasana basa akibat penambahan natrium karbonat, senyawa fenolik akan berubah
menjadi ion fenolat yang bersifat lebih reaktif terhadap adanya pereaksi
Ciocalteu. Ion fenolat tersebut dioksidasi oleh asam dalam pereaksi fenol
Folin-Ciocalteu (asam fosfomolibdat-fosfotungstat) sehingga akan terbentuk larutan
dengan warna biru. Pengujian menunjukkan hasil positif dengan larutan uji
berwarna biru (gambar 3). Hal ini menunjukkan bahwa fraksi etil asetat ekstrak
Gambar 3. Hasil uji pendahuluan fenolik (A = kontrol positif [asam galat] + reagen Folin-Ciocalteu, B =,larutan uji [fraksi etil asetat ekstrak
etanol kulit jeruk manis] + reagen Folin-Ciocalteu, C = kontrol negatif [blanko reagen Folin-Ciocalteu])
2. Uji aktivitas antioksidan
Uji ini menggunakan reaksi antara radikal DPPH dengan senyawa
antioksidan. Tujuan uji ini adalah untuk mengetahui secara kualitatif aktivitas
antioksidan dalam fraksi etil asetat ekstrak etanol kulit jeruk manis. Keberadaan
senyawa antioksidan dapat mengubah warna larutan DPPH dari ungu menjadi
kuning (Dehpour, Ebrahimzadeh, Fazel, dan Mohammad, 2009). Pengujian
menunjukkan hasil positif dengan larutan uji berwarna kuning (gambar 4). Hal ini
menunjukkan bahwa fraksi etil asetat ekstrak etanol kulit jeruk manis memiliki
aktivitas antioksidan.
Gambar 4. Hasil uji pendahuluan aktivitas antioksidan (A = kontrol positif [rutin], B = kontrol negatif [blanko DPPH], C = larutan uji [fraksi
etil asetat ekstrak etanol kulit jeruk manis] + DPPH)
E. Hasil Optimasi Metode Penetapan Kandungan Fenolik Total (1) Penentuan OT penetapan kandungan fenolik total
Tujuan penentuan OT adalah untuk menetapkan rentang waktu dimana
reaksi antara asam galat dengan pereaksi Folin-Ciocalteu telah berlangsung secara
sempurna.
Gambar 5. Kurva penentuan OT penetapan kandungan fenolik
Hasil (gambar 5) menunjukkan bahwa dari menit ke-30 sampai 60,
absorbansi senyawa molybdenum blue yang terbentuk telah stabil. Hal ini
menunjukkan bahwa reaksi dalam metode Folin-Ciocalteu telah sempurna sejak
menit ke-30.
(2) Penentuan maksimum penetapan kandungan fenolik total
Dari hasil spektra, senyawa berwarna biru tersebut memiliki
maksimum pada 750 nm (lampiran 4). Hal ini sesuai dengan penelitian-penelitian
yang menyatakan bahwa maksimum senyawa berwarna biru hasil metode Folin-
Ciocalteu berada pada rentang 750-765 nm (Gansch, Weber, dan Lee, 2009;
F.Hasil Validasi Metode Penetapan Kandungan Fenolik Total Untuk mengetahui validitas metode uji aktivitas antioksidan dilakukan
analisis presisi, linearitas, dan spesifisitas terhadap replikasi kandungan fenolik
total. Tiga persamaan regresi linear antara konsentrasi asam galat dengan
absorbansi telah dibuat. Dari ketiga persamaan tersebut dipilih persamaan yang
paling linear yang ditunjukkan oleh nilai r nya. Persamaan regresi linear yang
paling baik didapatkan dari replikasi tiga dengan y = 0,005x – 0,051 dan 0,999
sebagai nilai r. Persamaan tersebut digunakan untuk menghitung konsentrasi
terukur asam galat. Hasil %CV dapat dihitung jika konsentrasi tersebut telah
didapatkan.
Gambar 6. Kurva persamaan regresi linear penetapan kadar fenolik total
(1) Presisi penetapan kandungan fenolik total
Penilaian presisi berdasarkan pada nilai %CV dari data hubungan antara
seri konsentrasi asam galat dengan absorbansi yang dihasilkan. Dari data pada
tabel IV, %CV yang dihasilkan berada dalam rentang 0,3435% - 4,3575%.
Persyaratan %CV tersebut untuk asam galat sebagai bahan p.a. terpenuhi. Rentang
%CV yang baik harus ≤ 5% (Harmita, 2004). Metode ini memiliki presisi yang
baik karena memenuhi persyaratan yang telah ditetapkan.
Tabel IV. Hasil presisi asam galat dari beberapa parameter Konsentrasi
(2) Linearitas penetapan kandungan fenolik total
Hasil nilai koefisien korelasi (r) persamaan regresi linear penetapan
kandungan fenolik total yang paling bagus adalah pada replikasi tiga, yaitu 0,999.
Persyaratan linearitas yang baik jika nilai r > 0,999 terpenuhi. Metode ini
memiliki linearitas yang baik karena memenuhi persyaratan yang telah ditetapkan.
(3) Spesifitas penetapan kandungan fenolik total
Dari hasil spektra (lampiran 11), untuk larutan asam galat maupun
larutan uji tidak menunjukkan adanya gangguan berarti terhadap absorbansi
senyawa berwarna biru yang terukur. Oleh karena itu, metode ini memiliki
G. Hasil Estimasi Kandungan Fenolik Total
Penetapan kandungan fenolik total dilakukan untuk mengetahui
hubungan antara aktivitas antioksidan dan kandungan fenolik total pada fraksi etil
asetat kulit jeruk manis. Senyawa fenolik merupakan golongan terbesar dalam
perannya sebagai antioksidan. Maka jumlah atau kandungan fenolik total pada
suatu tumbuhan sangat menentukan atau berpengaruh pada aktivitas
antioksidannya.
Pada penetapan kandungan fenolik total ini menggunakan metode
Follin-Ciocalteu. Metode ini memakai reagen fenol asam fosfomolibdat-fosfotungstat
atau reagen Follin-Ciocalteu. Prinsip reaksi Follin-Ciocalteu ini adalah reaksi
reduksi oksidasi. Senyawa fenolik akan teroksidasi membentuk keton sedangkan
kompleks fosfomolibdat-fosfotungstat yang berasal dari pereaksi Follin-Ciocalteu
akan mengalami reduksi menjadi kompleks molybdenum blue yang berwarna biru.
Penambahan natrium karbonat dimaksudkan agar reaksi berada pada suasana basa
karena pada suasana basa fenolik akan menjadi ion fenolat yang lebih mudah
teroksidasi sehingga akan lebih mudah dan cepat bereaksi dengan pereaksi
Gambar 7. Reaksi asam galat dengan molibdenum, komponen dari reagen Folin-Ciocalteu (Nunes, et al., 2012)
Untuk dapat membuat kurva baku penentuan kandungan fenolik total
digunakan senyawa baku, yaitu asam galat. Asam galat digunakan sebagai
pembanding karena merupakan suatu senyawa fenolik dan memiliki aktivitas
antioksidan yang kuat, ketersediaannya juga melimpah di alam dan juga tersedia
dalam kemurnian yang tinggi dengan harga relatif murah dibanding standar lain.
Tabel V. Hasil pengukuran seri baku asam galat
Replikasi
Konsentrasi Teoritis (µg/mL)
Absorbansi Persamaan regresi linear
I
Tabel VI. Hasil penetapan kandungan fenolik total fraksi etil asetat ekstrak etanol kulit jeruk manis
Kandungan fenolik total ditentukan menggunakan persamaan regresi
linear antara konsentrasi asam galat dengan absorbansi yang didapat setelah
direaksikan dengan pereaksi Follin-Ciocalteu. Tabel V menunjukkan bahwa pada
replikasi tiga memiliki persamaan regresi linear yang paling baik dengan nilai y =
0,0054x – 0,051 dan r = 0,9996. Berdasarkan perhitungan menggunakan
25,81 ± 0,314 mg ekivalen asam galat per gram fraksi etil asetat ekstrak etanol
kulit jeruk manis (Tabel VI).
H. Hasil Optimasi Metode Uji Aktivitas Antioksidan
Metode DPPH merupakan metode yang mudah, cepat, dan sensitif untuk
pengujian aktivitas antioksidan senyawa tertentu atau ekstrak tanaman (Koleva, et
al., 2002; Prakash, et al., 2010). DPPH merupakan radikal bebas yang dapat
bereaksi dengan senyawa yang dapat mendonorkan atom hidrogen. Keberadaan
senyawa beraktivitas antioksidan dapat mengubah warna larutan DPPH dari ungu
menjadi kuning. DPPH mempunyai maksimum pada 517 nm (Dehpour, et al.,
2009). Oleh karena itu, peneliti melakukan scanning maksimum pada pelarut,
fraksi etil asetat, dan rutin pada daerah 400-600 nm (Lampiran 11). Hal ini
dilakukan dengan tujuan memastikan bahwa tidak ada gangguan pengukuran pada
daerah maksimum DPPH yang dapat menyebabkan hasil pengukuran absorbansi
dari DPPH menjadi tidak akurat. Hasil tersebut tidak menunjukkan adanya
gangguan pada daerah maksimum DPPH. Setelah dipastikan tidak terdapat
gangguan maka metode DPPH dapat dilaksanakan untuk menguji aktivitas
antioksidan fraksi etil asetat ekstrak etanol kulit jeruk manis. Untuk menguji
aktivitas antioksidan perlu dilakukan terlebih dahulu proses optimasi metode
DPPH. Proses optimasi tersebut berupa penentuan OT dan scanning maksimum
(1) Penentuan maksimum metode uji aktivitas antioksidan
Tujuan penentuan maksimum adalah untuk menetapkan panjang
gelombang DPPH yang digunakan dalam penelitian ini. Pengukuran absorbansi
perlu dilakukan pada maksimum karena pada maksimum, dengan hanya
sedikit perubahan konsentrasi akan memberikan perubahan absorbansi yang besar
sehingga didapatkan sensitivitas analisis yang maksimum.
Selain itu, kurva pada maksimum relatif datar sehingga adanya sedikit
pergeseran panjang gelombang karena variasi instrumental, absorbansi tetap
stabil.
Gambar 9. Gugus kromofor dan auksokrom DPPH
Penentuan maksimum dilakukan dengan scanning terhadap tiga seri
konsentrasi larutan DPPH pada panjang gelombang visibel dari 400 nm sampai
600 nm. DPPH bisa terukur pada daerah visibel karena memiliki gugus kromofor
dan auksokrom (gambar 8), sedangkan dengan adanya elektron yang tidak
berpasangan, DPPH memberikan serapan kuat pada 517 nm yang menyebabkan
keberadaan penangkap radikal bebas, maka absorbansinya menurun dan larutan
menjadi berwarna kuning. Pemilihan rentang panjang gelombang 400-600 nm
didasarkan pada warna DPPH berupa ungu dan maksimum-nya pada 517 nm.
Dari ketiga seri larutan DPPH tersebut, diperoleh maksimum, yaitu pada 515
nm.
(2) Penentuan OT metode uji aktivitas antioksidan
Tujuan penentuan OT adalah untuk menetapkan rentang waktu dimana
larutan pembanding dan uji sudah mereduksi radikal DPPH dengan sempurna
sehingga diperoleh nilai absorbansi yang stabil. Jika nilai absorbansi stabil maka
pengukuran bisa reprodusibel dan meminimalkan kesalahan analisis. Penentuan
OT dilakukan dengan mengukur absorbansi DPPH pada maksimum DPPH yang
telah diukur sebelumnya, yaitu 515 nm setiap 5 menit selama 60 menit pada
larutan pembanding dan uji.
Gambar 11. Grafik penentuan OT fraksi etil asetat
Hasil penentuan OT terlihat pada gambar 10 dan 11, yaitu pada menit
ke-5 sampai ke-60 baik pada larutan pembanding maupun uji, absorbansi DPPH
memberikan nilai yang semakin stabil, hal ini menunjukkan bahwa reaksi antara
DPPH dengan senyawa antioksidan dalam larutan pembanding dan uji semakin
sempurna dan akhirnya berhenti. Dari gambar 10 dan 11, dapat dinyatakan bahwa
OT pada larutan pembanding (rutin) selama 55 menit, sedangkan pada larutan uji
(fraksi etil asetat) selama 45 menit.
I. Hasil Validasi Metode Uji Aktivitas Antioksidan
Validasi metode analisis adalah suatu penilaian terhadap parameter
tertentu berdasarkan percobaan di laboratorium, untuk membuktikan bahwa
Untuk mengetahui validitas metode uji aktivitas antioksidan dilakukan
analisis presisi, linearitas, dan spesifisitas terhadap replikasi uji aktivitas
antioksidan rutin dan fraksi etil asetat ekstrak etanol kulit jeruk manis.
Tiga persamaan regresi linear antara konsentrasi rutin dan fraksi etil
asetat dengan %IC telah dibuat. Dari ketiga persamaan tersebut dipilih persamaan
yang paling linear yang ditunjukkan oleh nilai r nya. Persamaan regresi linear
yang paling baik untuk rutin diperoleh dari replikasi tiga (y = 1,7697x + 5,8873;
dengan 0,996 sebagai nilai r), sedangkan untuk fraksi etil asetat diperoleh dari
replikasi dua (y = 0,167x + 1,194; dengan 0,996 sebagai nilai r). Persamaan
tersebut digunakan untuk menghitung konsentrasi terukur baik untuk rutin
maupun larutan uji. Hasil %CV dapat dihitung jika konsentrasi tersebut telah
didapatkan. Gambar 12 dan 13 menunjukkan kurva persamaan regresi linear
aktivitas antioksidan rutin dan fraksi etil asetat ekstrak etanol kulit jeruk manis.
Gambar 12. Kurva persamaan regresi linear aktivitas antioksidan rutin
Gambar 13. Kurva persamaan regresi linear aktivitas antioksidan fraksi etil asetat ekstrak etanolik kulit jeruk manis
Dari gambar 12 dan 13, tampak bahwa ada korelasi antara konsentrasi
rutin dan fraksi etil asetat dengan %IC yang ditunjukkan dari koefisien korelasi
grafik (nilai r) yang mendekati nilai satu. Koefisien korelasi tersebut bernilai
positif yang menunjukkan bahwa hubungan antara konsentrasi baik rutin maupun
fraksi etil asetat dengan %IC yang dihasilkan sebanding. Semakin besar
konsentrasi dari rutin maupun fraksi etil asetat maka semakin besar %IC yang
dihasilkan, begitu juga sebaliknya.
(1) Presisi metode uji aktivitas antioksidan
Presisi suatu metode analisis dinyatakan dalam persentase Coefficient of
Variation (CV).
aktivitas antioksidan fraksi etil asetat
Tabel VII. Hasil presisi aktivitas antioksidan standar rutin
Nilai %CV untuk larutan pembanding rutin pada tabel diatas berada pada
rentang 0,383% - 3,778%. Nilai presisi yang masih dapat diterima adalah ≤ 5%
(Harmita, 2004). Pada semua seri konsentrasi larutan pembanding rutin telah
memenuhi nilai presisi yang baik.
Tabel VIII. Hasil presisi aktivitas antioksidan fraksi etil asetat Konsentrasi
0,071% - 0,313%. Nilai presisi yang masih dapat diterima adalah ≤ 5% (Harmita,
2004). Pada semua seri konsentrasi larutan uji diketahui telah memenuhi nilai
presisi yang baik. Dari hasil tersebut, dapat dikatakan bahwa metode DPPH yang
(2) Linearitas metode uji aktivitas antioksidan
Linearitas suatu metode didasarkan pada nilai koefisien korelasi (r) yang
dihasilkan dari suatu persamaan regresi linier. Linearitasnya dikatakan semakin
baik apabila nilai r semakin mendekati satu. Nilai koefisien korelasi (r) untuk
larutan pembanding rutin untuk replikasi I = 0,9957; replikasi II = 0,9953; dan
replikasi III = 0,99649 (Tabel VI). Data linearitas dapat diterima jika memenuhi
nilai r > 0,995 (Chan, Lam, Herman, Lee, 2005). Dari hasil tersebut, persamaan
kurva baku untuk ketiga replikasi larutan pembanding rutin telah memenuhi
persyaratan lineraitas yang baik.
Tabel IX. Hasil aktivitas antioksidan rutin dengan metode DPPH
Replikasi
Konsentrasi
(µg/mL) % IC Persamaan regresi linier
Tabel X. Hasil aktivitas antioksidan fraksi etil asetat ekstrak etanol kulit jeruk manis dengan metode DPPH
Replikasi Konsentrasi (µg/mL) % IC Persamaan regresi linier
160 28,90
asetat ekstrak etanol kulit jeruk manis yang ditunjukan pada tabel X, didapatkan
persamaan regresi linear berturut-turut adalah replikasi satu r = 0,995; r = 0,996,
dan r = 0,995. Tiga hasil ini masih memenuhi nilai koefisien korelasi linearitas
minimal menurut Chan, et al. (2005), yaitu r > 0,995. Dari hasil tersebut dapat
disimpulkan metode ini memiliki linearitas yang baik untuk menganalisis fraksi
etil asetat ekstrak kulit jeruk manis.
(3) Spesifitas metode uji aktivitas antioksidan
Spesifitas suatu metode adalah kemampuannya yang hanya mengukur zat
tertentu saja secara cermat dan seksama dengan adanya komponen lain yang
mungkin ada dalam matriks sampel (Harmita, 2004). Dalam metode analisis ini
yang menggunakan spektrofotometri visibel pada pengukuran rutin dan fraksi etil
adanya serapan dari sampel sebelum ditambah DPPH pada panjang gelombang
pengukuran yang digunakan, yaitu 515 nm. Dari hasil spektra terlihat bahwa
larutan rutin, larutan uji fraksi etil asetat ekstrak etanol kulit jeruk manis dan
pelarut metanol tidak menunjukkan adanya gangguan berarti terhadap absorbansi
DPPH hasil reaksi (Lampiran 11). Dengan demikian dapat dikatakan metode ini
memilki spesifitas yang baik.
Dari hasil validasi metode analisis yang dilakukan menunjukkan bahwa
metode penangkapan radikal bebas DPPH oleh rutin dan fraksi etil asetat ekstrak
etanol kulit jeruk manis sebagai antioksidan terbukti sudah baik dalam, presisi,
spesifisitas dan linearitas sehingga hasil yang diperoleh dapat dipercaya.
J.Hasil Penentuan Aktivitas Antioksidan dengan Radikal DPPH Aktivitas antioksidan dari suatu bahan uji dinyatakan dengan IC50. Nilai
tersebut diperoleh dari suatu persamaan regresi linear yang menyatakan hubungan
antara konsentrasi bahan uji dengan %IC. Semakin kecil nilai IC50, maka semakin
besar aktivitas antioksidan suatu bahan uji. Tujuan dari uji ini adalah memperoleh
nilai IC50 fraksi etil asetat ekstrak etanol kulit jeruk manis. Nilai tersebut
Tabel XI. Hasil perhitungan IC50 rutin dan fraksi etil asetat ekstrak etanol
sedangkan larutan uji sebesar 292,09± 0,379 ( g/mL). Untuk melihat signifikansi
antara nilai IC50 rutin dengan larutan uji maka data nilai aktivitas antioksidan diuji
secara statisik. Pengujian dilakukan dengan menggunakan software R 2.14.1.
Langkah pertama dilakukan uji Shapiro-Wilk karena sampel yang digunakan < 50
(Dahlan, 2012). Uji ini bertujuan untuk mengetahui apakah data yang didapatkan
terdistribusi normal atau tidak. Hipotesis null (Ho) adalah data %IC terdistribusi
normal sedangkan Hipotesis alternatif adalah data %IC tidak terdistribusi normal.
Dari hasil perhitungan Shapiro-Wilk diperoleh nilai signifikansi (p) untuk IC50
rutin sebesar 0,6361 (Gambar 14) dan larutan uji sebesar 0,2529 (Gambar 15).
Nilai signifikansi yang diperoleh untuk rutin dan fraksi etil asetat lebih besar dari
nilai signifikansi 0,05 (taraf kepercayaan 95%), oleh karena itu Hnull diterima.
Dari hasil tersebut dapat disimpulkan data IC50 rutin dan fraksi etil asetat