HALAMAN SAMPUL
SINTESIS NITROFURAZON DARI 5-NITRO-2-FURFURAL DIASETAT DAN SEMIKARBAZIDA HIDROKLORIDA DENGAN KATALIS ASAM
P-TOLUENSULFONAT
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh :
Georgius Borisdeva Radite Baswara
NIM : 048114078
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2008
1
HALAMAN JUDUL
SINTESIS NITROFURAZON DARI 5-NITRO-2-FURFURAL DIASETAT DAN SEMIKARBAZIDA HIDROKLORIDA DENGAN KATALIS ASAM
P-TOLUENSULFONAT
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh :
Georgius Borisdeva Radite Baswara
NIM : 048114078
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iii
HALAMAN PERSETUJUAN PEMBIMBING
Skripsi
SINTESIS NITROFURAZON DARI 5-NITRO-2-FURFURAL DIASETAT DAN SEMIKARBAZIDA HIDROKLORIDA DENGAN KATALIS ASAM
P-TOLUENSULFONAT
Yang diajukan oleh
Georgius Borisdeva Radite Baswara
NIM : 048114078
Telah disetujui oleh
Pembimbing
Lucia Wiwid Wijayanti, M. Si.
Tanggal 18 Juli 2008
iii
Pengesahan Skripsi Berjudul
SINTESIS NITROFURAZON DARI 5-NITRO-2-FURFURAL DIASETAT DAN SEMIKARBAZIDA HIDROKLORIDA DENGAN KATALIS ASAM
P-TOLUENSULFONAT
Oleh :
Georgius Borisdeva Radite Baswara NIM : 048114078
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi
Universitas Sanata Dharma Pada tanggal : 29 Juli 2008
Mengetahui Fakultas Farmasi Universitas Sanata Dharma
Dekan
Rita Suhadi, M. Si. Pembimbing :
Lucia Wiwid Wijayanti, M. Si.
Panitia Penguji : tanda tangan
1. Lucia Wiwid Wijayanti, M. Si. ……….
2. Jeffry Julianus, M. Si. ……….
v
HALAMAN PERSEMBAHAN
v
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak
memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam
kutipan dan daftar pustaka, sebagaimana karya ilmiah
Yogyakarta, 11 Juni 2008
Penulis,
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma :
Nama : Georgius Borisdeva Radite Baswara No mahasiswa : 048114078
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah yang berjudul :
“Sintesis Nitrofurazon dari 5-Nitro-2-furfural diasetat dan Semikarbazida HCl dengan Katalis Asam p-Toluensulfonat”
Beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, dan memublikasikannya di internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya
maupun memberikan royalti kepada saya selama mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini saya buat dengan sebenarnya. Dibuat di Yogyakarta
Pada tanggal 17 Agustus 2008
Yang menyatakan
G. Borisdeva Radite B.
PRAKATA
Puji syukur kepada Tuhan Yang Maha Esa atas berkat dan karunia-Nya
penulis dapat menyelesaikan skripsi yang berjudul “Sintesis Nitrofurazon dari
Starting Material 5-nitro-2-furfural diasetat dan Semikarbazida HCl dengan
Katalis Asam p-Toluensulfonat” sebagai salah satu syarat untuk mencapai gelar
sarjana pada Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Dalam penulisan skripsi ini, penulis mendapatkan bantuan dari banyak
pihak, Pada kesempatan ini penulis ingin menyampaikan penghargaan dan ucapan
terima kasih kepada :
1. Lucia Wiwid Wijayanti, M. Si. selaku dosen pembimbing atas bimbingan
dan pengarahannya baik selama penelitian maupun penyusunan skripsi ini.
2. Jeffry Julianus, M. Si. selaku penguji atas segala masukan, kritik, dan
sarannya.
3. Christine Patramurti, M. Si. selaku penguji atas segala masukan, kritik, dan
sarannya.
4. Yohanes Dwiatmaka, M. Si. selaku Kepala Laboratorium Farmasi atas
bantuannya sehingga penulis dapat bekerja di laboratorium dengan lancar.
5. Mas Parlan, Mas Kunto, dan Mas Bimo atas bantuannya selama peneliti
bekerja di laboratorium Kimia Organik, Kimia Analisis, dan Kimia Analisis
Instrumen.
6. Mia, Dewi, Probo, Robby, dan Vita, rekan seperjuangan dalam penelitian ini
viii
7. Bob, Coco, Fajar, Edvan, dan Elvan, atas kebersamaannya selama di
laboratorium.
8. Ayu, Ika, Lian, Rosa, Sisil, Leo, Adit, Budiarto, Rudi, Ella, Agung, Yoyo,
Robert, Tintus, Rizky, Brian dan teman-teman angkatan 2004 lain yang telah
banyak membantu dan memotivasi.
9. Mbak Ita, Kiki dan Seli, yang banyak membantu penyusunan skripsi ini.
10. Si kecil Toro yang tidak punya ruang sedikit pun di dunia yang luas ini, atas
inspirasi dan kebahagiaan singkat yang diberikan
11. Segenap rekan dan pihak-pihak yang membantu namun tidak dapat
disebutkan satu persatu.
Akhir kata penulis menyadari bahwa karya penulisan skripsi ini jauh dari
sempurna mengingat keterbatasan kemampuan dan pengalaman yang dimiliki.
Oleh karena itu, saran dan kritik yang sifatnya membangun sangat diperlukan oleh
penulis demi kesempurnaan skripsi ini. Semoga skripsi ini dapat memberikan
sumbangsih yang bermanfaat pada perkembangan ilmu pengetahuan.
Yogyakarta 10 Juni 2008
Penulis
viii
DAFTAR ISI
HALAMAN SAMPUL ... i
HALAMAN JUDUL... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN... iv
HALAMAN PERSEMBAHAN ... v
PERNYATAAN KEASLIAN KARYA ... vi
PRAKATA... vii
DAFTAR ISI... ix
DAFTAR TABEL... xiii
DAFTAR GAMBAR ... xiv
INTISARI PENELITIAN ... xvi
ABSTRACT... xvii
BAB I ... 1
PENDAHULUAN ... 1
A. Latar Belakang ... 1
1. Permasalahan ... 3
2. Keaslian penelitian ... 3
3. Manfaat penelitian... 4
B. Tujuan Penelitian ... 4
BAB II... 5
x
A. Nitrofurazon ... 5
1. Reaksi diskoneksi nitrofurazon ... 6
2. Sintesis nitrofurazon (reaksi pembentukan imin) ... 6
3. Semikarbazida hidroklorida ... 8
4. Katalis asam p-toluensulfonat ... 9
B. Sintesis 5-Nitro-2-furfural Diasetat... 10
1. Furfural... 10
2. Reaktivitas cincin furan pada furfural... 12
C. Elusidasi Struktur ... 13
1. Spetroskopi inframerah ... 14
2. Spektroskopi Resonansi Magnet Inti (RMI) ... 16
D. Landasan Teori... 18
E. Hipotesis... 20
BAB III ... 21
METODOLOGI PENELITIAN... 21
A. Jenis Penelitian... 21
B. Definisi Operasional Penelitian ... 21
C. Alat dan Bahan Penelitian... 21
1. Alat penelitian ... 21
2. Bahan penelitian... 22
D. Tata Cara Penelitian ... 22
1. Sintesis 5-nitro-2-furfural diasetat ... 22
2. Sintesis nitrofurazon ... 23
x
3. Uji pendahuluan ... 23
4. Elusidasi Struktur ... 24
E. Analisis Hasil ... 25
1. Data organoleptis ... 25
2. Perhitungan rendemen... 25
BAB IV ... 26
HASIL DAN PEMBAHASAN... 26
A. Sintesis 5-Nitro-2-furfural diasetat ... 26
B. Sintesis Nitrofurazon dan Mekanisme Reaksi ... 28
C. Uji Pendahuluan ... 32
1. Uji organoleptis... 32
2. Uji kelarutan... 33
3. Uji titik lebur ... 33
4. Uji kualitatif nitrofurazon ... 34
5. Uji Kromatografi Lapis Tipis... 35
D. Elusidasi Struktur ... 37
1. Spektroskopi inframerah ... 37
2. Spektroskopi Resonansi Magnet Inti (RMI) ... 42
E. Rendemen... 46
BAB V... 47
KESIMPULAN DAN SARAN... 47
A. Kesimpulan ... 47
xii
DAFTAR PUSTAKA ... 48
Lampiran ... 50
xii
DAFTAR TABEL
Tabel I. Korelasi antara gugus fungsi dengan frekuensi ... 15
Tabel II. Perbandingan organoleptis senyawa hasil sintesis dengan nitrofurazon
dan 5-nitro-2-furfural diasetat ... 32
Tabel III. Perbandingan kelarutan senyawa hasil sintesis dengan kelarutan
nitrofurazon ... 33
Tabel IV. Perbandingan interpretasi spektrum 5-nitro-2-furfural diasetat dan
senyawa hasil sintesis... 42
xiv
DAFTAR GAMBAR
Gambar 1. Struktur nitrofurazon ... 5
Gambar 2. Desain diskoneksi nitrofurazon... 6
Gambar 3. Desain diskoneksi 5-nitro-2-furfuraldehid ... 6
Gambar 4. Reaksi umum pembentukan senyawa imin ... 7
Gambar 5. Adisi amina primer pada senyawa karbonil ... 7
Gambar 6. Proses dehidrasi dan eliminasi proton... 7
Gambar 7. Protonasi amina primer membentuk ion ammonium ... 8
Gambar 8. Struktur semikarbazida hidroklorida... 9
Gambar 9. Struktur asam p-toluensulfonat ... 10
Gambar 10. Struktur 5-nitro-2-furfural diasetat... 10
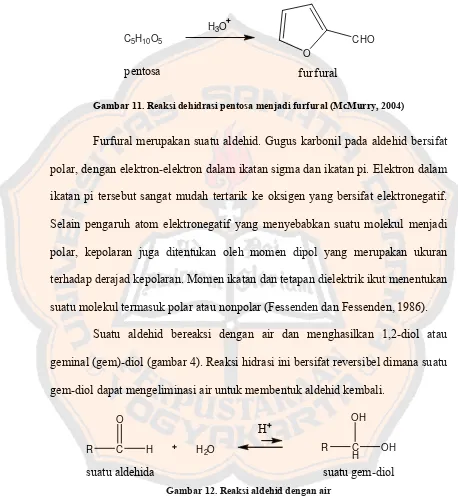
Gambar 11. Reaksi dehidrasi pentosa menjadi furfural (McMurry, 2004)... 11
Gambar 12. Reaksi aldehid dengan air ... 11
Gambar 13. Bentuk stabilisasi resonansi dari cincin furan (Hendrickson, 1970). 13 Gambar 14. Proton-proton yang ekivalen secara magnetik dan kimia pada kloroetana... 18
Gambar 15. Reaksi umum sintesis nitrofurazon ... 19
Gambar 16. Reaksi pembentukan asetil nitrit ... 26
Gambar 17. Proses delokalisasi elektron pada reaksi adisi ion nitronium pada cincin furan ... 27
Gambar 18. Pembentukan senyawa 5-nitro-2furfural diasetat... 28
Gambar 19. Hidrolisis senyawa 5-nitro-2-furfural diasetat menjadi bentuk hidrat ... 28
xiv
Gambar 20. Kesetimbangan reaksi antara bentuk hidrat dan bentuk aldehid ... 29
Gambar 21. Protonasi gugus karbonil aldehid sehingga elektrofilisitasnya meningkat... 30
Gambar 23. Adisi semikarbazida pada 5-nitrofurfuraldehid... 31
Gambar 24. Pelepasan proton untuk membentuk senyawa karbinolamin ... 31
Gambar 25. Proses dehidrasi dan pembentukan ikatan imina ... 32
Gambar 26. Perpanjangan gugus kromofor pada nitrofurazon dengan adanya basa kuat... 35
Gambar 27. Hasil pemeriksaan dengan KLT... 36
Gambar 28. Spektrum inframerah senyawa 5-nitro-2-furfural diasetat ... 39
Gambar 29. Interaksi hidrogen intramolekul antara atom O dan H pada nitrofurazon ... 40
Gambar 30. Spektrum inframerah senyawa hasil sintesis... 41
Gambar 31. Pencacahan tipe proton nitrofurazon... 42
xvi
INTISARI PENELITIAN
Senyawa nitrofurazon merupakan agen antibakteri nitroheterosiklik yang efektif terhadap bakteri Gram positif dan Gram negatif. Subtituen metilen hidrazin karboksamida pada posisi C2 menyebabkan aktivitas antibakterinya meningkat dibandingkan dengan antibiotik nitrofuran.
Sintesis nitrofurazon dilakukan dengan mereaksikan senyawa 5-nitrofurfural diasetat dan semikarbazida HCl dengan katalis asam p-toluensulfonat pada suhu 70°C. Senyawa hasil sintesis kemudian diisolasi dan diuji secara kualitatif menggunakan uji organoleptis, uji kelarutan, uji kualitatif nitrofurazon, uji titik leleh, uji kromatografi lapis tipis, elusidasi struktur dengan spektroskopi inframerah, dan spektroskopi resonansi magnet inti. Parameter keberhasilan penelitian ini adalah besarnya rendemen yang didapatkan.
Senyawa yang dihasilkan dari penelitian ini berupa kristal berwarna hijau pucat tidak berbau, larut dalam larutan alkalis, sukar larut dalam alkohol, tidak larut dalam air dan eter. Senyawa ini menunjukkan hasil positif dalam uji kualitatif nitrofurazon, memiliki profil bercak yang berbeda dengan bercak 5-nitro-2-furfural diasetat, dan memiliki titik lebur 229-230°C. Hasil elusidasi struktur dengan spektroskopi inframerah menunjukkan bahwa senyawa hasil sintesis memiliki gugus-gugus fungsional yang sama dengan nitrofurazon, dan dengan spektroskopi RMI menunjukkan bahwa profil proton senyawa hasil sintesis sama dengan profil proton nitrofurazon. Dari hasil analisis tersebut dapat disimpulkan bahwa nitrofurazon dapat disintesis dengan starting material 5-nitro-2-furfural diasetat dan semikarbazida HCl dengan katalis asam p-toluensulfonat dengan rendemen 46,51%.
Kata kunci : nitrofurazon, 5-nitro-2-furfural diasetat, sintesis
xvi
ABSTRACT
Nitrofurazone is a nitroheterocyclic antibiotic, active against a number of Gram-negative and Gram positive-bacteria. The methylene hydrazine carboxamide group in C2 position of the furan ring increases it’s activity.
Nitrofurazon was synthesized by reacting 5-nitro-2-furfural diacetate and semicarbazide HCl with p-toluenesulfonic acid catalysist at 70°C. The result was isolated and qualitatively analyzed using organoleptic test, solubility test, qualitative test of nitrofurazone, melting point determination, thin layer chromatography, structure determination using infrared (IR) and nuclear magnetic resonance (NMR) spectroscopy. Parameter of succeed of this study was the the product’s rendemen.
The result of this study was pale green crystalline solid, odorless, soluble in alkali solution, slightly soluble in alcohol and propilen glycol, insoluble in water and ether. The qualitative test for nitrofurazone showed positive result, and the thin layer chromatography test gave the difference between 5-nitro-2-furfural diacetate’s and the product’s spot. The product’s melting point was 229-230°C. Structure’s elucidation with IR spectroscopy showed that the product’s functional groups was identically with nitrofurazone’s. NMR spectroscopy showed product’s profile of proton was also similar to nitrofurazon’s. Whole complete results concluded that nitrofurazone could be synthetized using 5-nitro-2-furfural diacetate and semikarbazide HCl with p-toluenesulfonic acid catalysist, and gave rendemen for about 46,51%.
BAB I
PENDAHULUAN
A. Latar Belakang
Senyawa nitroheterosiklik, misalnya seperti nitrofuran, nitrotiazol, dan
nitroimidazol, merupakan agen kemoterapetik yang efektif untuk pengobatan
schistosomiasis, amebiasis, dan trichomoniasis pada manusia dan hewan
(Grunberg cit. Wang, Chiu, Muraoka, Michie, and Bryan, 1975).
Senyawa-senyawa nitroheterosiklik ini berperan cukup penting karena resistensi
mikroorganisme terhadap antibiotik β-laktam dan turunan sulfonamida telah
banyak dilaporkan (Jawetz dan Adelderg, 1996). Nitrofurazon termasuk golongan
nitrofuran yang memiliki spektrum luas sebagai agen antibakteri, mencakup
bakteri Gram positif dan Gram negatif dengan pelaporan kasus resistensi yang
jarang.
Dalam konsentrasi yang tinggi, nitrofurazon bersifat bakterisidal,
sedangkan pada konsentrasi yang rendah, nitrofurazon akan bersifat
bakteriostatik. Nitrofurazon efektif terhadap patogen-patogen yang umumnya
menyebabkan infeksi permukaan kulit, termasuk diantaranya Staphylococcus
aureus, Streptococcus, Escherichia coli, Clostridium perfringens, Enterobacter
aerogenes, dan bakteri Proteus (Anonim, 2004). Mekanisme aksi nitrofurazon
belum diketahui secara pasti. Diduga, nitrofurazon bekerja dengan menghambat
beberapa enzim dari bakteri, terutama untuk enzim-enzim yang terlibat di dalam
degradasi glukosa piruvat secara aerob dan anaerob.
1
Keberadaan senyawa-senyawa nitroheterosiklik dan turunannya dalam
produk alam sangat langka, untuk itu proses sintesisnya menjadi perlu untuk
dipelajari. Nitrofurazon, suatu turunan nitrofuran, memiliki subtituen metilen
hidrazin karboksamida pada posisi C2 sehingga aktivitas antibakterinya lebih baik
dibanding 5-nitrofurfural. Menurut Warren (1995), nitrofurazon dapat
didiskoneksi pada C=N sehingga didapatkan senyawa 5-nitrofurfural dan
semikarbazida. Senyawa 5-nitrofurfural ini dapat didiskoneksi lagi menjadi
starting material asam nitrat dan furfural. Untuk mencegah terbukanya cincin
furan dalam suasana asam, asam nitrat direaksikan terlebih dahulu dengan asam
asetat anhidrida sehingga membentuk asetil nitrit yang sifatnya lebih mild.
Adanya asam asetat anhidrida ini menyebabkan terjadi reaksi esterifikasi senyawa
hidrat hasil reaksi 5-nitrofurfural dengan air membentuk senyawa
5-nitro-2-furfural diasetat.
Pada penelitian ini, digunakan furfural sebagai salah satu reaktan.
Furfural dapat diperoleh dari hidrolisis biomassa (tongkol jagung dan sekam padi)
dalam suasana asam. Indonesia sendiri merupakan negara agraris yang sebagian
besar penduduknya adalah petani. Jadi, limbah agrikultur seperti tongkol jagung
dan sekam padi tersedia cukup banyak. Pemanfaatan tongkol jagung dan sekam
padi yang merupakan limbah agrikultur diharapkan dapat meningkatkan nilai
ekonominya, sehingga berperan dalam penemuan jalur sintesis nitrofurazon yang
lebih murah.
Penelitian tentang sintesis nitrofurazon sebelumnya telah dilakukan
3
nitrofurfuraloksim dengan menggunakan HCl dan H2SO4 sebagai katalisator
reaksi (Tehrani, 2003). Penelitian ini juga mengungkapkan bahwa keberadaan
asam yang sangat kuat seperti H2SO4 dan pemanasan berlebihan dapat
mendekomposisi produk yang terjadi.
Menurut Fessenden dan Fessenden (1986), reaksi pembentukan imin dari
aldehid maupun keton bergantung pada pH. Untuk mendapatkan laju reaksi yang
optimum maka pH diatur hingga 3-4. Dalam penelitian ini digunakan katalis asam
p-toluensulfonat (pKa ~-0.6) yang merupakan asam yang lebih lemah dari asam
klorida (pKa ~-7). Penggunaan katalis ini bertujuan untuk mengurangi resiko
terbukanya cincin furan dan terjadinya dekomposisi produk sintesis, sehingga
menghasilkan rendemen yang lebih banyak.
1. Permasalahan
Dari latar belakang di atas, masalah yang muncul dapat dirumuskan
sebagai berikut : apakah senyawa nitrofurazon dapat disintesis dari starting
material 5-nitro-2-furfural diasetat dan semikarbazida HCl dengan katalis asam p
-toluensulfonat?
2. Keaslian penelitian
Sejauh pengamatan peneliti, penelitian tentang sintesis nitrofurazon
dengan katalis asam p-toluensulfonat belum pernah dilakukan. Adapun penelitian
Tehrani (2003) menggunakan katalis asam klorida untuk sintesis nitrofurazon.
3. Manfaat penelitian
Penelitian ini bermanfaat dalam menemukan jalur sintesis nitrofurazon
yang baru yaitu dengan penggunaan katalis p-toluensulfonat sehingga diharapkan
akan meningkatkan rendemen sintesis nitrofurazon.
B. Tujuan Penelitian
Penelitian ini bertujuan untuk membuktikan apakah nitrofurazon dapat
disintesis dari 5-nitro-2-furfural diasetat dan semikarbazida dengan katalis asam
BAB II
PENELAAHAN PUSTAKA
A. Nitrofurazon
Golongan nitrofuran adalah senyawaan nitrofuraldehid sintetik yang
bersifat sangat bakterisidal dalam keadaan in vitro bagi banyak kuman
Gram-positif dan Gram-negatif. Sebagian besar nitrofuran tidak dapat dilarutkan dalam
air. Beberapa senyawaan (misalnya nitrofuraldehid semikarbazon) efektif sebagai
obat antikuman secara lokal dan digunakan dalam pembalutan luka serta hampir
tidak mengalami penyerapan (Jawetz dan Adelberg, 1996).
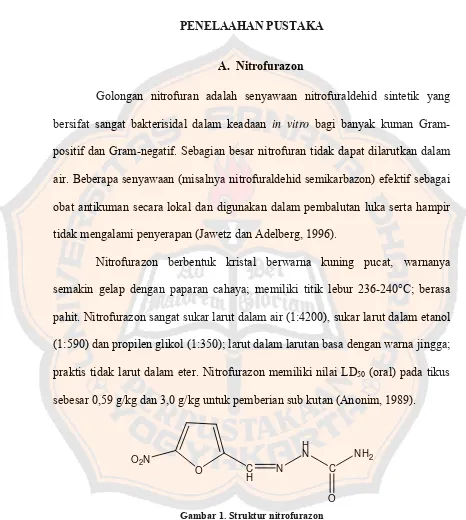
Nitrofurazon berbentuk kristal berwarna kuning pucat, warnanya
semakin gelap dengan paparan cahaya; memiliki titik lebur 236-240°C; berasa
pahit. Nitrofurazon sangat sukar larut dalam air (1:4200), sukar larut dalam etanol
(1:590) dan propilen glikol (1:350); larut dalam larutan basa dengan warna jingga;
praktis tidak larut dalam eter. Nitrofurazon memiliki nilai LD50 (oral) pada tikus
sebesar 0,59 g/kg dan 3,0 g/kg untuk pemberian sub kutan (Anonim, 1989).
O
Gambar 1. Struktur nitrofurazon
Nitrofurazon merupakan obat yang efektif terhadap beberapa
mikroorganisme Gram positif dan Gram negatif (staphylococci, streptococci,
5
dysentery bacillus, colon bacillus, paralyphoid bacyllus, dan lain-lain). Nama lain
obat ini adalah furacin, furacillin, antibioptal, vabrocid, dan lain-lain (Vardanyan
& Hruby, 2006).
1. Reaksi diskoneksi nitrofurazon
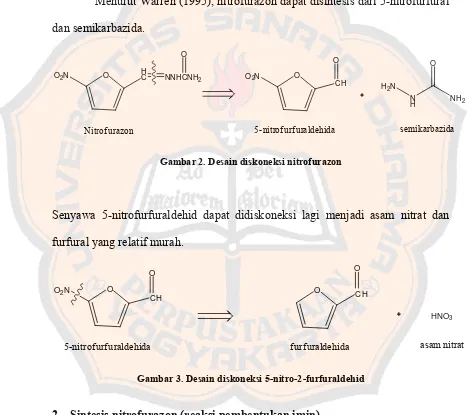
Menurut Warren (1995), nitrofurazon dapat disintesis dari 5-nitrofurfural
dan semikarbazida.
O HC NNHCNH
Nitrof urazon 5-nitrof urf uraldehida semikarbazida
Gambar 2. Desain diskoneksi nitrofurazon
Senyawa 5-nitrofurfuraldehid dapat didiskoneksi lagi menjadi asam nitrat dan
furfural yang relatif murah.
O
f urf uraldehida asam nitrat
Gambar 3. Desain diskoneksi 5-nitro-2-furfuraldehid
2. Sintesis nitrofurazon (reaksi pembentukan imin)
Reaksi sintesis nitrofurazon adalah reaksi pembentukan imin. Suatu
7
Gambar 4. Reaksi umum pembentukan senyawa imin
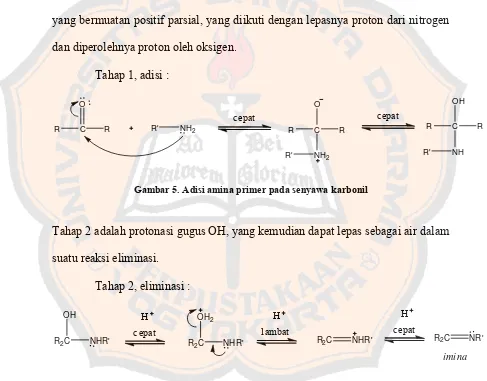
Mekanisme untuk pembentukan imina pada hakekatnya merupakan
proses dua tahap. Tahap pertama adalah adisi amina nukleofilik pada karbonil
yang bermuatan positif parsial, yang diikuti dengan lepasnya proton dari nitrogen
dan diperolehnya proton oleh oksigen.
Tahap 1, adisi :
Gambar 5. Adisi amina primer pada senyawa karbonil
Tahap 2 adalah protonasi gugus OH, yang kemudian dapat lepas sebagai air dalam
suatu reaksi eliminasi.
Tahap 2, eliminasi :
R2C
Gambar 6. Proses dehidrasi dan eliminasi proton
Pembentukan imina adalah suatu reaksi yang tergantung pada pH. Pada
tahap pertama, adisi amina takterprotonkan yang bebas pada gugus karbonil akan
sulit terjadi karena konsentrasi amina bebas menjadi sangat kecil (dapat
diabaikan). Jika hal ini terjadi, tahap adisi yang biasanya cepat ini akan menjadi
lambat dan benar-benar menjadi tahap penentu laju dalam rentetan reaksi tersebut.
Reaksi amina primer dalam asam :
R NH2 H R NH3
tidak nukleof ilik
Gambar 7. Protonasi amina primer membentuk ion ammonium
Tahap kedua reaksi itu adalah eliminasi gugus OH yang terprotonkan
sebagai air. Tidak seperti tahap pertama (adisi amina) laju tahap kedua meningkat
dengan bertambahnya konsentrasi asam. Hal ini disebabkan karena -OH
merupakan suatu basa kuat gugus pergi yang jelek, sedangkan -OH2+ merupakan
suatu basa lemah dan gugus pergi yang baik. Bertambahnya keasaman akan
mengakibatkan tahap 2 akan berjalan lebih cepat, tetapi tahap 1 akan menjadi
lebih lambat. Sebaliknya, menurunnya keasaman menyebabkan tahap 1 lebih
cepat dan tahap 2 menjadi lebih lambat (Fessenden dan Fessenden, 1985).
Tehrani (2003) membuktikan bahwa nitrofurazon dapat disintesis dari
5-nitro-2-furfural diasetat dan semikarbazida HCl dengan katalis asam sulfat dan
asam klorida dengan rendemen berkisar antara 79-92 %. Dalam penelitian tersebut
juga diungkapkan bahwa adanya asam kuat dan waktu reaksi yang panjang dapat
mengakibatkan dekomposisi produk yang terjadi.
3. Semikarbazida hidroklorida
Semikarbazida hidroklorida merupakan salah satu starting material
9
dimana satu gugus amida pada urea digantikan oleh residu dari hidrazin. Garam
hidroklorit dari semikarbazida berbentuk kristal berwarna putih, dengan titik leleh
175°C dan sangat mudah larut di dalam air.
Gambar 8. Struktur semikarbazida hidroklorida
Senyawa ini digunakan dalam preparasi bahan-bahan farmasetik
termasuk antibakteri golongan nitrofuran (furazolidon, nitrofurazon,
nitro-furantoin) dan senyawa lainnya. Semikarbazon merupakan bentuk keton dari
semikarbazida yang didapatkan dari reaksi kondensasi antara suatu keton atau
aldehid dengan semikarbazida (Anonim, 2008).
4. Katalis asam p-toluensulfonat
Katalis merupakan suatu bahan yang dapat meningkatkan laju reaksi
kimia tanpa diubah dalam keseluruhan kimia, namun tidak berarti tidak terlibat
dalam reaksi. Katalis akan berada dalam bentuk yang sama sebelum dan sesudah
reaksi berlangsung. Pada penelitian ini digunakan katalis asam para
-toluensulfonat.
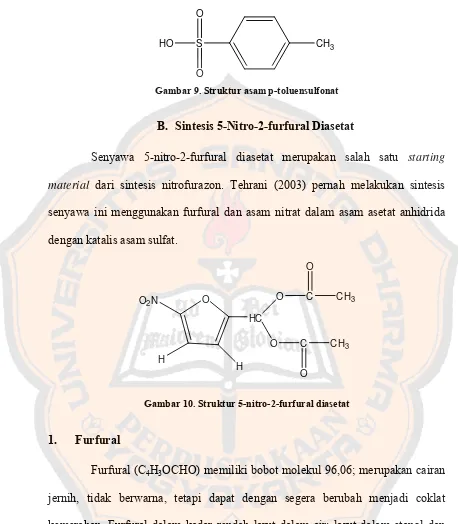
Asam para-toluensulfonat memiliki rumus struktur C7H8O3S. Kristal
asam p-toluensulfonat berbentuk seperti pasir; tidak berwarna; dalam bentuk
cairan berwarna gelap atau tidak berwarna; bersifat sangat mudah larut air dan
sangat higroskopis. Asam p-toluensulfonat digunakan dalam pembuatan pewarna,
obat, dan bahan-bahan kimia lainnya (Anonim, 2003).
CH3 S
O O
HO
Gambar 9. Struktur asam p-toluensulfonat
B. Sintesis 5-Nitro-2-furfural Diasetat
Senyawa 5-nitro-2-furfural diasetat merupakan salah satu starting
material dari sintesis nitrofurazon. Tehrani (2003) pernah melakukan sintesis
senyawa ini menggunakan furfural dan asam nitrat dalam asam asetat anhidrida
dengan katalis asam sulfat.
O
Gambar 10. Struktur 5-nitro-2-furfural diasetat
1. Furfural
Furfural (C4H3OCHO) memiliki bobot molekul 96,06; merupakan cairan
jernih, tidak berwarna, tetapi dapat dengan segera berubah menjadi coklat
kemerahan. Furfural dalam kadar rendah larut dalam air; larut dalam etanol dan
eter. Penyimpanan furfural harus dalam wadah tertutup rapat dan tidak tembus
cahaya (Anonim, 1995). Furfural dapat dibuat dari dehidrasi gula pentosa, yang
dapat ditemukan dalam sekam gandum dan tongkol jagung (McMurry, 2004).
11
dengan bahan baku tandan kosong sawit yang banyak tersedia sebagai limbah
agrikultur.
C5H10O5
H3O
O
CHO
pentosa f urf ural
Gambar 11. Reaksi dehidrasi pentosa menjadi furfural (McMurry, 2004)
Furfural merupakan suatu aldehid. Gugus karbonil pada aldehid bersifat
polar, dengan elektron-elektron dalam ikatan sigma dan ikatan pi. Elektron dalam
ikatan pi tersebut sangat mudah tertarik ke oksigen yang bersifat elektronegatif.
Selain pengaruh atom elektronegatif yang menyebabkan suatu molekul menjadi
polar, kepolaran juga ditentukan oleh momen dipol yang merupakan ukuran
terhadap derajad kepolaran. Momen ikatan dan tetapan dielektrik ikut menentukan
suatu molekul termasuk polar atau nonpolar (Fessenden dan Fessenden, 1986).
Suatu aldehid bereaksi dengan air dan menghasilkan 1,2-diol atau
geminal (gem)-diol (gambar 4). Reaksi hidrasi ini bersifat reversibel dimana suatu
gem-diol dapat mengeliminasi air untuk membentuk aldehid kembali.
R C
suatu aldehida suatu gem-diol
H2O
Gambar 12. Reaksi aldehid dengan air
Kesetimbangan reaksi antara gem-diol dan aldehid tergantung pada
struktur dari senyawa karbonilnya. Meskipun kecenderungan pada kesetimbangan
adalah membentuk senyawa karbonil untuk alasan sterik, namun untuk beberapa
aldehid sederhana cenderung akan membentuk gem-diol. Senyawa gem-diol atau
hidrat yang bersifat stabil juga dikenal, namun lebih bersifat kekecualian. Kloral
hidrat dan formalin adalah contoh senyawa gem-diol atau hidrat yang stabil
(McMurry, 2004; Fessenden dan Fessenden, 1986).
Adisi nukleofilik (air) pada suatu aldehid berjalan lambat dalam air
murni. Adanya katalis asam maupun basa dapat mempercepat laju reaksi tanpa
mengubah kesetimbangan (McMurry, 2004).
2. Reaktivitas cincin furan pada furfural
Cincin furan akan mengalami reaksi subtitusi elektrofilik aromatik
karena furan termasuk senyawa aromatik. Cincin furan memiliki 6 elektron π
dalam sistem terkonjugasi pada orbital p yang saling tumpang tindih. Pada
umumnya heterosiklik bersifat lebih reaktif terhadap elektrofil dibandingkan
dengan cincin benzena. Halogenasi, nitrasi, sulfonasi, dan asilasi Friedel-Crafts
dapat berlangsung apabila berada dalam kondisi reaksi yang tepat. Dibandingkan
dengan pirola dan tiofena, furan merupakan heterosiklik yang lebih reaktif
(McMurry, 2004).
13
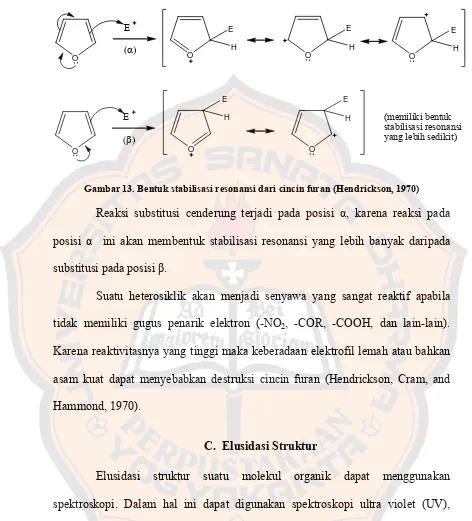
Gambar 13. Bentuk stabilisasi resonansi dari cincin furan (Hendrickson, 1970)
Reaksi substitusi cenderung terjadi pada posisi α, karena reaksi pada
posisi α ini akan membentuk stabilisasi resonansi yang lebih banyak daripada
substitusi pada posisi β.
Suatu heterosiklik akan menjadi senyawa yang sangat reaktif apabila
tidak memiliki gugus penarik elektron (-NO2, -COR, -COOH, dan lain-lain).
Karena reaktivitasnya yang tinggi maka keberadaan elektrofil lemah atau bahkan
asam kuat dapat menyebabkan destruksi cincin furan (Hendrickson, Cram, and
Hammond, 1970).
C. Elusidasi Struktur
Elusidasi struktur suatu molekul organik dapat menggunakan
spektroskopi. Dalam hal ini dapat digunakan spektroskopi ultra violet (UV),
spektroskopi infra merah (IR), resonansi magnet inti (NMR proton dan karbon),
dan spektrometri massa. Dalam hal ini, spektrum UV menguji susunan sistem
kromofor dari suatu zat. Spektrum IR dapat memberikan informasi tentang
gugus-gugus fungsional yang penting. Berdasarkan spektrum NMR, dapat diketahui
penyusunan atom-atom hidrogen dan akhirnya spektrum massa tidak hanya
membantu menentukan berat molekul di samping perhitungan rumus molekul
saja, tetapi juga petunjuk bagi gugus-gugus fungsional dan penyelidikan kerangka
molekul. Dengan demikian penggunaan keempat metode spektroskopi dengan
referensi menyempurnakan pemantapan struktur molekul (Samhoedi cit., Jung,
2001).
1. Spetroskopi inframerah
Bila sinar inframerah dilewatkan melalui cuplikan senyawa organik,
maka sejumlah frekuensi diserap sedang frekuensi yang lain
diteruskan/ditrans-misikan tanpa diserap. Jika persen transmisi atau persen absorbansi diplotkan
terhadap frekuensi maka akan dihasilkan suatu spektrum inframerah
(Sastrohamidjojo, 2007).
Energi dari kebanyakan vibrasi molekuler akan mengacu pada daerah
inframerah pada spektrum elektromagnetik. Vibrasi molekuler bisa dideteksi dan
diukur pada spektrum inframerah. Posisi dari suatu gelombang serapan pada
spektrum dapat diekspresikan dalam mikron (μm) atau yang lebih sering dijumpai
dalam bentuk resiprokal dari panjang gelombang (cm-1). Daerah spektrum
inframerah berada pada 4000 cm-1 pada akhir frekuensi tinggi dan 625 cm-1 pada
akhir frekuensi rendah (Williams dan Fleming, 1980). Daerah antara 1400-4000
cm-1, bagian kiri spektrum inframerah, merupakan daerah yang khusus berguna
untuk identifikasi gugus-gugus fungsional. Daerah ini menunjukkan absorbsi yang
disebabkan oleh modus uluran atau rentangan. Daerah di kanan 1400 cm-1
seringkali sangat rumit karena bank modus rentangan maupun modus tekukan
15
gugus fungsional spesifik tak dapat ditarik dengan cermat, namun tiap senyawa
organik mempunyai serapan yang unik di sini. Oleh karena itu, bagian spektrum
ini disebut daerah sidik jari (fingerprint region). Meskipun bagian kiri spektrum
nampaknya sama untuk senyawa-senyawa yang mirip, daerah sidikan haruslah
pula cocok antara dua spektrum, agar dapat disimpulkan bahwa kedua senyawa itu
sama (Fessenden dan Fessenden, 1986).
Molekul yang tersusun dari banyak atom mempunyai sangat banyak
frekuensi vibrasi. Setiap ragam vibrasi yang berbeda mungkin dapat memberikan
pita serapan yang berbeda. Sejumlah vibrasi yang mempunyai frekuensi sama
maka pita-pita serapannya akan saling tumpang tindih (Sastrohamidjojo, 2007).
Korelasi antara vibrasi beberapa gugus fungsi dan frekuensi (bilangan gelombang)
ditunjukkan pada tabel 1.
Tabel I. Korelasi antara gugus fungsi dengan frekuensi
Jenis vibrasi Frekuensi (cm-1) Intensitas C-H ulur (stretch) 3000 – 2850 tajam C=C Alkena 1680 – 1600 sedang-lemah Aromatik 1600 – 1475 sedang-lemah
Klorida asam 1800 tajam C-O Alkohol, eter, ester asam 1300 – 1000 tajam Karboksilat, anhidrida
O-H Alkohol, fenol
bebas 3650 – 3600 sedang Ikatan –H 3500 – 3200 sedang Asam karboksilat 3400 – 2400 sedang
N-H Amida primer & sekunder dan
amina (stretch) 3500 – 3100 sedang (bending) 1640 – 1550 sedang-tajam C-H Amina 1350 – 1000 sedang-tajam C=N Imina dan oksim 1690 – 1640 lemah-tajam C≡N Nitril 2260 – 2240 sedang X=C=Y Allena, keten, isosianat, 2270 – 1450 lemah-tajam isotiosianat
NO2 Nitro 1550 & 1350 tajam
S=O Sulfon, sulfonilklorida 1375 – 1300 tajam Sulfat, sulfonamida 1200 – 1140 tajam C-X Florida 1400 – 1000 tajam Klorida 800 – 600 tajam Bromida, iodida 667
2. Spektroskopi Resonansi Magnet Inti (RMI)
Spektroskopi resonansi magnet inti (RMI) didasarkan pada penyerapan
gelombang radio oleh inti-inti tertentu dalam molekul organik, apabila molekul ini
berada dalam medan magnet yang kuat.
Dalam suatu spektrum RMI, posisi serapan oleh sebuah proton
bergantung pada kuat netto medan magnet lokal yang mengitarinya. Medan lokal
ini merupakan hasil medan terapan H0 dan medan molekul terimbas yang
mengitari proton itu dan berlawanan dengan medan terapan. Jika medan imbasan
di sekitar proton itu relatif kuat maka medan itu melawan H0 dengan lebih kuat
dan diperluas medan terapan yang lebih besar untuk membawa proton itu agar
17
absorbsinya terletak di atas medan dalam spektrum. Atau sebaliknya jika medan
imbasan di sekitar proton itu relatif lemah, maka medan yang dipakai juga lemah
dan membawa proton ini ke dalam resonansi. Proton itu dikatakan tidak terperisai
(deshielded) dan absorbsinya muncul di atas medan.
Terperisai dan tak-terperisai merupakan istilah relatif. Untuk
memperoleh pengukuran yang kuantitatif diperlukan suatu titik rujukan
(referensi). Senyawa yang dipilih sebagai rujukan adalah tetremetilsilana (TMS),
yang proton-protonnya menyerap pada ujung kanan spektrum RMI.
Atom hidrogen dalam suatu senyawa organik selalu terikat dengan ikatan
sigma, baik pada atom karbon, oksigen, atau atom lain.Medan magnet luar akan
menyebabkan elektron-elektron sigma ini beredar, akibatnya adalah timbulnya
medan magnet molekular kecil yang melawan H0.
Karena medan imbasan melawan medan luar, maka proton yang terikat
secara sigma ini terperisai. Diperlukan kuat medan luar sedikit lebih besar untuk
mengalahkan efek medan imbasan, agar dapat membawa proton tersebut ke dlam
resonansi; oleh karena itu, proton itu menyerap di atas medan dibandingkan
dengan suatu proton hipotesis yang telanjang. Kuat medan imbasan bergantung
pada rapatan elektron di dekat atom hidrogen di dalam ikatan sigma. Makin besar
rapatan elektron, akan makin besar medan imbasan.
Medan magnet yang terimbas oleh elektron pi bersifat berarah
(directional, yakni tak simetris). Karena efek medan molekular yang diimbas oleh
lektron pi bergantung pada arah, maka efek ini disebut efek anisotropik. Efek
anisotropik terjadi sebagai tambahan pada medan-medan molekular yang selalu
ada, yang diimbas oleh elektron-elektron ikatan sigma. Adanya medan imbasan
dari elektron pi yang searah dengan medan magnet luar H0 akan membuat proton
menjadi lebih tak terperisai dan menyerap lebih jauh di bawah medan.
Proton yang berada dalam lingkungan magnetik dalam sebuah molekul,
mempunyai geseran kimia yang sama dalam spektrum RMI. Proton-proton
semacam itu disebut proton ekivalen secara magnetik. Proton yang berada dalam
lingkungan magnetik yang berbeda, akan mempunyai geseran kimia yang berbeda
dan dikatakan proton tak ekivalen.
Proton yang ekivalen secara magnetik secara spektroskopi RMI biasanya
sama seperti proton ekivalen secara kimia. Dalam kloroetana, ketiga proton metil
adalah ekivalen secara magnetik dan juga ekivalen secara kimia. Apabila
disubstitusi dengan atom lain, misalnya brom, akan didapatkan satu produk yaitu
1-bromo-2-kloroetana, tidak peduli proton mana yang disubstitusi (Fessenden dan
Fessenden, 1986).
Jika H sembarang digantikan oleh Br, hanya diperoleh satu senyawa bromo
Gambar 14. Proton-proton yang ekivalen secara magnetik dan kimia pada kloroetana
D. Landasan Teori
Nitrofurazon merupakan senyawa antibiotik turunan nitrofuran yang
memiliki spektrum luas terhadap bakteri Gram positif dan negatif. Nitrofurazon
19
semikarbazida HCl dalam suasana sedikit asam (pH 3-4) berdasarkan reaksi
pembentukan imin.
O
5-nitrof urf ural diasetat semikarbazida nitrof urazon
O
Gambar 15. Reaksi umum sintesis nitrofurazon
Reaksi pembentukan imin adalah reaksi antara suatu aldehid dengan
amina primer dalam suasana asam. Keasaman merupakan faktor yang penting
dalam proses reaksi ini. Apabila terlalu asam maka nukleofilisitas amina
berkurang sehingga lebih sulit untuk bisa menyerang atom C karbonil. Sedangkan
apabila terlalu basa maka elektrofilisitas atom C karbonil berkurang karena atom
O karbonil tidak terprotonasi.
Data hasil penelitian yang telah dilakukan sebelumnya menunjukkan
bahwa dengan katalis asam kuat, seperti asam sulfat (pKa ~-9), serta proses
pemanasan dengan suhu tinggi dalam waktu yang lama justru dapat
mendekomposisi produk yang terjadi sehingga dapat mengurangi rendemen. Oleh
karena itu pada penelitian ini digunakan katalis asam yang lebih lemah dibanding
asam sulfat yaitu asam p-toluensulfonat (pKa~ -0,6). Dengan demikian penelitian
ini bertujuan untuk membuktikan apakah sintesis nitrofurazon dari
5-nitro-2-furfural diasetat dengan katalis asam p-toluensulfonat dapat memberikan
rendemen yang lebih besar dibandingkan dengan dengan katalis asam sulfat.
E. Hipotesis
Nitrofurazon dapat disintesis dari 5-nitro-2-furfural diasetat dan
BAB III
METODOLOGI PENELITIAN
A. Jenis Penelitian
Penelitian ini termasuk penelitian deskriptif non-eksperimental karena
tidak dilakukan manipulasi terhadap subyek uji dan hanya dipaparkan fenomena
yang terjadi yang tidak terdapat hubungan sebab akibat.
B. Definisi Operasional Penelitian
1. Starting material: merupakan senyawa yang digunakan dalam sintesis yang
merupakan senyawa awal, dalam hal penelitian ini adalah senyawa
5-nitro-2-fufuraldiasetat dan semikarbazida HCl.
2. Katalis: merupakan senyawa yang digunakan untuk meningkatkan laju reaksi
kimia. Dalam penelitian ini digunakan asam p-toluensulfonat.
3. Molekul target: merupakan senyawa yang diharapkan terbentuk pada
penelitian yaitu nitrofurazon.
C. Alat dan Bahan Penelitian
1. Alat penelitian
Seperangkat alat gelas yang lazim untuk kegiatan sintesis, penangas es,
penangas mantel, drupple plate, pompa vakum, pengaduk magnetik, waterbath,
pendingin Alihn, neraca analitik, seperangkat alat untuk sistem KLT, seperangkat
instrumen untuk analisis dan identifikasi yaitu: spektrometer inframerah
21
(Shimadzu IR Prestige 21), spektrometer RMI (H1 NMR JOEL-MY60), dan alat
uji titik leleh (Electrothermal).
2. Bahan penelitian
Bahan yang digunakan dalam penelitian ini adalah furfural (Merck, GR
for synthesis), asam nitrat (Simac, extra pure), asam sulfat (Merck, p.a.), asam
asetat anhidrida (AnalaR, analytical grade), asam p-Toluensulfonat (Merck, for
synthesis), semikarbazida HCl (Merck, for synthesis), etanol (Brataco, teknis),
kalium hidroksida (Brataco, teknis), dimetil formamida (Merck, p.a.), aquades
(laboratorium Kimia Organik USD, teknis), dan kertas saring (laboratorium Kimia
Organik USD, teknis).
D. Tata Cara Penelitian
1. Sintesis 5-nitro-2-furfural diasetat
Campuran asam nitrat pekat (4,3 ml) dan asam sulfat pekat (0,3 ml)
ditambahkan bertetes-tetes pada 45 ml asam asetat anhidrida pada suhu -5oC
sampai 5oC. Ke dalam larutan ini ditambahkan furfural sebanyak 5,2 ml, dalam
kondisi yang sama. Campuran diaduk dalam pendingin es selama 1 jam.
Kemudian ditambahkan 40 ml air pada suhu 10o-15oC. Selanjutnya ditambahkan
larutan NaOH 25% hingga pH mencapai 3,5-4,5 pada suhu 15°-25°C. Campuran
kemudian dipanaskan pada suhu 50°-55°C selama 1 jam. Untuk isolasi produk,
campuran didinginkan pada suhu 10°-15°C sambil dilakukan pengadukan
konstan. Endapan yang terbentuk dicuci dengan air dingin dan direkristalisasi
23
2. Sintesis nitrofurazon
Sebanyak 3,91 mmol (0,95 g) 5-nitro-2-furfural diasetat dicampur
dengan etanol-air (7:9) ditambahkan asam p-toluensulfonat 25% sebanyak 2 tetes
hingga pH 3-4 kemudian dipanaskan pada 70°C selama 20 menit. Semikarbazida
HCl 8,52 mmol (0,62 g) dilarutkan dalam 3 ml aquades, kemudian ditambahkan
dan reaksi dilanjutkan selama 40 menit. Endapan hasil sintesis dicuci dengan
aquades, kemudian dicuci dengan alkohol panas. Suspensi disaring dengan corong
Buchner panas, kemudian endapan yang tersaring dikeringkan. Endapan tersebut
dicuci dengan eter hingga eter hasil cuciannya berwarna jernih dan selanjutnya
dikeringkan serta ditimbang.
3. Uji pendahuluan
a. Uji organoleptis. Hasil sintesis diamati bentuk, warna, dan bau.
b. Uji kelarutan. Dalam tabung reaksi, kurang lebih 10 mg serbuk hasil
sintesis ditetesi aquades hingga kurang lebih 1 ml, bila perlu dilakukan
pengojogan, jika belum larut ditambahkan aquades sampai kurang lebih 2 ml.
Setelah selesai dengan aquades lakukan prosedur yang sama untuk pelarut etanol,
eter dan larutan basa (piridin).
c. Uji titik lebur. Sedikit serbuk hasil sintesis diisikan kedalam tabung
kapiler kemudian dimasukan pada thermophan dengan suhu 220oC (dibawah titik
lebur teoritis nitrofurazon yaitu 236-240oC). Kristal diamati dan dicatat suhu pada
saat pertama hingga semua kristal melebur dengan kenaikan suhu 0,5oC tiap
menit.
d. Uji kualitatif nitrofurazon. Sejumlah kristal senyawa hasil sintesis
dilarutkan dalam campuran basa (KOH) 10 mg, alkohol 1 ml, dan
dimetilformamida hingga 10 ml. Warna ungu dari larutan menunjukkan adanya
nitrofurazon.
e. Uji Kromatografi Lapis Tipis. Uji kromatografi lapis tipis dilakukan
dengan sistem fase diam silika gel GF 254 dan dengan fase gerak kloroform,
metanol, ammonia (60:24:3). Senyawa hasil sintesis dan salah satu starting
material (5-nitrofurfural diasetat) sebagai pembanding dilarutkan dengan pelarut
dimetilformamida kemudian ditotolkan ± 10 μl. Plate silika dielusi dalam
chamber hingga 10 cm dari titik penotolan. Visualisasi bercak dengan sinar UV
254 dan UV 365 nm.
4. Elusidasi Struktur
Proses elusidasi struktur senyawa hasil sintesis dengan spektroskopi
inframerah dan resonansi magnet inti pada penelitian ini dilakukan oleh petugas
laboratorium kimia organik Fakultas MIPA, Universitas Gadjah Mada,
Yogyakarta. Prinsip kerjanya secara umum adalah sebagai berikut.
a. Spektroskopi inframerah . Sampel sebanyak kurang lebih 0,5-1,0
mg dicampur homogen dengan kurang lebih 100 mg KBr, lalu dikempa dan
dibuat tablet kemudian diukur dengan spektrometer inframerah.
b. Spektroskopi resonansi magnet inti (RMI). Sampel sebanyak
kurang lebih 10-50 mg dimasukkan ke dalam tabung dan ditambah pelarut
heksadeuterio-dimetilsulfoksida {(CD3)2SO} serta 0,5-1,0 tetes tetrametilsilana
25
diletakkan diantara kutub-kutub magnet. Sel sampel dipusingkan, kemudian
didapatkan sinyal resonansi dari spektrometer RMI.
E. Analisis Hasil
1. Data organoleptis
a. Pemeriksaan kemurnian senyawa hasil sintesis berdasarkan
1). Data uji titik lebur
2). Data uji kelarutan
3). Data uji KLT
b. Identifikasi struktur senyawa hasil sintesis berdasarkan
1). Spektrum Inframerah
2). Spektrum Resonansi Magnetik Inti
3). Spektrum Ultra Violet
2. Perhitungan rendemen
Rendemen =
berat senyawa hasil percobaan
berat senyawa secara teoritis x 100%
BAB IV
HASIL DAN PEMBAHASAN
A. Sintesis 5-Nitro-2-furfural diasetat
Senyawa 5-nitro-2-furfural diasetat dapat disintesis dengan mereaksikan
furfural dengan campuran asam nitrat nitrat dan asam sulfat dalam anhidrida
asetat berdasarkan reaksi nitrasi. Proses pencampuran dilakukan bertetes-tetes
dalam suhu rendah karena sifat dari asam sitrat dan asam sulfat yang eksotermis
sehingga panas pencampuran yang dihasilkan sangat tinggi. Adanya pendinginan
eksternal dapat mengurangi panas pencampuran yang terjadi.
Apabila asam-asam kuat seperti asam nitrat dan asam sulfat direaksikan
secara langsung dengan furfural dapat menyebabkan terbukanya cincin furan.
Penambahan asam asetat anhidrida dapat membentuk asetil nitrit dengan asam
nitrat sehingga membuat suasana reaksi menjadi lebih mild dan kemungkinan
terbukanya cincin furan semakin kecil.
O
asam asetat anhidrida asam nitrat asetil nitrit asam asetat
Gambar 16. Reaksi pembentukan asetil nitrit
Ion nitronium yang dihasilkan dari campuran asam nitrat dan asam sulfat
dalam asam asetat anhidrida akan diserang oleh elektron pi dari cincin furan.
Berdasarkan reaktivitas cincin furan, maka gugus nitro akan terikat pada atom C
27
gugus nitro terikat pada atom C posisi α lebih besar daripada jika gugus nitro
terikat pada atom C posisi β (gambar 18). Energi yang digunakan pada proses
reaksi akan semakin kecil. Suatu senyawa akan cenderung akan melalui reaksi
dimana tingkatan energi pada bentuk transisinya paling rendah, oleh sebab itu
maka gugus nitro akan terikat pada atom C posisi α bukan β.
Gambar 17. Proses delokalisasi elektron pada reaksi adisi ion nitronium pada cincin furan
Adanya air hasil sebagai produk dari reaksi pembentukan ion nitronium
dapat menyebabkan sebagian senyawa 5-nitrofurfuraldehid berubah menjadi
bentuk hidrat atau gem-diol. Senyawa ini dapat teresterifikasi karena adanya sisa
asam asetat anhidrida dan anion dari garam asetil nitrit, sisa asam (H2SO4), serta
dengan adanya pemanasan menjadi senyawa 5-nitro-2-furfural diasetat (gambar
18).
Keberadaan sisa asam setelah proses nitrasi harus dihilangkan, karena
dapat mengakibatkan terbukanya cincin furan. Untuk itu endapan yang terbentuk
dinetralkan dengan natrium bikarbonat. Setelah didapat filtrat yang netral, produk
direkristalisasi dengan etanol agar diperoleh senyawa yang murni.
O
5-nitrof urf ural (5-nitrof uran-2-il)metandiol 5-nitro-2-f urf ural diasetat 2AcO
Gambar 18. Pembentukan senyawa 5-nitro-2furfural diasetat
B. Sintesis Nitrofurazon dan Mekanisme Reaksi
Nitrofurazon disintesis berdasarkan reaksi pembentukan imin dari
aldehid dan amina primer. Senyawa 5-nitrofurfuraldehid berfungsi sebagai
sumber aldehid (elektrofil) dan senyawa semikarbazida sebagai sumber amina
primer (nukleofil). Pada penelitian ini, senyawa 5-nitrofurfuraldehid yang
digunakan berada dalam bentuk ester yaitu 5-nitro-2-furfural diasetat. Dalam air
dan suasana asam serta dengan adanya pemanasan, senyawa ini dapat terhidrolisis
menjadi bentuk geminal-diol atau hidrat.
O
Gambar 19. Hidrolisis senyawa 5-nitro-2-furfural diasetat menjadi bentuk hidrat
Bentuk hidrat ini cenderung tidak stabil, adanya cincin furan yang
merupakan gugus aromatis dapat membantu menstabilkan muatan positif pada
29
induksi positif, artinya memiliki kecenderungan seolah-olah mendonorkan
elektronnya ke atom C karbonil. Hal ini mengakibatkan kesetimbangan akan
bergeser ke bentuk aldehid atau cenderung akan membentuk 5-nitrofurfural
daripada bentuk hidrat. Untuk itu pada penelitian ini 5-nitrofurfural diasetat
dilarutkan terlebih dahulu dengan campuran pelarut (air dan alkohol) selama
kurang lebih 20 menit. Selain untuk memberikan waktu untuk proses pelarutan
5-nitrofurfural diasetat, juga untuk hidrolisis dan konversi dari bentuk hidrat
menjadi bentuk aldehid.
O
Gambar 20. Kesetimbangan reaksi antara bentuk hidrat dan bentuk aldehid
Katalis yang digunakan pada penelitian ini adalah asam p-toluensulfonat
yang bersifat asam. Katalis ini merupakan asam yang lebih lemah (pKa ~ -0,6)
dibandingkan HCl (pKa ~ -7) maupun H2SO4 (pKa ~ -9), namun memiliki
beberapa keuntungan. Pertama, asam p-toluensulfonat tidak bersifat eksotermis
sehingga memudahkan pengendalian suhu dalam proses pencampuran reaktan.
Kedua, akibat dari keasaamannya yang lebih lemah, maka kemungkinan terjadi
dekomposisi produk oleh asam p-toluensulfonat akan semakin kecil. Sehingga
memungkinkan untuk mendapatkan rendemen nitrofurazon yang lebih banyak.
Adanya katalis asam ini berfungsi untuk memprotonasi atom oksigen pada gugus
karbonil aldehid, sehingga elektrofilisitas atom C karbonil akan semakin
Gambar 21. Protonasi gugus karbonil aldehid sehingga elektrofilisitasnya meningkat
Penambahan katalis dilakukan dengan cara bertetes-tetes hingga pH
mencapai 3-4. Pada pH ini reaksi pembentukan imin akan berjalan optimal
(Fessenden dan Fessenden, 1986). Apabila terlalu asam (pH < 3) maka amina
primer pada semikarbazida dapat ikut terprotonasi, sehingga kehilangan sifat
nukleofilisitasnya.
Gambar 22. Protonasi amina primer pada semikarbazida
Pada pH yang tinggi (pH > 4) tahap protonasi dari aldehid akan berjalan
sangat lambat, sehingga laju reaksi menjadi sangat lambat. Pada pH 3-4 sebagian
amina akan terprotonkan, tetapi sebagian lain tidak sehingga dapat menjadi
nukleofil dan menyerang atom C karbonil yang telah terprotonasi, sehingga laju
reaksi keseluruhan menjadi optimal.
31
garamnya untuk meningkatkan kelarutannya dalam air. Senyawa yang terlarut
dalam air akan mempercepat laju reaksi karena akan memperbesar kemungkinan
tumbukan antarpartikel reaktan.
Semikarbazida merupakan suatu basa Lewis, dapat mendonorkan
elektronnya pada suatu elektrofil. Amina primer pada semikarbazida dapat
mendonorkan elektron bebasnya untuk membentuk ikatan dengan
5-nitrofurfuraldehid.
Gambar 23. Adisi semikarbazida pada 5-nitrofurfuraldehid
Karena mendonorkan sepasang elektron bebas untuk berikatan dengan gugus
aldehid pada 5-nitrofurfuraldehid maka atom N pada semikarbazida menjadi
bermuatan positif. Untuk itu atom tersebut akan melepaskan satu atom H untuk
menstabilkan diri sehingga membentuk senyawa karbinolamin yang bersifat
netral. Proses adisi nukleofilik ini berjalan relatif cepat
O
Gambar 24. Pelepasan proton untuk membentuk senyawa karbinolamin
Tahap reaksi berikutnya adalah eliminasi air yang berlangsung relatif
lebih lambat dari tahap adisi. Gugus alkohol pada senyawa karbinolamin
menangkap satu atom H sehingga menjadi gugus pergi yang lebih baik yaitu –
OH2+. Proses eliminasi air ini diikuti dengan lepasnya proton dari amina dan
membentuk senyawa imina.
O
Gambar 25. Proses dehidrasi dan pembentukan ikatan imina
C. Uji Pendahuluan
1. Uji organoleptis
Uji organoleptis dilakukan untuk mengetahui bentuk, warna, dan bau dari
senyawa hasil sintesis. Perbandingan organoleptis senyawa hasil sintesis dengan
organoleptis 5-nitro-2-furfural diasetat dipaparkan pada tabel berikut.
Tabel II. Perbandingan organoleptis senyawa hasil sintesis dengan 5-nitro-2-furfural diasetat
Organoleptis Senyawa hasil sintesis 5-Nitro-2-furfural diasetat Bentuk kristal kristal
Warna hijau pucat cokelat Bau tidak berbau tidak berbau
Data organoleptis di atas menunjukkan antara senyawa hasil sintesis
dengan 5-nitro-2-furfural diasetat, terdapat perbedaan warna antara kedua
33
struktur senyawa dari 5-nitro-2-furfural diasetat yang berwarna cokelat menjadi
senyawa yang berwarna kehijauan. Sehingga mengarahkan kesimpulan bahwa
senyawa hasil sintesis sudah merupakan senyawa yang berbeda dengan
5-nitro-2-furfural diasetat.
2. Uji kelarutan
Uji kelarutan dilakukan untuk mengetahui kelarutan senyawa hasil
sintesis dalam berbagai pelarut dibandingkan dengan senyawa 5-nitro-2-furfural
diasetat.
Tabel III. Perbandingan kelarutan senyawa hasil sintesis dengan kelarutan nitrofurazon
Pelarut Senyawa hasil sintesis 5-Nitro-2-furfural diasetat Air praktis tidak larut praktis tidak larut
Etanol sangat sukar larut larut Eter praktis tidak larut larut Piridin (basa) larut larut
Data kelarutan pada tabel III menunjukkan bahwa kelarutan senyawa hasil sintesis
berbeda dengan 5-nitro-2-furfural diasetat pada kelarutan dalam pelarut etanol dan
eter. Menurut literatur, agen-agen antibiotik golongan nitrofuran memang tidak
larut dalam air dan eter. Hal ini mengarahkan kesimpulan bahwa senyawa hasil
sintesis adalah senyawa nitrofurazon.
3. Uji titik lebur
Uji titik lebur dilakukan untuk mengetahui titik lebur senyawa hasil
sintesis. Sebagai hasil penelitian biasanya dilaporkan berupa jarak lebur (melting
range). Hasilnya dibandingkan dengan jarak lebur nitrofurazon yang terdapat
pada literatur (235°-240°C). Hasil pengukuran menunjukkan bahwa jarak lebur
senyawa hasil sintesis adalah 229°-230°C. Data jarak lebur ini menunjukkan
bahwa jarak lebur dari senyawa hasil sintesis berada di bawah jarak lebur
nitrofurazon. Hal ini diduga karena alat dan kondisi percobaan mungkin berbeda
dengan yang terdapat dalam literatur. Namun apabila dilihat dari selisih rentang
jarak leburnya, menurut Mackenzie (1967), senyawa hasil sintesis merupakan
senyawa yang murni. Hal ini ditunjukkan dari selisih 1°C dari rentang titik lebur
pengukuran.
4. Uji kualitatif nitrofurazon
Uji kualitatif nitrofurazon dilakukan menurut United States
Pharmacopeia, caranya dengan melarutkan sedikit kristal nitrofurazon dalam
campuran KOH dalam etanol dengan dimetilformamida. Hasil positif ditunjukkan
dengan warna ungu. Dalam penelitian ini terbentuk warna ungu yang berarti
terdapat nitrofurazon dalam senyawa hasil sintesis.
Adanya basa kuat (KOH) dapat mengabstraksi proton dari amina pada
gugus hidrazin sehingga menyebabkan adanya perpanjangan gugus kromofor.
Gugus auksokrom (–NH2) yang terikat pada kromofor juga dapat mengintensifkan
35
Gambar 26. Perpanjangan gugus kromofor pada nitrofurazon dengan adanya basa kuat
Keterangan :
: gugus kromof or : gugus auksokrom
5. Uji Kromatografi Lapis Tipis
Uji kromatografi lapis tipis (KLT) dilakukan untuk mengetahui
kemurnian dari senyawa hasil sintesis dan dibandingkan dengan 5-nitro-2-furfural
diasetat. Uji KLT menggunakan fase diam silika gel GF 254 dan fase gerak
kloroform, metanol, dan ammonia (60:24:3) dengan jarak rambat 10 cm dari
penotolan. Visualisasi bercak dilakukan di bawah sinar UV 254 nm dan 365 nm
(Anonim, 2005). Sebenarnya penggunaan silika gel G sebagai fase diam pun
sudah cukup dalam uji KLT ini, karena nitrofurazon sudah merupakan senyawa
yang berwarna, sehingga tanpa visualisasi dengan UV 254 dan 365 nm pun sudah
dapat terlihat. Namun prosedur ini ditempuh untuk memperjelas penampakan
bercak yang terjadi, baik bercak dari senyawa hasil sintesis maupun dari pengotor
apabila ada.
A
B
Gambar 27. Hasil pemeriksaan dengan KLT
Keterangan:
A = 5-nitro-2-furfural diasetat (pembanding) B = senyawa hasil sintesis
Fase diam = silika gel GF 254 Merck®
Fase gerak = kloroform : metanol : ammonia = 60 : 24: 3 (Anonim, 2005)
Senyawa nitrofurazon tidak berfluoresensi pada paparan sinar UV, hal ini
disebabkan karena strukturnya yang tidak rigid. Adanya cincin furan yang
aromatik menyebabkan sinar UV pada bercak akan diabsorbsi oleh senyawa hasil
sintesis sehingga sinar UV tersebut tidak dapat mencapai indikator fluoresensi dan
mengakibatkan bercak tidak berpendar. Hasil penelitian menunjukkan bahwa
terdapat bercak warna kuning yang tidak berfluorensensi pada paparan sinar UV
254 nm dan 365 nm dengan latar belakang fluoresensi hijau terang. Hasil KLT
mengarahkan suatu kesimpulan bahwa senyawa hasil sintesis sudah murni karena
37
diketahui bahwa senyawa hasil sintesis menunjukkan bercak warna kuning dengan
Rf 0,55 sedangkan senyawa 5-nitro-2-furfural diasetat sebagai pembanding tidak
menampakkan bercak. Hal ini membuktikan bahwa senyawa hasil sintesis sudah
merupakan senyawa yang berbeda dengan 5-nitro-2-furfural diasetat.
D. Elusidasi Struktur
Proses elusidasi struktur yang dilakukan meliputi spektroskopi
inframerah (IR) dan spektroskopi resonansi magnet inti (RMI). Spektroskopi IR
bertujuan untuk mengetahui gugus-gugus fungsional yang terdapat pada senyawa
hasil sintesis, sekaligus membandingkannya dengan gugus-gugus fungsional pada
starting material. Spektroskopi RMI bertujuan mengetahui profil proton dari
senyawa hasil sintesis.
1. Spektroskopi inframerah
Gugus-gugus fungsional pada senyawa hasil sintesis dapat dianalisis
dengan spektroskopi inframerah. Gambar 28 dan 30 menunjukkan hasil elusidasi
senyawa 5-nitro-2-furfural diasetat dan senyawa hasil sintesis dengan
spektroskopi inframerah. Tabel IV memaparkan perbandingan spektrum senyawa
5-nitro-2-furfural diasetat sebagai starting material dan senyawa hasil sintesis.
Dari spektrum inframerah senyawa 5-nitro-2-furfural diasetat didapatkan
6 profil pita representatif yang menunjukkan gugus-gugus fungsional pada
senyawa tersebut. Pita A yang melebar di sekitar 3400 cm-1 menunjukkan adanya
vibrasi dari gugus O-H, sedangkan pada senyawa 5-nitro-2-furfural diasetat tidak
terdapat gugus O-H. Kemungkinan munculnya pita vibrasi ini disebabkan oleh
adanya H2O yang terikat pada pelet KBr pada saat preparasi.
Cincin furan ditunjukkan dengan adanya serapan dari vibrasi ulur C-H
yang berada dalam gugus aromatis pada 3132 cm-1 (pita B). Kesimpulan tentang
adanya cincin furan diperkuat dengan adanya serapan yang tajam dan kuat pada
1226 cm-1 dari vibrasi ulur gugus eter (C-O-C) dalam cincin beranggota lima (pita
D). Pita C menunjukkan vibrasi ulur gugus karbonil pada ester dengan serapan
yang tajam dan kuat pada 1759 cm-1. Sedangkan pita vibrasi ulur gugus asetat
(C-C(=O)-O) tumpang tindih dengan pita vibrasi gugus eter (pita D). Pada gambar
tampak bahwa pita D (1226 cm-1) tersebut sedikit melebar ke arah bilangan
gelombang yang lebih kecil. Gugus nitro ditunjukkan oleh pita E1 dan E2. Gugus
nitro memang memberikan dua serapan karena memiliki dua tipe vibrasi ulur
39
A
B
C
D
Gambar 28. Spektrum inframerah senyawa 5-nitro-2-furfural diasetat
Keterangan :
A = pita vibrasi ulur gugus O-H sekitar 3448 cm-1
B = pita vibrasi ulur gugus C-H dalam cincin furan sekitar 3132 cm-1 C = pita vibrasi ulur gugus C=O ester sekitar sekitar 1759 cm-1
D = pita vibrasi ulur gugus CC(=O)O sekitar 1226cm-1 yang tumpang tindih dengan pita vibrasi ulur gugus eter (C-O-C) dalam cincin furan sekitar 1200 cm-1
E1 = pita vibrasi ulur asimetris gugus NO2 sekitar 1512 cm-1
E2 = pita vibrasi ulur simetris gugus NO2 sekitar 1334 cm-1
Dari data hasil analisis spektrum inframerah senyawa hasil sintesis,
didapatkan 6 profil pita representatif yang menginformasikan gugus-gugus
fungsional pada senyawa hasil sintesis. Pita A (ungu) sekitar 3433 cm-1
membuktikan adanya serapan dari gugus N-H pada amida primer. Pita vibrasi ini
tumpang tindih dengan vibrasi ulur interaksi hidrogen intramolekuler atom O dan
H dari nitrofurazon sehingga pita yang tampak menjadi melebar.
O HC N
N C
NH2
O O2N
H
Gambar 29. Interaksi hidrogen intramolekul antara atom O dan H pada nitrofurazon
Adanya pita B (hijau tua) pada 3271-3194 cm-1 semakin membuktikan
keberadaan gugus N-H dari amida, yaitu gugus N-H amida sekunder. Kesimpulan
tentang adanya gugus amida ini diperkuat dengan adanya vibrasi tekuk N-H amida
primer pada profil pita C (hijau muda) yang tumpang tindih dengan vibrasi ulur
gugus C=O dan amida sekunder pada pita D (biru) yang tumpang tindih dengan
vibrasi ulur -NO2. Vibrasi N-H kibasan ke luar bidang juga ditemukan pada
bilangan gelombang 732 cm-1 (pita G).
Pita C yang memiliki intensitas tajam pada 1689 cm-1 menunjukkan
vibrasi ulur C=O dari gugus amida. Adanya gugus –NO2 pada senyawa hasil
sintesis ditunjukkan dengan serapan pita E (oranye) pada bilangan gelombang
1543 cm-1 (asimetris) dan 1350 cm-1 (simetris). Adanya ikatan imina pada
senyawa hasil sintesis ditunjukkan pada pita F (merah) yang memberikan serapan
dengan intensitas cukup tajam pada 1473 cm-1. Pita G (merah muda)
menunjukkan vibrasi ulur gugus eter dalam suatu sistem siklik. Hal ini
41
B
C
D
E
F
G
H
Gambar 30. Spektrum inframerah senyawa hasil sintesis
Keterangan :
A = pita vibrasi ulur gugus N-H amida primer yang tumpang tindih dengan interaksi hidrogen gugus O-H sekitar 3433 cm-1
B = pita vibrasi ulur gugus N-H amida sekunder sekitar 3271-3194 cm-1 C = pita vibrasi ulur gugus C=O amida sekitar 1689 cm-1
D = pita vibrasi tekuk gugus N-H amida sekunder sekitar 1600-1620 cm-1 E = pita vibrasi ulur gugus NO2 sekitar 1543cm-1 dan 1350 cm-1
F = pita vibrasi ulur gugus C=N sekitar 1473 cm-1 G = pita vibrasi ulur gugus eter siklis sekitar 1149 cm-1
H = pita vibrasi kibasan ke luar bidang gugus N-H sekitar 732 cm-1
Hasil elusidasi struktur senyawa hasil sintesis dengan spektroskopi
inframerah menunjukkan bahwa gugus-gugus fungsi tertentu yang terdapat pada
senyawa hasil sintesis seperti amida dan imina tidak terdapat pada
5-nitro-2-furfural diasetat. Hal ini berarti senyawa hasil sintesis merupakan senyawa yang
berbeda dengan senyawa awal. Dari hasil elusidasi struktur tersebut juga
menunjukkan bahwa gugus-gugus fungsi yang terdapat pada nitrofurazon
ditemukan dalam senyawa hasil sintesis. Hal ini mengarahkan kesimpulan bahwa
senyawa hasil sintesis adalah nitrofurazon.
Tabel IV. Perbandingan interpretasi spektrum 5-nitro-2-furfural diasetat dan senyawa hasil sintesis
Gugus fungsi 5-Nitro-2-furfural diasetat Senyawa hasil sintesis
karbonil ada ada
cincin furan ada ada
nitro ada ada
amida tidak ada ada
imina tidak ada ada
2. Spektroskopi Resonansi Magnet Inti (RMI)
Keberadaan tipe-tipe proton yang berbeda dari senyawa hasil sintesis
dapat diidentifikasi dengan spektoskopi resonansi magnet inti. Nitrofurazon
memiliki 5 tipe proton dengan pencacahan tipe proton (gambar 32) sebagai
berikut: proton metinil pada ikatan imina (A) akan menunjukkan puncak singlet
pada spektrum dan akan memberikan serapan di bawah medan karena merupakan
proton yang terikat pada karbon yang berhibridisasi sp2.
O HC
Gambar 31. Pencacahan tipe proton nitrofurazon
Dua proton pada cincin furan (B dan C) merupakan dua proton yang
43
proton berbeda. Gugus NO2 pada posisi cis terhadap proton B bersifat menarik
elektron sehingga karena pengaruh induksi tersebut, kerapatan elektron pada
proton B lebih rendah daripada proton C. Hal ini mengakibatkan proton B lebih
tidak terperisai dan akan menyerap lebih di bawah medan dibanding proton C.
Proton B dan C akan memberikan puncak doublet karena terikat pada gugus
metinil yang saling berikatan secara langsung. Proton pada amina sekunder pada
gugus hidrazin (D) akan menunjukkan puncak singlet. Dua proton pada amida (E)
merupakan proton yang ekivalen, pada spektrum akan ditunjukkan dengan puncak
singlet. Proton E akan memberikan serapan di atas medan karena kedua proton
tersebut paling terperisai. Hasil elusidasi dengan spektroskopi RMI ditunjukkan
pada gambar 32 dan tabel V.
Hasil integrasi luas area di bawah kurva merepresentasikan perbandingan
jumlah proton yang dimiliki senyawa hasil sintesis. Sesuai dengan hasil elusidasi
senyawa hasil sintesis, perbandingan proton A:B:C:D:E senyawa hasil sintesis
adalah 1:1:1:1:2. Data ini sesuai dengan profil proton senyawa nitrofurazon.
Pada data spektrum RMI terdapat 6 sinyal puncak, 5 sinyal merupakan
proton senyawa hasil sintesis dan 1 sinyal yang terletak di paling atas medan
merupakan sinyal proton dari TMS (tetrametilsilana). Jumlah sinyal ini sesuai
dengan pencacahan proton pada nitrofurazon secara teoritis. Data tersebut dapat
diinterpretasikan sebagai berikut : sinyal puncak A mewakili proton A, yaitu
proton yang terikat pada C=N. Proton ini menyerap di paling bawah medan yaitu
pada δ sekitar 7,9 ppm, karena terikat pada karbon yang berhibridisasi sp2.
Adanya medan imbasan yang searah dengan medan magnet luar H0 dari elektron
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
pi pada ikatan C=N akan membuat proton yang terikat atom karbon menjadi tak
terperisai oleh efek anisotropik dan menyerap lebih jauh di bawah medan. Hasil
integrasi luas area di bawah kurva sinyal A menunjukkan bahwa jumlah
protonnya adalah 1.
Gambar 32. Spektrum RMI senyawa hasil sintesis (DMSO d6, 60 Hz)
Keterangan :
A = sinyal singlet pada δ sekitar 7,9 ppm menunjukkan 1 proton pada gugus C-H
B = sinyal doublet pada δ sekitar 7,8 ppmmenunjukkan 1 proton pada gugus C4-H furan
C = sinyal doublet pada δ sekitar 7,2 ppm menunjukkan 1 proton pada gugus C3-H furan
D = sinyal singlet pada δ sekitar 6,5 ppm menunjukkan 1 proton pada gugus N-H amida E = sinyal singlet pada δ sekitar 3,3 ppm menunjukkan 2 proton pada gugus NH2 amida
Sinyal doublet B (δ sekitar 7,8 ppm) dan C (δ sekitar 7,2 ppm)