i SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh : Gessy Purnamasari
NIM : 068114069
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
ii SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh : Gessy Purnamasari
NIM : 068114069
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
v
Kupersembahkan karyaku ini untuk
Tuhan Yesus Kristus dan Bunda Maria atas berkat, kasih dan
kekuatan
Bapak dan Ibu atas doa, kerja keras dan dukungan
Kakak - kakakku yang selalu mendukung
Semua sahabatku yang selalu ada dan setia
dan Almamaterku
~ Denis Waitley ~“Bila kita mengisi hati dengan
penyesalan untuk masa lalu dan
kekhawatiran untuk masa depan,
kita tidak memiliki hari ini untuk
kita syukuri”.
(Anonymous)
“ Supaya semua orang melihat,
mengetahui, memperhatikan dan
memahami bahwa tangan Tuhan
yang membuat segala sesuatunya
indah pada waktunya”.
vii
“Perbandingan Daya Antioksidan Infusa Teh Hijau (Camelia sinensisL.) dari Daerah
Wonosobo dan Daerah Karanganyar dengan menggunakan Metode Deoksiribosa”
guna memenuhi salah satu syarat untuk memperoleh gelar Sarjana Strata Satu
Program Studi Ilmu Farmasi (S.Farm.) pada Fakultas Farmasi Universitas Sanata
Dharma, Yogyakarta.
Dalam perkuliahan, penelitian dan penyusunan skripsi ini, penulis banyak
mendapatkan bantuan dari berbagai pihak yang berupa bimbingan, dukungan,
nasehat, informasi, kritik/ saran, material dan sarana. Oleh karena itu, penulis ingin
mengucapkan terima kasih kepada :
1. Rita Suhadi M.Si., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata
Dharma Yogyakarta.
2. Yohanes Dwiatmaka M.Si., selaku dosen pembimbing I yang telah memberikan
arahan, waktu, saran dan bimbingan kepada penulis.
3. Lucia Wiwid Wijayanti M.Si., selaku dosen pembimbing II yang telah
memberikan arahan, waktu, saran dan bimbingan kepada penulis.
4. Erna Tri Wulandari M.Si., Apt. selaku dosen penguji yang telah memberikan
viii diskusi kepada penulis.
7. Dr. Sri Noegrohati, Apt. atas waktu dan sarannya kepada penulis selama
penelitian di laboratorium.
8. Romo P. Sunu H. S.J. atas bimbingan, masukan selama penyusunan proposal dan
selama penulis menempuh perkuliahan di Fakultas Farmasi Universitas Sanata
Dharma Yogyakarta.
9. Bapak Moehni selaku Kepala Bagian Kebun PT. Tambi atas waktu, informasi, ijin
pada saat kunjungan dan pengambilan sampel.
10. Bapak Suwarso selaku personalia PT. RSK Karanganyar atas waktu, informasi,
ijin, saran, canda tawa pada saat pengambilan sampel.
11. Bapak Wayan, bapak Mikhael selaku mandor kebun atas diskusi, informasi dan
bantuan pemetikan sampel.
12. Segenap dosen atas ilmu yang telah diberikan dan bimbingan selama perkuliahan
di Fakultas Farmasi Universitas Sanata Dharma.
13. Mas Wagiran, Mas Sigit, Mas Bimo, Mas Parlan, Mas Kunto, Mas Kayat dan Mas
Ottok yang telah membantu penulis selama penelitian di laboratorium dan selama
perkuliahan di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
14. Bapak, Ibu, dan kakak yang selalu memberikan dukungan, motivasi, dan doa bagi
ix kesabaran yang diberikan selalu.
17. Bayu, Jimmy, Pungky, Eka, Pita, Joice, Melia, Inge, Dini, Ayu, Grace, Uut, Nika
sebagai teman – teman satu laboratorium. Terimakasih atas diskusi, bantuan,
canda-tawa selama penelitian di laboratorium.
18. Reni, Yanik, Yuli, Rocha, Sheila, Cibi, Olin, ci Lina dan ci Feli terimakasih atas
informasi, waktu, pendapat, dukungan yang sudah diberikan.
19. Teman-teman angkatan 2006, khususnya kelompok praktikum D atas perjuangan,
suka dan duka selama ini.
20. Teman – teman KKN kelompok 25 (Ayu, Eka, Yuli, Elfrid, Clare, Via dan Deva),
trimakasih atas doa, semangat, suka-duka dan pengalaman kebersamaan.
21. Serta semua pihak dan teman – teman atas dukungan, semangat yang tidak dapat
disebutkan satu per satu.
Penulis menyadari bahwa masih banyak kekurangan dan kelemahan dalam
penulisan skripsi ini sehingga segala kritik dan saran yang bersifat membangun
sangat penulis harapkan. Semoga skripsi ini memberikan manfaat bagi pembaca
khususnya dan ilmu pengetahuan pada umumnya.
Yogyakarta, Desember 2009
xi
tumbuh mempengaruhi kandungan kimia didalam teh disamping umur tanaman, jenis petikan, dan klon teh. Penelitian ini bertujuan untuk mengetahui dan membandingkan nilai aktivitas penangkapan radikal hidroksil oleh infusa teh hijau dari daerah Wonosobo dan Karanganyar berdasarkan perbedaan ketinggian tempat tumbuh dengan metode Deoksiribosa. Aktivitas penangkapan radikal hidroksil dinyatakan dalam % penangkapan ( %scavenging) daneffective scavenging 50( ES50).
Penelitian ini merupakan penelitian eksperimental karena subyek uji diberikan perlakuan. Metode penangkapan radikal hidroksil yang digunakan adalah metode deoksiribosa. Prinsip metode ini adalah deoksiribosa didegradasi oleh radikal hidroksil dari reagen Fenton mejadi malondialdehid (MDA). Apabila direaksikan dengan asam tiobarbiturat (TBA) dalam suasana asam dan dengan pemanasan menjadi kromogen berwarna merah muda (pink) yang diukur absorbansinya menggunakan spektrofotometer visibel pada panjang gelombang 532 nm. Nilai ES50
dihitung dari persamaan garis regresi linier antara konsentrasi infusa teh hijau terhadap %scavengingpada berbagai konsentrasi.
Hasil penelitian menunjukkan infusa teh hijau dari daerah Karanganyar memiliki nilai aktivitas antioksidan yang lebih besar (nilai ES50 rata – rata = 0,029
mg/ml) daripada infusa teh hijau daerah Wonosobo (nilai ES50 rata – rata = 0,032
mg/ml).
xii
composition for tea such as age of plant, types of picking, and clone of tea. This research is aimed to know and to compare the value of hydroxyl radical arrestment activity by infusa green tea based on the level of the growing place both in Wonosobo and Karanganyar by deoxyribose method. Hydroxyl radical scavenging activity expressed as percent scavenging and 50% hydroxyl radical effective scavenging (ES50).
This research is an experimental research because the subject has been given a treatment. Hydroxyl radical arrestment method that has been used is the Deoxyribose Method. Basicly, in this method, degraded deoxyribose by hydroxyl radical from reagent Fenton, and it is produced malondialdehid (MDA). If it is reacted with thiobarbituric acid (TBA) in a form of acid and heats it until the chromogen colored in pink then the absorbance is measured by visible spectrophotometer in 532 nm wave lengths. The ES50‘s value is accounted based on the similarity of the linear
regression between concentration of green tea infusa toward% scavengingin various concentration.
The result of this research shows that infusa green tea from Karanganyar has antioxidant activity (rate value ES50= 0,029 mg/ml) more greater than infusa green
tea from Wonosobo (rate value ES50= 0, 032 mg/ml).
xiii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ...iv
HALAMAN PERSEMBAHAN ...v
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS...vi
PRAKATA ...vii
PERNYATAAN KEASLIAN KARYA ...x
INTISARI ...xi
ABSTRACT ...xii
DAFTAR ISI ... xiii
DAFTAR TABEL ...xvi
DAFTAR GAMBAR ...xvii
DAFTAR LAMPIRAN ...xix
BAB I PENGANTAR ...1
1
A. Latar Belakang
Radikal bebas merupakan atom atau molekul yang mempunyai satu atau
lebih elektron bebas yang tidak berpasangan. Radikal bebas dapat berasal dari
dalam tubuh maupun dari lingkungan. Manusia setiap saat menghasilkan radikal
bebas pada proses metabolisme, fagositosis, di dalam organel seperti mitokondria,
sitosol, retikulum endoplasmik. Untuk mendapatkan satu atau lebih elektron bebas
yang tidak berpasangan guna menstabilkan dirinya, radikal bebas sangat reaktif
melakukan serangkaian reaksi oksidasi patogenik terhadap sel atau komponen sel
seperti nukleotida, membran sel, lemak dan protein, sehingga sel mengalami
disfungsi atau mutasi yang akhirnya berakibat pada timbulnya berbagai penyakit
degeneratif. Secara tidak langsung, senyawa radikal bebas tersebut akan
menyebabkan terjadinya suatu penyakit seperti penyakit liver, kanker, jantung
koroner, diabetes, katarak, dan berbagai proses penuaan dini (Hernani dan
Rahardjo, 2005). Antioksidan adalah senyawa yang dapat
menghentikan atau memutus reaksi berantai dari radikal bebas yang terdapat di
dalam tubuh, sehingga antioksidan dapat menyelamatkan sel – sel tubuh dari
kerusakan akibat radikal bebas (Hernani dan Rahardjo, 2005). Berdasarkan
sumber perolehannya, ada dua macam antioksidan yaitu antioksidan alami dan
BHA (butylated hydroxyanisole) dan BHT (butylated hydroxytoluene), namun telah
diketahui memiliki efek samping yang besar antara lain menyebabkan kerusakan hati.
Di sisi lain alam menyediakan sumber antioksidan alami yang efektif dan relatif aman
berupa senyawa turunal fenol seperti flavonoid, katekin, tokoferol, vitamin C, beta
karoten yang terdapat pada teh, buah – buahan, sayuran, anggur, bir dan kecap
(Kikuzaki and Nakatani, 1993). Hal tersebut yang mendorong penelitian ini sebagai
salah satu perwujudan eksplorasi bahan alam khususnya teh hijau sebagai sumber
antioksidan.
Teh (Camellia sinensis L. O. Kuntze) merupakan tanaman yang
dimanfaatkan sebagai salah satu minuman terpopuler di dunia (Chen, Liang, Lai, Tsa,
Tsay and Lin, 2003). Negara-negara yang tercatat sebagai produsen teh terbesar di
dunia di antaranya China, India, Srilanka, Jepang, Kenya, Bangladesh dan Indonesia
(Kumar, Nair, Reddy and Garg, 2005). Menurut Hartoyo (2003) aktivitas antioksidan
teh hijau disebabkan oleh senyawa polifenol, terutama golongan flavonoid tipe
flavanol (komponen katekin yang terdiri dari : epigalocatekin galat (EGCG),
epicatekin galat (ECG), epigalocatekin (EGC) atau epicatekin (EC)) dan tipe
flavonol (kuersetin, kemferol, dan mirisetin). Aktivitas sebagai antioksidan dimiliki
oleh sebagian besar flavonoid karena adanya gugus hidroksi fenolik dalam struktur
molekulnya (Cuvelier, Richard and Besset, 1992). Tipe flavonol di dalam teh hijau
terutama terdapat dalam bentuk glikosidanya dan sedikit dalam bentuk aglikonnya
karena sukar larut air (Hartoyo, 2003). Metode standar dalam penyiapan minuman teh
pada penelitian ini, cara penyarian dengan infudasi menggunakan air pada suhu 90oC
selama 15 menit karena flavonoid sifatnya polar sehingga larut air dan dapat
terekstrak optimal.
Berdasarkan proses pengolahannya, teh diklasifikasikan kedalam tiga jenis
yaitu teh fermentasi (teh hitam), teh semi fermentasi (teh oolong) dan teh tanpa
fermentasi (teh hijau). Sejumlah penelitian baik secara farmakologi maupun
epidemiologi menegaskan bahwa teh hijau merupakan sumber antioksidan yang
sangat potensial (Ikeda, Kobayashi, Hamada, Tsuda, Goto, Imaizumi, Nozowa,
Sugimoto and Kakuda, 2003). Faktor-faktor yang mempengaruhi tinggi rendahnya
aktivitas antioksidan teh sangat dipengaruhi oleh kandungan senyawa kimia dalam
teh tersebut (Chenet al., 2003). Umur tanaman, jenis petikan, ketinggian kebun dan
klon sangat mempengaruhi kandungan kimia dalam teh. Semakin tinggi daerah
perkebunan, maka kualitas dan mutu teh semakin baik (Rohdiana, 2005). Maka
berdasarkan hal tersebut, penelitian ini dilakukan perbandingan daya antioksidan teh
hijau daerah Wonosobo dengan teh hijau daerah Karanganyar dengan perbedaan
ketinggian tempat penanaman.
Mengacu pada penelitian Kuntari (2007), ekstrak etanol teh hijau diketahui
memiliki nilai aktivitas penangkapan radikal hidroksil dengan metode deoksiribosa
yang dinyatakan sebagai ES50sebesar 0,281 mg/ml. Sedangkan pada penelitian Dewi
(2007) fraksi air dan fraksi etil asetat teh hijau diketahui memiliki nilai aktivitas
penangkapan radikal hidroksil dengan metode deoksiribosa yang dinyatakan sebagai
secara in vitro dengan metode deoksiribosa. Dalam metode tersebut, deoksiribosa
diserang oleh radikal hidroksil menghasilkan produk degradasi yang apabila
direaksikan dengan asam tiobarbiturat dalam suasana asam dan dengan pemanasan
akan menjadi suatu kromogen berwarna merah muda (pink). Kromogen ini dapat
diukur absorbansinya menggunakan spektrofotometer visibel pada panjang
gelombang 532 nm (Halliwell, Gutteridge and Aruoma, 1987cit Purwantoko, 2006).
Adanya aktivitas penangkapan radikal hidroksil oleh ekstrak teh hijau diketahui
dengan % scavenging sedangkan nilai aktivitas penangkapan radikal hidroksil dapat
dinyatakan dalameffective scavenging 50 (ES50).
B. Perumusan Masalah
1. Berapa nilai aktivitas penangkapan radikal hidroksil oleh infusa teh hijau dari
daerah Karangayar dan teh hijau dari daerah Wonosobo dengan metode deoksiribosa
yang dinyatakan sebagai ES50?
2. Apakah perbedaan ketinggian tempat tumbuh teh dari daerah Wonosobo dengan
Karanganyar mempengaruhi nilai aktivitas penangkapan radikal hidroksil dengan
metode deoksiribosa yang dinyatakan sebagai ES50?
C. Keaslian Penelitian
Telah dilakukan beberapa penelitian tentang uji penangkapan radikal hidroksil oleh
fraksi etil asetat dan fraksi air ekstrak teh hitam dengan metode deoksiribosa
(Setyawati, 2006) ; uji antioksidan oleh fraksi etil asetat dan fraksi air ekstrak teh
hijau melalui penangkapan radikal hidroksil dengan metode deoksiribosa (Dewi,
2007) ; uji penangkapan radikal hidroksil oleh ekstrak etanol teh hijau dan teh hitam
dengan metode deoksiribosa (Kuntari, 2007); aktivitas antioksidan beberapa klon teh
unggulan (Rohdiana, 2009).
Uji antioksidan melalui penangkapan radikal hidroksil dengan metode
deoksiribosa yang dilakukan ini berbeda dengan penelitian sebelumnya.
Perbedaannya terletak pada sampel yang digunakan yaitu teh hijau yang berasal dari
dua daerah yang berbeda yaitu dari daerah Wonosobo dengan daerah Karanganyar
dan ketinggian kebun yang berbeda yang kemudian dibandingkan. Berdasarkan hal
tersebut sejauh pengamatan penulis, perbandingan daya antioksidan infusa teh hijau
daerah Wonosobo dan daerah Karanganyar secara in vitro dengan metode
deoksiribosa belum pernah dilakukan sebelumya.
D. Manfaat Penelitian
1. Manfaat teoritis
Hasil penelitian ini diharapkan dapat menambah informasi dalam bidang
ilmu kefarmasian tentang penggunaan metode deoksiribosa dalam menguji daya
2. Manfaat praktis
Memberikan informasi tambahan kepada masyarakat infudasi daun teh hijau
dari asal yang berbeda memiliki aktivitas antioksidan yang berbeda.
E. Tujuan Penelitian
1. Tujuan umum
Tujuan umum penelitian ini adalah mengetahui nilai aktivitas penangkapan
radikal hidroksil oleh infusa teh hijau dari daerah Karangayar dan teh hijau dari
daerah Wonosobo dengan metode deoksiribosa yang dinyatakan sebagai ES50.
2. Tujuan khusus
Mengetahui pengaruh ketinggian tempat penanaman teh dari daerah
Wonosobo dengan daerah Karanganyar terhadap nilai aktivitas penangkapan radikal
BAB II
PENELAAHAN PUSTAKA
A. Teh
Menurut Setyamidjaja (2000) keseragaman nama ilmiah untuk tanaman teh
yaitu Camellia sinensis L. yang diperkenalkan oleh O. Kuntze. Tanaman teh
termasuk suku (famili)Theaceae.
1. Klasifikasi teh dan proses pengolahannya
Komoditas teh dihasilkan dari pucuk daun tanaman teh melalui proses
pengolahan tertentu. Secara umum berdasarkan cara/proses pengolahannya, teh dapat
diklasifikasikan menjadi tiga jenis, yaitu teh hijau, teh oolong, dan teh hitam. Teh
hijau dibuat dengan cara menginaktivasi enzim oksidase/fenolase yang ada dalam
pucuk daun teh segar, dengan cara pemanasan atau penguapan menggunakan uap
panas, sehingga oksidasi enzimatik terhadap katekin dapat dicegah (tabel I). Teh
hitam dibuat dengan cara memanfaatkan terjadinya oksidasi enzimatis terhadap
kandungan katekin teh (tabel II). Sementara, teh oolong dihasilkan melalui proses
pemanasan yang dilakukan segera setelah proses rolling/penggulungan daun, dengan
tujuan untuk menghentikan proses fermentasi (Hartoyo, 2003).
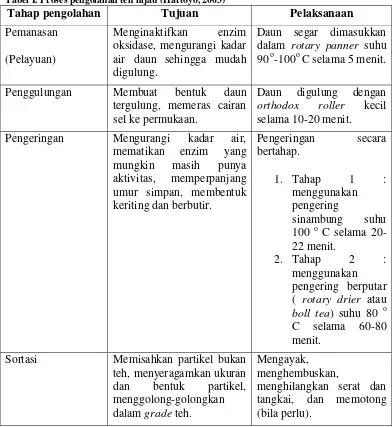
Tabel I. Proses pengolahan teh hijau (Hartoyo, 2003)
Tahap pengolahan Tujuan Pelaksanaan
Pemanasan
(Pelayuan)
Menginaktifkan enzim oksidase, mengurangi kadar air daun sehingga mudah digulung.
Daun segar dimasukkan dalam rotary panner suhu 90o-100oC selama 5 menit.
Penggulungan Membuat bentuk daun tergulung, memeras cairan sel ke permukaan.
Daun digulung dengan
orthodox roller kecil selama 10-20 menit.
Pengeringan Mengurangi kadar air, mematikan enzim yang ( rotary drier atau
boll tea) suhu 80 o C selama 60-80 menit.
Tabel II. Proses pengolahan teh hitam (Hartoyo, 2003)
Tahap pengolahan Tujuan Pelaksanaan
Pelayuan Mengurangi kadar air daun sehingga mudah digulung dan dihancurkan.
Daun segar dialiri udara hangat (≤ 30o C) dan kelembaban moderat (RH 60%) selama 10-16 jam.
Penggulungan Memperkecil ukuran partikel daun dan menciptakan kondisi fisik terbaik untuk mempertemukan polifenol dengan enzim polifenol oksidase.
Pucuk layu digulung bertahap dengan mesinorthodox roller
(Primary rolling selama 40 menit, rotavane rolling selam 2 menit, dan secondary rollingselama 15 menit).
Fermentasi Mempertemukan polifenol dengan enzim polifenol oksidase.
Meletakkan pucuk tergulung pada baki selama 30 menit dengan suhu ruangan 26-28o C dan kelembaban 85-95 %.
Pengeringan Menghentikan aktivitas enzim dan memperpanjang umur simpan.
Pengeringan secara
sinambung dengan suhu 90-100 o C (inlet) selama 25-30 menit.
Sortasi Memisahkan partikel bukan teh, menyeragamkan ukuran tangkai, dan memotong (bila perlu).
2. Khasiat teh
Teh mempunyai banyak manfaat pada kesehatan, diantaranya sebagai
antioksidan, menghambat oksidasi low density lipoprotein (LDL), mereduksi
kolesterol, antitrombosis, antimikroba, antivirus, memberikan perlindungan terhadap
3. Syarat tumbuh
Menurut Setyamidjaja (2000) tanaman teh berasal dari daerah subtropis yang
kemudian menyebar ke berbagai bagian dunia, baik daerah subtropis maupun tropis.
Dalam penanamannya di Indonesia yang beriklim tropis agar dapat tumbuh dan
berproduksi optimal, tanaman teh menghendaki persyaratan iklim dan tanah yang
sesuai umtuk keperluan pertumbuhannya. Daerah pertanaman teh yang lebih cocok di
Indonesia adalah daerah pegunungan. Secara umum, lingkungan fisik yang paling
berpengaruh terhadap pertumbuhan tanaman teh adalah keadaan iklim dan tanah.
a. Iklim
Adapun faktor iklim yang berpengaruh adalah curah hujan, suhu udara,
tinggi tempat, sinar matahari dan angin (Setyamidjaja, 2000).
1). Curah hujan
Tanaman teh menghendaki daerah pertanaman yang lembap dan sejuk.
Tanaman teh tidak tahan terhadap kekeringan, sehingga daerah pertanaman harus
memiliki curah hujan yang cukup tinggi dan merata sepanjang tahun. Curah hujan
yang diperlukan adalah 2.000 mm - 2.500 mm, dengan jumlah hujan pada musim
kemarau rata - rata tidak kurang dari 100 mm. Jika curah hujan kurang dari batas
minimum, akan mengakibatkan penurunan produksi, terutama di daerah pertanaman
2). Suhu udara
Suhu udara yang baik bagi tanaman teh adalah suhu berkisar antara 13o– 25o
C, yang diikuti oleh cahaya matahari yang cerah dengan kelembaban relatif pada
siang hari tidak kurang dari 70% (Setyamidjaja, 2000).
3). Tinggi tempat
Di Indonesia, pertanaman teh dilakukan pada ketinggian antara 400 m →
1.200 m dari permukan laut (dpl). Sehingga daerah pertanaman teh dapat dibagi
menjadi tiga daerah berdasarkan ketinggian tempat yaitu :
a. daerah dataran rendah : 400 – 800 m dpl, dengan suhu mencapai 23-24oC.
b. daerah dataran sedang : 800 - 1.200 m dpl, dengan suhu mencapai 21-22oC.
c. daerah dataran tinggi : diatas 1.200 m dpl, dengan suhu mencapai 18-19oC.
Perbedaan ketinggian tempat yang menyebabkan perbedaan suhu,
mempengaruhi sifat pertumbuhan perdu teh. Karena perbedaan sifat pertumbuhan
tersebut, maka terdapat perbedaan mutu dari teh. Apabila suhu tinggi, maka
pertumbuhan tanaman teh akan terhambat. Semakin tinggi daerah perkebunan maka
kualitas, mutu dan aroma teh semakin baik (Setyamidjaja, 2000). Mutu teh ini akan
berbanding lurus dengan kandungan kimia yang dapat larut dalam air. Semakin tinggi
mutu atau grade teh, maka kandungan kimia yang dapat larut dalam air adalah lebih
banyak (Rohdiana, 2005). Kadar katekin berpengaruh terhadap rasa dari teh. Semakin
4). Sinar matahari
Menurut Setyamidjaja (2000) sinar matahari sangat berpengaruh
terhadap pertumbuhan tanaman teh. Semakin banyak sinar matahari, pertumbuhan
tanaman teh semakin cepat. Sinar matahari mempengaruhi pula suhu udara, semakin
banyak sinar matahari, suhu udara semakin tinggi Kurangnya sinar matahari pada
bulan basah maka akan menghambat proses metabolisme sehingga mempengaruhi
mutu pucuk teh dan pertumbuhannya.
5). Angin
Pada umumnya, angin yang berasal dari dataran rendah membawa udara
yang panas dan kering. Angin yang bertiup kencang dapat menurunkan kelembaban
hingga 30%. Angin dapat pula mempengaruhi kelembapan udara serta penyebaran
hama dan penyakit (Setyamidjaja, 2000).
b. Tanah
Menurut Setyamidjaja (2000) tanah yang baik dan sesuai dengan kebutuhan
tanaman teh adalah tanah yang cukup subur dengan kandungan bahan organik cukup,
tidak bercadas serta mempunyai derajat keasaman (pH) antara 4,5 – 6,0. Di
Indonesia, tanah untuk tanaman teh dibedakan menjadi dua jenis utamaandosol(pada
ketinggian di atas 800 mdpl) dan tanahlatosol(ketinggian di bawah 800 mdpl).
4. Tempat tumbuh teh
Lokasi perkebunan pabrik teh PT. Rumpun Sari Kemuning (RSK), Desa
dan 7,40 – 7,54o LS dengan kemiringan wilayah 30o – 40o. Kelembaban udara di
wilayah PT. RSK antara 60 – 80 % dengan curah hujan rata – rata selama 10 tahun
terakhir adalah sebesar 3097 mm / tahun tanpa musim kemarau yang panjang,
intensitas penyinaran 40 % dan suhu rata – rata 21,5oC. Ketinggian lahan PT. RSK
800 – 1300 mdpl. Perkebunan PT. RSK memiliki jenis tanah latosol dengan pH tanah
4,6 – 5,5. Tanah yang memenuhi syarat untuk tanaman teh ialah tanah yang subur
banyak mengandung bahan organik, tidak bercadas serta memiliki keasaman (pH)
berkisar 4,5 – 5,6. Sehingga dilihat keadaan tanahnya PT. RSK cocok untuk ditanami
teh (Suwarso, wawancara pribadi, 1 Juli 2009).
PT. Tambi mengelola 3 unit perkebunan teh yang terletak di desa Bedakah,
Tanjungsari serta desa Tambi dengan luas area mencapai 829,14 Ha yang dilengkapi
fasilitas pondok wisata, Kolam Pemancingan, Lapangan Tenis, Taman Bermain,
Kebun dan Pabrik Teh. Perkebunan teh unit Tanjungsari, Kecamatan Kertek,
Kabupaten Wonosobo terletak 7,11o- 7,36o LS dan 109,43o-110,4o BT. Kelembaban
udara di wilayah unit Tanjungsari antara 20 – 22 % dengan curah hujan rata – rata
selama 10 tahun terakhir adalah sebesar 2500 - 2544 mm / tahun dan suhu rata – rata
15 - 24o C. Ketinggian lahan kebun teh 760 – 1020 mdpl. Perkebunan ini memiliki
jenis tanah latosol dengan pH tanah 4,6 – 5,5 (Moehni, wawancara pribadi, 25 Juni
2009).
Klon tanaman teh yang ditanam di kebun PT. RSK maupun PT. Tambi unit
Tanjungsari meliputi TRI (Tea Research Institute of Ceylon, Srilanka) 2024, TRI
TRI 2024 : Daun bulat lonjong, daun agak kecil dan lebih tipis, gerigi daun
meruncing dan panjang, serat daun lebih ringan daripada TRI 2025, biaya produksi
sedang sampai tinggi, mudah terserang penyakit cacar, dapat tumbuh hampir di
semua tempat dan mudah di stek.
TRI 2025 : Daun bulat memanjang, bergerigi tidak meruncing dan tidak
dalam, daun lebar dan lebih tebal, biaya produksi sedang sampai tinggi, lebih tahan
terhadap cacar, dapat tumbuh hampir di semua tempat dan mudah di stek.
Gambung : Lekukan daun lebih dalam, daun besar dan lebar, gerigi daun
lebih runcing (bergerigi besar), bulu – bulu daun lebih banyak, memiliki daya
adaptasi yang lebih baik.
CIN : Daun lebih kecil dan panjang, daya produksi rendah, tumbuh baik di
beberapa tempat, menghasilkan aroma teh yang baik dan mudah berakar.
5. Jenis Petikan
Menurut Pusat Penelitian Perkebunan Gambung (1992), jenis petikan dapat
dibedakan menjadi tiga kategori :
1. Petikan halus, apabila pucuk yang dihasilkan terdiri dari pucuk peko (p)
dengan satu daun, atau pucuk burung (b) dengan satu daun muda (m), biasa
ditulis dengan rumusp+1ataub+1m.
2. Petikan medium, apabila pucuk yang dihasilkan terdiri dari pucuk peko
dengan dua daun, tiga daun muda, serta pucuk burung dengan satu, dua atau
3. Petikan kasar, apabila pucuk yang dihasilkan terdiri dari pucuk peko dengan
empat daun atau lebih, dan pucuk burung dengan beberapa daun tua, ditulis
dengan rumusp+4 atau lebih, b+(1-4t)(Setyamidjaja, 2000).
B. Zat Bioaktif dalam teh
Zat bioaktif yang ada dalam teh, terutama merupakan golongan flavonoid.
Berdasarkan struktur dan konformasi cincin C molekul dasarnya, maka flavonoid
digolongkan menjadi enam kelas, yaitu flavon, flavanon, isoflavon, flavonol, flavanol
dan antosianin. Adapun flavonoid yang ditemukan pada teh terutama berupa flavanol
dan flavonol. Selain flavonoid, ada satu jenis zat bioaktif dalam daun teh yang
mungkin belum banyak dikenal meskipun sudah lama ditemukan, yaitu asam amino
bebas yang disebut L-theanin (Hartoyo, 2003).
1. Katekin teh
Katekin merupakan flavonoid yang termasuk kelas flavanol. Jumlah atau
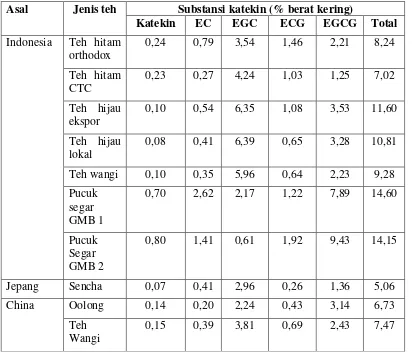
Tabel III. Kadar katekin berbagai jenis teh (Hartoyo, 2003)
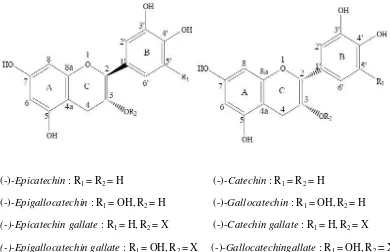
Katekin teh yang utama adalahepicatechin(EC),epicatechin gallate(ECG),
epigallocatechin (EGC) dan epigallocatechin gallate (EGCG) (gambar 1). Katekin
memiliki sifat tidak berwarna, larut air, serta membawa sifat pahit dan sepat pada
seduhan teh (Hartoyo, 2003).
Substansi katekin (% berat kering)
Asal Jenis teh
Katekin EC EGC ECG EGCG Total
Teh hitam orthodox
0,24 0,79 3,54 1,46 2,21 8,24
Teh hitam CTC
0,23 0,27 4,24 1,03 1,25 7,02
Teh hijau ekspor
0,10 0,54 6,35 1,08 3,53 11,60
Teh hijau lokal
0,08 0,41 6,39 0,65 3,28 10,81
Teh wangi 0,10 0,35 5,96 0,64 2,23 9,28
Pucuk segar GMB 1
0,70 2,62 2,17 1,22 7,89 14,60
Indonesia
Pucuk Segar GMB 2
0,80 1,41 0,61 1,92 9,43 14,15
Jepang Sencha 0,07 0,41 2,96 0,26 1,36 5,06
Oolong 0,14 0,20 2,24 0,43 3,14 6,73
China
Teh Wangi
(-)-Epicatechin: R1= R2= H (-)-Catechin: R1= R2= H
(-)-Epigallocatechin: R1= OH, R2= H (-)-Gallocatechin: R1= OH, R2= H (-)-Epicatechin gallate: R1= H, R2= X (-)-Catechin gallate: R1= H, R2= X (-)-Epigallocatechin gallate: R1= OH, R2= X (-)-Gallocatechingallate: R1= OH, R2= X
Gambar 1. Struktur kimia katekin dan epimernya (Hartoyo, 2003)
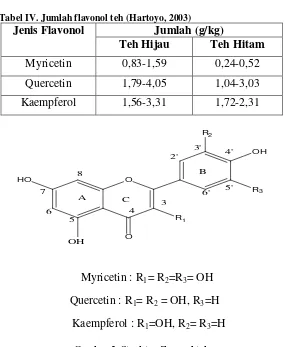
2. Flavonol teh
Flavonol utama yang ada di dalam daun teh adalah quercetin, kaempferol,
dan myricetin (gambar 2). Flavonol ini terutama terdapat dalam bentuk glikosida
(berikatan dengan molekul gula) dan sedikit dalam bentuk aglikonnya. Jumlah
flavonol teh bervariasi (tabel IV) tergantung pada beberapa hal, misalnya suhu dan
Tabel IV. Jumlah flavonol teh (Hartoyo, 2003) Jumlah (g/kg) Jenis Flavonol
Teh Hijau Teh Hitam
Myricetin 0,83-1,59 0,24-0,52
Gambar 2. Struktur flavonol teh
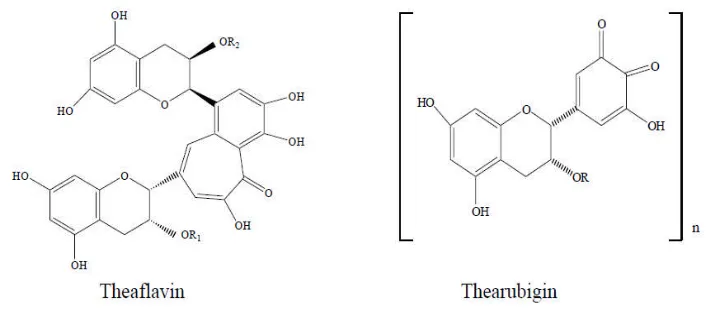
3. Theaflavin dan thearubigin
Dalam proses pembuatan teh hitam, katekin dioksidasi secara enzimatis
membentuk pigmen teh hitam yaitu theaflavin, theaflavin 3-gallate, theaflavin
3’-gallate dan theaflavin 2,3’-di3’-gallate. Jumlah theaflavin dan thearubigin dalam teh
Keduanya memberikan kontribusi terhadap sifat seduhan teh hitam seperti pada
warna dan ketajaman (Hartoyo, 2003).
Gambar 3. Strukur kimia theaflavin dan thearubigin teh hitam
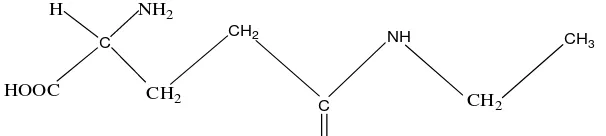
4. L-Theanin
Senyawa bioaktif dalam teh selain flavonoid yang memiliki manfaat bagi
tubuh, yaitu yang disebut L-theanin. L-theanin adalah sebuah asam amino yang unik
pada tanaman teh dan merupakan komponen utama yang bertanggung jawab terhadap
exotic taste. Senyawa ini unik karena hanya ditemukan pada teh dan jamur
Xeromonas badius. Jumlah L-theanin dalam daun teh berkisar 1% - 2% (berat
kering). L-theanin merupakan komponen asam amino utama dalam teh dengan
C
Gambar 4. Struktur kimia L-theanin
C. Penyarian
Penyarian adalah kegiatan penarikan zat yang dapat larut dari bahan yang
tidak dapat larut dengan pelarut cair. Secara umum, penyarian dapat dibedakan
menjadi infudasi, maserasi, perkolasi dan penyarian berkesinambungan. Sebagai
cairan penyari digunakan air, eter, atau campuran etanol air. Penyarian dengan
pencampuran etanol dan air dilakukan dengan cara maserasi atau perkolasi (Anonim,
1986).
1. Cara penyarian
a. Infudasi. Cara infudasi merupakan proses untuk menyari zat kandungan aktif yang larut dalam air dari bahan-bahan nabati. Penyarian ini menghasilkan sari
yang tidak stabil dan mudah tercemar oleh kapang dan kuman. Oleh karena itu sari
yang diperoleh tidak boleh disimpan terlalu lama (lebih dari 24 jam). Infudasi dibuat
dengan cara menyari simplisia dengan air pada suhu 90o C selama 15 menit.
(Anonim, 1986).
penyari akan menembus dinding sel dan masuk dalam rongga sel yang mengandung
zat aktif. Zat aktif akan terlarut dan dengan adanya perbedaan konsentrasi antara
larutan zat aktif di dalam dan diluar sel maka larutan yang terpekat akan didesak
keluar. Peristiwa tersebut berulang sehingga terjadi keseimbangan konsentrasi antara
larutan di luar sel dan di dalam sel. Cairan penyari yang digunakan dapat berupa air,
etanol, campuran air etanol (Anonim,1986).
Maserasi dapat dilakukan modifikasi misalnya dengan teknik remaserasi,
dimana cairan dibagi menjadi 2 kemudian seluruh serbuk dimaserasi dengan cairan
penyari pertama sesudah diendaptuangkan dan diperas maka ampas dimaserasi lagi
dengan cairan penyari kedua (Anonim,1986).
c. Perkolasi. Cara perkolasi merupakan proses penyarian dengan mengalirkan cairan penyari melalui serbuk simplisia yang sudah dibasahi. Prinsip
perkolasi dengan cara serbuk simplisia ditempatkan dalam bejana silinder yang
bagian bawahnya diberi sekat berpori. Cairan dialirkan dari atas ke bawah melalui
serbuk tersebut, cairan penyari akan melarutkan zat aktif sel-sel yang dilalui sampai
mencapai keadaan jenuh. Serbuk sebelum diperkolasi harus dimaserasi dulu untuk
mengembangkan sel sehingga aliran cairan penyari tidak akan mengalami hambatan
kemudian dimasukkan sedikit demi sedikit ke dalam alat perkolasi (perkolator)
sambil tiap kali ditekan. Serbuk kemudian ditutup dengan kertas saring dan cairan
penyari dialirkan hingga di atas permukaan massa masih terdapat lapisan cairan
penyari. Setelah 24 jam, keran dibuka dan diatur hingga kecepatan penetesan adalah 1
kualitatif pada perkolat terakhir (Anonim, 1986).
d. Penyarian berkesinambungan. Proses ini merupakan gabungan antara
proses untuk menghasilkan ekstrak cair dan proses penguapan. Alat yang digunakan
adalah Soxhlet. Pada penyarian ini, cairan penyari dipanaskan hingga mendidih
kemudian uap penyari akan naik ke atas dan mengembun karena didinginkan oleh
pendingin balik. Embun akan turun dan melarutkan zat aktif pada serbuk simplisia
(Anonim, 1986).
2. Cairan penyari
Untuk memilih cairan penyari perlu mempertimbangkan banyak faktor.
Cairan penyari yang baik harus memenuhi kriteria yaitu murah dan mudah didapat,
stabil secara fisika dan kimia, netral, tidak mudah menguap dan terbakar, selektif dan
tidak mempengaruhi zat berkhasiat (Anonim, 1986).
Farmakope Indonesia Edisi III menetapkan bahwa air, eter atau campuran air
etanol adalah cairan penyari. Etanol dapat melarutkan alkaloid basa, minyak
menguap, glikosida, kurkumin, kumarin, antrakinon, flavonoid, steroid, damar, dan
klorofil. Lemak, malam, tanin dan saponin hanya sedikit larut di dalam etanol.
Campuran etanol dan air dapat digunakan untuk meningkatkan penyarian (Anonim,
D. Radikal Hidroksil
Radikal bebas adalah suatu atom atau gugus atom apa saja yang memiliki
satu atau lebih elektron yang tidak berpasangan. Suatu radikal bebas tidak bermuatan
positif atau negatif yang sangat reaktif karena memiliki elektron yang tidak
berpasangan (Fessenden dan Fessenden, 1994). Pembentukan radikal bebas terjadi
melalui reaksi yang langsung memutuskan ikatan atau melalui proses transfer
elektron (Halliwell and Gutteridge, 1999). Suatu radikal bebas biasanya dijumpai
sebagai zat antara yang tidak dapat diisolasi, usia pendek, sangat reaktif dan berenergi
tinggi (Fessenden dan Fessenden, 1994). Radikal mampu menarik atom H dari suatu
molekul. Pengaruh radiasi ionisasi terhadap materi biologik akan menghasilkan
radikal bebas hidroksil dan radikal bebas lainnya, seperti radikal hidrogen dan
elektron yang siap berinteraksi dengan biomolekul-biomolekul lain yang saling
berikatan (Gitawati, 1995).
Radikal hidroksil adalah radikal yang sangat reaktif dan tidak stabil. Ia dapat
bereaksi dengan hampir semua substrat biologik. Karena sangat reaktif efek radikal
ini hanya berlangsung di daerah yang dekat dengan tempat terbentuknya dan dalam
kondisi fisiologik normal tidak ditemukan radikal hidroksi dalam kadar yang besar
(Gitawati, 1995).
Reaksi fisi homolitik ikatan O-O pada H2O2 menghasilkan dua molekul
radikal hidroksil (•OH), reaksi homolitik ini dapat terjadi karena pengaruh panas atau
adanya ion logam (Fe2+, Cu+) menurut reaksi Fenton, dan dengan adanya bahan
pengkelat (Gitawati, 1995).
Berbagai proses metabolisme normal dalam tubuh dapat menghasilkan
radikal bebas dalam jumlah kecil sebagai produk antara. Di dalam sel hidup, radikal
bebas terbentuk pada membran plasma pada organel-organel seperti mitokondria,
peroksisom, retikulum endoplasma, dan sitosol. Melalui reaksi-reaksi enzimatik
fisiologi yang berlangsung dalam proses metabolisme proses fagositosis oleh sel-sel
fagositik termasuk neutrofil, monosit, makrofag dan eusinofil juga menghasilkan
radikal bebas yaitu radikal hidroksil (•OH) (Hidayat, 2000).
D. Oksidan dan Radikal Bebas
Oksidan dalam ilmu kimia adalah senyawa penerima elektron (electron
acceptor) yakni senyawa – senyawa yang dapat menarik elektron (Syahbana dan
Bahalwan, 2002). Dampak aktivitas oksidan sangat luas dan sering mekanisme
molekulernya masih belum jelas. Radikal bebas merupakan suatu atom atau molekul
yang memiliki elektron tidak berpasangan dalam orbital terluarnya sehingga sangat
reaktif. Radikal ini cenderung mengadakan reaksi berantai yang bila terjadi dalam
tubuh dapat menimbulkan kerusakan – kerusakan yang serius.
Pengertian oksidan dan radikal bebas sering rancu karena keduanya memiliki
sifat yang mirip. Aktivitas kedua jenis senyawa ini sering menghasilkan akibat yang
sama walaupun melalui proses yang berbeda (Syahbana dan Bahalwan, 2002).
bahan bakar minyak, radiasi, merokok, memanggang makanan, dan dari proses
metabolisme tubuh normal. Radikal bersifat sangat reaktif karena memiliki elektron
tidak berpasangan. Reaktivitas radikal tergantung pada jenis radikal dan lingkungan
tempat radikal tersebut berada (Halliwell and Gutteridge, 1999).
Radikal bebas memiliki pengaruh di dalam tubuh kita, radikal hidroksil yang
dihasilkan dekat dengan DNA secara perlahan – lahan dapat memecah rantai DNA
dan berperan dalam proses karsinogenik, mutagenik dan sitotoksik. Terhadap protein,
radikal bebas dapt menyebabkan fragmentasi dan cross linking, sehingga
mempercepat terjadinya proteolisis. Terhadap lipid, radikal ini dapat menyebabkan
peroksidasi (Suyatna 1989; Gitawati, 1995).
E. Antioksidan
Antioksidan didefinisikan sebagai senyawa yang mampu menunda,
memperlambat atau menghambat dan mencegah kerusakan dikarenakan proses
oksidasi pada makanan dan obat (Pokorny, Yanishlieva and Gordon, 2001).
Tubuh sendiri memiliki sistem pertahanan internal terhadap radikal bebas
yakni antioksidan yang dikelompokkan menjadi tiga golongan sebagai berikut :
a. Antioksidan primer, yaitu antioksidan yang bekerja dengan cara
menghalangi pembentukan radikal bebas baru. Termasuk golongan ini adalah
superoksid dismutase (SOD) yang akan mengkatalis dismutase radikal anion
superoksida menjadi oksigen (O2) dan hidrogen peroksida (H2O2), katalase yang akan
dan flavonoid. (Wilmsen, Spada and Salvador, 2005).
b. Antioksidan sekunder atau penangkap radikal, yaitu antioksidan yang
dapat menangkap radikal sehingga dapat menekan terjadinya reaksi rantai, baik pada
awal pembentukan rantai maupun pada fase propagasi. Yang termasuk golongan ini
adalah vitamin E, beta karoten dan kurkuminoid (Niki, Nuguchi, Iwatsuki and Kato,
1995).
c. Antioksidan tersier, yaitu antioksidan yang memperbaiki kerusakan yang
telah terjadi. Termasuk golongan ini adalah enzim yang memperbaiki DNA dan
metionin sulfoksida reduktase (Nikiet al,. 1995).
Berdasarkan sumber, antioksidan dibagi dalam dua kelompok, yaitu
antioksidan alami (antioksidan dari hasil ekstraksi bahan alami) dan antioksidan
sintetik (antioksidan yang diperoleh dari hasil sintesis reaksi kimia). Antioksidan
alami berpotensi sebagai penangkap dan penyetabil radikal. Aktivitas antioksidan
alami bergantung pada struktur kimia senyawa penyusunnya dan kemampuan
senyawa tersebut untuk menangkap radikal kemudian menstabilkannya selama reaksi
berlangsung (Pokornyet al.,2001).
Antioksidan sintetis yang sering digunakan merupakan senyawa fenolik
yang disubstitusi gugus alkil untuk meningkatkan kelarutannya dalam lemak dan
minyak. Terdapat lima antioksidan sintetik yang diijinkan untuk makanan yang
penggunaannya meluas dan menyebar di seluruh dunia, yaitu butil hidroksi anisol
(BHA), butil hidroksi toluen (BHT), propil galat,ter- butyl hidroksi kuinon (TBHQ)
F. Pengukuran Aktivitas Antioksidan
Secara garis besar, pengukuran aktivitas antioksidan dapat dibedakan
menjadi 2, yaitu secara kualitatif dan secara kuantitatif. Uji kualitatif dilakukan untuk
mengetahui apakah suatu senyawa memiliki aktivitas antioksidan, tanpa mengetahui
berapa besar aktivitas antioksidannya. Uji ini dapat dilakukan dengan metode
kromatografi, baik kromatografi kertas maupun kromatografi lapis tipis. Metode ini
dapat memisahkan campuran antioksidan yang komplek sekalipun (Davidek, 1977).
Uji aktivitas antioksidan antara lain dapat dilakukan secara spektofotometri.
Beberapa uji kuantitatif untuk mengetahui aktivitas suatu senyawa sebagai
antioksidan adalah sebagai berikut :
1. Pengujian penangkapan radikal DPPH
Pengujian dengan cara ini dilakukan dengan mengukur penangkapan radikal
sintetik dalam pelarut organik polar seperti metanol atau etanol pada suhu kamar.
Radikal sintetik yang digunakan adalah DPPH (2,2-difenil-1-pikril hidrazil) dan
ABTS (2,2’-azinobis (3-etil benztiazolin-asam sulfonat)). Penangkapan radikal DPPH
oleh suatu senyawa diikuti dengan mengamati penurunan absorbansi pada 517 nm
dengan warna violet jelas. Penangkapan radikal bebas menyebabkan elektron menjadi
berpasangan yang kemudian menyebabkan penghilangan warna yang sebanding
dengan jumlah elektron yang diambil. Reaksi yang terjadi adalah sebagai berikut :
DPPH AH DPPH-H A
2. Pengujian aktivitas antioksidan dengan sistem linoleat-tiosianat
Asam linoleat merupakan asam lemak tidak jenuh dengan dua buah ikatan
rangkap yang mudah mengalami oksidasi membentuk peroksida yang selanjutnya
mengoksidasi ion ferro menjadi ion ferri. Ion ferri bereaksi dengan amonium tiosianat
membentuk kompleks feri-tiosianat (Fe (CNS)3) yang berwarna merah. Intensitas
warna merah ini diukur absorbansinya pada panjang gelombang 490 nm. Semakin
intens warna merahnya menunjukkan bahwa semakin banyak peroksida yang
terbentuk.
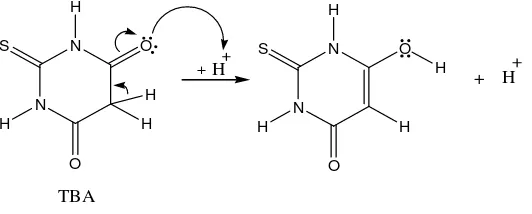
3. Pengujian dengan asam tiobarbiturat atau TBA (Thiobarbituric Acid).
Pengujian ini berdasarkan adanya malonaldehid yang terbentuk dari asam
lemak bebas tidak jenuh dengan paling sedikit memiliki 3 ikatan rangkap dua.
Malondialdehid selanjutnya bereaksi dengan asam tiobarbiturat membentuk produk
kromogen yang berwarna merah muda yang diukur absorbansinya pada panjang
gelombang 532 nm. Adanya senyawa yang bersifat antioksidan akan menghambat
terbentuknya malonaldehid dari asam lemak bebas tidak jenuh.
4. Pengujian dengan sistemβ-karoten-linoleat.
Pengujian ini dilakukan dengan mengamati kecepatan terjadinya pemucatan
warnaβ-karoten.
Selain keempat metode diatas, antioksidan dapat ditentukan dengan bilangan
peroksida, bilangan para - anisidin, dan dengan bilangan oktanoat (Pokorny et al.,
G. Metode Deoksiribosa
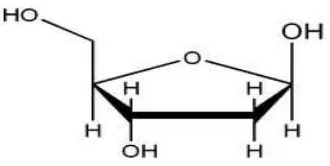
Deoksiribosa (2-deoksi-D-ribosa) (gambar 5) merupakan gula dengan lima
atom karbon yang merupakan turunan suatu gula pentosa yaitu ribosa. Gula ini biasa
ditemukan dalam DNA (Deoxyribonucleic Acid).
Gambar 5. Struktur deoksiribosa
Pada metode deoksiribosa, reaksi antara deoksiribosa dengan radikal
hidroksi akan mendegradasi deoksiribosa. Produk degradasinya, dengan pemanasan
dan di bawah kondisi asam akan menghasilkan senyawa malondialdehid (MDA)
melalui kemampuannya bereaksi dengan asam barbiturat untuk membentuk senyawa
kompleks merah muda (Halliwell et al., 1987). Jumlah senyawa kompleks merah
muda yang terbentuk proporsional dengan jumlah radikal hidroksi yang dibentuk dari
reaksi Fenton (Kunchandy and Rao, 1989). Kecepatan reaksi TBA dengan MDA
tergantung pada konsentrasi dari larutan TBA, temperatur dan pH dari campuran
reaksi (Sardjiman, 2000).
Radikal hidroksil secara in vitro dapat dihasilkan dari reaksi Fenton. Reaksi
ferro (Fe2+) akan bereaksi dengan hidrogen peroksida (H2O2) menghasilkan radikal
hidroksil. Namun reaksi antara Fe2+ dengan H2O2 memiliki kecepatan yang rendah
yaitu kurang dari 100 M-1s-1. Oleh karena itu, untuk meningkatkan kecepatan
reaksinya perlu ditambah dengan suatu ligan. Ethylenediamine tetraacetic (EDTA)
merupakan ligan yang baik dalam reagen Fenton (Halliwell and Gutteridge, 1999).
Oleh karena itu, untuk meningkatkan kecepatan reaksinya perlu ditambah dengan
suatu ligan. Ethylenediamine tetraacetic (EDTA) merupakan ligan yang baik dalam
reagen Fenton (Halliwell and Gutteridge, 1999). Ion Fe2+dapat membentuk ion Fe3+
melalui reaksi oksidasi dengan adanya reduktor (pereduksi) maka ion ferro (Fe2+)
dapat ditimbulkan lagi, sehingga dihasilkan radikal hidroksil yag lebih banyak. Bahan
– bahan seperti vitamin C dapat mereduksi ion ferri (Fe3+), begitu pula kurkumin
pada konsentrasi rendah (dibawah 0,61 μM) (Kunchandy and Rao, 1989). Secara in
vitro, reaksi pembentukan radikal hidroksil adalah sebagai berikut :
Fe3+- EDTA+ Vitamin C→ Fe2+- EDTA + Vitamin C teroksidasi
Fe2+- EDTA + H2O2→ Fe3+- EDTA +•OH +-OH (Halliwellet al., 1987).
I. Spektrofotometri Ultraviolet dan Sinar Tampak
Spektrofotometri UV-Vis merupakan anggota teknik analisis spektroskopik
yang memakai sumber radiasi elektromagnetik ultra violet dekat (190-380 nm) dan
sinar tampak (380-780 nm) dengan menggunakan instrumen spektrofotometri (Mulja
Interaksi antara senyawa yang memiliki gugus kromofor dengan radiasi
elektromagnetik pada daerah UV dan visibel akan menghasilkan transisi
elektromagnetik dan spektra serapan elektromagnetik. Tiga hal yang mungkin terjadi
sebagai akibat interaksi molekul dengan radiasi elektromagnetik adalah hamburan,
absorpsi dan emisi (Mulja dan Suharman, 1995).
Serapan di daerah UV-Vis oleh suatu molekul tergantung pada struktur
elektronik molekul yang bersangkutan. Penyerapan sejumlah energi menghasilkan
pencepatan elektron dari orbital tingkat dasar ke orbital yang lebih tinggi dalam
keadaan tereksitasi. Energi yang diserap tergantung pada perbedaan energi antara
tingkat dasar dan tingkat tereksitasi. Kelebihan energi dalam tingkat tereksitasi dapat
menghasilkan ionisasi molekul atau dipancarkan sebagai panas atau cahaya
(Silverstein, Bassler and Morrill, 1991).
Absorpsi cahaya UV-Vis mengakibatkan transisi elektronik, yaitu promosi
elektron – elektron dari orbital keadaan dasar yang berenergi rendah ke orbital
keadaan tereksitasi yang berenergi lebih tinggi. Transisi ini memerlukan 40 – 300
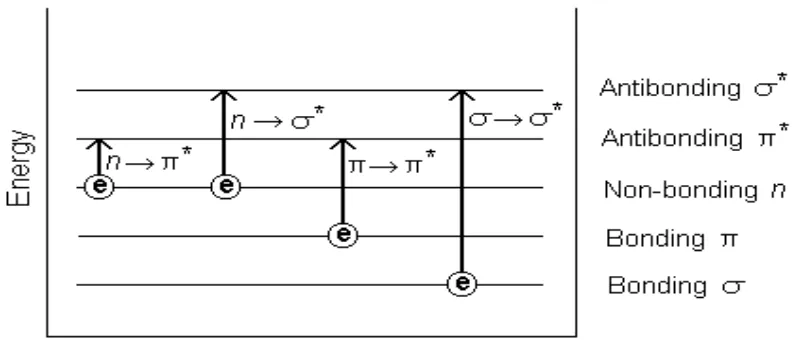
kkal/mol (Fessenden dan Fessenden, 1994). Jenis – jenis transisi ini antara lain :
1. Transisi σ → σ*
Transisi ini terjadi pada orbital ikatan σ dari suatu molekul tereksitasi ke
orbital anti ikatan yang sesuai melalui radiasi serapan. Energi yang dibutuhkan untuk
frekuensi pada daerah UV vakum (< 180 nm) yang diberikan oleh ikatan tunggal.
Sebagai contoh pada alkana, metana (Gandjar, 1991; Mulja dan Suharman, 1995).
2. Transisin→ σ*
Terjadi pada senyawa organik jenuh yang mengandung atom – atom dengan
elektron bukan ikatan (elektron n). Transisi ini sering terjadi saat molekul organik
mengandung heteroatom (N, O, S, F, Cl, Br, atau I). Secara umum, transisi ini
membutuhkan energi yang lebih sedikit daripada transisi σ → σ* dan dapat dihasilkan
melalui radiasi pada daerah antara 150 dan 250 nm dengan sebagian besar puncak
serapan di bawah 200 nm (Gandjar, 1991).
3. Transisi π → π* dan transisi n→ π*
Transisi ini terjadi pada molekul yang mempunyai gugus fungsional yang
tidah jenuh, sehingga ikatan rangkap dalam gugus tersebut memberikan orbital ikatan
yang diperlukan. Transisi ini sesuai untuk analisis karena memiliki serapan pada
daerah 200-700 nm dan dapat diaplikasikan untuk analisis kuantitatif (Gandjar,
1991). Transisi n→ π* menunjukkan pergeseran hipsokromik (biru) dalam
pelarut-pelarut yang lebih polar dan dengan substituen-substituen yang bersifat pemberi
Gambar 6 . Diagram tingkat energi elektronik (Mulja dan Suharman, 1995)
Molekul yang mengalami transisi π → π* adalah molekul yang memiliki
ikatan rangkap dua atau tiga, atau cincin aromatik. Molekul yang mengalami transisi
n→ π* adalah molekul yang mengandung C=O, N=N, NO dan NO2. Sebuah elektron
yang berada dalam orbital tidak berikatan yang diasosiasikan dengan heteroatom akan
tereksitasi pada orbital π anti-ikatan, yang diasosiasikan dengan ikatan rangkap dua
maupun rangkap tiga dari suatu molekul (Gandjar, 1991).
Serapan maksimum suatu senyawa kimia dipengaruhi oleh adanya kromofor
dan gugus auksokrom. Kromofor adalah semua gugus atau gugusan atom yang
mengabsorpsi radiasi UV – Vis. Kromofor biasanya berupa ikatan rangkap konjugasi,
kromofor paling sederhana adalah benzena (Mulja dan Suharman, 1995).
Sedangkan auksokrom adalah suatu gugus fungsional yang memiliki
elektron bebas seperti -OH, -NH2 dan OCH3 yang memberikan transisi n → σ*
akan meningkatkan absorbansinya dan menggeser puncak serapan ke panjang
gelombang yang lebih panjang. Peningkatan intensitas absorbsi dinamakan efek
hiperkromik, sedangkan penurunan intensitas absorbsi dinamakan efek hipokromik.
Pergeseran panjang gelombang dapat diklasifikasikan menjadi dua yaitu :
1. Pergeseran batokromik
Pergeseran batokromik adalah pergeseran serapan kearah panjang
gelombang yang lebih panjang disebabkan substitusi atau pengaruh pelarut
(pergeseran merah).
2. Pergeseran hipsokromik
Pergeseran hipsokromik adalah pergeseran serapan kearah panjang
gelombang yang lebih pendek disebabkan substitusi atau pengaruh pelarut
(pergeseran biru) (Sastrohamidjojo, 1991).
Panjang gelombang sinar UV-Vis yang diserap bergantung pada mudahnya
promosi elektron. Molekul yang memerlukan energi yang lebih banyak untuk
promosi elektron maka akan menyerap pada panjang gelombang yang lebih pendek
begitu juga sebaliknya. Senyawa yang akan menyerap cahaya dalam daerah visibel
(senyawa berwarna) memiliki elektron yang lebih mudah dipromosikan daripada
senyawa yang menyerap pada panjang gelombang UV yang lebih pendek. Kuantitas
energi yang diserap oleh suatu molekul berbanding terbalik dengan panjang
gelombang radiasi (Fessenden dan Fessenden, 1994). Hal ini dapat dirumuskan
AE = hv =
Dengan AE = energi cahaya yang diserap, dalam erg.
h = tetapan Planck (6,63 x 10-34)
v = frekuensi, dalam Hertz
c = cepat rambat cahaya, 3 x 108 m/s
= panjang gelombang, cm (Fessenden dan Fessenden, 1994).
Instrumentasi spektrofotometer meliputi sumber radiasi kontinyu pada
panjang gelombang tertentu, 2) monokromator untuk memilih berkas sempit dari
sumber spektrum, 3) sel sampel, 4) detektor, 5) pembaca respon detektor atau
rekorder. Sumber untuk daerah visibel adalah tungsten filament incandescent lamp,
sedangkan untuk sel sampelnya terbuat dari gelas atau kuarsa (Christian, 2004).
J. Landasan Teori
Radikal bebas adalah suatu atom yang memiliki satu atau lebih elektron yang
tidak berpasangan sehingga sifatnya reaktif dan tidak stabil. Reaksi radikal hidroksil
dengan DNA akan mengakibatkan kerusakan penting dalam sel. Antioksidan
merupakan senyawa yang mampu menunda, memperlambat atau menghambat dan
mencegah kerusakan di karenakan proses oksidasi. Berdasarkan sumbernya,
antioksidan dibagi dalam dua kelompok yaitu antioksidan alami (antioksidan dari
hasil ekstraksi bahan alami) dan antioksidan sintetik (antioksidan yang diperoleh dari
polifenol, didalam teh terdapat katekin yang merupakan flavonoid golongan flavanol.
Katekin teh merupakan kelas flavanol. Adapun katekin yang utama adalah
epicatechin (EC), epicatechin gallate (ECG), epigallocatechin (EGC), dan
epigallocatechin gallate (EGCG). Perbedaan ketinggian kebun teh menyebabkan
perbedaan suhu, sehingga mempengaruhi sifat pertumbuhan perdu teh. Karena
perbedaan sifat pertumbuhan tersebut, maka terdapat perbedaan mutu dari teh. Mutu
teh ini akan berbanding lurus dengan kandungan kimia yang dapat larut dalam air.
Semakin tinggi mutu atau grade teh, maka kandungan kimia yang dapat larut dalam
air adalah lebih banyak. Apabila suhu tinggi, maka pertumbuhan tanaman teh akan
terhambat. Semakin tinggi daerah perkebunan maka kualitas, mutu dan aroma teh
semakin baik. Kadar katekin berpengaruh terhadap rasa dari teh. Semakin tinggi
daerah perkebunan, maka semakin tinggi pula rasa sepat pada teh. Senyawa flavonoid
memiliki banyak gugus hidroksi sehingga cenderung bersifat polar dan dapat larut
dalam cairan penyari yaitu air. Oleh karena itu, dapat diindikasikan bahwa di dalam
infusa teh hijau tersebut terdapat senyawa flavonoid.
Metode yang digunakan untuk mengetahui aktivitas penangkapan radikal
hidroksil oleh infusa teh hijau adalah metode deoksiribosa. Metode ini menggunakan
spektrofotometri visible untuk mengukur produk degradasi deoksiribosa (MDA) oleh
radikal hidroksil yang dihasilkan dari reagen Fenton. MDA akan bereaksi dalam
suasana asam dengan TBA membentuk kromogen MDA-TBA (berwarna merah
muda) pada serapan maksimum 532 nm. Adanya senyawa polifenol (penangkap
ditunjukkan penurunan absorbansi larutan sampel dibandingkan larutan kontrol.
Adanya aktivitas penangkapan radikal hidroksil oleh ekstrak teh hijau diketahui
dengan % scavenging yang diperoleh dari selisih absorbansi larutan kontrol (tanpa
sampel) dan larutan dengan sampel dibagi larutan kontrol dikalikan 100 %. Nilai
aktivitas penangkapan radikal hidroksil dapat dinyatakan dalam aktivitas
penangkapan efektif 50 % radikal hidroksil ataueffective scavenging 50(ES50).
K. Hipotesis
Berdasarkan landasan teori, dapat dihipotesiskan bahwa infusa teh hijau
daerah Karanganyar (ketinggian tempat penanaman 1200 mdpl) memiliki nilai ES50
lebih kecil dibandingkan daerah Wonosobo (ketinggian tempat penanaman 760
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental murni dengan
rancangan acak pola searah karena subjek uji diberi perlakuan yaitu perlakuan
berbagai konsentrasi infusa teh hijau dari daerah Wonosobo dengan daerah
Karanganyar yang diuji dengan metode deoksiribosa.
B. Variabel – variabel Penelitian 1. Variabel bebas
Dalam penelitian ini variabel bebasnya adalah konsentrasi infusa teh hijau,
klon teh.
2. Variabel tergantung
Dalam penelitian ini variabel tergantungnya adalah% scavenging.
3. Variabel pengacau
(a) Variabel pengacau terkendali
Variabel pengacau terkendali dalam penelitian ini adalah proses infudasi,
bahan kimia dan alat-alat yang digunakan selama penelitian, suhu dan waktu inkubasi
larutan uji aktivitas penangkapan radikal hidroksil.
(b) Variabel pengacau tidak terkendali
Kondisi tempat penanaman teh (iklim, suhu, angin, curah hujan, sinar
matahari, kelembaban).
C. Definisi Operasional
1. Persen scavenging adalah persen yang menyatakan kemampuan senyawa
antioksidan (infusa teh hijau) dalam menangkap radikal hidroksil.
2. Larutan kontrol merupakan larutan yang terdiri dari reagen Fenton, larutan
deoksiribosa, buffer fosfat, asam trikloroasetat, dan asam tiobarbiturat.
3. Larutan sampel merupakan larutan kontrol yang telah ditambahi infusa teh hijau.
4. Effective scavenging 50 (ES50)menyatakan besarnya konsentrasi infusa teh hijau
menghasilkan penangkapan efektif radikal hidroksil sebesar 50%.
D. Bahan-Bahan Penelitian
Bahan utama yang digunakan dalam penelitian adalah daun teh hijau dari
daerah Wonosobo daerah Karanganyar klon Gambung 7. Bahan kimia (Merck):
hidrogen peroksida (larutan 35% H2O2), feri klorida heksahidrat (FeCl3. 6H2O),
etilendiamintetraasetat garam dinatrium dihidrat (C10H14N2Na2O8. 2H2O), L (+) asam
askorbat (Vitamin C), asam 2-tiobarbiturat (TBA), asam trikloroasetat (TCA),
dinatrium hidrogen fosfat (Na2HPO4), kalium dihidrogen fosfat (KH2PO4). Bahan
kimia kualitas p.a. (Sigma, USA) : 2-deoksi-D-ribosa. Bahan lain: kain flanel,
aquades (Laboratorium Kimia Organik Fakultas Farmasi Universitas Sanata Dharma
Yogyakarta).
E. Alat-Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah Spektrofotometer
UV-Vis (Perkin Elmer Lambda 20), pH meter (Metrohm 632), timbangan BP 160 P
mikropipet 0,5-10 µl, 40 µl, 50-200 µl, 200-1000 µl (Acura 825, Socorex), tabung
reaksi bertutup (Pyrex-Germany), waterbath (Labo-Tech; Heraeus), kompor listrik,
oven, termometer, panci infusa dan alat-alat gelas yang lazim digunakan di
laboratorium analisis.
F. Tata Cara Penelitian 1. Pemilihan sampel
Sampel diperoleh dari perkebunan teh PT. Tambi Unit 3 Tanjungsari
Kecamatan Kertek Wonosobo dengan ketinggian kebun 760 mdpl, tanggal 25 Juni
2009 dan perkebunan teh Desa Kemuning Kecamatan Ngargoyoso, Karanganyar
dengan ketinggian kebun 1200 mdpl, tanggal 1 Juli 2009.
2.Pembuatan infusa teh hijau daerah Wonosobo dan Karanganyar 0,25% b/v Sampel daun teh hijau yang telah kering, dihomogenkan dan diserbuk,
serbuk diayak menggunakan ayakan dengan nomor mesh 12 dan 50.
Pembuatan infusa dengan menimbang 0,25 gram serbuk kering teh hijau
kemudian dimasukkan dalam panci infusa dengan air sebanyak 100 ml, panaskan
diatas tangas air selama 15 menit terhitung mulai suhu mencapai 90oC sambil sekali –
kali diaduk. Infus diserkai sewaktu masih panas dengan kain flanel kemudian
ditambahkan air secukupnya melalui ampas hingga diperoleh volume infusa yang
2. Persiapan uji penangkapan radikal hidroksil Pembuatan larutan bufer fosfat pH 7,4
Ditimbang dengan seksama sebanyak 1,4196 g Na2HPO4 kemudian
dilarutkan dalam aquades sampai 500,0 ml sehingga dicapai kadar 20 mM.
Ditimbang seksama lebih kurang sebanyak 0,6805 g KH2PO4 kemudian dilarutkan
dalam aquades sampai 250,0 ml sehingga dicapai kadar 20 mM. Kedua larutan
tersebut dicampur sampai didapat larutan bufer fosfat dengan pH 7,4.
Pembuatan larutan deoksiribosa 2,5 mM
Ditimbang dengan seksama lebih kurang sebanyak 0,02012 g
2-deoksi-D-ribosa, kemudian dilarutkan dalam aquades sampai 10,0 ml sehingga dicapai kadar 15
mM. Dari larutan tersebut diambil 8,4 ml dan dilarutkan dalam aquades sampai 50,0
ml, sehingga didapat kadar 2,5 mM.
Pembuatan reagen Fenton
Reagen Fenton yang digunakan terdiri dari FeCl31 mM, EDTA 1 mM, H2O2
20 mM, dan Vitamin C 1 mM.
1. Larutan FeCl31 mM
Ditimbang seksama lebih kurang sebanyak 0,01352 g FeCl3. 6 H2O,
kemudian dilarutkan dalam aquades sampai 10,0 ml sehingga dicapai kadar 5 mM.
Dari larutan tersebut diambil 10,0 ml dan dilarutkan dalam aquades sampai 50,0 ml,
2. Larutan EDTA 1 mM
Ditimbang seksama lebih kurang sebanyak 0,046525 g Na2EDTA. 2 H2O,
kemudian dilarutkan dalam aquades sampai 25,0 ml sehingga dicapai kadar 5 mM.
Dari larutan tersebut diambil 20,0 ml dan dilarutkan dalam aquades sampai 100,0 ml,
sehingga diperoleh kadar 1 mM.
3. Larutan H2O220 mM
Diambil 4,3 ml larutan H2O2 35 % kemudian dilarutkan dalam akuades
sampai 5 ml sehingga didapatkan larutan H2O230 %. Diambil 0,2275 ml H2O230 %,
kemudian dilarutkan dalam aquades sampai 25,0 ml sehingga dicapai kadar 80 mM.
Dari larutan tersebut diambil 25 ml dan dilarutkan dalam aquades sampai 100,0 ml,
sehingga diperoleh kadar 20 mM.
4. Larutan Vitamin C 1 mM
Ditimbang seksama lebih kurang sebanyak 0,01761 g vitamin C, kemudian
dilarutkan dalam aquades sampai 10,0 ml sehingga dicapai kadar 10 mM. Dari
larutan tersebut diambil 1,0 ml dan dilarutkan dalam aquades sampai 10,0 ml,
sehingga diperoleh kadar 1 mM.
Pembuatan larutan TCA 5 %
Ditimbang dengan seksama lebih kurang sebanyak 5,0 g TCA, kemudian
Pembuatan larutan TBA 1 %
Ditimbang seksama lebih kurang sebanyak 0,5 g TBA, dimasukkan ke dalam
beaker glass 100 ml dan ditambah aquades secukupnya, kemudian dipanaskan di atas
hot plate hingga seluruh TBA larut. Setelah itu, dilarutkan dalam aquades sampai
50,0 ml sehingga dicapai kadar 1 % b/v.
3. Optimasi metode
Penentuanoperating time(waktu operasional)
Diambil 300 µl larutan deoksiribosa 2,5 mM, kemudian ditambah dengan
300 µl FeCl31 mM, 300 µl EDTA 1 mM, 300 µl H2O220 mM, 4500 µl bufer fosfat
pH 7,4, dan 300 µl vitamin C 1 mM. Campuran tersebut kemudian diinkubasi pada
suhu 37°C selama 30 menit. Setelah itu ditambah 1,0 ml TCA 5 % dan 1,0 ml TBA 1
%, dipanaskan dalam waterbath pada suhu 80°C selama 30 menit sampai terbentuk
kromogen MDA-TBA yang berwarna merah muda, kemudian didinginkan di bawah
air mengalir selama 5 menit, dan dibaca absorbansinya pada panjang gelombang
maksimum teoritis (λmaksteoritis) 532 nm selama 60 menit.
Penentuanoperating time(waktu operasional) infusa teh hijau Wonosobo
Diambil 80 µl infusa teh hijau Wonosobo, ditambahkan 300 µl larutan
deoksiribosa 2,5 mM, kemudian ditambah dengan 300 µl FeCl31 mM, 300 µl EDTA
1 mM, 300 µl H2O220 mM, 4420 µl bufer fosfat pH 7,4, dan 300 µl vitamin C 1 mM.
Campuran tersebut kemudian diinkubasi pada suhu 37°C selama 30 menit. Setelah itu
suhu 80°C selama 30 menit sampai terbentuk kromogen MDA-TBA yang berwarna
merah muda, kemudian didinginkan di bawah air mengalir selama 5 menit, dan
dibaca absorbansinya pada panjang gelombang maksimum teoritis (λmaksteoritis) 532
nm selama 60 menit.
Penentuanoperating time(waktu operasional) infusa teh hijau Karanganyar
Diambil 80 µl infusa teh hijau Karanganyar, ditambahkan 300 µl larutan
deoksiribosa 2,5 mM, kemudian ditambah dengan 300 µl FeCl31 mM, 300 µl EDTA
1 mM, 300 µl H2O220 mM, 4420 µl bufer fosfat pH 7,4, dan 300 µl vitamin C 1 mM.
Campuran tersebut kemudian diinkubasi pada suhu 37°C selama 30 menit. Setelah itu
ditambah 1,0 ml TCA 5 % dan 1,0 ml TBA 1 %, dipanaskan dalam waterbath pada
suhu 80°C selama 30 menit sampai terbentuk kromogen MDA-TBA yang berwarna
merah muda, kemudian didinginkan di bawah air mengalir selama 5 menit, dan
dibaca absorbansinya pada panjang gelombang maksimum teoritis (λmaksteoritis) 532
nm selama 60 menit.
Penentuan panjang gelombang serapan maksimum
Diambil 200, 300, dan 400 µl larutan deoksiribosa 2,5 mM, kemudian
masing-masing ditambah dengan 300 µl FeCl3 1 mM, 300 µl EDTA 1 mM, 300 µl
H2O2 20 mM, bufer fosfat pH 7,4 (penambahan bufer fosfat disesuaikan dengan
volume larutan deoksiribosa yang ditambahkan sehingga volume akhir campuran
adalah 6 ml), dan 300 µl vitamin C 1 mM. Campuran tersebut kemudian diinkubasi
pada suhu 37°C selama 30 menit. Setelah itu ditambah 1,0 ml TCA 5 % dan 1,0 ml
terbentuk kromogen MDA-TBA yang berwarna merah muda, kemudian didinginkan
di bawah ai r mengalir selama 5 menit, dan lakukan scanning absorbansi pada
panjang gelombang 400-600 nm.
Pembuatan larutan kontrol
Diambil 600 µl deoksiribosa 2,5 mM, kemudian ditambah dengan 300 µl
FeCl31 mM, 300 µl EDTA 1 mM, 300 µl H2O2 20 mM, 4,2 ml bufer fosfat pH 7,4,
dan 300 µl vitamin C 1 mM. Campuran tersebut kemudian diinkubasi pada suhu
37°C selama 30 menit. Setelah itu ditambah 1,0 ml TCA 5 % dan 1,0 ml TBA 1 %,
dipanaskan dalam waterbath pada suhu 80°C selama 30 menit sampai terbentuk
kromogen MDA-TBA yang berwarna merah muda, kemudian didinginkan dengan
bantuan air mengalir selama 5 menit dan dibaca absorbansinya pada panjang
gelombang maksimum hasil optimasi selamaoperating time.
4. Uji aktivitas penangkapan radikal hidroksil oleh infusa teh hijau
Diambil sejumlah volume 5, 10, 20, 40, dan 80 µl infusa teh hijau. Ke dalam
tiap-tiap tabung tersebut ditambah dengan 600 µl deoksiribosa 2,5 mM, kemudian
ditambah dengan 300 µl FeCl3 1 mM, 300 µl EDTA 1 mM, 300 µl H2O2 20 mM,
bufer fosfat pH 7,4 (penambahan bufer fosfat disesuaikan dengan volume infusa teh
hijau yang ditambahkan sehingga volume akhir larutan adalah 6 ml), dan 300 µl
vitamin C 1 mM. Campuran tersebut kemudian diinkubasi pada suhu 37°C selama 30
menit. Setelah itu ditambah 1,0 ml TCA 5 % dan 1,0 ml TBA 1 %, dipanaskan dalam
waterbath pada suhu 80°C selama 30 menit sampai terbentuk kromogen MDATBA
selama 5 menit dan dibaca absorbansinya pada panjang gelombang maksimum hasil
optimasi selama operating time. Dari hasil absorbansi yang diperoleh selanjutnya
dihitung % scavengingnya dan dibuat persamaan regresi linier yang merupakan
hubungan antara konsentrasi infusa teh hijau vs % scavenging untuk menentukan
ES50. Replikasi dilakukan sebanyak 5 kali.
G. Analisis Hasil
Analisis hasil pada penelitian ini meliputi penentuan % scavenging yang
dihitung dari selisih antara absorbansi larutan kontrol dan absorbansi larutan sampel
dibagi absorbansi larutan kontrol dikalikan 100% .
Nilai Efektivitas penangkapan radikal hidroksil sebesar 50 % (ES50)
ditentukan dengan menggunakan persamaan garis regresi linier antara konsentrasi
infusa teh hijau (sumbu x) dengan % scavenging (sumbu y). Analisis statistik yang
digunakan adalah uji T tidak berpasangan.
Persamaan regresi linier : y = bx + a
Perhitungan ES50:
ES50=
Keterangan : a : intersep
BAB IV
HASIL DAN PEMBAHASAN
A. Pemilihan Sampel
Sampel daun teh hijau diperoleh dari perkebunan teh PT. Tambi Unit 3
Tanjungsari Kecamatan Kertek, Wonosobo dengan ketinggian kebun 760 mdpl,
tanggal 25 Juni 2009 dan perkebunan teh Desa Kemuning Kecamatan Ngargoyoso,
Karanganyar dengan ketinggian kebun 1200 mdpl, tanggal 1 Juli 2009. Pertanaman
teh di berbagai perkebunan teh diarahkan untuk memperoleh produksi yang tinggi
sehingga menggunakan berbagai jenis klon seperti TRI 2024, TRI 2025, Gambung,
Kiara, CIN dan lainnya. Klon adalah bahan tanaman vegetatif yang digunakan untuk
pembiakan dengan cara setek. Pemetikan daun ini dilakukan selama masa daur
pangkas pada pemetikan produksi, dimana daur petik 8 – 12 hari. Daun teh hijau yang
digunakan dari pucuk daun teh yang masih muda dan merupakan klon Gambung 7
yang sudah dilakukan identifikasi. Katekin didapat dari tiga pucuk daun teh yang
paling atas, menurut penelitian pucuk daun ini memiliki katekin dan mutu paling
tinggi serta rasa paling bagus. Dipilihnya klon Gambung 7, karena memiliki daya
adaptasi yang paling baik dibandingkan dengan klon yang lainnya seperti TRI 2024,
TRI 2025 dan CIN (Moehni, wawancara pribadi, 25 Juni 2009). Selain itu klon
Gambung ini berbasisvarietas assamica, dimanaCamellia sinensis varietas assamica
lebih tinggi kandungan polifenolnya dibandingkanCamellia sinensis varietas sinensis
(TRI 2024, TRI 2025 dan CIN (Cinyiruan)).
B. Pembuatan serbuk
Daun teh hijau tidak dilakukan pencucian karena daun teh hijau tersebut
dalam keadaan bersih kemudian dikeringkan dengan bantuan kipas angin pada suhu
kamar sampai setengah kering yang bertujuan untuk mengurangi kadar air di dalam
simplisia dan menjamin kualitas bahan tetap baik karena terhindar dari jamur,
aktivitas bakteri, bekerjanya enzim oksidasi yang dapat menyebabkan perubahan
kimia.
Selanjutnya daun teh dikeringkan dengan oven pada suhu terkontrol, yakni
kisaran suhu 500– 600C selama kurang lebih 12 jam (diperkirakan daun sudah benar
- benar kering). Tujuan pengeringan secara umum adalah untuk lebih mengurangi
kandungan air, hal ini dikarenakan air yang tersisa dalam simplisia merupakan media
pertumbuhan yang baik untuk jamur maupun mikroorganisme lainnya. Tujuan
pengeringan selain untuk mengurangi kadar air, juga dapat menghentikan kerja enzim
sehingga mutu dari simplisia dapat dipertahankan, terjamin keawetannya, selain itu
memudahkan dalam pembuatan serbuk bahan.
Pembuatan serbuk bertujuan untuk meningkatkan luas permukaan simplisia
sehingga permukaan simplisia yang bersentuhan dengan penyari semakin luas. Luas
permukaan yang semakin besar akan mengoptimalkan pembasahan serbuk simplisia