KARAKTERISASI DAN EKSPRESI GEN COAT PROTEIN
Tomato infectious chlorosis virus PADA Escherichia coli
FITRIANINGRUM KURNIAWATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2012
PERNYATAAN MENGENAI TESIS
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis berjudul “Karakterisasi Dan Ekspresi Gen Coat Protein Tomato infectious chlorosis virus Pada Escherichia coli”
adalah karya saya sendiri, dengan arahan Komisi Pembimbing dan belum pernah diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir tesis ini.
Bogor, Januari 2012
FITRIANINGRUM KURNIAWATI NIM: A352080051
ABSTRACT
FITRIANINGRUM KURNIAWATI. Characterization and Expression of
Tomato infectious chlorosis virus Coat Protein Gene in Escherichia coli. Supervised by GEDE SUASTIKA and GIYANTO.
Tomato infectious chlorosis virus (TICV) is a member of Crinivirus genus. TICV infects tomato crop in Garut and Cipanas, West Java Indonesia. Tomato initially showed bright interveinal yellowing symptoms. The coat protein gene (CP-TICV) was amplified by RT-PCR from total RNA extracted from infected tomato leaves and the amplified fragment was cloned and completely sequenced. The fragment was subsequently subcloned into the pET-21b expression vector. The recombinant plasmid was transformed to Escherichia coli strain BL21(DE3)pLysS to express the coat protein. The coat protein fused to a 6xhistag, was purified by affinity chromatography using a NiNTA spin column. The identity of the purified protein was confirmed by SDS-PAGE. In this experiment, 792 bp of CP-TICV gene of TICV virus has been successfully cloned, sequenced, and expressed in E. coli. Based on nucleotide sequences alignment analysis, TICV-Indonesia strain showed 100% identity to TICV –Spain strain and 99% identity to North America, France, and California strains and based on amino acid sequences alignment analysis, TICV-Indonesia strain showed 100% identity to TICV –Spain, North America, France strains and 99.2% identity to California strain. CP-TICV showed over expressed in E. coli when it is induced with 1 mM IPTG and incubated at 37oC. Purified CP-TICV-Histag recombinants protein sized 29 kDa based on SDS-PAGE analysis.
Keyword : Tomato infectious chlorosis virus (TICV), coat protein gene, expression
RINGKASAN
FITRIANINGRUM KURNIAWATI. Karakterisasi dan Ekspresi Gen Coat
Protein Tomato infectious chlorosis virus pada Escherichia coli. Dibimbing oleh
GEDE SUASTIKA dan GIYANTO.
Penyakit klorosis pada tanaman tomat telah ditemukan di Indonesia. Penyebab penyakit klorosis ini adalah Tomato infectious chlorosis virus (TICV) anggota dari genus Crinivirus (famili Closteroviridae). Pada tanaman tomat, infeksi TICV menyebabkan berbagai gejala antara lain: klorosis antar tulang daun (interveinal yellowing), nekrotik, daun rapuh, ukuran buah mengecil, dan proses pemasakan buah terganggu. Deteksi virus dapat dilakukan dengan reverse transcription–polymerase chain reaction (RT-PCR) dan dengan pendekatan serologi yaitu enzyme-linked immunosorbent assay (ELISA), tissue blot immunosorbent assay (TBIA), dan dot blot immunosorbent assay (DIBA). Antiserum merupakan komponen utama dalam uji serologi, namun demikian antiserum terhadap TICV belum tersedia di Indonesia. Usaha penyediaan antiserum bermanfaat sebagai sarana dalam mendeteksi TICV. Ekspresi gen coat protein (CP) TICV pada Escherichia coli menjanjikan tersedianya antigen dalam jumlah yang cukup untuk produksi antiserum.
Penelitian ini bertujuan untuk: mendeteksi penyakit klorosis yang disebabkan oleh TICV dengan RT-PCR, mengarakterisasi gen CP-TICV isolat Indonesia dan melakukan ekspresi gen CP-TICV pada bakteri E. coli. Penelitian ini telah dilakukan pada bulan Maret 2009 – April 2011 di Laboratorium Virologi Tumbuhan Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dan Laboratorium Biokimia Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian. Tanaman sumber virus dikumpulkan dari tanaman bergejala klorosis di sentra produksi tomat Cikajang-Garut dan Cipanas-Cianjur, Jawa Barat. Untuk mengarakterisasi gen CP-TICV dilakukan ekstraksi RNA total dengan Qiagen Rneasy plant mini kits. RNA hasil ekstraksi digunakan sebagai cetakan dalam sintesis complementary (c)DNA melalui reaksi RT. cDNA hasil RT digunakan sebagai cetakan dalam reaksi PCR menggunakan primer spesifik. Hasil PCR langsung dirunut nukleotidanya di PT. Macrogen Incorporation-Korea Selatan. Runutan nukleotida tersebut dianalisis dengan program Basic Local Alignment Search Tools (BLAST). Gen CP-TICV disisipkan ke dalam vektor ekspresi pET-21b pada situs pemotongan BamHI dan HindIII yang terletak antara T7 pada ujung depan setelah start kodon dan 6xhis-tag pada ujung belakang sebelum stop kodon. Transformasi dilakukan pada bakteri E. coli strain BL21(DE3)pLysS. Konfirmasi transforman dilakukan dengan pemotongan menggunakan enzim restriksi BamHI dan HindIII pada plasmid rekombinan pET21b-CP dan PCR menggunakan primer spesifik TICV. Ekspresi CP-TICV dilakukan dengan menginduksinya menggunakan 1 mM isopropil-thio-D-galaktoside (IPTG) pada suhu 37 oC semalam. Purifikasi protein CP-TICV dilakukan dengan nickel-nitrilotriacetic (NiNTA) spin column (Qiagen, Germany) dan hasilnya dianalisis dengan Sodium Dedocyl Sulfate-Polyacrylamide Gel Electrophoresis (SDS-PAGE). Pada penelitian ini gen CP-TICV isolat asal Cipanas berhasil diisolasi dengan RT-PCR, nukleotidanya berhasil dirunut dan
diketahui berukuran 792 bp. Berdasarkan hasil analisis alignment two sequence runutan nukleotida gen CP tersebut, TICV isolat Indonesia mempunyai kemiripan 100% dengan TICV isolat Spanyol, dan 99% dengan isolat Amerika Utara, Perancis, dan California. Sedangkan berdasarkan hasil analisis alignment two sequence runutan asam amino protein CP tersebut, TICV isolat Indonesia mempunyai kemiripan 100% dengan Spanyol, Amerika Utara, dan perancis, serta 99.2% dengan California. Ekspresi gen CP-TICV berhasil dilakukan pada E. coli dengan menginduksinya menggunakan 1 mM IPTG pada 37 oC selama semalam. Protein CP-TICV berhasil dipurifikasi dengan NiNTA spin column dan melalui analisis SDS-PAGE CP-TICV diketahui berukuran 29 kDa.
Kata kunci: Tomato infectious chlorosis virus (TICV), gen coat protein (CP),
© Hak cipta milik Institut Pertanian Bogor, tahun 2012
Hak cipta dilindungi Undang Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB
KARAKTERISASI DAN EKSPRESI GEN COAT PROTEIN
Tomato infectious chlorosis virus PADA Escherichia coli
FITRIANINGRUM KURNIAWATI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Entomologi-Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2012
Penguji Luar Komisi pada Ujian Tesis: Dr. Ir. Tri Asmira Damayanti, MAgr
Judul Tesis : Karakterisasi dan Ekspresi Gen Coat Protein Tomato infectious chlorosis virus pada Escherichia coli
Nama Mahasiswa : FITRIANINGRUM KURNIAWATI
NIM : A352080051
Disetujui Komisi Pembimbing
Dr. Ir. Gede Suastika, M.Sc Dr. Ir. Giyanto, M.Si Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Fitopatologi
Dr. Ir. Sri Hendrastuti Hidayat, M.Sc Dr. Ir. Dahrul Syah, M.Sc Agr
Tanggal Ujian: Tanggal Lulus:
PRAKATA
Puji dan syukur alkhamdulillah penulis panjatkan kehadirat Allah Subhanahuwata’ala karena berkat dan rahmat-Nya sehingga tesis yang berjudul
”Karakterisasi dan Ekspresi Gen Coat Protein Tomato infectious chlorosis virus
pada Escherichia coli” dapat terselesaikan.
Penulis menyampaikan rasa terima kasih yang tak terhingga kepada Dr. Ir. Gede Suastika, M.Sc selaku ketua komisi pembimbing dan Dr. Ir. Giyanto, M.Si selaku anggota komisi pembimbing, atas segala kesabaran, bimbingan, nasihat, kritik, dan sarannya sehingga tesis ini dapat terselesaikan. Penulis juga mengucapkan terima kasih kepada Dr. Ir. Sri Hendrastuti Hidayat, M.Sc selaku Ketua program studi Fitopatologi dan semua dosen Departemen Proteksi Tanaman IPB atas ilmu yang bermanfaat. Terimaksih juga penulis ucapkan kepada Dr. Ir. Tri Asmira Damayanti, M. Agr selaku dosen penguji tamu.
Penulis juga mengucapkan terima kasih kepada Ketua Kelompok Peneliti (Kelti) Biokimia Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian (BB-BIOGEN) Dr. I Made Samudera, yang telah memberikan ijin kepada penulis untuk mengerjakan penelitian di Laboratorium Biokimia BB-BIOGEN, dan kepada Dr. Ir. Tri Puji Priyatno M.Sc, Dr. Ifa Manzila, M.Si terimakasih atas bimbingan, arahan, dan masukan selama penulis mengerjakan penelitian di BB-BIOGEN.
Penulis juga menyampaikan rasa terima kasih dan penghargaan kepada teman-teman Laboratorium Virologi, Pak Edi, Mbak Tuti Susanti Legiastuti, S.Si, Ibu Dr. Ifa Manzila, M. Si, Irwan Lakani M. Si, Ibu Dra. Rita Noveriza, M. Sc, Budi Sri Utami SP, Devi Agustina M. Si, Mbak Damayanti SP, Mbak Miftachurohmah SP, Aceu SP, Mbak Melinda SP, Mbak Dwi S.Si, dan Adik-adik mahasiswa S1. Ucapan terima kasih juga penulis sampaikan kepada teman-teman seperjuangan PS Entomologi-Fitopatologi 2008 (Kak Linda M. Si, Kak Nilda M. Si, Mas Tri M. Si, Wawan M.Si, Kak Kiki SP, Mia M. Si, Yani M. Si, Bang Dedi M. Si, Pak Aser, Pak Gatot, Kak Nela M. Si, Kak Rika M. Si, dan Umbu SP), teman-teman Fito 2007 (Eva M. Si, Donna M. Si, Teh Rika M. Si, dan Bruce M. Si) dan teman-teman Fito 2009.
Secara khusus penulis menyampaikan penghargaan dan terima kasih kepada yang tercinta ayahanda dan ibunda atas segala pengertian, dorongan, dan doa yang tiada henti sehingga penulis dapat menyelesaikan pendidikan, serta kepada bapak dan ibu mertua terimakasih atas doa dan semangatnya. Ungkapan terima kasih juga disampaikan kepada suami Bangun Sulistyobudi, ST dan ananda tersayang Ayazid Iqbal Budialbani atas segala semangat, pengertian, kasih sayang, motivasi dan inspirasi selama penulis menempuh studi.
Akhirnya penulis berharap mudah-mudahan tulisan ini dapat bermanfaat bagi kita semua.
Bogor, Januari 2012
RIWAYAT HIDUP
Penulis dilahirkan di Sukoharjo, Jawa Tengah pada tanggal 28 Juni 1983 dari pasangan Bapak Kumpul Hermawan dan ibu Tri Budiarsi. Penulis merupakan putri pertama dari empat bersaudara.
Tahun 2001 penulis lulus dari SMU Negeri 3 Sukoharjo dan pada tahun yang sama masuk Institut Pertanian Bogor, Departemen Proteksi Tanaman melalui jalur Undangan Seleksi Masuk IPB (USMI). Tahun 2005 penulis mendapat gelar Sarjana Pertanian. Tahun 2005-2007 penulis bekerja di perusahaan tanaman hias CV. Salsabiila Nursery Cipanas-Cianjur Jawa Barat. Tahun 2008 penulis mendapat kesempatan untuk melanjutkan studi Program Magister Sains di Program Pascasarjana IPB dengan biaya dari orangtua. Selama melaksanakan studi, penulis aktif di forum wacana Ento-Fito sebagai bendahara. Penulis menjadi asisten dosen penyakit kelapa sawit program D3 IPB (2009-2010). Tahun 2009 penulis mengikuti seminar internasional Perhimpunan Fitopatologi Indonesia di Universitas Hassanudin – Makassar, dan pada tahun yang sama penulis menikah dengan Bangun Sulistyobudi, ST dan dikaruniai satu orang anak, Ayazid Iqbal Budialbani.
DAFTAR TABEL
No Halaman
1. Tingkat kesamaan isolat TICV dari beberapa negara
berdasarkan perunutan nukleotida... 29 2. Tingkat kesamaan isolat TICV dari beberapa negara
19
DAFTAR GAMBAR
No Halaman
1. Partikel TICV berbentuk seperti benang memanjang
(filamentous) dan lentur... 5
2. Organisasi genom TICV... 6
3. Vektor ekspresi pET-21b... 12
4. Gejala penyakit klorosis di lapangan... 26
5. Deteksi RT-PCR TICV dan ToCV dengan primer spesifik pada tanaman tomat yang bergejala klorosis... 27
6. Amplifikasi gen CP-TICV... 28
7. Hasil Alignment nukleotida antara genom TICV- Indonesia dengan genom TICV yang terdapat pada Genbank ... 30
8. Hasil Alignment asam amino antara genom TICV- Indonesia dengan genom TICV yang terdapat pada Genbank ... 31
9. Pohon filogenetik berdasarkan runutan nukleotida (A) dan asam amino (B) gen protein selubung isolat TICV-Indonesia 32 10. Hasil elektroforesis 1% gel agarose A) pemotongan plasmid rekombinan pET-21b-CP, B) hasil PCR koloni tunggal E. coli rekombinan... 33
11. Optimasi ekspresi protein CP TICV pada beberapa suhu 35
12. Analisis SDS-PAGE ekspresi CP-TICV pada bakteri E. coli strain BL21(DE3)pLysS yang diinduksi dengan IPTG dan yang tidak diinduksi IPTG... 36
13. Analisis sodium deodecyl sulfat-polyacrilamid gel electrophoresis (SDS-PAGE) protein-protein yang diekstraksi dari E. coli BL- 21... 37
DAFTAR ISI
Halaman DAFTAR TABEL ... xiii DAFTAR GAMBAR ... xiv DAFTAR ISI ... xv PENDAHULUAN ... 1
Latar Belakang ... 1 Tujuan Penelitian ... 3 TINAJAUAN PUSTAKA ... 4 Tomato infectious chlorosis virus ... 4 Kloning ... 9 Ekspresi Gen... 11 BAHAN DAN METODE ... 15
Waktu dan Tempat ... 15 Tanaman Sumber Virus ... 15 Koleksi dan Pengumpulan Tanaman Sakit ... 15 Deteksi TICV dan ToCV dengan RT-PCR ... 16 Karakterisasi Gen CP-TICV ... 16
Ekstraksi RNA Total ... 16 Sintesis cDNA ... 17 Amplifikasi Gen CP-TICV dengan PCR ... 17 Perunutan Nukleotida dan Asam Amino Gen CP-TICV 18 Ekspresi Gen CP-TICV pada E. coli Strain BL21(DE3)pLysS . 18
Kloning CP-TICV ... 18 Konstruksi Vektor Ekspresi ... 18 Persiapan Kompeten Sel ... 18 Transformasi ... 19 Konfirmasi Transforman ... 19 Isolasi Plasmid dengan Metode Alkalin Lisis………... 20 Koloni PCR ... 20 Pemotongan pET-21b-CP dengan Enzim Restriksi . 21 Purifikasi CP-TICV ... 21 Kultur Ekspresi ... 21 Purifikasi dengan NiNTA Spin Column pada Kondisi Denaturasi 21 Analisis SDS-PAGE ... 22 HASIL DAN PEMBAHASAN ... 23
TICV Isolat Indonesia ... 23 Karakterisasi Gen CP-TICV ... 27 Amplifikasi Gen CP-TICV……… 27 Perunutan Nukleotida dan Asam Amino Gen CP-TICV 27 Ekspresi Gen CP-TICV pada E. coli………. 33
Konfirmasi Transformasi... 33 Ekspresi CP-TICV pada E. coli Strain BL21(DE3)pLysS ... 34 Purifikasi CP-TICV dengan NiNTA Spin Column ... 36 KESIMPULAN ... 38 DAFTAR PUSTAKA ... 39
1
PENDAHULUAN
Latar Belakang
Tanaman tomat (Lycopersicon esculentum Mill. ) merupakan salah satu komoditas hortikultura yang penting di Indonesia. Tomat mempunyai kandungan zat gizi yang banyak, seperti vitamin A, C, karbohidrat, lemak, protein, dan kalsium. Selain kaya kandungan gizinya, tomat juga mengandung likopen yang berfungsi sebagai antioksidan, mengobati gangguan pencernaan, memulihkan fungsi lever dan mencegah penggumpalan dan pembekuan darah (Astawan 2008).
Penyakit klorosis merupakan salah satu penyakit yang menyerang tomat. Penyakit klorosis sudah banyak dilaporkan menyerang tanaman tomat di berbagai negara. Di Indonesia, penyakit ini telah ditemukan di beberapa sentra produksi tomat, seperti di Garut, Cianjur, Bogor, Magelang, dan Yogyakarta (Fitriasari 2010; Hartono & Wijonarko 2007). Penyakit klorosis disebabkan oleh Tomato infectious chlorosis virus (TICV) (Dalmon et al. 2005; Tsai et al. 2004). TICV merupakan anggota dari genus Crinivirus (famili Closteroviridae) (Wisler et al. 1996; Li et al. 1998; Jacquemond et al. 2008).
Gejala serangan TICV pada tanaman tomat ditunjukan oleh klorosis pada bagian antara tulang daun (interveinal yellowing). Jika gejala klorosis sangat parah, daun akan mengalami nekrotik (kematian jaringan) dan menjadi rapuh, serta ukuran buah menjadi lebih kecil, mudah gugur dan proses pemasakan terganggu sehingga hasil panen menurun (Wisler et al. 1998a; Wisler et al. 1998b; Vaira et al. 2002).
TICV ditularkan dari satu tanaman ke tanaman lainnya oleh serangga vektor Trialeurodes vaporariorum (Hemiptera: Aleyrodidae) yang dikenal dengan nama kutu kebul. Penularan dapat terjadi secara cepat ke seluruh areal pertanaman karena serangga vektor bersifat aktif. TICV ditularkan oleh serangga vektor secara semipersisten (Duffus et al. 1994; Wintermantel 2004).
Sampai saat ini deteksi TICV dapat dilakukan dengan pendekatan molekuler yaitu Reverse transcription-polymerase chain reaction (RT-PCR) yang hasilnya sangat cepat dan akurat, namun memerlukan bahan-bahan dan peralatan
2
yang mahal. Selain RT-PCR, pendekatan serologi enzyme linked immunosorbent assay (ELISA), tissue blot immunosorbent assay (TBIA), dan dot blot immunosorbent assay (DIBA) juga diterapkan untuk deteksi virus tanaman karena lebih murah namun tetap cepat. Deteksi secara serologi ini memerlukan antiserum. Antiserum TICV belum tersedia di Indonesia, sehingga menyulitkan dalam mendeteksi virus ini. Usaha ke arah penyediaan antiserum akan sangat bermanfaat sebagai sarana dalam mendeteksi TICV.
Secara konvensional, siapan virus murni digunakan sebagai antigen dalam produksi antiserum. Untuk mendapatkan siapan virus murni diperlukan titer virus yang tinggi pada jaringan tanaman sumber virus. Syarat ini tidak dapat dipenuhi oleh TICV dalam jaringan tanaman tomat. TICV adalah virus yang penyebarannnya di dalam tanaman inang terbatas pada jaringan floem, oleh karena itu konsentrasi partikelnya sangat rendah dalam keseluruhan jaringan tanaman. Penyebaran yang terbatas pada jaringan floem ini menyebabkan TICV sangat sulit untuk diekstraksi agar mendapatkan jumlah yang memadai.
Kemajuan teknologi di bidang biologi molekuler telah menyediakan metode ekspresi suatu gen tertentu yang disisipkan dalam vektor ekspresi (plasmid) pada Escherichia coli. Ekspresi gen CP TICV pada E. coli menjanjikan tersedianya immunogen dalam jumlah yang cukup untuk produksi antiserum. Keunggulan penyediaan antiserum dengan metode ini antara lain: protein yang dihasilkan bersifat spesifik sehingga tidak bereaksi terhadap protein tanaman, dapat tersedia antigen dalam jumlah yang mencukupi setiap saat apabila diperlukan untuk produksi antiserum, (Cotillon et al. 2005). Melihat keunggulan diatas maka diperlukan suatu metode untuk dapat mengekspresikan gen CP TICV yang akan digunakan sebagai antigen dalam produksi antiserum. Ketersediaan antiserum yang mencukupi sangat diperlukan untuk mewujudkan pendeteksian TICV yang cepat dan akurat yang akhirnya sangat menentukan tindakan pengendalian penyakit pada tanaman tomat secara tepat.
3
Tujuan Penelitian
Penelitian ini mempunyai beberapa tujuan, yaitu untuk mendeteksi penyakit klorosis yang disebabkan oleh TICV dengan RT-PCR, mengarakterisasi gen CP-TICV, dan melakukan ekspresi gen CP-TICV pada bakteri E. coli.
4
TINJAUAN PUSTAKA
Tomato infectious chlorosis virus (TICV)
Tomato infectious chlorosis virus (TICV) pertama kali ditemukan pada tahun 1993 di daerah Irvine Orange, California. Pengamatan pertama kali dilakukan oleh Bill Glover (Crops Production Service-Riverside menunjukkan adanya gejala serangan TICV pada pertanaman tomat). Tanaman yang sakit ini menunjukkan gejala menguning pada bagian di antara tulang daun (interveinal yellowing) dan nekrosis. Survei untuk mengetahui kejadian penyakit yang disebabkan oleh TICV dilakukan di daerah dekat Irvine dan sebelah selatan Irvine pada musim semi tahun 1994. Survei penyakit ini dilakukan kembali di Orange, San Diego dan Carlsbad. Pada bulan Juli 1994 Dr. Bryce Falk menemukan gejala serangan TICV yang sama pada pertanaman tomat di daerah Yolo, California (pertanian organik Universitas California). TICV diisolasi dari pertanaman tomat di lapang dan rumah kaca di kampus Davis. Penyakit kemudian ditemukan di pembibitan tomat komersial rumah kaca, 15 mil dari Davis bagian utara dan California Tengah (daerah San Benito) (Duffus et al. 1996). Penyakit ini menyebar dan menimbulkan kerugian yang sangat besar di Negara penghasil tomat seperti Yunani (Dovas et al. 2002), Italia dan Jepang (Hartono et al. 2003), Taiwan (Tsai et al. 2004) dan Spanyol (Font et al. 2004).
Survei lapang terhadap penyakit ini telah dilakukan di Indonesia pada tahun 2005 sampai awal 2006, yaitu di daerah Magelang, Jawa Tengah dan Purwakarta, Jawa Barat. Penyakit yang disebabkan TICV ini sering disebut dengan penyakit ungu oleh petani di Magelang. Rata-rata intensitas penyakit ini di Magelang mencapi 30% sampai 80% (Hartono dan Wijonarko 2007). Serangan TICV telah ditemukan di dataran tinggi di Kecamatan Cikajang, Kabupaten Garut, Jawa Barat (Fitriasari 2010).
TICV adalah salah satu anggota Genus Crinivirus. Crinivirus berasal dari kata ‘crinis’ (Bahasa Latin, yang artinya rambut) yang berarti ‘virus yang partikelnya tampak seperti benang yang sangat panjang’. Virion terdiri atas kapsid, kapsidnya tidak punya envelope, kapsid atau nukleokapsid memanjang
5
dengan simetri helix. Menurut Wisler et al. (1996) partikel virus TICV, yang dilihat pada siapan murni hasil ekstraksi tanaman tomat sakit, berbentuk seperti benang (threadlike), memanjang (filamentous), dan lentur (flexuous). Partikel TICV memiliki panjang 850 – 900 nm (Duffus et al. 1996, Liu et al. 2000).
Gambar 1 Partikel TICV berbentuk seperti benang (threadlike), memanjang (filamentous) dan lentur (flexuous) (Liu 2000).
Genom TICV bersegmen (segmented). TICV mempunyai dua genom (bipartite), positif sense. Single stranded (ss) RNA, yaitu RNA 1 (7.8 kb) dan RNA 2 (7.4 kb). Pada RNA genom tersebut terdapat beberapa open reading frame (ORF) yang menyandi beberapa protein struktural dan non struktural. RNA 1 mengandung ORF yang mengkode dua jenis protein yang terlibat dalam replikasi virus, sedangkan RNA 2 mengandung ORF untuk sebuah protein kecil yang hidrofobik (small hydrophobic protein), heat shock protein 70 homologue (HSP70h), sebuah protein berukuran sekitar 60 kDa, dan dua jenis protein mantel yaitu main capsid protein (CP) dan minor capsid protein (CPm) (Wintermantel et al. 2009).
6
Gambar 2 Organisasi genom TICV (Wintermantel et al. 2009).
Infeksi TICV pada tanaman tomat menyebabkan daun-daun tomat klorosis, yaitu menguning di antara tulang daun (interveinal yellowing) yang berasosiasi dengan berkurangnya kemampuan fotosintesisnya. Pada perkembangan selanjutnya daun-daun menjadi rapuh (leaf brittleness), mengalami nekrotik pada beberapa bagian dan warna bagian yang nekrotik menjadi merah keunguan (bronzing), kebugaran (vigor) tanaman menjadi sangat berkurang, dan apabila menghasilkan buah maka ukurannya jauh lebih kecil dari normal dan proses pematangannya terganggu, serta mudah gugur (early senescence) sehingga sangat menurunkan bahkan meniadakan nilai ekonomi tanaman yang terinfeksi (Duffus et al. 1996; Dalmon et al. 2005).
TICV tidak dapat ditularkan secara mekanis, tetapi dapat ditularkan dengan serangga vektor (kutu kebul rumah kaca (Trialeurodes vaporariorum Westwood.) (Hemiptera: Aleyrodidae)) secara semipersisten. Berdasarkan ketidakmampuan virus tumbuhan melakukan sirkulasi dalam vektor, virus semipersisten sama non-persisten. Sebaliknya, berdasarkan kemampuan penularannya virus semipersisten lebih menyerupai virus persisten, yaitu membutuhkan waktu yang relative lama. Menurut Wisler et al. (1998a) TICV memiliki periode persistensi selama 4 hari. Periode makan akuisisi di atas 48 jam. TICV dapat ditularkan dengan waktu yang terbatas antara 1-9 hari tergantung dari virusnya.
TICV memiliki inang yang luas. TICV mampu menyerang 26 spesies dari delapan keluarga yang berbeda. Inang TICV mencakup beberapa tanaman penting
7
yang meliputi: famili Solanaceae (Tomat (Lycopersicon esculentum Mill., tomatillo (Physalis ixocarpa Brot.), Physalis alkekengi L., P. floridana. Rybd., P. wrightii Gray., dan kentang (Solanum tuberosum L.), Nicotiana benthamiana Domin., N. clevelandii Gray., N. glauca Graham., petunia (Petunia hybrida Vilm.)) ; Chenopodiaceae (Chenopodium capitatum L., C. murale L.) ; Compositae (artichoke (Cynara scolymus L.), Cynara scolymus L., lettuce (Lactuca sativa L.), Picris echioides L., Senecio vulgaris L., Sonchus oleraceus L., Zinnia elegans Jacq) ; Cruciferae (Capsella bursa-pastoris (L.) Medic)) ; Geraniaceae (Erodium cicutarium (L.)L’Her., Geranium dissectum L.) ; Leguminosae (Trifolium subterraneum L.) ; Malvaceae ( Anoda cristata (L.) Schlecht.) ; Umbelliferae (Conium maculatum L.) (Duffus et al. 1996; Wisler et al. 1996; Li et ai. 1998).
Deteksi TICV pada tomat sangat diperlukan dalam strategi pengendalian. Seiring dengan pesatnya kemajuan pada bidang bioteknologi, metode deteksi virus tumbuhan juga berkembang sangat cepat. Teknik RT-PCR dikembangkan untuk melakukan analisis terhadap molekul RNA hasil transkripsi yang terdapat dalam jumlah sangat sedikit di dalam sel. Oleh karena PCR tidak dapat dilakukan dengan menggunakan RNA sebagai cetakan, maka terlebih dahulu dilakukan proses transkripsi balik (reverse transcription) terhadap molekul RNA sehingga diperoleh molekul cDNA (complementary DNA). Molekul cDNA tersebut kemudian digunakan sebagai cetakan dalam proses PCR. Teknik RT-PCR ini sangat berguna untuk mendeteksi ekspresi gen, untuk amplifikasi RNA sebelum dilakukan kloning dan analisis, maupun untuk diagnosis agensia infektif maupun penyakit genetik (Yuwono 2006).
Teknik RT-PCR memerlukam enzim transkriptase balik (reverse transcriptase). Enzim transkriptase balik adalah enzim DNA polymerase yang menggunakan molekul RNA sebagai cetakan untuk menyintesis molekul DNA (cDNA) yang komplementer dengan molekul RNA tersebut. Beberapa enzim transkriptase balik yang dapat digunakan antara lain mesophilic viral reverse transcriptase (RTase) yang dikode oleh Avian myoblastosis virus (AMV) maupun oleh Moloney murine leukemia virus (M-MuLV), dan Tth DNA polymerase. RTase yang dikode oleh AMV maupun M-MuLV bersifat sangat prosesif dan
8
mampu menyintesis cDNA sampai sepanjang 10 kb, sedangkan Tth DNA polymerase mampu menyintesis cDNA sampai sepanjang 1-2 kb (Yuwono 2006).
Teknik deteksi TICV dengan RT-PCR telah dilakukan oleh para peneliti menggunakan beberapa primer. Hartono & Wijonarko (2007) dan Jaquemond (2008) telah melakukan deteksi TICV dengan teknik RT-PCR menggunakan primer HSP-70 h, Fitriasari (2010) mendeteksi TICV dengan primer CP, serta Andini (2011) dan Nurulita (2011) dengan primer CPm.
Teknik serologi juga merupakan salah satu cara deteksi dan identifikasi suatu patogen dalam suatu inang. Teknik serologi dengan hibridisasi dot blot menggunakan label digoxigenin TICV probe cRNA, ELISA (Enzyme linked immunosorbent assay), western blot telah dikembangkan dan digunakan untuk mendeteksi TICV pada tanaman tembakau (Nicotiana clevelandii), Physalis wrightii, dan tomat di laboratorium (Duffus et al. 1996; Wisler 1996, dan Li et al. 1998). Uji serologi merupakan pengujian berdasarkan sifat protein suatu virus. Pada dasarnya uji serologi adalah suatu uji yang memerlukan antigen dan antibodi, yang kemudian reaksi akan terjadi antara antigen dan antibodi dalam suatu substrat (Bos 1994 ; Wahyuni 2005).
Prinsip dari uji serologi adalah reaksi spesifik antara antibodi dengan antigen yang membentuk kompleks antigen-antibodi. Antibodi yang digunakan dalam teknik serologi untuk deteksi virus tanaman diperoleh melalui penyuntikan hewan (imunisasi) dengan antigen yang berasal dari hasil pemurnian virus. Darah hewan yang sudah mengandung antibodi terhadap virus yang disuntikkan tersebut kemudian akan diproses lebih lanjut untuk memperoleh antiserum yang spesifik terhadap virus yang bersangkutan. Adanya kompleks antigen-antibodi dapat diperhatikan dengan pengujian in vitro. Teknik serologi yang lazim digunakan untuk diagnosis virus tumbuhan didasarkan pada interaksi antigen-antibodi yang berupa ikatan primer, yaitu ELISA, DIBA, TBIA atau ikatan sekunder yaitu uji presipitasi atau aglutinasi (Akin 2006).
9
Kloning
Salah satu teknologi DNA rekombinan yang dikembangkan saat ini adalah kloning gen. Menurut Glick & Pasternak (2003) kloning gen adalah sejumlah eksperimen yang bertujuan memindahkan DNA dari satu organism ke organism lain. Eksperimen DNA rekombinan secara umum meliputi: (1) ekstraksi DNA sisipan dari organisme donor, (2) pemotongan dan penyambungan secara enzimatis ke DNA vektor untuk membentuk molekul DNA rekombinan baru, (3) pemindahan hasil konstruksi vektor kloning-DNA sisipan ke dalam suatu sel inang dan pemeliharaan di dalam sel tersebut, dan (4) penyeleksian sel-sel inang yang membawa konstruksi DNA.
Prinsip dari ekstraksi DNA dalam proses kloning adalah menghancurkan dinding sel, baik secara mekanis atau enzimatis; melisis sel dengan menambahkan deterjen (seperti: SDS; membersihkan debris sel menggunakan pelarut organik fenol dan chloroform-isoamilalkohol; dan mengendapkan DNA dari lisat jernih dengan menambahkan etanol dan garam natrium (Old & Primrose 2003).
DNA sisipan dan DNA vektor dipotong menjadi fragmen linear. Pemotongan DNA merupakan kerja enzim restriksi yang bersifat spesifik sehingga menghasilkan DNA dengan potongan unik, baik berujung tumpul (blunt-end) ataupun lancip (sticky-end). Bakteri menghasilkan enzim yang menghancurkan DNA fag sebelum fag ini sempat mengadakan replikasi dan mengarahkan sintesis partikel fag baru. DNA bakteri sendiri terlindung dari enzim ini, hal ini dikarenakan DNA mempunyai gugus metil tambahan yang menghalangi kerja degradatif enzim. Enzim-enzim degradatif ini disebut endonuklease restriksi dan disintesis oleh banyak spesies bakteri. Jenis-jenis enzim restriksi antara lain: Hindlll, Kpnl, Sacl, BamHl, spel, BstXl, EcoRl, EcoV,Notl, Xhol, Nsil, Xbal dan Apal (Brown 2003; Glick & Pasternak 2003). Penyambungan DNA sisipan dengan DNA vektor dilakukan oleh enzim ligase. Konstruksi DNA sisipan-vektor plasmid ditransfer ke sel inang melalui proses transformasi. Prinsip transformasi adalah membuat suatu kondisi yang mempengaruhi sel hidup sehingga dapat menarik dan membiarkan molekul DNA
10
asing masuk kedalam sel melalui membran sel dari lingkungannya (sel kompeten). Sel kompeten dibuat dengan menurunkan suhu pertumbuhan sel beberapa lama, lalu memberikan kejutan panas. Kemungkinan DNA asing masuk kedalam sel menjadi lebih besar jika pada lingkungannya terdapat ion-ion divalen Ca2+ dan Mg2+. Suatu inang yang baik hendaknya memenuhi prasyarat: pertumbuhan cepat, non patogenik, mampu menangkap molekul DNA dan stabil dalam kultur memiliki enzim yang sesuai untuk replikasi vektor rekombinan, mempunyai informasi genetik selengkap mungkin, dan mempunyai genotip spesifik untuk efektifitas hasil kloning (Glick & Pasternak 2003)
Sistem inang E.coli popular digunakan. Galur E.coli DH5α adalah E.coli yang dimutasi pada bagian lacZ (lacZ∆M15) sehingga dapat dimanfaatkan sebagai penseleksi transforman, Jika galur ini ditransformasikan oleh plasmid yang membawa daerah regulator operon lac yaitu gen penyandi ß-galaktosidase- dan suatu segmen pendek DNA penyadi ujung animo terminal plasmid tersebut berkombinasi dengan produk ß-galaktosidase tidak lengkap yang dihasilkan galur lacZ∆M15, menghasilkan ß-galaktosidase yang fungsional. Peristiwa penggabungan potongan protein lacZ menjadi lacZ fungsional ini disebut komplementasi-α. Enzim ß-galaktosidase fungsional ini dapat diinduksi oleh IPTG. Fenotip ini dapat diamati sebagai warna biru yang dihasilkan dari reaksi dengan substrat kromogenik X-gal (5-bromo-4chloro-3indoly-ß-D-galactoside). Telah dirancang tepat pada bagian hilir lacZ suatu multiple cloning region atau multiple cloning sites (MCS), yaitu suatu daerah sempit sebagai situs penyisipan suatu fragmen DNA. Jika DNA terklon pada daerah tersebut, maka aktivitas fungsional lacZ di plasmid terganggu, sehingga tidak dihasilkan ß-galaktosidase yang fungsional, akibat substrat tidak bereaksi menghasilkan warna biru. Prinsip seleksi koloni biru putih bermanfaat untuk membedakan transforman dengan koloni lainya (Glick & Pasternak 2003). Seleksi transforman hanya menggambarkan masuk tidaknya konstruksi DNA ke dalam inang. Untuk membedakan rekombinasi yaitu koloni yang membawa konstruksi DNA dengan plasmid non rekombinasi perlu dilakukan uji ekspresi klon gen pada media tertentu.
11
Keberhasilan transformasi dipengaruhi oleh: jenis plasmid yang digunakan, suhu, jumlah dan ukuran DNA, lama perlakuan, adanya enzim nuclease pada sel inang, lama dan cara pemberiannya kejutan panas, spesifitas panas, kekuatan ion, konformasi dan konsentrasi DNA. Untuk menghindari religasi vektor plasmid maka alkalin fosfatase dapat digunakan sehingga tidak muncul transforman yang tidak mengandung insert (Glick & Pasternak 2003).
Ekspresi Gen
Proses ekspresi gen merupakan proses transformasi informasi genetik melalui transkripsi dan translasi, untuk pembentukan protein atau enzim. Protein dan enzim sangat penting dalam proses metabolisme, sehingga ekspresi gen sebenarnya merupakan proses pengendalian metabolisme oleh gen (Jusuf 2009).
Secara umum dikenal dua sistem regulasi ekspresi gen, yaitu regulasi positif dan negatif. Regulasi ekspresi gen melibatkan suatu operon lac. Operon lac adalah operon yang dibutuhkan dalam transpor dan metabolisme dari laktosa di E.coli. Operon ini diregulasi oleh berbagai faktor seperti adanya glukosa dan laktosa. Gen struktural pada operan lac tersebut baru akan aktif bila ada induksi dari laktosa. Sistem regulasinya terjadi pada tahapan transkripsinya karena energi yang diperlukan akan menjadi lebih sedikit dan efisien. Bila tidak ada laktosa, gen lacI akan menghasilkan protein represor yang mengikat operator lac dan mencegah terjadinya transkripsi karena enzim RNA polimerase tidak lagi dapat melekat di situs tersebut. Akan tetapi, saat laktosa ditambahkan ke dalam mediumnya, represor LacI akan terlepas karena terikat pada alolaktosa lalu transkripsi ketiga gen struktural akan berjalan (Kimball 2006).
Setiap protein rekombinan yang diekspresikan pada E. coli dapat mengganggu dalam fungsi sel secara normal, dan bahkan ada yang beracun bagi bakteri. Vektor plasmid sebagai pembawa DNA sisipan adalah molekul DNA yang telah terkarakterisasi dengan baik, yang memungkinkan introduksi molekul DNA rekombinan ke sel inang yang sesuai, serta memungkinkan bertahan stabil dalam sel iang. Sebuah vektor plasmid harus memiliki fungsi (1) origin of replication (ori) dan gen-gen lain yang memungkinkan molekul ini bereplikasi
12
sebagai elemen ekstra kromosomal, (2) penanda seleksi, biasanya merupakan gen-gen penyandi resistensi terhadap senyawa toksik, seperti antibiotik, dan (3) situs-situs enzim restriksi unik sebagai situs kloning sisipan DNA. Plasmid yang berkualitas tinggi biasanya berukuran kecil, berbentuk sirkular, dan mempunyai banyak jumlah kopi (Glick & Pasternak 2003).
Salah satu pendekatan untuk mengendalikan ekspresi adalah dengan menggunakan vektor ekspresi yang mengandung T7 lac promoter (Studier et al. 1990). Sistem pET adalah alat ekspresi protein yang kuat, karena dapat mengatur ekspresi protein dengan T7 / T7 lac promoter, pLysS atau host pLysS E (Novagen 2003). Vektor pET-21b merupakan vektor ekspresi yang memiliki promoter T7, yang semakin optimal dengan adanya elemen operator yang mengandung runutan operator lac yang mampu meningkatkan ikatan repressor lac dan memastikan rendahnya represi promoter T7.
pET-21b berukuran sekitar 5.4 kb yang memiliki promoter T7, lacO, synthetic ribosome-binding site (RBS), ATG (start codon), runutan 6xhis-tag, multiple cloning site (MCS) dan stop codons (Gambar 5). Vektor ini memiliki situs yang resisten terhadap ampisilin. Plasmid pET-21b dapat ditransformasi dalam sel E. coli BL21(DE3)pLysS. Ekspresi protein diinduksi dengan penambahan isopropyl-thio-D-galactoside (IPTG).
13
Vektor pET-21b menghasilkan 6xhis-tag pada ujung C dari protein yang terekspresi. His-tag ini memudahkan dalam proses purifikasi karena afinitasnya terhadap resin nickel-nitrilotriacetic (Ni-NTA) (Qiagen 2003). pET-21b mempunyai kelebihan antara lain: mampu mengatur transkripsi gen target, hanya membutuhkan induser dengan konsentrasi yang kecil untuk dapat mengekspresikan gen target, dan hampir semua sel dari gen target terekspresi (Novagen 2003).
Menurut Glick & Pasternak (2003), penyisipan gen dalam suatu vektor tidak memberikan jaminan bahwa gen yang bersangkutan akan diekspresikan. Proses-proses dalam ekspresi suatu protein antara lain: (1) transkripsi, (2) translasi, (3) proses proteolitik dan degradasi, (4) lokalisasi seluler, (5) pelipatan protein, dan (6) pertumbuhan sel.
Laju ekspresi gen asing sangat tergantung pada karakteristik organisme inang yang digunakan. Pada umumnya produksi protein rekombinan masih menggunakan E.coli sebagai inang. Keunggulan produksi protein rekombinan dengan E. coli adalah produksi cepat dan murah, informasi genetik, karakteristik biologi molekuler, biokimia, dan fisiologinya paling banyak diketahui dan diteliti. Namun demikian, penggunaan sistem inang dengan E. coli mempunyai kelemahan. Kelemahan tersebut antara lain: (1) Sinyal transkripsi dan translasi spesies lain tidak dikenali dengan baik oleh inang E. coli, sehingga ekspresi gen-gen heterolog di E. coli lemah, (2) sulit mempelajari fungsi gen-gen-gen-gen dengan lintasan metabolic dan pengaturan yang tidak terdapat di E. coli, seperti degradasi hidrokarbon, dan (3) kemungkinan toksisitas dari produk-produk gen-gen heterolog terhadap sel E. coli. Selain hal-hal tersebut di atas, ada masalah serius pada ekspresi protein rekombinan pada E. coli, yaitu degradasi protein produk secara cepat dan seringkali protein rekombinan terakumulasi dalam sel inang dalam bentuk agregat kompak, bersifat inaktif tak larut, yang disebut badan inklusi (inclusion bodies). Hal ini terjadi akibat keterbatasan E. coli membentuk struktur tiga dimensi protein secara benar dalam proses pelipatan pasca translasi (Glick & Pasternak 2003).
Ekspresi gen pada E. coli untuk produksi antibodi suatu virus tanaman telah dilakukan oleh Kubota et al. (2011) untuk membuat antibodi terhadap Cucurbit
14
chlorotic yellow virus (CCYV), Fajardo et al. (2007) Grapevine leafroll associated virus 3 (GLRaV-3), Abouzid et al. (2002) terhadap empat Begomovirus, yaitu Bean golden mosaic virus (BGMV) isolat Brazil, Cabbage leaf curl virus (CabLCV), Tomato yellow leaf curl virus (TYLCV), dan Tomato mottle virus (ToMV), Cotillon et al. (2005) Cucurbit yellow stunting disorder crinivirus (CYSDV), dan Nickel et al. (2004) Apple stem grooving virus (ASGV). Keunggulan penyediaan antibodi dengan metode ini antara lain: protein yang dihasilkan bersifat spesifik sehingga tidak bereaksi terhadap protein tanaman, dapat tersedia antigen dalam jumlah yang mencukupi setiap saat apabila diperlukan untuk produksi antiserum, (Cotillon et al. 2005).
15
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilakukan di Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dan Laboratorium Biokimia Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian (BB-BIOGEN) sejak Maret 2009 hingga April 2011.
Tanaman Sumber Virus
Koleksi dan Pengumpulan Tanaman Sakit. Koleksi dan pengumpulan
tanaman sakit dilakukan di sentra produksi tomat di Cikajang-Garut (pada ketinggian 1287 m dpl), Cipanas-Cianjur (1225 m dpl). Pengamatan ditujukan terhadap tanaman tomat yang bergejala klorosis, yaitu klorosis diantara tulang daun, daun berwarna keunguan dan nekrotik, serta mudah rapuh. Tanaman tomat yang menunjukkan gejala tersebut kemudian diambil bagian pucuk daun yang berkembang penuh, dan ditempatkan di dalam coolbox agar daun tersebut tetap segar sampai di laboratorium sebelum diberi perlakuan lebih lanjut. Keberadaan TICV pada sampel daun yang diambil dipastikan melalui metode RT-PCR.
Deteksi TICV dan ToCV dengan RT-PCR. Sebanyak 0.1 g jaringan daun
tomat didinginkan dengan nitrogen cair, kemudian dilumatkan dengan mortar sampai menjadi tepung halus dan RNA total diekstraksi menggunakan RNeasy Plant Mini Kits (Qiagen). RNA hasil ekstraksi disintesis menjadi cDNA dengan menggunakan teknik RT. Reaksi RT dibuat dengan total volume 10 µl yang mengandung 2 µl RNA total, 1 µl buffer RT 10X, 0,35 µl 50 mM DTT (dithiothreitol), 2 µl 10 mM dNTP (deoksiribonukleotida triphosphat), 0,35 µl M-MuLV Rev, 0,35 µl RNase inhibitor, 0,75 µl oligo (dT), dan 3,2 µl H2O. Reaksi
RT dilakukan dalam sebuah Automated Thermal cycler (Gene Amp PCR System 9700; PE Applied Biosystem, USA) yang diprogram untuk satu siklus pada suhu 25ºC selama 5 menit, 42ºC selama 60 menit, dan 70ºC selama 15 menit. Siapan cDNA hasil RT digunakan sebagai template dalam reaksi PCR. Reaktan PCR dengan total volume 25 µl terdiri atas 1 µl masing-masing primer spesifik ToCV (ToCV-CP R-Hind:
5’-16
AATTAAAAGCTTTTAGCAACCAGTTATCGATGCAAG-3’ dan ToCV-CP F-Bam no ATG: 5’-AATTAAGGATCCGAGAACGATGCTGTTAC-3’) dan spesifik TICV (TICV–CP F-Bam no ATG ( 5’-AATTAAGGATCCGAAAACTTATCTGGTAATGCAAAC-3’ dan TICV–CP R-Hind 5’-AATTAAAAGCTTTTAGCATGGGTGTTTCATATCAGCC-3’), 2,5 µl buffer PCR 10X + Mg2+, 0,5 µl 10 mM dNTP, 2,5 µl sucrose cresol 10X, 0,3 µl Taq DNA polymerase, 14,2 µl H2O, dan 1 µl DNA template. PCR dilakukan pada
Automated Thermal cycler (Gene Amp PCR System 9700; PE Applied Biosystem, USA). Proses ini didahului dengan denaturasi awal pada 94ºC selama 4 menit, dilanjutkan dengan 30 siklus yang terdiri dari denaturasi pada 94ºC selama 1 menit, penempelan primer (annealing) pada 55ºC selama 1 menit, dan pemanjangan (Extension) pada 72ºC selama 2 menit, dan diikuti pemanjangan akhir pada 72ºC selama 10 menit. Amplikon hasil PCR dielektroforesis dengan 1% agarose gel yang mengandung ethidium bromida (EtBr) dan TAE bufer dengan voltase 50V selama 60 menit. Hasil elektroforesis divisualisasikan dengan Transluminator UV dan didokumentasikan dengan kamera digital.
Karakterisasi Gen CP TICV
Ekstraksi RNA Total. Ekstraksi RNA total dilakukan dengan
menggunakan RNeasy Plant Mini Kits (Qiagen) dan dikerjakan sesuai dengan protokol yang diberikan (Qiagen 2003). Sebanyak 0.1 g daun tomat yang didinginkan dengan nitrogen cair dilumatkan sampai menjadi tepung halus dengan menggunakan mortar steril. Hasil gerusan dimasukkan dalam tabung mikro 2 ml dan ditambahkan buffer ekstraksi (RLT) yang mengandung 1% merkaptoetanol. Setelah divortek 1 menit, sampel diinkubasi pada suhu 56 °C selama 10 menit, kemudian dimasukkan ke dalam QIA shredder spin column yang ditempatkan pada tabung koleksi 2 ml dan disentrifugasi pada kecepatan 13000 rpm selama 2 menit. Selanjutnya supernatan dipindahkan ke dalam tabung mikro 2 ml dan ditambah dengan 0.5 volume etanol 96% (± 225 µl), lalu dimasukan ke dalam RNeasy mini column pink di dalam tabung koleksi 2 ml. Setelah disentrifugasi dengan kecepatan 10000 rpm selama 15 detik, mini column dicuci dua kali dengan 700 µl buffer RW1 dan 500 µl bufer RPE serta disentrifugasi dengan kecepatan yang sama selama 2 minit. Cairan yang ada dalam tabung koleksi
17
dibuang dan mini column diletakan balik dalam tabung koleksi untuk dikeringkan dengan cara disentrifugasi dengan kecepatan 10000 rpm selama 2 menit. RNA total yang terikat dalam mini column dielusi dengan 40 µl RNAse free water ke dalam Rneasy dan disentrifugasi dengan kecepatan 10000 rpm selama 1 menit dalam tabung mikro yang baru setelah didiamkan selama 10 menit.
Sintesis complementary (c) DNA. RNA hasil ekstraksi disintesis menjadi
cDNA dengan menggunakan teknik Reverse Transcription Polymerase Chain Reaction (RT-PCR). Reaktan RT-PCR dibuat dengan total volume 10 µl yang mengandung 2 µl RNA total, 1 µl buffer RT 10X, 0,35 µl 50 mM DTT (dithiothreitol), 2 µl 10 mM dNTP (deoksiribonukleotida triphosphat), 0,35 µl M-MuLV Rev, 0,35 µl RNase inhibitor, 0,75 µl oligo (dT), dan 3,2 µl H2O.
Komponen-komponen tersebut digunakan untuk satu kali reaksi RT. Reaksi RT dilakukan dalam sebuah Automated Thermal cycler (Gene Amp PCR System 9700; PE Applied Biosystem, USA) yang diprogram untuk satu siklus pada suhu 25ºC selama 5 menit, 42ºC selama 60 menit, dan 70ºC selama 15 menit. Siapan cDNA hasil RT digunakan sebagai template dalam reaksi PCR.
Amplifikasi Gen CP-TICV dengan PCR. Reaktan PCR dengan total
volume 25 µl terdiri atas 1 µl masing-masing primer, 2,5 µl buffer PCR 10X + Mg2+, 0,5 µl 10 mM dNTP, 2,5 µl sucrose cresol 10X, 0,3 µl Taq DNA polymerase, 14,2 µl H2O, dan 1 µl cDNA. PCR dilakukan pada Automated
Thermal cycler (Gene Amp PCR System 9700; PE Applied Biosystem, USA). Proses ini didahului dengan denaturasi awal pada 94ºC selama 4 menit, dilanjutkan dengan 30 siklus yang terdiri dari denaturasi pada 94ºC selama 1 menit, penempelan primer (annealing) pada 55ºC selama 1 menit, dan pemanjangan (Extension) pada 72ºC selama 2 menit. Khusus untuk siklus terakhir ditambahkan 10 menit pada 72ºC untuk sintesis poliadenalin (poli A) yang diperlukan kloning ke dalam T-A cloning vector (pGEMT-Easy (Promega)), dan siklus berakhir pada suhu 4ºC. Produk PCR dielektroforesis dalam 1% agarose gel yang mengandung ethidium bromida dan TAE bufer dengan voltase 50V selama 60 menit. Hasil elektroforesis divisualisasikan dengan Transluminator UV dan didokumentasikan dengan kamera digital.
18
Perunutan Nukleotida dan Asam Amino Gen CP-TICV. Sebanyak
50µl PCR sampel yang positif mengandung CP-TICV dikirim ke PT. Macrogen Incorporation (Korea Selatan). Hasil perunutan nukleotida dan asam amino kemudian digunakan untuk analisis kesejajaran dengan runutan nukleotida dan asam amino TICV yang telah dipublikasikan di GenBank dengan program BLAST (Basic Local Alignment Search Tools) (NCBI 2010). Analisis filogenetika dilakukan menggunakan program PHYLIP versi 3.6 (University of Washington). Sebelum dianalisis, runutan nukleotida semua isolat yang terpilih dimodifikasi dengan software Clustal X 1.83 untuk menyamakan format runutannya. Matrik jarak genetika dihitung dengan menggunakan matrik parameter dalam program komputer DNA ML dan untuk runutan asam amino CP menggunakan ProML. Pohon filogenetika digambarkan dengan program DRAWTREE dalam paket program PHYLIP. Analisis boostrap dengan 1000 ulangan dilakukan menggunakan program SEQBOOT dan konsensus pohon filogenetika dibuat dengan program CONSENSE. Pohon filogenetik digambarkan dengan program Mega 4 dalam paket program PHYLIP.
Ekspresi Gen CP-TICV pada E. coli strain BL21(DE3)pLysS
Kloning CP-TICV. Kloning gen CP-TICV telah dilakukan di Jepang
(kerjasama dengan Utsunomiya University). Hasilnya plasmid pGEM-CP yang ditransformasi ke dalam E.coli strain DH5α.
Konstruksi Vektor Ekspresi. Ekpresi gen CP-TICV dalam pET-21b(+)
dilakukan dengan menggunakan promoter T7. Gen CP-TICV disisipkan pada tempat pemotongan BamHI/HindIII yang terletak antara promoter T7 pada ujung depan setelah start kodon dan 6xhis-tag pada ujung belakang sebelum stop kodon dari pET-21b(+) sehingga terbentuk pET21-CP.
Persiapan Kompeten Sel E. coli strain BL21(DE3)pLysS. Stok E. coli strain BL21(DE3)pLysS dalam gliserol digores pada media LB agar yang mengandung antibiotik Ampisilin 50 µg/ml dan Kloramfenikol 20 µg/ml, kemudian diinkubasi pada suhu 37 °C semalam. Satu kultur biakan E. coli semalam dipindahkan ke dalam 5 ml LB broth yang mengandung antibiotik
19
kemudian diinkubasi pada suhu 37 °C semalam. Sekitar 2 ml kultur semalam tersebut diambil dan dipindahkan ke dalam 40 ml media A (LB, MgSO47H2O 10
mM, gukosa 0.2%), lalu diinkubasi selama 2 jam. Setelah 2 jam kultur bakteri dipindahkan ke tabung Falcon steril dan diinkubasi dalam es selama 10 menit. Sentrifugasi biakan yang berada pada tabung Falcon dengan kecepatan 4000 rpm, selama 15 menit pada suhu 4 °C. Supernatan dibuang dan diambil peletnya. Pelet diresuspensi dengan 2.5 ml media B (LB, glyserol 36%, PEG 7000 12%, dan MgSO47H2O 12 mM). Siapan bakteri tersebut kemudian dipindahpisahkan
masing-masing 100 µl ke tabung eppendorf 1.5 ml dan disimpan di freezer -80 °C sampai digunakan untuk transformasi (Nishimura et al. 2003).
Transformasi. Sebelum dilakukan transformasi terlebih dahulu dilakukan
ligasi antara fragmen CP-TICV dengan vektor ekspresi pET-21b(+) (Novagen, Germany) yang masing-masing telah dipotong dengan enzim restriksi BamH1 dan HindIII. Ligasi dilakukan dalam volume 10 µl yang terdiri dari plasmid pET-21b 2 µl, CP-TICV 2 µl, buffer T4 DNA ligase 2x sebanyak 5 µl, dan T4 DNA ligase 1 µl (3 U/µl). Kemudian diinkubasi pada suhu 4oC selama 16 jam. Transformasi dilakukan dengan mencampur 10 µl hasil ligasi dengan 100 µl sel kompeten BL21(DE3)pLySs. Terhadap siapan ini berturut-turut dilakukan diinkubasi dalam es batu selama 20 menit, heat shock pada suhu 42 °C selama 1 menit, didinginkan dalam es batu selama 2 menit, ditambahkan 500 µl LB cair, dan diinkubasi dengan dishaker pada suhu 37 °C selama 4 jam, kemudian disentrifuse 12000 rpm 1 menit, supernatan dibuang, pelet dan LB yang masih tersisa sampai 100 µl dihomogenasi, dan terakhir ditumbuhkan dalam media LB agar yang telah diberi ampisilin 50 µg/ml dan kloramfenikol 20 µg/ml.
(Sambrook & Russel 2001).
Konfirmasi Transforman. Untuk mengonfirmasi transforman yang
membawa plasmid pET21-CP maka transforman ditumbuhkan pada media LB cair yang mengandung 50 μg/ml ampisilin dan 20 μg/ml kloramfenikol. Sel dari biakan yang berumur 18 jam dipanen dan diisolasi palsmidnya dengan metode alkalin lisis (Sambrook & Russel 2001). Plasmid pET21-CP dipotong dengan enzim restriksi BamHI dan HindIII. Selain dicek dengan pemotongan menggunakan enzim restriksi, klon rekombinan dicek dengan PCR.
20
Isolasi Plasmid dengan Metode Alkalin Lisis. Satu koloni bakteri
diinokulasi ke dalam 10 ml LB dan diinkubasi semalam pada suhu 37 °C, kemudian dipindahkan ke tabung eppendorf 1.5 ml dan disentrifugasi 12.000 rpm pada 4 °C selama 2 menit. Setelah itu supernatan dibuang. Resuspensi pelet dengan 100 µl larutan I (50 mM glukosa, 10 mM EDTA, 25 mM Tris pH 8.0, 2 mg/ml lisozyme (ditambahkan saat akan digunakan)), kemudian divortex, ditambahkan 200 µl larutan II (0.2 M NaOH, 1% SDS dibuat saat akan digunakan), divortex, ditambahkan 150 µl larutan III (3 M NaOAc pH 4.8), tabungnya dibolak-balik agar bercampur, disentrifuse 12.000 rpm selama 5 menit. Supernatan dipindahkan ke tabung eppendorf baru, ditambahkan 300 µl phenol kloroform, vortex, sentrifuse 12.000 rpm 5 menit. Larutan yang paling atas dipindahkan ke tabung yang baru, kemudian ditambahkan etanol absolut 2 x volume, sentrifuse 12.000 rpm selama 20 menit, supernatan dibuang, dicuci dengan 800 µl etanol 70%, vortex, disentrifuse 12.000 rpm 5 menit, supernatan dibuang, pelet dikering-anginkan, kemudian diresuspensi dengan 30 µl buffer TE atau ddH2 O (Sambrook & Russel 2001).
Koloni PCR. Satu klon transforman diambil dengan tusuk gigi, kemudian
dimasukkan ke dalam tabung eppendorf yang telah diisi dengan ddH2O 10 µl,
kemudian diinkubasi pada suhu 95 °C selama 10 menit, setelah itu dimasukkan ke dalam komponen PCR. Koloni tersebut digunakan sebagai templatenya. Reaktan PCR dilakukan dengan volume total 12.5 µl, terdiri dari 2.5 µl buffer PCR (500 mM KCl; 100 mM Tris-HCl, pH 9; 1% Triton X-100), dan 0.3 µl taq DNA polymerase, H2O 7.2 µl, dNTP 10 mM 0.5 µl, primer forward TICV – CP
AATTAAGGATCCGAAAACTTATCTGGTAATGCAAAC dan primer reverse TICV – CP AATTAAAAGCTTTTAGCATGGGTGTTTCATATCAGCC masing-masing 1 µl. Reaksi PCR dilakukan dengan Perkin Elmer 480 Thermocycler dan dikondisikan untuk denaturasi inisiasi pada 94 °C selama 4 menit, kemudian dilanjutkan 30 siklus yang terdiri dari denaturasi 94 °C selama 1 menit, penempelan primer (annealing) pada suhu 55 °C selama 1 menit, pemanjangan pada suhu 72 °C selama 2 menit, dan diikuti pemanjangan akhir pada suhu 72 °C selama 10 menit. Hasil koloni PCR dielektroforesis pada gel agarose 1% dalam TAE buffer yang mengandung EtBr dengan voltase 90 V
21
selama 30 menit. Hasil elektroforesis divisualisasikan dengan Transluminator UV dan didokumentasikan dengan kamera digital.
Pemotongan pET-21CP dengan Enzim Restriksi. Plasmid pET 21-b(+)
dipisahkan dengan insertnya (CP-TICV) dengan menggunakan enzim restriksi BamHI dan HindIII dengan komposisi 1 µl plasmid pET 21-CP, 1 µl enzim restriksi BamHI dan HindIII, 1 µl buffer 2, dan dd H2O 7 µl. Larutan tersebut
diinkubasi 37 °C selama 3 jam. Hasil pemotongan dengan enzim restriksi dielektroforesis pada gel agarose 1% dalam TAE buffer yang mengandung EtBr dengan voltase 90 V selama 30 menit. Hasil elektroforesis divisualisasikan dengan Transluminator UV dan didokumentasikan dengan kamera digital.
Purifikasi Protein CP-TICV
Kultur Ekspresi. E.coli strain BL21 (DE3)pLysS yang membawa plasmid rekombinan pET21-CP diinokulasi ke dalam 3 ml media LB yang mengandung
50 μg/ml ampisilin dan 20 μg/ml kloramfenikol. Biakan diinkubasi di dalam
orbital shaker (75 rpm) pada suhu 37 oC semalam. Kemudian sebanyak 100 μl biakan di inokulasikan ke dalam 10 ml media LB yang mengandung antibiotik dan diinkubasikan di dalam orbital shaker (75 rpm) pada suhu 37 oC. Setelah pertumbuhan bakteri mencapai OD600 0.5 (kira-kira 5-6 jam), biakan diinduksi
dengan 1 mM IPTG dan diinkubasikan semalam. Sel bakteri yang mengekpresikan protein rekombinan dipanen dengan sentrifugasi (12.000 rpm, 4oC, 15 menit) dan dilisis dengan buffer B-7M Urea 300 µl dan turbonuclease 3 Unit/ml kultur (0.4 µl) (Nacalai, Japan). Sel hasil lisis disentrifugasi dengan kecepatan 12.000 rpm pada suhu 4oC selama 15 menit. Protein rekombinan yang ada dalam supernatan (soluble protein) dan pelet (insoluble protein) dianalisis dengan analisis SDS-PAGE.
Purifikasi dengan NiNTA Spin Column pada Kondisi Denaturasi. Sel
dicairkan selama 15 menit dan diresusupensi dengan 300 µl buffer B-7M urea dan ditambahkan dengan 0.4 µl turbonuclease (Nacalai, Japan), kemudian sel diinkubasi dengan agitasi selama 15 menit pada suhu 20oC. Lysate disentrifugasi pada 12000 rpm selama 30 menit pada suhu ruang, supernatan diambil. Ekuilibrasi NI-NTA (Nickel nitrilotriacetic acid) spin column (Qiagen) dengan 600 µl buffer B-7M urea, disentrifugasi dengan kecepatan 2900 rpm selama 2
22
menit. 600 µl supernatan jernih yang mengandung protein 6xHis-tagged diambil dan dimasukkan pada Ni-NTA spin column (Qiagen). Kemudian disentrifugasi dengan kecepatan 1600 rpm selama 5 menit dan diambil bawahnya, dimasukkan ke tabung mikro untuk dianalisis SDS-PAGE. Kemudian Ni-NTA spin column dicuci dengan 600 µl buffer C, disentrifugasi 2900 rpm selama 2 menit, dilakukan sebanyak dua kali. Kemudian protein dimurnikan (elusi) dua kali dengan menambahkan 200 µl buffer E, disentrifugasi 2900 rpm selama 2 menit dan hasil elusi disimpan pada -20 oC sampai digunakan untuk analisis SDS-PAGE.
Analisis SDS-PAGE. Setelah diperoleh protein murni, dilakukan analisis
SDS-PAGE (Laemmli 1970). Sebanyak 10.000 µl separating gel 12,5% 0.375 M tris pH 8.8 dibuat dengan mencampur akuades 3355 µl, tris HCl 1.5 M pH 8.8 2500 µl, SDS 10% 100 µl, acrylamide/bis 4000 µl, amonium persulfat (APS) 10% 35 µl, dan temed (Merck) 10 µl, kemudian dipipet pada cetakan gel. Setelah separating gel membeku maka stacking gel 4% 0.125 M tris pH 6.8 dibuat dengan mencampur akuades 3027.5 µl, tris HCl 0.5 M pH 6.8 1250 µl, SDS 10% 50 µl, acrylamide/bis 650 µl, APS 10% 17.5 µl, dan temed (Merck) 5 µl, kemudian dipipet dan diletakkan diatas separating gel yang sudah membeku dan stacking gel ditunggu sampai membeku. Setelah stacking gel membeku, dipindahkan ke dalam alat elektroforesis. Sebanyak 10 µl marker protein (Fermentas) dan 60 µl (30 µl hasil purifikasi + 30 µl loading buffer (Sigma)) didenaturasi pada suhu 95
oC selama 10 menit. Sekitar 10 µl marker dipipet dan dimasukkan ke dalam gel
yang diletakkan pada alat elektroforesis, sedangkan untuk hasil purifikasi yang telah dicampur dengan loading buffer diambil 15 µl dan dimasukkan ke dalam gel yang diletakkan pada alat elektroforesis.
Elektroforesis dilakukan dengan Biorad power pac 300 selama 2 jam dengan voltase 150 V. Kemudian gel hasil elektroforesis dilepas dari cetakannya dan dimasukkan ke dalam larutan staining (coomassie brilliant blue R-250, metanol, asam asetat glasial) dan dishaker semalaman, setelah itu dicuci dengan larutan distaining (metanol, asam asetat glasial, aquades) sampai gel terlihat bening dan pita protein terlihat berwarna biru, hasilnya kemudian difoto.
23
HASIL DAN PEMBAHASAN
TICV Isolat Indonesia
Penyakit klorosis saat ini sudah ditemukan di Indonesia. Pertama kali ditemukan di sentra pertanaman tomat di Magelang, Jawa Tengah dan Purwakarta, Jawa Barat (Hartono & Wijonarko 2007). Berdasarkan hasil survei Fitriasari (2010), penyakit klorosis telah ditemukan menyerang areal pertanaman tomat di daerah Bogor, Cianjur, dan Garut dengan persentase kejadian penyakit yang berbeda-beda.
Koleksi dan pengumpulan tanaman bergejala klorosis yang dilakukan di daerah Cipanas-Cianjur dan Cikajang-Garut Jawa Barat berhasil mendapatkan tanaman tomat yang terinfeksi TICV. Varietas tanaman tomat yang ditanam antara lain: Synta, Marta, dan Warani. Menurut pengamatan di lapangan, semua varietas yang ditanam oleh petani di Cikajang-Garut dan Cipanas dapat menunjukkan gejala klorosis akibat infeksi TICV. Hal ini menunjukkan bahwa varietas yang ditanam diwilayah tersebut rentan terhadap TICV. Selain varietas yang ditanam rentan, sistem pertanaman yang dilakukan oleh petani adalah monokultur, sehingga menyebabkan tingkat serangan TICV yang tinggi, karena sumber inokulumnya selalu ada.
Adanya serangga vektor TICV T. vaporariorum memperluas penyebaran virus ini dari satu tanaman ke tanaman yang lain.Populasi T. vaporariorum sangat tinggi pada musim kemarau sehingga penyebaran virus terjadi secara meluas dan merata pada pertanaman tomat, hal ini sesuai dengan penelitian Fitriasari (2010).
Korelasi antara penyebaran penyakit klorosis dengan populasi kutukebul T. vaporariorum juga telah dibuktikan dalam penelitian Navas-Castillo et al. (2000) yang menyatakan bahwa tingkat kejadian penyakit klorosis di lapangan berkorelasi positif dengan tingkat populasi kutukebul. Budidaya tanaman tomat di Indonesia selalu mendapatkan cekaman infeksi TICV karena varietas tanaman yang ditanam rentan, sehingga petani terancam menanggung kerugian.
Gejala penyakit klorosis di lapangan ditunjukkan adanya warna kuning pada bagian tulang daun (interveinal yellowing) yang dimulai pada daun
24
terbawah, kemudian berkembang cepat secara merata ke daun-daun bagian atasnya (Gambar 4 A dan D). Pada serangan klorosis yang parah akan menyebabkan daun menjadi rapuh dan berubah warna menjadi ungu keabu-abuan (bronzing) (Gambar 4 E) dan lama kelamaan daun mengalami nekrotik (Gambar 4 B dan F). Hal ini menyebabkan proses fotosintesis terganggu sehingga ukuran buah mengecil dan mengakibatkan penurunan produksi (Gambar 4 C) (Wisler et al. 1998).
Walaupun gejala klorosis yang disebabkan TICV ini sangat khas pada tanaman tomat, namun pada kondisi lingkungan tertentu gejala klorosis mirip dengan gejala kekurangan unsur hara tertentu (Duffus et al. 1994). Selain sering dikacaukan dengan gejala kekurangan unsur hara tertentu, gejala penyakit klorosis pada tanaman tomat di lapangan, juga dapat sama dengan gejala yang disebabkan oleh virus lain yang sering berasosiasi dengan TICV di lapangan. Virus ini adalah Tomato chlorosis virus (ToCV) yang juga merupakan anggota dari genus Crinivirus. Pada pengamatan di lapangan, ToCV juga telah ditemukan, akan tetapi gejala penyakit klorosis yang disebabkan oleh TICV maupun ToCV dilapangan tidak dapat dibedakan. Sehingga untuk memastikan penyebab penyakit klorosis pada tomat di lapangan dilakukan deteksi RT-PCR dengan primer yang spesifik. Oleh karena itu, agar tidak terjadi kesalahan diagnosis yang kemudian mengakibatkan kesalahan dalam tindakan pengendalian, maka diperlukan metode deteksi yang akurat.
25
Gambar 4 Gejala penyakit klorosis di lapangan, A dan D: interveinal yellowing, B dan F: nekrotik, C: produksi buah menurun, dan E: bronzing.
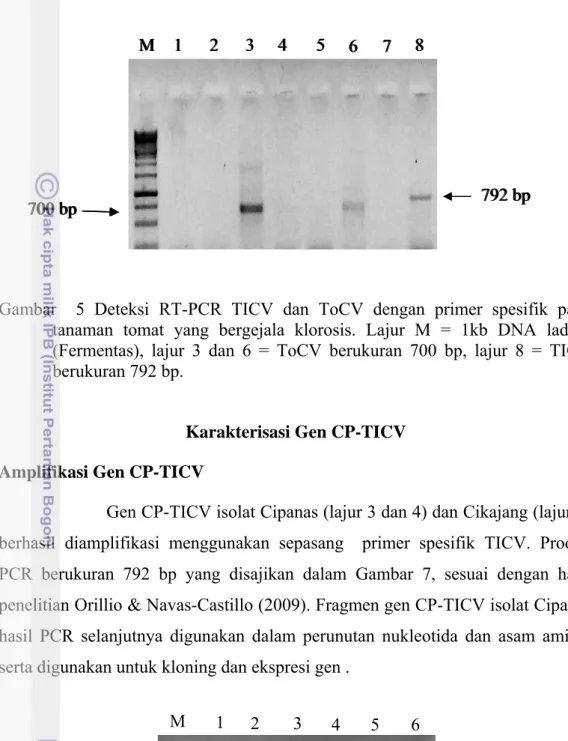
Gejala penyakit yang disebabkan oleh TICV maupun ToCV tidak dapat dibedakan (Dovas et al. 2002). Namun, jika dilakukan deteksi melalui deteksi molekuler dengan menggunakan metode RT-PCR, maka akan diperoleh hasil yang berbeda. Berdasarkan hasil penelitian, setelah dilakukan amplifikasi, ternyata panjang fragmen DNA TICV lebih panjang daripada panjang fragmen DNA ToCV (Gambar 5). Deteksi RT-PCR menggunakan primer spesifik ToCV berhasil mendapatkan fragmen DNA ToCV yang berukuran 700 bp dan dengan primer spesifik TICV berhasil mendapatkan fragmen DNA TICV yang berukuran 792 bp (Gambar 5). Teknik RT-PCR merupakan modifikasi dari teknik PCR. Metode RT-PCR merupakan metode yang sangat sensitif karena dapat mendeteksi virus pada konsentrasi rendah (Ram et al. 2005).
A B C
26
Gambar 5 Deteksi RT-PCR TICV dan ToCV dengan primer spesifik pada tanaman tomat yang bergejala klorosis. Lajur M = 1kb DNA ladder (Fermentas), lajur 3 dan 6 = ToCV berukuran 700 bp, lajur 8 = TICV berukuran 792 bp.
Karakterisasi Gen CP-TICV Amplifikasi Gen CP-TICV
Gen CP-TICV isolat Cipanas (lajur 3 dan 4) dan Cikajang (lajur 2) berhasil diamplifikasi menggunakan sepasang primer spesifik TICV. Produk PCR berukuran 792 bp yang disajikan dalam Gambar 7, sesuai dengan hasil penelitian Orillio & Navas-Castillo (2009). Fragmen gen CP-TICV isolat Cipanas hasil PCR selanjutnya digunakan dalam perunutan nukleotida dan asam amino, serta digunakan untuk kloning dan ekspresi gen .
750 bp 1000 bp 792 bp M 1 2 3 4 5 6 5 M 1 2 3 4 6 7 8 792 bp 700 bp 5 M 1 2 3 4 6 7 8 792 bp 700 bp
27
Gambar 6 Amplifikasi Gen CP-TICV berhasil mendapatkan fragmen DNA yang berukuran sekitar 792 bp menggunakan pasangan primer spesifik terhadap daun tomat yang sakit dari Cipanas (lajur 3 dan 4)), dan Cikajang (lajur 2 dan 4). Lajur 1 adalah 1 kb DNA ladder (Fermentas).
Metode deteksi virus yang akurat dan banyak dikembangkan saat ini adalah berdasarkan pendekatan molekuler. Teknik PCR merupakan cara cepat untuk mengamplifikasi DNA secara invitro. Identifikasi virus dengan teknik PCR didasarkan pada sifat primer yang spesifik (Sambrook et al. 1989).
Perunutan Nukleotida dan Asam Amino Gen CP-TICV
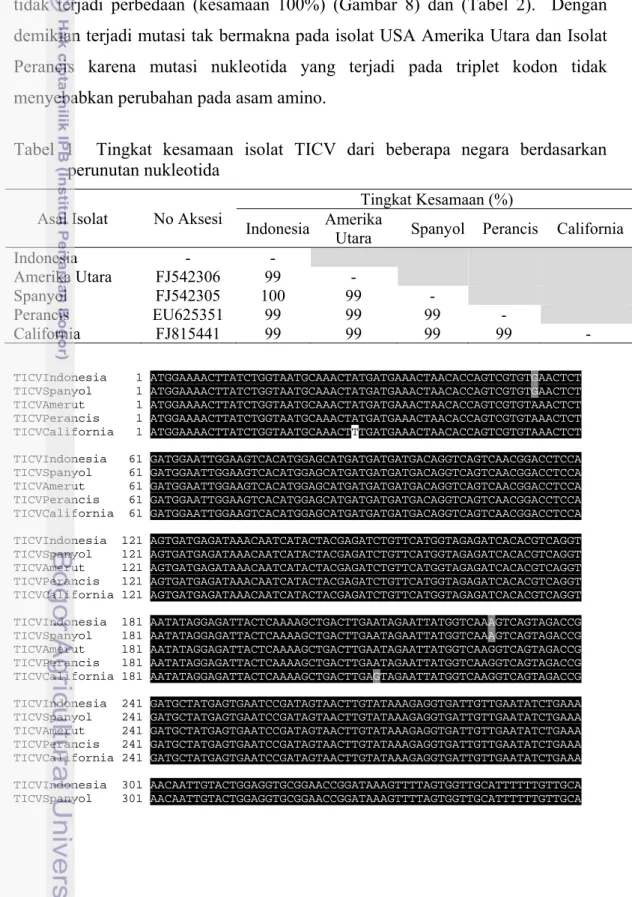
Hasil perunutan menunjukkan kualitas yang sangat baik dan tidak ada sequencing error berdasarkan analisis alignment two sequences (http://blast.ncbi.nlm.nih.gov/). Analisis kekerabatan TICV isolat Indonesia yang dibandingkan dengan empat sikuen gen CP-TICV pada Genbank (http://blast.ncbi.nlm.nih.gov/) menunjukkan hubungan tingkat kesamaan yang tinggi (99-100%) (Tabel 1). Isolat TICV Indonesia memiliki hubungan kekerabatan yang dekat dengan isolat lainnya dari beberapa negara. Isolat TICV Indonesia memiliki kesamaan dan dapat dikatakan merupakan strain yang sama dengan isolat Spanyol (100%). Jika dibandingkan dengan tiga isolat lainnya yaitu isolat Amerika Utara, Perancis dan California tingkat kesamaan juga masih sangat tinggi (99%). Fauquet et al. (2005) menyatakan bahwa apabila terdapat persamaan runutan nukleotida dari gen CP antara satu virus dengan virus yang lain dengan nilai lebih dari 90%, maka virus-virus tersebut merupakan spesies virus yang sama. Berdasarkan hasil tersebut maka dapat dikatakan bahwa isolat virus yang menyerang sejumlah pertanaman tomat di beberapa negara termasuk Indonesia adalah spesies yang sama. Homologi yang tinggi menunjukkan bahwa runutan CP-TICV isolat Indonesia dan negara lain masih conserved dan terdapat kemungkinan bahwa isolat-isolat TICV dari berbagai negara mempunyai epitope yang relatif homogen, sehingga antiserum yang dihasilkan akan dapat mendeteksi seluruh isolat tersebut.
Hasil alignment menjelaskan bahwa tidak ada perbedaan runutan nukleotida dengan isolat Spanyol (Gambar 7). Alignment nukleotida
28
menunjukkan tidak terjadi mutasi pada isolat TICV Indonesia jika dibandingkan dengan isolat Spanyol. Perbedaan runutan hanya terjadi dengan tiga isolat lainnya (Amerika Utara, Perancis, dan Caifornia) (Gambar 7). Terjemahan sikuen nukleotida ke asam amino antara semua sikuen menunjukkan bahwa TICV Indonesia hanya mempunyai perbedaan dua asam amino (posisi ke-10 dan ke-69) dengan TICV asal California (kesamaan 99.2%) sedangkan dengan isolat lainnya tidak terjadi perbedaan (kesamaan 100%) (Gambar 8) dan (Tabel 2). Dengan demikian terjadi mutasi tak bermakna pada isolat USA Amerika Utara dan Isolat Perancis karena mutasi nukleotida yang terjadi pada triplet kodon tidak menyebabkan perubahan pada asam amino.
Tabel 1 Tingkat kesamaan isolat TICV dari beberapa negara berdasarkan perunutan nukleotida
Asal Isolat No Aksesi
Tingkat Kesamaan (%)
Indonesia Amerika Utara Spanyol Perancis California
Indonesia - - Amerika Utara FJ542306 99 - Spanyol FJ542305 100 99 - Perancis EU625351 99 99 99 - California FJ815441 99 99 99 99 - TICVIndonesia 1 ATGGAAAACTTATCTGGTAATGCAAACTATGATGAAACTAACACCAGTCGTGTGAACTCT TICVSpanyol 1 ATGGAAAACTTATCTGGTAATGCAAACTATGATGAAACTAACACCAGTCGTGTGAACTCT TICVAmerut 1 ATGGAAAACTTATCTGGTAATGCAAACTATGATGAAACTAACACCAGTCGTGTAAACTCT TICVPerancis 1 ATGGAAAACTTATCTGGTAATGCAAACTATGATGAAACTAACACCAGTCGTGTAAACTCT
TICVCalifornia 1 ATGGAAAACTTATCTGGTAATGCAAACTTTGATGAAACTAACACCAGTCGTGTAAACTCT
TICVIndonesia 61 GATGGAATTGGAAGTCACATGGAGCATGATGATGATGACAGGTCAGTCAACGGACCTCCA TICVSpanyol 61 GATGGAATTGGAAGTCACATGGAGCATGATGATGATGACAGGTCAGTCAACGGACCTCCA TICVAmerut 61 GATGGAATTGGAAGTCACATGGAGCATGATGATGATGACAGGTCAGTCAACGGACCTCCA TICVPerancis 61 GATGGAATTGGAAGTCACATGGAGCATGATGATGATGACAGGTCAGTCAACGGACCTCCA TICVCalifornia 61 GATGGAATTGGAAGTCACATGGAGCATGATGATGATGACAGGTCAGTCAACGGACCTCCA TICVIndonesia 121 AGTGATGAGATAAACAATCATACTACGAGATCTGTTCATGGTAGAGATCACACGTCAGGT TICVSpanyol 121 AGTGATGAGATAAACAATCATACTACGAGATCTGTTCATGGTAGAGATCACACGTCAGGT TICVAmerut 121 AGTGATGAGATAAACAATCATACTACGAGATCTGTTCATGGTAGAGATCACACGTCAGGT TICVPerancis 121 AGTGATGAGATAAACAATCATACTACGAGATCTGTTCATGGTAGAGATCACACGTCAGGT TICVCalifornia 121 AGTGATGAGATAAACAATCATACTACGAGATCTGTTCATGGTAGAGATCACACGTCAGGT TICVIndonesia 181 AATATAGGAGATTACTCAAAAGCTGACTTGAATAGAATTATGGTCAAAGTCAGTAGACCG TICVSpanyol 181 AATATAGGAGATTACTCAAAAGCTGACTTGAATAGAATTATGGTCAAAGTCAGTAGACCG TICVAmerut 181 AATATAGGAGATTACTCAAAAGCTGACTTGAATAGAATTATGGTCAAGGTCAGTAGACCG TICVPerancis 181 AATATAGGAGATTACTCAAAAGCTGACTTGAATAGAATTATGGTCAAGGTCAGTAGACCG TICVCalifornia 181 AATATAGGAGATTACTCAAAAGCTGACTTGAGTAGAATTATGGTCAAGGTCAGTAGACCG TICVIndonesia 241 GATGCTATGAGTGAATCCGATAGTAACTTGTATAAAGAGGTGATTGTTGAATATCTGAAA TICVSpanyol 241 GATGCTATGAGTGAATCCGATAGTAACTTGTATAAAGAGGTGATTGTTGAATATCTGAAA TICVAmerut 241 GATGCTATGAGTGAATCCGATAGTAACTTGTATAAAGAGGTGATTGTTGAATATCTGAAA TICVPerancis 241 GATGCTATGAGTGAATCCGATAGTAACTTGTATAAAGAGGTGATTGTTGAATATCTGAAA TICVCalifornia 241 GATGCTATGAGTGAATCCGATAGTAACTTGTATAAAGAGGTGATTGTTGAATATCTGAAA TICVIndonesia 301 AACAATTGTACTGGAGGTGCGGAACCGGATAAAGTTTTAGTGGTTGCATTTTTTGTTGCA TICVSpanyol 301 AACAATTGTACTGGAGGTGCGGAACCGGATAAAGTTTTAGTGGTTGCATTTTTTGTTGCA