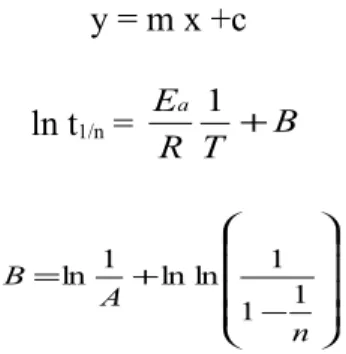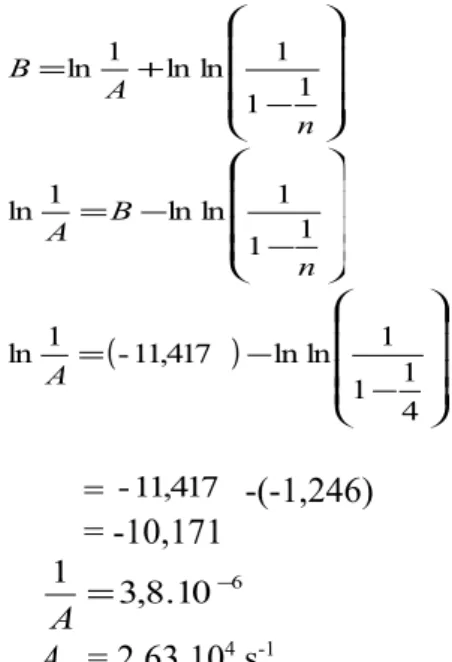LAPORAN PRAKTIKUM KIMIA I
PERCOBAAN IX
PENENTUAN ENERGI AKTIVASI REAKSI
(K1-9)
LABORATORIUM KIMIA FISIKA
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS GADJAH MADA
YOGYAKARTA
2006
I.
TUJUAN
• Dapat menentukan tenaga pengaktifan reaksi ion persulfat dengan ion iodida
• Dapat menentukan tenaga pengaktifan reaksi hidrogen peroksida dengan ion iodida.
II.
LANDASAN TEORI
Pada percobaan untuk menentukan tenaga pengaktifan pada reaksi ion persulfat dengan ion iodida, terjadi stokiometri reaksi persulfat dengan ion iodida, yaitu
S2O8= + 2 I_ I2 + 2SO4=
Jika reaksi di atas dijalankan pada kondisi konsentrasi ion iodida yang
konstan, maka reaksi yang terjadi adalah reaksi tingkat satu terhadap persulfat dan laju reaksinya dapat dinyatakan dengan
= − = = 8 2 8 2 O S k dt O S d
Jika konsentrasi persulfat awal adalah a dan konsentrasi pada waktu t adalah a-x, maka integrasi persamaan memberikan
− = n t k n i 1 1 1 ln 1 / (1)
Waktu untuk menyelesaikan 1/n bagian reaksi itu dapat diamati dengan menambahkan sejumlah ion tiosulfat dan larutan amilum dalam campuran reaksi. Tiosulfat memberikan efek regenerasi iodida karena terjadi reaksi
2S2O3= + I2 2 I_ + 2S4O6=
Konsentrasi ion iodida dengan demikian adalah konstan dan karena reaksi ini demikian cepat, maka tidak ada yodium yang dibebaskan sampai semua ion tiosulfat telah habis yaitu pada waktu larutan berubah menjadi biru.
Pengaruh temperatur terhadap laju reaksi dinyatakan oleh persamaan Arhenius
dimana A adalah faktor frekuensi, E adalah tenaga pengaktivan dan T adalah temperatur mutlak.
Dari persamaan (1) dan (2)
B RT E t n)= + ln( 1/ Dimana − + = n A B 1 1 1 ln ln 1 ln
Waktu untuk berlangsungnya reaksi 1/n bagian dapat diamati untuk konsentrasi-konsentrasi reaktan yang sama pada variasi temperatur T dan grafik ln t 1/n lawan 1/T akan memberikan garis lurus dengan kemiringan E/R
III.
ALAT DAN BAHAN
a. Alat :
1. Tabung 100 mL 2 buah
2. Gelas Piala besar atau termostat 3. Pipet Ukur
4. Termometer 5. Pengaduk
b. Bahan :
1. Larutan KI 0,5 M
2. Larutan Kalium Persulfat 0,01 M 3. Larutan H2O2 3%
4. Lempung Na2S2O3 0,1 M
5. Larutan Indikator amilum (segar) 6. Aquades
7. Larutan H2SO4
c. Susunan Alat dan bahan :
Termometer
Termostat
Air es / air hangat Pengaduk
a. Untuk larutan K2S2O8 0,01 M
b. Untuk larutan H2O2 3%
V.
HASIL PERCOBAAN DAN PEMBAHASAN
Tabung 2 20 mL K2S2O8 0,01 M 5 tetes amilum Tabung 1 20 mL KI 0,5 M 1 mL Na2S2O3 0,01 M
Gelas Piala Besar Di isi air + es + garam
atau air hangat
Di biarkan sampai temperature thermostat
Larutan dalam tabung 1 dimasukan dalam tabung 2
Diaduk dan diukur waktu yang dibutuhkan agar larutan berubah warna
menjadi biru
Diulangi prosedur itu pada temperature 5OC, 10 OC,15 OC, 20 OC,25 OC,30 OC Tabung 2 20 mL H 2O2 3% 5 tetes amilum Tabung 1 20 mL KI 0,5 M 1 mL Na2S2O3 0,01 M 2 mL H2SO4 2 M
Gelas Piala Besar Di isi air + es + garam
atau air hangat
Di biarkan sampai temperature thermostat
Larutan dalam tabung 1 dimasukan dalam tabung 2
Diaduk dan diukur waktu yang dibutuhkan agar larutan berubah warna
menjadi biru
Diulangi prosedur itu pada temperature 5OC, 10 OC,15 OC,
a. Data Eksperimen
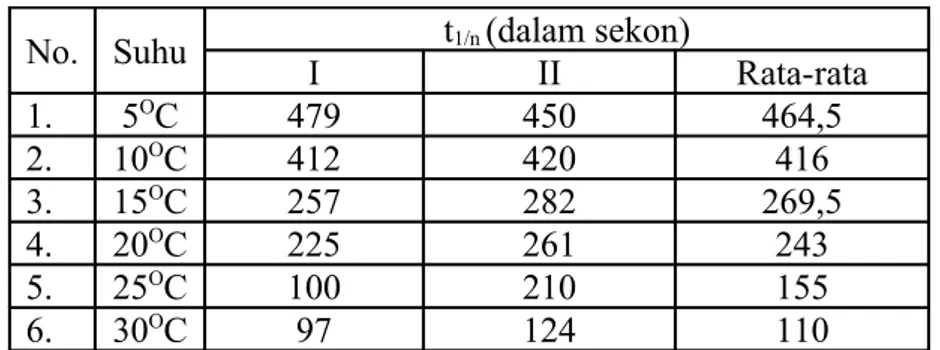
Tabel pengamatan lama waktu reaksi kalium persulfat
No. Suhu t1/n (dalam sekon)
I II Rata-rata 1. 5OC 479 450 464,5 2. 10OC 412 420 416 3. 15OC 257 282 269,5 4. 20OC 225 261 243 5. 25OC 100 210 155 6. 30OC 97 124 110
Tabel pengamatan lama waktu reaksi hidrogen peroksida
No. Suhu t1/n (dalam sekon)
I II Rata-rata 1. 5OC 27,41 36,4 31,905 2. 10OC 20,38 24,1 22,24 3. 15OC 14,94 15,2 15,07 4. 20OC 9,62 12,8 11,21 5. 25OC 7,32 10,8 9,06 6. 30OC 2,71 9 5,855 b. Hasil Perhitungan
• Untuk percobaan dengan larutan K2S2O8 didapat energi aktivasi
sebesar 40,95 KJ mol-1 dengan faktor frekuensi sebesar 2,63 .104 s-1
• Untuk percobaan dengan larutan H2O2 didapat energi aktivasi
sebesar 45,89 KJ mol-1 dengan faktor frekuensi sebesar 3,5. 105 s-1
c. Pembahasan
Setelah dilakukan percobaan sesuai dengan prosedur serta di lakukan perhitungan, didapatkan harga-harga Ea dan A seperti yang telah tercantum diatas dimana Ea merupakan energi aktivasi dan A adalah faktor frekuensi.
Dari data pengamatan, tampak bahwa dengan bertambahnya suhu, bertambah cepat pula reaksi terjadi. Kenaikan suhu akan meningkatkan energi-energi dari molekul sehingga makin banyak molekul yang mencapai energi pengaktifan. Selain itu, pengaruh suhu juga menyebabkan partikel begerak lebih cepat sehingga meningkatkan frekuensi tumbukan. Panas merupakan gerak ketidak teraturan suatu zat. Ketika suatu partikel bergerak makin cepat (akibat naiknya suhu) maka kemungkinan bertumbukan dengan molekul lain semakin besar. Namun tidak semua tumbukan akan menghasilkan suatu reaksi. Partikel harus bertumbukan dengan Energi yang lebih tinggi dari energi aktivasi untuk menjamin berlangsungnya suatu reaksi.
Energi aktivasi adalah energi minimum yang diperlukan untuk melangsungkan terjadinya suatu reaksi. Jika partikel-partikel bertumbukan dengan energi yang lebih rendah dari energi aktivasi, tidak akan terjadi
reaksi. Mereka akan kembali ke keadaan semula. Kita dapat membayangkan energi aktivasi sebagai tembok dari reaksi. Hanya tumbukan yang memiliki energi sama atau lebih besar dari energi aktivasi yang dapat menghasilkan terjadinya reaksi. Walaupun partikel-partikel itu berorientasi dengan baik, kita tidak akan mendapatkan reaksi jika partikel-partikel tersebut tidak dapat bertumbukan melampui energi minimum yang disebut dengan energi aktivasi reaksi. Di dalam reaksi kimia, ikatan-ikatan diceraikan (membutuhkan energi) dan membentuk ikatan-ikatan baru (melepaskan energi). Umumnya, ikatan-ikatan harus diceraikan sebelum yang baru terbentuk. energi aktivasi dilibatkan dalam menceraikan beberapa dari ikatan-ikatan tersebut. Ketika tumbukan-tumbukan tersebut relatif lemah, dan tidak cukup energi untuk memulai proses penceraian ikatan. mengakibatkan partikel-partikel tersebut tidak bereaksi.
Karena energi aktivasi memegang peranan penting dalam menentukan suatu tumbukan menghasilkan reaksi, hal ini sangat berguna untuk menentukan bagaimana macam bagian partikel berada untuk mendapatkan energi yang cukup ketika mereka bertumbukan. Di dalam berbagai sistem, keberadaan partikel-partikel akan memiliki berbagai variasi besar energi. Agar reaksi berlangsung, partikel-partikel harus bertumbukan guna memperoleh energi yang sama atau lebih besar daripada aktivasi energi.
Pada percobaan menggunakan larutan hidrogen peroksida, di gunakan katalis H2SO4. Hidrogen peroksida adalah cairan bening, agak lebih kental
daripada air, yang merupakan oksidator kuat. Katalis adalah suatu zat yang mempercepat suatu laju reaksi, namun ia sendiri, secara kimiawi, tidak berubah pada akhir reaksi. Katalisator dapat mengubah mekanisme reaksi dengan membuat tahapan reaksi yang memiliki energi pengaktifan yang lebih rendah Ketika reaksi selesai, kita akan mendapatkan massa katalasis yang sama seperti pada awal kita tambahkan. Katalisator bereaksi pada satu tahap kemudian dibebaskan pada tahap berikutnya. Karena itulah reaksi yang terjadi pada larutan ini berlangsung relatif cepat.
d. Sumber kesalahan
• Larutan yang di sediakan pada waktu praktikum sudah terkontaminasi sehingga praktikan harus mengulang eksperimen dengan larutan yang berbeda.
• Termometer yang digunakan hanya satu sehingga suhu pada tabung yang lain hanya dalam prediksi.
• Suhu kurang bisa dijaga konstan selama berlangsungnya reaksi akibat mengalirnya panas dari tubuh kita ke tabung, serta gesekan pengaduk yang pasti akan menimbulkan panas.
VI.
KESIMPULAN
Hasil dari percobaan ini dapat disimpulkan :
• Untuk percobaan dengan larutan K2S2O8 didapat energi aktivasi sebesar
40,95 KJ mol-1 dengan faktor frekuensi sebesar 2,63 . 104 s-1
• Untuk percobaan dengan larutan H2O2 didapat energi aktivasi sebesar
45,89 KJ mol-1 dengan faktor frekuensi sebesar 3,5. 105 s-1
VII. DAFTAR PUSTAKA
•Alberty, R.A. & Daniels, F., 1984, KIMIA FISIKA, jilid 2 (terjemahan), Penerbit Erlangga, Jakarta
•Atkins, P.W., 1990, Physical Chemistry, edisi 4, Oxford University Press. Oxford
•Castellan, G. W., 1983, Physical Chemistry, edisi 3, Adison-Wesley Publishing Company, Singapore
•Hamroy, Muchlas.1999. Kimia fisika I. Yogyakarta: MIPA UGM
•Moore & Pearson, 1987, Chemical Kinetics, John Wiley & sons, New York
VIII. LAMPIRAN
1. Menentukan 1/na. Untuk larutan K2S2O8
S2O8= + 2 I_ I2 + 2SO4=
2S2O3= + I2 2 I_ + 2S4O6=
S2O8= + 2S2O3=_ 2SO4= + S4O6=
Mula-mula 0,2 mmol 0,1 mmol -
-Reaksi 0,05 mmol 0,1 mmol 0,1 mmol 0,05 mmol Setimbang 0,15 mmol - 0,1 mmol 0,05 mmol
awal
O
mmolS
bereaksi
O
mmolS
n
= ==
8 2 8 21
=00,,2005mmolmmol 4 1 = Jadi nilai n 1untuk larutan K2S2O8 adalah
4 1
b. Untuk larutan H2O2
Mencari konsentrasi hiderogen peroksida
ρ x x Mr massa i konsentras 100 1000 % = M i konsentras x x i konsentras 97 , 0 1 , 1 100 1000 34 3 = =
Maka kuantitas H2O2 yang digunakan
mmol n mmol x n 4 , 19 ) 20 97 , 0 ( = = Reaksi H2O2 + 2 I_ + 2H+ I2 + 2H2O 2S2O3= + I2 2 I_ + 2S4O6= H2O2 + 2S2O3=_ 2H2O + S4O6=
Mula-mula 19,4 mmol 0,1 mmol -
-Reaksi 0,05 mmol 0,1 mmol 0,1 mmol 0,05 mmol Setimbang 18,9 mmol - 0,1 mmol 0,05 mmol
awal O mmolH bereaksi O mmolH n 2 2 2 2 1 = =190,05,4mmolmmol =0,0258 Jadi nilai n 1
untuk larutan H2O2 adalah 0,0258
+
-+
-2. Menentukan Ea dan A
Dari data percobaan t1/n dan T dibuat grafik ln t1/2 dimana T adalah suhu dalam
satuan Kelvin. Dari grafik tersebut akan didapat garis dengan kemiringan tertentu. Persamaan garis tersebut
y = m x +c analog ln t1/n = B T R Ea + 1 dimana − + = n A B 1 1 1 ln ln 1 ln
Dari rumusan di atas kita akan mendapatkan nilai Ea yang merupakan tenaga pengaktifan reaksi dan A yaitu faktor frekuensi.
a. Untuk Grafik ln t1/n Vs 1/T K2S2O8 dari 5OC sampai 30OC
No. T (K) 1/T(1/K) t(s) ln t 1 278 0,003597 464,5 6,140962 2 283 0,003534 416 6,030685 3 288 0,003472 269,5 5,596568 4 293 0,003413 243 5,493061 5 298 0,003356 155 5,043425 6 303 0,0033 110 4,70048
Grafik ln t1/n Vs 1/T dengan Larutan
K2S2O8 y = 4926x - 11,471 R2 = 0,9666 0 1 2 3 4 5 6 7 0,00325 0,0033 0,00335 0,0034 0,00345 0,0035 0,00355 0,0036 0,00365 1/T (1/K) ln t 1/ n Didapat y = mx +c y= 4926 x-11,417 R E m= a Ea = m.R = 4926 . 8,314 J mol -1 K-1 = 40954,764 J mol-1 = 40,95 KJ mol-1 B = c
− + = n A B 1 1 1 ln ln 1 ln − − = n B A 1 1 1 ln ln 1 ln ( ) − − = 4 1 1 1 ln ln 11,417 -1 ln A = -11,417 -(-1,246) = -10,171 1 =3,8.10−6 A A = 2,63.104 s-1
b. Untuk Grafik ln t1/n Vs 1/T H2O2 dari 5OC sampai 30OC
No. T (K) 1/T(1/K) t(s) ln t 1 278 0,003597 31,905 3,462763 2 283 0,003534 22,24 3,101892 3 288 0,003472 15,07 2,712706 4 293 0,003413 11,21 2,416806 5 298 0,003356 9,06 2,203869 6 303 0,0033 5,855 1,767296
Grafik ln t1/n Vs 1/T dengan Larutan H2O2
y = 5519,6x - 16,406 R2 = 0,9938 0 0,5 1 1,5 2 2,5 3 3,5 4 0,0033 0,0033 0,0034 0,0034 0,0035 0,0035 0,0036 0,0036 0,0037 1/T (1/K) ln t 1/ n Didapat y = mx +c = 5519,6x-16,406 R E m= a Ea = m.R = 5519,6 . 8,314 J mol -1 K-1 = 45889,95 J mol-1 = 45,89 KJ mol-1 B = c
− + = n A B 1 1 1 ln ln 1 ln − − = n B A 1 1 1 ln ln 1 ln