PRAKTIKUM KIMIA DASAR I
KECEPATAN REAKSI
Kelompok V :
Amir Hamzah 1415005
Umi Kulsum 1415018
AKADEMI KIMIA ANALISIS
CARAKA NUSANTARA
CIMANGGIS, KELAPA DUA
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Reaksi kimia berlangsung dengan kecepatan yang berbeda-beda. Meledaknya petasan, adalah contoh reaksi yang berlangsung dalam waktu singkat. Proses perkaratan besi, pematangan buah di pohon, dan fosilisasi sisa organisme merupakan peristiwa-peristiwa kimia yang berlangsung sangat lambat. Reaksi kimia selalu berkaitan dengan perubahan dari suatu pereaksi (reaktan) menjadi hasil reaksi (produk). Laju reaksi dapat dinyatakan sebagai berkurangnya jumlah (konsentrasi) pereaksi per satuan waktu atau bertambahnya jumlah (konsentrasi) hasil reaksi per satuan waktu. Laju reaksi adalah berkurangnya jumlah konsentrasi pereaksi untuk setiap satuan waktu atau bertambahnya jumlah konsentrasi hasil reaksi untuk setiap satuan waktu .Dinyatakan dengan satuan molaritas per detik ( M / detik atau mol / L.detik ). Faktor-Faktor yang Mempengaruhi Laju Reaksi Wujud Zat diantaranya adalah Konsentrasi pereaksi ,Suhu reaksi ,Luas permukaan bidang sentuh reaksi dan Katalis. Laju mempunyai penerapan baik dalam kehidupan sehari-hari maupun dalam berbagai industri.
1.2 Tujuan
Mempelajari faktor-faktor yang mempengaruhi kecepatan reaksi dalam larutan.
1.3 Manfaat
Setelah melakukan praktikum kali ini mahasiswa dapat : 1. Menjelaskan pengertian Laju Reaksi.
2. Menjelaskan faktor-faktor yang mempengaruhi Laju Reaksi.
TINJAUAN PUSTAKA
2.1 Teori
Tiap-tiap mempunyai kecepatan masing-masing yang dapat ditentukan antara lain berdasarkan :
a. Kecepatan timbulnya suatu hasil reaksi kimia. b. Kecepatan habisnya salah satu zat yang direaksikan.
Hal ini dapat dilihat pada timbulnya atau hilangnya warna zat yang bereaksi atau perubahan warna dari indikator, kecepatan reaksi dipengaruhi oleh faktor-faktor : a. Sifat zat itu sendiri
b. Temperatur c. Katalisator
a. Pengertian kecepatan reaksi
Kecepatan reaksi adalah besarnya perubahan jumlah pereaksi dan hasil reaksi persatuan waktu. Perubahan ini biasa dinyatakan sebagai perubahan konsentrasi molar (molaritas) sehingga kecepatan reaksi dapat dinyatakan sebagai perubahan konsentrasi akhir (hasil reaksi) terhadap konsentrasi awal (pereaksi) per satuan waktu. Satuan kecepatan reaksi dinyatakan dengan molaritas per detik (M/detik).
Misalnya pada reaksi : A B
Maka :
Kecepatan reaksi (v) = - ∆[ A ]∆ t atau + ∆[B ]∆ t Keterangan :
Tanda ( - ) pada ∆ [A] menunjukkan bahwa konsentrasi zat A berkurang,
Sedangkan tanda ( + ) pada ∆ [B] menunjukkan bahwa konsentrasi zat B bertambah.
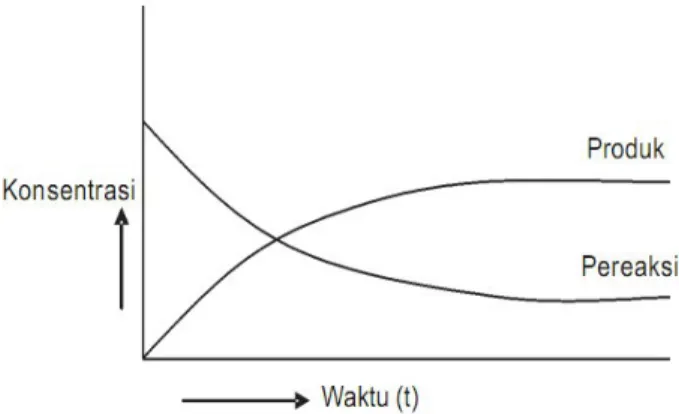
Secara umum dapat digambarkan :
Gambar 3.1 Grafik hubungan perubahan konsentrasi terhadap waktu Stoikiometri kecepatan Reaksi
Pada persamaan reaksi :
mA + nB pC + qD
Secara umum dapat dituliskan :
Kecepatan reaksi = - m 1 ∆[ A ]∆ t = - 1n ∆[B ]∆ t = + 1p ∆[C]∆ t = + 1
q
∆[ D] ∆ t
Laju pengurangan B = m x laju berkurangnya An
Laju pertambahan C = m x laju berkurangnya Ap
Laju pertambahan D = m x laju berkurangnya Aq
Atau
= - mn x laju berkurangya B
= mp x laju pertambahan C
= mq x laju pertambahan D
Jika dituliskan dalam persamaan matematika :
Laju pengurangan A = - ∆[ A ]∆ t
Sehingga : - ∆[ A ]∆ t = - mn ∆ [B]∆ t = + mp ∆[C]∆ t = + mq ∆ [D ]∆ t
Laju Reaksi Rerata dan Laju Reaksi Sesaat
Laju reaksi rerata adalah laju reaksi untuk selang waktu tertentu. Dirumuskan :
v = - ∆[ pereaksi]∆ t = + ∆[hasil reaksi]∆ t
Laju reaksi sesaat adalah laju reaksi pada saat waktu tertentu.
Biasanya ditentukan dengan menggunakan grafik yang menyatakan hubungan antara waktu reaksi ( sumbu x ) dengan konsentrasi zat ( sumbu y ). Besarnya laju reaksi sesaat = kemiringan ( gradien ) garis singgung pada saat t tersebut.
Langkah-langkah menentukan laju reaksi sesaat :
Lukislah segitiga untuk menentukan gradien ( kemiringan )!
Laju reaksi sesaat = gradien garis singgung ( yx = ΔCΔt ) b. Persamaan Laju Reaksi
Secara umum, laju reaksi dapat dinyatakan dengan rumus :
mA + nB pC + qD
v k.
A
x
B
y Keterangan : v = laju reaksik = konstanta laju reaksi (nilainya tergantung pada jenis reaktan, suhu dan katalis) x = orde atau tingkat reaksi terhadap reaktan A.
y = orde atau tingkat reaksi terhadap reaktan B x + y = orde atau tingkat reaksi total / keseluruhan.
Harga k akan berubah jika suhu berubah. Kenaikan suhu dan penggunaan katalis umumnya akan memperbesar harga k.
c. Orde Reaksi
“ Orde reaksi menyatakan besarnya pengaruh konsentrasi reaktan terhadap laju
reaksi. ”
1. Orde reaksi nol.
Reaksi dikatakan berorde nol terhadap salah satu reaktan, jika perubahan konsentrasi reaktan tersebut tidak mempengaruhi laju reaksi. Artinya, asalkan terdapat dalam jumlah tertentu, perubahan konsentrasi reaktan itu tidak mempengaruhi laju reaksi. Besarnya laju reaksi hanya dipengaruhi oleh besarnya konstanta laju reaksi ( k ).
2. Orde reaksi satu.
Suatu reaksi dikatakan berorde satu terhadap salah satu reaktan, jika laju reaksi berbanding lurus dengan konsentrasi reaktan itu. Jika konsentrasi reaktan itu dilipat-tigakan maka laju reaksinya akan menjadi 31 atau 3 kali lebih besar.
v k.
X
k.
X
3. Orde reaksi dua.
Suatu reaksi dikatakan ber’orde dua terhadap salah satu reaktan, jika laju reaksi merupakan pangkat dua dari konsentrasi reaktan itu. Jika konsentrasi reaktan itu dilipat-tigakan, maka laju reaksi akan menjadi 32atau 9 kali lebih besar.
d. Teori Tumbukan
Suatu zat dapat bereaksi dengan zat lain jika partikel-partikelnya saling bertumbukan. Tumbukan yang terjadi akan menghasilkan energi untuk memulai terjadinya reaksi. Terjadinya tumbukan tersebut disebabkan karena partikel-partikel zat selalu bergerak dengan arah yang tidak teratur. Tumbukan antar partikel yang bereaksi tidak selalu menghasilkan reaksi. Hanya tumbukan yang menghasilkan energi yang cukup serta arah tumbukan yang tepat, yang dapat menghasilkan reaksi. Tumbukan seperti ini disebut tumbukan yang efektif.
Jadi, laju reaksi tergantung pada 3 hal : a) Frekuensi tumbukan
b) Energi partikel reaktan c) Arah tumbukan
Energi minimum yang harus dimiliki oleh partikel reaktan, sehingga menghasilkan tumbukan yang efektif disebut energi pengaktifan atau energi aktivasi ( Ea ).
Semua reaksi, baik eksoterm maupun endoterm memerlukan Ea. Reaksi yang dapat berlangsung pada suhu rendah berarti memiliki Ea yang rendah. Sebaliknya, reaksi yang dapat berlangsung pada suhu yang tinggi, berarti memiliki Ea yang tinggi.
Ea ditafsirkan sebagai energi penghalang ( barrier ) antara reaktan dengan produk. Reaktan harus didorong agar dapat melewati energi penghalang tersebut sehingga dapat berubah menjadi produk.
Faktor-Faktor yang Mempengaruhi Laju Reaksi Besarnya laju reaksi dipengaruhi oleh :
Pada reaksi heterogen ( reaksi yang fase reaktannya tidak sama ), misalnya logam Zn dengan larutan HCl; laju reaksi selain dipengaruhi oleh konsentrasi larutan HCl, juga dipengaruhi oleh kondisi logam Zn tersebut.
Dalam jumlah ( massa ) yang sama; butiran logam Zn akan bereaksi lebih lambat daripada serbuk Zn.
O Reaksi akan terjadi antara molekul-molekul HCl dengan atom-atom Zn yang bersentuhan langsung dengan HCl.
Pada butiran Zn, atom-atom Zn yang bersentuhan langsung dengan HCl lebih sedikit daripada serbuk Zn sebab atom-atom Zn yang bersentuhan hanya atom Zn yang ada di permukaan butiran.
Jika butiran Zn tersebut dihaluskan menjadi serbuk, maka atom-atom Zn yang semula ada di bagian dalam akan berada di bagian permukaan dan terdapat lebih banyak atom Zn yang secara bersamaan bereaksi dengan larutan HCl.
Semakin luas permukaan bidang sentuh zat padat, semakin banyak tempat terjadinya tumbukan antar partikel zat yang bereaksi sehingga laju reaksi akan semakin meningkat juga.
2. Konsentrasi Reaktan.
Pengaruh konsentrasi reaktan terhadap laju reaksi dapat dijelaskan dengan menggunakan teori tumbukan.
Semakin tinggi konsentrasinya berarti semakin banyak molekul dalam setiap satuan luas ruangan; dengan demikian tumbukan antar molekul akan semakin sering terjadi.
Semakin banyak tumbukan yang terjadi, berarti kemungkinan untuk menghasilkan tumbukan yang efektif akan semakin besar sehingga reaksi berlangsung lebih cepat.
3. Tekanan.
Pada reaksi yang reaktannya berwujud gas, peningkatan tekanan dapat meningkatkan laju reaksi. Jika tekanan meningkat, maka volumenya akan berkurang sehingga konsentrasi gas akan meningkat (konsentrasi berbanding terbalik dengan volume; ( M = nv )
Jika volumenya berkurang, maka memungkinkan bertambahnya jumlah tumbukan yang terjadi karena setiap molekul menjadi lebih berdekatan jaraknya.
4. Suhu
Pada umumnya, suhu yang semakin tinggi akan semakin mempercepat reaksi. Meningkatnya suhu akan memperbesar energi kinetik molekul reaktan. Oleh karena itu,gerakan antar molekul reaktan akan semakin acak sehingga kemungkinan terjadinya tumbukan antar molekul akan semakin besar. Akibatnya tumbukan yang efektif akan mudah tercapai dan energi aktivasi akan mudah terlampaui.
5. Katalis
Katalis adalah suatu zat yang dapat mempercepat laju reaksi, tanpa dirinya mengalami perubahan yang kekal sehingga pada akhir reaksi zat tersebut dapat diperoleh kembali. Suatu katalis mungkin dapat terlibat dalam proses reaksi atau mengalami perubahan selama reaksi berlangsung, tetapi setelah reaksi itu selesai maka katalis akan diperoleh kembali dalam jumlah yang sama.Katalis dapat mempercepat reaksi dengan cara mengubah jalannya reaksi. Jalur reaksi yang ditempuh tersebut mempunyai energi aktivasi ( Ea ) yang lebih rendah daripada jalur reaksi yang ditempuh tanpa katalis.Artinya : katalis berperan untuk
menurunkan energi aktivasi ( Ea ).
Jenis-jenis katalis yaitu :
Katalis Homogen.
Katalis Homogen adalah katalis yang wujudnya sama dengan wujud reaktannya. Dalam reaksi kimia, katalis homogen berfungsi sebagai zat perantara (fasilitator). Contohnya :
o Katalis gas NO2 pada pembuatan gas SO3.
o Katalis gas Cl2 pada penguraian N2O
Katalis Heterogen.
Katalis Heterogen Adalah katalis yang wujudnya berbeda dengan wujud reaktannya. Reaksi zat-zat yang melibatkan katalis jenis ini, berlangsung pada permukaan katalis tersebut.
Contohnya :
o Katalis logam Ni pada reaksi hidrogenasi etena ( C2H4 ).
o Katalis logam Rodium atau Iridium pada proses pembuatan asam etanoat. o Katalis logam Ni pada proses pembuatan mentega.
o Katalis logam Fe pada reaksi pembuatan amonia ( proses Haber-Bosch )
Biokatalis ( enzim ).
Biokatalis ( enzim ) Adalah katalis yang dapat mempercepat reaksi-reaksi kimia dalam tubuh makhluk hidup. Mekanisme kerjanya dengan metode “kunci dan
gembok “ atau “lock and key “ yang dipopulerkan oleh Emil Fischer.
Contohnya :
Enzim amilase = membantu menghidrolisis amilum menjadi maltosa. Enzim katalase = menguraikan H2O2 menjadi O2 dan H2O
Enzim lipase = menguraikan lipid menjadi gliserol dan asam lemak.
Autokatalis.
Autokatalis adalah zat hasil reaksi yang berfungsi sebagai katalis. Artinya, produk reaksi yang terbentuk akan mempercepat reaksi kimia.
Contohnya :
Reaksi antara kalium permanganat ( KMnO4 ) dengan asam oksalat ( H2C2O4 )
salah satu hasil reaksinya berupa senyawa mangan sulfat ( MnSO4 ). Semakin
lama, laju reaksinya akan semakin cepat karena MnSO4 yang terbentuk berfungsi
sebagai katalis.
BAB III
METODELOGI PRAKTIKUM
3.1 Alat yang digunakan 1. Tabung reaksi 10 buah 2. Pipet tetes 2 buah 3. Pipet ukur 5 mL 1 buah 4. Beaker glass 250 mL 1 buah 3.2 Bahan yang digunakan
1. Larutan KIO3 0,5 M, 0,4 M, 0,3 M, 0,2 M, dan 0,1 M
2. Larutan kanji
4. Larutan H2SO4 pekat dan H2SO4 6 M
5. Larutan Asam Cuka 1 M 6. Larutan KmnO4 0,1 M
7. MnSO4
3.3 Prosedur Kerja
A. Pengaruh Konsentrasi
1. Memasukkan KIO3 1 M sebanyak 5 mL dalam gelas ukur atau tabung reaksi. Tambahkan 1 mL larutan kanji.
2. Memasukkan ke dalam gelas ukur atau tabung reaksi larutan NaHSO3 0,5 M 5 mL dan tambahkan 1 tetes H2SO4 pekat.
3. Memasukkan campuran no. 2 ke dalam campuran no. 1, mencatat waktu pada saat mencampurkannya dan saat timbul warna.
4. Mengulangi percobaan sebanyak 3 kali.
5. Mengulangi percobaan no. 1 sampai no. 3 dengan larutan KIO3 0,4 M, 0,3 M, 0,2 M, dan 0,1 M.
B. Pengaruh Temperatur dan Autokatalis
1. Memasukkan 5 mL larutan Asam Cuka 1 M dan 10 mL H2SO4 6 M di dalam suatu tabung reaksi. Kemudian tambahkan 1 mL larutan KmnO4 0,01 M. Mengocok tabung reaksi tersebut dan mencatat waktu yang dibutuhkan sampai warna larutan terbentuk menghilang.
2. Memasukkan 5 mL Asam Cuka 1 M dan tambahkan 10 mL 6 M, lalu panaskan larutan hingga 720C. Kemudian menambahkan 1 mL larutan
KmnO4. Mencatat waktunya sampai warna larutan terbentuk dan menghilang. 3. Menambahkan 1 mL KmnO4 Ke dalam larutan percobaan no. 1 dan mencatat
waktu yang dibutuhkan sampai warna larutan terbentuk dan menghilang ( bandingkan dengan waktu percobaan no. 1 )
4. Tambahkan ke dalam 5 mL Asam Cuka 1 M, 5 tetes H2SO4 6 M dan sedikit MnSO4 ( seujung pisau ). Kemudian menambahkan 1 mL larutan KmnO4 lalu di kocok selama 1 menit dan menambahkan 2 tetes fe2+. Amati perubahan
warna, dan mencatat waktu yang dibutuhkan sampai hilangnya warna ( bandingkan dengan no. 3 ).
3.4 Reaksi Kimia
KIO3 + H2SO4 + NaHSO3
Reduksi : 2IO3- + I2H+ + 10e’ I2 + 6H2O
Oksidasi : H2SO4 + H2O SO42- + 3H+ + e’
2IO3- + 10H2SO4 + 4H2O I2IOSO42- + 18H+
CH3COOH
Reduksi : MnO4- + 8H+ + 5e’ Mn2+ + 4H2O X 2
Oksidasi : CH3COO- CO2 + 2e’ X 5
2MnO4- + 16H+ + 5COCH3 2Mn2+ + 2H2O + 5CO2
3.5 Bagan Kerja A. Pengaruh konsentrasi
1)
KIO3 0,5 M 5 mL + KIO3 0,4 M 5 mL + KIO3 0,3 M 5 mL +
1mL Larutan Kanji 1mL Larutan Kanji 1mL Larutan Kanji (bening) (bening) (bening)
KIO3 0,2 M 5 mL + KIO3 0,1 M 5mL +
1 mL Larutan Kanji 1mL Larutan Kanji (bening) (bening)
2)
NaHSO3 5 mL + NaHSO3 5 mL + NaHSO3 5 mL +
H2SO4 pekat 1 tetes H2SO4 pekat 1 tetes H2SO4 pekat 1 tetes
NaHSO3 5 mL + NaHSO3 5 mL +
H2SO4 pekat 1 tetes H2SO4 pekat 1 tetes
(bening) (bening) 3)
Larutan I + Larutan II Larutan I + Larutan II Larutan I + Larutan II (Kuning Tua) waktu 3 detik (Biru Tua) waktu 10 detik (Biru Tua) waktu 3 detik Duplo Duplo Duplo
Larutan I + Larutan II Larutan I + Larutan II (Kuning Tua) waktu 3 detik (Biru Tua) waktu 3 detik Duplo Duplo (Kuning Muda) waktu 2 detik (Biru Tua) waktu 2 detik B. Pengaruh Temperatur dan Katalisator
1)
Larutan CH3COOH H2SO4 6 M 10 mL 1mL KmnO4 0,1 M
6 M 5 mL (bening) (ungu) (bening)
2 tetes Fe2+1M
(Merah Bata) waktu 20 detik 2) 5 mL CH3COOH H2SO4 6 M 10 mL 6 M (bening) (bening) Panaskan hingga 720C Hilang
KmnO4 1 mL
(Ungu)
3)
Larutan Percobaan I Larutan Percobaan II
4)
(Coklat Bening) Waktu 1 menit 36
detik
5 mL CH3COOH H2SO4 6 M 5 tetes 1 M (bening) (bening) KmnO4 1 mL
Kocok 1 menit hingga homogen (hitam)
BAB IV
Hasil dan Data Pengamatan
MnSO4 sedikit
(endapan putih)
2 tetes Fe2+ 1M
4.1 Data Pengamatan A. Pengaruh Konsentrasi
1. 5 mL KIO3 0,5 M + 1 mL larutan kanji + 5 mL NaHSO3 + 1 tetes H2SO4 pekat
waktu 3 detik warna berubah menjadi kuning
2. 5 mL KIO3 0,4 M + 1 mL larutan kanji + 5 mL NaHSO3 + 1 tetes H2SO4 pekat
waktu 10 detik warna berubah menjadi biru tua
3. 5 mL KIO3 0,3 M + 1 mL larutan kanji + 5 mL NaHSO3 + 1 tetes H2SO4 pekat
waktu 3 detik warna berubah menjadi biru tua
4. 5 mL KIO3 0,2 M + 1 mL larutan kanji + 5 mL NaHSO3 + 1 tetes H2SO4 pekat
waktu 3 detik warna berubah menjadi biru tua
5. 5 mL KIO3 0,2 M + 1 mL larutan kanji + 5 mL NaHSO3 + 1 tetes H2SO4 pekat
waktu 3 detik warna berubah menjadi biru tua
B. Pengaruh Temperatur dan Autokatalisator
1. 5 mL Larutan CH3COOH 6 M + H2SO4 6 M 10 mL (bening) + 1 mL KMnO4
0,1 M (ungu) + 2 tetes fe2+ 1 M ( merah bata ) waktunya 20 detik
2. 5 mL Larutan CH3COOH 6 M + H2SO4 6 M 10 mL (bening) di panaskan
hingga 720C mL + KMnO
4 0,1 M (ungu) hilang coklat bening
waktunya 1 menit 36 detik.
3. Larutan percobaan no. 1 + 1 mL larutan KMnO4 warna larutan menghilang
dalam waktu 2 menit 16 detik
4. 5 mL Larutan CH3COOH 6 M + H2SO4 6 M 10 mL (bening) + MnSO4 sedikit
(endapan putih) + KMn04 1 mL dikocok 1 menit hingga homogen (hitam) + 2
tetes fe2+ 1 M (hitam)
Perhitungan
Yang disediakan adalah KIO3 0,5 M
Membuat KIO3 0,4 M dari 0,5 M
V1 . 0,5 M = 50 mL . 0,4 M
V1 =
50 .0,4
0,5 = 40 mL
Membuat KIO3 0,3 M dari 0,5 M
V1 . M1 = V2 . M2
V1 . 0,5 M = 50 mL . 0,3 M
V1 =
50 . 0,3
0,5 = 30 mL Membuat KIO3 0,2 M dari 0,5 M
V1 . M1 = V2 . M2
V1 . 0,5 M = 50 mL . 0,2 M
V1 =
50 . 0,2
0,5 = 20 mL Membuat KIO3 0,1 M dari 0,5 M
V1 . M1 = V2 . M2 V1 . 0,5 M = 50 mL . 0,1 M V1 = 50 . 0,1 0,5 = 10 mL 4.2 Pembahasan
Kecepatan reaksi adalah banyaknya suatu zat yang dapat berubah menjadi zat lain dalam setiap satuan waktu.
Kecepatan reaksi dipengaruhi oleh faktor – faktor antara lain :
Suhu : Semakin tinggi suhu semakin cepat pergerakan partikel – partikel zat yang bereaksi sehingga tumbukan antar partikel lebih cepat dan reaksi berlangsung lebih cepat.
Katalis : adanya katalisator dalam reaksi dapat mempercepat jalannya suatu praktek. Pada praktikum ini katalisator yang digunakan adalah KMnO4 0,1 M.
Sifat zat itu sendiri : Sifat mudahnya atau sukar suatu zat bereaksi akan menentukan kecepatan berlangsungnya reaksi.
Konsentrasi : Makin besar konsentrasi zat yang bereaksi makin cepat reaksinya berlangsung. Makin besar konsentrasi makin banyak zat – zat yang bereaksi sehingga makin besar kemungkinan terjadinya tumbukan dengan demikian makin besar pula kemungkinan terjadinya reaksi.
Pada praktikum ini terjadi kesalahan pada pengaruh konsentrasi yaitu percobaan pertama, warnanya yang pertama kuning tua dan yang kedua kuning muda , ini dimungkinkan karena :
Larutan kanji dalam percobaan pertama menggunakan larutan kanji yang sudah lama, sedangkan pada percobaan ke 2,3,4,5 menggunakan kanji yang baru dibuat. Kanji yang bagus itu adalah kanji yang baru dibuat dan larutan belum terdapat endapan dan larutan sudah terlarut sempurna. Ini dibuktikan pada saat penggunaan larutan kanji yang baru pada percobaan 2,3,4, dan 5 (duplo) warna berubah menjadi biru tua semua dan warna ini adalah warna yang benar.
Pada percobaan 1 terjadi kesalahan dalam waktu dikarenakan larutan kanji sudah lama dan adanya endapan,pada saat perubahan warna membutuhkan waktu yang cukup lama.
BAB V PENUTUP
5.1 Kesimpulan
o Kecepatan reaksi adalah banyaknya suatu zat yang dapat berubah menjadi zat lain dalam setiap satuan waktu.
o Faktor – faktor yang mempengaruhi kecepatan reaksi : a. Suhu
b. Katalis
c. Sifat zat itu sendiri d. Konsentrasi
o Katalisator dapat mempercepat proses dalam reaksi.
o Temperatur konsentrasi dan katalisator dapat mempengaruhi kecepatan reaksi. o Semakin besar konsentrasi larutan maka semakin cepat reaksinya.
o jika suhu larutan besar akan mempengaruhi kecepatan reaksi.
5.2 Saran
Diharapkan kepada praktikan selanjutnya untuk lebih teliti dan hati-hati baik dalam proses pencampuran larutan, pencatatan waktu maupun pada saat timbulnya
warna agar diperoleh hasil yang maksimal.
DAFTAR PUSTAKA
Asni, Msi. Nurul. 2011. Penuntun Praktikum Kimia Dasar l. Depok: Aka Caraka Nusantara
Justiana, Sandri dan Muchtaridi. 2009. Kimia 2. Jakarta: Yudhistira