PENENTUAN PERSAMAAN LAJU REAKSI
LEMBAR PENGESAHAN
Kelompok : I (Satu)
Praktikum : Teknik Reaksi Kimia
Modul Percobaan : Penentuan persamaan laju reaksi Tanggal Praktikum : 24 maret 2023
Dosen Pembimbing : M. Zulfikar Luthfi,S.TP,M.T Analis/Asisten :Faldi Lulrahman, M.T
No NamaPraktikan BukuPokok
1 Rara Nurrahmi 2112032
2 Renold Ramadhan Putra 2112033
3 Reza Anderta 2112034
4 Zulfi Andre 2112040
5 Tiara Apriliani 2112043
Catatan Tanggal ParafDosenPembimb ing
LEMBAR PENUGASAN
Kelompok : I (Satu)
Praktikum : Teknik Reaksi Kimia Modul Percobaan :Energi Aktivasi Tanggal Praktikum :
Dosen Pembimbing : M. Zulfikar Luthfi,S.TP,M.T Analis/Asisten :Faldi Lulrahman, M.T
No NamaPraktikan BukuPokok
1 Rara Nurrahmi 2112032
2 Renold Ramadhan Putra 2112033
3 Reza Anderta 2112034
4 Zulfi Andre 2112040
5 Tiara Apriliani 2112043
Adapun penugasan pada praktikum ini adalah sebagai berikut:
Dicuplik sampel setiap 10 menit
BAB I
PENDAHULUAN
1.1 Latar Belakang
Saat ini kehidupan manusia sudah sangat berkembang dan tidak dapat dipisahkan dari bahan- bahan kimia, baik dalam kehidupan rumah tangga, kesehatan, pendidikan, perhiasan, dan lain- lain. Itu semua berhubungan dengan bahan kimia. Dalam suatu reaksi kimia terdapat perbedaan laju reaksi antara reaksi satu dengan reaksi yang lain misalnya, saat membakar sampah.
Proses berlangsungnya suatu reaksi kimia dapat dipengaruhi oleh beberapa faktor. Suatu reaksi akan berlangsung secara cepat apabila frekuensi tumbukan antar partikel dan zat- zat yang bereaksi sering terjadi. Sebaliknya, reaksi akan berlangsung secara lambat apabila hanya sedikit partikel zat- zat yang mengalami tumbukan titik. Beberapa faktor yang mempengaruhi ketika reaksi adalah konsentrasi, luas permukaan, suhu dan katalis. Menurut tumbukan, reaksi berlangsung sebagai hasil tumbukan antar partikel pereaksi. Akan tetapi, tidaklah setiap tumbukan menghasilkan reaksi, melainkan hanya tumbukan antar partikel yang memiliki energi cukup serta arah tumbukan yang tepat. Laju reaksi sangat penting untuk dipelajari karena dengan mengetahui laju reaksi dan mengetahui hal- hal yang mempengaruhinya sehingga dapat menerapkannya dalam kehidupan misalnya, dalam kegiatan industri. Dengan mengetahui laju reaksi dapat membuat produksi lebih terdeteksi sehingga dapat jumlah produk dalam waktu yang bisa diperhitungkan.
Cabang ilmu yang khusus mempelajari tentang laju reaksi disebut kinetika kimia. Tujuan utama kinetika kimia adalah untuk menjelaskan bagaimana laju bergantung pada konsentrasi reaktan dan mengetahui mekanisme suatu reaksi berdasarkan pengetahuan tentang laju reaksi yang diperoleh dari experimen (Oxtoby:2001).
Pada percobaan ini dilakukan reaksi menggunakan asam oleat yang akan menghasilkan metil oleat. Percobaan ini berfungsi untuk dapat menghitung konstanta laju reaksi esterifikasi dan orde reaksi.
1.2 Tujuan Praktikum
Adapun tujuan praktikum ini adalah:
1. Menghitung konstanta laju reaksi esterifikasi asam oleat.
2. Menghitung Orde Reaksi esterifikasi asam oleat
3. Menganalisis persamaan reaksi dari percobaan esterifikasi asam oleat
BAB II
TINJAUAN PUSTAKA
2.1 Tinjauan Pustaka
Secara umum laju reaksi merupakan laju perubahan konsentrasi reaktan atau laju penambahan/pengurangan produk reaksi. Laju reaksi dipengaruhi oleh beberapa faktor yaitu:
1. Konsentrasi 2. Temperature 3. penambahan katalis
Pada percobaan ini penentuan laju reaksi asam oleat menjadi metil oleat ditentukan dengan persamaan reaksi dari esterifikasi asam oleat yaitu:
Oleic acid + Metanol ↔ Metil Oleat + Air
Dari percobaan reaksi tersebut secara matematika persamaan kinetika reaksi dapat dituliskan :
−dca
dt =k Can Ca = kosentrasi asam oleat
t = waktu reaksi
k = konstanta laju reaksi n = orde laju reaksi
Penentuan orde dan konstanta laju reaksi dapat ditentukan dengan beberapa metode yaitu:
1. Metode Diferensial 2. Metode Integral 3. Metode Paruh Waktu 4. Metode Relaksasi
5. Metode Analisis Guggenheim A. Metode integrasi
∫
−dcaca =∫
k .dtB. Metode diferensial
ln−dca
dt =lnk+nlnca
Laju reaksi merupakan peristiwa perubahan konsentrasi reaktan atau produk dalam satuan waktu. Laju reaksi juga dapat dinyatakan sebagai suatu laju terhadap berkurangnya konsentrasi suatu pereaksi. Konstanta laju reaksi merupakan laju reaksi bila konsentrasi dari masing- masing jenis adalah satu.
(Keenan,1984)
Kecepatan laju reaksi yang berbanding lurus terhadap konsentrasi dengan satu atau dua pengikut berpangkat dua akan disebutkan sesuai jumlah pangkat.
Reaksi disebut bertingkat tiga apabila kecepatan reaksinya berbanding lurus dengan konsentrasi pangkat tiga. Biasanya laju reaksi tidak bergantung pada orde reaksi, suatu reaksi yang merupakan proses satu tahap didefinisikan dengan berdasarkan reaksinya yaitu reaksi dasar. (Petrucci,1982)
Molaritas mnyatakan banyaknya jumlah mol terlarut dalam tiap liter larutan. Normalitas menyataka jumlah ekivalen zat terlarut dalam tiap liter larutan. Molalitas menyatakan jumlah mol zat terlarut dalam tiap 1000 gr pelarut murni. Sedangkan fraksi mol menyatakan perbandingan mol salah satu komponen dengan jumlah mol semua komponen.( Syukri,1999)
Berdasarkan teori tumbukan yang menyatakan bahwa sebelum terjadinya molekul pereaksi haruslah saling bertumbukan sehingga sebagian molekul pada tumbukan ini akan membentuk sebuah suatu molekul. Molekul yang akan mampu bersifat mengaktivasi diri secara langsung. Molekul tersebut berubah menjadi hasil reaksi agar reaksi dapat membentuk kompleks yang akan aktif. Walaupun demikian, molekul- molekul ini hanya akan mempunyai energi minimum yang disebut energi aktivasi.( Sukardjo,2002)
Hukum laju reaksi merupakan suatu bentuk persamaan yang menyatakan laju reaksi sebagai fungsi dari konsentrasi semua spesi yang ada termasuk produkproduk yang dihasilkan dalam reaksi tersebut. Hukum laju reaksi mempunyai dua penerapan utama, yakni penerapan teoritis yang merupakan pemandu dalam mekanisme reaksi sedangkan penerapan praktiknya akan dilakukan setelah mengetahui hukum laju reaksi dan konstanta laju reaksi.
Untuk reaksi kimia sebagai berikut:
aA + bB → cC + dD hubungan antara laju reaksi dengan molaritas adalah :
υ = k A
¿
¿¿
[ B
¿ ¿n dimana :
υ = laju reaksi
k = konstanta laju reaksi [ A] = konsentrasi zat A [B ] = konsentrasi zat B
m = orde reaksi terhadap zat A n = orde reaksi terhadap B
Persamaan laju reaksi untuk suatu zat a dapat ditulis sebagai berikut:
Ra = n/t RA = laju reaksi
n = jumlah mol zat A yang terbentuk t = waktu
RA memiliki harga positif jika zat tersebut terbentuk dan akan memiliki harga negatif jika zat tersebut digunakanuntuk bereaksi.(Atkins,1996)
Adapun faktor- faktor yang mempengaruhi laju reaksi atau kecepatan reaksi sebagai berikut:
A. Konsentrasi
Jika kecepatan suatu zat semakin besar maka laju reaksinya akan semkain besar pula dan sebaliknya jika konsentrasi semakin kecil maka laju reaksinya juga akan semakin kecil pula. Untuk beberapa reaksi laju reaksi dapat
dinyatakan dengan persamaan matematis yang dikenal dengan hukum laju reaksi atau persamaan laju reaksi. Pangkat- pangkat dalam persamaaan laju reaksi dinamakan orde reaksi. Menentukan orde reaksi dalam suatu reaksi kimia pada prinsipnya menentukan pengaruh seberapa besar perubahan konsentrasi laju reaksi terhadap konsentrasi pereaksi.(Charles, 2004)
B. Luas Permukaan
Reaksi yang berlangsung dalam sistem homogen sangat berbeda dengan reaksi yang berlangsung dalam sistem heterogen. Pada reaksi homogen campuran campuran zatnya bercampur seluruhnya. Hal ini dapat mempercepat berlangsungnya reaksi kimia karena molekul- molekul ini dapat bersentuhan satu sama lain. Dalam sistem reaksi hanya berlangsung pada bidang- bidang yang bersentuhan dari kedua fase yang bereaksi. Reaksi kimia yang berlangsung pada kedua molekul- molekul, atom- atom atau ion- ion dari zat- zat yang bereaksi terlebih dahulu bertumbukan. Semakin luas permukaan suatu reaksi maka semakin cepat reaksi itu I-7 berlangsung begitupun sebaliknya semakin kecil luas permukaan maka akan semakin lambat reaksi itu berlangsung. ( Chang,2001)
C. Katalis
Berbagai reaksi berlangsung lambat dapat dipercepat dengan menambahkan zat lain yang disebut dengan katalis. Konsep yang menerapkan pengaruh terhadap laju reaksi diantaranya katalis dimana menurunkan energi- energi pengaktifan suatu reaksi dengan jalan membentuk tahap- tahap reaksi yang baru. Ada dua jenis katalis yaitu katalis homogen dan katalis heterogen.
Katalis homogen dalah katalis yang satu fase dengan zat, yang jenis katalis ini pada umumnya ikut bereaksi tetapi pada akhirnya reaksi ini akan kembali ke bentuk semula. Katalis heterogen adalah katalis yang tidak satu fase dengan zat- zat yang bereaksi jenis katalis ini umunya logam- logam dan reaksi yang tercepat umumnya pada gas. (Supardi,2008)
Orde suatu reaksi adalah jumlah pangkat faktor konsentrasi dalam hukum laju reaksi berbentuk differensial. Pada umumnya orde reaksi merupakan bilangan bulat dan kecil namun dalam beberapa kasus dapat berupa bilangan pecahan atau nol. Orde reaksi terhadap suatu zat tertentu tidak sama dalam
koefisien dalam persamaan stoikiometri. Reaksi harga n memberikan orde reaksi jika n=0 maka laju reaksinya disebut orde nol terhadap x. Hal ini berarti bahwa perubahan konsentrasi tidak berpengaruh pada laju reaksi.
(Chang,2001) D. Suhu/ Temperatur
Pada suhu yang tinggi, energi molekul- molekul akan bertambah. Laju reaksi meningkat dengan naiknya suhu. Biasanya kenaikan suhu sebesar 10C akan menyebabkan kenaikan laju reaksi sebesar dua atau tiga kalinya. Kenaikan laju reaksi ini disebabkan dengan kenaikan suhu atau menyebabkan semakin cepatnya molekul- molekul sehingga memperbesar kemungkinan terjadi tabrakan efektivitas. Energi tumbukan suatu reaksi dapat berlangsung disebut energi aktivasi. (Chang,2001)
E. Tekanan gas
Jika tekanan gas diperbesar maka volume gas itu diperkecil, sehingga letak partikel makin berdekatan dan makin mudah bertumbukan, jadi makin besar tekanan gas maka akan semakin cepat reaksinya. Sebaliknya makin kecil tekann gas maka akan semakin lamabat reaksinya.
F. Teori Tumbukan
Pengaruh dari berbagai faktor terhadap laju reaksi dapat dijelaskan dengan teori tumbukan. Menurut teori ini, suatu reaksi berlangsung sebagai hasil tumbukan antar partikel pereaksi. Akan tetapi tidaklah setiap tumbukan menghasilkan reaksi melainkan hanya tumbukan antar partikel yang memiliki energi cukup serta arah tumbukan yang cepat. Tumbukan yang menghasilkan reaksi, kita sebut tumbukan efektif. Energi minimum yang harus dimiliki oleh partikel- partikel pereaksi shinga menghasilkan tumbukan efektif disebut energi pengaktifan ( Ea = energi aktivasi ).
Faktor- faktor yang mempengaruhi suatu tumbukan adalah sebagai berikut:
Jumlah partikel atau konsetrasi
Temperatur
Luas permukaan
Menambah katalisator
BAB III
METODOLOGI PERCOBAAN
3.1 Alat
Adapun alat yang digunakan pada praktikum ini adalah 1. Labu ukur (500ml)
=>Untuk pengenceran larutan 2. Buret (100ml)
=> Untuk alat titrasi 3. Erlenmeyer (250ml)
=>Sebagai tempat pentitrasian 4. Pipet ukur (5ml)
=>Untuk memindahkan larutan yang akan dititrasi ke erlenmeyer 5. Labu leher (1000ml)
=>Sebagai reaktor 6. Gelas piala (100ml)
=>Sebagai wadah atau penampung cairan 7. Gelas ukur (100ml)
=>Untuk mengukur volume larutan 8. Neraca analitik
=>Untuk menimbang asam oleat 9. Kondensor
=>Tempat mengembunkan uap hasil distilasi 10. Corong
=>Untuk membantu memasukkan larutan ke dalam wadah 11. Termometer
=>Untuk mengukur temperatur larutan ke dalam wadah 12. Hot plate
=>Untuk memanaskan larutan
3.2 Bahan
Adapun bahan yang digunakan dalam praktikum ini adalah sebagai berikut:
1. Asam oleat
=>Untuk reaksi esterifikasi 2. Metanol
=>Untuk direaksikan dengan asam oleat 3. Asam sulfat 98%
=>Untuk proses esterifikasi 4. Asam oksalat 0,1N
=>Untuk standarisasi 3.3 Prosedur Percobaan
1. Reaksi Esterifikasi
Siapkan labu leher tiga dan ditimbang berat kosong labu leher tiga
Ditimbang sebanyak 100ml asam oleat beserta labu leher 3 sebagai data berat asam oksalat
Tambahkan 30 ml metanol kedalam labu leher tiga
Pasang kondensor dan thermometer (diset temperature tetap sesuai dengan penugasan) dan jalankanreaksi selama 40 menit dan ulangi untuk perbandingan volume etanol lainnya.
2. Standarisasi larutan NaOH
Standarisasi NaOH dengan asam oksalat 0,1 N dengan cara memasukkan 5 ml larutan asam oksalat ke dalam erlenmeyer dan tambahkan beberapa tetes indikator pp dan titrasi sampai warna pink hilang dan catat volume NaOH
3. Penentuan konsentrasi asam oleat sisa
Ambil sampel larutan dari labu leher 3, masukkan ke erlenmeyer tambahkan beberapa tetes indikator pp lalu lakukan titrasi dengan NaOH sampai warna pink dan catat volume larutan NaoH
3.4 Skema Kerja
LEMBAR DATA PENGAMATAN
Kelompok : I (satu)
Praktikum : Teknik Reaksi Kimia
Modul Percobaan : Energi Aktivasi Tanggal Praktikum : 13 Mei 2023 Dosen Pembimbing : M. Zulfikar Luthfi Analis/Asisten : Faldi Lulrahman MT
Adapun data pengamatan yang didapatkann pada praktikum ini adalah sebagai berikut:
Standarisasi oksalat 1. V. awal : 0 ml
V. akhir : 5,2 ml Terpakai = 5,2 ml 2. V. awal : 4,9 ml
V. akhir : 9,9 ml Terpakai = 5 ml 3. V. awal : 9,9 ml V. akhir : 15 ml Terpakai = 5.2 ml Standarisai oleat 1. 10 menit
V. awal : 11,7 ml V. akhir : 34,9 ml Terpakai = 23,2 ml 2. 20 menit
V. awal : 42,9 ml V. akhir : 12 ml Terpakai = 30,9 ml 3. 30 menit
V. awal : 0 ml V. akhir : 36,4 ml Terpakai = 36,4 ml
Berat lagu leher 3 = 326
Labu + oleat 100 ml = 412 gr
Berat oleat 100 ml = 86 gr
Methanol = 50 ml
Suhu (T) = 65°c
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil
Adapun hasil yang diperoleh dari praktikum ini yaitu sebagai berikut : Waktu (menit) Konsentrasi asam
oleat sisa (M) Ln dc dt
[C]
10 0.45008 1.0512 1.5684
20 0.59946 1.0095 1.8210
30 0.6868 0.9859 1.9873
4.2 Pembahasan
Pada percobaan ini dilakukan penentuan persamaan laju reaksi dari suatu reaksi dengan proses esterifikasi. Reaksi esterifikasi adalah reaksi antara asam karboksilat atau turunannya dengan alkohol melalui pelarut air yang menghasilkan produk hasil reaksi berupa senyawa ester. Pada percobaan ini adam karboksilat yang digunakan adalah asam oleat sedangkan alkohol yang digunakan adalah metanol.
Tujuan dalam praktikum ini adalah untuk menghitung laju reaksi dengan penitiranan 10 menit sampai 30 menit. Kemudian dihitung volume NaOH yang terpakai untuk menentukan asam oleat sisa per waktu 10 menit.
Pada dasarnya orde reaksi adalah banyaknya faktor konsentrasi zat reaktan yang mempengaruhi kecepatan reaksi. penentuan orde reaksi tidak dapat dilakukan/ ditentukan dari percobaan. Reaksi yang berlangsung dalam sistem homogen berbeda dengan reaksi yang terjadi secara heterogen. Pada reaksi homogen campuran zatnya bercampur seluruhnya hal ini dapat mempercepat berlangsungnya reaksi kimia, karena molekul - molekulnya dapat bersentuhan satu dengan yang lain. Dalam sistem heterogen hanya berlangsung pada budang - bidang yang bersentuhan dari kedua fasenya.
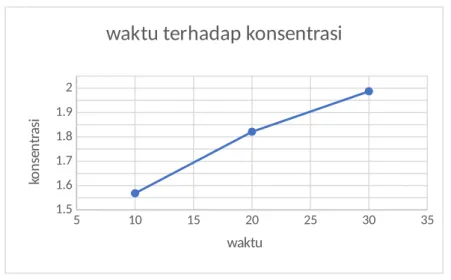
4.2.1 Pengaruh waktu terhadap konsentrasi
Berikut grafik hubungan waktu terhadap konsentrasi
5 10 15 20 25 30 35
1.5 1.6 1.7 1.8 1.9 2
waktu terhadap konsentrasi
waktu
konsentrasi
Gambar 4.1 Grafik hubungan pengaruh waktu terhadap konsentrasi
pada grafik dapat kita amati bahwa setiap berjalannya waktu maka konsentrasi dari metil oleat yang sebagai produk akan meningkat konsentrasinya. Dimana nilai terendah berada pada waktu 10 menit yaitu 1.5684 sedangkan nilai tertinggi berada pada waktu 30 menit yaitu 1.9813.
Dapat kita simpulkan bahwa semakin lama waktu yang digunakan maka konsentrasi dari produk akan semakin besar yang berbanding terbalik denga reaktan.
BAB V PENUTUP
5.1 Kesimpulan
Adapun kesimpulan yang dapat diambil dari praktikum ini yaitu sebagai berikut:
1. Konstanta laju reaksi yang diperoleh semakin tinggi konsentrasinya maka semakin tinggi laju reaksinya.
2. Orde reaksi yang diperoleh yaitu orde reaksi 1, dimana konsentrasi dan laju reaksi berbanding lurus.
3. Dari persamaan laju reaksi yang diperoleh, seiring bertambahnya waktu maka laju reaksi akan semakin tinggi.
4. Faktor - faktor yang mempengaruhi laju reaksi adalah konsentrasi, suhu, luas permukaan dan katalis.
5.2 Saran
Adapun saran yang dapat diberikan pada praktikum ini adalah sebagai berikut:
1. Diharapkan praktikan dalam pemanasan, menjaga suhu pemanasan sesuai penugasan agar hasil yang diperoleh maksimal.
2. Diharapkan praktikan melakukan titrasi dengan teliti.
LAMPIRAN PERHITUNGAN
A. Pembuatan larutan standar
Larutan standar primer H2C2O4 (Asam oksalat) Gr = N X Be X V(ml)
1000 =0.1x63x100
1000 =0.63gram
Larutan standar sekunder NaOH Gr = N X Be X V(ml)
1000 =0.1x40x150
1000 =0.6gram
B. Standarisasi NaOH
V oksalat x N oksalat = v NaOH X N NaOH 5 ml x 0.1 N = 5.133 ml x N NaOH
N NaOH = 5X0.1N
5.133 =0.097M
C. Penentuan konsentrasi asam oleat sisa V oksalat x N oksalat = v NaOH X N NaOH
T 10 menit
M oleat = v NaOH X M NaOH
5ml =23,2x0,097
5ml =0.45008M
T 20 menit
M oleat = v NaOH X M NaOH
5ml =30.9x0,097
5ml =0.59946M
T 30 menit
M oleat = v NaOH X M NaOH
5ml =35.4x0,097
5ml =0.6868M
D. Konsentrasi asam oleat awal (co) Co oleat = gr
mlx1000
v ml = 86
282.47x1000
100 =3.0446M
E. Laju reaksi
T 10 menit = ln (-dca/dt) = ln(- 3.0446−0.45008
10 =−ln 0.3495=1.0512
T 20 menit = ln (-dca/dt) = ln(- 3.0446−0.59946
10 =−ln 0.3644=1.0095
T 30 menit = ln (-dca/dt) = ln(- 3.0446−0.6868
10 =−ln 0.3731=0.9839
F. Konsentrasi akhir asam oleat
T 10 menit = ln C = 0.45008 C = 1.5684
T 20 menit = ln C = 0.59944 C = 1.8210
T 30 menit = ln C = 0.6868 C = 1.9873
ENERGI AKTIVASI
LEMBAR PENGESAHAN
Kelompok : I (Satu)
Praktikum : Teknik Reaksi Kimia Modul Percobaan : Energi Aktivasi Tanggal Praktikum :
Dosen Pembimbing : M. Zulfikar Luthfi,S.TP,M.T Analis/Asisten :Faldi Lulrahman, M.T
No NamaPraktikan BukuPokok
1 Rara Nurrahmi 2112032
2 Renold Ramadhan Putra 2112033
3 Reza Anderta 2112034
4 Zulfi Andre 2112040
5 Tiara Apriliani 2112043
Catatan Tanggal ParafDosenPembimb ing
LEMBAR PENUGASAN
Kelompok : I (Satu)
Praktikum : Teknik Reaksi Kimia Modul Percobaan :Energi Aktivasi Tanggal Praktikum :
Dosen Pembimbing : M. Zulfikar Luthfi,S.TP,M.T Analis/Asisten :Faldi Lulrahman, M.T
No NamaPraktikan BukuPokok
1 Rara Nurrahmi 2112032
2 Renold Ramadhan Putra 2112033
3 Reza Anderta 2112034
4 Zulfi Andre 2112040
5 Tiara Apriliani 2112043
BAB I
PENDAHULUAN
1.1 Latar Belakang
Proses untuk mencapai keadaan transisi kompleks membutuhkan energi yang disuplai dari luar sistem. Energi inilah yang disebut dengan energi aktivasi (dalam kimia, disebut juga sebagai energi permulaan). Pada reaksi endoterm ataupun eksoterm, keduanya memiliki energi aktivasi yang positif, karena keadaan transisi kompleks memiliki tingkat energi yang lebih tinggi dari reaktan. (Castellan : 1982)
Energi aktivasi adalah energi minimum yang dibutuhkan oleh suatu reaksi kimia agar dapat berlangsung. Energi aktivasi memiliki simbol Ea dengan E menotasikan energi dan a yang ditulis subscribe menotasikan aktivasi. Kata aktivasi memiliki makna bahwa suatu reaksi kimia membutuhkan tambahan energi untuk dapat berlangsung. (Vogel,1994).
Dalam reaksi endoterm, energi yang diperlukan untuk memutuskan ikatan dan sebagainya disuplai dari luar sistem.
Pada reaksi eksoterm, yang membebaskan energi, ternyata juga membutuhkan suplai energi dari luar untuk mengaktifkan reaksi tersebut. (Atkins,1999).
Dalam kinetika, suatu reaksi berlangsung melalui beberapa tahap. Diawali dengan tumbukan antar partikel reaktan. Setelah reaktan bertumbukan, maka akan terjadi penyusunan ulang ikatan dalam senyawa reaktan menjadi susunan ikatan yang berbeda ( membentuk senyawa produk ). (Vogel : 1994)
1.2 Tujuan Praktikum
Adapun tujuan praktikum ini adalah sebagai berikut:
1. Mempelajari fenomena perubahan energy aktivasi.
2. Menganalisis energy aktivasi reaksi esterifikasi.
BAB II
TINJAUN PUSTAKA
2.1 Teori Dasar
Energi aktivasi adalah energi minimum yang dibutuhkan oleh suatu reaksi kimiaagar dapat berlangsung. Energi aktivasi memiliki simbol Ea dengan E menotasikan energi dan a yang ditulis subscribe menotasikan aktivasi. Kata aktivasi memiliki maknabahwa suatu reaksi kimia membutuhkan tambahan energi untuk dapat berlangsung. Dalam reaksi endoterm, energi yang diperlukan untuk memutuskan ikatan dansebagainya disuplai dari luar sistem. Pada reaksi eksoterm, yang membebaskanenergi, ternyata juga membutuhkan suplai energi dari luarbuntuk mengaktifkan reaksitersebut (Castellan GW.
1982).
Istilah energi aktifasi (Ea) pertama kali diperkenalkan oleh Svante Arrhenius dandinyatakan dalam satuan kilojule per mol.
Terkadang suatu reaksi kimia membutuhkanenergi aktivasi yang teramat sangat besar, maka dari itu dibutuhkan suatu katalis agarreaksi dapat berlangsung dengan pasokan energi yang lebih rendah. Jika terdapatsuatu reaksi reaktan menjadi produk, maka jika reaksi diatas berlangsung secaraeksoterm. Persamaan Arrhenius mendefisinkan secara kuantitatif hubungan antaraenergi aktivasi dengan konstanta laju reaksi , dimana A adalah faktor frekuensi darireaksi, R adalah konstanta universal gas, T adalah temperatur dalam Kelvin dan kadalah konstanta laju reaksi. Dari persamaan diatas dapat diketahui bahwa Eadipengaruhi oleh temperatur (Atkins PW. 1999).
Dalam kinetika, suatu reaksi berlangsung melalui beberapa tahap. Diawalidengan tumbukan antar partikel reaktan. Setelah reaktan bertumbukan, maka akanterjadi penyusunan ulang ikatan dalam senyawa reaktan menjadi susunan ikatan yangberbeda ( membentuk senyawa produk ) (Castellan GW.
1982).
Dalam penyusunan ini, akan ada pemutusan ikatan dan pembentukan ikatanyang baru, yang membutuhkan sejumlah energi. Ketika beberapa ikatan reaktan putusdan beberapa ikatan baru terbentuk, tercapailah suatu keadaan dimana dalam sistemterdapat sejumlah reaktan dan produk. Keadaan ini kita sebut sebagai transisikompleks. Dalam keadaan transisi kompleks, memiliki campuran antara produk dan reaktan yang cenderung kurang stabil, karena produk yang terbentuk dapatmembentuk reaktan kembali. Keadaan ini memiliki energi yang cukup tinggi, karenasistem tidak stabil (Vogel. 1994)
Proses untuk mencapai keadaan transisi kompleks membutuhkan energi yangdisuplai dari luar sistem. Energi inilah yang disebut dengan energi aktivasi. Pada reaksiendoterm ataupun eksoterm, keduanya memiliki energi aktivasi yang positif, karenakeadaan transisi kompleks memiliki tingkat energi yang lebih tinggi dari reaktan.
2.2 Faktor-faktor yang mempengaruhi energi aktivasi Beberapa faktor yang mempengaruhi energi aktivasi adalah sebagai berikut :
1. Suhu
Fraksi molekul-molekul mampu untuk bereaksi dua kali lipat dengan peningkatansuhu sebesar 10C, hal ini menyebabkan laju reaksi berlipat ganda.
2. Faktor frekuensi
Dalam persamaan ini kurang lebih konstan untuk perubahan suhu yang kecil. Perludilihat bagaimana perubahan energi dari fraksi molekul sama atau lebih dari energiaktivasi
3. Katalis
Katalis akan menyediakan rute agar reaksi berlangsung dengan energi aktivasi yanglebih rendah.
(Atkins PW. 1999)
BAB III
METODOLOGI PERCOBAAN
3.1 Alat
Adapun alat yang digunakan pada praktikum ini adalah 13. Labu ukur (500ml)
=>Untuk pengenceran larutan 14. Buret (100ml)
=> Untuk alat titrasi 15. Erlenmeyer (250ml)
=>Sebagai tempat pentitrasian 16. Pipet ukur (5ml)
=>Untuk memindahkan larutan yang akan dititrasi ke erlenmeyer 17. Labu leher (1000ml)
=>Sebagai reaktor 18. Gelas piala (100ml)
=>Sebagai wadah atau penampung cairan 19. Gelas ukur (100ml)
=>Untuk mengukur volume larutan 20. Neraca analitik
=>Untuk menimbang asam oleat 21. Kondensor
=>Tempat mengembunkan uap hasil distilasi 22. Corong
=>Untuk membantu memasukkan larutan ke dalam wadah 23. Termometer
=>Untuk mengukur temperatur larutan ke dalam wadah 24. Hot plate
=>Untuk memanaskan larutan
3.2 Bahan
Adapun bahan yang digunakan dalam praktikum ini adalah sebagai berikut:
5. Asam oleat
=>Untuk reaksi esterifikasi 6. Metanol
=>Untuk direaksikan dengan asam oleat 7. Asam sulfat 98%
=>Untuk proses esterifikasi 8. Asam oksalat 0,1N
=>Untuk standarisasi 3.3 Prosedur Percobaan
4. Reaksi Esterifikasi
Siapkan labu leher tiga dan ditimbang berat kosong labu leher tiga
Ditimbang sebanyak 100ml asam oleat beserta labu leher 3 sebagai data berat asam oksalat
Tambahkan 30 ml metanol kedalam labu leher tiga
Pasang kondensor dan thermometer (diset temperature tetap sesuai dengan penugasan) dan jalankanreaksi selama 40 menit dan ulangi untuk perbandingan volume etanol lainnya.
5. Standarisasi larutan NaOH
Standarisasi NaOH dengan asam oksalat 0,1 N dengan cara memasukkan 5 ml larutan asam oksalat ke dalam erlenmeyer dan tambahkan beberapa tetes indikator pp dan titrasi sampai warna pink hilang dan catat volume NaOH
6. Penentuan konsentrasi asam oleat sisa
Ambil sampel larutan dari labu leher 3, masukkan ke erlenmeyer tambahkan beberapa tetes indikator pp lalu lakukan titrasi dengan NaOH sampai warna pink dan catat volume larutan NaoH
3.4 Skema Kerja
LEMBAR DATA PENGAMATAN
Kelompok : I (satu)
Praktikum : Teknik Reaksi Kimia
Modul Percobaan : Energi Aktivasi Tanggal Praktikum : 13 Mei 2023 Dosen Pembimbing : M. Zulfikar Luthfi Analis/Asisten : Faldi Lulrahman MT
Adapun data pengamatan yang didapatkann pada praktikum ini adalah sebagai berikut:
Standarisasi oksalat 4. V. awal : 40 ml
V. akhir : 46 ml Terpakai = 6 ml 5. V. awal : 3,8 ml V. akhir : 9 ml Terpakai = 5,2 ml 6. V. awal : 0 ml
V. akhir : 5,7 ml Terpakai = 5.7 ml Standarisai oleat 4. 60°c
V. awal : 0 ml V. akhir : 45,5 ml Terpakai = 45,5 ml 5. 65c
V. awal : 9 ml V. akhir : 49,2 ml Terpakai = 40,2 ml 6. 70°c
V. awal : 5,7 ml V. akhir : 46,1ml Terpakai = 40,4 ml 7. 75°c
V. awal : 6 ml V. akhir : 35 ml Terpakai = 28 ml
Berat lagu leher 3 = 326
Labu + oleat 100 ml = 412 gr
Berat oleat 100 ml = 86 gr
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil
Adapun hasil yang diperoleh dari praktikum ini yaitu sebagai berikut:
Temperature Konstanta 1
R.T ln K
60°c 0,0359 0,000361 3,3270
65°c 0,0291 0,000356 3,5370
70°c 0,0235 0,000351 4,2976
75°c 0,0189 0,000346 4,8173
7.2 Pembahasan
Pada praktikum ini dilakukan reaksi esterifikasi antara asam oleat dengan methanol dengan tujuan untuk mengamati energi aktivasi pada reaksi ini. Energi aktivasi adalah energi minimum yang butuhkan agar reaksi kimia tertentu dapat terjadi. Adapun variasi suhu pada reaksi ini yaitu pada suhu 60°c, 65°c, 70°c, dan 75°c. energi aktivasi juga dipengaruhi oleh beberapa faktor yaitu temperature, katalis, konsentrasi,. Disini dibuat grafik hubungan ln K vs 1
R.T untuk mengatahui pengaruh dari variasi yang dilakukan.
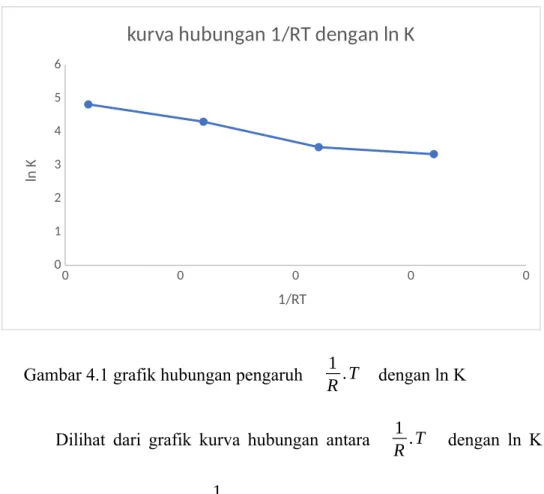
4.2.1 Hubungan pengaruh 1
R.T dengan ln K
0 0 0 0 0 0
1 2 3 4 5 6
kurva hubungan 1/RT dengan ln K
1/RT
ln K
Gambar 4.1 grafik hubungan pengaruh 1
R.T dengan ln K Dilihat dari grafik kurva hubungan antara 1
R.T dengan ln K adalah semakin besar nilai 1
R.T maka nilai ln K semakin kecil.
Tujuan dari variasi suhu yang diberikan adalah untuk mengetahui pengaruh suhu terhadap energi aktivasinya, karena semakin tinggi suhu maka laju reaksi akan semakin besar, dengan demikian semakain tinggi suhu yang diberikan maka energi aktivasi akan semakin kecil. Energi aktivasi merupakan energi minimum yang dibutuhkan untuk mereaksikan suatu reaksi, dengan kecilnya energi aktivasi maka laju reaksi akan semakin tinggi dan akan menyebabkan pergerakan partikel menjadi cepat.
Dengan kata lain dengan tingginya suhu reaksi, maka semakin banyak tumbukan yang terjadi pada reaksi. Konstanta laju reaksi (k) bergantung pada temperature (T) reaksi dan besarnya energi aktivasi (Ea). Hubungan antara k, T, dan Ea yang dinyatakan dalam persamaan Arhenius.
BAB V PENUTUP
5.1 Kesimpulan
Adapun kesimpulan yang diperoleh pada praktikum ini adalah:
1. Energi aktivasi dipengaruhi oleh suhu, dimana semakin tinggi suhu maka akan semakin besar pula energi aktivasinya
2. Hubungan ln K dengan 1
R.T , semakin besar suhu maka akan semakin besar pula konstanta laju rekasinya
3. Faktor yang mempengaruhi energi aktivasi adalah suhu, konsentrasi dan penambahan katalis
5.2 Saran
Adapun saran yang dapat diberikan pada praktikum ini adalah sebagai berikut:
1. Sebaiknya pada saat melakukan percobaan gunakan api kecil agar suhu konstan dan data yang diperoleh sesuai
2. Hati – hati saat melakukan pemanasan dan hindari dari bahan yang mudah terbakar karena dapat terjadinya kecelakaan kerja