1 BAB I
PENDAHULUAN 1. Material
adalah sesuatu yang disusun/dibuatoleh bahan. Material digunakan untuk transportasi hingga makanan Ilmu material/bahan merupakan pengetahuan dasar tentang struktur, sifat-sifat dan pengolahan bahan.
Jenis Material
•LogamKuat, ulet, mudah dibentuk dan bersifat penghantar panas dan listrik yang baik •Keramik Keras, getas dan penghantar panas dan listrik yang buruk
•Polimer kerapatan rendah, penghantar panas dan listrik buruk dan mudah dibentuk •Komposit merupakan ganbungan dari dua bahan atau lebih yang masing-masing sifat tetap.
Pengetahuan Material Teknik Dasar
Didalam industri manufaktur tidak akan lepas dengan satu bidang ilmu teknik yang berhubungan dengan material. Secara umum material teknik diklasifikasikan menjadi 2 golongan yakni :
1. Metal (logam)
2. Non Metal (bukan logam)
Metal (logam)
Jika ditinjau dari sudut pandang susunan unsur dasar, metal (logam) dibagi menjadi 2, yakni : 1.1 Logam murni (hanya terdiri satu jenis atom saja), contoh : besi (Fe) murni, tembaga (Cu) murni
1.2 Logam paduan atau metal alloy (terdiri dari dua atau lebih jenis atom) Logam paduan dibedakan menjadi 3 jenis :
a. Larut padat interstisi (menyisip), yaitu : suatu paduan yang terjadi bila atom yang larut mempunyai diameter yang jauh lebih kecil daripada yang dilaruti, contoh : Pada baja Carbon yang mengalami Nitriding dimana atom Fe (yang dilaruti) mempunyai diameter atom lebih besar bila dibandingkan dengan atom N (yang larut) dengan diameter lebih kecil sehingga menyisip diantara atom Fe.
b. Larut Padat Subtitusi (menggantikan posisi yang dilaruti), yaitu : suatu paduan yang terjadi terutama bila diameter atom yang larut hampir sama dengan diameter atom yang dilaruti, contoh : Pada paduan alumunium (diameter atom Al dan diameter atom
2 Cu hampir sama), pada stainless steel (diameter atom Fe dan diameter atom Cr hampir sama), dll.
c. Senyawa, yaitu : suatu paduan yang terjadi karena adanya ikatan atom yang sangat kuat, contoh : NaCl (Senyawa garam).
Metal juga dapat diklasifikasikan menjadi jenis, yakni : a. Ferrous (besi)
b. Non Ferrous (bukan besi), contoh : Al dan paduannya, Ni dan paduannya, dll.
Ferrous (besi)
a. Wrought Iron (besi tempa)
Fasa besi tempa berupa ferit (alpha), didalamnya terdapat sisa terak yang masih terperangkap. Terak tersebut banyak mengandung silikat (silikon oksida), bentuknya menyerupai fiber (cukup kuat). Sifat dari besi tempa ini Ulet dan cukup kuat. Contoh komposisi dari besi tempa :
- Carbon : 0.06% - Mangaan : 0.045% - Silicon : 0.101% - Phospor : 0.068%
- Sulfur (belerang) : 0.009% - Terak (dalan berat) : 1.97%
Besi tempa digunakan pada bangunan kereta api, bangunan kapal laut, industri minyak, tujuan arsitektur, perlengkapan pertanian, dll. Umumnya, pembuatan dari besi tempa ini menggunakan dapur puddle (dapur aduk)
b. Steel (Baja)
Baja (Steel) digolongkan menjadi 2, yakni : 2.1 Carbon steel (baja karbon)
Baja karbon dapat digolongkan menjadi 3 macam, yakni : -Baja karbon rendah [Kadar Carbon antara 0,1% hingga 0,20%] -Baja Karbon sedang [Kadar Carbon antara 0,25% hingga 0,55%] -Baja Karbon tinggi [Kadar Carbon antara 0,55% hingga 1,75%]
Pembagian baja karbon yang lain yakni : baja hipoeutektoid [Kadar Carbon Kurang dari 0,8%], baja eutektoid [Kadar Carbon 0,8%] dan baja hipereutektoid [Kadar Carbon lebih dari 0,8%]. Fasa-fasa padat yang ada didalam baja :
3 a) Ferit (alpha) : merupakan sel satuan (susunan atom-atom yang paling kecil dan teratur) berupa Body Centered Cubic (BCC=kubus pusat badan), Ferit ini mempunyai sifat : magnetis, agak ulet, agak kuat, dll.
b) Autenit : merupakan sel satuan yang berupa Face Centered Cubic (FCC =kubus pusat muka), Austenit ini mempunyai sifat : Non magnetis, ulet, dll.
c) Sementid (besi karbida) : merupakan sel satuan yang berupa orthorombik, Semented ini mempunyai sifat : keras dan getas.
d) Perlit : merupakan campuran fasa ferit dan sementid sehingga mempunyai sifat Kuat. e) Delta : merupakan sel satuan yang berupa Body Centered Cubic (BCC=kubus pusat
badan).
2.2 Alloy steel (baja paduan)
Sebenarnya perbedaan mendasar dari baja karbon dengan baja paduan terletak pada dominasi atas unsur dalam suatu baja. Jika yang mendominasi sifat fisik dan mekanik adalah prosentase atau kadar karbon maka dapat disebut sebagai baja karbon sedang bila yang mendominasi sifat fisik dan mekanik adalah paduan (selain unsur karbon) maka dapat disebut sebagai baja paduan. Baja paduan dapat diklasifikasikan menjadi :
a. Baja paduan rendah, yaitu : bila jumlah unsur tambahan selain karbon lebih kecil dari 8%, misalnya : suatu baja terdiri atas 1,35%C; 0,35%Si; 0,5%Mn; 0,03%P; 0,03%S; 0,75%Cr; 4,5%W [Dalam hal ini 6,06%<8%]>
b. Baja paduan tinggi, yaitu : bila jumlah unsur tambahan selain karban lebih dari atau sama dengan 8%, misalnya : baja HSS (High Speed Steel) atau SKH 53 (JIS) atau M3-1 (AISI) mempunyai kandungan unsur : 1,25%C; 4,5%Cr; 6,2%Mo; 6,7%W; 3,3%V.
Tujuan utama dari penambahan unsur paduan sebenarnya untuk memperbaiki sifat-sifatnya seperti : kekuatan tarik, kekuatan impak, ketahanan korosi, ketahanan panas, dll. Pada baja HSS (contoh diatas) mempunyai sifat keras, ulet, tahan temperatur tinggi, dll. 2.3 Cast iron (besi cor)
Umumnya besi cor akan mengandung unsur Fe dan C [3,5% - 4,3%]. Besi cor, diklasifikasikan menjadi :
a. Besi cor putih (white cast iron) Besi cor putih mempunyai fasa sementid+perlit sehingga mempunyai sifat keras dan getas.
b. Besi cor kelabu (grey cast iron) Unsur penyusun dari besi cor kelabu yakni : Fe + C + Silikon (Si). Adanya penambahan unsur Si (Silikon) bertujuan untuk mengurai Sementid menjadi Fe (ferit atau perlit) dan C (grafit). Bentuk grafitnya berupa serpih sehingga secara sederhana dapat dikatakan bahwa fasa besi cor kelabu berupa ferit/perlit + grafit
4 serpih dengan sifat : agak getas yang dikarenakan ujung-ujung grafit berbentuk serpih tajam, akibatnya konsentrasi tegangan tinggi sehingga mudah patah. Contoh penggunaan besi cor kelabu pada konstruksi mesin jahit, blok mesin, lampu hias, mesin bubut, pagar, dll. Keistimawaan besi cor kelabu terhadap baja yakni : mampu meredam getaran.
c. Besi cor bergrafit bulat (ductile cast iron atau noduler cast iron) Unsur penyusun dari besi cor bergrafit bulat yakni : Fe + C + Si + Mg / Ce. Penambahan Mg atau Ce bertujuan untuk “melunakan” grafit menjadi bulat sehingga konsentrasi tegangan sedikit sekali (besi cor bersifat ulet). Contoh penggunaan besi cor bergrafir bulat pada kontruksi penjepit rel kereta api, batang torak kompresor, dll.
d. Besi cor mampu tempa (malleable cast iron) Untuk membuat besi cor mampu tempa dapat dibuat dengan memanaskan besi cor putih hingga mencapai suhu 700 Derajat Celcius selama 30 Jam. Hal ini bertujuan agar sementid terturai menjadi Fe (ferit) dan C (grafit). Grafit yang dihasilkan berbentuk pipih. Contoh penggunaan besi cor mampu tempa pada spare part yang berukuran kecil-kecil.
Non Metal
Dikategorikan menjadi 3 jenis yakni : Polimer, Komposit dan keramik. Keramik merupakan senyawa-senyawa dari karbida dan oksida logam atau oksida metaloid (Si). Perbedaan logam dengan polimer yakni bahwa logam mempunyai butir-butir (kristal-kristal) sedang polimer terdiri dari mer-mer (molekul-molekul) yang berikatan satu dengan lainnya. Butir (kristal) adalah kumpulan atom-atom yang mempunyai orientasi atau arah yang sama.
5 BAB II
PEMBAHASAN A. Klasifikasi Material Teknik:
Secara garis besar material teknik dapat diklasifikasikan menjadi : 1. Material logam
2. Material non logam
Berdasarkan pada komposisi kimia, logam dan paduannya dapat dibagi menjadi dua golongan yaitu:
1. Logam besi / ferrous
2. Logam non besi / non ferrous
Logam-logam besi merupakan logam dan paduan yang mengandung besi (Fe) sebagai unsur utamanya.
Logam-logam non besi merupakan meterial yang mengandung sedikit atau sama sekali tanpa besi. Dalam dunia teknik mesin, logam (terutama logam besi / baja) merupakan material yang paling banyak dipakai, tetapi material-material lain juga tidak dapat diabaikan. Material non logam sering digunakan karena meterial tersebut mempunyai sifat yang khas yang tidak dimiliki oleh material logam.
Material non logam dapat dibedakan menjadi beberapa golongan, yaitu: 1. Keramik
2. Plastik (polimer) 3. Komposit
a. Keramik
Material keramik merupakan material yang terbentuk dari hasil senyawa (compound) antara satu atau lebih unsur logam (termasuk Si dan Ge) dengan satu atau lebih unsur-unsur non logam. material jenis keramik semakin banyak digunakan, mulai berbagai abrasive, pahat potong, batu tahan api, kaca, dan lain-lain, bahkan teknologi roket dan penerbangan luar angkasa sangat memerlukan keramik.
6 SIFAT MEKANIK KERAMIK
Keramik biasanya material yang kuat, dan keras dan juga tahan korosi. Sifat-sifat ini bersama dengan kerapatan yang rendah dan juga titik lelehnya yang tinggi, membuat keramik merupakan material struktural yang menarik.
Aplikasi struktural keramik maju termasuk komponen untuk mesin mobil dan struktur pesawat. Misalnya, TiC mempunyai kekerasan 4 kali kekerasan baja. Jadi, kawat baja dalam struktur pesawat dapat diganti dengan kawat TiC yang mampu menahan beban yang sama hanya dengan diameter separuhnya dan 31 persen berat. Semen dan tanah liat adalah contoh yang lain, keduanya dapat dibentuk ketika basah namun ketika kering akan menghasilkan objek yang lebih keras dan lebih kuat. Material yang sangat kuat seperti alumina (Al2O3) dan silikon karbida (SiC) digunakan sebagai abrasif untuk grinding dan polishing.
Keterbatasan utama keramik adalah kerapuhannya, yakni kecenderungan untuk patah tiba-tiba dengan deformasi plastik yang sedikit. Ini merupakan masalah khusus bila bahan ini digunakan untuk aplikasi struktural. Dalam logam, elektron-elektron yang terdelokalisasi memungkinkan atom-atomnya berubah-ubah tetangganya tanpa semua ikatan dalam strukturnya putus. Hal inilah yang memungkinkan logam terdeformasi di bawah pengaruh tekanan. Tapi, dalam keramik, karena kombinasi ikatan ion dan kovalen, partikel-partikelnya tidak mudah bergeser. Keramiknya dengan mudah putus bila gaya yang terlalu besar diterapkan.
Faktur rapuh terjadi bila pembentukan dan propagasi keretakan yang cepat. Dalam padatan kristalin, retakan tumbuh melalui butiran (trans granular) dan sepanjang bidang cleavage (keretakan) dalam kristalnya. Permukaan tempat putus yang dihasilkan mungkin memiliki tekstur yang penuh butiran atau kasar. Material yang amorf tidak memiliki butiran dan bidang kristal yang teratur, sehingga permukaan putus kemungkinan besar mulus penampakannya.
Kekuatan tekan penting untuk keramik yang digunakan untuk struktur seperti bangunan. Kekuatan tekan keramik biasanya lebih besar dari kekuatan tariknya. Untuk memperbaiki sifat ini biasanya keramik di-pretekan dalam keadaan tertekan. Sifat Hantaran Listrik.
Sifat listrik bahan keramik sangat bervariasi. Keramik dikenal sangat baik sebagai isolator. Beberapa isolator keramik (seperti BaTiO3) dapat dipolarisasi dan digunakan sebagai kapasitor.
7 Keramik lain menghantarkan elektron bila energi ambangnya dicapai, dan oleh karena itu disebut semikonduktor. Tahun 1986, keramik jenis baru, yakni superkonduktor temperatur kritis tinggi ditemukan. Bahan jenis ini di bawah suhu kritisnya memiliki hambatan = 0. Akhirnya, keramik yang disebut sebagai piezoelektrik dapat menghasilkan respons listrik akibat tekanan mekanik atau sebaliknya.
Sering pula digunakan bahan yang disebut dielektrik. Bahan ini adalah isolator yang dapat dipolarisasi pada tingkat molekular. Material semacam ini digunakan untuk menyimpan muatan listrik.
Kekuatan dielektrik bahan adalah kemampuan bahan tersebut untuk menyimpan elektron pada tegangan tinggi. Bila kapasitor dalam keadaan bermuatan penuh, hampir tidak ada arus yang lewat. Namun dengan tegangan tinggi dapat mengeksitasi elektron dari pita valensi ke pita konduksi. Bila hal ini terjadi arus mengalir dalam kapasitor, dan mungkin disertai dengan kerusakan material karena meleleh, terbakar atau menguap. Medan listrik yang diperlukan untuk menghasilkan kerusakan itu disebut kekuatan dielektrik. Beberapa keramik mempunyai kekuatan dielektrik yang sangat besar.Porselain misalnya sampai 160 kV/cm. Sebagian besar hantaran listrik dalam padatan dilakukan oleh elektron. Di logam, elektron penghantar dihamburkan oleh vibrasi termal meningkat dengan kenaikan suhu, maka hambatan logam meningkat pula dengan kenaikan suhu.
Sebaliknya, elektron valensi dalam keramik tidak berada di pita konduksi, sehingga sebagian besar keramik adalah isolator. Namun, konduktivitas keramik dapat ditingkatkan dengan memberikan ketakmurnian. Energi termal juga akan mempromosikan elektron ke pita konduksi, sehingga dalam keramik, konduktivitas meningkat (hambatan menurun) dengan kenaikan suhu.
Beberapa keramik memiliki sifat piezoelektrik, atau kelistrikan tekan. Sifat ini merupakan bagian bahan "canggih" yang sering digunakan sebagai sensor. Dalam bahan piezoelektrik, penerapan gaya atau tekanan dipermukaannya akan menginduksi polarisasi dan akan terjadi medan listrik, jadi bahan tersebut mengubah tekanan mekanis menjadi tegangan listrik. Bahan piezoelektrik digunakan untuk tranduser, yang ditemui pada mikrofon, dan sebagainya.
Dalam bahan keramik, muatan listrik dapat juga dihantarkan oleh ion-ion. Sifat ini dapat diubah-ubah dengan merubah komposisi, dan merupakan dasar banyak aplikasi komersial, dari sensor zat kimia sampai generator daya listrik skala besar. Salah satu teknologi yang paling prominen adalah sel bahan bakar. Kemampuan penghantaran ion didasarkan kemampuan keramik tertentu untuk memungkinkan anion oksigen bergerak,
8 sementara pada waktu yang sama tetap berupa isolator. Zirkonia, ZrO2, yang distabilkan dengan kalsia (CaO), adalah contoh padatan ionik.
Serbuk Keramik Silikat
Efek Domino pada Pemrosesan Keramik Sesuai dengan sifat alami keramik, bahan baku keramik yang digunakan untuk produksi mempunyai banyak kendala yang mempengaruhi pada sifat akhir benda jadi dibandingkan dengan kelompok bahan lain misal logam atau polimer. Hal ini dikarenakan tidak terdapat tahapan penghalusan lanjut untuk keramik, tidak seperti logam (peleburan – pembekuan – deformasi plastik). Pada dasarnya, “apa yang masuk – itulah yang keluar”. Semua ketidak-sempurnaan pada bahan baku diperbanyak kedalam pembesaran ketidak-sempurnaan dalam produk yang disinter.
Efek domino ini menekankan ketergantungan dari sifat akhir produk keramik dalam karakteristik semua tahapan pemrosesan, dan secara umum dalam karakteristik bahan baku, secara harfiah bila terdapat kesalahan dalam satu tahap pemrosesan keramik maka akan mempengaruhi secara nyata hasil akhir keramiknya.
Mineralogi Keramik
Keramik secara tradisional berdasar pada mineral oksida, atau mineral-mineral lain dimana dapat berubah menjadi oksida-oksida luluh, seperti hidroksida, karbonat, sulfida, halida, phospatat dll. Mineral-mineral ini merupakan gabungan dari sebagian besar unsur yang ada dipermukaan bumi ini. Bagaimanapun juga, berkenaan dengan keunggulan oksigen dalam kerak bumi, hampir setengah unsur yang telah dikenali terjadi secara normal sebagai oksida, biasanya oksida kompleks seperti silikat. Struktur silikat meliputi sejumlah besar unsur-unsur dalam tabel periodik. Jadi, kita dapat secara nyata mengatakan bahwa “ separo dari dunia ini adalah keramik…”Deret unsur-unsur relatif besar dimana sering terdapat dalam keramik meliputi: O, Al, Si, Ca, Mg, Ti, Na, K. Hal ini menarik untuk dicatat, bahwa beberapa keramik penting menunjukkan konsentrasi yang agak tinggi pada air laut.
Sungguh, sebagian besar MgO dengan kemurnian tinggi (suatu bahan tahan api yang penting) sekarang ini disediakan dari air laut. Bagaimanapun juga, sebagian besar mineral penting dalam keramik berasal dari transformasi batu beku dari perapian (igneous rock), seperti halnya granit atau basal dimana kristal terbentuk dari magma (siapa tahu lumpur lapindo merupakan bahan baku keramik maju yang tersedia…). Batu-batu ini adalah silikat kompleks, dimana komposisi dapat menggambarkan kandungan dari oksida biner sederhana seperti silika, alumina, alkali dll.
9 Silika, oksida yang relatif besar di Bumi (62% berat dari kerak kontinental Bumi) adalah dasar dari klasifikasi ini. Batu dengan proporsi SiO2 yang tinggi (dan biasanya mengandung alumina yang tingi, dimana merupakan komponen kedua terbesar di kerak Bumi, mengandung 16% berat) dikenal dengan nama asidik (acidic), dan dengan silika rendah (dan biasanya mengandung magnesia yang tinggi {[3,1% dari kerak bumi] dan/atau kalsia [5,7% dari kerak bumi]): didefinisikan sebagai dasar
Alumina agak tidak umum dalam batuan dasar, dan sebaliknya: magnesia adalah tidak umum dalam batuan asidik. Hal ini sangat menguntungkan untuk produksi bahan tahan api khususnya: kontaminasi silang dari batuan dasar dan asidik akan menyebabkan kehilangan ketahanan api yang signifikan, yaitu secara signifikan menurunkan titik lebur yang mengkontaminasi bahan.
Kristalisasi dari batuan beku dari perapian menjadikan formasi dari silikat dan mineral-mineral lain penting dalam pemrosesan keramik. Istimewanya, hal ini dipercaya dimana kerusakan dari beberapa silikat, diikuti dengan sedimentasi, membentuk formasi mineral tanah liat.Bahan baku dasar untuk keramik tradisional termasuk lempung, silika SiO2, dan Fledspars (K, Na) AlSi3O8, dan beberapa industri kimiawi lain. Tidak ada mineral-mineral yang digunakan dalam pemrosesan tradisional keramik dapat diperlakukan sebagai “komposisi tetap”. Yaitu, mereka tidak mempunyai komposisi yang diberikan oleh formula kimia. Sebagai contoh, kandungan silika pada lepung Kaolin secara umum bervariasi pada 45% berat sampai 50% berat, dan alumina 35 % berat sampai 40% berat. Keseimbangan dipengaruhi oleh komponen yang mudah menguap (air dan organiks), dari 10% berat sampai 15% berat. Jumlah ini dapat dibandingkan dengan formula kimiawi ideal dari mineral-mineral silikat terpilih berikut:
Mineral Formula Kimia Ideal Kaolinit Al2(Si2O5)(OH)4 Halosit Al2(Si2O5)(OH)4 2H2O
Piropillit Al2(Si2O5)2(OH)2
Monmorilonit (Al1,67 Na0,33 Mg0,33)(Si2O5)2(OH)2 Mika Al2K(Si1.5Al0,5)2 (OH)2
Ilit Al2-xMgxK-1-x-y(Si1,5-yAl0.5+YO5)2(OH)2
Pemrosesan Mineral
Teknik modern dan keramik unggul membutuhkan serbuk kemurnian tinggi dimana akan sangat menguntungkan dan mempunyai karakteristik tertentu (keuntungan dijabarkan dalam seluruh proses penggilingan (milling) dan klasifikasi prosedur serbuk keramik). Salah
10 satu kemungkinan klasifikasi dari bahan baku keramik berhubungan dengan teknik pemrosesan maju/unggul yaitu:
Mineral mentah (crude minerals): tanah liat (gerabah, ubin, bola, bentonit), serpihan, bauksit mentah, kianit mentah.
Mineral Industri: bola lempung dimurnikan, kaolin, bentonit dimurnikan, piropilit, talek, feldspar, nepelin syenit, wolastonit, spodumen, pasir kaca, batu api tembikar (potter’s flint), kianit, bauksit, sirkon, rutil, bijih krom, kaolin kalsinasi, dolomit, dan banyak lagi yang lain
Industri Kimia: alumina kalsinasi (dari proses Bayer), magnesia kalsinasi (dari air laut), alumina fusi, magnesia fusi, silikon karbida (proses Acheson), abu soda, barium karbonat, titania, titaniat kalsinasi, oksida besi, ferit kalsinasi, sirkonia kalsinasi stabil, pigmen sirkonia, pigmen sirkon kalsinasi.
Operasi peremukan dan penggerindaan awal pada deposit mineral ditujukan membebaskan komponen yang tidak dikehendaki (ketidak-murnian, organik) dengan menempatkan dan/atau pemisahan magnetik, dan pengumpulan partikel-halus mineral murni (misal lempung) dengan pengambangan (floating). Secara alami, lempung hasil proses mempunyai variasi yang lebar dalam komposisi dan ukuran partikel, tergantung pada lokasi dan pemrosesan mineral. Sebagai contoh, salah satu pencemar yang paling tidak dikehendaki dalam kaolin adalah oksida besi, dimana akan secara efektif menghitamkan barang yang putih. Kaolin Georgia kualitas tinggi dikenal akan kemurniannya (rendah besi) dan sifat perapian putih bagus. Bola lempung pada umumnya lebih banyak mengandung bahan organik (menunjukkan “hilangnya” permulaan dalam diagram komposisional) dan lebih plastik
b. POLIMER
Plastik (polimer) adalah material hasil rekayasa manusia, merupakan rantai molekul yang sangat panjang dan banyak molekul MER yang saling mengikat. Pemakaian plastik juga sangat luas, mulai peralatan rumah tangga, interior mobil, kabinet radio/televisi, sampai konstruksi mesin.
Istilah polimer digunakan untuk menggambarkan bentuk molekul raksasa atau rantai yang sangat panjang yang terdiri atas unit-unit terkecil yang berulangulang atau mer atau meros sebagai blok-blok penyusunnya. Molekul-molekul (tunggal) penyusun polimer dikenal dengan istilah monomer.
11 Polimer Polyethylene, misalnya, adalah salah satu jenis bahan polimer dengan rantai linear sangat panjang yang tersusun atas unit-unit terkecil (mer) yang berulang-ulang yang berasal dari monomer molekul ethylene. Perhatikan bahwa monomer memiliki ikatan kovalen tak jenuh (ikatan ganda) sedangkan pada mer ikatan tersebut menjadi aktif atau ikatan kovalen terbuka dengan elektron tak berpasangan.
Bahan organik alam mulai dikenal dan digunakan sejak tahun 1866, yaitu dengan digunakannya polimer cellulose. Bahan organik buatan mulai dikenal tahun 1906 dengan ditemukannya polimer Phenol Formal dehide atau Bakelite, mengabadikan nama penemunya L.H. Baekeland. Bakelite, hingga saat ini masih digunakan untuk berbagai keperluan. Para mahasiswa metalurgi atau metallographist profesional misalnya menggunakan bakelit untuk memegang (mounting) spesimen metalografi dari sampel logam yang akan dilihat struktur mikronya di bawah mikroskop optik reflektif.
Istilah plastik, yang sering digunakan oleh masyarakat awam untuk menyebut
sebagian besar bahan polimer, mulai digunakan pada tahun 1909. Istilah tersebut berasal dari kata Plastikos yang berarti mudah dibentuk dan dicetak. Teknologi modern plastik baru dimulai tahun 1920-an, yaitu dengan mulai digunakannya polimer yang berasal dari produk derivatif minyak bumi, seperti misalnya Polyethylene. Salah satu jenis plastik yang sering kita jumpai adalah LDPE (Low Density Poly Ethylene) yang banyak digunakan sebagai plastik pembungkus yang lunak dan sangat mudah dibentuk.
Di samping pembagian di atas, yaitu natural polymer yang berasal dari alam (misalnya cellulose) dan synthetic polymer yang merupakan hasil rekayasa manusia (misalnya bakelite dan plyethylene), polimer umumnya dikelompokkan berdasarkan perilaku mekanik dan struktur rantai atau molekulnya. Polimer thermoplastik, misalnya polyethylene, adalah jenis polimer yang memiliki sifat-sifat thermoplastik yang disebabkan oleh struktur rantainya yang linear (linear), bercabang (branched) atau sedikit bersambung (cross linked). Polimer dari jenis ini akan bersifat lunak dan viskos (viscous) pada saat dipanasikan dan menjadi keras dan kaku (rigid) pada saat didinginkan secara berulang-ulang. Sementara itu, polimer thermoset (termosetting), misalnya bakelite, hanya melebur pada saat pertama kali dipanaskan dan selanjutnya mengeras secara permanen pada saat didinginkan. Polimer jenis ini bersifat lebih keras dan kaku (rigid) karena strukturnya molekulnya yang membentuk jejaring tiga dimensi yang saling berhubungan (network).
Polimer jenis elastomer, misalnya karet alam, memiliki daerah elastis non linear yang sangat besar yang disebabkan oleh adanya sambungan-sambungan antar
12 rantai (cross links) yang berfungsi sebagai ’pengingat bentuk’ (shape memory) sehingga karet dapat kembali ke bentuknya semula, pada saat beban eksternal dihilangkan.
Proses Pembentukan Polimer (Polimerisasi)
Proses pembentukan rantai molekul raksasa polimer dari unit-unit molekul
terkecilnya (mer atau meros) melibatkan reaksi yang kompleks. Prosespolimerisasi tersebut yang secara umum dapat dikelompokkan menjadi dua
jenis reaksi, yaitu:
(1) polimerisasi adisi (Addition), dan (2) polimerisasi
kondensasi (Condensation). Reaksi adisi, seperti yang terjadi pada proses pembentukan makro molekul polyethylene dari molekul-molekul ethylene, berlangsung secara cepat tanpa produk samping (by-product) sehingga sering disebut pula sebagai Pertumbuhan Rantai (Chain Growth). Sementara itu, polimerisasi kondensasi, seperti yang misalnya pada pembentukan bakelit dari dua buah mer berbeda, berlangsung tahap demi tahap (Step Growth) dengan menghasilkan produk samping, misalnya molekul air yang dikondensasikan keluar.
Contoh polimerisasi dengan reaksi adisi adalah proses pembentukan
Polyethylene (PE). Proses pembentukan polimer berlangsung dalam 3 tahap, yaitu:
(1) inisiasi
(2) adisi atau pertumbuhan rantai, dan (3) terminasi.
Untukmemulai proses polimerisasi ethylene, ditambahkan H2O2 sehingga terjadi pemutusan ikatan kovalen antar oksigen dalam molekul Hidrogen Peroksida dan ikatan kovalen antar karbon dalam molekul Ethylene. Polimerisasi dimulai dengan terbentuknya dua kelompok inisiator (OH) dan mer. Satu dari dua kelompok OH selanjutnya akan bergabung dengan mer ethylene mengawali terbentuknya rantai molekul polimer. Selanjutnya akan terjadi pertumbuhan rantai yang berlangsung sangat cepat membentuk rantai molekul raksasa linear. Terminasi dari pertumbuhan rantai dapat dilakukan dengan dua cara, yaitu (1) dengan bergabungnya OH ke ujung rantai molekul, dan (2) bergabungnya dua rantai molekul. Panjang dari rantai polimer dapat dikendalikan dengan cara mengendalikan jumlah inisiator.
13 Secara, umum, jika jumlah inisiator yang diberikan sedikit, maka jumlah OH yang tersedia untuk menghentikan reaksi semakin sedikit pula. Yang perlu dicatat adalah bahwa di reaksi adisi ini tidak menghasilkan produk sampingan (by product).
Contoh dari polimerasi kondensasi adalah proses pembentukan Bakelit yang telah kita kenal sebelumnya. Nama kondensasi diberikan karena pada proses polimerisasi ini dikondensasikan molekul air sebagai produk sampingan (by product)-nya. Bakelit, produk utama dari reaksi ini, terbentuk dari dua jenis molekul mer, yaitu Phenol dan Formal Dehide. Tidak seperti halnya pada polimerisasi adisi, reaksi berlangsung lebih lambat, tahap demi tahap, sehingga sering pula disebut sebagai reaksi pertumbuhan tahap demi tahap (step growth reaction). Rantai molekul yang terbentuk dalam proses polimerisasi bakelit ini
lebih rigid, karena membentuk jejaring tiga dimensi (three dimensional network) yang kompleks.
Berat Molekul dan Derajat Polimerisasi
Panjang rata-rata dari rantai polimer dapat dilihat dari berat molekul (molecular weight) polimer. Berat molekul dari polimer pada dasarnya adalah penjumlahan dari berat molekul-molekul mer-nya. Jadi semakin tinggi berat molekul dari suatu polimer tertentu, semakin besar panjang rata-rata dari rantai polimernya. Mengingat polimerasasi adalah peristiwa yang terjadi secara acak, maka berat molekul biasanya ditentukan secara statistik dalam bentuk rata-rata berat molekul atau distribusi berat molekulnya.
Suatu polimer thermoplastik misalnya, memiliki distribusi berat molekul sebagaimana terlihat dalam gambar berikut ini. Distribusi berat molekul tersebut terjadi karena proses polimerisasi terjadi secara acak (random) sehingga thermoplastik tersebut terdiri atas banyak rantai-rantai polimer yang berbeda-beda panjangnya. Dari distribusi tersebut dapat ditentukan rata-rata berat molekul dari thermoplastik tersebut.
Derajat polimerisasi (DP) dari suatu polimer adalah rasio atau perbandingan berat molekul polimer dengan berat molekul mer-nya. Suatu polyethylene (PE)
dengan berat molekul 28.000 g misalnya, memiliki derajat polimerisasi 1000 karena berat molekul dari mer-nya (C2H4) adalah 28 (12x2 + 1x4). DP
menggambarkan ukuran molekul dari suatu polimer berdasarkan atas jumlahdari monomer penyusunnya
Berat molekul rata-rata atau derajat polimerisasi dari suatu polimer thermoplastik sangat berpengaruh terhadap keadaan dan sifat-sifatnya.
Viskositas dan kekuatan polimer misalnya akan meningkat dengan meningkatnya berat molekul atau derajat polimerisasinya. Sebagai ilustrasi, kita dapat membandingkan
14 keadaan dari monomer ethylene pada derajat polimerisasi yang berbeda-beda. Perbedaan dari sifat-sifat tersebut dapat dijelaskan oleh fakta bahwa semakin panjang rantai molekul suatu polimer, semakin besar energi yang diperlukan untuk mengatasi ikatan sekundernya.
Ikatan-ikatan dalam Polimer Ikatan-ikatan dalam polimer dapat dikelompokkan menjadi dua kelompok, yaitu ikatan primer dan ikatan sekunder. Ikatan primer dari suatu polimer adalah ikatan kovalen, yaitu ikatan antar atom dengan cara memakai elektron secara bersama-sama, sebagaimana diilustrasikan dalam gambar.
Ikatan-ikatansekunder yang penting di dalam polimer misalnya adalah ikatan Van der Waals, ikatan Hidrogen, dan ikatan Ionik. Ikatan primer kovalen termasuk ikatan antar atom yang sangat kuat, jauh lebih kuat jika dibandingkan dengan ikatan-ikatan sekunder, 10 hingga 100 kalinya. Kekuatan ikatan primer ganda antar atomkarbon di dalam ethylene (C=C), misalnya besarnya adalah 721 kJ/(g.mol) sedangkan ikatan antar atom karbon dan hidrogen (C-H) adalah 436 kJ/(g.mol).
Strukur Rantai Molekul Polimer
Arsitektur polimer sangat berpengaruh terhadap sifat-sifat dan perilakunya secara umum. Secara umum, polimer dapat dikelompokkan menjadi empat jenis berdasarkan struktur molekulnya, yaitu:
(1) polimer linear (linear polymer)
(2) polimer bercabang (branched polymer) (3) polimer berkait (cross-linked polymer)dan (4) polimer berjejaring (network polymer).
Polyethy linear adalah contoh dari jenis polimer dengan struktur rantai linear dan bercabang. Struktur rantai tersebut menyebabkan polyethylene berperilaku termoplastik, yaitu dapat dibentuk menjadi suatu bentuk tertentu dan dikembalikan ke bentuk semula. Struktur rantai molekul berkait adalah struktur rantai yang khas dari karet yang memiliki daerah elastis non-linear yang sangat besar. Cross-link atau kaitan antar rantai dalam hal ini berfungsi sebagai ‘pengingat bentuk’ (shape memory) dari karet. Bakelite salah satu contoh polimer yang telah kita bahas sebelumnya memiliki struktur rantai molekul berjejaring 3 dimensi yang kompleks. Struktur rantai ini sangat rigid sehingga polimer dengan struktur rantai ini akan berperilaku termoset, yaitu menjadi rigid secara permanen pada saat pertama kali didinginkan.
Secara umum, perilaku mekanik dari berbagai jenis polimer dapat dijelaskan dari ikatan-ikatan atom dan struktur rantai molekulnya.
15 Derajat Kekristalan Polimer
Tidak seperti halnya logam, polimer pada umumnya bersifat amorphous, tidak bersifat kristalin atau memiliki keteraturan dalam rentang cukup panjang.Namun, polimer dapat mdirekayasa sehingga strukturnya memiliki daerah kristalin, baik pada proses sintesis maupun deformasi. Besarnya daerah kristalin dalam polimer dinyatakan sebagai derajat kekristalan polimer. Derajat kekristalan polimer misalnya dapat direkayasa dengan mengendalikan laju solidifikasi dan struktur rantai, walaupun sangat sulit untuk mendapatkan derajat kekristalan 100% sebagaimana halnya pada logam. Polimer dengan struktur rantai bercabang misalnya akan memiliki derajat kekristalan yang lebih rendah jika dibandingkan dengan struktur tanpa cabang. Sifat-sifat mekanik dan fisik dari polimer sangat dipengaruhi oleh derajat kekri jrestalannya. Sifat-sifat mekanik yang dipengaruhi oleh derajat kekristalan misalnya adalah kekakuan (stiffness), kekerasan (hardness), dan keuletan (ductility). Sedangkan sifat-sifat fisik yang berhubungan dengan derajat kekristalan misalnya adalah sifat-sifat optik dan kerapatan (density) dari polimer.
c. KOMPOSIT
Komposit merupakan material hasil kombinasi dari dua material atau lebih, yang sifatnya sangat berbeda dengan sifat masing-masing material asalnya. Komposit selain dibuat dari hasil rekayasa manusia, juga dapat terjadi secara alamiah, misalnya kayu, yang terdiri dari serat selulose yang berada dalam matriks lignin. Komposit saat ini banyak dipakai dalam konstruksi pesawat terbang, karena mempunyai sifat ringan, kuat dan non magnetik.
B. Sifat – Sifat Material
Secara garis besar material mempunyai sifat-sifat yang mencirikannya, pada bidang teknik mesin umumnya sifat tersebut dibagi menjadi tiga sifat. Sifat –sifat itu akan mendasari dalam pemilihan material, sifat tersebut adalah:
Sifat mekanik Sifat fisik Sifat teknologi
Dibawah ini akan dijelaskan secara terperinci tentang sifat-sifat material tersebut 1. Sifat Mekanik
Sifat mekanik material, merupakan salah satu faktor terpenting yang mendasari pemilihan bahan dalam suatu perancangan. Sifat mekanik dapat diartikan sebagai respon atau
16 perilaku material terhadap pembebanan yang diberikan, dapat berupa gaya, torsi atau gabungan keduanya. Dalam prakteknya pembebanan pada material terbagi dua yaitu beban statik dan beban dinamik. Perbedaan antara keduanya hanya pada fungsi waktu dimana beban statik tidak dipengaruhi oleh fungsi waktu sedangkan beban dinamik dipengaruhi oleh fungsi waktu.
Untuk mendapatkan sifat mekanik material, biasanya dilakukan pengujian mekanik. Pengujian mekanik pada dasarnya bersifat merusak (destructive test), dari pengujian tersebut akan dihasilkan kurva atau data yang mencirikan keadaan dari material tersebut.
Setiap material yang diuji dibuat dalam bentuk sampel kecil atau spesimen. Spesimen pengujian dapat mewakili seluruh material apabila berasal dari jenis, komposisi dan perlakuan yang sama. Pengujian yang tepat hanya didapatkan pada material uji yang memenuhi aspek ketepatan pengukuran, kemampuan mesin, kualitas atau jumlah cacat pada material dan ketelitian dalam membuat spesimen. Sifat mekanik tersebut meliputi antara lain: kekuatan tarik, ketangguhan, kelenturan, keuletan, kekerasan, ketahanan aus, kekuatan impak, kekuatan mulur, kekeuatan leleh dan sebagainya.
Sifar-sifat mekanik material yang perlu diperhatikan: 1. Kekuatan (strength)
Merupakan kemampuan suatu material untuk menerima tegangan tanpa menyebabkan material menjadi patah. Berdasarkan pada jenis beban yang bekerja, kekuatan dibagi dalam beberapa macam yaitu kekuatan tarik, kekuatan geser, kekuatan tekan, kekuatan torsi, dan kekuatan lengkung.
2. Kekakuan (stiffness)
Adalah kemampuan suatu material untuk menerima tegangan/beban tanpa mengakibatkan terjadinya deformasi atau difleksi.
3. Kekenyalan (elasticity)
Didefinisikan sebagai kemampuan meterial untuk menerima tegangan tanpa mengakibatkan terjadinya perubahan bentuk yang permanen setelah tegangan dihilangkan, atau dengan kata lain kemampuan material untuk kembali ke bentuk dan ukuran semula setelah mengalami deformasi (perubahan bentuk).
17 4. Plastisitas (plasticity)
Adalah kemampuan material untuk mengalami deformasi plastik (perubahan bentuk secara permanen) tanpa mengalami kerusakan. Material yang mempunyai plastisitas tinggi dikatakan sebagai material yang ulet (ductile), sedangkan material yang mempunyai plastisitas rendah dikatakan sebagai material yang getas (brittle).
5. Keuletan (ductility)
Adalah sutu sifat material yang digambarkan seprti kabel dengan aplikasi kekuatan tarik. Material ductile ini harus kuat dan lentur. Keuletan biasanya diukur dengan suatu periode tertentu, persentase keregangan. Sifat ini biasanya digunakan dalam bidan perteknikan, dan bahan yang memiliki sifat ini antara lain besi lunak, tembaga, aluminium, nikel, dll.
6. Ketangguhan (toughness)
Merupakan kemampuan material untuk menyerap sejumlah energi tanpa mengakibatkan terjadinya kerusakan.
7. Kegetasan (brittleness)
Adalah suatu sifat bahan yang mempunyai sifat berlawanan dengan keuletan. Kerapuhan ini merupakan suatu sifat pecah dari suatu material dengan sedikit pergeseran permanent. Material yang rapuh ini juga menjadi sasaran pada beban regang, tanpa memberi keregangan yang terlalu besar. Contoh bahan yang memiliki sifat kerapuhan ini yaitu besi cor.
8. Kelelahan (fatigue)
Merupakan kecenderungan dari logam untuk menjadi patah bila menerima beban bolak-balik (dynamic load) yang besarnya masih jauh di bawah batas kekakuan elastiknya.
9. Melar (creep)
Merupakan kecenderungan suatu logam untuk mengalami deformasi plastik bila pembebanan yang besarnya relatif tetap dilakukan dalam waktu yang lama pada suhu yang tinggi.
18 Merupakan ketahanan material terhadap penekanan atau indentasi / penetrasi. Sifat ini berkaitan dengan sifat tahan aus (wear resistance) yaitu ketahanan material terhadap penggoresan atau pengikisan.
Load
Didefinisikan sebagai kekuatan eksternal yang mendukung bagian dari sutau mesin. Beban ini terdiri dari 3 tipe, yaitu:
Beban tetap (steady load), dikatakan beban tetap apabila beban dalam keadaan diam dimana benda tersebut tidak dapat erubah arah.
Beban gerak (variying load), apabila beban dapat dipindahkan secara kontiyu.
Beban kejut (shock load), apabila bebam digunakan dan dipindahkan secara tiba-tiba.
Tegangan
Saat gaya atau beban dari system eksternal terjadi pada benda kerja, gaya internal aka muncul dari dalam benda kerja baik searah ataupun berlawanan arah sebagai reaksi atas gaya eksternal tersebut. Stress adalah besarnya gaya internal yangtimbul per satuan luas area pada benda kerja.
Regangan
Adalah gaya yang diberikan pada suatu benda dengan memberikan tegangan tarik sehingga benda tersebut juga mengalami perubahan bentuk.
Tensile Stress / Tegangan Tarik
Adalah suatu sifat bahan hubungan tegangan-regangan pada tarikan memberikan nilai yang cukup berubah tergantung pada laju tegangan temperature dll. Umumpnya kekuatan tarik lebih rendah daripada umpannya seperti baja, duralumin dll.
Compressive Stress / Tegangan Tekan
Compressive in terjadi bila suatu benda kerj ayang menjadi sasaran aksial yang sama ata berlawanan, dimana tekanan ini disebabakan pada setiap sisi dari benda kerja dan inilah yang disebut dengan compressive stress. Pertimbangan lain akan menunjukkan bahwa dengan adanya tegangan beban, akan ada penurunan penjang benda kerja dimana perbandingan pengurangan panjang dengan panjang asli suatu benda kerja dikenal sebagai tegangan regangan.
19 Shear Stress / Tegangan Geser
Ketika benda kerja menjadi sasaran dua kekuatan yang sama atau berlawanan, bergerak secara tangensial dengan sisi yang berlawanan, dimana ini disebabkan pada setiap sisi dari benda kerja dan inilah yang disebut shear stress. Dan yang berhubungan dengan regangan dikenal shear strain, yang diukur dengan sudut deformasi yang berdekatan dengan shear stress
Modulus Young
Hukum Hook menyatakan bahwa ketika benda kerja pada sutu bahan yang elastis maka tegangan akan seimbang dengan regangan. Dimana E adalah konstanta maka dapat dikatakan modulus young, dan satuan yang digunakan adalah kg/cm3 atau N/mm2.
E
Bearing Stress / Tegangan Dukung
Pembatasan compressive stress pada area antara 2 bagian dikenal sebagai bearing stress. Bearing stress ini dapat digunakan dalam mendesign penyambungan paku. Distribusi dari bearing stress ini tidak selalu sama tetapi bergantung pada bentuk permukaan benda kerja dan sifat-sifat fisik dari dua material tersebur. Sedangkan distribusi tekanan akan sama. Bila pendistribusian stress sulit untuk ditentikan oleh karena itu bearing stress biasanya dikalkuasikan dengan membagi beban pada beberap area.
Bending Stress / Tegangan Tekuk
Dalam kegiatan perteknikan, bagian-bagian atau anggota structural mungkin menjadi sasaran pada beban static atau dinamis yang disebut sebagai bending stress. Sedikit pertimbangan akan menujukkan karena adanya moment bending, kabel pada bagian atas benda kerja akan diperpendek karena akompresi terebut.
2. Sifat Fisik
Sifat penting yang kedua dalam pemilihan material adalah sifat fisik. Sifat fisik adalah kelakuan atau sifat-sifat material yang bukan disebabkan oleh pembebanan seperti pengaruh pemanasan, pendinginan dan pengaruh arus listrik yang lebih mengarah pada struktur material. Sifat fisik material antara lain : temperatur cair, konduktivitas panas dan panas spesifik.
20 Struktur material sangat erat hubungannya dengan sifat mekanik. Sifat mekanik dapat diatur dengan serangkaian proses perlakukan fisik. Dengan adanya perlakuan fisik akan membawa penyempurnaan dan pengembangan material bahkan penemuan material baru.
3. Sifat Teknologi
Selanjutnya sifat yang sangat berperan dalam pemilihan material adalah sifat teknologi yaitu kemampuan material untuk dibentuk atau diproses. Produk dengan kekuatan tinggi dapat dibuat dibuat dengan proses pembentukan, misalnya dengan pengerolan atau penempaan. Produk dengan bentuk yang rumit dapat dibuat dengan proses pengecoran. Sifat-sifat teknologi diantaranya sifat mampu las, sifat mampu cor, sifat mampu mesin dan sifat mampu bentuk. Sifat material terdiri dari sifat mekanik yang merupakan sifat material terhadap pengaruh yang berasal dari luar serta sifat-sifat fisik yang ditentukan oleh komposisi yang dikandung oleh material itu sendiri.
Pengaruh Lingkungan Terhadap Perilaku Material
Hubungan antara struktur, sifat dan prosses juga dipengaruhi oleh lingkungan sekitar,di mana material tersebut diperlakukan. Beberapa kategori yang disebut sebagai lingkungan adalah; suhu, korosi dan radiasi. Suhu. Perubahan suhu secara drastis dapat mengubah sifat-sifat dari material
(gambar 1-12). Kekuatan dari sebagian besar material akan turun bila suhu dinaikkan. Selanjutnya suatu kondisi yang sangat buruk dapat secara tiba – tiba terjadi pada material bila ditempatkan pada temperatur yang melebihi titik kritisnya. Material yang telah diperkuat dengan mendapatkan suatu perlakuan panas atau pada sebuah teknik pembentukan bisa saja secara mendadak kehilangan kekuatannya bila dipanaskan lanjut. Temperatur yang sangat rendah pun dapat menyebabkan material baja menjadi rapuh walaupun hanya diberikan beban yang ringan. Temperatur tinggi pun dapat menyebabkan perubahan struktur pada keramik dan menyebabkan material polimer mencair atau menjadi hangus.
21 Saat ini teknologi untuk membuat material menjadi semakin tahan terhadap
pengaruh panas semakin marak seiring dengan tuntutan pasar seperti pada pesawat ataupun kendaraan luar angkasa (gambar 1-13). Pada aplikasi pesawat terbang, pengaruh peningkatan suhu permukaan yang diakibatkan oleh gesekan permukaan dengan udara sangatlah kentara dan sebagai tambahan atas kondisi ini adalah mesin akan beroperasi dengan effisien (hemat BBM) pada suhu yang tinggi. Untuk menjawab tantangan agar mendapatkan kecepatan yang tinggi dengan menggunakan bahan bakar yang hemat maka penemuan terhadap material yang tahan panas terhadap suhu
permukaan dan suhu mesin secara bertahap ditemukan.
Korosi. Sebagian besar metal dan polimer bereaksi terhadap oksigen atau gas
22 ini, sedangkan material polimer akan menjadi getas atau rapuh (gambar 1-14). Material juga bisa diserang oleh berbagai macam cairan yang korosif. Metal bisa mendapatkan serangan korosi secara seragam atau secara selektif dalam bentuk munculnya celah atau lubang yang mengkibatkan kegagalan prematur (gambar 1-15). Saat ini telah banyak dikembangkan teknologi pelapis yang dapat melindungi material dari pengaruh korosi.
Radiasi. Radiasi energi tinggi, seperti neutron yang dihasilkan pada reaktor nuklir, dapat mempengaruhi struktur internal dari seluruh material serta dapat menghasilkan kehilangan kekuatan, kegetasan, ataupun perubahan yang kritis dari sifat – sifat fisis.
23 Selain itu juga dimensi dari suatu material juga dapat berubah seperti terjadinya
pembengkakan atau bahkan terjadinya retak.
Pemilihan Material
Pemilihan material untuk berbagai macam aplikasi pada awalnya sangat tergantung kepada suatu proses yang dinamakan pemilihan material. Pemilihan ini biasanya didasari oleh beberapa persyaratan yang harus dilewati, diantaranya :
1. Material tersebut harus mampu memenuhi persyaratan fisik dan mekanik. 2. Material tersebut mudah untuk dibentuk ataupun dipabrikasi.
3. Material yang dapat diproses tersebut haruslah memiliki nilai ekonomis. C. PROSES PENGOLAHAN LOGAM
Secara umum logam bisa dibedakan atas dua yaitu : logam-logam besi (ferous) dan logam-logam bukan besi (non feorus). Sesuai dengan namanya logam-logam besi adalah logam atau paduan yang mengandung besi sebagai unsur utamanya, sedangkan logam-logam bukan besi adalah logam yang tidak atau sedikit sekali mengandung besi.
24 - besi tuang (cast iron)
- baja karbon (carbon steel) - baja paduan (alloy steel) - baja spesial (specialty steel)
Keempat kelompok besi diatas terbagi lagi atas pengelompokan yang lebih kecil yang diperlihatkan pada tabel 1. Untuk logam bukan besi contohnya adalah logam dan paduan seperti : aluminium, tembaga, timah, emas, magnesium dsb.
Dalam penggunaannya pada bidang teknik diharuskan memilih bahan logam yang sesuai dengan keperluan aplikasi dalam hal kekuatan, kekerasan, kekuatan lelah, ketahan korosi dan sebagainya sehingga dalam pemakaiannya akan memberikan hasil yang paling optimal.
Sifat-sifat yang diperlukan di dalam aplikasi sangat dipengaruhi oleh struktur bahan tersebut, sedangkan struktur yang terbentuk dipengaruhi oleh komposisi kimia, teknik/proses pembuatan serta proses perlakuan panas yang diberikan kepada logam tersebut. Secara
skematik hubungan antara struktur, sifat mekanik dan kualitas yang diberikan logam diperlihatkan pada gambar 1.
Pada produk rekayasa, selain pengaruh faktor-faktor diatas, kualitasnya juga dipengaruhi oleh faktor desain (perencanaan) dan kondisi pengoperasian.
Pada dewasa ini penggunaan logam yang paling banyak masih didominasi oleh logam besi dan paduannya terutama di bidang permesinan. Logam aluminium dan paduannya juga mengalami penggunaan yang meningkat akhir-akir ini karena beberapa sifat-sifatnya yang disukai yang salah satunya adalah bobotnya yang ringan.
Tabel 1: Pembagian Paduan Besi dan Baja Menurut Komposisinya.
______________________________________________________________________ No. Paduan besi dan Baja Komposisi kimia (dalam %) ____________________________________________________________________
1 Besi tuang 2-4 %C, 1-3 %Si, 0,80 %Mn (maks) 0,10
%P (maks), 0,05% S (maks). - Besi tuang kelabu Disamping terdapat perbedaan yang
kecil
- Besi tuang putih dari segi komposisi, perbedaan sifat -sifat
25 - Besi tuang noduler besi tuang ditentukan oleh struktur mikro
karena proses pembuatan atau karena proses perlakuan panas.
- Besi tuang paduan Unsur-unsur pemadu : Cr, Ni, Mo, Al atau logam-logam lainnya.
2. Baja karbon :
- Baja karbon rendah 0,08-0,35 %C | 0,25-1,50 %Mn - Baja karbon sedang 0,35-0,50 %C plus | 0,25-0,30 %Si - Baja karbon 0,04 %P (maks) | 0,05 %S (maks)
3. Baja paduan :
- Baja paduan rendah - Seperti pada baja karbon rendah +unsur-unsur pemadu kurang dari 4 % seperti : Cr, Ni, Mo, Cu, Al, Ti, V, Nb,B,
W dll.
- Baja paduan medium - Seperti pada baja paduan rendah tetapi jumlah unsur-unsur pemadu diatas 4%.
4. Baja Spesial :
- Baja stainless : a. Feritik (12-30 %Cr dan kadar karbon rendah)
b. Martensitik (12-17 %Cr dan 0,1-1,0 % C)
c. Austenitik (17-25 %Cr dan 8-20% Ni) d. Duplek (23-30 %Cr, 2,5-7 %Ni, plus Ti dan Mo)
e.Presipitasi (seperti pada austenitik, plus
elemen pemadu seperti : Cu, Ti, Al, Mo, Nb atau N)
26 - Baja perkakas General purpose steels Die steels
High speed steels (0,85-1,25 %C, 1,50-20 %W, 4-9,5 %Mo, 3-4,5 %Cr, 1-4%V, 5-12 Co)
D. KARAKTERISTIK LOGAM
Sebelum mempelajari dasar-dasar fisik logam, kita terlebih dahulu harus mempunyai gambaran yang jelas tentang golongan kualitas keadaan logam. Sering terbayang oleh kita bahwa logam adalah sesuatu yang mempunyai kilauan tinggi, konduktivitas listrik serta panas yang baik, dapat ditempa, dan ulet.
Diantara sesama logam sendiri variasi perbedaan sifat teryata sangat besar. Untuk mengambarkan perbedaan mencolok antara perilaku logam yang satu dengan yang lain orang cukup membandingkan masing-masing dengan ulet serta mudahnya timbal (lead) ditempa pada suhu kamar, serta kekerasan dan kerapuhan tungsten pada suhu sama.
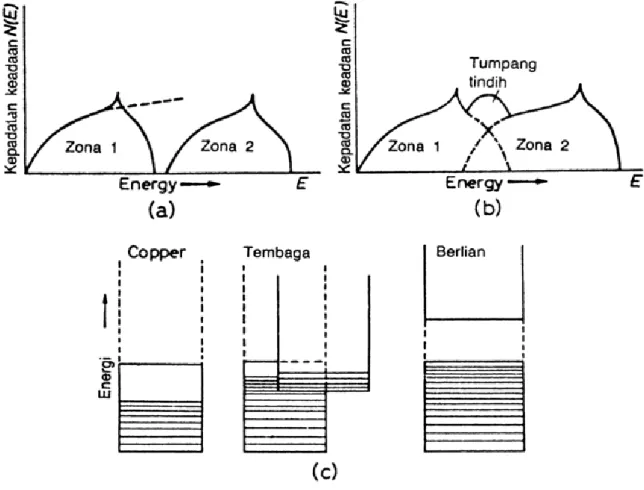
Sifat yang paling sering dianggap mencirikan logam adalah konduktivitas listrik atau konduktivitas termalnya yang tinggi. Sebagai contoh, logam konduktor listrik yang paling baik adalah tembaga sedangkan yang paling buruk adalah timbal, padahal kehambatan (resituvity) timbal hanya dua belas kali kehambatan tembaga. Sangat besarnya perbedaan konduktivitas antara logam dan non logam adalah karena pada logam yang mengalami beda potensial elektron-elektron dapat bergerak bebas, sementara pada bahan non logam tidak demikian. Jadi dapat disimpulkan bahwa karakteristik dasar logam harus dipelajari dari struktur elektronnya, atau dengan kata lain pengkajian material teknik harus dimulai dari pemahaman struktur atom-atom yang membentuknya.
E. ATOM
Dalam gambaran sederhana oleh Rutherford, atom terbentuk atas inti bermuatan positif pembawa sebagian besar massa atom, dengan elektron-elektron yang bergerak mengitarinya. Ruterford mengatakan bahwa elektron-elektron mengitari inti dalam orbit melingkar sehingga gaya sentrifugal semua elektron tepat sama dengan gaya tarik elektrostatik antara inti yang bermuatan positif dan elektronelektron yang bemuatan negatif. Guna menghindari kesulitan dalam pemahaman akibat adanya hokum elektrodinamika yang disini menyatakan bahwa elektronelektron yang berevolusi harus
terus-27 menerus melepaskan energi berupa radiasi elektromagnetik, maka Bohr dalam tahun 1913 terpaksa menyimpulkan bahwa dari semua orbit yang mungkin, hanya orbit-orbit tertentu saja yang boleh ditempati oleh electron.
Orbit-orbit khusus itu diandaikan mempunyai sifat luar biasa, yakni bahwa bila sebuah elektron berada dalam salah satu orbit tersebut, radiasi tak akan terjadi.Kumpulan orbit-orbit stabil tadi dicirikan menurut kritiria yang menyatakan bahwa momentum sudut elektron-elektron dalam orbit dihitung mengunakan rumus nh h konstanta
Planck dan n bilangan bulat (n = 1, 2, 3, …). Dengan cara ini Bohr berhasil memberikan penjelasan yang memuaskan tentang spektrum garis atom hydrogen, sekaligus membangun batu pijakan untuk teori atom modern.
Ketika selanjutnya teori atom dikembangkan oleh de Broglie, Schodinger dan Heienberg, orang yang menyadari bahwa hukum-hukum klasik tentang dinamika partikel tidak dapat diterapkan terhadap partikel-partikel dasar (fundamental particles).
Dalam dinamika klasik, sudah menjadi prasyarat bahwa posisi dan momentum suatu partikel diketahui secara tepat, namun dalam dinamika atom bila posisi partikel secara pasti, maka besaran yang lain (momentum) tidak dapat ditentukan.
Dalam kenyataan, ketidak pastian tentang posisi dan momentum partikel kecil harus kita akui, akan tetapi hasil kali derajat ketidakpastian masing-masing besaran tadi dapat kita hubungkan dengan nilai konstanta Planck (h = 6.6256 x 10-34 Js).
Di alam makroskopik ketiddakpastian ini terlalu kecil untuk dapat diukur, namun bila kita melakukan sesuatu terhadap gerak elektron yang mengelilingi inti atom, penerapan prinsip ketidakpastian (Uncertainty Principle-istilah yang diperkenalkan oleh Heisenberg) penting sekali.
Akibat menganut Prinsip Ketidakpastian ini, kita tak boleh lagi membayangkan elektron sebagai sesuatu yang bergerak dalam orbit tetap mengelilingi inti. Kita harus memandang gerak elektron sebagai fungsi gelombang.
Dengan fungsi ini kita hanya mungkin mendapatkan elkctron yang energinya tertentu saja diruang disekitar inti. Situasi menjadi lebih rumit bila kita memperhitungkan kenyataan bahwa elektron bukan hanya bergerak mengitari inti, namun juga berpusing pada porosnya sendiri. Sebagai konsekuensi, untuk menyatakan gerak elkctron disebuah atom kita tidak lagi mengunakan integer tunggal n, seperti pada teori Borh. Sekarang kita harus menyatakan keadaan elektron mengunakan empat buah bilangan.
Bilangan-bilangan yang dikenal sebagai bilangan-bilangan kuantum ini adalah n, l, m dan s, dimana n merupakan bilangan kkuatum pertama (principal quantum number), l
28 bilangan kuantum orbit (orbital quantum number), m bilangan kuantum dalam (inner
quantum number) dan s bilangan kuantum spin (spin quantum number). Prinsip dasar lain
teori kuantum modern untuk atom adalah Prinsip Pengecualian Pauli (Pauli Exclusion Principle) yang yang menyatakan bahwa dalam sebuah atom tidak ada dua elektron yang bias memiliki perangkat bilangan kuantum
persis sama.
Jika kita ingin memahami cara membuat Tabel Periodik menurut struktur elektronik atom-atom berbagai unsure, kita harus memperhatikan kebermaknaan keempat bilangan kuantum tadi, sekaligus batasan harga-harga numeric yang dapat dimiliki masing-masing. Bilangan kuantum yang paling penting adalah bilangan kuantum utama, karena inilah yang paling berperan dalam penentuan energi elektron.
Bilangan kuantum utama dapat memiliki harga bilangan bulat mulai dari n = 1, yang menyatakan energi paling rendah. Elektron dengan n = 1 paling stabil, dan kestabilan berkurang dengan naiknya harga n. Elektron yang bilangan kuantum utamanya n dapat mempunyai bilangan kuantum orbital bernilai bulat antara 0 dan (n - 1). Jadi jika n = 1, l harus 0, sementara bila n = 2, l = 0 atau 1, dan bila n = 3, l = 0, 1, atau 2. bilangan kuantum orbital menyatakan momentum sudut elektron ketika mengitari inti, dan ini mnentukan sesuatu yang dalam mekanika nonkuantum disebut bentuk orbit.
Untuk suatu harga n, elektron dengan l paling rendah akan mempunyai energi paling rendah, sehingga semakin tinggi harga l makin besar ula energinya. Dua bilangan kuantum yang lain, yaitu m dan s berturut-turut menyatakan orientasi orbit elektron diseputar inti dan orientasi arah spin elektron. Untuk suatu harga l, sebuah elektron boleh mempunyai bilangan kuantum dalam m bernilai bulat dari +l sampai –l, termasuk 0. jadi untuk l = 2, m bisa mempunyai harga-harga +2, +1, 0, -1, dan –2. Elektro-elektron dengan harga-harga n dan l yang sama tetapi berbeda dalam harga-harga m mempunyai energi yang sama besar, asalkan tidak dipengaruhi suatu medan magnet. Bila ada medan magnet, energi elektron-elektron dengan harga-harga m berbeda akan berubah sedikit, seperti yang tampak dari terpisahnya garis-garis spektrum pada efek Zeeman. Untuk sebuah electron yang mempunyai harga-harga
n, l dan m sama besar, bilangan kuantum spin
s-n bahwa harga tesebut bukas-n bilas-ngas-n bulat us-ntuk semes-ntara is-ni tidak perlu dirisaukan; yang perlu kita ingat hanyalah bahwa dua elektron dalam sebuah atom dapat mempunyai harga-harga n, l dan m yang sama, serta bahwa kedua elektron tadi akan berpusing dengan arah berlawanan. Hanya dibawah pengaruh medan magnet saja energi dua elektron dengan spin berlawanan akan berbeda.
29 STRUKTUR ATOM
Setiap atom terdiri dari inti yang sangat kecil yang terdiri dari proton dan neutron, dan di kelilingi oleh elektron yang bergerak. Elektron dan proton mempunyai muatan listrik yang besarnya 1,60 x 10-19 C dengan tanda negatif untuk elektron dan positif untuk proton sedangkan neutron tidak bermuatan listrik. Massa partikel-partikel subatom ini sangat kecil: proton dan neutron mempunyai massa kira-kira sama yaitu 1,67 x 10-27 kg, dan lebih besar dari elektron yangmassanya 9,11 x 10-31 kg.
Setiap unsur kimia dibedakan oleh jumlah proton di dalam inti, atau nomor atom (Z). Untuk atom yang bermuatan listrik netral atau atom yang lengkap, nomor atom adalah sama dengan jumlah elektron. Nomor atom merupakan bilangan bulat dan mempunyai jangkauan dari 1 untuk hidrogen hingga 94 untuk plutonium yang merupakan nomor atom yang paling tinggi untuk unsur yang terbentuk secara alami.
Massa atom (A) dari sebuah atom tertentu bisa dinyatakan sebagai jumlah massa proton dan neutron di dalam inti. Walaupun jumlah proton sama untuk semua atom pada sebuah unsur tertentu, namun jumlah neutron (N) bisa bervariasi. Karena itu atom dari sebuah unsur bisa mempunyai dua atau lebih massa atom yang disebut isotop. Berat atom berkaitan dengan berat rata-rata massa atom dari isotop yang terjadi secara alami. Satuan massa atom (sma) bisa digunakan untuk perhitungan berat atom. Suatu skala sudah ditentukan dimana 1 sma didefinisikan sebagai 1/12 massa atom dari isotop karbon yang paling umum, karbon 12 (12C) (A = 12,00000). Dengan teori tersebut, massa proton dan neutron sedikit lebih besar dari satu, dan A Z + N Berat atom dari unsur atau berat molekul dari senyawa bisa dijelaskan berdasarkan sma per atom (molekul) atau massa per mol material. Satu mol zat terdiri dari 6,023 x 1023 atom atau molekul (bilangan Avogadro). Kedua teori berat atom ini dikaitkan dengan persamaan berikut:
1 sma/atom (molekul) = 1 g/mol
Sebagai contoh, berat atom besi adalah 55,85 sma/atom, atau 55,85 g/mol.
Kadang-kadang penggunaan sma per atom atau molekul lebih disukai; pada kesempatan lain g/mol (atau kg/mol) juga digunakan; satuan yang terakhirlah yang akan digunakan pada buku ini.
IKATAN ATOM PADA BAHAN PADAT GAYA DAN ENERGI IKAT
Ketika atom didekatkan dari suatu jarak yang tak terbatas. Pada jarak jauh, interaksi bisa diabaikan, tetapi ketika atom saling mendekati, masing-masing memberikan gaya ke yang lainnya. Gaya ini ada dua macam, tarik atau tolak, dan besarnya merupakan fungsi jarak
30 antar atom. Sumber gaya tarik FA tergantung pada jenis ikatan yang ada antara dua atom. Besarnya berubah dengan jarak, seperti yang digambarkan secara skematis pada Gambar 2.8a. Akhirnya, kulit elektron terluar dari kedua atom mulai tumpang tindih, dan gaya tolak yang kuat FR mulai timbul. Gaya netto FN antar dua atom adalah jumlah kedua komponen tarik dan tolak, yaitu : F F F N A R = + yang juga merupakan fungsi jarak antar atom sebagaimana di plot pada Gambar 2.8a.Jika FA dan FR sama besar, tidak ada gaya netto, sehingga: F F A R + = 0
Kemudian kondisi kesetimbangan muncul. Pusat kedua atom tetap terpisah pada jarak keseimbangan ro seperti ditunjukkan gambar 2.8a. Pada sebagian besar atom, ro kira-kira 0,3 nm (3Å). Ketika sudah berada pada posisi ini, kedua atom akan melawan semua usaha untuk memisahkannya dengan gaya tarik, atau untuk mendorongnya dengan gaya tolak. Kadang-kadang lebih menyenangkan untuk menggunakan energi potensial antara dua atom daripada gaya. Secara matematik, energi (E) dan gaya (F)dihubungkan dengan :
31 Atau untuk sistem atom
E F dr N N r F dr F dr A r R r E E A R
dimana EN, EA dan ER masing-masing adalah energi netto, energi tarik dan energi tolak bagi dua atom yang terisolasi dan berdekatan. Gambar 2.8b menggambarkan energi potensial tarik, tolak dan energi potensial netto sebagai fungsi jarak antar atom untuk dua atom. Untuk kurva netto, yaitu jumlah kedua energi, mempunyai energi potensial dititik minimum. Pada posisi ini spasi kesetimbangan yang sama, ro, bersesuaian dengan jarak atom pada kurva energi potensial minimum. Energi Ikat untuk kedua atom ini, Eo, bersesuaian dengan energi pada titik minimum ini (juga diperlihatkan pada gambar 2.8b), dimana menyatakan energi yang diperlukan untuk memisahkan kedua atom ini kejarak yang tak terbatas.
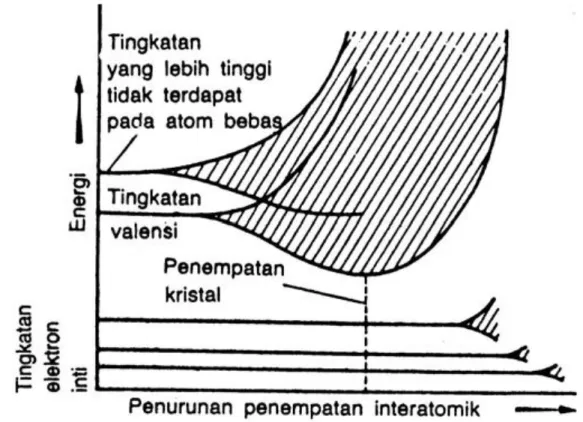
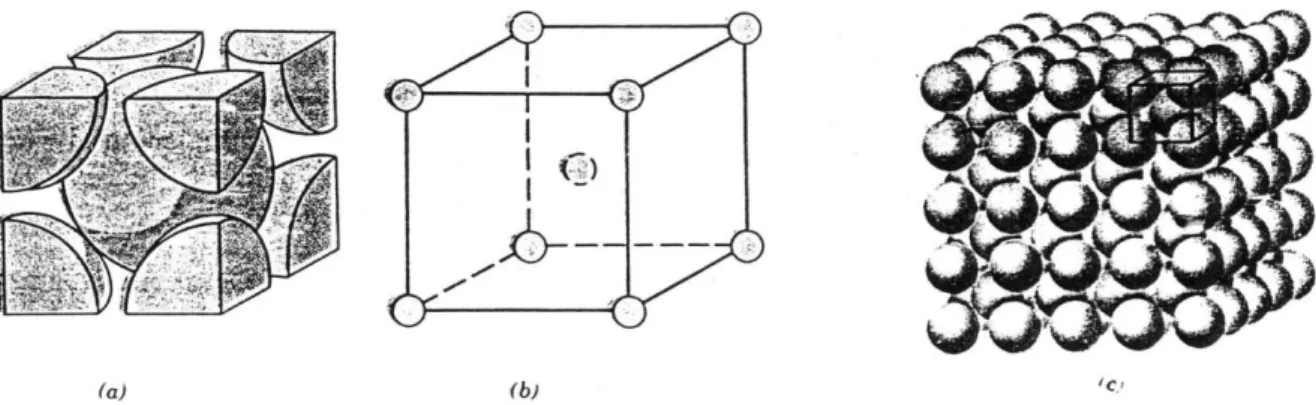
Besar energi ikat ini dan bentuk energi vs kurva jarak antar atom berbeda dari satu material ke material lainnya, kedua variabel ini bergantung kepada jenis ikatan atom. Zat padat dibentuk dengan energi ikat yang besar, sedangkan energi ikat yang kecil lebih disukai oleh gas, kondisi cair berlaku bagi energi yang besarnya menengah. Pada umumnya untuk material padat, temperatur leleh dan sifat ikatannya mencerminkan besarnya energi ikat . TATANAMA KEADAAN ELEKTRON DI SEBUAH ATOM
Sebelum membahas cara membuat susunan berkala unsur-unsur menurut strktur elektronika atom-atomnya, kita perlu menjabarkan dahulu system tatanama (nomeklatur) yang memungkinkan dijelaskanya keadaan elektron-elektron dalam sebuah atom. Karena energi sebuah elektron hanya ditentukan harga-harga bilangan kuantum utama dan orbital, maka kedua bilangan kuantum ini saja yang perlu diperhatikan dalam nomenklatur kita. Bilangan kuantum utama ditampilkan atau diekspresikan sebagaimana adanya, namun bilangan kuantum orbital dinyatakan dengan huruf. Huruf-huruf ini, yang diturunkan dari kebiasaan diawal perkembangan spektroskopi, adalah s, p, d, f yang berturut-turut
menyatakan bilangan-bilangan kuantum orbital l berharga 0, 1, 2 dan 3. (s = sharp, p = principal, d = diffusi, f = fundamental).
Bila bilangan kuantum utama n = 1 maka l harus sama dengan nol, dan elektron dalam keadaan demikian dinyatakan dengan simbol 1s. disini bilanga kuantum dalam tidak
32 boleh memiliki harga yang lain dari m = 0, namun harga bilangan kuantum spin-nya (s) boleh 2 + 1 atau 2 − 1 . Jadi, dapat disimpulkan bahwa dalam sebuah atom hanya dua elektron yang boleh memiliki keadaan 1s, dan elektron-elektron itupun berpusing dalam arah berlawanan. Dengan kata lain bila n =1, hanya s keadaan yang terjadi dan keadaan-keadaan itu hanya dapat dimiliki oleh dua buah elektron. Begitu kedua keadaan 1s terisi penuh, keadaan energi paling rendah berikutnya harus memiliki harga n = 2. Disini l boleh mempunyai harga 0 atau 1, dan karena itu elektron-elektron bias dalam keadaan entah 2s atau 2p. Energi sebuah keadaan 2s lebih rendah dari energi dalam keadaan 2p, oleh sebab itu keadaan 2s akan terisi lebih dahulu. Di sini pun, hanya dua electron bias berada dalam keadaan 2s, dan untuk keadaan-keadan s ini selalu demikian, tidak peduli berapapun harga bilangan kuantum utamanya. Electron-elektron dalam keadaan p dapat memiliki harga-harga m = +1, 0, -1, dan elektron-elektron yang memiliki masing-masing dari harga tersebut dapat memilikidua harga bilangan kuantum spin. Ini memungkinkan adanya enam buah elektron dalam setiap.
Tidak ada lagi elektron yang dapat ditambahkan ke dalam keadaan n = 2 sesudah keadaan-keadaan 2s dan 2p-nya terisi. Elektron-elektron berikutnya harus menempati keadaan denga n = 3 yang energinya lebih tinggi. Disini muncul kemungkinan adanya l berharga 0, 1 dan 2, sehingga disampuing keadaan-keadaan s dan p, keadaan-keadaan dengan d dengan l = 2 kini bias terjadi. Bila l = 2, m bias memilki harga-harga +2, +1, 0, -1, -2 dan masing-masing dapat ditempati dua elektron dengan spin berlawanan, sehingga total keadaan d mungkin adalah 10. Akhirnya bila n = 4, l bias mempunyai harga dari 0 hingga 4, dan bila l = 4, dapat dibuktikan bahwa kita akan mendapatkan 14 keadaan 4f.
TABEL PERIODIK
Atom paling sederhana adalah atom hidrogen, yang mempunyai proton tunggal sebagai intinya, dan karena itu hanya sebuah elektron yang dapat mengitarinya supaya atom itu tetap netral. Bila atom hydrogen ini bebas, yaitu dalam keadaan energi paling rendah, elektronnya akan berada dalam keadaan 1s. Untuk helium, yang intinya terdiri atas dua proton dan dua neutron, massa atomnya akan empat kali lebih besar dari hidrogen, tetapi karena muatan inti (nuclear charge) sematamata hanya ditentukan oleh banyaknya proton, maka hanya dua elektron yang berkitar di orbitnya. Kedua elektron ini kakn mempunyai energi paling rendah bila masing-masing menempati keadaan 1s. atom berikutnya, lithium, yang mempunyai tiga muatan inti, hanya dapat menempatkan dua elektronnya dalam keadaan 1s, sedangkan elektron ketiga harus masuk ke keadaan 2s yang energinya sedikit lebih tinggi. Begitu seperangkat keadaan untuk kuantum utama tertentu terisi, elektronelektron dalam keadaan demikian disebut membentuk selapis kulit yang rapat, dan dalam mekanika kuantum
33 begitu suatu kulit terisi, energi dari kulit tersebut turun ke harga yang demikian rendahnya sehingga elektron-elektron bias berada dalam keadaan mantap sekali. Oleh sebab itu, lithium mempunyai dua elektron yang terikatsekali ke intinya dan sebuah electron di keadaan 2s yang sangat kurang terikat. Elektron ini, yang sering disebut electron valensi, dapat dilepaskan dengan mudah, dan karena itu lithium dapat membentuk ion dengan muatan positif satu, dan bervalensi satu. Elektron 2s yang terletek disebelah luar ini denga demikian tergolong bebas.
Berilium mempunyai muatan inti empat, karena itu elektron-elektronnya akan menempati keadaan-keadaan 1s dan 2s, sementara keenam keadaan 2p dengan energi lebih tinggi tetap kosong. Dalam enam atom berikutnya, yang bermuatan inti dari lima hingga sepuluh, keadaan 2p ini akan cepat terisi, dan pada usur dengan muatan sepuluh (neon) semua keadaan tersedia yang memiliki bilangan kuantum utam 1 dan 2 terisi sehingga atom itu memiliki dua lapis kulit yang rapat. Seperti dalam kasus helium, elektron-elektron berada dalam keadaan energi rendah dan dari sini tidak dapat dipindahkan dengan mudah. Akibatnya, seperti helium, neon tidak mudah membentuk ion dan karena itu tidak dapat berperan serta dalam reaksi-reaksi kimia.
Dalam susunan berkala unsur-unsur, tiap kali sebuah atom mendapatka cukup elektron untuk merapatkan kulitnya, unsur yang terbentuk bersifat nonreaktif, dan unsur-unsur ini disebut gas mulia (inert gases).
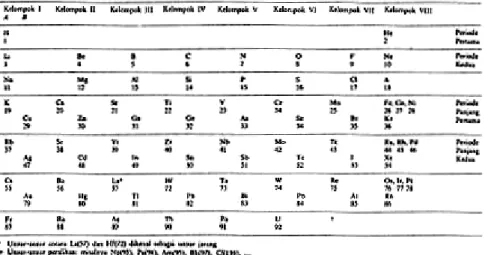
Tabel 2.2 Tabel Periodik Unsur
Dengan mekanisme yang sama, atom-atom dengan muatan inti atau nomor atom antara sebelas dan delapan belas akan membentuk kulit ketiga yang memiliki n = 3 dengan mengisi keadaan-keadaan 3s dahulu, kemudian 3p. bukan tidak mungkin orang berpikir bahwa sesudah argon yang bernomor atom Z = 18, atom-atom akan mempunyai electron keadaan 3d. ternyata yang terjadi bukan demikian karena kebetulan saja energi elektron di keadaan 4s lebih endah dibandingkan keadaan 3d. akibatnya, pada kalium (potassium) yang
34 mempunyai Z = 19 elektron-elektron berenergi tinggi keadaan s, dan unsure ini memiliki sifat kimia lebih menyerupai natrium(sodium) dan litium yang juga mempunyai elektron-elektron tunggal di keadaan s. Kalsium dengan Z = 20 memiliki dua elektron di keadaan 4s yang dengan demikian terisi penuh, sehingga scandium yang mungkin diharapkan memiliki elektron berenergi paling tinggi di keadaan 4p, ternyata menemukan bahwa energi elektron lebih rendah bila ditempatkan di keadaan 3d yang sampai kini dibiarkan kosong karena energinya lebih tinggi dibandingkan keadaan 4s. Sesudah skandium, unsur-unsur berikutnya meneruskan proses pengisian keadaan 3d, yang menjadi penuh pada unsur seng (Zn).
Bagaimanapun, proses pengisian keadaan 3d ini ternyata tidak sederhana. Dalam atom-tom bebas, diketahui bahwa ketika keadaan 3d diisi, elektron-elektron mula-mula menempati lima keadaan yang sesuai dengan kelima harga bilangan kuantum dalam m dan elektron-elektron tadi semuanya mempunyai bilangan spin sama (kaidah Hund). Apabila kelima keadaan itu telah terisi, energi elektron-elektron turun sehingga dari segi energi bagi khrom lebih menguntungkan andaikata sebuah elektron yang seharusnya menempati keadaan 4s digunakan untuk melengkapi kelima keadaan 3d. Itu sebabnya khrom hanya mempunyai sebuah elektron 4s dan lima elektron 3d. Proses serupa terjadi pada pada tembaga. Di sini sebuah dari elektron-elektron 4s digunakan untuk melengkapi kesepuluh keadaan 3d, yang dengan demikian merapatkan kulit ketiga dan mendapatkan reduksi energi elektron yang lumayan untuk kulit ini. Unsur-unsur dari scandium hinga tembaga, yang keadaan-keadaan 3d-nya terisi dengan cepat, doikenal sebagai unsur-unsur trnsisi. Pada tujuh unsur sesudah tembaga proses pengisian keadaan 4s dan 4p tidak begitu lancar, dan kripton, yang keadaan-keadaan 4s serta 4p-nya terisi penuh, termasuk kelompok gas mulia.
Pada kelompok unsur berikutnya, dari rubidium hingga xenon, terjadi proses
pengisian seperti terdahulu, yaitu 5s dahulu, baru kemudian 4d dan akhirnya 5p. Keadaan 4f untuk sementara belum terisi karena mempersyaratkan energi lebih tinggi ketimbang
keadaan-keadaan 5s, 4d, 5p dan 6s. Baru sesudah lanthanium, dari segi energi sudah pada tempatnya mengisi keempat belas keadaan 4f. Kelompok unsur yang dalam tabel periodik terletak antara lanthanium dan hafnium ini dikenal sebagai unsur tanah jarang. Setelah keadaan-keadaan 4f terisi, unsur-unsur berikutnya hingga gas mulia radon, mulai mengisi keadaan 5d dan akhirnya 6p. Unsur-unsur yang tersisa, lagilagi mengisi keadan s terlebih dahulu, yaitu keadaan-keadaan 7s dan proses selanjutnya sama dengan pada kelompok logam sebelumnya. Bagaimanapun, dari Material Teknik
unsur-unsur diatas untuk saat ini hanya enam unsur yang betul-betul terdapat di alam, yang lainnya belum ditetapkan apakah termasuk kelompok unsur tanah jarang atau tidak.