ANALISA PENGARUH KONSENTRASI KATALIS HCl PADA
HIDROLISA MINYAK JARAK
Christyowati Primi Sagita
*), Erna Listyaningrum, Irfan Suryanto
Jurusan Teknik Kimia, Fakultas Teknik, Universitas Diponegoro, Jl. Prof. Soedarto, SH, Kampus Undip Tembalang, Semarang, Indonesia 50275
Abstrak
Minyak jarak merupakan minyak nabati yang diperoleh dengan cara pemerasan dari tanaman Ricinus communis, kegunaan langsung minyak jarak terbatas pada industri genteng, obat – obatan , minyak rem, dan minyak lincir sehingga dilakukan hidrolisa minyak untuk meningkatkan penggunaannya. Hidrolisa minyak jarak dalam percobaan ini dilakukan menggunakan variabel konsentrasi katalis HCl yaitu 0.1N, 0.15N, dan 0.2N dengan melakukan analisa kadar asam lemak pada bahan baku, kemudian hidrolisa minyak selama 15 menit dan analisa kadar asam lemak bebas. Berdasarkan percobaan yang telah dilakukan, hasil menunjukkan pada konsentrasi HCl 0,2 N didapatkan konversi hidrolisa tertinggi sebesar 0,13; konstanta kecepatan reaksi tertinggi yaitu 0,0104/menit; dan konstanta kesetimbangan reaksi hidrolisa yang diperoleh sebesar 1,283x10-7.
Kata kunci:minyak jarak; konversi; konstanta kecepatan reaksi; hidrolisa; katalis
Abstract
The Analysis of Effect of Catalyst’s Concentration on Hydrolysis of Castor oil Plant. Castor oil is vegetable oil obtained by extortion from Ricinus communis, direct usefulness of castor oil is limited to the tile industry , medicine , brake fluid , and oil slick, so to increase its usage can be done by hydrolysis of castor oil. The hydrolysis of castor oil in this lab work are using HCl catalyst’s concentration variable which are 0.1N, 0.15N, and 0.2N by analyzing the content of fatty acids in raw materials, hydrolyzing castor oil for 15 minutes and analyzing the content of free fatty acid as hydrolysis results. The results of this lab work show that the HCl catalyst’s concentration of 0.2 N produces the highest conversion, i.e 0,13; the greatest of reaction rate constant value, i.e 0.0104/min and the greatest of equilibrium constant value, i.e 1,283x10-7.
Keywords: castor oil; conversion; the reaction rate constant; hydrolysis; catalyst
1. Pendahuluan
Hidrolisa merupakan pengikatan gugus hidroksil (-OH) oleh suatu senyawa. Gugus hidroksil (–OH) dapat diperoleh dari air. Hidrolisis dapat digolongkan menjadi hidrolisis murni, hidrolisis katalis asam, hidrolisis katalis basa, gabungan alkali dengan air dan hidrolisis dengan katalis enzim. Berdasarkan fase reaksi hidrolisis dikelompokkan menjadi hidrolisis fase cair dan fase uap. Hidrolisa minyak nabati dapat dilakukan pada tekanan rendah akan tetapi reaksinya berlangsung lambat sehingga diperlukan katalisator, misalnya H2SO4 [2].
Minyak jarak merupakan minyak nabati yang diperoleh dengan cara pemerasan dari tanaman
Ricinus communis, kegunaan langsung minyak jarak terbatas pada industri genteng, obat – obatan, minyak
rem, minyak lincir. Sifat fisik dari minyak jarak adalah cairan tidak berwarna atau berwarna kuning pucat, bau lemak, rasa sedikit menggigit, viskositas tinggi dan bilangan asam akan tinggi sesuai dengan waktu yang ditandai dengan biji rusak dan cara pemerasan yang tidak baik. Sifat kimia dari minyak jarak adalah mengandung 46 – 53% minyak. Minyak jarak mengandung 80% gliserida, asam asinolat, stearat isoresinolat, dihidroksi stearat dan palmiat. Minyak jarak juga mengandung 20% protein, 0,2 alkaloid piridin beracun, risinin serta enzim lipase minyak jarak mengandung zat toksin risin.
Hidrolisa minyak jarak menjadi asam – asam lemak dan gliserol dilakukan dengan cara memanaskan campuran minyak jarak dan sedikit asam sulfat di dalam sebuah labu leher tiga [4]. Pemanasan dilangsungkan sampai suhu yang diinginkan sebelum air panas dimasukkan. Contoh
*)
Penulis Korespondensi. E-mail: [email protected]
diambil setiap waktu tertentu (10 menit) untuk dianalisa asam bebasnya, kecepatan hidrolisis terutama ditentukan oleh kecepatan reaksi antara air dan trigliserida di fase minyak. Penggunaan air yang berlebihan memungkinkan fase minyak selalu jenuh dengan air sehingga reaksi hidrolisis bertingkat satu semu terhadap konsentrasi gliserida [5].
Dalam penelitian ini, terdapat beberapa faktor yang mempengaruhi hidrolisa minyak jarak, yaitu semakin tinggi suhu akan memperbesar kelarutan air di dalam fase minyak, maka semakin banyak pula trigliserida yang bereaksi sehingga memperbesar nilai konstanta kecepatan reaksi; katalisator pada percobaan ini dipilih katalisator asam., semakin banyak katalis asam yang ditambahkan, konversi akan semakin besar demikian juga terhadap konstanta kecepatan reaksinya, bila katalisator semakin banyak maka semakin banyak pula molekul – molekul trigliserida yang teraktifkan; agar zat dapat saling bertumbukan dengan baik, maka perlu adanya pencampuran, untuk proses batch dapat dicapai dengan bantuan pengaduk, apabila prosesnya kontinyu maka pengadukan dilakukan dengan cara mengatur aliran dalam reaktor agar terjadi olakan; bila salah satu zat pereaksi berlebihan jumlahnya maka kesetimbangan dapat bergeser ke kanan dengan baik [7].
Hidrolisa adalah suatu proses menggunakan air untuk memecah senyawa. Minyak jarak merupakan trigliserida dari lemak, yang apabila dihidrolisa oleh air akan menghasilkan asam lemak bebas dan gliserin. Mekanisme hidrolisa minyak jarak dengan katalis mengikuti pemecahan ester. Radikal asam lemak bebas dipindahkan dari molekul gliserida, sehingga pemecahan lemak tidak berjalan sempurna. Pemecahan terjadi antara permukaan minyak dan lemak yang merupak reaksi homogen melalui oksidasi air yang dilarutkan dalam fase minyak [10].
Pada hidrolisa minyak jarak surfaktan yang digunakan ialah emulsifier berupa sabun. Molekul surfaktan memiliki gugus yang bersifat hidrofilik dan lipofilik sehingga dapat mempersatukan campuran minyak dan air. Molekul yang bersifat hidrofilik (suka air) dan molekul yang bersifat lipofilik (suka minyak). Umumnya bagian nonpolar (lipofilik) merupakan rantai alkil panjang dan bagian yang polar (hidrofilik) mengandung gugus hidroksil [1]. Di dalam molekul surfaktan salah satu gugus harus dominan jumlahnya. Bila gugus polar lebih dominan maka molekul surfaktan akan di absorpsi lebih kuat ke air dibanding minyak. Akibatnya tegangan permukaan menurun sehingga kedua fase mudah menyebar dan menjadi fase kontinyu. Demikian pula sebaliknya bila gugus non polar lebih dominan maka
molekul surfaktan akan diabsorpsi lebih kuat oleh minyak dibanding air [4].
2. Bahan dan Metode 2.1 Bahan Utama
Bahan yang digunakan pada hidrolisa minyak jarak yaitu minyak jarak, aquadest, katalis HCl 25%, NaOH, alcohol 96%, surfaktan Sunlight yang diproduksi oleh PT. UNILEVER Tbk, serta indicator PP.
2.2 Alat Utama
Peralatan yang digunakan dalam penelitian ini yaitu labu leher tiga, buret, statif, klem, pendingin balik, water bath, dan erlenmeyer.
2.3 Metode Percobaan
Langkah awal dalam penelitian ini adalah menghitung densitas dengan menimbang picnometer kosong (m1), masukkan minyak jarak kedalam
picnometer yang telah diketahui volumenya (V), timbang beratnya (m2), hitung densitas minyak jarak
=(m2-m1)/V; selanjutnya menghitung densitas
katalis dengan cara yang sama.
Langkah selanjutnya yaitu menganalisa kadar asam lemak dalam bahan baku dengan memasukkan 10 ml minyak jarak ke dalam erlenmeyer, menambahkan 15 ml alkohol 96% dan memanaskannya sambil diaduk pada suhu 60oC, menambahkan 3 tetes indikator PP dan menitrasi dengan NaOH sampai warna berubah menjadi merah muda, mencatat kebutuhan titrai.
Selanjutnya yaitu menghidrolisa minyak jarak dengan memasukkan minyak jarak ke dalam labu leher tiga, memasukkan katalis HCl 0.1 N ke dalam labu leher tiga, mengalirkan air pendingin selama proses hidrolisa, memanaskan campuran tersebut sampai suhu 60 oC kemudian menambahkan aquadest yang telah dipanaskan ke dalam labu leher tiga,dan emulsifier (sabun) 5 ml, mengambil sampel dalam selang waktu 5 menit untuk dianalisa asam lemak dan asam total selama 15 menit, mengulangi prosedur percobaan dengan konsentrasi katalis HCl 0.15 dan 0.2 N.
Setelah menghidrolisa minyak jarak, kemudian kadar asam lemak bebas ditentukan dengan memasukkan 10 mL minyak jarak yang telah dihidrolisa ke dalam erlenmeyer, menambahkan alkohol 96% 15 mL dan dipanaskan sambil diaduk pada suhu 60oC, menitrasi dengan NaOH : penambahan 3 tetes indikator PP, kemudian dititrasi sampai warna merah muda, mencatat kebutuhan titran
3. Hasil dan Pembahasan
3.1 Hubungan Konsentrasi Katalis terhadap Konversi Hidrolisa Minyak Jarak
Berdasarkan praktikum hidrolisa minyak jarak menggunakan variabel berubah konsentrasi katalis HCl , diperoleh data-data yang menunjukkan hubungan konsentrasi katalis terhadap konversi hidrolisa minyak jarak pada tabel berikut ini.
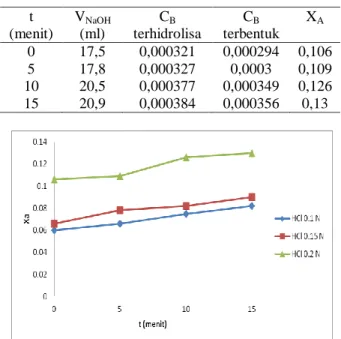
Tabel 3.1 Data Konversi Hidrolisa Minyak Jarak pada Konsentrasi Katalis HCl 0.1 N t (menit) VNaOH (ml) CB terhidrolisa CB terbentuk XA 0 10,6 0,0001946 0,0001668 0,06 5 11,5 0,000211 0,0001834 0,066 10 12,9 0,000237 0,000209 0,075 15 14 0,000257 0,000229 0,082
Tabel 3.2 Data Konversi Hidrolisa Minyak Jarak pada Konsentrasi Katalis HCl 0.15 N
t (menit) VNaOH (ml) CB terhidrolisa CB terbentuk XA 0 11,1 0,000204 0,000176 0,066 5 13,2 0,000242 0,000215 0,078 10 13,6 0,00025 0,000222 0,082 15 14,3 0,000263 0,000235 0,09
Tabel 3.3 Data Konversi Hidrolisa Minyak Jarak pada Konsentrasi Katalis HCl 0.2 N
t (menit) VNaOH (ml) CB terhidrolisa CB terbentuk XA 0 17,5 0,000321 0,000294 0,106 5 17,8 0,000327 0,0003 0,109 10 20,5 0,000377 0,000349 0,126 15 20,9 0,000384 0,000356 0,13
Gambar 3.1 Hubungan konsentrasi katalis terhadap konversi hidrolisa minyak jarak
Berdasarkan grafik pada gambar 3.1, data yang diperoleh menunjukkan semakin besar lama waktu hidrolisa, maka nilai konversi minyak yang
terhidrolisa semakin besar. Hal ini dapat dilihat pada konsentrasi HCl 0,1 N, nilai konversi minyak yang terhidrolisis meningkat dari 0,066 pada waktu 5 menit menjadi 0,075 pada 5 menit berikutnya dan menjadi 0,082 pada waktu 15 menit. Waktu reaksi hidrolisa yang semakin lama akan memperbesar kesempatan zat-zat reaktan untuk saling berinteraksi sehingga minyak yang terhidrolisa relatif bertambah. Dari gambar 3.1 di atas juga dapat dilihat semakin besar konsentrasi katalis yang digunakan dalam hidrolisa minyak, nilai konversi yang dihasilkan semakin besar. Pada waktu ke-5 menit, konversi yang dihasilkan menggunakan katalis HCl dengan konsentrasi 0,1 N sebesar 0,066 sedangkan pada katalis HCl 0,15 N, diperoleh konversi sebesar 0,078 dan pada katalis HCl 0,2 N konversi yang dihasilkan lebih besar yaitu sebesar 0,109. Hal ini juga terjadi pada waktu ke-10 menit hingga ke-15 menit , dimana nilai konversi yang dihasilkan pada reaksi hidrolisa dengan penambahan konsentrasi katalis HCl 0,2 N lebih besar dari pada menggunakan katalis dengan konsentrasi 0,15 dan 0,1 N.
Penambahan katalisator berfungsi untuk mengaktifkan zat-zat pereaksi sehingga energi aktivitas (Ea) semakin kecil dan proses hidrolisa dapat terjadi semakin cepat [8]. Semakin besar konsentrasi katalis asam yang ditambahkan, maka semakin banyak molekul-molekul trigliserida yang teraktifkan dan kecepatan reaksi hidrolisa menjadi lebih cepat. Peningkatan kecepatan reaksi hidrolisa menyebabkan semakin banyak minyak yang terhidrolis menjadi asam lemak bebas, sehingga nilai konversi hidrolisa semakin meningkat [9].
3.2 Hubungan Konsentrasi Katalis terhadap Konstanta Kecepatan Reaksi Hidrolisa Minyak Jarak
Berdasarkan praktikum hidrolisa minyak jarak menggunakan variabel berubah konsentrasi katalis HCl , diperoleh data-data yang menunjukkan hubungan konsentrasi katalis terhadap nilai konstanta laju reaksi hidrolisa minyak jarak pada tabel berikut ini.
Tabel 3.4 Data Konstanta Kecepatan Reaksi Hidrolisa Minyak Jarak pada setiap T (men) CB trigliserida yang bereaksi k (menit -1 ) 0.1 N 0.15 N 0.2 N 0.1 N 0.15 N 0.2 N 0 0,06 0,066 0,106 0.0079 0.0082 0.0104 5 0,066 0,078 0,109 10 0,075 0,082 0,126 15 0,082 0,09 0,13
Variabel Konsentrasi Katalis HCl
Gambar 3.2 Hubungan konsentrasi katalis terhadap konstanta kecepatan reaksi hidrolisa minyak jarak
Berdasarkan grafik pada gambar 3.2, data yang diperoleh menunjukkan semakin besar konsentrasi katalis HCl yang digunakan maka nilai konstanta kecepatan reaksinya semakin besar. Hal ini dapat dilihat pada konsentrasi HCl 0,1 N, konstanta kecepatan reaksi hidrolisanya sebesar 0,0079/menit, sedangkan pada konsentrasi HCl 0,15 N konstanta kecepatan reaksinya sebesar 0,0082/menit dan pada konsentrasi HCl 0,2 N konstanta kecepatan reaksinya juga lebih besar yaitu sebesar 0,0104/menit. Katalisator yang dipakai dalam reaksi hidrolisa ini adalah katalis HCl yang memiliki ion H+ yang akan mengaktifkan trigliserida (minyak) dengan membentuk suatu kompleks. Kompleks yang terbentuk ini bersifat reaktif sehingga dapat menurunkan energi aktivasi yang diperlukan dalam reaksi hidrolisa. Katalis tidak mengalami perubahan pada akhir reaksi, tetapi memberi energi pengaktifan yang lebih rendah sehingga dapat meningkatkan laju reaksi [11]. Berdasarkan persamaan Arrhenius berikut ini :
k = A
dengan k = konstanta laju reaksi, Ea = energi aktivasi, A = frekuensi tumbukan, R = konstanta gas ideal dan T = suhu dalam Kelvin,
menyatakan bahwa penurunan energi aktivasi menyebabkan nilai konstanta kecepatan reaksi menjadi bertambah besar.
Pada konsentrasi HCl 0,1 N, diperoleh jumlah mol H+ yang terkandung dalam 300 ml volume total adalah 30 mmol, pada konsentrasi HCl 0,15 N diperoleh jumlah mol H+ sebesar 45 mmol dan pada konsentrasi HCl 0,2 N diperoleh jumlah mol H+ sebesar 60 mmol. Pada konsentrasi HCl 0,1 N, nilai konstanta kecepatan reaksi yang diperoleh yaitu 0,0079/menit, sehingga dengan A= 1,2515x108 dan suhu operasi 65°C menggunakan persamaan Arrhenius diperoleh energi aktivasi (Ea) sebesar65998,52 J/mol, pada konsentrasi 0,15 N dengan konstanta kecepatan reaksi yaitu 0,0082/menit diperoleh energi aktivasi (Ea) sebesar 65893,78 J/mol dan pada konsentrasi 0,2 N dengan konstanta kecepatan reaksi yaitu 0,0104/menit diperoleh energi aktivasi (Ea) sebesar 65225,89 J/mol. Dari data energi aktivasi yang diperoleh ini menunjukkan bahwa energi aktivasi mengalami penurunan.
Penurunan energi aktivasi ini dapat disebabkan oleh meningkatnya kereaktifan zat-zat pereaksi untuk saling bertumbukan karena adanya penambahan katalis [3]. Oleh karena itu, semakin besar konsentrasi katalis yang digunakan maka semakin banyak ion H+ yang mengaktifkan trigliserida menjadi senyawa kompleks yang reaktif yang menyebabkan energi aktivasi untuk reaksi hidrolisa semakin turun dan nilai konstanta kecepatan reaksi menjadi semakin besar.
3.3 Hubungan Konsentrasi Katalis terhadap Arah Kesetimbangan Reaksi Hidrolisa Minyak Jarak
Berdasarkan praktikum hidrolisa minyak jarak menggunakan variabel berubah konsentrasi katalis HCl , diperoleh data-data yang menunjukkan hubungan konsentrasi katalis terhadap nilai konstanta laju reaksi hidrolisa minyak jarak pada tabel berikut ini.
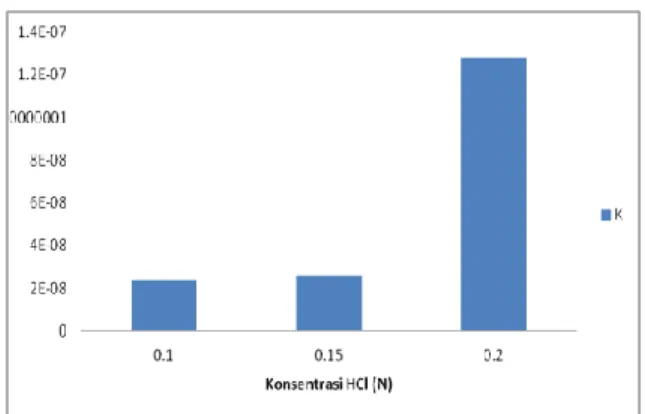
Tabel 3.5 Data Konstanta Kesetimbangan Reaksi Hidrolisa Minyak Jarak pada setiap Variabel Konsentrasi
Katalis HCl t (menit) XA K 0.1 N 0.15 N 0.2 N 0.1 N 0.15 N 0.2 N 0 5,56x 10-5 5,87 x 10-5 9,8 x 10-5 2,377x10-8 2,611x10-8 1,283x10-7 5 6,11 x 10-5 7,17 x 10-5 1,00 x 10-4 10 6,97 x 10-5 7,4 x 10-5 1,16 x 10-4 15 7,63 x 10-5 7,83 x 10-5 1,19 x 10-4
Gambar 3.3 Hubungan konsentrasi katalis terhadap arah kesetimbangan reaksi hidrolisa
minyak jarak
Berdasarkan grafik pada gambar 4.3, data yang diperoleh menunjukkan semakin besar konsentrasi katalis HCl yang digunakan pada reaksi hidrolisa minyak, konstanta kesetimbangan reaksi yang diperoleh juga semakin besar. Konstanta kesetimbangan reaksi pada konsentrasi katalis HCl 0,1 N yang diperoleh yaitu sebesar 2,377x10-8 , pada konsentrasi katalis HCl 0,15 N diperoleh konstanta kesetimbangan reaksi sebesar 2,611x10-8 sedangkan pada konsentrasi katalis HCl 0,2 N diperoleh konstanta kesetimbangan reaksi sebesar 1,283x10-7. Reaksi hidrolisa minyak jarak dapat ditulis dalam bentuk sederhana menjadi persamaan reaksi berikut ini :
A + 3B C + D
sehingga nilai konstanta kesetimbangan yang diperoleh menggunakan rumus :
K = [ ] [ ][ ] [ ]
Konstanta kesetimbangan reaksi yang diperoleh dalam percobaan ini nilainya kurang dari satu (K<<1) sehingga reaksi hidrolisa minyak yang terjadi merupakan reaksi reversibel atau dua arah. Reaksi dua arah ini menyebabkan reaksi hidrolisa minyak memiliki reaksi kesetimbangan yang berlangsung dalam dua tahap yaitu reaksi kesetimbangan hidrolisis trigliserida menjadi asam lemak dan gliserol, dan reaksi esterifikasi minyak dari asam lemak dan gliserol [3]. Dalam reaksi hidrolisa minyak jarak, reaktan air dibuat berlebihan dibandingkan reaktan minyak dengan perbandingan mol reaktan minyak : air yaitu 1 : 10. Perbandingan mol air yang lebih banyak dari minyak menyebabkan reaksi bergeser ke arah kanan yaitu pembentukan asam lemak.
Katalis bereaksi pada awal dan dihasilkan kembali pada akhir reaksi, sehingga katalis tidak mempengaruhi harga tetapan kesetimbangan. Katalis hanya berfungsi mempercepat baik reaksi irreversibel maupun reaksi reversibel sehingga mempercepat
tercapainya keadaan setimbang [6]. Peningkatan nilai konstanta kesetimbangan dengan semakin besar konsentrasi katalis HCl disebabkan karena dengan semakin besar konsentrasi katalis HCl, maka semakin banyak reaktan yang teraktifkan dengan adanya ion H+ dari katalis HCl sehingga semakin banyak produk yang terbentuk dalam proses hidrolisa. Pada konsentrasi katalis HCl 0,1 N diperoleh konsentrasi asam lemak yang terbentuk yaitu 0,000229 mgrek/gr minyak, pada konsentrasi katalis HCl 0,15 N diperoleh konsentrasi asam lemak terbentuk sebesar 0,000235 mgrek/gr minyak dan konsentrasi asam lemak terbentuk dengan penambahan katalis HCl 0,2 N diperoleh sebesar 0,000356 mgrek/minyak. Konsentrasi produk yang terbentuk ini mempengaruhi nilai konstanta kesetimbangan reaksi hidrolisa yang diperoleh. Sehingga semakin besar konsentrasi produk yang terbentuk, semakin besar pula nilai konstanta kesetimbangan reaksi yang diperoleh.
3.4 Mekanisme Penambahan Surfaktan terhadap Hidrolisa Minyak Jarak
Surfaktan (Surface Active Agent) merupakan zat seperti deterjen yang ditambahkan pada campuran emulsi untuk meningkatkan sifat penyebaran atau pembasahan dengan menurunkan tegangan permukaan cairan, terutama air. Surfaktan memiliki struktur molekul yang terdiri dari gugus liofobik (tidak suka air) yang mudah bersenyawa dengan minyak dan gugus liofilik (suka air) yang mudah bersenyawa dengan air. Penggunaan surfaktan terbagi menjadi tiga, yaitu sebagai bahan pembasah, bahan pengemulsi dan bahan pelarut, sehingga surfaktan dibagi menjadi 2 golongan besar yaitu surfaktan yang larut dalam minyak dan surfaktan yang larut dalam pelarut air.
Gambar 3.4 Struktur molekul surfaktan Mekanisme kerja surfaktan pada hidrolisa minyak yaitu dengan menurunkan tegangan permukaan air. Penurunan tegangan permukaan air dilakukan dengan mematahkan ikatan-ikatan hidrogen pada permukaan [1]. Hal ini didukung juga oleh struktur molekul surfaktan yang memiliki gugus liofobik dan liofilik, dimana kepala-kepala hidrofilik terletak di permukaan air dengan ekor-ekor
hidrofobiknya terentang menjauhi permukaan air. Gugus liofilik pada surfaktan bersifat polar sehingga jika gugus polar lebih dominan, maka akan menyebabkan tegangan permukaan air menjadi lebih rendah sedangkan jika gugus liofobik yang bersifat non polar lebih dominan, maka tegangan permukaan minyak yang akan menjadi lebih rendah sehingga mudah menyebar dan menjadi fase kontinyu.
Gambar 3.5 Mekanisme kerja surfaktan sebagai emulsifier minyak dan air
Penambahan surfaktan dalam larutan, setelah mencapai konsentrasi tertentu, tegangan permukaan akan konstan walaupun konsentrasi surfaktan ditingkatkan. Bila surfaktan tetap ditambahkan melebihi konsentrasi ini maka surfaktan akan beragregasi membentuk misel dengan konsentrasi yang disebut critical micelle concentration (cmc). Tegangan permukaan akan menurun hingga cmc tercapai [4]. Kemudian setelah cmc tercapai maka tegangan permukaan akan konstan yang menunjukkan bahwa antar muka menjadi jenuh dan terbentuk misel yang berada dalam keseimbangan dinamis dengan monomernya. Terbentuk misel inilah yang menandakan bahwa minyak dan air dapat larut dengan adanya penambahan surfaktan.
4. Kesimpulan
Kesimpulan yang dapat diambil dari penelitian ini adalah sebagai berikut:
1. Semakin besar konsentrasi katalis HCl yang digunakan selama reaksi hidrolisa maka konversi yang dihasilkan semakin besar. Hasil praktikum diperoleh konversi tertinggi yaitu 0,13 pada konsentrasi HCl 0,2 N.
2. Semakin besar konsentrasi katalis HCl yang digunakan selama reaksi hidrolisa maka nilai konstanta kecepatan reaksi yang terjadi semakin besar. Pada praktikum ini, diperoleh nilai konstanta kecepatan reaksi terbesar yaitu 0,0104/menit pada konsentrasi HCl 0,2 N. 3. Semakin besar konsentrasi katalis HCl yang
digunakan selama reaksi hidrolisa maka semakin banyak produk yang terbentuk
sehingga nilai konstanta kesetimbangan reaksi semakin besar. Pada praktikum ini, nilai konstanta kesetimbangan terbesar diperoleh pada konsentrasi HCl 0,2 N sebesar 1,283x10-7. 4. Mekanisme kerja surfaktan yang ditambahkan
pada reaksi hidrolisa minyak jarak adalah dengan menurunkan tegangan permukaan sehingga hingga terbentuk misel sehingga minyak dan air dapat larut.
Daftar Pustaka
[1] Adamson, A.W., 1982. Physical Chemistry of Surface. A wiley-Interscience Publication, USA. [2] Agra, S. B. dan Warnijati S. 1972. Hidrolisis
Minyak Kelapa Dengan Katalisator Asam.
Forum Teknik.2 (1). Hal 31–40
[3] Dwi, Ardiana. “Kinetika Reaksi Esterifikasi Asam Formiat dengan Etanol pada Varian Suhu dan Konsentrasi Katalis”
[4] Furi, Trievita A. dan Pamilia C., 2012. Pengaruh Perbedaan Ukuran Partikel dari Ampas Tebu dan Konsentrasi Natrium Bisulfit (NaHSO3)
pada Proses Pembuatan Surfaktan. Jurusan Teknik Kimia Fakultas Teknik Universitas Sriwijaya: Palembang
[5] Griflin, R. C. 1927. Technical Method of Analysis. 2nd ed. P. 307 – 311. Mc Graw Hill Book Company, Inc. New York.
[6] Persada, Welly R. 2012. Pendekatan Kinetika terhadap Reaksi Kesetimbangan; Studi Kasus pada Data Pustaka dan Reaksi Hidrolisis Metil
Asetat. Fakultas Matematika dan IPA
Universitas Negeri Sebelas Maret: Surakarta [7] Rahayu, S. 1999. Hidrolisis Minyak Jarak
Dengan Katalisator Asam Sulfat. Presiding Seminar Nasional Rekayasa Dan Proses.
[8] Setyadji, Moch., Susiantini, Endang dan Sri Murniasih. 2013. Pengaruh Jumlah Katalisator dan Kecepatan Pengadukan terhadap Konstanta Kecepatan Reaksi dan Hasil Esterifikasi Minyak Jarak Pagar. Pusat Teknologi Akselerator dan Proses – BATAN
[9] Suwandari, Juwita, Aziz, Isalmi dan Siti Nurbayti. 2013. Pembuatan Gliserol dengan Reaksi Hidrolisis Minyak Goreng. Fakultas Sains dan Teknologi, Universitas Islam Negeri Syarif Hidayatullah: Jakarta
[10] Sven, Tj And Chien, T.P. 1941. Reaction Mechanism Of The Acid Hydrolysis Of Fatty Oils. Ind. Eng. Chem, 33.1893.
[11] Widjajanti, Endang. 2005. Pengaruh Katalisator terhadap Laju Reaksi. Fakultas Matematika dan Ilmu Pengetahuan Alam. Universitas Negeri Yogyakarta: Yogyakarta