POTENSI PENGGUNAAN ACEPROMAZINE SEBAGAI
SEDIAAN TRANSQUILIZER UNTUK TRANSPORTASI
BENIH IKAN PATIN
LARAS ANDINI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2010
Dengan ini saya menyatakan bahwa skripsi dengan Potensi Penggunaan Acepromazine sebagai Sediaan Transquilizer untuk Transportasi Benih Ikan Patin adalah karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, 30 Agustus 2010
Laras Andini
ABSTRACT
LARAS ANDINI. The Potential Use of Acepromazine as a Transquilizer for Transportation of Catfish Juvenille. Supervised by WASMEN MANALU and ANDRIYANTO.
This study aimed to assess the potential use of acepromazine as a transquilizer in catfish juvenille (Pangasius pangasius) transportation with a different times of treatment (in the morning and afternoon). This research was conducted by using the method of soaking (dipping), mixing water with acepromazine. Experimental animals used were 600 catfishes, 3-week old catfish, with average body length about 5.08 cm, and body weight around 6 g. The experimental catfish were assigned into a completely randomized design with a 2x6 factorial arrangement. The first factor was soaking time consisted of two levels, morning and afternoon. The second factor was dose of acepromazine consisted of six levels, 0 ppm, 5 ppm, 15 ppm, 25 ppm, 35 ppm, and 45 ppm. Catfish were placed in a container containing 100 ml water and then mixed with acepromazine. When the fish showed the symptoms of anaesthesia, the fish were immediately placed into another container that contains water for the process of recovery. The symptoms of anaesthesia were observed, the decreases of body balance, reflex body, tonus muscle, and pain. Time needed by fish to recover was the duration of acepromazine. In addition, the mortality rate was also observed to document the safety of acepromazine as a transquilizer. The result showed that the effective dosage for used in catfish juvenille transportation were 25 ppm with time of treatment in the morning. This dosage was choosed because it had a faster onset (96,55 minute), a longer duration (81.76 minute), and a lower mortality rate (10%).
©Hak Cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB
POTENSI PENGGUNAAN ACEPROMAZINE SEBAGAI
SEDIAAN TRANQSUILIZER UNTUK TRANSPORTASI
BENIH IKAN PATIN
LARAS ANDINI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada Fakultas Kedokteran Hewan
Institut Pertanian Bogor
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2010
Nama : Laras Andini NIM : B04061374
Disetujui
Prof. Dr. Ir. Wasmen Manalu Drh. Andriyanto, M.Si Pembimbing 1 Pembimbing 2
Diketahui
Dr. Dra. Nastiti Kusumorini Wakil Dekan Fakultas Kedokteran Hewan
PRAKATA
Puji dan syukur penulis panjatkan pada Allah SWT atas segala karunia dan rahmat-Nya sehingga penulisan skripsi ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan pada bulan Mei sampai dengan Agustus tahun 2009 ialah mengenai transportasi ikan dengan judul Potensi Penggunaan Acepromazine sebagai Sediaan Transquilizer untuk Transportasi Benih Ikan Patin.
Lewat prakata ini, penulis ingin mengucapkan terima kasih yang tak terhingga kepada:
1. Prof. Dr. Ir. Wasmen Manalu selaku pembimbing skripsi pertama yang telah memberikan bimbingan dan pengarahan kepada penulis dengan penuh kesabaran sehingga penulis akhirnya dapat menyelesaikan pembuatan skripsi ini.
2. Drh. Andriyanto, M.Si selaku pembimbing skripsi kedua yang telah membimbing penulis dengan kesabaran dan kebijaksanaan.
3. Drh. Chaerul Basri, M.Epid dan Bapak Bayu Febram, S.Si,Apt, M.Si selaku penguji pada ujian akhir sarjana yang telah memberikan banyak masukan untuk perbaikan karya tulis ini.
4. Dr. drh. M. Winny K. Sanjaya, MS selaku dosen pembimbing akademik yang telah membimbing penulis sejak penulis memulai kuliah di FKH IPB.
5. Bapak dan Ibu yang senantiasa memberikan doa, semangat, dan dukungan baik moril maupun materil serta kasih sayang yang melimpah untuk penulis.
6. Kakak dan adikku yang juga telah memberikan semangat dan dorongan sehingga penulis dapat menyelesaikan penyusunan skripsi ini.
7. Pak De Sri dan Mas Min selaku pegawai di farm Rumah Ikan, yang telah membantu selama penelitian.
8. Rekan-rekan satu penelitian Kurnia, Sisca, dan Rizki yang telah membantu penulis dalam pelaksanaan penelitian sekaligus teman di saat-saat susah maupun senang. Terima kasih kawan.
selama 3 tahun ini, semoga hubungan pertemanan yang telah terjalin tidak akan terputus.
10. Teman-teman Wisma Bisma II yang telah membagi pengalaman dan semangat di dalam masa-masa penyusunan skripsi serta berbagai pihak yang tidak dapat disebutkan satu-persatu.
Penulis berharap semoga skripsi ini dapat bermanfaat bagi semua pihak.
Bogor, Agustus 2010
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta, pada tanggal 20 Juni 1988. Penulis merupakan anak kedua dari tiga bersaudara dari pasangan Bapak Drs. Sutiman M.Si dan Ibu Sukaesih.
Penulis menyelesaikan pendidikan dasar pada tahun 2000 di SD Negeri Kalibata 03 Pagi, Kalibata, Jakarta Selatan. Kemudian pada tahun 2003 penulis menyelesaikan pendidikan di SLTP Negeri 182, Empang Tiga, Kalibata. Selanjutnya penulis melanjutkan studinya di SMA Negeri 55, Duren Tiga, Kalibata dan lulus pada tahun 2006.
Tahun 2006, penulis diterima di Institut Pertanian Bogor melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) dan memilih untuk melanjutkan studi di Fakultas Kedokteran Hewan IPB pada tahun kedua.
Selama menjadi mahasiswa Fakultas Kedokteran Hewan, penulis mengikuti berbagai organisasi internal kampus seperti Himpunan Profesi Ornithologi dan Unggas, penulis menjabat sebagai sekretaris selama dua tahun kepengurusan, Dewan Keluarga Mushola An Nahl, penulis menjabat sebagai anggota dari divisi keputrian dan penulis pernah menjadi panitia di berbagai acara internal kampus.
DAFTAR ISI
Halaman
DAFTAR TABEL ... ii
DAFTAR GAMBAR ... iii
DAFTAR LAMPIRAN ... iv PENDAHULUAN ... 1 Latar Belakang ... 1 Tujuan Penelitian ... 3 Manfaat Penelitian ... 3 Hipotesis Penelitian ... 3 TINJAUAN PUSTAKA ... 4
Karateristik Ikan Patin... 4
Budi Daya Ikan Patin ... 8
Tranportasi pada Distribusi Ikan Patin ... 10
Stres pada Ikan ... 13
Transquilizer ... 15
Acepromazine (ACP) ... 18
BAHAN DAN METODE ... 20
Waktu dan Tempat ... 20
Alat dan Bahan ... 20
Tahap Persiapan ... 20
Rancangan Percobaan ... 20
Tahap Perlakuan ... 21
Parameter yang diamati ... 22
Analisis Data ... 22
HASIL DAN PEMBAHASAN ... 23
Onset ... 23
Durasi ... 27
Tingkat Kematian ... 31
Pembahasan Umum ... 36
KESIMPULAN DAN SARAN ... 38
Kesimpulan ... 38
Saran ... 38
DAFTAR PUSTAKA ... 39
ii
DAFTAR TABEL
Halaman 1. Standar Kepadatan Ikan (g/L) dengan sistem tertutup ... 11 2. Standar Kepadatan Ikan (g/L) dengan sistem terbuka …... 12 3. Rancangan Perlakuan yang dilakukan pada percobaan ... 21
DAFTAR GAMBAR
Halaman
1. Ikan patin (Pangasius pangasius) ………...….. 4
2. Anatomi umum ikan jenis catfish ………... 6
3. Struktur umum insang ikan ... 6
4. Budi daya ikan patin dengan sistem keramba dan fence ... 8
5. Diagram mekanisme stres pada ikan ……….… 14
6. Ikan patin dalam kondisi normal ... 23
7. Lama onset anastesi pada berbagai dosis acepromazine dengan waktu perendaman pagi dan siang hari ... 24
8. Lamanya onset anastesi pada berbagai tingkatan dosis acepromazine tanpa memperhatikan waktu perendaman ... 25
9. Ikan yang telah teranastesi secara total (kehilangan keseimbangan dan tonus otot) ... 27
10. Lamanya durasi anastesi pada berbagai tingkatan dosis acepromazine dengan waktu perendaman pagi dan siang hari ... 29
11. Lamanya durasi anastesi pada berbagai tingkatan dosis acepromazine tanpa memperhatikan waktu perendaman ………... 30
12. Besarnya tingkat kematian ikan patin pada berbagai tingkatan dosis acepromazine tanpa memperhatikan waktu perendaman ……….... 32
13. Besarnya tingkat kematian ikan patin pada berbagai tingkatan dosis acepromazine dengan waktu perendaman pagi dan siang hari ……….... 34
14. Ikan yang telah mati setelah mengalami proses perendaman pada larutan acepromazine ……….... 35
iv
DAFTAR LAMPIRAN
Halaman
1. Data awal pengamatan onset, durasi, dan tingkat kematian ………... 43
2. Hasil olahan data onset dengan metode ANOVA ... 45
3. Hasil olahan data durasi dengan metode ANOVA ... 47
Latar Belakang
Protein merupakan salah satu zat gizi yang dibutuhkan oleh tubuh sebagai sumber utama perbaikan sel-sel yang telah rusak. Protein banyak terdapat pada pangan asal hewan maupun asal tumbuhan. Sumber protein jenis ini banyak diperoleh dari perairan laut maupun perairan darat. Indonesia memiliki perairan yang sangat luas yang terdiri atas sungai dan danau besar, ditambah dengan potensi sumber air tawar lainnya (Kordin 2010). Hal tersebut merupakan lahan potensial bagi pengembangan usaha perikanan.
Salah satu komoditas perikanan yang digemari oleh masyarakat ialah ikan patin. Ikan patin memiliki kandungan protein tinggi dan kolesterol yang rendah, serta harga yang lebih terjangkau. Hal-hal tersebut membuat ikan patin disukai oleh masyarakat. Tingkat konsumsi ikan patin telah mengalami kenaikan dari tahun 2004 hingga tahun 2007 dengan presentase kenaikan mencapai 22,86%. Produksi ikan dalam negeri tidak mampu memenuhi permintaan konsumen di seluruh negeri atau dapat dikatakan tidak terjadi keseimbangan antara jumlah permintaan dengan jumlah penyediaan sehingga tiap tahun Indonesia masih mengimpor ikan patin sebanyak 1300 ton dari Vietnam (Poernomo 2009).
Pembudidayaan ikan patin saat ini banyak dilakukan di luar Pulau Jawa, yaitu di Sumatera Selatan, Lampung, dan Kalimantan. Sementara itu, pembenihannya banyak dilakukan di Pulau Jawa sehingga diperlukan sarana transportasi dari tempat pembenihan menuju tempat pembudidayaan. Umumnya, pengusaha ikan di Pulau Sumatera membeli benih dari tempat pembenihan yang ada di Pulau Jawa, salah satunya di Bogor. Distributor benih dapat mengambil 3 sampai 4 kali dari Bogor setiap bulannya. Setiap pengambilan dapat mencapai 50.000 hingga 60.000 ekor dengan ukuran benih 3,81 cm sampai dengan 5,08 cm.
Transportasi benih merupakan salah satu aspek terpenting di dalam usaha pembudidayaan ikan. Transportasi yang memakan waktu lama serta penanganan yang tidak tepat selama dan setelah pengangkutan dapat menimbulkan stres pada benih ikan yang dapat berujung pada kematian. Salah satu upaya untuk
2
memperkecil angka kematian dan stres ialah dengan menggunakan anastetikum, yang dapat membuat ikan tertidur serta menurunkan laju metabolisme ikan dalam jangka waktu yang bisa ditentukan, bergantung pada dosis pemberian serta sediaan yang digunakan. Fungsi sediaan anastetikum lainnya selain untu pengangkutan antara lain, untuk mempermudah penanganan serta mengurangi stres pada ikan, misalnya saat dilakukan pengambilan sampel dengan biopsi oleh para peneliti (Ross dan Ross 2008).
Sediaan-sediaan anastetikum yang umumnya digunakan pada pengangkutan ikan dapat dibagi menjadi dua macam, yaitu yang berbahan dasar kimia, misalnya gas CO2, benzocaine, quinaldine, 2-phenoxythanol, metomidate,
isoeugenol, dan minyak cengkeh serta metode non-kimia, misalnya hipotermia dan penggunaan elektro-anastesi. Zat yang paling banyak digunakan dan populer adalah tricaine methanesulphonate. Sediaan ini merupakan satu-satunya sediaan yang telah disertifikasi oleh pemerintah Amerika Serikat sebagai obat yang boleh digunakan di bidang perikanan karena aman dikonsumsi oleh manusia. Namun, karena harganya yang relatif mahal (100 ml seharga $80), masyarakat masih mengandalkan gas CO2 sebagai anastetikum walaupun memiliki efek samping
yang lebih tinggi, di antaranya dapat menyebabkan hiperkapnia, dan disfungsi organ respiratori karena kadarnya yang tiba-tiba dapat lebih tinggi dari kadar yang diberikan (Coyle et al. 2004). Untuk mengatasi masalah tersebut, telah dikembangkan sebuah solusi untuk mencari sediaan anastetikum yang lebih aman dengan harga yang lebih terjangkau. Salah satunya ialah acepromazine.
Acepromazine merupakan salah satu jenis transquilizer yang termasuk dalam golongan phenotiazine. Onset kerja obat ini sangat cepat dan jika diberikan dalam dosis yang rendah, mekanisme sediaan ini dapat bekerja selama empat jam (pada hewan mamalia). Sediaan acepromazine ini bekerja dengan menekan sistem saraf pusat sehingga menyebabkan efek sedasi, relaksan otot serta menurunkan aktivitas spontan. Hewan yang diinduksi oleh senyawa ini terlihat seperti tertidur.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui dosis dan waktu perendaman efektif pada penggunaan acepromazine sebagai sediaan transquilizer pada ikan patin. Penentuan dosis dan waktu perendaman yang efektif, dapat dilihat melalui beberapa parameter, yaitu onset, durasi, dan persentase kematian pada ikan patin yang diuji. Selain itu, tujuan lain dari penelitian ini, untuk mengetahui pengaruh dosis acepromazine, waktu perendaman, dan interaksi antara keduanya terhadap parameter-parameter yang diamati. Keamanan penggunaan sediaan acepromazine pada benih ikan patin juga dapat diketahui dari besarnya persentase kematian.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi kepada mahasiswa dan masyarakat terutama pembudidaya ikan tentang potensi acepromazine pada benih ikan patin, dan perbandingan potensinya pada dua waktu yang berbeda, yang nantinya dapat diaplikasikan pada transportasi benih ikan patin.
Hipotesis Penelitian
H0 : Adanya faktor yang mempengaruhi lamanya onset anastesi pada benih ikan patin.
H1 : Tidak adanya faktor yang mempengaruhi lamanya onset anastesi pada benih ikan patin.
H0 : Adanya faktor yang mempengaruhi lamanya durasi anastesi pada benih ikan
patin.
H1 : Tidak adanya faktor yang mempengaruhi lamanya durasi anastesi pada benih ikan patin.
H0: Adanya faktor yang mempengaruhi tingkat kematian yang terjadi pada benih ikan patin.
H1 : Tidak adanya faktor yang mempengaruhi tingkat kematian yang terjadi pada benih ikan patin.
TINJAUAN PUSTAKA
Karateristik Ikan Patin
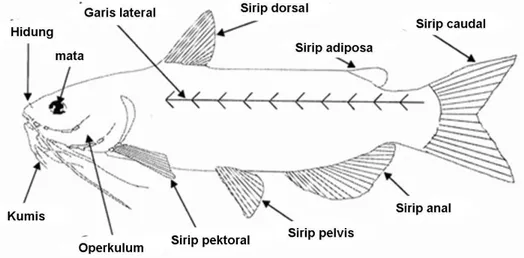
Ikan patin ialah ikan yang aslinya berasal dari negara Thailand dengan habitat di air tawar atau air payau dengan aliran air yang tenang, terutama di lingkungan yang berpasir dan berlumpur. Ikan patin merupakan salah satu jenis ikan air tawar yang saat ini banyak dibudidayakan oleh masyarakat dan sangat diunggulkan. Ikan patin merupakan nama lokal di Indonesia, tetapi di luar negeri ikan ini disebut dengan catfish. Kerabat dekat ikan patin dari famili Pangasidae pada umumnya memiliki ciri-ciri tubuh yang berbentuk pipih, tidak memiliki sisik, atau jika memiliki sisik maka strukturnya akan halus sekali, memiliki sungut atau kumis yang berjumlah 4-6, memiliki senjata berupa patil yang umumnya berada di sirip punggung dan sirip dada serta panjang sirip dubur yang dimulai dari belakang dubur hingga pangkal ekor (Kordin 2010).
Menurut Kordin (2010), klasifikasi ikan patin antara lain termasuk ke dalam filum Chordata dengan subfilum Vertebrata, kelas Pisces, subkelas Teleosteii, ordo Ostariophysi, sub ordo Silurodea, famili Pangasidae, genus
Pangasius, dan spesies Pangasius pangasius. Morfologi ikan patin dewasa yang
pada gambar di bawah ini.
Gambar 1. Ikan patin (Pangasius pangasius) (Balai Penelitian Perikanan Air Tawar 1994)
Walaupun berasal dari Thailand, di Indonesia ikan ini memiliki beberapa jenis kerabat di antaranya Pangasius polyuranodo (ikan Juaro), Pangasius
niuwenhuisii. Manfaat pemeliharaan ikan ini ialah sebagai sumber penyediaan
protein hewani ataupun sebagai ikan hias bagi orang-orang penyuka ikan hias (Susanto 1998).
Ikan patin dewasa berukuran hampir mencapai 120 cm, cukup besar bagi jenis ikan air tawar domestik. Pada umur 6 bulan, panjang ikan telah mencapai 35-40 cm. Tubuhnya berwarna putih keperakan licin tanpa sisik dengan punggung yang berwarna kebiru-biruan. Kepalanya berukuran kecil dengan mulut yang terletak agak ke bawah (merupakan ciri khas dari catfish). Selain itu, ikan ini juga memiliki kumis yang berfungsi sebagai indera peraba (Balai Penelitian Perikanan Air Tawar 1994).
Sirip yang terdapat di tubuh ikan patin terdiri atas lima jenis, yakni sirip punggung, sirip ekor, sirip perut, sirip dada, dan sirip dubur. Sama seperti ikan lele, ikan ini juga memiliki patil sebagai senjata, bedanya patil tersebut merupakan bagian dari sirip punggung dan sirip dada. Patil pada bagian sirip punggung berupa jari-jari keras yang bergerigi dan berukuran besar. Selain bagian tersebut, terdapat bagian sirip yang lunak yang terdiri atas enam sampai tujuh buah serta bagian sirip lemak yang berukuran sangat kecil (Kordin 2010).
Menurut Kordin (2010), patil yang terdapat pada sirip dada juga terdiri atas jari-jari keras yang sewaktu-waktu dapat berubah dan juga sirip lunak sebanyak 12 hingga 13 buah. Untuk sirip ekor, berbentuk seperti cagak, simetris satu sama lain, dan berukuran sangat besar. Sirip dubur merupakan sirip yang paling banyak memiliki jari-jari yang dapat mencapai 30 hingga 33 jari-jari lunak, sedangkan sirip perut hanya memiliki enam jari-jari yang lunak.
6
Gambar 2. Anatomi umum ikan jenis catfish (Department of Fisherian and Allied Aquaculture 2006)
Ikan juga memiliki salah satu organ penting, yaitu insang. Organ ini berfungsi sebagai organ pernapasan untuk mengatur pertukaran oksigen dan karbondioksida. Secara umum, struktur insang ditunjukkan pada Gambar 3.
Gambar 3. Struktur umum insang ikan (Wellborn 1988)
Ikan patin merupakan jenis ikan nokturnal yang senang beraktivitas dan mencari makan di malam hari sebagaimana ikan jenis catfish pada umumnya. Namun, ada hal yang membedakan ikan patin dari jenis catfish lainnya, yakni dalam hal sifatnya yang omnivor, pemakan segala mulai dari ikan-ikan kecil,
cacing, moluska, biji-bijian, serangga, hingga plankton. Selain itu, ikan ini juga sangat responsif terhadap pemberian pakan, semakin sering pakan diberikan maka semakin cepat pula pertumbuhan ikan. Oleh karena itu, ikan patin ini banyak dibudidayakan oleh masyarakat karena keuntungan yang akan didapat berlimpah (Susanto 1998).
Habitat yang disenangi oleh ikan patin sebagai tempatnya mencari makan ialah dasar kolam, kali, sungai, rawa, ataupun sumber kolam air tawar lainnya dan senang memilih liang-liang di tepi kolam sebagai sarangnya. Hal-hal yang telah disebutkan di atas dapat dibuktikan dengan letak mulut yang agak di bawah pada bagian kepala. Salah satu kebiasaan unik ikan patin yang terkadang dilakukan ialah ikan ini sering memunculkan diri di atas permukaan air dengan tujuan untuk mengambil oksigen langsung dari udara (Susanto 1998).
Ikan patin akan mengalami siklus hidup yang dimulai dari telur, larva, benih, konsumsi, induk, dan calon induk dalam hidupnya (Anonim 2008). Pada fase awal, telur akan berkembang jika suhu air di sekitarnya berada pada kisaran 26°C sampai dengan 28°C dan perkembangan tersebut berlangsung selama 28 jam. Larva yang baru menetas dari telur masih mendapatkan cadangan makanan dari yolk sac atau kuning telur yang masih menempel pada tubuhnya. Baru kemudian di usia dua sampai tiga hari, larva ikan patin akan mencari makanan sendiri, yakni berupa zat-zat organik. Selain itu, dapat diketahui bahwa derajat hidup larva pada salinitas air yang tinggi jauh lebih tinggi dibandingkan dengan air yang kadar salinitasnya lebih rendah.
Sistem imun bawaan ikan ini terdiri atas penghalang fisik yang akan menahan serangan infeksi, pertahanan humoral, dan sel-sel fagositik. Karena tidak memiliki sisik, penghalang fisik yang ada di permukaan tubuh ikan patin hanyalah kulit dan mukosa (lendir). Pada permukaan kulit terdapat immunoglobulin alami (IgM) yang dapat mencegah infeksi agen patogen. Selain immunoglobulin, kulit juga berfungsi sebagai sistem kekebalan terhadap infeksi yang bersifat fisik. Mukosa selain berfungsi sebagai pelindung fisik juga dapat berfungsi sebagai pelindung kimiawi karena adanya lisozim, komplemen, dan berbagai zat lainnya yang dapat mencegah tumbuhnya mikroorganisme dan mencegah terjadinya
8
infeksi (Irianto 2005). Selain itu, karena sifatnya yang poikiloterm, sistem imun ikan ini juga sangat dipengaruhi oleh suhu. Secara umum, masing-masing ikan memiliki derajat kekebalan yang berbeda yang bergantung pada berbagai faktor di antara umur, jenis kelamin, status nutrien, dan ada tidaknya stres (Ross dan Ross 2008).
Budi Daya Ikan Patin
Menurut Susanto (1999), pemeliharaan ikan dapat dibagi menjadi dua sistem, yaitu sistem keramba dan sistem pemagaran (fence). Untuk sistem pemeliharaan jenis keramba, ikan patin dipelihara dalam sebuah kotak dengan bahan utama jaring apung yang dilengkapi dengan rangka dan pelampung yang memungkinkan alat ini terapung di permukaan air. Untuk sistem pemagaran, ikan patin dipelihara dalam kolam yang di sekelilingnya telah dipasangi pagar (Gambar 4)
Gambar 4. Budi daya ikan patin dengan sistem keramba (kiri) dan fence (kanan) (Anonim 2008)
Selain itu, budi daya ikan patin meliputi tiga jenis kegiatan, yaitu pembenihan, pendederan, dan pembesaran. Kegiatan pembenihan merupakan kegiatan untuk menghasilkan benih dengan ukuran tertentu. Pendederan merupakan kegiatan pemeliharaan ikan patin ukuran tertentu dari hasil pembenihan sebagai transit sebelum dipelihara di tempat pembesaran. Kemudian, pembesaran merupakan suatu kegiatan untuk menghasilkan ikan patin dari hasil pendederan ke ukuran yang siap untuk dikonsumsi masyarakat (Susanto 1998).
Lokasi pembesaran ikan harus memenuhi beberapa kriteria, di antaranya tanah untuk kolam pemeliharaan haruslah jenis tanah liat/lempung dan tidak bersudut sehingga dapat menahan massa air yang besar dan tidak bocor. Kemiringan tanah dibuat berkisar antara 3% sampai 5%. Hal ini bertujuan untuk memudahkan sistem pengairan kolam dengan sistem gravitasi. Namun, apabila pembesaran ikan patin dilakukan dalam jala apung, maka lokasi pemeliharaan yang tepat ialah pada sungai yang memiliki arus lambat. Air yang digunakan juga harus bersih, tidak terlalu keruh, dan tidak mengandung bahan-bahan beracun. Kualitas air juga harus selalu diperhatikan untuk menghindari tumbuhnya parasit atau jamur pada tubuh ikan (Emolin atau Blitzich dengan dosis 0,05 ml/liter). Suhu yang diperlukan untuk penetasan telur berkisar antara 26° sampai 28°C. Jika air yang dipakai bersuhu lebih rendah, maka diperlukan pemanas untuk dapat menghangatkan air. Keasaman air yang dibutuhkan berkisar antara pH 6,5 sampai dengan 7 (Susanto 1999).
Benih yang sudah menetas pada proses pembenihan, dikumpulkan dalam satu wadah beserta air yang bersih di dalamnya. Pemeliharaan benih ini dilakukan selama dua minggu dengan perawatan yang hati-hati. Jika air dalam wadah tersebut sudah kotor, harus diganti kembali dengan air yang bersih dan diusahakan tidak terkena sengatan matahari. Tempat pemeliharaan benih dan pembesaran umumnya berada dalam jarak yang jauh sehingga pemindahan benih harus dilakukan dengan hati-hati agar benih dapat selamat sampai tempat pembesaran. Keberhasilan transportasi benih ikan biasanya sangat erat kaitannya dengan kondisi fisik maupun kimia air, terutama oksigen terlarut, NH3, pH, CO2, dan
suhu air (Susanto 1999).
Ikan patin termasuk ke dalam ikan konsumsi budi daya unggulan yang berprospek cerah dan memiliki nilai jual yang tinggi. Selain karena perawatannya tidak terlalu sulit, ikan ini sangat responsif terhadap pemberian pakan tambahan sehingga pada usia enam bulan, panjang ikan ini dapat mencapai 35 cm hingga 40 cm serta dapat dengan cepat tumbuh besar bahkan dapat mencapai bobot 4,5 kg per ekornya. Keuntungan lain dalam pembudidayaan ikan ini ialah tingkat produksi telur dari seekor indukan betina sangat tinggi, yang dapat mencapai 6000 sampai 9000 butir sehingga jika waktu panen, akan dihasilkan 340 kg sampai 450
10
kg/hektar untuk ikan yang berukuran kecil dan untuk yang berukuran besar akan menghasilkan sekurang-kurangnya 900 kg/hektar dengan pemberian pakan sekitar 3,4% dari bobot badannya (Bardach et al. 1972).
Tranportasi pada Distribusi Ikan Patin
Faktor transportasi pada usaha di bidang perikanan sangat menentukan keberhasilan usaha yang dijalankan. Selama perjalanan pengiriman benih ikan, ketersediaan oksigen serta es batu (sebagai pendingin) sangat diperlukan terutama pada pengangkutan jarak jauh baik melalui transportasi darat maupun trasnportasi udara demi menjaga kualitas dan kesegaran ikan. Suhu air yang rendah (sekitar 20°C) akan membuat oksigen saat pengangkutan lebih sedikit dibutuhkan (Jensen 1990).
Berbeda spesies ikannya maka berbeda pula penanganan yang akan dilakukan, karakter biologis, sensitivitas, dan konsumsi oksigen yang diberikan. Pada pengangkutan benih, kepadatan populasi dalam satu kantong ditentukan oleh ukuran ikan yang diangkut, suhu media air, lamanya waktu pengangkutan, dan kondisi jalan yang akan dilalui. Penggunaan anastesi terkadang diperlukan demi menjaga kondisi kesegaran ikan agar dapat lebih tahan lama. Sediaan anastesi yang umumnya digunakan antara lain tricaine metanosulphonate dengan perbandingan pemberian untuk benih 10 gram untuk 500 liter air dan untuk larva 10 gram untuk 100 liter air (Balai Penelitian Perikanan Air Tawar 1994).
Menurut Balai Penelitian Perikanan Air Tawar (1994), sebelum pengangkutan, benih ikan harus diberok dulu dalam kurun waktu beberapa hari. Perlakuan ini bertujuan untuk mengurangi polutan yang merupakan hasil metabolisme ikan. Tempat pemberokan ialah sebuah bak bersih berukuran 1 m x 1 m x 2 m yang juga berisi air bersih dengan sistem aerasi yang baik. Bak dengan ukuran tersebut mampu menampung sekitar 5000 ekor benih dengan ukuran 3 sampai 5 cm tetapi jumlah benih pemberokan juga harus disesuaikan dengan ukuran benihnya.
Berdasarkan lama dan jarak pengiriman, terdapat dua sistem transportasi benih ikan, yakni sistem transportasi terbuka dan tertutup. Sistem transportasi
jenis tertutup dilakukan untuk distribusi larva, benih, ikan konsumsi, dan induk. Sistem ini biasa digunakan pada pengangkutan jarak jauh yang umumnya memakan waktu 4 sampai 5 jam. Ciri pengemasan dari sistem jenis ini ialah ikan dikemas dan diikat dalam kantong plastik yang sebelumnya telah diisi oksigen yang kadarnya telah ditentukan. Penambahan buffer Na2(HPO)4 juga diperlukan
untuk menjaga kestabilan keasaman air. Pengemasan benih ikan yang diangkut dengan kantong plastik diperlukan beberapa tahap, yaitu pemasukkan dahulu air bersih (air sumur yang telah diaerasi selama 24 jam) ke dalam kantong plastik baru kemudian benih ikan. Udara di dalam kantong plastik dihilangkan dengan cara menekan kantong ke permukaan air. Oksigen dialirkan ke kantong sebanyak 2/3 dari volume keseluruhan rongga (air:oksigen = 1:1). Proses selanjutnya, kantong diikat, dimasukkan ke dalam dus yang berukuran panjang 0,50 m, lebar 0,35 m, dan tinggi 0,50 m. Ukuran dus tersebut hanya dapat diisi oleh 2 buah kantong plastik saja (Balai Penelitian Perikanan Air Tawar 1994).
Kemudian untuk sistem pengangkutan terbuka, ikan ditempatkan dalam suatu wadah seperti akuarium atau keramba dengan volume sampai 15 liter yang airnya selalu diaerasi dengan jumlah benih di dalamnya mencapai 5000 ekor yang ukurannya 3-5 cm. Sistem ini biasa digunakan untuk pengangkutan benih dalam jarak dekat atau tidak memerlukan waktu yang lama. Kedua sistem pengangkutan jenis ini dimodifikasi sedemikian rupa sehingga dihasilkan suatu rasio antara ketersediaan oksigen yang ada dan media air, yaitu 70:30. Tabel 1 dan 2 menyajikan standar kepadatan ikan pada sistem transportasi.
Tabel 1. Standar Kepadatan Ikan (g/L) dengan Sistem Tertutup
Ukuran Ikan Lama (jam)
1 12 24 48
Larva baru menetas (g/L) 120 80 40 10
Benih ¼ inch (g/L) 60 50 40 20
Benih 1 inch (g/L) 120 100 75 40
Benih 2 inch (g/L) 120 105 90 40
Benih 3 inch (g/L) 120 105 90 40
12
Tabel 2. Standar Kepadatan Ikan (g/L) dengan Sistem Terbuka
Ukuran Ikan Lama (jam)
1 2 24 48 Benih ¼ inch (g/L) 120 60 30 30 Benih 1 inch (g/L) 240 180 120 120 Benih 2 inch (g/L) 360 240 120 120 Benih 3 inch (g/L) 360 360 240 180 Induk/konsumsi (g/L) 480 180 360 240
Sumber: Budidaya Ikan Mas (Sucipto 2006)
Beberapa hal yang perlu diperhatikan pada pengemasan ikan dengan kantung plastik ialah tiap kantongnya dibuat rangkap untuk menghindari kebocoran dan kantong ditutup dengan menggunakan karet dengan simpul sederhana. Sebelum dilakukan pengangkutan, benih ikan dipuasakan terlebih dahulu selama 18 jam. Pengangkutan benih ikan patin dapat dilakukan dalam kurun waktu 10 jam dengan tingkat kelangsungan hidup mencapai 98,67%. Jika jarak yang ditempuh memerlukan waktu yang lama, maka satu-satunya cara untuk menjamin agar benih ikan tersebut selamat ialah dengan mengurangi jumlah benih dalam satu kantung plastik. Berdasarkan sebuah penelitian, dapat terbukti bahwa benih patin masih aman diangkut selama 14 jam dengan kepadatan 300 ekor/liter (Froese 1998).
Beberapa hal yang umumnya menjadi masalah utama dalam transportasi ikan antara lain stres, kejutan yang bersifat mekanik, cekaman panas, dan sifat kimia air. Jika dipandang dari sisi sifat kimia air, beberapa aspek yang harus diperhatikan adalah kandungan O2 yang terlarut dalam air, salinitas, kadar CO2,
amonia, dan kandungan bahan padat. Saat awal dilakukannya transportasi, ikan akan membutuhkan O2 yang lebih tinggi dan diusahakan tidak naik selama
transportasi berlangsung. Kadar garam (salinitas) secara tidak langsung juga akan mempengaruhi laju metabolisme ikan dan dapat mengurangi fungsi kerja osmoregulator. Selain itu, kandungan CO2 yang terus terakumulasi dalam air juga
akan menyebabkan stres pada ikan, bahkan dapat berakibat fatal jika kandungannya berlebih (Ross dan Ross 2008).
Menurut Ross dan Ross (2008), kandungan amonia dalam air juga harus selalu diperhatikan. Karena terus diekskresikan melalui insang oleh ikan, amonia
terus-menerus bertambah di dalam air. Laju ekskresi amonia dapat disebabkan oleh beberapa hal antara lain level pemberian pakan, kandungan protein diet, dan temperatur lingkungan. Namun, kandungan amonia dapat dikurangi dengan cara pendinginan dan penundaan pemberian pakan selama transportasi. Pada prinsipnya seluruh aspek yang telah dipaparkan di atas akan mempengaruhi metabolisme ikan dan akan mempengaruhi kondisi fisiologis ikan. Hal ini membuat diperlukannya suatu manajemen untuk menjaga kondisi air agar tetap aman untuk dipakai dan memelihara kualitas air.
Stres pada Ikan
Stres dapat diartikan sebagai suatu keadaan yang ditimbulkan oleh faktor-faktor lingkungan atau faktor-faktor-faktor-faktor lainnya yang mempengaruhi daya penyesuaian diri seekor hewan melebihi batas-batas daya normalnya atau mengganggu fungsi-fungsi normal hewan hingga ke batas harapan untuk dapat bertahan sudah jelas-jelas berkurang (Nabib dan Pasaribu 1989). Stres yang terjadi pada ikan dapat terjadi karena beberapa faktor, di antaranya suhu yang terlalu tinggi atau terlalu rendah, kepadatan ikan dalam kolam yang terlalu tinggi.
Tanda-tanda penyesuaian umum (general adaptation syndrome = GAS) merupakan perubahan-perubahan tubuh yang terjadi akibat adanya tanggapan atau reaksi terhadap adanya stres yang ditimbulkan oleh lingkungan. Suatu stimulus yang dapat menyebabkan stres dikenal dengan sebutan stresor atau faktor stres. Secara umum stresor dapat dikelompokkan menjadi empat golongan, yakni stresor kimiawi (misalnya, kualitas air yang buruk, adanya polusi dan sebagainya), stresor fisik (misalnya, suhu lingkungan yang lebih tinggi atau lebih rendah dan pencahayaan yang berlebihan ataupun kurang), stresor biologis (misalnya, karena mikroba atau parasit), dan stresor prosedural yang biasanya timbul saat penanganan, pengiriman, dan penanganan penyakit (Nabib dan Pasaribu 1989).
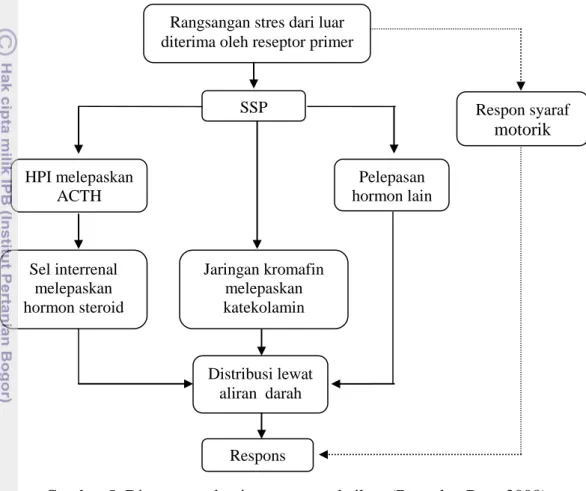
Jika terjadi stres maka tanggapan yang diberikan oleh tubuh ikan merupakan rangkaian reaksi biokimiawi yang berujung pada rangkaian proses hormonal yang dikenal sebagai sindrom adaptif umum yang berpusat pada aktivitas sistem hipotalamik-pituitari interrenal (HPI). Sebagai bentuk usaha ikan untuk menyesuaikan diri terhadap gangguan yang ada maka ikan akan
14
menggunakan seluruh cadangan energi yang ada sehingga dapat bertahan hidup dari gangguan tersebut. Namun, jika gangguan tersebut berlangsung secara terus-menerus, energi cadangan yang ada akan habis sehingga ikan akan lemah dan dapat berakibat ikan menjadi sakit dan akhirnya akan mati. Mekanisme stres pada ikan ditunjukkan oleh diagram di bawah ini.
Gambar 5. Diagram mekanisme stres pada ikan (Ross dan Ross 2008)
Secara umum, mekanisme stres pada ikan hampir sama dengan pada hewan mamalia. Hormon steroid yang dihasilkan oleh kelenjar interrenal terutama adalah hormon kortisol. Hormon ini berperan untuk memobilisasi glukosa dari jaringan adiposa, yang akan digunakan sebagai sumber energi untuk respons stres. Sementara itu, katekolamin (epinefrin dan norepinefrin) dapat menaikkan laju metabolisme tubuh sehingga saat stres laju metabolisme ikan akan naik. Stres pada ikan dapat berakibat pada kondisi eksternal maupun internal. Secara eksternal, ikan akan mengalami kegagalan koordinasi otot, tachyventilation, serta perubahan warna kulit luar (dapat lebih gelap atau lebih terang), sedangkan secara
Rangsangan stres dari luar diterima oleh reseptor primer
SSP HPI melepaskan ACTH Pelepasan hormon lain Respon syaraf motorik Jaringan kromafin melepaskan katekolamin Sel interrenal melepaskan hormon steroid Distribusi lewat aliran darah Respons
internal, efek stres akan mempengaruhi laju denyut jantung, hormonal, dan haematologi (Ross dan Ross 2008).
Menurut Irianto (2005), stres yang dialami oleh ikan dapat berakibat pada berkurangnya faktor pelindung alami yang dimiliki oleh ikan, misalnya mukus, sisik, kulit, lisozim, dan antibodi. Stres akan berpengaruh pada kerusakan struktur kimiawi mukus sehingga terjadi penurunan fungsi mukus (lendir) tersebut untuk melindungi inang. Stres yang bersifat fisik juga dapat terjadi saat dilakukan penanganan, seperti saat pemindahan ikan atau transportasi sehingga dapat menyebabkan hilangnya mukosa (lapis lendir) sama sekali. Selain itu, timbulnya kebisingan dan getaran dari alat transportasi tidak jarang dapat membuat ikan menjadi stres.
Temperatur mempengaruhi seluruh aspek metabolisme dan semakin tinggi suhu lingkungan sekitar maka laju metabolisme ikan akan semakin tinggi sehingga saat ditransportasikan, suhu lingkungan diusahakan tidak lebih besar dari suhu awal (Ross dan Ross 2008). Jika laju metabolisme tinggi, maka hal tersebut dapat membuat hasil buangan dari proses metabolisme bertambah dan dapat mencemari lingkungan. Semua stres yang terjadi dapat dicegah dengan selalu menjaga kualitas air, sanitasi, serta pakan yang baik (Irianto 2005). Manajemen perikanan budi daya juga harus dirancang sedemikian rupa untuk dapat mengurangi stres yang dapat terjadi sehingga tingkat kematian ikan dapat dikurangi.
Transquilizer
Ikan merupakan salah satu hewan yang mudah stres terutama karena penanganan ataupun pengangkutan sehingga dapat mengakibatkan penekanan kekebalan tubuh, luka fisik, bahkan kematian. Oleh karena itu, untuk memperkecil adanya perlukaan saat transportasi dan reduksi metabolisme, pemberian sediaan penenang pada benih ikan dianjurkan. Salah satu jenis sediaan penenang yang dapat digunakan ialah transquilizer. Secara umum, transquilizer diklasifikasikan sebagai transquilizer mayor dan minor. Transquilizer mayor memiliki efek pereda emosi dan relaksasi mental serta sangat efektif dalam mengontrol gejala baik yang bersifat akut maupun kronis pada penderita penyakit psychotic seperti
16
schizophrenia. Kelompok phenotiazine merupakan jenis dari transquilizer mayor. Beberapa contoh sediaannya yaitu acepromazine dan chlorpromazine. Transquilizer minor juga memiliki efek menenangkan dan relaksasi yang dapat membuat pemakai tertidur tetapi kualitasnya tidak sama dengan jenis transquilizer mayor. Umumnya sediaan ini digunakan untuk mengobati kelainan mental seperti depresi dan tekanan syaraf. Efek dari jenis sediaan ini juga bergantung pada dosis dan keadaan fisiologis pemakai. Beberapa contoh jenis sediaan yang tergolong dalam transquilizer minor ialah kelompok benzodiazepine, yang terdiri atas diazepam, lorazepam, dan lain-lain. Kedua jenis sediaan ini memiliki target pada sistem saraf pusat (Plumb 2008).
Menurut Coyle (2004), terdapat empat tahap anastesi ikan. Pada tahap pertama, pergerakan dan pernapasan ikan mulai berkurang. Hilangnya sedikit keseimbangan tetapi masih reaktif terhadap adanya rangsangan, gejala ini terjadi pada tahap kedua (anastesi ringan). Kemudian pada tahap ketiga, tercapai kondisi anastesi operasi, yaitu ketika keseimbangan tubuh ikan telah hilang seluruhnya dan tidak adanya respons terhadap rangsangan. Pada tahap keempat, pernapasan dan denyut jantung berhenti, jika terjadi overdosis karena anastesi yang terlalu dalam, dapat mengakibatkan kematian
Menurut Bowser (2001), terdapat enam tahap anastesi pada ikan yang diketahui. Pertama adalah sedasi ringan. Pada tahap ini terjadi hilangnya sedikit kereaktifan pada stimuli eksternal tetapi keseimbangan masih dapat dikatakan normal. Tahap kedua adalah terjadi sedasi yang dalam. Pada tahap ini ikan telah kehilangan seluruh reaktivitas terhadap stimuli eksternal. Pada tahap ketiga, terjadi kehilangan sebagian keseimbangan tubuh yang ditandai dengan hilangnya sebagian tonus otot, cara berenang sudah tidak normal, dan hanya akan bereaksi terhadap sentuhan yang kuat dan rangsangan getaran.
Pada tahap yang keempat, terjadi kehilangan keseimbangan secara total karena telah kehilangan seluruh tonus otot, kecepatan ventilasi operkuler yang sangat cepat dan hanya akan bereaksi terhadap tekanan stimulus yang dalam. Lalu, pada tahap kelima terjadi hilangnya refleks secara total, pergerakan operkuler menjadi sangat lambat. Kemudian pada tahap keenam, terjadi medullary
collapse yang ditandai dengan pergerakan operkuler yang terhenti dan berhentinya
denyut jantung.
Penentuan ikan yang sudah teranastesi, sulit dilakukan sehingga perlu pengamatan secara visual dengan teliti. Salah satu hal yang dapat digunakan sebagai indikator keadaan tersebut ialah perubahan pada pernapasan. Apabila gejala ini muncul, maka ikan harus segera dipindahkan atau tahapan anastesi selanjutnya akan segera berlanjut. Selain itu, penentuan waktu anastesi juga dapat dilakukan dengan pengamatan terhadap cara berenang ikan/benih ikan. Jika terlihat sudah tidak normal bahkan menjadi inaktif dan tenggelam di dasar wadah, benih ikan tersebut juga harus dipindahkan (Treves-Brown 2000).
Tahapan setelah anastesi juga disebut dengan tahap recovery atau tahap pemulihan. Pada tahap ini, terjadi pemulihan ikan yang tadinya teranastesi menjadi normal kembali. Lamanya periode ini dapat bervariasi mulai dari beberapa detik sampai menit bahkan jam, bergantung pada cara pemberian sediaan yang digunakan, spesies ikan, dan jenis sediaannya. Ciri mencolok yang terjadi adalah kembalinya respons terhadap suara dan stimuli sensoris.
Menurut Ferguson (1988), beberapa faktor yang dapat mempengaruhi onset anastesi antara lain spesies, kualitas air, dan status umum kesehatan ikan. Spesies ikan yang berbeda juga akan menunjukkan respons yang juga berbeda. Selain itu, perbedaan spesies ikan juga menentukan perbedaaan rasio bobot badan dan perbedaan insang yang dimiliki sehingga untuk spesies ikan yang memiliki insang yang lebih luas, proses penyerapan sediaan anastetikumnya juga akan lebih efisien.
Faktor lain yang juga ikut mempengaruhi onset ialah kualitas air yang meliputi suhu air, kadar garam atau salinitas, dan pH. Suhu air merupakan faktor utama tetapi tidak ada contoh yang dapat membuktikan pernyataan tersebut dan faktor tersebut juga bergantung pada penggunaan obat dan juga sediaan obat yang digunakan. Sebagai contoh, sediaan tricaine methanesulphonate diperlukan dalam dosis yang besar dan suhu yang tinggi. Salinitas juga terkadang ikut mempengaruhi. Sebagian besar zat anastetikum bekerja baik pada air laut (kadar garam tinggi) tetapi beberapa sediaan bekerja baik pada air tawar. Selain itu, pH
18
juga akan mempengaruhi ionisasi sediaan. Kesehatan ikan secara umum juga ikut mempengaruhi, ikan yang sedang tidak sehat merupakan objek yang tidak baik untuk proses anastesi, terutama untuk penyakit insang dan kulit (Ross dan Ross 2008).
Acepromazine (ACP)
Transquilizer merupakan salah satu jenis sediaan obat yang ada dalam dunia farmasi. Umumnya kelompok obat ini bekerja pada susunan saraf pusat dan memberikan rasa menenangkan pada pemakai. Dalam dosis yang sesuai, preparat obat ini berfungsi sebagai premedikasi dan restrain. Namun, pada pemakaian dosis yang berlebihan, dapat menimbulkan efek hipnotis, menginduksi penurunan kondisi fisiologis tubuh dan memfasilitasi terjadinya onset tidur seekor hewan (Einstein 1994).
Salah satu jenis obat yang biasa digunakan sebagai preparat sedatif ialah acepromazine. Acepromazine atau acetylpromazine merupakan derivat dari phenothiazine dengan struktur kimia [10-[3-(dimethylamino) propyl] phenothiazin-2-yl-methyl ketone] dan memiliki bentuk asal, yaitu maleate (garam), kristal solid, berwarna kuning, dan memiliki rasa tawar. Seperti kelompok sedatif jenis phenotiazine lainnya, jika terpapar walaupun pada dosis kecil, akan langsung mempengaruhi kelakuan si pengguna. Sedasi ini dapat dengan cepat mencapai puncaknya tetapi hanya sedasi dalam jangka panjang saja yang dapat menimbulkan efek samping (Katzung 1998). Efek obat ini sangat bervariasi, bergantung pada jenis sediaan. Acepromazine merupakan salah satu jenis sediaan sedatif yang paling banyak digunakan dalam dunia kedokteran hewan, terutama di hewan jenis kuda, anjing, dan kucing (Einstein 1994).
Mekanisme kerja kelompok phenotiazine itu sendiri ialah dengan menghambat reseptor pusat dopamin. Dopamin merupakan salah satu neurotransmiter jenis monoamine yang juga dapat berperan sebagai hormon (Katzung 1998). Sebagai hormon, dopamin menghambat pelepasan hormon prolaktin. Selain itu, dopamin juga merupakan prekursor pada pembentukan norepinefrin dan epinefrin (Adams 2008).
Menurut Wanamaker (2000), efek yang dapat terjadi pada semua jenis makhluk hidup karena sediaan acepromazine ini ialah dapat menyebabkan tekanan darah menjadi lebih rendah karena terjadinya vasodilatasi pembuluh darah akibat reseptor α1 adrenoreseptor. Selain itu memiliki efek sedatif, sediaan ini juga memiliki efek lain yang terdiri atas, antiemetik, antiarritmia, antihistamin, tetapi sediaan ini tidak memiliki efek analgesik. Sediaan ini akan dimetabolisme di dalam hati, menghasilkan metabolit conjugated dan non-conjugated, yang akan diekskresikan dalam urine. Mekanisme obat ini sendiri sama seperti mekanisme phenotiazine tetapi preparat obat ini lebih memiliki potensi dibandingkan jenis obat lain dalam kelompok phenotiazine. Selain itu, sediaan ini memiliki efek depresan terhadap SSP sehingga menimbulkan efek sedasi, relaksasi otot, dan reduksi dari aktivitas yang bersifat spontan. Reaksinya berjalan dengan sangat cepat dalam menimbulkan efek sedasi (Forney 2004).
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Mei sampai dengan Agustus tahun 2009. Lokasi penelitian bertempat di Rumah Ikan yang terdapat di Kompleks Dramaga Pratama, Ciampea, Bogor.
Alat dan Bahan
Alat yang digunakan dalam penelitian ini antara lain akuarium, spuid 1 ml, gelas plastik, sendok untuk memindahkan ikan, gelas ukur 50 ml, saringan ikan, dan baskom. Bahan-bahan yang digunakan pada penelitian ini, antara lain ikan patin sebanyak 600 ekor yang berumur 3 minggu, memiliki panjang sekitar 5,08 cm, dan berat sekitar 6 g, sediaan acepromazine 20%, dan air mineral.
Tahap Persiapan
Sebelum penelitian dimulai, ikan diaklimatisasikan terlebih dahulu di dalam akuarium selama satu bulan. Hal ini bertujuan agar ikan-ikan tersebut dapat menyesuaikan diri dengan lingkungannya dan untuk memperkecil terjadinya kematian akibat faktor lingkungan. Selain itu, proses aklimatisasi juga akan dilakukan saat proses pemindahan ikan dari akuarium ke gelas plastik, dengan lama waktu aklimatisasi ialah 5 menit. Tujuannya juga sama seperti aklimatisasi di akuarium tadi, yaitu agar ikan-ikan dapat menyesuaikan diri pada lingkungan baru.
Rancangan Percobaan
Rancangan percobaan yang digunakan dalam penelitian ini ialah rancangan acak lengkap (RAL) dengan pola faktorial berukuran 2x6. Perlakuan terdiri atas enam kelompok dosis acepromazine. Masing-masing kelompok tersebut direplikasi sebanyak lima kali dalam gelas yang berbeda. Percobaan dilakukan pada dua waktu yang berbeda, yaitu pagi dan siang hari dan direplikasi sebanyak dua kali. Rancangan perlakuan yang digunakan pada penelitian ini dapat dilihat pada Tabel 3.
Tabel 3. Rancangan perlakuan pada percobaan Dosis acepromazine (ppm) Waktu perendaman Pagi (suhu 26°-28°C) Siang (suhu 28°-31°C) 0 2 kali pengulangan 2 kali pengulangan 5 2 kali pengulangan 2 kali pengulangan 15 2 kali pengulangan 2 kali pengulangan 25 2 kali pengulangan 2 kali pengulangan 35 2 kali pengulangan 2 kali pengulangan 45 2 kali pengulangan 2 kali pengulangan
Tahap Perlakuan
Pertama-tama, ikan diambil dari dalam akuarium dalam jumlah yang secukupnya dengan menggunakan saringan dan dipindahkan ke dalam baskom berisi air bersih. Kemudian dilanjutkan dengan penyusunan wadah (30 gelas plastik untuk tempat perendaman ikan dan 25 gelas lainnya untuk tempat
recovery) dan pengisian air ke dalam wadah sebanyak 100 ml.
Masing-masing gelas plastik tersebut dimasukkan ikan patin sebanyak 5 ekor dengan menggunakan sendok plastik kecuali dalam gelas plastik untuk pemulihan (recovery). Selanjutnya dilakukan pemberian preparat acepromazine 20% sesuai dengan perlakuan dengan menggunakan spuid 1 ml. Sebelum disemprotkan ke dalam wadah, spuid diaspirasi terlebih dahulu dengan menggunakan air pada media perendaman, baru disemprotkan ke dalam wadah. Pengamatan dilakukan terhadap ikan-ikan yang telah menunjukkan gejala anastesi untuk menentukan onset. Setelah terlihat ikan yang teranastesi, maka ikan tersebut secepatnya dipindahkan ke dalam gelas plastik yang berisi air mineral segar untuk proses pemulihan. Tahap pemindahan ini dilakukan untuk mengetahui durasi dari sediaan acepromazine dengan berbagai dosis yang digunakan.
22
Parameter yang diamati
Parameter yang diamati dalam penelitian ini ialah onset dan durasi anastesi pada ikan patin dengan metode perendaman (dipping). Selain itu, juga diamati tingkat keamanan (tingkat kematian pada ikan patin) dan tahapan anastesi acepromazine. Onset dapat ditentukan dari rentang waktu dimulainya ikan diberi sediaan acepromazine sampai dengan teranastesi. Durasi dapat ditentukan dari lamanya ikan teranastesi sampai dengan sadar kembali. Untuk tingkat kematian dapat pula ditentukan dari banyaknya ikan yang mati setelah dipindahkan pada gelas pemulihan.
Analisis Data
Data-data yang diperoleh, baik onset, durasi, maupun tingkat kematian, dianalisis dengan metode ANOVA (Analysis of Varian) yang dilanjutkan dengan uji Duncan untuk melihat perbedaan pada setiap kelompok perlakuan.
Sebelum dilakukan perendaman pada larutan acepromazine, dilakukan pengamatan terlebih dahulu terhadap kondisi fisiologis normal ikan patin agar dapat dibedakan antara ikan patin yang telah teranastesi dengan yang belum teranastesi. Umumnya dalam kondisi normal, ikan ini berenang dengan cepat, selalu berputar mengitari wadah atau akuarium dan sangat responsif terhadap adanya rangsangan dari luar. Selain itu, seluruh sirip yang terdapat di badannya bergerak dengan aktif karena bertindak sebagai motor penggerak tubuh. Walaupun bergerak dengan sangat cepat, keseimbangan tubuhnya (equilibrium) juga terlihat normal, tidak miring ke kanan ataupun ke kiri. Berikut ini diberikan gambar ikan patin yang berada dalam kondisi fisiologis normal (Gambar 5).
Gambar 6. Ikan patin dalam kondisi normal (Dokumentasi pribadi 2009)
Percobaan yang dilakukan terutama ditujukan untuk mengetahui lamanya onset, durasi, serta tingkat kematian ikan setelah ikan direndam (dipping) dalam larutan acepromazine dengan dosis yang berbeda.
Onset
Onset (onset of action) merupakan rentang waktu setelah suatu obat diadministrasikan sampai efeknya terlihat sehingga menurut Mckelvey dan Wayne (2003), onset anastetikum dapat diartikan lamanya hewan sampai kehilangan status kesadarannya. Pengujian dengan metode ANOVA terhadap onset yang disajikan pada Lampiran 2, menunjukkan bahwa hipotesis H0 diterima
24
dan H1 ditolak, yang membuktikan bahwa terdapat beberapa faktor yang mempengaruhi onset, yaitu waktu perendaman dan dosis acepromazine. Hal ini dapat disebabkan terdapat perbedaan yang nyata dengan nilai signifikansi keduanya lebih kecil dari 0,05 (p < 0,05). Namun, ternyata tidak ditemukan pengaruh interaksi antara waktu perendaman dan dosis acepromazine terhadap lamanya onset. Hal ini disebabkan hasil analisis statistiknya yang tidak berbeda nyata (p > 0,05). Oleh karena itu, dapat dikatakan bahwa waktu perendaman dan dosis acepromazine tidak berhubungan satu sama lain. Rata-rata nilai onset pada waktu perendaman siang lebih singkat (21,21 menit) dibandingkan dengan waktu perendaman pagi (87,76 menit). Sementara itu, kontrol (dosis acepromazine 0 ppm) tidak menunjukkan gejala anastesi (Gambar 6).
Gambar 7. Lamanya onset anastesi pada berbagai tingkatan dosis acepromazine dengan waktu perendaman pagi dan siang hari
Perbedaan lama onset pada kedua waktu perendaman kemungkinan berkaitan dengan suhu lingkungan yang secara tidak langsung mempengaruhi suhu air. Suhu lingkungan saat perlakuan pagi hari berkisar antara 26°C sampai dengan 28°C, sedangkan saat siang hari mencapai 28°C hingga 31°C. Menurut Velisek et al. (2007), semakin tinggi suhu maka semakin efektif pula proses anastesi oleh suatu sediaan. Hal ini dipertegas oleh Ross dan Ross (2008), yang menyatakan bahwa suhu mempengaruhi seluruh aspek pada proses metabolisme.
0 10 20 30 40 50 60 70 80 90 100 0 5 15 25 35 45 Tidak terhingga O ns e t (m e ni t) Dosis (ppm) Pagi Siang
Semakin tinggi suhu, maka laju metabolisme akan semakin meningkat. Hal ini akan menyebabkan konsumsi oksigen ikan meningkat. Saat ikan mengambil oksigen dari dalam air, maka secara tidak langsung molekul-molekul acepromazine yang terlarut dalam air juga akan terserap melalui insang. Semakin banyak ikan mengambil oksigen, maka semakin banyak pula sediaan acepromazine yang terserap. Hal inilah yang menyebabkan waktu perendaman siang lebih pendek dibandingkan dengan waktu perendaman pagi.
Gambar 8. Lamanya onset anastesi pada berbagai tingkatan dosis acepromazine tanpa memperhatikan waktu perendaman
Dari hasil uji lanjut didapatkan bahwa peningkatan dosis acepromazine dari 5 ppm sampai dengan 35 ppm tidak mempengaruhi lama onset. Lama onset secara drastis menurun pada pemberian dosis acepromazine 45 ppm. Onset tersingkat terjadi pada dosis acepromazine terbesar, yaitu 45 ppm dengan lama onset 38,6 menit dan onset terpanjang terjadi pada dosis terendah dengan lama onset 59,1 menit. Oleh karena itu, dapat dikatakan bahwa semakin tinggi dosis acepromazine yang digunakan, maka lama onset akan semakin singkat. Berdasarkan hasil tersebut, maka diperlukan minimal waktu selama 38 menit sebelum kegiatan transportasi dilaksanakan.
Menurut Katzung (1998), onset suatu sediaan obat akan lebih cepat jika dosis yang digunakan semakin besar karena konsentrasi molekul-molekul obat
0 10 20 30 40 50 60 0 5 15 25 35 45 tidak terhingga 59,1b 59,0b 58,3b 57,4b 38,6a O ns e t (m e ni t) Dosis (ppm)
26
yang terkandung dalam media juga semakin banyak sehingga memudahkan molekul obat tersebut untuk bekerja pada tempatnya di dalam tubuh. Selain melalui insang, sediaan juga dapat terabsorpsi melalui kulit melalui pori-pori yang terdapat di kulitnya. Soto dan Burhanudin (1995) menambahkan, beberapa faktor yang dapat mempengaruhi efektivitas dari suatu zat anastetikum di antaranya termasuk konsentrasi dari zat anastetikum, temperatur air yang digunakan, ukuran ikan, kondisi fisiologis, dan spesiesnya. Pada penelitian yang telah dilakukan, beberapa indikator untuk menentukan onset, antara lain kesadaran, refleks, keseimbangan, tonus otot, dan rasa nyeri. Indikator-indikator tersebut dapat diketahui dengan melihat reaksi ikan saat dilakukan pemberian sedikit rangsangan.
Awalnya ikan kehilangan tonus otot. Hal ini dibuktikan dengan gerakan sirip bagian belakang yang mulai pelan. Setelah tonus otot hilang seluruhnya, ikan akan kehilangan keseimbangannya (equilibrium) sehingga sulit untuk memposisikan tubuhnya dengan benar di air. Posisi tubuh ikan biasanya akan terbalik atau dalam posisi miring. Hal ini menyebabkan ikan akan menjadi inaktif dan tenggelam ke dalam dasar wadah. Saat keadaan tersebut terjadi, ikan telah masuk ke dalam tahap ketiga tahap anastesi dan harus segera dipindahkan ke wadah yang berisi air mineral segar untuk proses pemulihan. Jika terlambat sedikit saja, proses anastesi langsung dapat melaju ke tahap keempat, dimana pada tahap tersebut dapat terjadi kematian pada ikan. Selain keseimbangan, pengamatan dapat juga dilakukan pada respons ikan terhadap stimulus yang diberikan.
Saat ikan telah kehilangan keseimbangan seluruhnya, respons ikan terhadap stimulus juga tidak akan ada. Hal ini disebabkan ikan telah masuk pada tahap anastesi ketiga dimana saat itu keseimbangan telah hilang sama sekali, dan respons terhadap adanya rangsangan telah hilang. Pengamatan terhadap ikan yang tenggelam harus benar-benar dilakukan karena bisa saja ikan yang tenggelam merupakan ikan yang mati. Perbedaannya dari kedua ikan tersebut ialah gerakan insangnya. Jika insang terlihat masih bergerak maka dapat dikatakan bahwa ikan tersebut adalah ikan yang teranastesi secara total yang masih bernapas.
Selanjutnya benih ikan patin yang telah teranastesi secara total ditampilkan pada Gambar 9.
Gambar 9. Ikan yang telah teranastesi secara total (kehilangan keseimbangan tubuh dan tonus otot) (Dokumentasi pribadi 2009)
Menurut Treves-Brown (1999), karena penentuan anastesi ikan sulit, maka dilakukan pengamatan terhadap pernapasannya sebagai suatu indikator. Namun, dikarenakan ukuran ikan patin yang digunakan dalam penelitian ini cukup kecil (sekitar 5 cm) sehingga pernapasannya sulit untuk diamati, maka penentuan dilakukan dengan pengamatan terhadap cara berenang ikan.
Air yang digunakan dalam penelitian ini berasal dari sumber yang sama dengan standar yang telah diakui, tetapi karena dilakukan dalam waktu yang berbeda maka hasil onset yang didapat juga berbeda. Selain itu, tujuan digunakannya media tersebut ialah untuk memperkecil pengaruh media air terhadap ikan sehingga tidak mempengaruhi hasil. Selain itu, sifat suatu sediaan anastetikum juga bergantung pada kelarutannya dalam lemak, ikatan dengan protein, pKa, difusi pada jaringan, dan efek vasodilatasi.
Durasi
Selain onset, lamanya durasi juga telah diketahui melalui penelitian ini. Pengertian durasi itu sendiri ialah keadaan lamanya hewan teranastesi sampai menunjukkan tanda-tanda kesadaran kembali (recovery). Stadium pemulihan ini dimulai ketika stadium anastesi berakhir dan konsentrasi zat anastetikum yang terdapat di otak berkurang (McKelver dan Wayne 2003).
28
Hasil pengujian durasi dengan menggunakan metode ANOVA yang disajikan pada Lampiran 3, menunjukkan bahwa hipotesis H0 diterima dan H1 ditolak. Hal ini membuktikan bahwa terdapat faktor yang mempengaruhi lamanya durasi, yaitu waktu perendaman. Hal ini dapat disebabkan hasil yang didapat berbeda nyata (p < 0,05). Namun, interaksi antara dosis acepromazine dan waktu perendaman tidak mempengaruhi lamanya durasi karena hasilnya tidak berbeda nyata (p > 0,05). Perendaman pada pagi hari memberikan durasi anastesi yang lebih lama dibandingkan dengan perendaman pada siang hari. Rata-rata lama durasi anastesi pada waktu pagi hari ialah 72,98 menit, sedangkan untuk rata-rata lama durasi pada waktu perendaman siang hari hanya mencapai 55,18 menit. Oleh karena itu, untuk keperluan transportasi jarak jauh yang memakan waktu lebih dari satu jam, waktu pagi hari lebih efektif dibandingkan siang hari dengan berbagai tingkatan dosis acepromazine. Hal ini disebabkan lama onset yang akan dihasilkan tidak begitu berbeda. Sementara itu, kontrol menunjukkan rataan durasi sebesar 0 menit karena ikan patin tidak mengalami penambahan sediaan acepromazine, hanya direndam pada air mineral saja.
Salah satu faktor yang mempengaruhi lama durasi ialah lamanya waktu onset. Pada Gambar 10 dapat dilihat bahwa lama onset pada perlakuan pagi hari lebih panjang dibandingkan siang hari sehingga molekul-molekul sediaan acepromazine lebih banyak pula yang masuk ke dalam tubuh ikan patin. Hal ini menyebabkan proses farmakokinetik acepromazine dalam tubuh lebih panjang. Selain itu, ikan merupakan salah satu jenis hewan yang berdarah dingin yang laju metabolisme tubuhnya ditentukan oleh temperatur lingkungan sehingga semakin tinggi suhu lingkungan, semakin tinggi pula laju metabolisme tubuh. Hal inilah yang membuat durasi pada waktu perendaman siang hari lebih pendek, karena laju metabolisme acepromazine dalam tubuh ikan patin yang juga lebih cepat. Kenaikan laju metabolisme secara tidak langsung juga akan menaikkan konsumsi O2, produksi amonia, dan produksi CO2 serta juga akan mempercepat laju
detoksifikasi sediaan ini oleh hati sehingga efek anastesi dapat cepat hilang (Swann 1993).
Gambar 10. Lamanya durasi anastesi pada berbagai tingkatan dosis acepromazine dengan waktu perendaman pagi dan siang hari
Tingginya suhu lingkungan sekitar juga akan mempengaruhi suhu air yang dipakai sehingga juga akan ikut berpengaruh pada sistem imun ikan (Irianto 2005). Kekebalan tubuh ikan menjadi menurun, memperlemah sistem tubuh untuk dapat mendetoksifikasi zat yang ada. Namun, penurunan suhu air juga dapat mengakibatkan stres pada ikan sehingga penentuan suhu air sesuai dengan habitat ikan juga merupakan salah satu faktor yang menentukan keberhasilan dalam anastesi.
Menurut Treeves-Brown 1999, molekul-molekul sediaan acepromazine yang telah terabsorpsi ke dalam tubuh melalui insang dan kulit, akan terakumulasi di daerah lapisan lemak. Semakin banyak lemak yang terkandung dalam tubuh ikan maka semakin banyak pula sediaan acepromazine yang terakumulasi. Selanjutnya, molekul-molekul acepromazine oleh aliran darah akan dibawa ke susunan saraf pusat, yaitu otak dan medulla spinalis (sistem saraf pusat atau SSP). Acepromazine akan memblokir reseptor dopamin post-synaptic dan menghambat pelepasan dopamin. Akibatnya terjadi penghambatan produksi hormon epinefrin dan norepinefrin pada jaringan kromafin sehingga respon stres tidak muncul pada ikan. Hal ini menyebabkan tertekannya SSP sehingga menimbulkan efek sedasi, relaksasi otot, dan juga menurunkan kegiatan-kegiatan yang bersifat spontan, misalnya refleks terhadap adanya rangsangan dari luar.
0 10 20 30 40 50 60 70 80 90 0 5 15 25 35 45 Duras i (m e ni t) Dosis (ppm) Pagi Siang
30
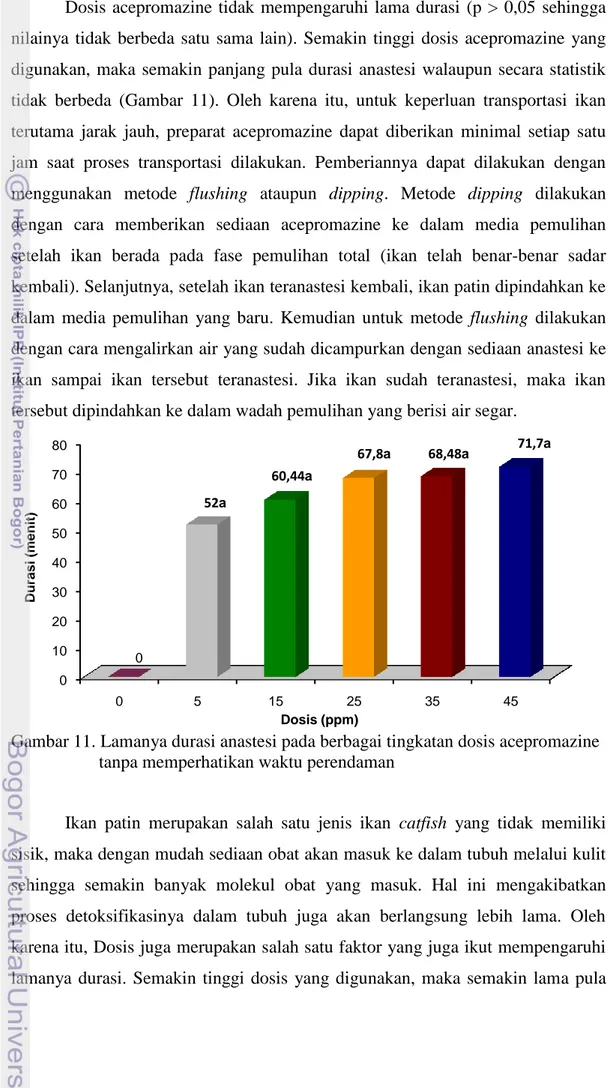
Dosis acepromazine tidak mempengaruhi lama durasi (p > 0,05 sehingga nilainya tidak berbeda satu sama lain). Semakin tinggi dosis acepromazine yang digunakan, maka semakin panjang pula durasi anastesi walaupun secara statistik tidak berbeda (Gambar 11). Oleh karena itu, untuk keperluan transportasi ikan terutama jarak jauh, preparat acepromazine dapat diberikan minimal setiap satu jam saat proses transportasi dilakukan. Pemberiannya dapat dilakukan dengan menggunakan metode flushing ataupun dipping. Metode dipping dilakukan dengan cara memberikan sediaan acepromazine ke dalam media pemulihan setelah ikan berada pada fase pemulihan total (ikan telah benar-benar sadar kembali). Selanjutnya, setelah ikan teranastesi kembali, ikan patin dipindahkan ke dalam media pemulihan yang baru. Kemudian untuk metode flushing dilakukan dengan cara mengalirkan air yang sudah dicampurkan dengan sediaan anastesi ke ikan sampai ikan tersebut teranastesi. Jika ikan sudah teranastesi, maka ikan tersebut dipindahkan ke dalam wadah pemulihan yang berisi air segar.
Gambar 11. Lamanya durasi anastesi pada berbagai tingkatan dosis acepromazine tanpa memperhatikan waktu perendaman
Ikan patin merupakan salah satu jenis ikan catfish yang tidak memiliki sisik, maka dengan mudah sediaan obat akan masuk ke dalam tubuh melalui kulit sehingga semakin banyak molekul obat yang masuk. Hal ini mengakibatkan proses detoksifikasinya dalam tubuh juga akan berlangsung lebih lama. Oleh karena itu, Dosis juga merupakan salah satu faktor yang juga ikut mempengaruhi lamanya durasi. Semakin tinggi dosis yang digunakan, maka semakin lama pula
0 10 20 30 40 50 60 70 80 0 5 15 25 35 45 0 52a 60,44a 67,8a 68,48a 71,7a Duras i (m e ni t) Dosis (ppm)
proses detoksifikasi dalam tubuh. Lamanya durasi ini juga dipengaruhi oleh cara pemberian, spesies ikan itu sendiri, dan jenis sediaan yang digunakan. Spesies ikan juga memiliki mekanisme detoksifikasi yang berbeda-beda pula di dalam tubuh (Ross dan Ross 2008). Begitu juga dengan jenis sediaan yang digunakan, misalnya saja pada penelitian ini digunakan sediaan acepromazine yang merupakan salah satu golongan sediaan yang bersifat long acting sehingga proses eliminasi sediaan anastetikum ini berlangsung lama dalam tubuh. Pada hewan mamalia, efek dari obat ini masih terlihat selama 48 jam (Plumb 2008).
Sama seperti pada penentuan waktu onset, durasi juga ditentukan dari beberapa indikator, antara lain kesadaran, refleks, keseimbangan, tonus otot, dan rasa nyeri. Selama pengamatan, umumnya yang akan muncul indikator terlebih dahulu ialah tonus otot. Munculnya kembali tonus otot dapat dilihat dari gerakan pada sirip belakang ikan. Awalnya ikan yang telah sadar kembali, tetapi belum sepenuhnya, akan berenang dari dasar wadah dan bergerak berputar mengitari wadah dengan kecepatan yang relatif lamban. Namun, karena ikan patin termasuk ke dalam ikan yang memiliki pergerakan yang cepat, maka kecepatan renangnya juga semakin lama akan semakin bertambah seiring dengan pulihnya kesadaran ikan. Saat ikan teranastesi, pergerakan sirip belakang dan sirip dada masih dapat terlihat. Setelah tonus otot telah muncul, barulah satu-persatu indikator lainnya bermunculan kembali. Hal ini dapat diketahui dari adanya respon dari ikan terhadap rangsangan yang diberikan. Penentuan kesadaran ikan juga dapat dilakukan dengan membandingkannya dengan ikan patin yang normal (kontrol).
Tingkat Kematian
Setiap pemakaian sediaan farmakologik baik itu obat, transquilizer, maupun anastetikum dapat menimbulkan efek negatif bagi si pemakai karena selain memiliki efek yang menguntungkan, sediaan-sediaan tersebut juga memiliki efek samping yang merugikan kesehatan. Bahkan jika digunakan dalam dosis yang berlebihan, sediaan ini dapat menimbulkan kematian meskipun ada faktor lain yang ikut mempengaruhi. Pada penelitian ini telah digunakan senyawa acepromazine. Tujuan penggunaan senyawa ini ialah sebagai penenang tetapi
32
tidak dapat dimungkiri bahwa senyawa ini dapat menimbulkan tingkat kematian yang cukup tinggi.
Hasil pengolahan data tingkat kematian dengan menggunakan metode ANOVA yang disajikan pada Lampiran 4, menunjukkan bahwa H0 diterima dan H1 ditolak karena hasilnya yang berbeda nyata (p < 0,05). Hal ini mengindikasikan bahwa terdapat faktor yang mempengaruhi besarnya tingkat kematian pada benih ikan patin yaitu dosis acepromazine, terbukti pada dosis acepromazine 45 ppm secara drastis menaikkan tingkat kematian ikan patin (Gambar 11). Sebaliknya, waktu perendaman pagi dan siang hari tidak mempengaruhi tingkat kematian ikan patin begitu pula dengan pengaruh dari interaksi antara keduanya. Hal ini disebabkan pada hasil analisis statistika keduanya menunjukkan tidak adanya perbedaan yang nyata (p > 0,05). Tingkat kematian terbesar terjadi pada dosis 45 ppm, yaitu sebesar 39%. Untuk tingkat kematian terkecil terjadi pada dosis 5 ppm, yaitu sebesar 6%. Menurut Velisek et
al. (2007), suatu sediaan obat dapat dikatakan aman jika tingkat kematian ikan
yang ditimbulkan ialah maksimal sebesar 20%. Dosis 35 ppm merupakan batas aman penggunaan acepromazine sebagai sediaan anastesi pada ikan karena pada dosis 45 ppm, tingkat kematian ikan yang terjadi sudah melebihi 20%.
Gambar 12. Besarnya tingkat kematian ikan patin pada berbagai tingkatan dosis acepromazine tanpa memperhatikan waktu perendaman
0 5 10 15 20 25 30 35 40 0 5 15 25 35 45 0 6a 11a 11a 13 a 39b Pe rse nta s e k e m a tia n (% ) Dosis (ppm)