203 LAMPIRAN 01
SILABUS MATA PELAJARAN KIMIA (Peminatan Bidang MIPA)
Satuan Pendidikan : SMAN 4 KUPANG
Kelas : XI
Kompetensi Inti
KI 1 : Menghayati dan mengamalkan ajaran agama yang dianutnya
KI 2 : Menghayati dan mengamalkan perilaku jujur, disiplin, tanggung jawab, peduli (gotong royong, kerjasama, toleran, damai), santun, responsif dan proaktif, dan menunjukan sikap sebagai bagian dari solusi atas berbagai permasalahan dalam berinteraksi secara efektif dengan lingkungan sosial dan alam serta dalam menempatkan diri sebagai cerminan bangsa dalam pergaulan dunia
KI 3 : Memahami, menerapkan, dan menganalisis pengetahuan faktual, konseptual,prosedural, dan metakognitif berdasarkan rasa ingin tahunya tentang ilmu pengetahuan, teknologi, seni, budaya, dan humaniora dengan wawasan kemanusiaan, kebangsaan, kenegaraan, dan peradaban terkait penyebab fenomena dan kejadian, serta menerapkan pengetahuan prosedural pada bidang kajian yang spesifik sesuai dengan bakat dan minatnya untuk memecahkan masalah
KI 4 : Mengolah, menalar, dan menyaji dalam ranah konkret dan ranah abstrak terkait dengan pengembangan dari yang dipelajarinya di sekolah secara mandiri, bertindak secara efektif dan kreatif, serta mampu menggunakan metoda sesuai kaidah keilmuan
Kompetensi Dasar Materi Pokok Pembelajaran Penilaian Alokasi
Waktu
Sumber Belajar 1.1 Menyadari adanya keteraturan dari
sifat hidrokarbon, termokimia, laju reaksi, kesetimbangan kimia, larutan dan koloid sebagai wujud kebesaran Tuhan YME dan pengetahuan tentang adanya keteraturan tersebut sebagai hasil pemikiran kreatif manusia yang
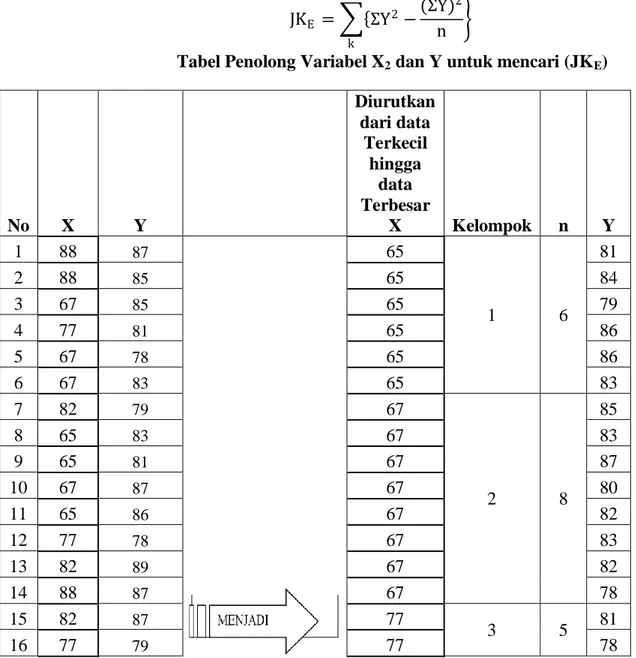
Kelarutan dan hasilkali kelarutan Memprediksi terbentuknya endapan Pengaruh penambahan ion Mengamati (Observing)
Mencari informasi dari berbagai sumber denganmembaca/mendengar/mengamati tentang kelarutan dan hasilkali kelarutan serta memprediksi terbentuknya endapan dan pengaruh penambahanion senama
Tugas Merancang percobaan reaksi pengendapan Observasi Sikap ilmiah 3 mgg x 3 jp - Buku kimia kelas XI - Lembar kerja - Berbagai sumber lainnya
204
Kompetensi Dasar Materi Pokok Pembelajaran Penilaian Alokasi
Waktu
Sumber Belajar kebenarannya bersifat tentatif. senama Menanya (Questioning)
Mengajukan pertanyaan yang berkaitan dengan kelarutan dan hasilkali kelarutan.
Mengapa Kapur (CaCO3) sukar larut
dalam air?
Mengumpulkan data (Eksperimenting)
Mendiskusikan reaksi kesetimbangan kelarutan
Mendiskusikan rumus tetapan kesetimbangan (Ksp)
Merancang percobaan kelarutan suatu zat dan mempresentasikan hasil rancangan untuk menyamakan persepsi
Melakukan percobaan kelarutan suatu zat
Mengamati dan mencatat data hasil percobaan
Mengasosiasi (Associating)
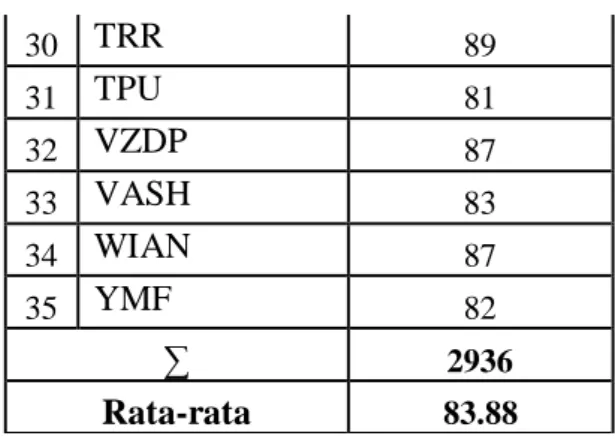
Diskusi informasi tentang hubungan kelarutan dan hasil kali kelarutan
Diskusi informasi tentang pengaruh ion senama pada kelarutan.
dalam melakukan percobaan dan presentasi, misalnya: melihat skala volumedan suhu,cara menggunakan pipet, caramenimbang, keaktifan, kerja sama, komunikatif, tanggung jawab, dan peduli lingkungan, dsb) Portofolio Laporan percobaan 2.1Menunjukkan perilaku ilmiah (memiliki
rasa ingin tahu, disiplin, jujur, objektif, terbuka, mampu
membedakan fakta dan opini, ulet, teliti, bertanggung jawab, kritis, kreatif, inovatif, demokratis, komunikatif) dalam merancang dan melakukan percobaan serta berdiskusi yang diwujudkan dalam sikap sehari-hari.
2.2 Menunjukkan perilaku kerjasama, santun, toleran, cintadamai dan peduli lingkungan serta hemat dalam
memanfaatkan sumber daya alam.
2.3 Menunjukkan perilaku responsif dan pro-aktifserta bijaksana sebagai wujud kemampuan memecahkan masalah dan membuatkeputusan
205
Kompetensi Dasar Materi Pokok Pembelajaran Penilaian Alokasi
Waktu
Sumber Belajar dari suatu reaksi berdasarkan
kesetimbangan kelarutan dan data hasil kali kelarutan (Ksp)
Memprediksi kelarutan suatu zat
Menghitung kelarutan dan hasil kali kelarutan
Mengolah data hasil percobaan Mengkomunikasikan (Communicating)
Membuat laporan percobaan dan mempresen-tasikannya dengan menggunakan tata bahasa yang benar.
Tes tertulis uraian
Menghitung kelarutan dan hasilkali kelarutan Memprediksi kelarutan suatu zat
4.14 Merancang dan melakukan percobaan untuk memisahkan campuran ion logam (kation) dalam larutan
206 Lampiran 02
RENCANA PELAKSANAAN PEMBELAJARAN (RPP 01)
Satuan Pendidikan : SMA Negeri 4 Kupang Mata Pelajaran : Kimia
Kelas / Semester : XI / 2
Materi Pokok : Kelarutan dan Hasil Kali Kelarutan Alokasi Waktu : 2 x 45 menit
Pertemuan : I
A. Kompetensi Inti
B. Kompetensi Dasar dan Indikator
1.1 Menyadari adanya keteraturan dari sifat hidrokarbon, termokimia, laju reaksi, kesetimbangan kimia, larutan dan koloid sebagai wujud kebesaran Tuhan YME 1. Menghayati dan mengamalkan ajaran agama yang dianutnya.
2. Menghayati dan mengamalkan perilaku jujur, disiplin, tanggung jawab, peduli (gotong royong, kerjasama, toleran, damai), santun, responsif dan proaktif, dan menunjukan sikap sebagai bagian dari solusi atas berbagai permasalahan dalam berinteraksi secara efektif dengan lingkungan sosial dan alam serta dalam menempatkan diri sebagai cerminan bangsa dalam pergaulan dunia.
3. Memahami, menerapkan, dan menganalisis pengetahuan faktual, konseptual, prosedural, dan metakognitif berdasarkan rasa ingin tahunya tentang ilmu pengetahuan, teknologi, seni, budaya, dan humaniora dengan wawasan kemanusiaan, kebangsaan, kenegaraan, dan peradaban terkait penyebab fenomena dan kejadian, serta menerapkan pengetahuan prosedural pada bidang kajian yang spesifik sesuai dengan bakat dan minatnya untuk memecahkan masalah.
4. Mengolah, menalar, dan menyaji dalam ranah konkret dan ranah abstrak terkait dengan pengembangan dari yang dipelajarinya di sekolah secara mandiri, bertindak secara efektif dan kreatif, serta mampu menggunakan metoda sesuai kaidah keilmuan.
207
dan pengetahuan tentang adanya keteraturan tersebut sebagai hasil pemikiran kreatif manusia yang kebenarannya bersifat tentatif.
1.1.1 1.1.2 1.1.3 1.1.4 1.1.5 1.1.6 1.1.7
Mengagungkan kebesaran Tuhan YME dalam menjalankan proses pembelajaran materi kelarutan dan hasilkali kelarutan (Ksp).
Menyadari bahwa ketentuan yang ditetapkan oleh Tuhan YME adalah yang terbaik bagi kita melalui pembelajaran materi tentang Konsep kelarutan dan hasil kali kelarutan, faktor-faktor yang mempengaruhi kelarutan dan hubungan kelarutan dan hasil kali kelarutan.
Bersyukur kepada Tuhan Bersyukur kepada Tuhan Yang Maha Esa atas rahmat dan karunia-Nya dalam proses pembelajaran kimia materi tentang Konsep kelarutan dan hasil kali kelarutan, Faktor-faktor yang mempengaruhi kelarutan dan hubungan kelarutan dan hasil kali kelarutan. Berdoa setelah mengakhiri kegiatan pembelajaran
Berdoa sesudah mengakhiri kegiatan pembelajaran. Menunjukkan sikap berdoa yang baik.
Berdoa sesuai dengan ajaran agama yang diyakini.
2.1 Menunjukkan perilaku ilmiah (memiliki rasa ingin tahu, disiplin, jujur, objektif, terbuka, mampu membedakan fakta dan opini, ulet, teliti, bertanggung jawab, kritis, kreatif, inovatif, demokratis, komunikatif) dalam merancang dan melakukan percobaan serta berdiskusi yang diwujudkan dalam sikap sehari-hari.
2.2 Menunjukkan perilaku kerjasama, santun, toleran, cinta damai dan peduli ling-kungan serta hemat dalam memanfaatkan sumber daya alam.
2.3 Menunjukkan perilaku responsif dan pro-aktif serta bijaksana sebagai wujud kemampuan memecahkan masalah dan membuat keputusan.
2.1.1 Menunjukkan rasa ingin tahu dalam mengelola bahan ajar dan sumber informasi dari buku sumber lainnya dalam kegiatan pembelajaran tentang materi kelarutan dan hasilkali kelarutan(Ksp)
2.1.2 Menunjukkan perilaku teliti dalam mengolah dan menganalisis data (melakukan pembuktian tentang kelarutan beberapa senyawa).
2.1.3 Menunjukkan perilaku jujur dalam mengerjakan kuis, soal diskusi, melakukan praktikum dan mengerjakan tugas laporan.
208
keselamatan alat-alat praktikum, dan mengerjakan laporan praktikum. 2.2.1 Menunjukkan perilaku kerja sama dengan cara saling membantu sesama
teman dalam melakukan praktikum, diskusi untuk menyelesaikan soal-soal yang diberikan,dan presentasi.
2.2.2 Menunjukkan perilaku peduli lingkungan dalam melakukan praktikum dengan membuang limbah praktikum pada tempatnya, menggunakan bahan-bahan praktikum secukupnya, menjaga kebersihan ruang kelas dan laboratorium
2.2.3 Menunjukkan perilaku toleransi dengan cara menerima masukan, kritik dan saran dari kelompok lain.
2.2.4 Menunjukkan perilaku santun dalam menanggapi dan memberikan saran ketika teman lain mempresentasikan hasil diskusi serta santun dalam memberikan ide selama diskusi.
2.3.1 Menunjukkan perilaku proaktif dalam kegiatan diskusi untuk menyelesaikan masalah di awal hingga akhir dengan langkah-langkah yang benar.
3.14 Memprediksi terbentuknya endapan dari suatu reaksi berdasarkan prinsip kelarutan dan data hasil kali kelarutan.
3.14.1 Menjelaskan konsep kelarutan dan hasil kali kelarutan. 3.14.2 Menganalisis faktor-faktor yang mempengaruhi kelarutan. 3.14.3 Menentukan persamaan tetapan hasil kali kelarutan.
3.14.4 Menentukan hubungan kelarutan dan hasil kali kelarutan jika salah satu data diketahui.
4.14 Mengolah dan menganalisis data hasil percobaan untuk memprediksi terbentuknya endapan.
1. Keterampilan
4.8.1 Persiapan percobaan 4.8.2 Pelaksanaan percobaan 4.8.3 Kegiatan akhir percobaan 2. Proses
4.8.4 Merumuskan masalah dari percobaan tentang mengukur kelarutan beberapa senyawa.
209
4.8.5 Merumuskan hipotesis tentang percobaan tentang mengukur kelarutan beberapa senyawa.
4.8.6 Mencatat data hasil pengamatan dari percobaan tentang mengukur kelarutan beberapa senyawa.
4.8.7 Menganalisis data hasil pengamatan dari percobaan tentang mengukur kelarutan beberapa senyawa.
4.8.8 Menarik kesimpulan dari percobaan tentang mengukur kelarutan beberapa senyawa.
C. Tujuan Pembelajaran
1. Tujuan Pembelajaran KI 1
Setelah mengikuti pembelajaran ini maka siswa diharapkan mampu: a. b. c. d. e. f. g. h.
Berdoa sebelum memulai kegiatan pembelajaran Berdoa setelah mengakhiri kegiatan pembelajaran Berdoa dengan sikap yang santun
Berdoa sesuai dengan ajaran agama yang dianut Bersyukur kepada Tuhan
Menyadari kebesaran Tuhan Bertaqwa kepada Tuhan Menghargai karunia Tuhan 2. Tujuan Pembelajaran KI 2
Setelah mengikuti pembelajaran ini maka siswa diharapkan mampu:
a. Menunjukkan perilaku rasa ingin tahu selama mengikuti kegiatan pembelajaran. b. Menunjukkan perilaku teliti dalam melakukan praktikum.
c. Menunjukkan perilaku jujur dalam mengerjakan kuis, soal diskusi, melakukan praktikum dan mengerjakan tugas laporan.
d. Menunjukkan perilaku bertanggungjawab dalam menjaga keselamatan alat-alat praktikum dan mengerjakan tugas.
e. Menunjukkan perilaku kerja sama dalam melakukan praktikum dan diskusi. f. Menunjukkan perilaku peduli lingkungan dalam melakukan praktikum.
g. Menunjukkan perilaku pro-aktif sebagai wujud kemampuan memecahkan masalah dalam soal diskusi dan melakukan praktikum.
3. Tujuan Pembelajaran KI 3
210
a. Menjelaskan konsep kelarutan dan hasil kali kelarutan. b. Menganalisis faktor-faktor yang mempengaruhi kelarutan. c. Menentukan persamaan tetapan hasil kali kelarutan.
d. Menentukan hubungan kelarutan dan hasil kali kelarutan jika salah satu data diketahui.
4. Tujuan Pembelajaran KI 4
Setelah mengikuti pembelajaran ini maka siswa diharapkan mampu: a. Menjelaskan konsep kelarutan dan hasil kali kelarutan.
b. Menganalisis faktor-faktor yang mempengaruhi kelarutan. c. Menentukan persamaan tetapan hasil kali kelarutan.
d. Menentukan hubungan kelarutan dan hasil kali kelarutan jika salah satu data diketahui.
D. Materi Pembelajaran
1. Konsep kelarutan dan hasil kali kelarutan. 2. Faktor-faktor yang mempengaruhi kelarutan. 3. Hubungan kelarutan dan hasil kali kelarutan. E. Pendekatan, dan Metode Pembelajaran
Model : Kooperatif Tipe NHT
Metode : Diskusi, Tanya Jawab, Kuis dan Eksperimen F. Media, Alat, dan Sumber Pembelajaran
Media : LKS
Alat : Perangkat Pembelajaran dan Alat Praktikum
Sumber : Sudarmo, Unggul. 2013. Kimia Kelas XI Kelompok Peminatan Matematika dan Ilmu Alam. Jakarta : Erlangga.
Rahardjo, Sentot Budi. 2015. Kimia Berbasis Eksperimen kelas Xll Kurikulum 2013. Surakarta : Platinum.
G. Langkah-langkah Pembelajaran Langkah Pembelajaran Sintak Model Pembelajaran Deskripsi Alokasi Waktu Kegiatan Pendahuluan Fase 1 Menyampaikan tujuan dan
Guru Memberi Salam
Guru Meminta Salah Satu Peserta Didik Untuk Memimpin Doa
211 memotivasi
Siswa
(Mengajarkan siswa untuk mengagungkan kebesaran Tuhan YME melalui berdoa sebelum memulai kegiatan pembelajaran, berdoa dengan sikap yang santun dan berdoa sesuai dengan ajaran agama yang dianut).
Guru menanamkan sikap disiplin dengan mengecek Kehadiran Peserta Didik
Guru memotivasi siswa dan menumbuhkan rasa ingin tahu siswa dengan memberikan pertanyaan, “Saat kita memasak, kita biasa menambahkan garam ke dalam masakan, apa yang terjadi bila kita terus-menurus menambahkan garam? Apakah garam dalam masakan tersebut akan melarut atau mengendap? Mengapa demikian? Guru Menyampaikan tujuan
Pembelajaran
Guru menginformasikan tentang proses pembelajaran yang akan dilakukan termasuk aspek-aspek yang dinilai selama proses pembelajaran berlangsung.
212 Kegiatan Inti Fase 2 Menyajikan Informasi Fase 3 Mengorganisasik an siswa kedalam kelompok belajar (Penomoran) (Mengajukan Pertanyaan) Fase 4 Membimbing kelompok bekerja dan belajar (Berpikir bersama)
Guru memberikan penjelasan singkat mengenai Konsep kelarutan dan hasil kali kelarutan (Ksp), Faktor-faktor yang mempengaruhi kelarutan dan Hubungan kelarutan dengan tetapan hasil kali kelarutan
Guru membagi peserta didik ke dalam kelompok. Kemudian kepada setiap anggota kelompok diberi nomor antara 1-5.
Guru membagikan LKPD dan bahan ajar ke masing-masing kelompok. Guru memperkenalkan praktikum
yang akan dilakukan.
Guru memperkenalkan alat dan bahan. Guru meminta perwakilan siswa dari
tiap kelompok untuk mengambil alat dan bahan. (Guru menanamkan sikap bertanggung jawab kepada siswa) Guru mempertegas prosedur kerja
pada LKPD.
Guru membimbing siswa melakukan percoban (siswa diharapakandapat bekerja sama dengan teman kelompok dalam melakukan praktikum dan pro-aktif serta teliti melakukan pengamatan).
213 (Menjawab)
Guru menilai keterampilan siswa dalam melakukan percobaan.
Guru membimbing siswa mencatat hasil percobaan (siswa diharapkan menunjukkan perilaku jujur dan teliti dalam mencatat data hasil pengamatan).
Guru membimbing siswa mengolah data hasil pengamatan (siswa diharapkan menunjukkan perilaku jujurdan teliti dalam mengolah data hasil pengamatan).
Guru membimbing siswa menganalisis data pengamatan menjawabi pertanyaan (siswa diharapkan dapat bekerja sama dengan teman kelompok, teliti, pro-aktif sertabertanggung jawab dalam menyelesaikan soal-soal LKPD). Guru membimbing siswa
menyimpulkan pengamatan.
Guru meminta siswa untuk menulis secara lengkap laporan sementara mereka.
Peserta didik membereskan alat dan bahan yang digunakan selama percobaan (Guru menilai keterampilan siswa dalam kegiatan akhir percobaan).
Guru memanggil suatu nomor tertentu, kemudian peserta didik yang nomornya sesuai mengacungkan
214 Fase 5
Evaluasi
tangannya dan mempresentasikan hasil percobaan mereka kepada seluruh kelas. (siswa diharapkan dapat
bertanggung jawab
mempresentasikan data hasil pengamatan dan menggunakan bahasa yang baku dalam mempresentasikan hasil diskusi).
Peserta didik menyajikan penyelesaian soal yang tertera pada LKPD.
Guru menilai presentasi siswa.
Guru merangsang siswa untuk pro-aktif dengan memberikan kesempatan kepada kelompok lain untuk menanggapi hasil diskusi kelompok yang mempresentasikan.
Peserta didik menanggapi dan memberikan saran dengan santun. Peserta didik menunjukkan perilaku
toleransi dengan menerima masukan, kritik, dan saran dari kelompok lain.
Guru memberikan penguatan kepada peserta didik yang belum berkinerja baik
Guru memberikan kuis untuk mengecek kembali pemahaman siswa mengenai percobaan yang telah dilakukan. Kegiatan Penutup Fase 6 Memberikan penghargaan
Guru memberikan penghargaan kepada siswa yang sudah berkinerja baik berupa pujian
215
Guru dan peserta didik bersama-sama membuat kesimpulan dari materi yang telah dibahas
Guru memberikan tugas rumah kepada peserta didik
Guru meminta salah satu siswa untuk memimpin doa (Mengajarkan siswa untuk mengagungkan kebesaran Tuhan YME melalui berdoa setelah mengakhiri kegiatan pembelajaran, berdoa dengan sikap yang santun dan berdoa sesuai dengan ajaran agama yang dianut).
Guru mengakhiri pembelajaran dengan salam penutup.
H. Penilaian
No Aspek Teknik Bentuk Instrumen 1. Sikap aspek
spiritual
Observasi dan Angket
Lembar Obsevasi Sikap Spiritual Lembar Angket Sikap Spiritual 2. Sikap aspek
sosial
Observasi dan Angket
Lembar Obsevasi Sikap Sosial Lembar Angket Sikap Sosial 3. Pengetahuan
Tes
Kuis
Soal Penugasan dan Pedoman Penilaian Soal Tes Tertulis Uraian dan Pedoman Penilaian
4. Keterampilan
Observasi
Lembar Penilaian Psikomotor Lembar Penilaian Presentasi Lembar Penilaian THB Proses Lembar Penilaian Portofolio
216
RENCANA PELAKSANAAN PEMBELAJARAN (RPP 02)
Satuan Pendidikan : SMA Negeri 4 Kupang Mata Pelajaran : Kimia
Kelas / Semester : XI / 2
Materi Pokok : Kelarutan dan Hasil Kali Kelarutan Alokasi Waktu : 2 x 45 menit
Pertemuan : II
A. Kompetensi Inti
I. Kompetensi Dasar dan Indikator
1.1 Menyadari adanya keteraturan dari sifat hidrokarbon, termokimia, laju reaksi, kesetimbangan kimia, larutan dan koloid sebagai wujud kebesaran Tuhan YME dan pengetahuan tentang adanya keteraturan tersebut sebagai hasil pemikiran kreatif manusia yang kebenarannya bersifat tentatif.
1. Menghayati dan mengamalkan ajaran agama yang dianutnya.
2. Menghayati dan mengamalkan perilaku jujur, disiplin, tanggung jawab, peduli (gotong royong, kerjasama, toleran, damai), santun, responsif dan proaktif, dan menunjukan sikap sebagai bagian dari solusi atas berbagai permasalahan dalam berinteraksi secara efektif dengan lingkungan sosial dan alam serta dalam menempatkan diri sebagai cerminan bangsa dalam pergaulan dunia.
3. Memahami, menerapkan, dan menganalisis pengetahuan faktual, konseptual, prosedural, dan metakognitif berdasarkan rasa ingin tahunya tentang ilmu pengetahuan, teknologi, seni, budaya, dan humaniora dengan wawasan kemanusiaan, kebangsaan, kenegaraan, dan peradaban terkait penyebab fenomena dan kejadian, serta menerapkan pengetahuan prosedural pada bidang kajian yang spesifik sesuai dengan bakat dan minatnya untuk memecahkan masalah.
4. Mengolah, menalar, dan menyaji dalam ranah konkret dan ranah abstrak terkait dengan pengembangan dari yang dipelajarinya di sekolah secara mandiri, bertindak secara efektif dan kreatif, serta mampu menggunakan metoda sesuai kaidah keilmuan.
217 1.1.1 1.1.2 1.1.3 1.1.4 1.1.5 1.1.6 1.1.7 1.1.8
Mengagungkan kebesaran Tuhan YME dalam menjalankan proses pembelajaran materi kelarutan dan hasilkali kelarutan (Ksp).
Menyadari bahwa ketentuan yang ditetapkan oleh Tuhan YME adalah yang terbaik bagi kita melalui pembelajaran materi tentang Makna hasil kali kelarutan, Pengaruh ion senama terhadap kelarutan dan Hubungan Ksp dengan pH.
Bersyukur kepada Tuhan Yang Maha Esa atas rahmat dan karunia-Nya dalam proses pembelajaran kimia materi kelarutan dan hasilkali kelarutan(Ksp).
Berdoa setelah mengakhiri kegiatan pembelajaran Berdoa sesudah mengakhiri kegiatan pembelajaran. Menunjukkan sikap berdoa yang baik.
Berdoa sesuai dengan ajaran agama yang diyakini.
2.1 Menunjukkan perilaku ilmiah (memiliki rasa ingin tahu, disiplin, jujur, objektif, terbuka, mampu membedakan fakta dan opini, ulet, teliti, bertanggung jawab, kritis, kreatif, inovatif, demokratis, komunikatif) dalam merancang dan melakukan percobaan serta berdiskusi yang diwujudkan dalam sikap sehari-hari.
2.2 Menunjukkan perilaku kerjasama, santun, toleran, cinta damai dan peduli ling-kungan serta hemat dalam memanfaatkan sumber daya alam.
2.3 Menunjukkan perilaku responsif dan pro-aktif serta bijaksana sebagai wujud kemampuan memecahkan masalah dan membuat keputusan.
2.1.1 Menunjukkan rasa ingin tahu dalam mengelola bahan ajar dan sumber informasi dari buku sumber lainnya dalam kegiatan pembelajaran tentang materi kelarutan dan hasilkali kelarutan(Ksp)
2.1.2 Menunjukkan perilaku teliti dalam mengolah dan menganalisis data (melakukan pembuktian tentang kelarutan beberapa senyawa).
2.1.3 Menunjukkan perilaku jujur dalam mengerjakan kuis, soal diskusi, melakukan praktikum dan mengerjakan tugas laporan.
2.1.4 Menunjukkan perilaku tanggung jawab dalam diskusi kelompok, menjaga keselamatan alat-alat praktikum, dan mengerjakan laporan praktikum. 2.2.1 Menunjukkan perilaku kerja sama dengan cara saling membantu sesama
soal-218 soal yang diberikan,dan presentasi.
2.2.2 Menunjukkan perilaku peduli lingkungan dalam melakukan praktikum dengan membuang limbah praktikum pada tempatnya, menggunakan bahan-bahan praktikum secukupnya, menjaga kebersihan ruang kelas dan laboratorium
2.2.3 Menunjukkan perilaku toleransi dengan cara menerima masukan, kritik dan saran dari kelompok lain.
2.2.4 Menunjukkan perilaku santun dalam menanggapi dan memberikan saran ketika teman lain mempresentasikan hasil diskusi serta santun dalam memberikan ide selama diskusi.
2.3.1 Menunjukkan perilaku proaktif dalam kegiatan diskusi untuk menyelesaikan masalah di awal hingga akhir dengan langkah-langkah yang benar.
3.14 Memprediksi terbentuknya endapan dari suatu reaksi berdasarkan prinsip kelarutan dan data hasil kali kelarutan.
3.14.1 Menjelaskan tiga kemungkinan yang akan terjadi jika dua larutan elektrolit dicampurkan.
3.14.2 Memprediksi terbentuknya endapan dari suatu reaksi berdasarkan prinsip kelarutan dan data hasil kali kelarutan.
3.14.3 Menjelaskan pengaruh ion senama terhadap kelarutan berdasarkan asas Le Chatelier.
3.14.4 Membandingkan kelarutan suatu garam dalam air murni dan larutan yang mengandung salah satu ion zat terlarut.
3.14.5 Menyimpulkan pengaruh ion senama terhadap kelarutan. 3.14.6 Menentukan hubungan Ksp dengan pH suatu larutan
4.14 Mengolah dan menganalisis data hasil percobaan untuk memprediksi terbentuknya endapan.
1. Keterampilan
4.8.1 Persiapan percobaan 4.8.2 Pelaksanaan percobaan 4.8.3 Kegiatan akhir percobaan 2. Proses
219
4.8.4 Merumuskan masalah dari percobaan memprediksi terjadinya endapan.
4.8.5 Merumuskan hipotesis tentang percobaan memprediksi terjadinya endapan
4.8.6 Mencatat data hasil pengamatan dari percobaan memperkirakan terjadinya endapan.
4.8.7 Menganalisis data hasil pengamatan dari percobaan memprediksi terjadinya endapan.
4.8.8 Menarik kesimpulan dari percobaan memperkirakan terjadinya endapan.
B. Tujuan Pembelajaran
1. Tujuan Pembelajaran KI 1
Setelah mengikuti pembelajaran ini maka siswa diharapkan mampu: a. b. c. d. e. f. g. h.
Berdoa sebelum memulai kegiatan pembelajaran Berdoa setelah mengakhiri kegiatan pembelajaran Berdoa dengan sikap yang santun
Berdoa sesuai dengan ajaran agama yang dianut Bersyukur kepada Tuhan
Menyadari kebesaran Tuhan Bertaqwa kepada Tuhan Menghargai karunia Tuhan 2. Tujuan Pembelajaran KI 2
Setelah mengikuti pembelajaran ini maka siswa diharapkan mampu:
a. Menunjukkan perilaku rasa ingin tahu selama mengikuti kegiatan pembelajaran.
b. Menunjukkan perilaku teliti dalam melakukan praktikum.
c. Menunjukkan perilaku jujur dalam mengerjakan kuis, soal diskusi, melakukan praktikum dan mengerjakan tugas laporan.
d. Menunjukkan perilaku bertanggungjawab dalam menjaga keselamatan alat-alat praktikum dan mengerjakan tugas.
e. Menunjukkan perilaku kerja sama dalam melakukan praktikum dan diskusi. f. Menunjukkan perilaku peduli lingkungan dalam melakukan praktikum.
220
masalah dalam soal diskusi dan melakukan praktikum. 3. Tujuan Pembelajaran KI 3
Setelah mengikuti pembelajaran ini maka siswa diharapkan mampu:
a. Menjelaskan tiga kemungkinan yang akan terjadi jika dua larutan elektrolit dicampurkan.
b. Memprediksi terbentuknya endapan dari suatu reaksi berdasarkan prinsip kelarutan dan data hasil kali kelarutan.
c. Menjelaskan pengaruh ion senama terhadap kelarutan berdasarkan asas Le Chatelier.
d. Menganalisis kelarutan suatu garam dalam air murni dan larutan yang mengandung salah satu ion zat terlarut.
e. Menyimpulkan pengaruh ion senama terhadap kelarutan. f. Menentukan hubungan Ksp dengan pH suatu larutan
4. Tujuan Pembelajaran KI 4
Setelah mengikuti pembelajaran ini maka siswa diharapkan mampu:
a. Merumuskan masalah dari percobaan memperkirakan terjadinya endapan. b. Mencatat data hasil pengamatan dari percobaan memperkirakan terjadinya
endapan.
c. Menganalisis data hasil pengamatan dari percobaan memperkirakan terjadinya endapan.
d. Menarik kesimpulan dari percobaan memperkirakan terjadinya endapan.
C. Materi Pembelajaran
1. Makna hasil kali kelarutan.
2. Pengaruh ion senama terhadap kelarutan. 3. Hubungan Ksp dengan pH.
D. Pendekatan, dan Metode Pembelajaran Model : Kooperatif Tipe NHT
Metode : Diskusi, Tanya Jawab, Kuis dan Eksperimen E. Media, Alat, dan Sumber Pembelajaran
Media : LKS dan Bahan Praktikum
221
Sumber : Sudarmo, Unggul. 2013. Kimia Kelas XI Kelompok Peminatan Matematika dan Ilmu Alam. Jakarta : Erlangga.
Rahardjo, Sentot Budi. 2015. Kimia Berbasis Eksperimen kelas Xll Kurikulum 2013. Surakarta : Platinum.
F. Langkah-langkah Pembelajaran Langkah Pembelajara n Sintak Model Pembelajaran Deskripsi Alokasi Waktu Kegiatan Pendahulua n Fase 1 Menyampaikan tujuan dan Memotivasi Siswa
Guru Memberi Salam
Guru Meminta Salah Satu Peserta Didik Untuk Memimpin Doa (Mengajarkan siswa untuk mengagungkan kebesaran Tuhan YME melalui berdoa sebelum memulai kegiatan pembelajaran, berdoa dengan sikap yang santun dan berdoa sesuai dengan ajaran agama yang dianut).
Guru menanamkan sikap disiplin dengan mengecek Kehadiran Peserta Didik
Guru menyampaikan tujuan pembelajaran yang ingin dicapai. Guru menginformasikan tentang proses
pembelajaran yang akan dilakukan termasuk aspek-aspek yang dinilai selama proses pembelajaran berlangsung.
Guru memotivasi siswa dan menumbuhkan rasa ingin tahu siswa dengan memberikan pertanyaan, “Pada pertemuan sebelumnya, kita belajar
222
tentang hubungan kelarutan dan tetapan hasil kali kelarutan, bagaimana hubungan nilai Ksp dengan kelarutan
suatu zat? Bagaimana kita dapat memperkirakan terjadi atau tidaknya endapan jika zat dilarutkan dalam air?” Kegiatan Inti Fase 2 Menyajikan Informasi Fase 3 Mengorganisasik an siswa kedalam kelompok belajar (Penomoran) (Mengajukan Pertanyaan) Fase 4 Membimbing kelompok bekerja dan
Guru memberikan penjelasan singkat mengenai Makna hasil kali kelarutan, Pengaruh Ion Senama terhadap kelarutan dan Hubungan Ksp dengan pH.
Guru membagi peserta didik ke dalam kelompok. Kemudian kepada setiap anggota kelompok diberi nomor antara 1-5.
Guru memberi lembar kerja peserta didik (LKPD) yang berisi memprediksi terbentuknya endapan
Guru memperkenalkan praktikum yang akan dilakukan
Guru memperkenalkan alat dan bahan. Guru meminta perwakilan siswa dari
tiap kelompok untuk mengambil alat dan bahan. (Guru menanamkan sikap bertanggung jawab kepada siswa) Guru membimbing siswa melakukan
percobaan (siswa diharapakandapat bekerja sama dengan teman kelompok dalam melakukan praktikum dan
223 belajar
(Berpikirbersa ma)
aktif serta teliti melakukan pengamatan).
Peserta didik menganalisis tentang efek ion senama dan pembentukan endapan berdasarkan Kspdan prinsip kelarutanyang telah diperolehnya dari berbagai literatur.
Guru menilai keterampilan siswa dalam melakukan percobaan.
Guru membimbing siswa mencatat hasil percobaan (siswa diharapkan menunjukkan perilaku jujur dan teliti dalam mencatat data hasil pengamatan). Guru membimbing siswa mengolah data
hasil pengamatan (siswa diharapkan menunjukkan perilaku jujurdan teliti dalam mengolah data hasil pengamatan).
Guru membimbing siswa menganalisis data pengamatan menjawabi pertanyaan (siswa diharapkan dapat bekerja sama dengan teman kelompok, teliti, pro-aktif sertabertanggung jawab dalam menyelesaikan soal-soal LKPD).
Guru membimbing siswa
menyimpulkan pengamatan.
Guru meminta siswa untuk menulis secara lengkap laporan sementara mereka.
Guru meminta siswa yang lain untuk merapikan dan membersihkan alat dan bahan yang telah digunakan (siswa
224 (Menjawab)
Fase 5 Evaluasi
diharapkan dapat bekerjasama dan bertanggung jawab)
Peserta didik membereskan alat dan bahan yang digunakan selama percobaan (Guru menilai keterampilan siswa dalam kegiatan akhir percobaan).
Guru memanggil suatu nomor tertentu, kemudian peserta didik yang nomornya sesuai mengacungkan tangannya dan mencoba mempresentasikan hasil diskusi kelompoknya untuk seluruh kelas
Guru merangsang siswa untuk pro-aktif dengan memberikan kesempatan kepada kelompok lain untuk menanggapi hasil
diskusi kelompok yang
mempresentasikan.
Peserta didik menyajikan penyelesaian soal yang tertera pada LKPD.
Peserta didik menanggapi dan memberikan saran dengan santun. Peserta didik menunjukkan perilaku
toleransi dengan menerima masukan, kritik, dan saran dari kelompok lain.
Guru memberi penegasan terhadap jawaban peserta didik
Guru memberikan kuis untuk mengecek kembali pemahaman siswa mengenai percobaan yang telah dilakukan.
Guru dan peserta didik bersama-sama membuat kesimpulan dari materi yang
225 telah dibahas Kegiatan Penutup Fase 6 Memberikan penghargaan
Guru memberikan penguatan kepada peserta didik yang belum berkinerja baik
Guru memberikan penghargaan kepada siswa yang sudah berkinerja baik berupa pujian
Guru memberikan tugas rumah kepada peserta didik
Guru meminta salah satu siswa untuk memimpin doa (Mengajarkan siswa untuk mengagungkan kebesaran Tuhan YME melalui berdoa setelah mengakhiri kegiatan pembelajaran, berdoa dengan sikap yang santun dan berdoa sesuai dengan ajaran agama yang dianut).
Guru mengakhiri pembelajaran dengan salam penutup.
10 Menit
G. Penilaian
No Aspek Teknik Bentuk Instrumen 1. Sikap aspek
spiritual
Observasi dan Angket
Lembar Obsevasi Sikap Spiritual Lembar Angket Sikap Spiritual 2. Sikap aspek
sosial
Observasi dan Angket
Lembar Obsevasi Sikap Sosial Lembar Angket Sikap Sosial 3. Pengetahuan
Tes
Kuis
Soal Penugasan dan Pedoman Penilaian Soal Tes Tertulis Uraian dan Pedoman Penilaian
4. Keterampilan
Observasi Lembar Penilaian Psikomotor Lembar Penilaian Presentasi
226
Lembar Penilaian THB Proses Lembar Penilaian Portofolio
227
LAMPIRAN 03
BAHAN AJAR 01
KELARUTAN DAN HASIL KALI KELARUTAN
A. Konsep Kelarutan dan Hasil Kali Kelarutan Perhatikan gambar berikut!
Jika kita melarutkan padatan garam dapur ke dalam air sedikit demi sedikit, pada awalnya NaCl larut seluruhnya dalam air. Ketika sejumlah tertentu NaCl telah melarut dan ada sebagian yang tidak larut (terbentuk endapan), maka larutan tersebut merupakan larutan jenuh atau tepat jenuh. Konsentrasi zat terlarut di dalam larutan jenuh sama dengan kelarutannya. Dengan demikian, kelarutan (solubility) –dengan lambang s– dapat didefinisikan sebagai jumlah maksimum suatu zat yang dapat larut dalam pelarut tertentu. Satuan kelarutan biasanya dinyatakan dalam gram/ Liter atau mol/ Liter.
B. Faktor-faktor Yang Mempengaruhi Kelarutan dan Hasilkali Kelarutan Besarnya kelarutan suatu zat dipengaruhi oleh faktor-faktor berikut: 1. Suhu
Kelarutan zat padat dalam air semakin tinggi bila suhunya dinaikkan. Adanya panas mengakibatkan semakin renggangnya jarak antar molekul zat padat, sehingga kekuatan gaya antarmolekulnya menjadi lemah dan mudah putus oleh gaya tarik dari molekul-molekul air.
Pengaruh suhu yang berbeda terhadap kelarutan suatu zat dapat diperhatikan pada gambar berikut.
228 Tugas I:
Berikut adalah kelarutan beberapa zat dalam air. Jika suhu diperbesar, maka kelarutan zat semakin besar. Mengapa demikian?
2. Jenis pelarut
Senyawa polar mudah larut dalam pelarut seperti air. Misal: Garam dapur, gula, alkohol, dan semua asam merupakan senyawa polar sehingga mudah larut dalam pelarut polar seperti air. Demikian senyawa non-polar mudah larut dalam pelarut non-polar. Misal: Lemak mudah larut dalam minyak. Tetapi senyawa polar tidak larut dalam senyawa nonpolar, seperti yang ditunjukkan pada gambar berikut.
229 Tugas II:
Berdasarkan gambar di atas, mengapa senyawa nonpolar tidak larut dalam senyawa polar?
C. Tetapan Hasilkali Kelarutan
Dalam suatu larutan jenuh dari zat elektrolit yang sukar larut, terdapat kesetimbangan antara zat padat yang tidak larut dengan ion-ion yang terlarut. Secara umum, persamaan kesetimbangan untuk larutan garam AmBn yang sedikit larut adalah:
Berdasarkan reaksi diatas maka dapat dibuat tetapan hasilkali kelarutan dari reaksi tersebut adalah ;
Dengan demikian, hasil kali kelarutan (Ksp) menggambarkan perkalian konsentrasi ion-ion elektrolit yang sukar larut dalam larutan jenuhnya, dipangkatkan koefisiennya masing-masing.
Senyawa yang mempunyai harga Ksp adalah senyawa elektrolit yang
sukar larut. Senyawa elektrolit yang mudah larut seperti NaCl, Na2SO4,
KOH, HCl, atau H2SO4 tidak mempunyai harga Ksp. Demikian pula
senyawa-senyawa non-elektrolit yang sukar larut seperti benzena, minyak, eter, juga tidak mempunyai harga Ksp. Besarnya harga Ksp dari suatu zat
A
mB
n(s)mA
n++ nB
230
adalah tetap pada suhu tetap. Jika terjadi perubahan suhu, maka harga Ksp
-nya pun akan mengalami perubahan.
Perhatikan contoh soal berikut untuk menentukan tetapan hasil kali kelarutan (Kap)!
Tuliskan persamaan tetapan hasil kali kelarutan untuk masing-masing larutan jenuh:
a. AgCl b. Ag2CrO4
c. Al(OH)3
Penyelesaian:
a. AgCl(s) Ag+(aq) + Cl-(aq)
Ksp = [Ag+]x [Cl-]
b. Ag2CrO4(s) 2Ag+(aq)+ CrO42-(aq)
Ksp = [Ag+]2x [CrO42-]
c. Al(OH)3(s) Al3+(aq)+ 3OH-(aq)
Ksp = [Al3+]x [OH-]3
Tugas III:
Tuliskan rumus Ksp untuk senyawa-senyawa berikut.
a. PbI2
b. CdS c. Ca(OH)2
d. Ag2CrO4
e. Cu2S
D. Hubungan Kelarutan dengan Tetapan Hasil kali Kelarutan
Karena nilai kelarutan (s) dan hasil kali kelarutan (Ksp) sama-sama dihitung
pada larutan jenuh, maka terdapat hubungan yang sangat erat di antara keduanya. Untuk senyawa AmBn yang terlarut, maka ia akan mengalami
ionisasi dalam sistem kesetimbangan:
A
mB
n(s)mA
n+m-231
Jika harga kelarutan dari senyawa AmBn sebesar s mol L–1, maka di dalam
reaksi kesetimbangan tersebut konsentrasi ion-ion An+ dan Bm– adalah: AmBn (s) mAn+(aq) + nBm-(aq)
s mol L-1 ms mol L-1 ns mol L-1
Sehingga harga hasil kali kelarutannya adalah:
Ksp = [An+]m x [Bm-]n = (ms)m x (ns)n = mm.sm.nn.sn = mm.nn.sm+n sm+n = Ksp mm.nn S = Ksp mm. nn m +n
Hubungan kelarutan dengan hasil kali kelarutan dapat pula dinyatakan dengan persamaan berikut:
Perhatikan contoh soal berikut untuk menentukan hubungan kelarutan dan tetapan hasil kali kelarutan (Kap)!
Diketahui Ksp CaF2 = 3,2 . 10-11, tentukan:
a. Kelarutan garam CaF2 dalam air?
b. Konsentrasi ion Ca2+ dan F- pada keadaan jenuh?
c. Berapa massa garam, CaF2 yang terlarut dalam 100 mL larutan?
(Mr CaF2 = 78)
Penyelesaian:
a. s = 1+2 3,2 .1011.2−112 = 2 . 10-4 mol L-1
Jadi kelarutan garam CaF2 dalam air adalah 2 . 10-4 mol L-1
b. CaF2(s) Cal2+(aq)+ 2F-(aq)
s s 2s
[Ca2+] = s = 2 . 10-4 mol L-1 [F-] = 2s = 4 . 10-4 mol L-1
c. Dalam 1 liter terdapat CaF2 yang terlarut sebanyak = 2 . 10-4 mol L-1
Dalam 100 mililiter = 2 . 10-5 mol L-1 Massa CaF2 =mol . Mr
Ksp = (n-1)n-1 sn
Dengan n = Jumlah ion dari elektrolit s = Larutan elektrolit (mol L-)
232 =2 . 10-5 . 78 = 156 . 10-5 g
Jadi banyaknya CaF2 yang terlarut dalam 100 ml larutan adalah
156 . 10-5 g
Tugas IV:
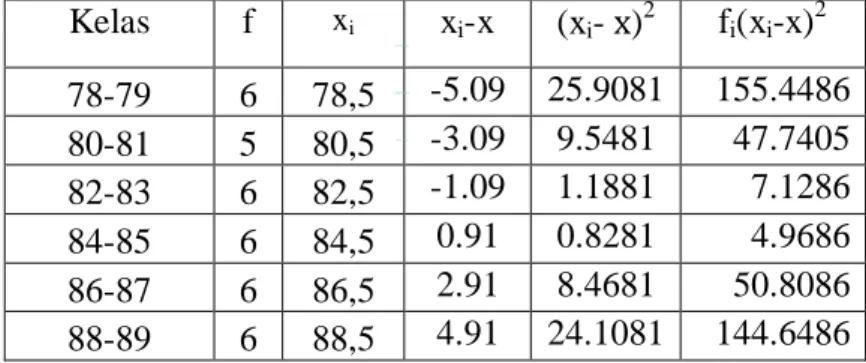
1. Kelarutan AxBy dalam air adalah s mol/liter. Hitunglah Ksp AxBy.
2. Jika hasil kali kelarutan AxBy = Ksp, hitunglah kelarutan (s) dari AxBy.
3. Apabila suatu larutan jenuh PbCl2 terdapat ion Cl- dengan konsentrasi 2 x
233
BAHAN AJAR 02
KELARUTAN DAN HASIL KALI KELARUTAN
A. Makna Hasil Kali Kelarutan Perhatikan gambar berikut !
Berdasarkan gambar diatas, “Bagaimana mengetahui terjadi atau tidaknya endapan dari garam AgBr? Bagaimana pengaruh penambahan KBr terhadap larutan AgBr?”. Semua akan dijelaskan pada bahan ajar ini.
Harga Ksp suatu elektrolit dapat digunakan untuk memperkirakan apakah
elektrolit tersebut dapat larut atau mengendap dalam suatu larutan. Semakin besar harga Ksp suatu senyawa, maka semakin mudah larut senyawa tersebut.
Dengan membandingkan harga Ksp dengan harga hasil kali konsentrasi
ion-ion (Qsp) yang ada dalam larutan yang dipangkatkan dengan koefisien reaksi
masing-masing, maka ada tiga kemungkinan yang akan terjadi jika dua larutan elektrolit dicampurkan, yaitu:
• Jika Qsp < Ksp, larutan belum jenuh (tidak ada endapan)
• Jika Qsp = Ksp, larutan tepat jenuh (belum ada endapan)
• Jika Qsp > Ksp, larutan lewat jenuh (ada endapan)
Perhatikan contoh soal berikut untuk memperkirakan apakah elektrolit tersebut dapat larut atau mengendap dalam suatu larutan!
Diketahui 500 mL larutan Pb(NO3)2 M dicampurkan dengan 1 L larutan NaI
10-2 M. Jika diketahui Ksp PbI2 = 6 . 10-9, tentukan apakah terbentuk endapan
234 Penyelesaian: Mol Pb2+ = V . M = 0,5 L . 10-3 M = 5 . 10-4 mol Mol I- = V . M = 1,0 L . 10-2 M = 1 . 10-2 mol
Konsentrasi setelah pencampuran:
[Pb2+] = mol Pb2+ / V total = 5 . 10-4 mol/1,5 L = 3,33 . 10-4 M [I-] = mol I- / V total = 1 . 10-2 mol/1,5 L = 6,67 . 10-3 M Qsp = [Pb2+] [I-] = (3,33 . 10-4) (6,67 . 10-3) = 1,5 . 10-8
Harga Qsp > Ksp maka terjadi pengendapan PbI2
Tugas V:
1. Sebanyak 1 L larutan yang mengandung ion Pb2+, Fe2+, Cu2+, dan Cd2+ dengan konsentrasi masing-masing 10-4 M. Dengan menggunakan perhitungan, ion mana sajakah yang akan mengendap?
(Diketahui: Ksp PbS = 8 x 10-28, Ksp CdS = 8 x 10-27, Ksp CuS = 6,3 x 10-36,
dan Ksp FeS = 6,3 x 10-18).
2. Ke dalam akuades yang volumenya 100 mL ditambahkan masing-masing 1 mL larutan Pb(NO3)2 0,01 M dan 1 mL larutan NaCl 0,01 M.
Dengan menganggap bahwa volume larutan tetap 100 mL dan nilai Ksp =
PbCl2 = 2,0 x 10-5 , tunjukan dengan perhitungan apakah akan terjadi endapan
pada reaksi di atas.
B. Pengaruh Ion Senama terhadap Kelarutan
Suatu zat elektrolit umumnya lebih mudah larut dalam pelarut air murni dari pada dalam air yang mengandung salah satu ion dari elektrolit tersebut. Jika AgCl dilarutkan dalam larutan NaCl atau larutan AgNO3, ternyata
235
dibandingkan dengan kelarutan AgCl dalam air murni. Hal ini disebabkan karena sebelum AgCl(s) terionisai menjadi Ag+(aq) atau Cl–(aq), di dalam larutan
sudah terdapat ion Ag+ (dari AgNO3) atau ion Cl– (dari NaCl).
AgCl(s) Ag+(aq) + Cl-(aq)
Sesuai dengan Asas Le Chatelier, penambahan Ag+ atau Cl– akan menggeser kesetimbangan ke kiri, sehingga AgCl yang larut makin sedikit. Dengan demikian, adanya ion sejenis akan memperkecil kelarutan suatu elektrolit.
Tugas VI
Perhatikan gambar berikut! Berdasarkan Asas Le Chatelier, bagaimana pengaruh penambahan Pb(NO3)2 pada larutan PbCrO4? Buatlah kesimpulan
tentang pengaruh penambahan ion senama terhadap kelarutan?
Gambar a: Larutan jenuh PbCrO4 Gambar b: Larutan Pb(NO3)2ditambahkan
pada larutan jenuh PbCr04
Perhatikan soal berikut untuk menentukan pengaruh ion senama terhadap kelarutan suatu garam!
Jika diketahui Ksp AgCl pada suhu 25oC adalah 2 .10-10 mol L-1,
bandingkanlah kelarutan AgCl dalam: a. Air murni (pada suhu yang sama) b. Larutan NaCl 0,1 M
236 Penyelesaian:
a. Misal, kelarutan AgCl dalam air = s mol L-1 AgCl(s) Ag+(aq) + Cl-(aq)
s mol L-1 s mol L-1 s mol L-1 Ksp AgCl = [Ag+] x [Cl-]
2 . 10-10 = (s) (s)
s = 2 . 10−10 = 1,41 . 10-5 mol L-1
b. Misal, kelarutan AgCl dalam larutan NaCl 0,1 M = n mol L-1 AgCl(s) Ag+(aq) + Cl-(aq)
n mol L-1 n mol L-1 n mol L-1 NaCl(s) Na+(aq) + Cl-(aq)
0,1 mol L-1 0,1 mol L-1 0,1 mol L-1
Jadi, di dalam sistem terdapat: [Ag+] = n mol L-1
[Cl-] = (n + 0,1) mol L-1
Karena [Cl-] yang berasal dari AgCl sangat sedikit dibandingkan dengan [Cl-] yang berasal dari larutan NaCl, maka [Cl-] yang berasal dari AgCl dapat diabaikan, sehingga:
Ksp AgCl = [Ag+] x [Cl-]
Kelarutan AgCl dalam air murni, 1,41.10–5 mol.L–1 jauh lebih besar daripada kelarutan AgCl dalam larutan NaCl yang besarnya hanya 2 . 10–9 mol.L–1. Dengan demikian, telah terbukti bahwa adanya ion senama akan memperkecil kelarutan suatu elektrolit.
2 . 10-10 = (n) (0,1) n = 2 . 10-9 mol L-1
237 Tugas VII:
Pada suhu 25oC, Ksp Ni(OH)2 = 6 x 10-18. Hitunglah kelarutan Ni(OH)2 pada
larutan:
a. Air pada suhu tersebut. b. NiCl2 0,001 M.
c. NaOH 0,001 M.
C. Hubungan Ksp dengan pH
Harga Ksp suatu basa dapat digunakan untuk menentukan pH larutan.
Sebaliknya, harga pH sering digunakan untuk menghitung besarnya nilai Ksp.
Perhatikan soal berikut untuk menentukan hubungan Ksp dengan pH suatu
larutan!
Jika larutan MgCl2 0,3 M ditetesi larutan NaOH, pada pH berapakah
endapan Mg(OH)2 mulai terbentuk? (Ksp Mg(OH)2 = 3,0 . 10-11)
Penyelesaian: Ksp Mg(OH)2 = [Mg2+] [OH-]2 3,0 . 10-11 = (0,3) [OH-]2 [OH-]2 = 10-10 [OH-]2 = 10-5 pOH = 5 pH = 9
Jadi, Mg(OH2) membentuk endapan pada pH = 9.
Tugas VIII:
Kelarutan L(OH)2 pada suhu tertentu adalah 2 x 10-5 mol/L. Hitunglah kelarutan
238
LEMBAR KERJA PESERTA DIDIK(LKPD) PERTEMUAN I
Nama Anggota Kelompok : ... ... ... ... ... ... A. Kompetensi Inti
1. Menghayati dan mengamalkan ajaran agama yang dianutnya.
2. Menghayati dan mengamalkan perilaku jujur, disiplin, tanggung jawab, peduli (gotong royong, kerjasama, toleran, damai), santun, responsif dan proaktif, dan menunjukan sikap sebagai bagian dari solusi atas berbagai permasalahan dalam berinteraksi secara efektif dengan lingkungan sosial dan alam serta dalam menempatkan diri sebagai cerminan bangsa dalam
pergaulan dunia.
3. Memahami, menerapkan, dan menganalisis pengetahuan faktual, konseptual, prosedural, dan metakognitif berdasarkan rasa ingin tahunya tentang ilmu pengetahuan, teknologi, seni, budaya, dan humaniora dengan wawasan kemanusiaan, kebangsaan, kenegaraan, dan peradaban terkait penyebab fenomena dan kejadian, serta menerapkan pengetahuan prosedural pada bidang kajian yang spesifik sesuai dengan bakat dan minatnya untuk memecahkan masalah.
4. Mengolah, menalar, dan menyaji dalam ranah konkret dan ranah abstrak terkait dengan pengembangan dari yang dipelajarinya di sekolah secara mandiri, bertindak secara efektif dan kreatif, serta mampu menggunakan metoda sesuai kaidah keilmuan.
239 B. Kompetensi Dasar
3.14 Memprediksi terbentuknya endapan dari suatu reaksi berdasarkan prinsip kelarutan dan data hasil kali kelarutan.
C. Indikator
1. Kognitif a) Produk
Siswa mampu :
3.14.1 Menjelaskan konsep kelarutan dan hasil kali kelarutan.
3.14.2 Menganalisis faktor-faktor yang mempengaruhi kelarutan.
b) Proses
Siswa mampu :
4.14.1 Merumuskan masalah dari percobaan tentang mengukur kelarutan
beberapa senyawa.
4.14.2 Merumuskan hipotesis percobaan tentang kelarutan beberapa
senyawa.
4.14.3 Mencatat data hasil pengamatan dari percobaan tentang mengukur
kelarutan beberapa senyawa.
4.14.4 Menganalisis data hasil pengamatan dari percobaan tentang
mengukur kelarutan beberapa senyawa.
4.14.5 Menarik kesimpulan dari percobaan tentang mengukur kelarutan
beberapa senyawa.
2. Psikomotor
4.13.1 Menunjukkan keterampilan dalam persiapan percobaan tentang mengukur kelarutan beberapa senyawa.
4.13.2 Menunjukkan keterampilan dalam pelaksanaan percobaan tentang mengukur kelarutan beberapa senyawa.
4.13.3 Menunjukkan keterampilan dalam kegiatan akhir percobaan tentang mengukur kelarutan beberapa senyawa.
240 3. Afektif
a) Perilaku berkarakter
Rasa ingin tahu, jujur, ulet, teliti, tanggung jawab, kerjasama, santun, toleransi dan peduli lingkungan dalam melakukan percobaan dan berdiskusi. b) Keterampilan sosial
Perilaku proaktif dalam memecahkan masalah di awal hingga akhir dengan langkah yang benar.
D. Judul
Menguji kelarutan beberapa garam dalam air E. Dasar Teori
Jika kita melarutkan padatan garam dapur ke dalam air sedikit demi sedikit, pada awalnya NaCl larut seluruhnya dalam air. Ketika sejumlah tertentu NaCl telah melarut dan ada sebagian yang tidak larut (terbentuk endapan), maka larutan tersebut merupakan larutan jenuh atau tepat jenuh. Konsentrasi zat terlarut di dalam larutan jenuh sama dengan kelarutannya. Dengan demikian, kelarutan (solubility) –dengan lambang s– dapat didefinisikan sebagai jumlah maksimum suatu zat yang dapat larut dalam pelarut tertentu. Satuan kelarutan biasanya dinyatakan dalam gram/ Liter atau mol/ Liter.
Besarnya kelarutan suatu zat dipengaruhi oleh suhu. Kelarutan zat padat dalam air semakin tinggi bila suhunya dinaikkan. Adanya panas mengakibatkan semakin renggangnya jarak antar molekul zat padat, sehingga kekuatan gaya antarmolekulnya menjadi lemah dan mudah putus oleh gaya tarik dari molekul-molekul air.
F. Wacana
Maya mendapat tugas dari gurunya untuk menguji kelarutan beberapa garam dalam air. Maya pun mulai melaksanakan tugas tersebut dengan melakukan praktikum sederhana. Garam yang digunakan adalah garam dapur dan kalsium karbonat. Untuk menguji kelarutan garam dapur dan kalsium karbonat, maka Maya melarutkan sejumlah garam dapur dan kalsium karbonat dalam air, kemudian membandingkan kelarutannya.
241 G. Rumusan Masalah ... ... ... ... H. Hipotesis Percobaan ... ... ... ...
I. Alat dan Bahan
Alat Bahan
Gelas kimia 100 mL 2 buah Padatan garam dapur Gelas Ukur Padatan kalsium karbonat
Air
J. Cara Kerja
1. Siapkan 2 buah gelas kimia 100 mL, diberi label A dan B, kemudian masing-masing gelas kimia diisi 100 ml air!
2. Masukkan ¼ senduk gram dapur secara terus menerus ke dalam gelas A menggunakan senduk sambil diaduk, kemudian amati kelarutan garam dapur dalam air. Hentikan penambahan garam dapur, tepat pada saat garam dapur tidak larut dalam pelarut air!
3. Masukkan ¼ senduk kalsium karbonat secara terus menerus ke dalam gelas B menggunakan senduk sambil diaduk, kemudian amati kelarutan kalsium karbonat dalam air. Hentikan penambahan kalsium karbonat, tepat pada saat kalsium karbonat tidak larut dalam pelarut air!
4. Bandingkan gelas kimia A dengan B, zat mana yang lebih lambat melarut dalam air!
242 K. Data Pengamatan
Berdasarkan percobaan, lengkapilah tabel data di bawah ini!
Pelarut Zat Terlarut Jumlah zat terlarut yang dimasukan ke dalam pelarut (sampai tidak dapat larut lagi)
Air NaCl ...gr
Air CaCO3 ...gr
L. Analisis Data
1. Berapa jumlah NaCl yang ditambahkan sampai saat tidak larut lagi? Jawab :
... gram
2. Berapa jumlah CaCO3 yang ditambahkan sampai saat tidak larut lagi?
Jawab : ... gram
3. Pada penambahan……….gram NaCl (jawaban 1) dan ………gram CaCO3
(jawaban 2), pelarut tidak bisa melarutkan zat terlarut lagi, keadaan demikian disebut keadaan jenuh atau larutan jenuh. Apa yang dimaksud dengan larutan jenuh?
Jawaban :
... ... ...
4. Apa yang terjadi jika ke dalam larutan NaCl atau CaCO3 jenuh tadi ditambahkan
kembali kristal NaCl atau CaCO3 lagi secara terus menerus?Apakah akan larut
atau tidak, mengapa? Jawab :
... ... ...
243 5. Apa yang dimaksud dengan kelarutan?
Jawab :
... ... ...
6. Tuliskan persamaan tetapan hasil kali kelarutan CaCO3 !
Jawab :
... ... ...
7. Tuliskan persamaan tetapan hasil kali kelarutan NaCl! Jawab : ... ... ... M. Kesimpulan ... ... ... ... ...
244
KUNCI JAWABAN LKPD PERTEMUAN I Rumusan Masalah
1. Apa yang dimaksud dengan larutan jenuh? 2. Apa yang dimaksud dengan kelarutan?
3. Bagaimana kelarutan garam dapur dan kalsium karbonat dalam air?
Hipotesis Percobaan
1. Larutan jenuh adalah suatu keadaan dimana, sejumlah zat terlarut melarut dan sebagian zat terlarut tidak melarut (atau terbentuk endapan).
2. Kelarutan adalah jumlah maksimum suatu zat yang dapat larut dalam pelarut tertentu.
3. Kelarutan garam dapur lebih besar dibanding kalsium karbonat, sehingga kalsium termasuk garam yang sukar larut.
Data Pengamatan
Berdasarkan percobaan, lengkapilah tabel data di bawah ini!
Pelarut Zat Terlarut Jumlah zat terlarut yang dimasukan ke dalam pelarut (sampai tidak dapat larut lagi)
Air NaCl 12 gr
Air CaCO3 2 gr
Analisis Data
1. Jumlah NaCl yang ditambahkan sampai saat tidak larut lagi adalah : 12 gram 2. Jumlah CaCO3 yang ditambahkan sampai saat tidak larut lagi adalah 2 gram
3. Pada penambahan 2 gram NaCl (jawaban 1) dan 12 gram CaCO3 (jawaban 2)
pelarut bisa melarutkan zat terlarut lagi, keadaan demikian disebut keadaan jenuh atau larutan jenuh. Yang dimaksud dengan larutan jenuh adalah suatu keadaan dimana, sejumlah zat terlarut melarut dan sebagian zat terlarut tidak melarut (atau terbentuk endapan).
245
4. Yang terjadi jika ke dalam larutan NaCl atau CaCO3 jenuh tadi ditambahkan
kembali kristal NaCl atau CaCO3 lagi secara terus menerus adalah kristal NaCl
atau CaCO3 tidak akan larut, karena telah melebihi batas kelarutannya dalam air.
5. Yang dimaksud dengan kelarutan adalah jumlah maksimum zat terlarut dalam pelarut tertentu.
6. Persamaan tetapan hasil kali kelarutan CaCO3 adalah:
CaCO3(s) Ca2+(aq)+ CO32-(aq)
Ksp = [Ca2+] [CO32-]
7. Persamaan tetapan hasil kali kelarutan NaCl adalah: NaCl(s) Na+(aq)+ Cl-(aq)
Ksp = [Na+] [Cl-]
Kesimpulan
1. Larutan jenuh adalah suatu keadaan dimana, sejumlah zat terlarut melarut dan sebagian zat terlarut tidak melarut (atau terbentuk endapan).
2. Kelarutan adalah jumlah maksimum zat terlarut dalam pelarut tertentu.
3. Kelarutan garam dapur lebih besar dibanding kalsium karbonat, sehingga kalsium termasuk garam yang sukar larut.
246
LEMBAR KERJA PESERTA DIDIK (LKPD) PERTEMUAN II
Nama Anggota Kelompok : ... ... ... ... ... ... A. Kompetensi Inti
1. Menghayati dan mengamalkan ajaran agama yang dianutnya.
2. Menghayati dan mengamalkan perilaku jujur, disiplin, tanggung jawab, peduli (gotong royong, kerjasama, toleran, damai), santun, responsif dan proaktif, dan menunjukan sikap sebagai bagian dari solusi atas berbagai permasalahan dalam berinteraksi secara efektif dengan lingkungan sosial dan alam serta dalam menempatkan diri sebagai cerminan bangsa dalam pergaulan dunia.
3. Memahami, menerapkan, dan menganalisis pengetahuan faktual, konseptual, prosedural, dan metakognitif berdasarkan rasa ingin tahunya tentang ilmu
pengetahuan, teknologi, seni, budaya, dan humaniora dengan wawasan kemanusiaan, kebangsaan, kenegaraan, dan peradaban terkait penyebab fenomena dan kejadian, serta menerapkan pengetahuan prosedural pada bidang kajian yang spesifik sesuai dengan bakat dan minatnya untuk memecahkan masalah.
4. Mengolah, menalar, dan menyaji dalam ranah konkret dan ranah abstrak terkait dengan pengembangan dari yang dipelajarinya di sekolah secara mandiri, bertindak secara efektif dan kreatif, serta mampu menggunakan metoda sesuai kaidah keilmuan.
247 B. Kompetensi Dasar
3.14 Memprediksi terbentuknya endapan dari suatu reaksi berdasarkan prinsip kelarutan dan data hasil kali kelarutan.
C. Indikator 4. Kognitif
c) Produk
Siswa mampu :
3.14.3 Menjelaskan tiga kemungkinan yang akan terjadi jika dua larutan
elektrolit dicampurkan.
3.14.4 Memprediksi terbentuknya endapan dari suatu reaksi berdasarkan
prinsip kelarutan dan data hasil kali kelarutan
d) Proses
Siswa mampu :
4.14.6 Merumuskan masalah dari percobaan tentang memprediksi
terjadinya endapan.
4.14.7 Merumuskan hipotesis percobaan tentang memprediksi terjadinya
endapan.
4.14.8 Mencatat data hasil pengamatan dari percobaan tentang
memprediksi terjadinya endapan.
4.14.9 Menganalisis data hasil pengamatan dari percobaan tentang
memprediksi terjadinya endapan.
4.14.10 Menarik kesimpulan dari percobaan tentang mengukur
memprediksi terjadinya endapan.
5. Psikomotor
4.13.4 Menunjukkan keterampilan dalam persiapan percobaan tentang memprediksi terjadinya endapan.
248
4.13.5 Menunjukkan keterampilan dalam pelaksanaan percobaan tentang memprediksi terjadinya endapan.
4.13.6 Menunjukkan keterampilan dalam kegiatan akhir percobaan tentang memprediksi terjadinya endapan.
6. Afektif
c) Perilaku berkarakter
Rasa ingin tahu, jujur, ulet, teliti, tanggung jawab, kerjasama, santun, toleransi dan peduli lingkungan dalam melakukan percobaan dan berdiskusi. d) Keterampilan sosial
Perilaku proaktif dalam memecahkan masalah di awal hingga akhir dengan langkah yang benar.
D. Judul
Memperkirakan terjadinya endapan
E. Dasar Teori
Harga Ksp suatu elektrolit dapat digunakan untuk memperkirakan apakah elektrolit
tersebut dapat larut atau mengendap dalam suatu larutan. Semakin besar harga Ksp
suatu senyawa, maka semakin mudah larut senyawa tersebut. Dengan membandingkan harga Ksp dengan harga hasil kali konsentrasi ion-ion (Qsp) yang ada
dalam larutan yang dipangkatkan dengan koefisien reaksi masing-masing, maka ada tiga kemungkinan yang akan terjadi jika dua larutan elektrolit dicampurkan, yaitu:
• Jika Qsp < Ksp, larutan belum jenuh (tidak ada endapan)
• Jika Qsp = Ksp, larutan tepat jenuh (belum ada endapan)
• Jika Qsp > Ksp, larutan lewat jenuh (ada endapan)
F. Wacana
Maya mendapat tugas dari gurunya untuk memperkirakan terjadinya endapan secara teoritis dan melakukan pengamatan secara langsung terhadap perkiraan yang dibuat, apabila dua larutan yang mengandung ion-ion yang sukar larut direaksikan. Perkiraan didasarkan kepada perhitungan konsentrasi zat yang direaksikan dan dibandingkan dengan nilai Ksp yang terdapat pada tabel berikut.
249
Senyawa PbCl2 PbI2 PbSO4 CaSO4
Ksp 2,0 x 10-5 7,1 x 10-9 1,8 x 10-8 2,0 x 10-5
Dalam percobaan tersebut, Maya membuat perkiraan seperti pada contoh di atas, kemudian melakukan eksperimen untuk menunjukkan apakah perkiraan dengan perhitungan sesuai dengan fakta percobaan.
G. Rumusan Masalah ... ... ... ... H. Hipotesis Percobaan ... ... ... ...
I. Alat dan Bahan
Alat Bahan
Tabung reaksi 10 buah Larutan Pb(NO3)2 0,1 M
Rak Tabung Reaksi 1 buah
Larutan CaCl2 0,1 M
Silinder Ukur 10 mL 2 buah
Larutan BaCl2 0,1 M
Pipet Tetes 2 buah Larutan KI 0,1 M Gelas Kimia 4 buah Larutan H2SO4 0,1 M
J. Cara Kerja
1. Masukan ke dalam tabung reaksi masing-masing 1 mL larutan Pb(NO3)2 0,1 M
dan 0,1 mL Larutan CaCl2 0,1 M. Amati perubahan apa yang terjadi! Apakah
250
2. Ulangi percobaan dengan mengganti larutan CaCl2 0,1 M dengan Larutan KI 0,1
M.
3. Lakukan eksperimen dengan kombinasi seperti pada tabel data pengamatan! 4. Untuk prosedur keempat masukan 1 mL CaCl2 0,1 M ke dalam tabung reaksi dan
1 mL H2SO4 0,1 M. Amati perubahan apa yang terjadi! Apakah larutan keruh?
K. Data Pengamatan
Berdasarkan percobaan, lengkapilah tabel data di bawah ini!
No Larutan yang direaksikan Hasil eksperimen (terjadi/tidak terjadi endapan) 1 Pb(NO3)2 dengan CaCl2 ...
2 Pb(NO3)2 dengan KI ...
3 Pb(NO3)2 dengan H2SO4 ...
4 CaCl2 dengan H2SO4 ...
L. Analisis Data
Perkirakan endapan yang terbentuk berdasarkan perhitungan dan bandingkan dengan data percobaan: 1. PbCl2 2. PbI2 3. PbSO4 4. CaSO4 Jawaban Pertanyaan: ... ... ... ... ... ... ... ... ... ... ...
251 ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... M. Kesimpulan ... ... ... ... ... ...
252
KUNCI JAWABAN LKPD PERTEMUAN II Rumusan Masalah
Bagaimana memperkirakan terbentuknya endapan dari beberapa larutan jenuh?
Hipotesis Percobaan
Untuk memperkirakan terbentuknya endapan dari suatu larutan jenuh adalah dengan membandingkan nilai Qsp dengan nilai Ksp dari larutan jenuh tersebut, dengan:
• Jika Qsp < Ksp, larutan belum jenuh (tidak ada endapan)
• Jika Qsp = Ksp, larutan tepat jenuh (belum ada endapan)
• Jika Qsp > Ksp, larutan lewat jenuh (ada endapan)
Data Pengamatan
Berdasarkan percobaan, lengkapilah tabel data di bawah ini!
No Larutan yang direaksikan Hasil eksperimen (terjadi/tidak terjadi endapan) 1 Pb(NO3)2 dengan CaCl2 Terjadi endapan
2 Pb(NO3)2 dengan KI Terjadi endapan
3 Pb(NO3)2 dengan H2SO4 Terjadi endapan
4 CaCl2 dengan H2SO4 Terjadi endapan
Analisis Data 1. PbCl2 Penyelesaian: Mol Pb2+ = V . M = 10-3 L . 10-1 M = 10-4 mol Mol Cl- = V . M = 10-3 L . 10-1 M = 10-4 mol
Konsentrasi setelah pencampuran:
[Pb2+] = mol Pb2+ / V total = 10-4 mol/2 . 10-3 L = 5 . 10-2 M [Cl-] = mol Cl- / V total = 10-4 mol/2 . 10-3 L = 5 . 10-2 M Qsp = [Pb2+] [Cl-] = (5 . 10-2) (5 . 10-2) = 2,5 . 10-3
253 Harga Ksp = 2,0 . 10-5
Harga Qsp > Ksp maka terjadi pengendapan PbCl2
Perkiraan perhitungan sesuai dengan data hasil pengamatan. 2. PbI2 Mol Pb2+ = V . M = 10-3 L . 10-1 M = 10-4 mol Mol I- = V . M = 10-3 L . 10-1 M = 10-4 mol
Konsentrasi setelah pencampuran:
[Pb2+] = mol Pb2+ / V total = 10-4 mol/2 . 10-3 L = 5 . 10-2 M [I-] = mol I- / V total = 10-4 mol/2 . 10-3 L = 5 . 10-2 M Qsp = [Pb2+] [I-] = (5 . 10-2) (5 . 10-2) = 2,5 . 10-3
Harga Ksp = 7,1 . 10-9
Harga Qsp > Ksp maka terjadi pengendapan PbI2
Perkiraan perhitungan sesuai dengan data hasil pengamatan. 3. PbSO4 Mol Pb2+ = V . M = 10-3 L . 10-1 M = 10-4 mol Mol SO42- = V . M = 10-3 L . 10-1 M = 10-4 mol
Konsentrasi setelah pencampuran:
[Pb2+] = mol Pb2+ / V total = 10-4 mol/2 . 10-3 L = 5 . 10-2 M [SO42-] = mol SO42- / V total = 10-4 mol/2 . 10-3 L = 5 . 10-2 M
Qsp = [Pb2+] [SO42-] = (5 . 10-2) (5 . 10-2) = 2,5 . 10-3
Harga Ksp = 1,8 . 10-8
254
Perkiraan perhitungan sesuai dengan data hasil pengamatan. 4. CaSO4 Mol Ca2+ = V . M = 10-3 L . 10-1 M = 10-4 mol Mol SO42- = V . M = 10-3 L . 10-1 M = 10-4 mol
Konsentrasi setelah pencampuran:
[Pb2+] = mol Ca2+ / V total = 10-4 mol/2 . 10-3 L = 5 . 10-2 M [SO42-] = mol SO42- / V total = 10-4 mol/2 . 10-3 L = 5 . 10-2 M
Qsp = [Ca2+] [SO42-] = (5 . 10-2) (5 . 10-2) = 2,5 . 10-3
Harga Ksp = 2,0 x 10-5
Harga Qsp > Ksp maka terjadi pengendapan CaSO4
Perkiraan perhitungan sesuai dengan data hasil pengamatan.
Kesimpulan
Untuk memperkirakan terbentuknya endapan dari suatu larutan jenuh adalah dengan membandingkan nilai Qsp dengan nilai Ksp dari larutan jenuh tersebut, dengan:
• Jika Qsp < Ksp, larutan belum jenuh (tidak ada endapan)
• Jika Qsp = Ksp, larutan tepat jenuh (belum ada endapan)
255 Kuis 01 1. Jelaskan apa yang dimaksud dengan kelarutan?
2. Jelaskan apa yang dimaksud dengan Ksp?
3. Tentukan hubungan antara kelarutan dan hasil kali kelarutan?
Jawaban Kuis 01
1. Kelarutan adalah jumlah maksimum suatu zat yang dapat larut dalam pelarut tertentu.
2. Ksp adalah tetapan yang menggambarkan perkalian konsentrasi ion-ion elektrolit yang
sukar larut dalam larutan jenuhnya, dipangkatkan koefisiennya masing-masing.
3. Hubungan s dan Ksp dapat dinyatakan dalam persamaan berikut:
K
sp= [A
n+]
mx [B
m-]
n =(ms)
mx (ns)
n =m
m.s
m.n
n.s
n =m
m.n
n.s
m+ns
m+n =K
spm
m.n
nS
=Ksp
m
m. n
n m +n256 Kuis 02
1. Jelaskan tiga kemungkinan yang akan terjadi jika dua larutan elektrolit dicampurkan?
2. Jelaskan pengaruh penambahan ion senama terhadap kelarutan?
Jawaban Kuis 02
1. Ada tiga kemungkinan yang akan terjadi jika dua larutan elektrolit dicampurkan, yaitu:
• Jika Qsp < Ksp, larutan belum jenuh (tidak ada endapan)
• Jika Qsp = Ksp, larutan tepat jenuh (belum ada endapan)
• Jika Qsp > Ksp, larutan lewat jenuh (ada endapan)
257
Tugas Rumah 01
1. Jelaskan apa yang dimaksud dengan kelarutan dan tetapan hasil kali kelarutan? 2. Berikut adalah gambar yang menunjukkan kelarutan beberapa zat dalam
air yang dipengaruhi oleh suhu. Mengapa kelarutan suatu zat bertambah bila suhu semakin tinggi?
3. Berikut adalah gambar yang menunjukkan pengaruh pelarut terhadap kelarutan. Mengapa senyawa nonpolar tidak larut dalam senyawa polar?
4. Tentukan persamaan tetapan hasil kali kelarutan dari masing-masing larutan jenuh berikut!
2. AgCl 3. Ag2CrO4