BAB III
METODE PENELITIAN
Penelitian ini menggunakan metode eksperimental dengan tahapan penelitian yaitu pengujian toksisitas akut secara oral terhadap mencit, pengamatan gejala toksik, berat badan, kematian, pemeriksaan makropatologi, berat organ relatif serta histopatologi hati dan ginjal mencit. Data hasil penelitian dianalisis secara statistik dengan metode one way analysis of variance (ANOVA) dilanjutkan dengan uji post hoc tukey menggunakan statistical product and service solution (SPSS) versi 17.
3.1 Alat dan Bahan
3.1.1 Alat-alat
Alat-alat yang digunakan pada penelitian ini adalah alat-alat gelas (Bomex), neraca analitik (AND), mortir dan stamfer, pipet tetes, oral sonde, seperangkat alat bedah (Wella Spencer), penangas air (Griffin), neraca hewan (Presica), spuit 1 ml (Terumo), kertas saring dan mikroskop cahaya (Boeco Germany). Alat untuk pembuatan preparat histopatologi adalah mikrotom, vakum, inkubator, cetakan, kaca objek dan kaca penutup.
3.1.2 Bahan-bahan
hematoxylin, larutan eosin, etanol 70%, etanol 80%, etanol 90%, etanol absolut, xylol, paraffin cair, cairan perekat (DPX).
3.2 Hewan Penelitian
Hewan yang digunakan dalam penelitian ini adalah mencit (Mus musculus) betina yang sehat dalam keadaan nulipara (belum pernah melahirkan) dan tidak hamil, sebanyak 20 ekor dengan berat badan 20 – 30 g. Mencit diaklimatisasi terlebih dahulu selama 14 hari di dalam kandang, diberi makan pelet dan minum air suling.
3.3 Tahap Penelitian
3.3.1 Penyiapan ekstrak etanol daun srikaya (EEDS)
Ekstrak etanol daun srikaya (EEDS) diperoleh dari penelitian sebelumnya yang berjudul uji aktivitas antioksidan ekstrak etanol daun srikaya (Annona squamosa L.) dengan metode DPPH sebagai hepatoprotektor terhadap tikus jantan
masih terdapat selapis cairan penyari, tutup perkolator, biarkan selama 24 jam. Perkolasi dihentikan jika perkolat yang keluar telah jernih (Ditjen POM, 1979). Perkolat yang diperoleh dipekatkan dengan alat penguap vakum putar (rotary evaporator) sampai sebagian besar pelarutnya menguap, dan dilanjutkan proses
penguapan di atas penangas air sampai diperoleh ekstrak kental. 3.3.2 Pembuatan suspensi Na-CMC 0,5 %
Sebanyak 0,5 g Na-CMC dimasukkan ke dalam lumpang yang telah berisi akuades panas sebanyak 1 ml, dibiarkan selama 15 menit sehingga mengembang, digerus hingga diperoleh massa yang transparan, lalu diencerkan dengan akuades, dimasukkan ke dalam wadah, cukupkan dengan akuades hingga 100 ml.
3.3.3 Pembuatan suspensi ekstrak etanol daun srikaya (EEDS)
Pengujian menggunakan 4 variasi dosis yakni dosis 5, 50, 300, 2000 dan 5000 mg/kg bb. Ditimbang EEDS sebanyak 5, 50, 300, 2000 dan 5000 mg. Masing-masing dimasukkan ke dalam lumpang dan ditambahkan suspensi Na-CMC 0,5 % b/v sedikit demi sedikit sambil digerus sampai homogen hingga 10 ml.
3.3.4 Pengujian efek toksik
Pengujian toksisitas dilakukan berdasarkan pada Peraturan Kepala Badan Pengawas Obat dan Makanan Republik Indonesia Nomor 7 Tahun 2014 tentang pedoman uji toksisitas nonklinik secara in vivo menggunakan metode fixed dose. 3.3.4.1 Penyiapan hewan uji
15 ekor di uji utama yang dibagi dalam 3 kelompok dengan masing-masing kelompok terdiri dari 5 ekor.
3.3.4.2 Uji pendahuluan
Tujuan dari uji pendahuluan adalah mencari dosis awal yang sesuai untuk uji utama. Uji pendahuluan menggunakan 5 ekor mencit yang masing-masing mencit diberikan EEDS dengan dosis yang berbeda. Mencit dipuasakan selama 3-4 jam, air minum boleh diberikan. Setelah dipuasakan, hewan ditimbang dan diberikan kontrol Na-CMC [0,5%] 50 mg/kg bb dan EEDS dalam dosis tunggal menggunakan sonde dengan masing-masing dosis 5, 50, 300 dan 2000 mg/kg bb. Setelah diberikan perlakuan, pakan boleh diberikan kembali setelah 1-2 jam. Gejala toksik dan kematian, diamati setiap 30 menit selama 4 jam dan selanjutnya diamati setiap hari selama 14 hari. Gejala toksik yang diamati meliputi, perubahan kulit, bulu dan mata, gemetar, kejang, diare, lemas, serta tingkah laku berupa jalan mundur dan jalan dengan perut. Pengamatan berat badan mencit dilakukan dengan menimbang berat badan mencit 7 kali selama 14 hari.
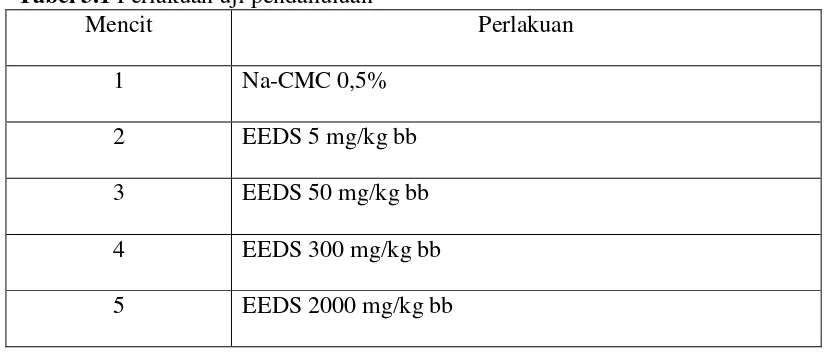
Tabel 3.1 Perlakuan uji pendahuluan
Mencit Perlakuan
1 Na-CMC 0,5%
2 EEDS 5 mg/kg bb 3 EEDS 50 mg/kg bb
3.3.4.3 Uji utama
3.3.4.4 Makropatologi organ hati dan ginjal
Organ hati, ginjal kanan dan kiri diamati secara visual yaitu mengamati warna, bentuk permukaan dan konsistensi organ. Perubahan warna menjadi salah satu parameter terjadinya efek toksik yang bertujuan mendapatkan informasi mengenai toksisitas zat uji yang berkaitan dengan organ sasaran dan efek terhadap organ tersebut (Lu,1995).
3.3.4.5 Penimbangan organ hati dan ginjal
Organ hati dan ginjal dicuci dengan natrium klorida, dikeringkan terlebih dahulu dengan kertas penyerap, kemudian ditimbang untuk mendapatkan berat organ absolut, sedangkan yang dianalisis adalah berat organ relatif, yaitu berat organ absolut dibagi berat badan.
3.3.4.6 Histopatologi hati dan ginjal
Organ hati dan ginjal hewan percobaan diambil dan dimasukkan ke dalam larutan buffer formalin 10%. Lalu dibuat preparat dan diwarnai dengan hekmatosilin dan eosin dan dilihat di bawah mikroskop. Prosedur pembuatan preparat histopatologi dilakukan berdasarkan prosedur kerja yang diterapkan di laboratorium patologi anatomi Rumah Sakit Murni Teguh.
Prosedur pembuatan preparat histopatologi:
a. Organ yang akan dibuat preparat direndam di dalam larutan dapar formalin 10% pada suhu kamar.
b. Organ yang akan dibuat preparat dipotong.
d. Dilakukan proses dehidrasi dengan etanol 70%, 80%, 90%, etanol absolut. Kemudian dilanjutkan dengan penjernihan menggunakan xilen sebanyak tiga kali selama 1 jam.
e. Proses penanaman. Caranya: sampel direndam dalam campuran xilen dan parafin cair pada suhu 60–70o C, dengan perbandingan xilen : parafin berturut-turut 3:1, 1:1, dan 1:3 masing-masing selama 2 jam.
f. Dilakukan pencetakan dan dibiarkan membeku, kemudian blok parafin dipotong dengan menggunakan alat mikrotom dengan ketebalan irisan 5-7 µm. Setelah memperoleh potongan yang bagus, potongan tersebut ditempelkan pada kaca objek. Sayatan organ yang telah menempel pada kaca objek segera diletakkan pada permukaan pemanas dengan suhu 56 - 58° C selama kurang lebih 10 detik, sehingga organ meregang dan menempel pada kaca objek sambil diatur jangan sampai organ berkerut atau melipat. Selanjutnya preparat disimpan dalam suhu kamar untuk dilakukan pewarnaan.
dimasukkan kedalam xilen selama 12 menit. Preparat diamati di bawah mikroskop.
3.3.5 Analisis data
BAB IV
HASIL DAN PEMBAHASAN
Sampel uji yang digunakan pada penelitian adalah ekstrak etanol daun srikaya (Annona squamosa L.). Uji toksisitas akut dilakukan karena beberapa hasil penelitian menunjukkan bahwa daun srikaya dapat digunakan sebagai antidiabetes (Gupta, et al., 2005), antioksidan dan antibakteri (El-Chaghaby, et al., 2014), hepatoprotektor (Raj, et al., 2009), antihiperlipidemia (Rofida, et al., 2015), aktivitas sitotoksik (Meiningrum, 2012) dan pada penelitian Utami dan Adelina (2016) menunjukan bahwa ekstrak etanol daun srikaya memiliki nilai IC50 sebesar 29,27 µg/ml yang merupakan kategori antioksidan sangat kuat serta efektif sebagai hepatoprotektor. Berdasarkan penjelasan di atas, maka daun srikaya akan memiliki manfaat yang besar bagi manusia. Sehingga uji toksisitas ini perlu dilakukan untuk mengetahui tingkat keamanan dari tumbuhan tersebut.
Pengujian toksisitas akut ekstrak etanol daun srikaya (EEDS), dilakukan terhadap mencit betina berdasarkan pada “Peraturan Kepala Badan Pengawas Obat dan Makanan Republik Indonesia Nomor 7 Tahun 2014 tentang Pedoman Uji Toksisitas Nonklinik Secara In Vivo” dengan menggunakan metode fixed dose. Mencit betina yang digunakan dalam keadaan nulipara (belum pernah
yaitu 5, 50, 300, 2000 mg/kg bb dan pada uji utama digunakan dosis 2000 dan 5000 mg/kg bb. Pengamatan dilakukan selama 14 hari baik secara kualitatif maupun kuantitatif, meliputi pengamatan gejala toksik, berat badan, kematian hewan, serta pemeriksaan makropatologi dan histopatologi hati dan ginjal mencit.
4.1 Uji Pendahuluan
4.1.1 Hasil pengamatan gejala toksik
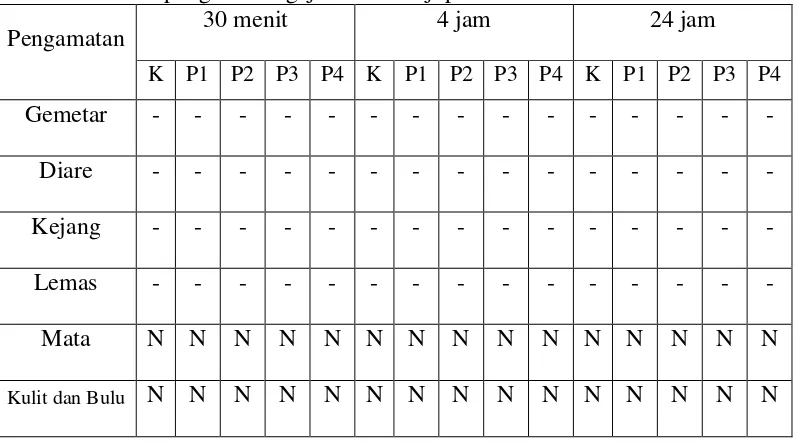
Pengamatan terhadap gejala toksik dilakukan pada setiap kelompok dan dibandingkan dengan kontrol. Hewan diamati setiap 30 menit selama 4 jam dan selanjutnya diamati setiap hari selama 14 hari. Gejala toksik yang diamati meliputi perubahan kulit, bulu dan mata, gemetar, kejang, diare, lemas serta tingkah laku berupa jalan mundur dan jalan dengan perut. Tujuan dari uji pendahuluan ini adalah mencari dosis awal yang sesuai untuk uji utama (BPOM, 2014). Hasil pengamatan dapat dilihat pada Tabel 4.1.
Tabel 4.1 Hasil pengamatan gejala toksik uji pendahuluan
Pengamatan 30 menit 4 jam 24 jam
K P1 P2 P3 P4 K P1 P2 P3 P4 K P1 P2 P3 P4
Gemetar - - - - Diare - - - - Kejang - - - - Lemas - - - - Mata N N N N N N N N N N N N N N N
Pengamatan
30 menit 4 jam 24 jam
K P1 P2 P3 P4 K P1 P2 P3 P4 K P1 P2 P3 P4
Jalan Perut - - - - Jalan Mundur - - - -
Pengamatan 48 jam 1 minggu 2 minggu
K P1 P2 P3 P4 K P1 P2 P3 P4 K P1 P2 P3 P4
Gemetar - - - - Diare - - - -
Kejang - - - - Lemas - - - - Mata N N N N N N N N N N N N N N N
Kulit dan Bulu N N N N N N N N N N N N N N N
Jalan Perut - - - - Jalan Mundur - - - - Keterangan: K= kontrol; P1= dosis 5 mg/kg bb; P2= dosis 50 mg/kg bb; P3= dosis
300 mg/kg bb; P4= dosis 2000 mg/kg bb; N= normal ; (-) = tidak terjadi; (+) = terjadi
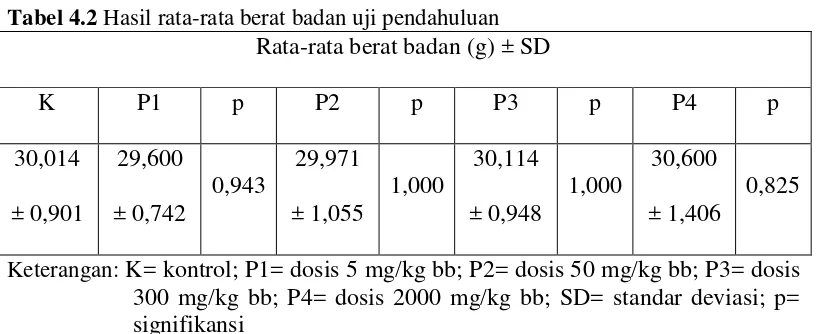
4.1.2 Hasil pengamatan berat badan
Berat badan masing-masing hewan dimonitor pada saat sebelum diberikan
EEDS dan setelah diberikaan EEDS. Penimbangan berat badan dilakukan sebanyak 7
kali dalam 14 hari. Perubahan berat badan dianalisis menggunakan statistical
product and service solution (SPSS) versi 17. Hasil pengamatan berat badan dapat
dilihat pada Tabel 4.2.
Tabel 4.2 Hasil rata-rata berat badan uji pendahuluan Rata-rata berat badan (g) ± SD
Keterangan: K= kontrol; P1= dosis 5 mg/kg bb; P2= dosis 50 mg/kg bb; P3= dosis 300 mg/kg bb; P4= dosis 2000 mg/kg bb; SD= standar deviasi; p= signifikansi
Berdasarkan hasil analisis secara statistik rata–rata berat badan mencit menggunakan uji one way anova pada Tabel 4.2 di atas menunjukkan bahwa tidak ada perbedaan yang signifikan kenaikan atapun penurunan berat badan mencit antara kelompok kontrol dan kelompok perlakuan dengan pemberian EEDS yaitu dengan tingkat p > 0,05.
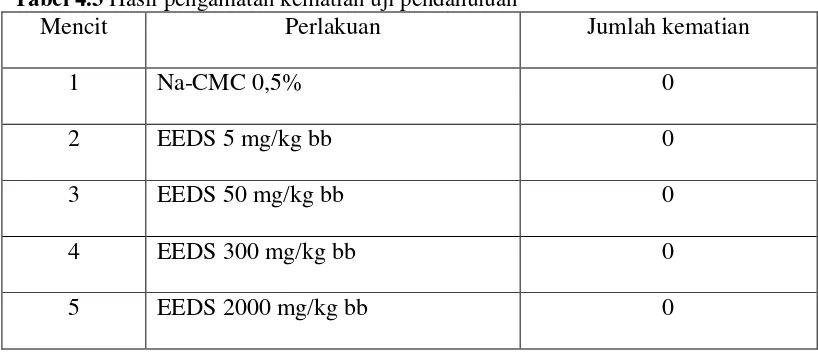
4.1.3 Hasil pengamatan kematian hewan
Jumlah kematian hewan selama 14 hari pada uji pendahuluan dapat dilihat
pada Tabel 4.3.
Tabel 4.3 Hasil pengamatan kematian uji pendahuluan
Mencit Perlakuan Jumlah kematian
1 Na-CMC 0,5% 0
2 EEDS 5 mg/kg bb 0
3 EEDS 50 mg/kg bb 0
4 EEDS 300 mg/kg bb 0
5 EEDS 2000 mg/kg bb 0
Berdasarkan Tabel 4.3 menunjukkan bahwa dengan pemberian EEDS dosis
tunggal secara oral sampai dengan dosis 2000 mg/kg bb tidak menimbulkan kematian
pada mencit.
Berdasarkan hasil uji pendahuluan di atas, baik dari hasil pengamatan gejala toksik, berat badan dan juga kematian, menunjukkan bahwa hingga pada dosis tertinggi yaitu 2000 mg/kg bb, hewan tidak mengalami kematian ataupun menunjukkan gejala toksik, sehingga pada uji utama dosis awal yang digunakan adalah dosis tertinggi dari uji pendahuluan yaitu dosis 2000 dan dilanjutkan dengan dosis 5000 mg/kg bb.
4.2 Uji Utama
4.2.1 Hasil pengamatan gejala toksik
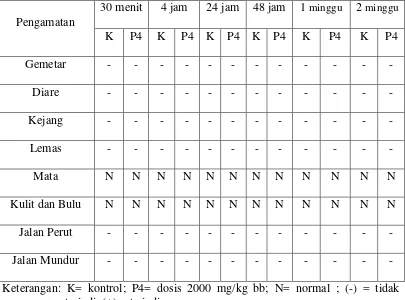
awal yang digunakan pada uji utama adalah dosis 2000 mg/kg bb. Pengujian tidak diteruskan pada dosis selanjutnya sampai diketahui apakah hewan masih bertahan hidup atau mati (BPOM, 2014). Hasil pengamatan gejala toksik dan kematian pada dosis 2000 mg/kg bb dapat dilihat pada Tabel 4.4.
Tabel 4.4 Hasil pengamatan gejala toksik uji utama dosis 2000 mg/kg bb
Pengamatan
Pengamatan terhadap gejala toksik dilakukan pada setiap kelompok dan dibandingkan dengan kontrol. Hewan diamati setiap 30 menit selama 4 jam dan selanjutnya diamati setiap hari selama 14 hari. Gejala toksik yang diamati meliputi perubahan kulit, bulu dan mata, gemetar, kejang, diare, lemas, serta tingkah laku berupa jalan mundur dan jalan dengan perut.
hewan kontrol yang tidak diberikan EEDS. Setelah 24 jam dan 48 jam pengujian, tidak menunjukkan gejala toksik. Karena setelah 48 jam kelompok hewan dosis 2000 mg/kg bb tidak menunjukkan gejala toksik, maka pada hari tersebut dilakukan pemberian ekstrak pada 5 ekor mencit lainnya dengan dosis 5000 mg/kg bb. Secara umum terdapat 3 pilihan yang akan diambil dalam uji utama, yaitu menghentikan uji, melanjutkan uji dengan dosis yang lebih tinggi atau melanjutkan uji dengan dosis yang lebih rendah (BPOM, 2014).
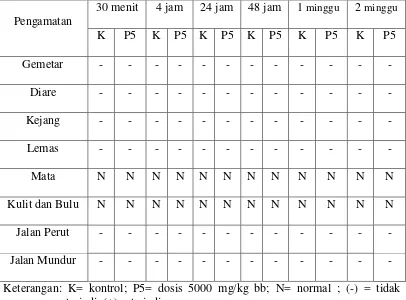
Hasil pengamatan gejala toksik pada dosis 5000 mg/kg bb dapat dilihat pada Tabel 4.5.
Tabel 4.5 Hasil pengamatan gejala toksik uji utama dosis 5000 mg/kg bb
Pengamatan
30 menit 4 jam 24 jam 48 jam 1 minggu 2 minggu
K P5 K P5 K P5 K P5 K P5 K P5
Gemetar - - - -
Diare - - - -
Kejang - - - -
Lemas - - - -
Mata N N N N N N N N N N N N
Kulit dan Bulu N N N N N N N N N N N N Jalan Perut - - - - Jalan Mundur - - - - Keterangan: K= kontrol; P5= dosis 5000 mg/kg bb; N= normal ; (-) = tidak
Pengamatan terhadap gejala toksik yang dilakukan pada kelompok hewan dosis 5000 mg/kg bb sama dengan pengamatan pada kelompok hewan dosis 2000 mg/kg bb sebelumnya. Hasil pengamatan yang didapatkan dibandingkan dengan kontrol. Hewan diamati setiap 30 menit selama 4 jam dan selanjutnya diamati setiap hari selama 14 hari. Gejala toksik yang diamati meliputi perubahan kulit, bulu dan mata, gemetar, kejang, diare, lemas, serta tingkah laku berupa jalan mundur dan jalan dengan perut.
Berdasarkan Tabel 4.5 menunjukkan bahwa dosis 5000 mg/kg bb pada 4 jam pertama hewan beraktivitas normal dan tidak terjadi gejala toksik seperti hewan kontrol yang tidak diberikan EEDS. Setelah 24 jam dan 48 jam pengujian tidak terdapat gejala toksik dan sampai hari ke 14 hewan masih dalam keadaan normal.
lebih dari 5 kali sehari, maka hewan harus dibunuh; tremor atau gemetar menunjukkan otot berkedut atau gerakan kulit yang cepat; diare berupa feses yang berair atau berdarah (disentri).
4.2.2 Hasil pengamatan berat badan
Berat badan masing-masing hewan dimonitor pada saat sebelum diberikan
ekstrak dan setelah diberikaan ekstrak. Penimbangan berat badan dilakukan sebanyak
7 kali dalam 14 hari. Perubahan berat badan dianalisis menggunakan statistical
product and service solution (SPSS) versi 17. Hasil pengamatan berat badan dapat
dilihat pada Tabel 4.6.
Tabel 4.6 Hasil rata-rata berat badan uji utama
Rata-rata berat badan (g) ± SD
K P4 p P5 p
28,911 ± 3,611 27,831 ± 2,554 0,260 28,486 ± 2,249 0,809
Keterangan: K= kontrol; P4= dosis 2000 mg/kg bb; P5= dosis 5000 mg/kg bb; SD= standar deviasi; p= signifikansi
Berdasarkan hasil analisis secara statistik rata–rata berat badan mencit menggunakan uji one way anova pada Tabel 4.6 di atas menunjukkan bahwa tidak ada perbedaan yang signifikan kenaikan atapun penurunan berat badan mencit antara kelompok kontrol dan kelompok perlakuan dengan pemberian EEDS yaitu dengan tingkat p > 0,05.
4.2.3 Hasil pengamatan kematian hewan
Jumlah kematian hewan selama 14 hari pada uji utama dapat dilihat pada
Tabel 4.7.
Tabel 4.7 Hasil pengamatan kematian uji utama
Kelompok Perlakuan Jumlah kematian
I Na-CMC 0,5% 0
II EEDS 2000 mg/kg bb 0
III EEDS 5000 mg/kg bb 0
Berdasarkan Tabel 4.7 menunjukkan bahwa dengan pemberian EEDS dosis tunggal secara oral sampai dengan dosis 5000 mg/kg bb tidak menimbulkan kematian pada mencit. Kematian yaitu keadaan sekarat atau ketidakmampuan untuk bertahan hidup, bahkan jika dirawat (OECD, 2000).
Berdasarkan hasil pengamatan pada uji utama menunjukkan bahwa pada dosis 2000 mg/kg bb EEDS tidak menyebabkan kematian ataupun gejala toksik terhadap mencit, dimana menurut kategori globally harmonized classification system for chemical substances and mixtures (GHS) dosis tersebut termasuk dalam kategori 5 atau tidak terklasifikasi. Hingga pada dosis 5000 mg/kg bb, hewan uji masih dalam keadaan normal, sehingga dapat disimpulkan bahwa pemberian EEDS secara oral dengan dosis ≤ 5000 mg/kg bb aman, namun tidak
4.3 Hasil Pengamatan Makropatologi Organ Hati dan Ginjal
Pada hari ke 15 dilakukan pembedahan terhadap hewan uji untuk mengamati organ hati dan ginjal mencit setelah diberikan EEDS dan dibandingkan dengan hewan kontrol. Hal ini dilakukan untuk mengamati patologi yang muncul pada organ hati dan ginjal ketika diamati secara makroskopis ataupun mikroskopis akibat pemberian EEDS.
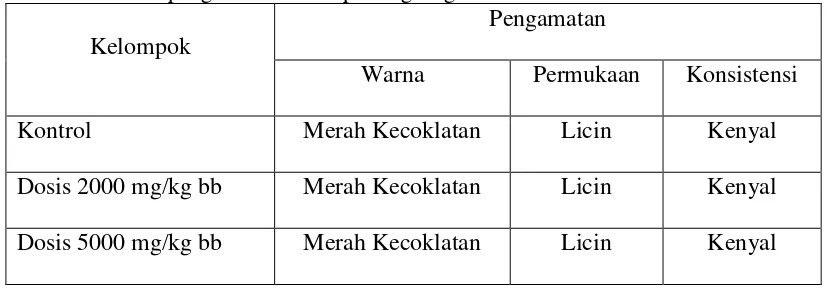
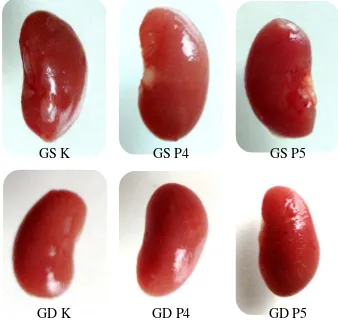
Perubahan warna menjadi salah satu parameter terjadinya efek toksik yang bertujuan mendapatkan informasi mengenai toksisitas zat uji yang berkaitan dengan organ sasaran dan efek terhadap organ tersebut (Lu, 1995). Hasil pengamatan makropatologi organ hati dan ginjal dapat dilihat pada Gambar 4.1 dan 4.2 serta Tabel 4.8 dan 3.9.
Gambar 4.1 Makropatologi organ hati, HK= hati kontrol; HP4= hati dosis 2000 mg/kg bb; HP5= hati dosis 5000 mg/kg bb
Tabel 4.8 Hasil pengamatan makropatologi organ hati
Kelompok
Pengamatan
Warna Permukaan Konsistensi
Kontrol Merah Kecoklatan Licin Kenyal
Dosis 2000 mg/kg bb Merah Kecoklatan Licin Kenyal Dosis 5000 mg/kg bb Merah Kecoklatan Licin Kenyal
Gambar 4.2. Makropatologi organ ginjal, GSK= ginjal kiri kontrol; GSP4= ginjal kiri dosis 2000 mg/kg bb; GSP5= ginjal kiri dosis 5000 mg/kg bb; GDK= ginjal kanan kontrol; GDP4= ginjal kanan dosis 2000 mg/kg bb; GDP5= ginjal kanan dosis 5000 mg/kg bb
Tabel 4.9 Hasil pengamatan makropatologi ginjal kiri dan kanan
Kelompok
Pengamatan
Warna Permukaan Konsistensi
Kontrol Merah Kecoklatan Licin Kenyal
Dosis 2000 mg/kg bb Merah Kecoklatan Licin Kenyal
Dosis 5000 mg/kg bb Merah Kecoklatan Licin Kenyal
Pengamatan makropatologi organ hati dan ginjal mencit meliputi warna, permukaan dan konsistensi (Anggraini, 2008). Berdasarkan hasil pengamatan makropatologi organ pada Tabel 4.8 dan 4.9 di atas, tidak terlihat adanya
GS K
GS P4
GS P5
perubahan warna, struktur permukaan ataupun konsistensi dari organ hati dan ginjal pada semua kelompok uji. Pada kelompok dosis 2000 dan 5000 mg/kg bb, organ hati dan ginjal terlihat memiliki warna merah kecoklatan, permukaan licin dan konsistensi yang kenyal tidak terlihat perbedaan dengan kelompok kontrol.
Organ hati dan ginjal yang normal berwarna merah kecoklatan, permukaannya licin dan konsistensinya kenyal. Warna merah kecoklatan menunjukkan bahwa aliran darah pada organ hati dan ginjal dalam keadaan normal. Ginjal diperfusi oleh sekitar 1200 ml darah permenit-suatu volume yang sama dengan 20% sampai 25% curah jantung (5000 ml per menit) (Price, 2005).
Pengamatan pada organ hati dilakukan karena hati merupakan organ terbesar dan secara metabolisme paling kompleks di dalam tubuh. Organ ini terlibat dalam metabolisme zat makanan dan sebagian besar obat dan toksikan. Sedangkan pengamatan organ ginjal dilakukan karena ginjal merupakan organ yang memproduksi urin yang merupakan jalur utama ekskresi sebagian besar toksikan. Akibatnya, ginjal mempunyai volume aliran darah yang tinggi, mengkonsentrasi toksikan pada filtrat, membawa toksikan melalui sel tubulus dan mengaktifkan toksikan tertentu. Karenanya, ginjal adalah organ sasaran utama dari efek toksik (Lu, 1995).
4.4 Hasil Berat Organ Relatif Hati dan Ginjal
Tabel 4.10 Hasil berat organ relatif per 100 g berat badan Organ
Rata-rata berat organ relatif per 100 g ± SD
K P4 p P5 p
Berdasarkan hasil berat organ relatif hati dan ginjal mencit pada Tabel 4.10 yang dianalisis secara statistik menggunakan uji one way anova menunjukkan tidak ada perbedaan yang signifikan berat organ relatif hati dan ginjal mencit antara kelompok kontrol dan kelompok uji setelah pemberian EEDS dengan tingkat signifikansi p = 0,435 (p > 0,05) untuk organ hati, p = 0,594 (p > 0,05) untuk ginjal kanan dan p = 0,869 untuk ginjal kiri (p > 0,05), dengan demikian dapat dinyatakan bahwa pemberian EEDS dosis tunggal secara oral tidak berpengaruh terhadap perbandingan berat organ hati, ginjal kiri dan ginjal kanan dengan berat badan.
4.5 Hasil Pengamatan Histopatologi Hati dan Ginjal
K
P4
Gambar 4.3 Histopatologi hati (perbesaran 10 x 10)
a b
c a
b
P5
Gambar 4.3 (lanjutan), a. vena sentralis normal; b. hepatosit normal; c. sinusoid normal; d. hepatosit nekrosis; K= kontrol; P4= dosisi 2000 mg/kg bb; P5= dosis 5000 mg/kg bb
Berdasarkan hasil pengamatan histopatologi hati pada Gambar 4.3, pada kelompok kontrol, vena sentralis merupakan sebuah pembuluh vena yang dikelilingi oleh sel endothelium yang tersusun rapat dan terletak pada pusat lobulus dengan hepatosit tersusun secara teratur ke arah vena sentralis. Hepatosit memiliki sitoplasma yang masih utuh dengan nukleus yang bulat. Di sepanjang hepatosit terdapat sinusoid tempat mengalirkan darah yang akan ditampung oleh vena sentralis (Leeson, 1989). Pada kelompok dosis 2000 mg/kg bb, hasil pengamatan menunjukkan keadaan yang tidak berbeda dengan kelompok kontrol. Tidak terjadi degenerasi hidropik, nekrosis ataupun pelebaran sinusoid. Sehingga dapat dikatakan bahwa jaringan hati kelompok 2000 mg/kg bb dalam keadaan normal. Sedangkan pada kelompok 5000 mg/kg bb terlihat adanya indikasi
a d
kerusakan jaringan hati yang ditandai dengan terjadinya degenerasi hidropik dan juga nekrosis hepatosit.
Degenerasi hidropik merupakan pertanda awal terjadinya kerusakan hati akibat toksin dan kerusakan non fatal yang bersifat reversible dan sel dapat normal kembali apabila penyebabnya dihilangkan (Winarsih, 2012). Pada inti sel hepatosit, sel hati telah mengalami nekrosis setelah terjadinya degenerasi hidropik, yaitu ditandai dengan pecahnya membran plasma sehingga menyebabkan inti sel keluar dan menumpuk kemudian berwarna kehitaman (inti piknotik) yang dapat dilihat pada gambar. Nekrosis hati adalah kematian hepatosit. Nekrosis dapat bersifat fokal (sentral, pertengahan, perifer) atau masif. Biasanya nekrosis merupakan kerusakan akut. Nekrosis hati merupakan suatu manifestasi toksik yang berbahaya tetapi tidak selalu kritis karena hati mempunyai kapasistas pertumbuhan kembali yang luar biasa (Lu, 1995).
K
Gambar 4.4 Histopatologi ginjal (perbesaran 10 x 10)
b c
P4
P5
Gambar 4.4 (lanjutan), a. glomerulus normal; b. tubulus proksimal normal; c.tubulus distal normal; d. pelebaran ruang Bowman; e. pelebaran lumen tubulus; K= kontrol; P4 = dosis 2000 mg/kg bb ; P5 = dosis 5000 mg/kg bb
b c
a
Berdasarkan hasil pengamatan histopatologi ginjal pada Gambar 4.4, diperoleh bahwa kelompok kontrol dan dosis 2000 mg/kg bb memiliki jaringan ginjal yang terlihat normal, tidak terjadi pelebaran ruang Bowman, pelebaran lumen tubulus ataupun nekrosis. Sedangkan pada kelompok dosis 5000 mg/kg bb, terlihat terjadi pelebaran ruang Bowman dan pelebaran lumen tubulus.
Pelebaran ruang Bowman diakibatkan atrofi glomerulus, yaitu menurunnya ukuran jaringan yang disebabkan oleh berkurangnya jumlah sel atau berkurangnya ukuran sel yang mungkin terjadi karena lambatnya sirkulasi atau terjadi kekurangan oksigen di jaringan (hipoksia) (Al-Tameemi, 2016). Kerusakan ini menyebabkan terganggunya proses filtrasi darah. Jika kemampuan menyaring darah berkurang, maka sel darah dan protein dapat keluar bersama urin atau malah tertimbun pada tubulus karena dapat lolos pada proses filtrasi (Hasnisa, dkk., 2014).
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan penelitian yang telah dilakukan, maka dapat disimpulkan bahwa ekstrak etanol daun srikaya (Annona squamosa L.) tidak memiliki potensi ketoksikan akut terhadap mencit.
5.2 Saran
a. Disarankan pada penelitian selanjutnya dilakukan pengujian toksisitas akut oral ekstrak etanol daun srikaya dengan menggunakan mencit jantan.
b. Disarankan pada penelitian selanjutnya dilakukan pengujian toksisitas akut oral ekstrak etanol daun srikaya dengan menggunakan metode lain, seperti metode Farmakope Indonesia edisi III.