BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Tumbuhan akar tuba[Derris elliptica (Roxb.)] tersebar luas di Indonesia, biasanya banyak tumbuh liar di hutan-hutan, di ladang-ladang yang sudah di tinggalkan. Tumbuhan tuba memiliki tingi 5-10 meter, ranting berwarna coklat tua, daun tersebar bertangkai pendek, memanjang sampai bulat, sisi bawah hijau keabu-abuan, kelopak berbentuk cawan,biji 1-2, biasanya berbuah pada bulan April-Desember (Sitepu, 1995).
2.1.1 Sistematika Tumbuhan
Sistematikatumbuhan akar tuba (Derris elliptica (Roxb.)) sebagai berikut(Herbarium medanense, 2016):
Kingdom : Plantae
Divisi : Spermatophyta Class : Dicotyledoneae Ordo : Fabales
Famili : Papilionaceae Genus : Derris
Spesies : Derris elliptica (Roxb). Nama Lokal : Tuba
2.1.2 Nama Daerah
2.1.3 Bagian yang Digunakan
Bagian yang digunakan adalah akar(Ryzki, 2014).
2.1.4 Penggunaan Tumbuhan
Akar tuba[Derris elliptica (Roxb.)] digunakan sebagai racun panah, racun ikan, skabicid, dan insektisida (Ryzki, 2014).
2.1.5 Kandungan Kimia Akar Tuba
Tumbuhan akar tuba ini memiliki kandungan rotenone (C23H22O6), rotenone ini sejenis racun kuat untuk ikan dan serangga (insektisida) sehingga
menyebabkan ikan atau serangga bisa dikendalikan.Serangga bisa dikendalikan baik dalam ruangan maupun diluar ruangan. Disamping rotenone sebagai bahan bio aktif utama, bio aktif lain yang terdapat pada tumbuhan akar tuba [Derris elliptica(Roxb.)] adalah deguelin, elliptone, dan toxicarol (Kardinan, 2000).Kandungan senyawa rotenone yang terdapat pada bagian akar tumbuhan tuba, yaitu 0,3-12%,rotenonerelatif aman bagi kesehatan manusia. Oleh karena itu, ikan nila yang telah diracun oleh akar tuba aman untuk di konsumsi manusia (Kardinan,2001).
2.2 Ekstraksi
simplisia asal, dengan tujuan pengobatan yang lebih terjamin (Syamsuni, 2006). Hasil ekstraksi disebut dengan ekstrak, yaitu sediaan pekat yang diperoleh dengan mengektraksi zat aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan. Simplisia yang digunakan dalam proses pembuatan ekstrak adalah bahan alamiah yang belum mengalami pengolahan apapun juga dan kecuali dinyatakan lain berupa bahan yang telah dikeringkan (DepkesRI., 2000).
Ada beberapa metode ekstraksi yang sering digunakan yaitu cara dingin dan cara panas.
2.2.1 Cara Dingin
a. Maserasi
Maserasi adalah penyarian simplisia dengan cara perendaman menggunakan pelarut disertai sesekali pengadukan pada temperatur kamar.Maserasi yang dilakukan pengadukan secara terus menerus disebut maserasikinetik sedangkan yang dilakukan panambahan ulang pelarut setelah dilakukan penyaringan terhadap maserat pertama dan seterusnya disebutremaserasi.
b. Perkolasi
2.2.2 Cara Panas
a. Refluks
Refluks adalah proses penyarian simplisia pada temperatur titik didihnya menggunakan alat dengan pendingin balik dalam waktu tertentu dimana pelarut akan terkondensasi menuju pendingin dan kembali ke labu.
b. Digesti
Digesti adalah proses penyarian dengan pengadukan kontinu pada temperatur lebih tinggi dari temperatur kamar, yaitu secara umum dilakukan pada temperatur 40-50°C.
c. Sokletasi
Sokletasi adalah proses penyarian menggunakan pelarut yang selalu baru, dilakukan dengan menggunakan alat khusus (soklet) dimana pelarut akan terkondensasi dari labu menuju pendingin, kemudian jatuh membasahi sampel. d. Infundasi
Infundasi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 90°C selama 15 menit.
e. Dekoktasi
Dekoktasi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 90°C selama 30 menit (Depkes RI., 2000).
2.3 Pestisida
tanaman pengganggu/gulma). Pestisida telah secara luas digunakan untuk tujuan memberantas hama dan penyakit tanaman dalam bidang pertanian. Pestisida juga digunakan dirumah tangga untuk memberantas nyamuk, lalat, kecoa, dan berbagai serangga penganggu lainnya, akan tetapi pestisida ini secara nyata banyak menimbulkan keracunan pada makhluk hidup. Bermacam jenis pestisida telah diproduksi dengan usaha mengurangi efek samping yang dapat menyebabkan berkurangnya daya toksisitas pada manusia, tetapi sangat toksik pada serangga. Bila dihubungkan dengan pelestarian lingkungan maka penggunaan pestisida perlu diwaspadai karena akan membahayakan kesehatan bagi manusia maupun makhluk hidup lainnya (Djunaedy, 2009).
Penggunaan pestisida kimia yang berlebihan akan meningkatkan biaya pengendalian, mempertinggi kematian organisme non target serta dapat menurunkan kualitas lingkungan. Oleh karena itu penggunaan pestisida alami merupakan alternatif yang saat ini digunakan untuk mengurangi dampak pestisida kimia terhadap lingkungan sebagai contoh akar tuba [Derris elliptica(Roxb.)](Kardinan, 2005).
Pestisidayangmasuk dalam jumlah besar dapat bersifat racun bagi biota yanghidup di perairan, misalnyaikan-ikan. Pestisida secara langsung maupun tidak langsung akan menganggu kualitas air sehingga kelangsungan hidup dan pertumbuhan ikan juga akan terganggu (Rudiyanti dan Ekasari, 2009).
kulit akar mindi, biji srikaya, biji mahoni, daun sirsak, akartuba, dan juga berbagai jenis gulma sepertibabandotan (Samsudin, 2008).
Pestisida nabati adalah pestisida yang bahan aktifnya berasal dari tumbuhan yang berkhasiat mengendalikan seranganhama. Cara kerja pestisida nabati sangat spesifik (Djojosumartono, 2004):
- Merusak perkembangan telur, larva, dan pupa, - Menghambat pergantian kulit,
- Mengganggu komunikasi serangga, - Menyebabkan serangga menolak makan, - Menghambat reproduksi serangga betina, - Mengurangi nafsu makan,
- Memblokir kemampuan makan serangga, - Mengusir serangga, dan
- Menghambat perkembangan patogen penyakit.
Pestisida alami merupakan hasil ekstraksi bagian tertentu dari tanaman baik dari daun, buah, biji, atau akar yang memiliki senyawa atau metabolit sekunder dan memiliki sifat racun terhadap hama dan penyakit tertentu (Djunaedy, 2009).Meskipun disebut ramah lingkungan, tidak berarti pestisida alami memiliki daya racun (toksisitas) yang rendah.Beberapa jenis pestisida botani seperti nikotin, memiliki daya racun yang lebih tinggi dibandingkan dengan pestisida sintetis, terutama jika termakan.Dengan demikian penggunaan pestisida alami juga perlu diperhatikan toksisitasnya terhadap organisme non sasaran (Novizan, 2004).
2.4 Keracunan Pestisida
potensiuntuk dapat menimbulkan dampak yang tidak diinginkan. Tercemarnya tanah, air, udara dan unsur lingkungan lainnya olehpestisida, dapat berpengaruh buruk secara langsung maupuntidak langsung terhadap manusia dan kelestarian lingkunganhidup.Pencemaran lingkungan pada umumnya terjadi karenapenanganan pestisida yang tidak tepat dan sifat fisiko kimiapestisidanya (Suprapti, 2011).
Bahan-bahan racun pestisida masuk ke dalam tubuh organisme (jasad hidup) berbeda-beda menurut situasi paparan. Mekanisme masuknya racun pestisida tersebut dapat melalui melalui kulit luar, mulut dan saluran makanan, serta melalui saluran pernapasan.Melalui kulit, bahan racun dapat memasuki pori-pori atau terserap langsung ke dalam sistem tubuh, terutama bahan yang larut minyak (polar).Keracunan ini menimbulkan gejala keracunan setelah waktu yang relatif lama karena kemampuannya menumpuk (akumulasi) dalam lemak yang terkandung dalam tubuh. Racun ini juga apabila mencemari lingkungan (air, tanah) akan meninggalkan residu yang sangat sulit untuk dirombak atau dirubah menjadi zat yang tidak beracun karena kuatnya ikatan kimianya. Demikian pula halnya, ada yang dapat terurai di dalam tubuh manusia atau hewan tapi menghasilkan metabolit yang juga masihberacun (Ngatidjan, 2006).
tidak terjadi seketika itu juga, melainkan sedikit demi sedikit.Sisa yang tertinggal inilah yang kemudian diserap sebagai residu.Jumlah residu pestisida dipengaruhi oleh suhu, kelembaban, jasad renik, sinar matahari, dan jenis dari pestisida tersebut (Pohan, 2004).
Pengaruh secara langsung maupun secara tidak langsung akibat adanya pencemaran pestisida akan mengganggu kualitas air, sehingga kelangsungan hidup dan pertumbuhan ikan juga akan terganggu. Pengaruh secara langsung disebabkan oleh akumulasi pestisida dalam organ-organ tubuh akibat tertelan bersama-sama makanan yang terkontaminasi, atau akibat rusaknya organ-organ pernafasan sehingga dapat mematikan ikan budidaya dalam jangka waktu tertentu, sedangkan secara tidak langsung adalah menurunnya kekebalan tubuh terhadap penyakit dan terhambatnya pertumbuhan ikan (Mega dan Abdulgani, 2013).
2.5 Kualitas Air
Air merupakan media vital bagi kehidupan ikan. Suplai air yang memadai
akan memecahkan masalah dalam budidaya ikan secara intensif, yaitu dengan menghanyutkan berbagai kumpulan dari bahan buangan dan bahan beracun sehingga kondisi air optimal untuk pemeliharaan. Selain jumlah air yang tersedia, kualitas air memenuhi syarat adalah salah satu kunci keberhasilan budidaya ikan. Kemampuan ikan untuk mengonsumsi oksigen dipengaruhi oleh toleransi ikan terhadap stres, temperatur/suhu air, pH, dan konsentrasi CO2 serta sisa metabolism lain seperti amoniak (Taurusman, 1996).
perairan yang semakin tinggi akan menyebabkan metabolisme ikan yang semakin meningkat dan berakibat meningkatnya kadar amoniak dalam air (Puspowardoyo dan Abbas, 1992).
Cara terbaik untuk menjamin kadar oksigen terlarut dalam air tetap tinggi adalah dengan mempertahankan air tetap bersuhu rendah, mengganti air dalam wadah dengan air yang baru serta mempertahankan oksigen melalui proses difusi yang cukup, yaitu dengan aerasi yang menimbulkan gerakan air yang sedang atau tidak terlalu keras (Huet, 1994).
2.5.1 Parameter Kualitas Air
Untuk menghindari terjadinya wabah penyakit akibat kualitas air yang tidakbaik, sebaiknya air yang akan dimanfaatkan untuk memelihara ikan dianalisis terlebihdahulu. Pemeriksaan air ditujukan terhadap sifat fisika, kimia, dan keadaan biota airlainnya, khususnya makhluk hidup yang berpotensi mengganggu kehidupan ikan, baikberupa pemangsa (predator), pesaing (kompetitor) ataupun jasad penyebab penyakit(patogen). Dengan demikian, air yang digunakan benar-benar sesuai bagi kehidupanikan yang akan dipelihara (Daelami, 2001).
1. Oksigen terlarut
Oksigen diperlukanikan untuk respirasi dan metabolisme dalam tubuh ikanuntuk aktivitas berenang, pertumbuhan, reproduksi dan lain-lain. Dalam pengelolaan kesehatan ikan sangat pentingkarena kondisi yang kurang optimal untuk pertumbuhan dan perkembangan dapat mengakibatkan ikan stres sehingga mudah terserang penyakit (Suciptodan Prihartono, 2005).
2. Suhu
berakibat kurang baik bagikehidupan ikan.Perubahan suhu ini dampaknya akan tampak jelas terutama bilaterjadi perubahan dari dingin ke panas. Dampak yang jelas terlihat adalah stressdengan gejala ikan berenang melonjak-lonjak, mengapung dan bernafas dipermukaan, serta terjadi kematian bila hal tersebut berlangsung relatif lama.Kisaran suhu yang baik bagi kepentingan budidaya ikan adalah antara 25-320C.Kisaran suhu ini umumnya terjadi di daerah beriklim tropis, seperti Indonesia.
3. Derajat keasaman (pH)
Keadaan pH yang dapat mengganggu kehidupan ikan adalah pH yang terlalurendah (sangat asam) atau sebaliknya terlalu tinggi (sangat basa). Setiap jenisikan akan memperlihatkan respon yang berbeda terhadap perubahan pH dandampak yang ditimbulkannya berbeda (Daelami, 2001).
4. Amoniak
Amonia diperairanberasal dari hasil pemecahan nitrogenorganik
(protein danurea) dan nitrogen anorganik yang terdapat dalam tanah dan air, berasal daridekomposisi bahan organik (biota akuatik yang telah mati) yang dilakukan olehmikroba dan jamur yang dikenal dengan istilah amonifikasi.
2.6 Mortalitas
2.7 Toksisitas
Toksisitas adalah daya racun yang berarti kemampuan suatu bahan atau zat yang menyebabkan keracunan. Toksikan adalah bahan atau agent yang mampu menghasilkan efek merugikan pada sistem biologi yang akan menyebabkan kematian. Beberapa toksikan yang disebutkan seperti pestisida, klorin, limbah industri yang bersifat racun dan karsinogenik (Koeman, 1983).
Uji toksisitas merupakan uji hayati yang berguna untuk menentukan tingkat toksisitas dari suatu zat atau bahan pencemar dan digunakan juga untuk pemantauan rutin suatu limbah.Uji toksisitas akut dengan menggunakan hewan uji merupakan salah satu bentuk penelitian toksikologi perairan yang berfungsi untuk mengetahui apakah effluent atau badan perairan penerima mengandung senyawa toksik dalam konsentrasi yang menyebabkan toksisitas akut.Pengaruh zatpencemarantara lain berhubungan dengan lamanya pajanan/pemaparan serta konsentrasi atau dosis zat pencemar. Untuk melihat berbagai efek yang berhubungan dengan waktu pemaparan.Uji toksisitas akut (LC50 dan LD50), dilakukan dengan memberikan zat kimia/toksikan yang sedang diuji sebanyak satu kali dalam jangka waktu singkat (24, 48, 96 jam) (Rossiana, dkk., 2007).
Parameter yang diukur biasanya berupa kematian hewan uji, yang hasilnya dinyatakan sebagai konsentrasi yang menyebabkan 50% kematian hewan uji (LC50) dalam waktu yang relatif pendek satu sampai empat hari (Husni dan Esmiralda, 2010).
meneliti berbagai efek yang berhubungan dengan cara dan waktu pemberian suatu sediaan obat. Pengujian toksisitas biasanya dibagi menjadi tiga kelompok, yaitu: 1. Uji toksisitas akut
Uji ini dilakukan dengan memberikan zat kimia yang sedang diuji sebanyak satu kali atau beberapa kali dalam jangka waktu 24 jam.
2. Uji toksisitas jangka pendek (subkronis)
Uji ini dilakukan dengan memberikan zat kimia tersebut berulang-ulang, biasanya setiap hari, atau lima kali seminggu, selama jangka waktu kurang lebih 10% masa hidup hewan, yaitu 3 bulan untuk tikus dan 1 atau 2 tahun untuk anjing. Namun, beberapa peneliti menggunakan jangka waktu yang lebih pendek, misalnya pemberian zat kimia selama 14 dan 28 hari.
1. Uji toksisitas jangka panjang (kronis)
Percobaan jenis ini mencakup pemberian zat kimia secara berulang selama 3 - 6 bulan atau seumur hidup hewan, misalnya 18 bulan untuk mencit dan 24 bulan untuk tikus. Memperpanjang percobaan kronis lebih dari 6 bulan tidak akan bermanfaat, kecuali untuk percobaan karsinogenik. Pengujian toksisitas suatu senyawa dibagi menjadi dua golongan yaitu uji toksisitas umum dan uji toksisitas khusus.Pengujian toksisitas umum meliputi pengujian toksisitas akut, subkronik, dan kronik.Pengujian toksisitas khusus meliputi uji potensiasi, karsinogenik, mutagenik, teratogenik, reproduksi, kulit, mata, dan tingkah laku (Manggung, 2008).
mempelajari efek-efek dari pemaparan bahan kimia terhadap hewan percobaan, pemaparan bahan kimia terhadap organisme tingkat rendah seperti bakteri dan kultur sel-sel dari mamalia di laboratorium dan pemaparan bahan kimia terhadap manusia (Retnomurti, 2008).
Uji toksisitas digunakan untuk mengevaluasi besarnya konsentrasi toksikan dan waktu pemaparan yang dapat menimbulkan efek toksik pada jaringan biologis. Salah satu biota yang dapat digunakan untuk uji toksisitas adalah ikan, dengan syarat harus mempunyai kepekaan tinggi yang memenuhi syarat umur, berat, dan panjang, serta sesuai dengan ikan yang hidup di perairan yang telah dalam keadaan tercemar (Pratiwi, dkk., 2012).
Toksisitas akut adalah efek total yang didapat pada dosis tunggal/multiple dalam 24 jam pemaparan. Toksisitas akut sifatnya mendadak, waktu singkat, biasanya reversibel yang secara statistik dapat menyebabkan kematian 50% dari hewan percobaan dinyatakan dengan LC50.Nilai LC50 sangat berguna untuk menentukan klasifikasi zat kimia sesuai dengan toksisitas relatifnya.
2.7.1 Lethal Concentration (LC50)
LC50 (Lethal Concentration) merupakan konsentrasi yang menyebabkan kematian sebanyak 50% dari organisme uji yang dapat diestimasi dengan grafik dan perhitungan. Berdasarkan waktu lamanya, metode penambahan larutan uji dan maksud serta tujuannya maka uji toksisitas diklasifikasikan sebagai berikut:
a) Klasifikasi menurut waktu, yaitu uji hayati jangka pendek (short term bioassay), jangka menengah (intermediate bioassay) dan uji hayati jangka
b) Klasifikasi menurut maksud dan tujuan penelitian adalah pemantauan kualitas air limbah, uji bahan atau satu jenis senyawa kimia, penentuan toksisitas serta daya tahan dan pertumbuhan organisme uji (Rossiana, 2006).
Untuk mengetahui efek zat pencemar terhadap biota dalam suatu perairan, perlu dilakukan suatu uji toksisitas zat pencemar terhadap biota yang ada yaitu dalam bentuk Lethal Concentration (LC50). Jadi, uji toksisitas digunakan untuk mengevaluasi besarnya konsentrasi toksikan dan durasi pemaparan yang dapat menimbulkan efek toksik pada jaringan biologis (Pratiwi, dkk., 2012).
2.8Ikan Nila
Ikan nila selama ini dikenal dengan nama ilmiah Tilapia nilotica, namun menurut klasifikasi terbaru pada tahun 1982 nama ilmiah ikan nila berubah menjadi Oreochromis niloticus (Kordi, 2004).
2.8.1 Klasifikasi Ikan Nila
Klasifikasi ikan nila (Oreochromis niloticus)adalah sebagai berikut : Filum : Chordata
Subfilum : Vertebrata Kelas : Osteichtyes Subkelas : Acanthopterygii Ordo : Percomorphi SubOrdo : Percoidea Famili : Cichlidae Genus : Oreochromis
2.8.2 Morfologi Ikan Nila
Ikan nila (Oreochromis nilotica) memiliki ciri morfologi, yaitu berjari-jari keras, sirip perut torasik, letak mulut subterminal dan berbentuk meruncing.Tanda lainnya yang dapat dilihat dari ikan nila adalah warna tubuhnya hitam dan agak keputihan. Bagian bawah tutup insang berwarna putih, sedangkan pada nila lokalputih agak kehitaman bahkan ada yang kuning.Sisik ikan nila berukuran besar, kasar dan tersusun rapi (Setiawan, 2012).Warna tubuh ikan nila amat bervariasi tergantung pada strain atau jenisnya. Mata ikan nila berbentuk bulat menonjol, dan bagian tepi berwarna putih.Ciri pada ikan nila adalah garis vertikal yang berwarna gelap di sirip ekor sebanyak enam buah. Garis seperti itu juga terdapat di sirip punggung dan sirip dubur (Rukmana,1997).
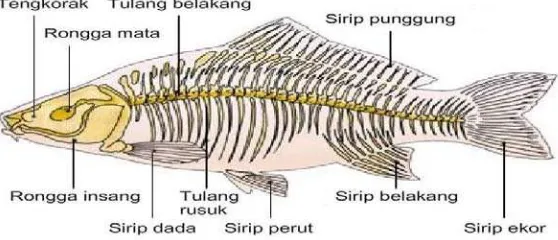
Morfologi dan anatomi ikan nila (Oreochromis niloticus) dapat dilihatsebagai berikut (Amri dan Khairuman, 2003).
Gambar 2.1Morfologi dan Anatomi Ikan Nila
Seperti ikan yang lain, jenis kelamin ikan nila yang masih kecil, belum tampak dengan jelas. Perbedaannya dapat diamati dengan jelas setelah bobot badannya mencapai 50 gram.Ikan nila yang berumur 4-5 bulan (100-150 g) sudah mulai kawin dan bertelur.Tanda-tanda ikan nila jantan adalah warna badan lebih gelap dari ikan betina, alat kelamin berupa tonjolan (papila) di belakang lubang anus, dan tulang rahang melebar ke belakang.Sedangkan tanda-tanda ikan nila betina adalah alat kelamin berupa tonjolan di belakang anus, dimana terdapat 2 lubang. Lubang yang di depan untuk mengeluarkan telur, sedang yang di belakang untuk mengeluarkan air seni dan bila telah mengandung telur yang masak,dan perutnya tampak membesar (Andrianto, 2005).