BAB II
TINJAUAN PUSTAKA
2.1. Tuli Kongenital
Tuli kongenital merupakan gangguan pendengaran yang timbul pada saat lahir (Victor, Rosa Andrea & Silvia 2012). Tuli kongenital merupakan ketulian yang terjadi pada seorang bayi disebabkan faktor-faktor yang mempengaruhi kehamilan maupun pada saat lahir impaired) atau tuli total (deaf). Tuli sebagian adalah keadaan fungsi pendengaran berkurang namun masih dapat dimanfaatkan untuk berkomunikasi dengan atau tanpa bantuan alat bantu dengar, sedangkan tuli total adalah keadaan fungsi pendengaran yang sedemikian terganggunya sehingga tidak dapat berkomunikasi dengan baik. Tuli kongenital dibagi menjadi genetik herediter (faktor keturunan) dan non genetik (Genetic Evaluation of Congenital Hearing Loss Expert Panel 2002).
▸ Baca selengkapnya: jawaban lkpd mutasi gen
(2)respons anak terhadap suara di lingkungan rumah, kemampuan vokalisasi dan cara pengucapan kata (Gurtler 2008).
2.2. Epidemiologi Tuli Kongenital
Gangguan pendengaran merupakan masalah kesehatan yang memerlukan perhatian khusus mengenai 6-8% dari populasi di negara berkembang dan sebagian merupakan defek yang didapatkan sejak lahir. Berdasarkan universal newborn hearing screening (UNHS) angka kekerapan yang didapatkan akan jauh lebih tinggi lagi.Kurang lebih 1,64 dari 1000 anak lahir hidup mengalami tuli kongenital. 1 dari 1000 kelahiran hidup mengalami tuli bilateral, dan 0,64 dari1000 kelahiran hidup mengalami tuli unilateral. Di Negara maju angka tuli kongenital berkisar antara 0,1 - 0,3 % kelahiran hidup (Gurtler 2008; Victor, Rosa Andrea & Silvia 2012; Nugroho, Zulfikar & Muyassaroh 2012; Kamiya 2015). Sedangkan di Indonesia berdasarkan survei yang dilakukan oleh Departemen Kesehatan di 7 propinsi pada tahun 1994 - 1996 yaitu sebesar 0,1 % (Hendarmin 2006).
2.3. Etiologi Tuli Kongenital
2.3.1. Genetik
d a r i seluruh gen manusia terlibat dalam proses pendengaran. Secara garis besar gangguan pendengaran yang berdasarkan kelainan genetik terbagi menjadi ketulian non sindromik dan ketulian sindromik. P e r u b a h a n g e n e t i k y a n g t e r j a d i d a p a t b e r u p a m u t a s i p a d a g e n t u n g g a l a t a u merupakan kombinasi mutasi pada gen yang berbeda dan faktor lingkungan. Sekitar 50% kasus merupakan kelainan pendengaran bentuk mutasi gen. Mutasi gen ini dapat diturunkan kepada keturunannya (Genetic Evaluation of Congenital Hearing Loss Expert Panel 2002; Steer, Bolton & Golding 2015). Penelitian Coco dan kawan-kawan yang melakukan amniocentesis untuk pemeriksaan genetik GJB3 35delG dan M34T pada ibu dengan kehamilan trimester dua mendapatkan dari 12.395 cairan amnion yang dianalisis ditemukan 2 kasus mutasi homozigot 35delG dan 352 kasus karier heterozigot, yang terdiri dari 42 mutasi M34T, 298 dengan mutasi 35delG dan 12 kasus heterozigot ganda M34T/35delG (Coco et al. 2013)
2.3.2. Non genetik
2.3.2.1 Masa kehamilan (Prenatal)
Kehamilan trimester I merupakan periode penting karena infeksi bakteri maupun virus akan mempunyai akibat terjadinya ketulian. Infeksi yang sering mempengaruhi pendengaran antara lain adalah infeksi TORCHS (Toksoplasmosis, Rubella, Cytomegalovirus, Herpes dan Sifilis), selain campak dan parotitis (Guerina 1994; Adler & Marshall 2007).
Beberapa jenis obat ototoksik dan teratogenik seperti salisilat, kina, gentamisin, streptomisin dll mempunyai potensi menyebabkan terjadinya gangguan proses pembentukan organ dan sel rambut pada rumah siput (koklea). Gangguan struktur anatomi telinga juga dapat menyebabkan terjadinya ketulian antara lain aplasia koklea (rumah siput tidak terbentuk), displasia Mondini dan atresia liang telinga (Mudd 2012).
2.3.2.2 Saat lahir (Perinatal)
Penyebab ketulian pada saat lahir antara lain : lahir prematur, berat badan lahir rendah (< 1500 gram), tindakan dengan alat pada proses kelahiran (ekstraksi vakum, forcep), hiperbilirubinemia, asfiksia (lahir tidak langsung menangis), dan hipoksia otak bila nilai Apgar < 5 pada 5 menit pertama (Gomella 2004; Okhravi et al. 2015).
terjadinya gangguan pendengaran (Joint Committee on Infant Hearing 2007) :
1. Riwayat keluarga dengan tuli sejak lahir 2. Infeksi prenatal; TORCHS
3. Kelainan anatomi pada kepala dan leher
4. Sindrom yang berhubungan dengan tuli kongenital 5. Berat badan lahir rendah (BBLR < 1500 gram ) 6. Meningitis bakterialis
7. Hiperbilirubinemia (bayi kuning) yang memerlukan transfusi tukar 8. Asfiksia berat
9. Pemberian obat ototoksik
10. Menggunakan alat bantu pernapasan / ventilasi mekanik lebih dari 5 hari (ICU).
2.4. Klasifikasi Tuli Kongenital
2.5. Gambaran Klinis Tuli Kongenital
Bayi dan anak dengan gangguan pendengaran sering memberikan gejala berupa keterlambatan bicara (speech delay).Tidak berkembangnya kemampuan berbicara dan berbahasa merupakan tanda yang menunjukkan adanya gangguan pendengaran dan perlu dievaluasi (Oller et al. 1999).
Perkembangan bicara erat kaitannya dengan tahap perkembangan mendengar pada bayi, sehingga adanya gangguan pendengaran perlu dicurigai apabila (Oller et al. 1999):
Usia 12 bulan : belum dapat mengoceh (babbling) atau meniru bunyi
Usia 18 bulan : tidak dapat menyebut 1 kata yang mempunyai arti
Usia 24 bulan : perbendaharaan kata kurang dari 10 kata
Usia 30 bulan : belum dapat merangkai 2 kata
2.5.1. Perkembangan auditorik sesuai dengan usia anak, antara lain (Soetjipto 2007) :
Usia 0-4 bulan : kemampuan respons auditorik masih terbatas dan bersifat reflex. Dapat ditanya apakah bayi kaget mendengar suara keras atau terbangun ketika sedang tidur. Respons berupa refleks auropalpebral maupun refleks Moro.
otot leher cukup kuat sehingga kepala dapat diputar dengan cepat ke arah sumber suara.
Usia 7-9 bulan dapat mengidentifikasi dengan tepat asal sumber bunyi dan bayi dapat memutar kepala dengan tegas dan cepat. Usia 9-13 bulan bayi sudah mempunyai keinginan yang besar untuk mencari sumber bunyi dari sebelah atas, dan pada usia 13 bulan mampu melokalisir bunyi dari segala arah dengan cepat.
Pada usia 2 tahun pemeriksa harus lebih teliti karena anak tidak akan memberi reaksi setelah beberapa kali mendapat stimulus yang sama. Hal ini disebabkan karena anak sudah mampu memperkirakan sumber suara.
2.6. Diagnosis Tuli Kongenital
Perkembangan pendengaran dimulai saat masih dalam kandungan, bayi dipersiapkan untuk merespon suara pada saat lahir. Proses yang kompleks meliputi mengenali suara ibunya dan membedakan suara dan bunyi dapat kita lihat pada bayi baru lahir. Respon inisial bayi terhadap suara adalah bersifat refleks (behavioral responses) seperti refleks auropalpebral (mengejapkan mata), denyut jantung meningkat, eye widening (melebarkan mata), cessation (berhenti menyusu) dan mengerutkan wajah atau grimacing (Carlson & Reeh 2006; HTA Indonesia 2010).
standard) dengan prinsip pemeriksaan cepat, mudah, tidak invasif dengan sensitifitas mendekati 100% (Genetic Evaluation of Congenital Hearing Loss Expert Panel 2002).
2.6.1. Emisi otoakustik
Emisi otoakustik merupakan suara dengan intensitas rendah yang diproduksi oleh sel rambut luar koklea dan direkam pada meatus akustikus eksternus baik dengan tidak adanya stimulasi akustik (emisi spontan) atau sebagai respon terhadap stimulasi akustik (akustik-menimbulkan emisi) atau rangsangan listrik (elektrik menimbulkan emisi). Suara yang ditangkap oleh koklea sangat kecil berkisar pada 30 dB, namun berpotensi untuk didengar. Emisi otoakustik timbul secara spontan karena suara yang sudah ada di koklea secara terus menerus bersirkulasi, tetapi pada umumnya emisi otoakustik didahului adanya stimulasi. Emisi otoakustik dihasilkan hanya bila organ Corti dalam keadaan mendekati normal, dan telinga tengah berfungsi dengan baik (Donovalova 2006; Hall III & Antonelli 2006; Berg et al. 2011).
menjadi elektrik agar mudah diproses (Hall III & Antonelli 2006; Xiao et al. 2015).
Emisi otoakustik dihasilkan oleh adanya gerakan membran timpani yang ditransmisikan ke koklea melalui telinga tengah secara spontan ataupun menggunakan stimulus. Untuk merekam emisi otoakustik diperlukan kondisi telinga tengah yang sehat dengan konduksi suara yang baik. Koklea tidak signifikan memancarkan suara ke udara di kavum timpani. Agar pergerakan membran timpani efisien, lebih padat dan sedikit udara yang bisa keluar masuk liang telinga, maka liang telinga harus ditutup (Hall III & Antonelli 2006).
Getaran yang dihasilkan dari mekanisme koklea yang unik dikenal sebagai “cochlear amplifier” yang menyebabkan adanya suatu gerakan sel-sel rambut luar di telinga bagian dalam. Gerakan-gerakan ini dapat terjadi baik secara spontan maupun oleh rangsangan bunyi dari luar dan dihasilkan oleh mekanisme sel yang aktif (Gelfand 2010).
Pergerakan sel rambut luar dapat dicetuskan oleh bunyi click dengan intensitas sedang atau kombinasi yang sesuai dari dua tone, kemudian terjadi gerakan biomekanik dari membran basilaris sehingga menghasilkan amplifikasi energi intrakoklea dan tuning koklea. Pergerakan sel rambut luar menimbulkan energi mekanis dalam koklea yang diperbanyak dan keluar melalui sistem telinga tengah dan membran timpani menuju liang telinga (Prieve & Fitzgerald 2002; Gelfand 2010).
keadaan koklea baik; sedangkan hasil Refer artinya adanya gangguan koklea (Abdullah 2006).
2.6.1.1 Anatomi dan fisiologi dasar emisi otoakustik
Stimulus bunyi keluar dari probe untuk ditransmisikan melalui telinga luar, di membran timpani rangsang auditori dirubah dari sinyal akustik menjadi sinyal mekanik dan ditransmisikan melalui tulang-tulang pendengaran pada telinga tengah; footplate dari tulang stapes akan bergerak pada foramen ovale yang akan menyebabkan pergerakan gelombang cairan pada koklea. Pergerakan gelombang cairan tersebut menggetarkan membran basilaris dimana setiap bagian dari membran basilaris sensitif terhadap frekuensi yang terbatas dalam rentang tertentu (Campbell 2006).
Bagian yang paling dekat dengan foramen ovale lebih sensitif terhadap rangsang suara dengan frekuensi tinggi, sementara bagian yang jauh dari foramen ovale lebih sensitif terhadap rangsang suara dengan frekuensi rendah. Pada emisi otoakustik, respon pertama yang kembali dan direkam menggunakan mikrofon berasal dari bagian koklea dengan frekuensi paling tinggi (Prieve & Fitzgerald 2002; Campbell 2006).
Dasar-dasar dari timbulnya keaktifan emisi ini adalah kemampuan telinga dalam untuk mengadakan kompresi dinamis gelombang bunyi. Dengan kompresi ini tekanan dinamik suara dapat diteruskan telinga bagian dalam kira-kira sebesar 0,7% ke sistem saraf yang mempunyai kapasitas dinamis yang jauh lebih kecil. Kompresi ini merupakan kemampuan sel-sel rambut yang tidak linear. Sel-sel rambut dalam yang sebenarnya adalah bagian aferen untuk sistem pendengaran, baru terangsang pada tekanan bunyi yang lebih kecil. Sel-sel rambut luar secara serentak menambah energi kepada sel-sel rambut dalam dengan cara gerakan mekanis. Proses gerakan inilah yang diperkirakan merupakan sumber aktifitas emisi telinga bagian dalam (Møller 2006).
2.6.1.2 Tujuan dan syarat pemeriksaan
Tujuan utama pemeriksaan emisi otoakustik adalah untuk menilai keadaan koklea, khususnya fungsi sel rambut luar telinga dalam. Hasil pemeriksaan dapat berguna untuk (Campbell 2006):
a. Skrining pendengaran (khususnya pada neonatus, bayi atau individu dengan gangguan perkembangan).
b. Memperkirakan sensitivitas pendengaran dalam rentang tertentu. c. Pemeriksaan pada gangguan pendengaran fungsional (berpura-pura).
Syarat-syarat untuk menghasilkan emisi otoakustik (Campbell 2006): a. Liang telinga luar tidak obstruksi
b. Liang telinga dengan ditutup rapat dengan probe. c. Posisi optimal dari probe
d. Tidak ada penyakit telinga tengah e. Sel rambut luar masih berfungsi f. Pasien kooperatif
g. Lingkungan sekitar tenang.
Emisi otoakustik hanya dapat menilai sistem auditori perifer, meliputi telinga luar, telinga tengah dan koklea. Respon memang berasal dari koklea, tetapi telinga luar dan telinga tengah harus dapat mentransmisikan kembali emisi suara sehingga dapat direkam oleh mikrofon. Emisi otoakustik tidak dapat digunakan untuk menentukan ambang dengar individu (Campbell 2006).
Emisi otoakustik dapat terjadi spontan sebesar 40-60% pada telinga normal, tetapi secara klinis yang memberikan respon baik adalah evoked otoacoustic emissions (Mainley, Ray & Propper 2008).
2.6.1.3 Jenis-jenis emisi otoakustik
Emisi otoakustik dibedakan menjadi 4 jenis, yaitu:
perekaman multiple untuk memastikan kemampuan replikasi dan untuk membedakan respon dari tingkat bising. Perekaman SOAEs biasanya berada dalam rentang frekuensi 500-7000 Hz. Pada umumnya, SOAEs terjadi hanya pada 40-50% individu dengan pendengaran normal. Pada dewasa sekitar 30-60%, pada neonatus sekitar 25-80%. SOAEs tidak ditemukan pada individu dengan dengan ambang dengar >30 dB HL. Oleh karena itu, adanya SOAEs biasanya dianggap sebagai tanda kesehatan koklea, tetapi tidak adanya SOAEs tidak selalu merupakan tanda kelainan dan juga biasanya tidak berhubungan dengan adanya tinitus. SOAEs biasanya terjadi pada frekuensi 1000-2000 Hz, amplitudo antara -5 dan 15 dB SPL.
b. Transient otoacoustic emission (TOAEs) atau Transient evoked otoacoustic emissions (TEOAEs), merupakan emisi suara yang dihasilkan oleh rangsangan bunyi menggunakan durasi yang sangat pendek, biasanya bunyi click, tetapi dapat juga tone-bursts.
c. Distortion product otoacoustic emission (DPOAEs), merupakan emisi suara sebagai respon dari dua rangsang yang berbeda frekuensi. d. Sustained-frequncy otoacoustic emission (SFOAEs), merupakan emisi
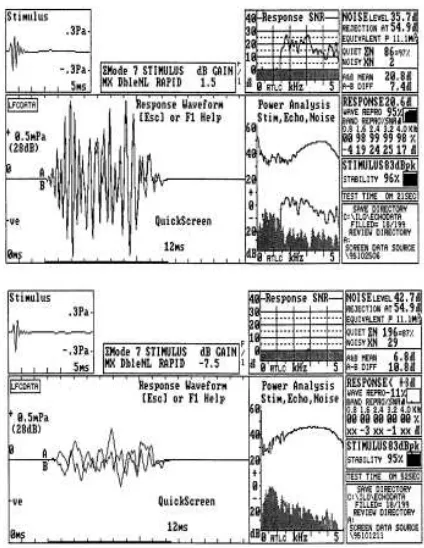
Gambar 2.1. Contoh hasil pemeriksaan OAE (Mainley, Ray & Propper 2008)
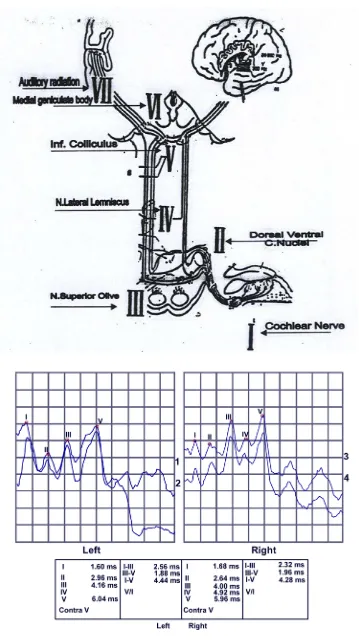
2.6.2. Brainstem evoked response audiometry (BERA)
Respon yang diperoleh dari pemeriksaan ini adalah dalam bentuk gelombang yang diukur dengan menggunakan elektroda permukaan yang dilekatkan pada kulit kepala atau dahi dan prosesus mastoid atau pada lobulus telinga. Cara pemeriksaan ini mudah, tidak invasif dan bersifat objektif (Bhattcharrya 2006; Hall III & Antonelli 2006).
Pemeriksaan BERA terdiri dari tujuh gelombang yang terjadi dalam waktu 10 msec setelah onset rangsangan pada intensitas yang tinggi (70-90 dBnHL). Bentuk puncak gelombang yang tercatat diberi nama dan angka Romawi, yaitu gelombang I-VII (Bhattcharrya 2006). Komponen gelombang:
a. Gelombang I: merupakan representasi dari potensial aksi saraf pada daerah distal saraf kranial ke VIII. Respon tersebut berasal dari aktivitas afferen dari serabut saraf VIII.
b. Gelombang II: dihasilkan oleh bagian proksimal saraf VIII. c. Gelombang III: berasal dari nukleus koklearis.
d. Gelombang IV: berasal dari kompleks olivaris superior.
e. Gelombang V: berasal dari kolikulus inferior dan lemniskus lateral. Gelombang ini paling sering dianalisa dalam aplikasi klinis BERA. f. Gelombang VI dan VII: diduga berasal dari korpus genikulatum
Mekanisme pemeriksaan BERA adalah dengan memberikan rangsangan bunyi melalui headphone yang telah diatur pada level kontrol akan menempuh perjalanan melalui koklea nukleus koklearis nukleus olivarius superior lemniskus lateral kolikulus inferior korteks auditorius di lobus temporal otak. Respon yang diberikan akan diterima oleh elektroda-elektroda yang ditempelkan pada kulit dan diteruskan ke komputer sehingga hasilnya dapat dilihat di layar komputer.
Penilaian BERA (Bhattcharrya 2006; Hall III & Antonelli 2006) a. Masa laten absolut gelombang I, III, V.
Masa laten absolut gelombang I,III,V adalah waktu yang diperlukan dari pemberian stimulus sampai timbulnya gelombang I, III, V.
b. Interwave latency I-III, III-V, I-V.
Merupakan waktu yang diperlukan dari gelombang I ke gelombang III, dari gelombang III ke gelombang V dan dari gelombang I ke gelombang V.
c. Beda masa laten absolut telinga kanan dan kiri (interaural latency) Yaitu perbedaan masa laten gelombang V antara telinga kanan dengan telinga kiri, yang kadang-kadang juga pada gelombang III. Rata-rata perbedaan bervariasi antara 0,2 ms - 0,6 ms.
d. Beda masa laten pada penurunan intensitas bunyi (latency intensity function)
ambang audiometri behavioral. Hal ini dapat lengkap terlihat dengan memakai intensitas stimulus `klik`. Semakin kecil intensitas yang diberikan, maka gelombang BERA akan menghilang kecuali gelombang V yang dapat terlihat sampai pada level 5-20 dB.
e. Rasio amplitudo gelombang V/I.
Pengukuran rasio amplitudo gelombang V/I adalah untuk menilai integritas batang otak. Amplitudo gelombang I dan V diukur kemudian dibandingkan. Pada kondisi normal orang dewasa gelombang V harus lebih besar dari gelombang I dengan hasil > 1,0. Pada kasus kelainan retrokoklea, ratio amplitudo gelombang V/I akan menurun yaitu <1,0.
2.6.3. Pemeriksaan tambahan a . Timpanometri
Pemeriksaan ini merupakan alat yang mengukur impedansi (tahanan terhadap tekanan) pada telinga tengah. Timpanometri digunakan untuk membantu menentukan penyebab dari tuli konduktif. Prosedur ini tidak memerlukan partisipasi aktif dari penderita dan biasa digunakan juga pada anak-anak. Timpanometer terdiri dari sebuah mikrofon dan sumber suara dan di pasang di liang telinga. Hasil pemeriksaan dari alat ini dibaca dalam bentuk gelombang (Steele, Susman & McCurdy 2003).
b. Visual Reinforcement Audiometry (VRA)
subjektif karena membutuhkan respons dari anak. Namun pada tes ini selain diberikan bunyi-bunyi, alat yang digunakan juga harus dapat menghasilkan gambar sebagai reward bila anak berhasil memberi jawaban. Pemeriksaan ini dapat dilakukan sambil bermain (Shaw 2004).
c. Audiometri bermain (Play Audiometry)
Pemeriksaan yang juga berfungsi mengetahui ambang dengar anak ini dapat dilakukan pada anak usia 2,5-7 tahun. Caranya dengan menggunakan audiometer yang menghasilkan bunyi dengan frekuensi dan intensitas berbeda. Bila anak mendengar bunyi berarti sebagai pertanda anak mulai bermain misalnya harus memasukkan benda ke kotak di hadapannya (Diefendorf 2002).
d. Audiometri Konvensional
2.7. Embriologi, Anatomi dan Fisiologi Telinga 2.7.1. Embriologi telinga
Perkembangan struktur kepala dan leher dari mamalia merupakan hasil diferensiasi jaringan lunak dari embrio mamalia, dimana struktur kepala dan leher berasal dari jaringan lunak di daerah pharyngeal apparatus dari embrio (Choo & Richter 2009).
Perkembangan dari pharyngeal apparatus embrio membentuk tiga komponen yaitu lengkung brankial (faringeal), kantong brankial dan celah brankial, dimana lengkung brankial merupakan unsur pokok tempat berkembangnya struktur-struktur dari lapisan mesoderm embrio seperti jaringan otot, elemen pembuluh darah dan sel-sel neural crest yang nantinya akan membentuk jaringan tulang dan jaringan syaraf. Oleh karena itu apabila terjadi gangguan perkembangan pada lengkung brankial akan menyebabkan kelainan kongenital pada struktur kepala dan leher (Wareing, Lalwani & Jackler 2006; Choo & Richter 2009).
Periode yang penting untuk perkembangan telinga adalah pada minggu ke-3 setelah fertilisasi, dimana telinga dalam terlebih dahulu dibentuk. Telinga luar, tengah dan dalam berasal dari embriologi yang berbeda dan perkembangannya dapat terganggu pada tingkatan manapun sehingga dapat menimbulkan abnormalitas yang sangat bervariasi mulai dari yang ringan sampai yang berat (Choo & Richter 2009).
perkembangan otak yang sangat cepat. Berdasarkan hal tersebut, maka upaya melakukan deteksi dini gangguan pendengaran sampai habilitasi dapat dimulai pada saat perkembangan otak masih berlangsung (HTA Indonesia 2010).
ditemukannya diferensiasi sel baru seperti yang terjadi pada periode embrionik (Wright 1997).
2.7.1.1. Perkembangan Telinga Dalam
Struktur telinga dalam terdiri dari labirin bagian membran berisi cairan yang dibentuk dari lapisan ektoderm dan labirin bagian tulang (otic capsule) yang dibentuk dari lapisan mesoderm dan neural crest (Choo & Richter 2009).
a. Labirin Bagian Membran
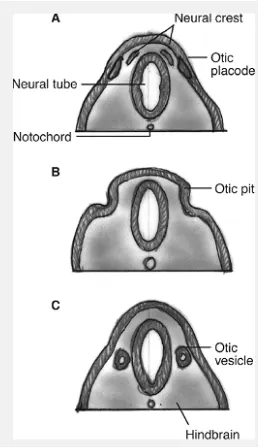
Telinga bagian dalam merupakan bagian yang pertama kali dibentuk dan berkembang dibandingkan dengan bagian telinga yang lain. Pada akhir minggu ke-3 masa gestasi (hari ke-22) atau disebut juga periode 7 somit, lapisan ektoderm yang berada di depan occipital somite mengalami penebalan pada masing-masing sisi dari neural groove yang masih terbuka dimana penebalan ini disebut dengan otic placode. Lapisan mesoderm yang berada disekitar otic placode berproliferasi sehingga perlahan-lahan membuat lapisan ektoderm yang membentuk otic placode makin lama makin menyempit dan membentuk otic pit dimana pada akhirnya otic placode akan lenyap dari permukaan luar dan membentuk otocyst (otic vesicle), yang akan menjadi cikal bakal pembentukan labirin bagian membran (Wareing, Lalwani & Jackler 2006).
ke-10 dan mencapai ukuran dewasa pada minggu ke-20 (Wareing, Lalwani & Jackler 2006).
Dalam perkembangannya, otocyst lebih berkembang ke arah panjang daripada lebar, hal ini menyebabkan otocyst dapat dibagi menjadi tiga daerah dan terlihat jelas pada minggu ke-5 masa gestasi, yaitu daerah kranial yang akan berkembang menjadi saluran endolimfatik (endolympatic duct), daerah kaudal yang akan berkembang menjadi saluran koklea (cochlear duct), dan daerah tengah atau daerah utrikulosakular (utriculosaccular area) yang akan berkembang menjadi sistem vestibular (Wareing, Lalwani & Jackler 2006).
Gambar 2.3. Perkembangan dini dari telinga dalam pada minggu ke-3 dan ke-4
masa gestasi. Pembentukan otocyst dari otic placode (Wareing, Lalwani &
Jackler 2006).
lateral yang akan membentuk kanalis semisirkularis superior, posterior dan lateral dimana kanalis semisirkularis superior terlebih dahulu terbentuk secara lengkap pada minggu ke-6 kemudian diikuti oleh kanalis semisirkularis posterior dan yang terakhir dibentuk adalah kanalis semisirkularis lateral. Saluran koklea (cochlear duct) juga mulai mengalami perkembangan secara cepat sehingga membentuk 1,5 putaran pada minggu ke-8 serta telah mencapai putaran penuh yaitu 2,5 putaran pada minggu ke-10 masa gestasi, walaupun belum mencapai panjang keseluruhan, yang baru akan dicapai pada minggu ke-20 masa gestasi (Wareing, Lalwani & Jackler 2006).
rambut luar (outer hair cell). Sel-sel rambut ini dapat dikenali secara jelas pada minggu ke-11 masa gestasi (Wareing, Lalwani & Jackler 2006).
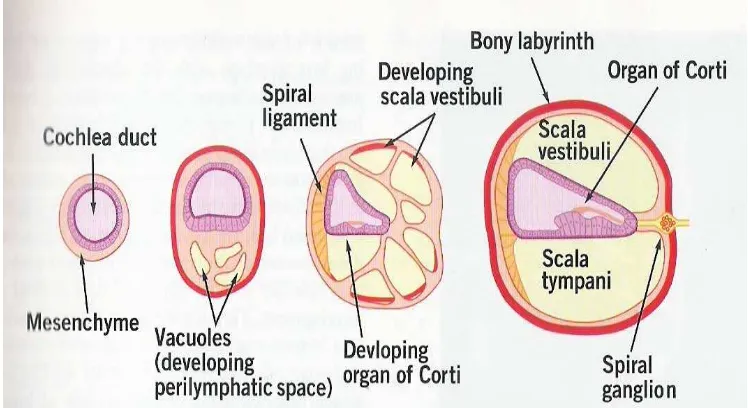
Organ Corti berasal dan berkembang dari bagian dinding posterior saluran koklea (cochlear duct), pada saat saluran koklea terus bertambah panjang dan apabila pada waktu yang bersamaan dilakukan potongan lintang maka terlihat bahwa struktur dalam dari saluran koklea berubah bentuk, yang awalnya berbentuk lingkaran kemudian berubah menjadi oval dan akhirnya berubah menjadi triangular. Bagian dinding posterior saluran koklea berkembang menjadi organ Corti, dinding anterior berkembang menjadi sebagian dari membran Reissner dan dinding lateral berkembang menjadi stria vaskularis (Wareing, Lalwani & Jackler 2006).
b. Labirin Bagian Tulang
Gambar 2.4. Perkembangan labirin bagian tulang. Potongan lintang koklea yang
menggambarkan perkembangan organ Corti, labirin tulang, dan ruang
perilympatik pada minggu ke-8 sampai minggu ke-12 masa gestasi (Choo &
Richter 2009).
Secara klinis gangguan perkembangan telinga dalam dibagi menjadi 2 bagian yaitu:
1. Gangguan perkembangan pada labirin tulang dan labirin membran 2. Gangguan perkembangan pada Labirin membran.
Gambaran histopatologis yang sering dijumpai pada tuli kongenital adalah displasia kokleasakular yang diakibatkan oleh terhambatnya perkembangan bagian kaudal dari otocyst, sehingga sebagian atau seluruh bagian dari organ Corti tidak terbentuk, yang pertama kali digambarkan oleh Scheibe pada tahun 1892. Saluran koklea dan sakulus mengalami kolaps, dan stria vaskularis mengalami degenerasi sedangkan utrikulus dan kanalis semisirkularis normal (Wareing, Lalwani & Jackler 2006).
2.7.2. Anatomi Telinga
2.7.2.1 Anatomi Telinga Dalam
Telinga dalam atau labirin terdiri dari labirin bagian tulang dan labirin bagian membran. Labirin bagian tulang terdiri dari kanalis semisirkularis, vestibulum dan koklea, sedangkan labirin bagian membran terletak di dalam labirin bagian tulang terdiri dari kanalis semisirkularis, utrikulus, sakulus dan koklea (Dhingra 2010).
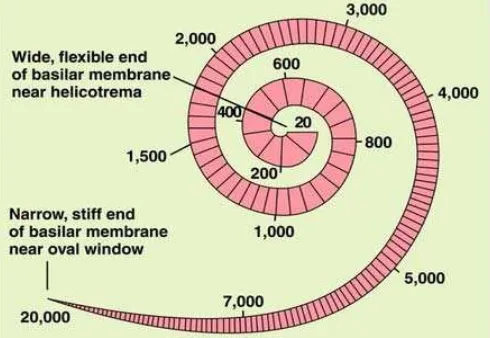
Koklea merupakan saluran tulang yang menyerupai cangkang siput dan bergulung 21/2 putaran, dengan panjang kurang lebih 35 mm dengan
dengan ruang perilimfe vestibularis dan akan mencapai permukaan dalam fenestra ovalis. Skala timpani menjulur ke lateral fenestra rotundum yang memisahkannya dengan ruang timpani. Pada apeks koklea skala vestibuli dan timpani akan bertemu melalui suatu saluran sempit yang disebut helikotrema (Gacek 2009; Dhingra 2010).
Organ Corti terletak di atas membran basilaris yang mengandung organ penting untuk mekanisme saraf perifer pendengaran, terdiri dari tiga bagian utama, yaitu sel penunjang, sel-sel rambut dan suatu lapisan gelatin penghubung membran tektoria. (Gacek 2009).
Cairan perilimfe memiliki komposisi ion yang mirip dengan cairan cerebrospinalis (CSF) dan juga mirip dengan cairan ekstraseluler, dengan konsentrasi natrium (Na+) tinggi dan kalium (K+) rendah. Cairan perilimfe pada skala vestibuli berasal dari plasma darah yang terdapat pada barrier hemato-perilimfatik, sedangkan cairan perilimfe pada skala timpani berasal dari CSF(Dhingra 2010).
Gambar 2.6. Komposisi cairan koklea(Wikipedia 2013)
Membran basilaris adalah struktur fibrosa yang berlapis – lapis dari lamina spiral pars osseus ke ligamen spiral. Elastisitas membran basilaris bervariasi di sepanjang koklea dari kekakuan dan kelebarannya. Membran basilaris tampak kaku dan sempit di daerah basis koklea. Pada daerah ini merupakan daerah yang sensitif terhadap frekuensi tinggi. Sedangkan ujung lain dari membran, yaitu pada apeks koklea, tampak lebih fleksibel dan luas dan paling sensitif terhadap frekuensi rendah (Dhingra 2010).
Gambar 2.7. Lebar membran basilaris dari basal ke apeks(Wikipedia 2013)
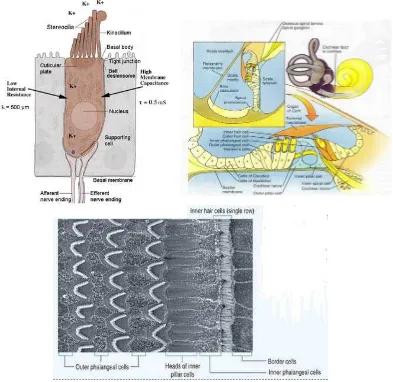
basis ke apeks koklea. Ukuran organ Corti bervariasi secara bertahap dari basis koklea ke apeks koklea. Organ Corti terdiri atas sel – sel penyokong dan sel – sel rambut. Sel rambut merupakan sel sensoris yang menghasilkan impuls saraf dalam menanggapi getaran membran basilaris. Di organ Corti terdapat 1 deret sel rambut dalam dan 3 sampai 5 deret sel rambut luar. Ada sekitar 3500 sel rambut dalam dan 12000 sel rambut luar. Sel – sel ini berbeda secara morfologi, bentuk dari sel rambut dalam seperti botol dan ujung syarafnya berbentuk piala yang menyelubunginya, sedangkan bentuk dari sel rambut luar seperti silinder dan ujung syarafnya hanya pada basis sel yang terletak bebas di perilimfe pada organ Corti (Gacek 2009).
melekat pada membran tektorial atasnya dan berbentuk huruf W (Laura & Abraham 2012).
Gambar 2.8. Sel rambut, organ Corti dan sel rambut luar dan dalam dilihat dengan mikroskop elektron(Laura & Abraham 2012)
Gambar 2.9. Tip Link (Laura & Abraham 2012)
Connexin-26 merupakan suatu kelompok protein di gap junction yang berperan penting dalam komunikasi berbagai komponen sel-sel rambut, pengaturan perpindahan elektrolit dan metabolisme elektrolit sel-sel rambut. Connexin 26 diekspresikan pada epitel non sensorik (sel interdental limbus spiralis, sel penunjang, sel sulkus dalam dan luar, serta sel ligamen spiralis) dan sel-sel jaringan penghubung (fibrosit ligamen spiralis dan limbus spiralis, sel intermediet dan basal di stria vaskularis). Enam connexin 26 membentuk connexon, dan masing-masing connexon berhubungan satu sama lain untuk membentuk suatu gap junction (Moller 2006).
Gambar 2.10. Lokasi Ekspresi GJB2 (Connexin 26) (Moller 2006)
2.7.2.2 Sistem Saraf Pendengaran Sentral
Daerah sentral dari sistem pendengaran meliputi seluruh struktur pendengaran yang letaknya setelah saraf koklearis, yaitu:
a. Kompleks nukleus koklearis
disebut dengan olivaris superior medialis, serta kontralateral dari nukleus corpus trapezoideus yang membentuk bagian ipsilateral dari kompleks olivaris superior (Moller 2006).
Nada frekuensi rendah pada kompleks nukleus koklearis dihantar oleh daerah kontralateral dan nada frekuensi tinggi oleh daerah dorsomedialis (Rappaport & Provencal 2002).
b. Kompleks olivaris superior
Kompleks olivaris superior meliputi olivaris superior lateralis, medialis dan nukleus corpus trapezoideus medialis dan nukleus preolivaris dan periolivaris yang merupakan bagian dari sistem pendengaran descending. (Rappaport & Provencal 2002; Moller 2006).
c. Lemniskus lateralis
d. Kolikulus inferior
Terdiri dari daerah sentral atau kolikulus inferior sentral yang dikelilingi oleh belt area. Kolikulus inferior sentral kanan dan kiri dihubungkan dengan suatu komissura. Kolikulus inferior sentral ini menerima proyeksi kontralateral dari masing-masing subdivisi kompleks nukleus koklearis. Bilateral dari olivaris superior lateralis dan dari nukleus dorsalis dan intermedius lemniskus lateralis serta pada ipsilateral dari olivaris superior medius, nukleus korpus trapezoideus medius dan nukleus lemniskus lateralis ventralis (Rappaport & Provencal 2002). Belt area menerima proyeksi dari nukleus lemniskus lateralis dorsalis dan ventralis dan dari nukleus koklearis ventralis dan dorsalis. Akson-akson dari kolikulus juga membentuk kolikulus inferior brakialis. Pada kolikulus inferior sentralis, nada frekuensi rendah terletak pada daerah dorsalis dan frekuensi tinggi pada ventrolateralis (Luxon & Cohen 1997; Rappaport & Provencal 2002).
e. Korpus genikulatum medialis
medialis (Rappaport & Provencal 2002; Mills, Khariwala & Weber 2006).
f. Korteks auditorius
2.7.3. Fisiologi pendengaran
ada getaran dengan nada rendah. Hal ini dapat diibaratkan dengan senar gitar yang pendek dan tegang, akan beresonansi dengan nada tinggi. Getaran yang bernada tinggi pada perilimfe skala vestibuli akan melintasi membran basilaris bagian basal. Sebaliknya nada rendah akan menggetarkan bagian membran basilaris di daerah apex. Getaran ini kemudian akan turun ke perilimfe skala timpani, kemudian keluar melalui foramen rotundum ke telinga tengah untuk diredam (Ingber 2006).
Membran basilaris merupakan membran yang membatasi skala timpani dengan skala media. Gerakan membran basilaris ke atas akan membengkokkan stereosilia ke arah stereosilia yang lebih tinggi pada fase depolarisasi mengakibatkan terjadinya peregangan pada serabut tip link di puncak stereosilia. Ketika tip link meregang langsung membuka saluran mekanoelekrik transduksi (MET) pada membran stereosilia dan menimbulkan aliran arus K+ ke dalam sel sensoris. Aliran kalium timbul karena terdapat perbedaan potensial endokoklea +80 mV dan potensial intraseluler negatif pada sel rambut, sel rambut dalam -40 mV dan sel rambut luar -70 mV. Hal tersebut menghasilkan depolarisasi intraseluler yang menyebabkan kation termasuk kalium dan kalsium mengalir ke dalam sel rambut. Masuknya ion K+ akan mengubah potensial listrik dalam sel rambut dan mendepolarisasi sel, pada akhirnya sel rambut memendek dengan mempengaruhi motor sel rambut luar atau prestin (Gacek 2009; Dhingra 2010)
mengakibatkan terjadinya pengenduran pada serabut tip link di puncak stereosilia maka saluran MET akan tertutup. Bila stereosilia tegak lurus, pembukaan saluran MET tak akan berpengaruh. Tip link ini seperti saluran elastik yang bisa mengendalikan buka tutupnya saluran MET. Ion K+ keluar dari sel rambut luar ke dalam ruang ekstraseluler di sekitar sel rambut luar kemudian masuk ke sel pendukung. Rangsangan suara diubah menjadi getaran membran basilaris, dan mengarahkan pada pembukaan dan penutupan saluran MET pada stereosilia kemudian menghasilkan respon elektrokimia dan akhirnya akan mepresentasikan suara pada saraf pendengaran (Gacek 2009; Dhingra 2010)
Serabut-serabut serabut saraf koklearis berjalan menuju inti koklearis dorsalis dan ventralis. Sebagian besar serabut inti melintasi garis tengah dan berjalan naik menuju kolikulus inferior kontralateral, namun sebagian serabut tetap berjalan ipsilateral. Penyilangan selanjutnya pada lemniskus lateralis dan kolikulus inferior. Dari kolikulus inferior jaras pendengaran berlanjut ke korpus genikulatum dan kemudian ke korteks pendengaran pada lobus temporalis (Gacek 2009).
2.8. Skrining Pendengaran Bayi Baru lahir
a. Universal Newborn Hearing Screening (UNHS), bertujuan melakukan deteksi dini gangguan pendengaran pada semua bayi baru lahir. Upaya skrining pendengaran ini sudah dimulai pada saat usia 2 hari atau sebelum meninggalkan rumah sakit. Untuk bayi yang lahir pada fasilitas kesehatan yang tidak memiliki program UNHS, paling lambat pada usia 1 bulan sudah melakukan skrining pendengaran.
2.9. Klasifikasi gangguan pendengaran Tabel 2.1. Klasifikasi Gangguan Pendengaran
Variabel Keterangan
Lokasi lesi
Konduktif Telinga luar atau tengah. Sensorineural Koklea atau saraf auditorius.
Neural Saraf auditorius (seperti pada neuropati auditorius), mungkin non-genetik (misalnya timbul setelah hiperbilirubinemia) atau genetik (misalnya akibat mutasi gen otoferlin OTOF).
Sentral Akibat kesulitan proses persepsi informasi suara pada otak.
Onset
Kongenital Timbul sejak lahir, dapat dideteksi dengan skrining neonates
Didapat Timbul kapan saja setelah lahir (misalnya akibat infeksi atau trauma kepala).
Penyebab
Genetik Berhubungan dengan gangguan mekanisme
molekular telinga dalam yang diturunkan; penyebab genetik ditemukan pada sedikitnya 50% kasus gangguan pendengaran permanen pada anak-anak; molekul yang dikodekan termasuk gap-junction protein connexin 26 (mutasi GJB2), molekul motor (actin dan myosin), dan faktor transkripsi; pewarisan umumnya resesif (80% kasus) tapi juga bisa
dominan (15% kasus) atau X-linked atau
mitokondria (<1%); ketulian dapat terjadi sejak lahir atau dapat juga timbul kemudian; sekitar 4% anak-anak dengan gangguan pendengaran genetik memiliki malformasi telinga dalam.
Infeksi
Prenatal (infeksi sitomegalovirus, rubella, sifilis, toxoplasma, atau infeksi virus lainnya) atau postnatal (measles, mumps, atau meningitis); meningitis dapat mengganti koklea dengan tulang baru, yang menimbulkan masalah mayor saat implan koklea.
Variabel Keterangan
Agen ototoksik Antibiotik aminoglikosida (dengan mutasi 1555AG pada gen 12S rRNA [MTRNR1]) dan agen
kemoterapi seperti sisplatin.
Lain-lain Sepsis, anomali kraniofasial, prematur, berat badan lahir rendah, anoksia, inkompatibilitas rhesus.
Gambaran klinis Ketulian
sindromik
Berhubungan dengan temuan klinis lainnya (misalnya gangguan penglihatan pada sindroma Usher, gangguan fungsi tiroid pada sindroma Pendred, atau aritmia pada sindroma Jervell dan Lange-Nielsen); ditemukan pada 30% kasus gangguan pendengaran herediter; sekitar 400 sindroma berhubungan dengan gangguan pendengaran.
Ketulian nonsindromik
Ketulian sebagai temuan tersendiri.
Bahasa Ketulian prelingual
Terjadi sebelum perkembangan bicara.
Ketulian postlingual
Terjadi setelah perkembangan bicara.
Severitas
Ketulian ringan, sedang, atau berat
Level pendengaran 20-40 dB menunjukkan
gangguan pendengaran ringan, 41-70 dB gangguan sedang, dan 71-90 dB gangguan berat; gangguan ringan sampai berat umumnya permanen namun alat bantu dengar dapat mengkompensasi
gangguan; level gangguan dapat berfluktuasi seperti pada large vestibular aqueduct syndrome (sering pada sindroma Pendred) dimana trauma kepala minor atau terbang dengan pesawat dapat mencetuskan gangguan pendengaran.
Frekuensi
2.10. Mutasi Genetik
Mutasi adalah perubahan yang terjadi
maupun yang menyebabkan perubahan ekspresinya, baik pada
taraf uruta
Mutasi pada tingkat kromosom biasanya disebut
dapat mengarah pada munculny
variasi-variasi baru pada spesies. Mutasi di alam dapat terjadi akibat zat
pembangkit mutasi (mutagen, termasu
kimia termasuk makanan. Peristiwa terjadinya mutasi disebut
mutagenesis. Sedangkan, individu yang mengalami mutasi sehingga menghasilkan fenotip baru disebut mutan (Jena 2012).
Mutasi gen atau mutasi titik adalah mutasi yang terjadi karena perubahan pada satu pasang basa DNA suatu gen. Perubahan DNA menyebabkan perubahan kodon-kodon RNA, yang akhirnya menyebabkan perubahan asam amino tertentu pada protein yang dibentuk. Perubahan protein atau enzim akan menyebabkan perubahan metabolisme dan fenotip organisme. Besar kecilnya jumlah asam amino yang berubah akan menentukan besar kecilnya perubahan fenotip pada organisme tersebut. Ada dua mekanisme mutasi gen, yaitu subtitusi pasangan basa dan penambahan atau pengurangan pasangan basa (Jena 2012).
a. Subtitusi Pasangan Basa
Subtitusi pasangan basa ialah pergantian satu pasang nukleotida oleh pasangan nukleotida lainnya. Subtitusi pasangan basa ada dua macam, yaitu transisi dan tranversi. Transisi adalah penggantian satu basa purin oleh basa purin yang lain, atau penggantian basa pirimidin menjadi basa pirimidin yang lain. Transisi sesama basa purin, misalnya basa adenin diganti menjadi basa guanin atau sebaliknya. Sedangkan, transisi sesama basa pirimidin, misalnya basa timin diganti oleh basa sitosin atau sebaliknya (Jena 2012).
Tranversi adalah penggantian basa purin oleh basa pirimidin, atau basa pirimidin oleh basa purin. Tranversi basa purin oleh basa pirimidin, misalnya basa adenin atau guanin diganti menjadi basa timin atau sitosin. Tranversi basa pirimidin oleh basa purin, misalnya basa timin atau sitosin menjadi basa adenin atau guanin (Jena 2012).
Subtitusi pasangan basa ini kadang-kadang tidak menyebabkan perubahan protein, karena adanya kodon sinonim (kodon yang terdiri atas tiga urutan basa yang berbeda, tetapi menghasilkan asam amino yang sama). Misalnya, basa nitrogen pada DNA adalah CGC menjadi CGA sehingga terjadi perubahan kodon pada RNA dari GCG menjadi GCU. Sedangkan, asam amino yang dipanggil sama, yaitu arginin (Jena 2012).
b. Penambahan atau Pengurangan Pasangan Basa
basa pada DNA dapat menyebabkan perubahan sederetan kodon RNA yang terdapat di belakang titik perubahan tersebut, berarti juga akan terjadi perubahan asam amino yang disandikan melalui RNA tersebut. Akibat lain dari penambahan atau pengurangan basa adalah terjadinya pergeseran kodon akhir pada RNA. Pergeseran kodon akhir menyebabkan rantai polipeptida mutan menjadi lebih panjang atau lebih pendek. Mutasi ini disebut juga mutasi ubah rangka karena menyebabkan perubahan ukuran pada DNA maupun polipeptida (Jena 2012).
Mutasi ubah rangka ini dapat dibedakan menjadi dua, yaitu penambahan basa (adisi) dan pengurangan basa (delesi). Mutasi karena penambahan basa, misalnya basa DNA awalnya AGC-GTC menjadi TAG-CGT-C…. Sedangkan, jika basa DNA tersebut mengalami pengurangan basa maka urutannya menjadi GCG-TC.... Penambahan atau pengurangan basa dapat terjadi di bagian awal, di tengah, atau di akhir (Jena 2012).
Contoh mutasi (Rehm, Williamson, Kenna, Corey, Korf, 2008):
Pengaruh mutasi terhadap protein (Jena 2012):
a. Silent artinya triplet mutan memberi kode asam amino yang sama Misalnya: AGG CGG memberi kode asam amino arginin
c. Mutasi missense artinya mutasi menghasilkan asam amino yang berbeda atau tidak berfungsi.
d. Mutasi nonsense artinya mutasi menghasilkan kodon pemutus, sehingga sintesis protein berhenti. Misanya CAG (glisin) UAG (berhenti)
e. Mutasi Frameshift : penambahan atau delesi pasangan basa yang bukan kelipatan 3, sehingga menyebabkan pergeseran pembacaan kerangka, sehingga sintesis protein dari tempat terjadi mutasi sampai seterusnya dapat berubah.
2.11. Ketulian dan Genetik
Diperkirakan sekitar setengah dari jumlah kejadian tuli yang terjadi pada masa kanak-kanak penyebabnya adalah herediter. Kelainan herediter ini melibatkan gen yang bertanggungjawab dalam proses pendengaran yang diturunkan dalam keluarga (Cynthia et al. 2006).
Terdapat dua jenis ketulian yang bersifat genetik, antara lain sindromik yaitu dimana terdapat masalah kesehatan lain yang menyertai hilangnya pendengaran, dan jenis yang non-sindromik yaitu satu-satunya gejala adalah hilangnya pendengaran. Walaupun sebagian besar ketulian kongenital bersifat non-sindromik namun banyak juga sindroma-sindroma lain yang memiliki tanda hilang pendengaran sebagai salah satu gejalanya (Cynthia et al. 2006; Avraham & Kanaan 2012).
Tabel 2.2. Sindroma yang sering menyebabkan ketulian (Cynthia et al. 2006)
Sindroma Kelainan selain ketulian
Alport Masalah ginjal
Brankio-oto-renal Kista leher dan masalah ginjal Jervell dan Lange-Nielsen Masalah jantung
Pendred Pembesaran tiroid
Stickler Perubahan bentuk wajah, masalah mata, artritis
Sindroma Usher Buta yang progresif Sindroma Waardenburg Perubahan pigmen kulit
yang kedua orangtuanya tidak tuli dan tidak memiliki riwayat tuli pada keluarganya (Cynthia et al. 2006; Avraham & Kanaan 2012).
2.12. Jenis-jenis Ketulian Genetik
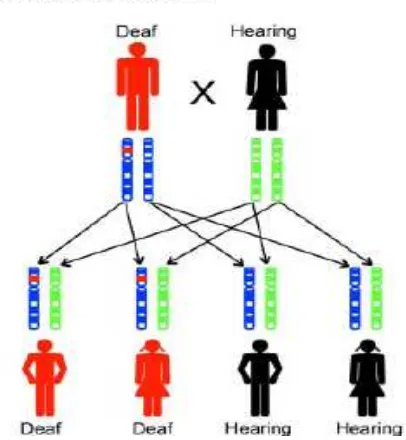
2.12.1. Pewarisan Autosomal Resesif (DFNB)
Kebanyakan tuli genetik diturunkan secara resesif, yaitu sekitar 80%. Karena adanya karier heterozigot yang asimtomatik terkadang sulit dibedakan dengan tuli non genetik (Avraham & Kanaan 2012).
Gambar 2.13. Gambar penurunan gen dari ayah dan ibu secara resesif (Rehm et
al. 2008)
Ketulian kongenital yang diturunkan bisa berdiri sendiri (non-sindromik) atau melibatkan gangguan kesehatan lainnya ((non-sindromik). Gangguan autosomal resesif non-sindromik (Autosomal Recessive Nonsyndromic Hearing Loss / ARNSHL) sejauh ini telah diketahui setidaknya melibatkan 30 gen yang menimbulkan kelainan tersebut. Sekitar 47% dari populasi tuna rungu di Kolombia menderita ARNSHL. Lokus gen ARNSHL ini diberi nama DFNB dimana huruf B mewakili sifat resesif pada keturunan ini (Lattig et al. 2008).
hanya 10-15% yang memiliki gen ini (Rehm et al. 2008). Mutasi GJB2 ditemukan pada banyak pasien dengan latar belakang etnis yang beragam, misalnya delesi basa guanin pada nukleotida posisi 35 (35delG) sering ditemui pada bangsa Eropa. Delesi timin pada posisi 167 (167delT) sering ditemukan pada populasi kaum Yahudi Ashkenazi dan mutasi 235delC sering pada Jepang atau bangsa Asia pada umumnya (Bailey, Jonas & Shawn 2006).
Pada warga kulit putih di Amerika Serikat ditemukan 1 dari 40 orang adalah carrier mutasi GJB2. Tingginya frekuensi mutasi ini membuat tes skrining genetik dan molekuler layak untuk dilakukan (Eisen & Ryugo 2008).
Gangguan autosomal resesif sindromik artinya ketulian ini diturunkan secara resesif dan disertai oleh beberapa gangguan medis lainnya selain ketulian sehingga membentuk suatu sindroma, antara lain sindroma Usher, sindroma Pendred, sindroma Jervell dan Lange-Nielsen, dan lain-lain (Rehm et al. 2008).
Kanaan 2012). Tuli pada sindroma ini bisa timbul berat pada saat lahir atau memberat seiring dengan usia, dengan jenis ketulian sensorineural (Eisen & Ryugo 2008).
Sindroma Usher memiliki karakteristik retinitis pigmentosa dan tuli dimana insidensinya mencapai 4,4 per 100.000 penduduk di Amerika Serikat dan 3,0 per 100.000 di Skandinavia. Pada sindroma ini gen yang terganggu pada akhirnya mempengaruhi sel-sel rambut sensori sehingga menganggu proses pendengaran. Diperkirakan sindroma Usher diderita sekitar 0,6-28% dari populasi tuna rungu. Sampai saat ini telah ditemukan 8 gen penyebab sindroma Usher, diagnosis dini sindroma ini memiliki implikasi yang penting untuk rehabilitasi dan perencanaan edukasi pasien (Bailey, Jonas & Shawn 2006).
2.12.2.Pewarisan Autosomal Dominan (DFNA)
Gambar 2.14. Gambar penurunan gen dari ayah dan ibu secara dominan (Rehm
et al. 2008)
Autosomal dominant non syndromic Hearing loss (ADNSHL) adalah ketulian yang progresif dengan onset pada usia dekade kedua atau ketiga, memiliki beragam derajat ketulian dan merupakan kandidat yang potensial untuk menjalani implantasi koklea (Avraham & Kanaan 2012).
Gangguan autosomal dominan sindromik antara lain adalah sindroma branchiootorenal (BOR atau disebut juga sindroma Melnick-Fraser) memiliki beberapa kriteria:
Tabel 2.3. Kriteria sindroma branchiootorenal (Avraham & Kanaan 2012)
Kriteria Mayor Kriteria Minor
Anomali brakial Kelainan telinga luar
Ketulian Kelainan telinga tengah
Lubang preaurikular Kelainan telinga dalam
Kelainan ginjal Lainnya: asimetri wajah, kelainan
Disebut sindroma BOR bila ditemukan 3 kriteria mayor, atau 2 kriteria minor dan 2 kriteria minor, atau 1 kriteria mayor dan terdapat keterlibatan keluarga dekat yang menderita sindroma ini (Bailey, Jonas & Shawn 2006).
2.12.3. Pewarisan Mutasi Resesif X-linked (DFN)
X yang tidak aktif akan tetap tidak aktif selama hidup sel dan keturunannya pada organisme. Inaktivasi X adalah perubahan epigenetik yang menyebabkan perbedaan fenotipe dan bukan merupakan perubahan pada tingkat genotipe. (Hiratani & Gilbert 2010).
Namun pada anak laki-laki, si anak memiliki kemungkinan 50% untuk menerima kromosom X yang termutasi resesif dari ibunya, serta si anak akan menerima kromosom Y dari ayahnya. Apabila si anak laki-laki menerima kromosom X termutasi dari ibunya, dia tidak memiliki kromosom X normal lain untuk memblok efek mutasi. Sehingga setiap anak laki-laki memiliki kemungkinan 50% untuk menderita kelainan (Rehm et al. 2008).
Gambar 2.15. Gambar penurunan gen dari ayah dan ibu secara resesif x-liked
(Rehm et al. 2008)
sindroma Wildervanck, sindroma Alport dan sindroma Leigh (Avraham & Kanaan 2012).
2.12.4. Pewarisan Mutasi Mitokondria
Pada reproduksi, hanya ovum dari ibu yang menurunkan mitokondria ke anaknya, sedangkan sperma dari ayah tidak menurunkan mitokondria. Sehingga bila terdapat mutasi pada gen mitokondria ibu, kelainan ini akan diturunkan ke semua anaknya. Sedangkan seorang ayah tidak akan mewariskan mutasi mitokondria ke anak-anaknya (Rehm et al. 2008; Avraham & Kanaan 2012).
Gambar 2.16. Gambar penurunan gen dari ayah dan ibu secara pewarisan
mutasi mitokondria (Rehm et al. 2008)
sindroma Turner, bisa dijumpai tuli konduktif, sensorineural ataupun campuran, dan gangguan genetik yang multifaktor (Rehm et al. 2008).
Terdapat juga kasus-kasus dimana mutasi genetik ditemukan pertama kali pada seseorang dimana kedua orangtuanya tidak membawa mutasi tersebut. Jenis mutasi ini disebut mutasi spontan dan umumnya disebabkan karena perubahan DNA pada gen ovum atau sperma orangtua. Pada keadaan ini kelainan genetik dapat tiba-tiba muncul pada suatu keluarga yang tidak ditemukan pada pendahulunya. Pada kasus seperti ini, tidak dapat ditentukan kemungkinan seorang anak akan memiliki kelainan (Jena 2012).
2.13. Gen Gap Junction Beta 2 (GJB2)
Gambar 2.17. Regulasi Kalium dalam Organ Corti (Bruzzone & Cohen-Salmon
2005).
M163V, R143W, R32H, R165W, 333–334 delAA dan yang baru pertama kali ditemukan (novel) yaitu 355–357delGAG. Mutasi yang paling sering ditemukan adalah mutasi 35delG (Hamid et al. 2009).
Sejumlah 127 pasien dari 324 pasien pada penelitian Wu dan kawan-kawan (2002) ditemukan memiliki 1 mutan alel Cx26. Dari 127 kasus ini, 26 (20,4%) homozigot, 31 (24,4%) heterozigot, dan 70 (55,1%) dideteksi hanya memiliki 1 mutasi.
Penelitian Abe dan kawan-kawan (2000) di Jepang menunjukkan 235delC merupakan yang paling banyak terjadi (73%). Analisis dari GJB2 pada penelitian ini terdapat 3 mutasi missense, satu nonsense mutasi dan tiga frameshift mutasi.Data ini menunjukkan indikasi adanya kombinasi spesifik pada setiap populasi yang berbeda (Abe et al. 2000).
Gambar 2.19. Gap Junction 2 (Genetic Home Reference 2013)
2.14. Gen Myosin 7A (MYO7A)
Protein ini memainkan peranan dalam transportasi molekul ke dalam sel. Myosin berinteraksi dengan aktin yang merupakan protein penting untuk pergerakan sel dan bentuk sel. Myosin 7A adalah protein motor yang menggerakkan filamen aktin dan bertanggung jawab untuk sensitifitas channel transduksi mekanoelektrik (Shahzad et al. 2013).
Di telinga daIam myosin 7A berperan dalam perkembangan dan pemeliharaan sel-sel rambut yang disebut dengan stereosilia. Stereosilia kaya dengan aktin. Myosin7A berperan dalam pergerakan stereosilia sebagai respon dari gelombang suara. Gerakan ini mengubah energi mekanik menjadi energi listrik yang disampaikan ke saraf pendengaran (Liu et al. 2013). Gen MYO7A termasuk didalam struktur hair bundles pada bagian apeks sel-sel rambut sensori yang berperan dalam mekanotransduksi dalam proses mendengar dan keseimbangan. Mutasi gen MYO7A menyebabkan bentuk abnormal dari hair bundles sehingga menyebabkan ketulian (Ernest & Rosa 2014). Mutasi MYO7A menyebabkan ketulian pada shaker-1 mice ataupun model yang lain (Cosgrove et al. 2012).
yang lain menghubungkan mutasi MYO7A dengan bentuk autosomal resesif pada ketulian non sindromik yaitu DFNB2 (Shahzad et al. 2013). Pada manusia gen MYO7A terdiri dari 49 exon. Gen ini diekspresikan di koklea dan retina (Kumar et al. 2004).
DFNA2
Gambar 2.20. Gambar kromosom 11 dan lokus gen penyebab ketulian (Rehm et al. 2008)
Gambar 2.1. Gen Myosin 7A (Genetic Home Reference 2013)
2.15. Pemeriksaan Genetik
Dengan ditemukannya gen baru yang menyebabkan gangguan pendengaran, jumlah pemeriksaan genetik untuk gangguan pendengaran juga bertambah (Avraham & Kanaan 2012). Mengetahui penyebab genetik dari gangguan pendengaran dapat membantu tatalaksana pasien. Pada beberapa kasus, informasi genetik dapat membantu memperkirakan apakah gangguan pendengaran akan menetap atau akan semakin memburuk. Mengetahui penyebab genetik juga berguna untuk mengetahui jenis kerusakan yang terjadi pada sistem pendengaran. Hal ini penting karena derajat kerusakan telinga dalam akan mempengaruhi apakah implan koklea atau alat bantu dengar lainnya dapat membantu pasien. Sebagai tambahan, karena mutasi pada beberapa gen akan menyebabkan sindroma gangguan pendengaran, pemeriksaan genetik dapat membantu menentukan apakah ada masalah lain selain gangguan pendengaran (Rehm et al. 2008).
Selain manfaat dari informasi genetik, hal ini juga dapat menyebabkan gangguan pada orangtua dengan mengetahui bahwa mutasi pada gen mereka adalah penyebab dari gangguan pendengaran pada anak mereka. Penting untuk diingat bahwa mutasi genetik sangat umum terjadi. Tidak ada orang yang bertanggung jawab terhadap gen yang dimilikinya. Keuntungan dan kerugian dari pemeriksaan genetik ini harus dimengerti oleh mereka yang akan menjalani pemeriksaan (Avraham & Kanaan 2012).
2.16. Manfaat Pemeriksaan Genetik
Tes genetik dapat melihat jenis kerusakan pada sistem pendengaran yang menyebabkan ketulian, hal ini penting untuk diketahui karena kerusakan telinga bagian dalam dapat mempengaruhi berfungsinya alat bantu dengar seperti implan koklea. Sebagai tambahan, pada beberapa mutasi gen yang menyebabkan sindroma ketulian, tes genetik dapat memperkirakan apakah ada kelainan medis lain yang mungkin muncul di kemudian hari (Bailey, Jonas & Shawn 2006).
Penelitian di Australia barat menunjukkan bahwa keluarga yang terpapar ketulian mendukung dilakukannya tes genetik ini demi memahami lebih baik mengenai penyebab ketulian serta mengembangkan diskusi terhadap kondisi yang mungkin dihadapi, dan dari survey yang dilakukan diketahui sebagian besar dari mereka menolak dilakukannya terminasi kehamilan walaupun telah diketahui melalui pre-natal diagnosis (PND) bahwa janin yang dikandung mungkin menderita ketulian (Avraham & Kanaan 2012).
2.17. Sekuensing DNA
Sekuensing DNA dapat digunakan untuk menentukan sekuens dari gen tertentu, daerah genetik yang lebih besar (misalnya beberapa gen atau operon), seluruh kromosom atau seluruh genom. Tergantung pada metode yang digunakan, sekuensing dapat menunjukkan urutan nukleotida di DNA atau RNA yang diisolasi dari sel (Morton & Nance 2006; Duman et al. 2011).
2.17.1. Sekuensing Maxam-Gilbert
Allan Maxam dan Walter Gilbert mempublikasikkan metode sekuensing DNA pada tahun 1977 berdasarkan modifikasi kimiawi DNA dan dilanjutkan dengan pemotongan pada basa tertentu. Teknik ini juga dikenal sebagai sekuensing kimiawi. Metode ini memungkinkan penggunaan sampel DNA untai ganda yang dimurnikan tanpa kloning. Metode ini menggunakan labeling radioaktif serta memiliki kesulitan teknis. Metode ini mulanya cukup populer, namun seiring dengan dikembangkannya metode terminasi rantai menjadi semakin mudah dan murah, metode sekuensing Maxam-Gilbert menjadi tidak populer (Brownstein et al. 2011).
2.17.2. Sekuensi
Metode penghentian rantai (chain termination) dikembangkan oleh Frederick Sanger et al pada tahun 1977, metode ini menjadi metode pilihan karena relatif mudah dikerjakan serta memiliki kepercayaan yang tinggi. Metode ini menggunakan lebih sedikit bahan kimia toksik dan lebih sedikit radioaktif. Metode ini kemudian diotomatisasi, dan menjadi pilihan selama tahun 1980-an sampai pertengahan 2000-an (Brownstein et al. 2011).
Primer tersebut diperpanjang menggunakan diikutsertakan pula empat jenis basa DNA), juga nukleotida pemutus atau penghenti rantai (terminator rantai) dalam konsentrasi rendah. Penggabungan nukleotida pemutus rantai tersebut secara terbatas kepada rantai DNA oleh polimerase DNA menghasilkan fragmen-fragmen DNA yang berhenti bertumbuh hanya pada posisi pada DNA tempat nukleotida tertentu tersebut tergabungkan. Fragmen-fragmen DNA tersebut lalu dipisahkan menurut ukurannya
Selama itu, banyak pengembangan terhadap metode ini, seperti labeling fluorescent, elektroforesis kapiler, dan otomatisasi. Pengembangan ini memungkinkan sekuensing yang efisien sehingga harganya tidak terlalu mahal (Morton & Nance 2006; Duman & Tekin 2012).
2.18. Restriction Fragment Length Polymorphism (RFLP)
dinamakan menurut spesies bakteri yang menghasilkannya. Contoh: EcoRI adalah enzim RE yang dihasilkan dari bakteri Escherichia coli strain RI (R satu) atau Bam-HIII yang diperoleh dari bakteri Bacillus americanus strain HIII atau H tiga (Cheng et al. 2010).
Pada analisis RFLP, sampel DNA dipecah menjadi potongan-potongan (dicerna) oleh enzim restriksi dan hasil fragmen restriksi terpisah menurut panjangnya oleh elektroforesis gel. Fragmen DNA yang dihasilkan kemudian dipisahkan berdasarkan panjangnya melalui proses yang dikenal sebagai elektroforesis gel agarosa, dan ditransfer ke membran melalui prosedur Southern blot. Hibridisasi membran untuk DNA probe berlabel kemudian menentukan panjang fragmen yang akan melengkapi probe. RFLP terjadi saat panjang fragmen yang terdeteksi bervariasi antara tiap individu. Setiap panjang fragmen dianggap sebagai alel, dan dapat digunakan dalam analisis genetik (Cheng et al. 2010).
penentuan risiko penyakit, dan pengujian paternitas (David, Chang & Jonathan 2006).
Gambar 2.22. Analisis and pewarisan alel fragmen RFLP (Wikipedia 2015)
2.19. Implikasi Klinis Pemeriksaan Genetik
Salah satu tujuan dari penelitian dibidang neurobiologi pendengaran adalah untuk melihat dasar genetik anatomi dan fisiologi proses pendengaran dan ketulian. Karena ketulian dapat disebabkan oleh beragam variasi gangguan genetik yang luas, sehingga tidak ada pengobatan tunggal untuk penderita ketulian. Pengetahuan keterlibatan gen dalam bentuk tuli yang spesifik dapat mendorong perencanaan pengobatan , mengubah gaya hidup, atau bagian untuk intervensi operasi.
sulit dilakukan tes. Tuli kongenital paling sering dijumpai pada skrining pendengaran. Untuk anak yang didiagnosis dengan tuli, etiologinya sering kali sulit ditemukan. Namun dengan uji genetik, identifikasi terjadinya mutasi dapat menghasilkan prognosis yang akurat untuk perkembangan terhadap ketulian. Pengetahuan ini sangat membantu mengarahkan pengobatan. Sebagai contoh, mutasi dari gen GJB2 berarti ketulian bukan disebabkan kelainan neurologis. Anak ini merupakan kandidat untuk implantasi koklea yang baik. Pada pengobatan jangka pendek, identifikasi awal terhadap terjadinya mutasi yang bertanggung jawab terhadap ketulian menawarkan keuntungan untuk pengobatan medikamentosa awal dan lebih spesifik juga untuk memperburuk hilangnya pendengaran, atau lebih baik lagi adalah memperbaikinya (Eisen & Ryugo 2008).
untuk berdifferensiasi ke dalam sel rambut sensorik menjadi over ekspresi produksi gen pada mamalia atonal homolog (Math-1). Sel rambut baru yang berdiferensiasi in vitro telah menunjukkan kemampuan untuk merespon terhadap rangsangan mekanik dan membentuk hubungan dengan sel ganglion spiralis. Jika sel rambut dapat beregenerasi, disfungsi dasar koklea dapat menghalangi stabilitas lingkungan sekitar koklea dimana regenerasi sel rambut dapat berfungsi. Kemampuan untuk memperbaiki abnormalitas molekul spesifik pada koklea sebaik mengganti sel rambut sensorik yang hilang lebih menjanjikan dibanding hanya regenerasi sel rambut saja (Eisen & Ryugo 2008).
2.20. Terapi Untuk Penderita Tuli Kongenital 2.20.1.Alat bantu dengar
Gambar 2.23. Alat bantu dengar (Hearing dan Amplification 2013)
2.20.2.Implan koklea
Implan koklea merupakan alat prostetik yang dirancang untuk mengubah energi suara mekanik menjadi sinyal elektrik yang secara langsung merangsang saraf auditori pada penderita dengan gangguan pendengaran berat-sangat berat. Implan koklea menggantikan fungsi transduser sel rambut koklea yang rusak. Alat ini telah menjadi penatalaksanaan standar dalam rehabilitasi penderita yang tidak tertolong dengan alat bantu dengar konvensional (Wright & Valentine 2008; Bird et al. 2010).
2.20.3. Terapi Genetik
Math1 atau Atoh1 pada mamalia dibutuhkan untuk perkembangan sel rambut koklea yang berfungsi sebagai sel mekanosensori yang diperlukan untuk pendengaran. Ekspresi Atoh1 yang besar dalam sel penunjang koklea dapat meregenerasi sel rambut dan hal ini dapat berguna untuk terapi ketulian (Jin et al. 2013; Parker et al. 2013).
Bentuk paling sederhana terapi gen berupa pengenalan versi normal gen yang mengalami defek pada sel yang sesuai dan berharap sel tersebut akan menggunakan versi normal ini. Pendekatan alternatif adalah pemberian obat yang memiliki akses langsung ke sel target. Dapat pula dibuat jalur alternatif, misalnya, connexin lain mungkin bisa menggantikan connexin 26 dalam membentuk gap junction. Gen GJB2 yang mengkode connexin 26 ini tidak secara normal diekspresikan di koklea. Karena itu dapat dikembangkan obat untuk meningkatkan ekspresi connexin alternatif dalam sel yang membutuhkan pembentukan gap junction baru (Kawamoto et al. 2003).
pada sel rambut yang tidak berfungsi akibat defek genetik. Untuk mereka yang mengalami tuli genetik dapat dipertimbangkan kombinasi antara regenerasi sel rambut dengan terapi gen untuk menggantikan gen yang mengalami defek (Kawamoto et al. 2003).
2.21. Kerangka Teori
Gambar 2.25. Skema kerangka teori GENETIK,
Salah satu atau kedua orang tua mengalami mutasi
Menggerakkan aktin menyebabkan pergerakan stereosilia
Mutasi gen myosin7A
Keterangan: Bila salah satu atau kedua orang tua mengalami mutasi genetik maka akan dapat diturunkan kepada anaknya, misalnya mutasi genetik pada gen MYO7A yang merupakan gen yang terdapat pada silia dan stereosilia berfungsi untuk menggerakkan aktin sehingga menyebabkan pergerakan stereosilia, mutasi pada gen MYO7A mengakibatkan gangguan pada transduksi mekanoelektrik, sehingga menyebabkan tuli kongenital pada anaknya, demikian pula dengan mutasi gen gap junction beta 2 (GJB2) yang merupakan gen pada gap junction. Saat stimulasi suara, kalium dilepaskan oleh sel-sel rambut dan memasuki sel-sel penunjang dengan bantuan K+/Cl- ko-transporter, KCC4. Kalium (K+) kemudian dikeluarkan melalui kanal-kanal gap junction. GJB2 tipe wild yang menghasilkan protein connexin26 juga memungkinkan aliran interselular dari Ins(1,4,5)P3 dan propagasi gelombang Ca2+. Hal ini menghasilkan aktivasi jarak jauh dari sistem refluks K+/Cl- yang menggunakan kembali K+ dari sel-sel penunjang ke dalam endolimfe untuk mencegah kelebihan ion. Mutasi GJB2 menyebabkan penurunan aktivitas ko-transpor, akumulasi ion K+ di ruang ekstraselular yang mengelilingi sel-sel rambut dan sel-sel penunjang sehingga menyebabkan gangguan homeostasis ion di koklea kemudian menyebabkan kematian sel dan menimbulkan ketulian.
2.22. Kerangka Konsep