134
Penetapan Kadar Total α-Mangostin Dalam Ekstrak Etanol Kulit
Batang Asam Kandis (Garcinia cowa Roxb. ex Choisy) Dengan
Spektrofotometri Ultraviolet
(Determination of Total Level of α-Mangostin in Ethanol Extract of Stem Bark of
Kandis Acid (Garcinia cowa Roxb. ex Choisy) by Ultraviolet Spectrophotometry)
Fitra Fauziah
1*; Roslinda Rasyid
2; & Hesti Septiana
1 1SekolahTinggi Ilmu Farmasi (STIFARM) Padang
2Fakultas Farmasi Universitas Andalas Padang
*Corresponding email: mrs.fitrafauziah@gmail.com
ABSTRAK
α-Mangostin merupakan salah satu senyawa golongan xanton yang memiliki aktifitas antibakteri, antijamur, antitumor, antiinflamasi dan antioksidan. Senyawa ini banyak terdapat pada genus Garcinia, salah satunya yaitu asam kandis (Garcinia cowa Roxb. ex Choisy). Penelitian ini bertujuan untuk menetapkan kadar α-mangostin dalam ekstrak etanol kulit batang asam kandis dengan menggunakan metode spektrofotometri ultraviolet (UV). Ekstraksi dilakukan dengan maserasi dengan etanol 70 %. Identifikasi dengan KLT dilakukan terhadap ekstrak dan pembanding α-mangostin dengan fase diam silika gel 60 F254 dan fase gerak kloroform : etil asetat (9 : 1). Hasil identifikasi dengan KLT diperoleh nilai Rf pada ekstrak hampir sama dengan pembanding α-mangostin. Analisis dengan spektrofotometri UV diperoleh panjang gelombang maksimum α-mangostin yaitu 244 nm dan persamaan regresi linear dari kurva kalibrasi yaitu y = 0,0008 + 0,0854 x. Validasi metode analisis menunjukkan bahwa metode ini memenuhi akurasi dengan rata – rata persen perolehan kembali yaitu 107,8477%, presisi intraday
diperoleh rata-rata persen RSD yaitu 0,4589%, 0,4475% dan 0,3688%, presisi interday yaitu 0,6752%, linearitas yaitu 0,9997, batas deteksi yaitu 0,1159 µg/mL dan batas kuantitasi yaitu 0,3864 µg/mL. Hasil penetapan kadar total α-mangostin dalam ekstrak etanol kulit batang asam kandis yaitu 2,4302 ± 0,0158 %.
Kata Kunci: α-Mangostin, ekstrak, Garcinia cowa, spektrofotometri ultraviolet. PENDAHULUAN
Sumatera Barat merupakan daerah yang subur dan kaya dengan berbagai tumbuhan. Sebagian tumbuhan tersebut telah digunakan secara tradisional oleh masyarakat sebagai bahan obat (Adnan, 1991). Salah satunya yaitu asam kandis (Garcinia cowa Roxb. ex Choisy). Tumbuhan ini banyak ditemukan di daerah tropis seperti India, Thailand, Malaysia
dan Indonesia (Whitmore, 1973). Akhir-akhir ini tumbuhan dari genus Garcinia ini banyak diteliti kandungan dan aktivitasnya. Genus ini dilaporkan mengandung xanton, benzofenon, triterpen, flavonoid dan benzoquinon (Kenji, et al., 2003; Rukachaisirikul, et al., 2008). Senyawa xanton terutama dikenal dengan potensinya sebagai antikanker (Chiang, et al., 2003).
135 Aktivitas lain dari senyawa tersebut
yaitu sebagai antileukimia, hipoglisemik, sitotoksik, antimikroba, antioksidan, antimalaria dan aktivitas penghambat HIV (Linuma, et al.,
1996). Senyawa-senyawa xanton dan flavonoid dari genus Garcinia yang mempunyai aktivitas antimalaria mayoritas yaitu senyawa xanton dan flavonoid yang tersubstitusi gugus hidroksi (Ignatuschenko, et al., 1997; Fotie, 2008).
Asam kandis (Garcinia cowa Roxb. ex Choisy) sebagai salah satu dari tumbuhan genus
Garcinia mengandung senyawa xanton
teroksigenasi dan terprenilasi, flavonoid dan benzofenon hampir pada semua bagian tanaman ini (Ampofo, et al., 1986). Pada kulit batang asam kandis mengandung berbagai macam senyawa yang salah satunya yaitu α-mangostin yang merupakan salah satu senyawa golongan xanton (Wahyuni, et al., 2004).
Pemanfaatan asam kandis sampai saat ini masih terbatas pada kayunya sebagai bahan bangunan, buahnya sebagai manisan dan bumbu masak (Darwati, et al., 2009). Daun dan buah digunakan untuk memperlancar peredaran darah, pengencer dahak pada batuk pilek dan tonikum (Panthong et al., 2006). Kulit batang telah digunakan secara tradisional sebagai antipiretik (Pattalung et al., 1994). Pada getahnya dilaporkan mengandung senyawa cowargacinon A-E (Mahabusarakam, et al., 2005). Sedangkan pada daun, buah dan kulit buah yang telah dikeringkan dilaporkan mengandung asam-asam organik seperti asam hidroksisitrat, asam sitrat dan asam oksalat (Jena, et al., 2002).
α-Mangostin merupakan senyawa mayor yang terdapat di dalam kulit buah manggis sehingga berfungsi sebagai senyawa penanda dari ekstrak kulit buah manggis. Selain itu juga berfungsi dalam menentukan kontrol
kualitas dari ekstrak kulit buah manggis dan sediaannya (Yates & Stout, 1958; Pedraza, et al.,
2009). Dari penelitian sebelumnya diperoleh kadar α-mangostin dalam ekstrak kulit buah muda, kulit buah matang dan kulit batang
Garcinia mangostana dengan metode
TLC-Densitometri secara berturut- turut 4,19 %, 15,85 % dan 3,88 %(Agustina, 2014).
Berdasarkan hal di atas, maka dalam penelitian ini dilakukan penetapan kadar total α-mangostin dalam ekstrak etanol kulit batang asam kandis (Garcinia cowa Roxb. ex Choisy) dengan metode Spektrofotometri UV, karena panjang gelombang α-mangostin berada pada kisaran antara 200–400 nm. Metode ini dipilih karena kinerjanya cepat, murah, dapat mengukur dengan mudah dan ketelitiannya baik.
METODE PENELITIAN Alat dan Bahan
Alat-alat yang digunakan yaitu Sektrofotometer UV-Visibel (Shimadzu UV mini-1240), plat KLT Silika gel 60 F254 (Merck), bejana kromatografi, pipet mikro, lampu UV, desikator, aluminium foil, destilasi vakum, botol maserasi, rotary evaporator (IKA Basic®), gelas ukur, erlemenyer, labu ukur, pipet tetes, beaker glass (Pyrex), spatel, batang pengaduk, pipet ukur (Pyrex), timbangan analitik (Ohaus), waterbath, oven, botol timbang dan krus porselen.
Bahan-bahan yang digunakan yaitu kulit batang asam kandis (Garcinia cowa Roxb. ex Choisy), α-mangostin (Wuxi Gorunjie Natural-Pharma Co., Ltd), aquadest, asam sulfat encer (Merck), kloroform (Merck), etil asetat (Merck), metanol (PT Brataco) dan etanol 70% (PT Brataco).
136 Pengumpulan Sampel
Sampel yang digunakan yaitu kulit batang asam kandis yang diambil secara manual sebanyak 2 kg diperoleh di daerah Korong Kampung Jambak, Nagari Sunur, Kecamatan Nan Sabaris, Kabupaten Padang Pariaman, Sumatera Barat.
Identifikasi Tanaman Asam Kandis
Tanaman asam kandis diidentifikasi di Herbarium Universitas Andalas (ANDA), Jurusan Biologi, FMIPA, Universitas Andalas, Padang, Sumatera Barat.
Pembuatan Simplisia
Pada umumnya pembuatan simplisia melalui tahapan seperti berikut : sortasi basah, pencucian, perajangan, pengeringan, sortasi kering, penyiapan simplisia (Departemen Kesehatan Republik Indonesia, 1985).
Ekstraksi Sampel
Ekstrak dibuat dengan cara maserasi menggunakan etanol 70%. Sebanyak 400,152 g serbuk simplisia kulit batang asam kandis dimasukkan kedalam botol maserasi masing – masing 100 g. Tambahkan etanol 70% sebanyak 1 L masing – masing botol maserasi, rendam selama 6 jam sambil sesekali diaduk. Simpan di tempat yang terlindung dari cahaya matahari langsung selama 18 jam atau 24 jam. Kemudian disaring dengan kertas saring maka didapat maserat I. Rendam kembali ampasnya dengan etanol 70% sebanyak tiga kali pengulangan sehingga didapat maserat II dan III. Kumpulkan semua maserat dalam satu wadah, kemudian dipekatkan dengan rotary evaporator setelah itu diuapkan dengan waterbath pada temperatur 65oC sampai didapat ekstrak kental (Badan
Pengawasan Obat dan Makanan Republik Indonesia, 2004).
Karakterisasi Ekstrak Kental
Karakterisasi terhadap ekstrak kental yang dilakukan terdiri dari karakterisasi spesifik dan non spesifik. Karakterisasi spesifik meliputi identitas ekstrak, organoleptis, penetapan kadar sari larut air dan kadar sari larut etanol. Karakterisasi non spesifik meliputi penetapan susut pengeringan, kadar abu total dan kadar abu tidak larut asam (Departemen Kesehatan Republik Indonesia, 2000).
Kromatografi Lapis Tipis (Depkes RI, 2010)
Sebelum uji KLT dilakukan, lakukan penjenuhan bejana dengan larutan fase gerak kloroform : etil asetat (9:1). Larutan sampel, larutan pembanding dan campuran larutan sampel dan pembanding masing-masing ditotolkan pada plat KLT Silika gel 60 F254 ukuran 10 x 5 cm, menurut cara yang tertera pada masing-masing monografi dengan jarak 1-2 cm dari tepi atas dan bawah plat KLT dan biarkan mengering. Masukkan plat KLT pada rak penyangga, pada bejana kromatografi, biarkan sistem hingga fase gerak merambat hingga batas jarak rambat. Keluarkan plat KLT Silika gel 60 F254 dan keringanginkan di udara dan amati noda dengan menggunakan lampu UV 254 nm.
Pembuatan larutan induk α- mangostin
kadar 1000 μg/mL
Timbang 25 mg zat murni α-mangostin dilarutkan dengan metanol ke dalam labu ukur 25 mL lalu dicukupkan volumenya sampai tanda batas, sehingga diperoleh larutan induk dengan kadar 1000 μg/mL α-mangostin.
137 Penentuan panjang gelombang serapan
maksimum α-mangostin
Larutan induk dengan kadar 1000 μg/mL α-mangostin diencerkan sehingga diperoleh larutan α-mangostin dalam pelarut metanol dengan kadar 100 μg/mL. Kemudian diencerkan kembali sehingga diperoleh larutan α-mangostin dengan kadar 6 μg/mL. Kemudian diukur panjang gelombang maksimumnya dengan spektrofotometer UV-Vis pada rentang panjang gelombang 200-400 nm.
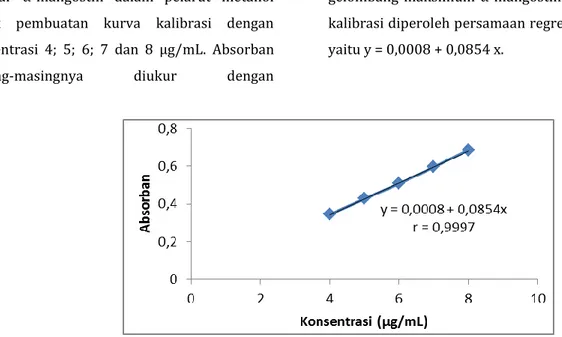
Pembuatan kurva kalibrasi α-mangostin Penentuan kurva kalibrasi diawali dengan pembuatan larutan seri standar α-mangostin dalam pelarut metanol dengan kadar 4, 5, 6, 7 dan 8 µg/mL. Kemudian diukur absorbannya dengan spektrofotometer UV-Vis pada panjang gelombang maksimum α-mangostin. Buat kurva kalibrasi α-mangostin dan tentukan persamaan regresi linearnya. Penetapan Kadar α-mangostin
Timbang 25 mg ekstrak kulit batang asam kandis, kemudian masukkan ke dalam labu ukur 25 mL. Larutkan dengan metanol. Cukupkan dengan metanol hingga tanda batas, kocok homogen. Kemudian encerkan dengan cara dipipet 0,6 mL larutan α-mangostin sebelumnya, masukkan ke dalam labu ukur 10 mL, cukupkan dengan metanol hingga tanda batas, dan kocok homogen. Lakukan penetapan kadar α-mangostin tersebut dengan tiga kali pengulangan. Masing- masingnya diukur absorbannya dengan spektrofotometer UV-Vis pada panjang gelombang α-mangostin.
Validasi Metode Analisis Linearitas
Linearitas ditentukan berdasarkan nilai koefisien korelasi dari kurva kalibrasi α-mangostin.
Batas Deteksi dan Batas Kuantitasi
Batas deteksi dan batas kuantitasi ditentukan berdasarkan pada simpangan baku dan kemiringan dari kurva kalibrasi α-mangostin.
Akurasi
Akurasi ditentukan oleh pengujian persen perolehan kembali (recovery) menggunakan metode penambahan baku/adisi standar α-mangostin (standar addition method) sebesar 80%, 100% dan 120%. Larutan diukur absorbannya dengan tiga kali pengulangan dengan spektrofotometri UV untuk tiap–tiap kadar. Nilai persen perolehan kembali dihitung dengan cara membandingkan kadar terukur dengan kadar sebenarnya.
Presisi
Larutan standar α-mangostin dengan berbagai kadar 6, 7 dan 8 µg/mL sebanyak tiga kali pengulangan diukur absorbannya pada hari yang sama untuk presisi intraday dan tiga hari berturut-turut untuk presisi interday. Presisi dinyatakan sebagai persen Simpangan Baku Relatif atau Relative Standard Deviation (RSD). Analisis data
Kadar larutan sampel dihitung berdasarkan persamaan regresi linear (y = a + bx) dari kurva kalibrasi α-mangostin.
BD = 3 x SB
b
BK = 10 x SB
b
138 HASIL DAN DISKUSI
Dari penelitian yang telah dilakukan diperoleh hasil sebagai berikut :
1. Identifikasi sampel diperoleh bahwa sampel yang digunakan yaitu kulit batang asam kandis, dengan nama spesies Garcinia cowa
Roxb. ex Choisy dari famili Clusiaceae. 2. Dari 2 kg kulit batang asam kandis segar
(Garcinia cowa Roxb. ex Choisy) diperoleh 400,152 g serbuk simplisia kulit batang asam kandis, didapatkan ekstrak kental sebanyak 66,8332 g, rendemen ekstrak etanol kulit batang asam kandis yaitu 16,7019%.
3. Karakterisasi Ekstrak a. Karakterisasi Spesifik
Identitas
Nama ekstrak: Extractum Garcinia cowa
Roxb. ex Choisy. Spissum
Nama latin: Garcinia cowa Roxb. ex Choisy
Bagian tumbuhan: Cortex (Kulit Batang) Nama tumbuhan: Asam kandis
Pemeriksaan organoleptis ekstrak: bentuk kental, warna coklat kemerahan, bau khas, dan rasa pahit.
Kadar sari larut air dan kadar sari larut etanol yaitu 51,8029±0,0891% dan 68,3208±0,0310%.
b. Karakterisasi Non Spesifik
Susut pengeringan yaitu 9,6446 ±0,0021%, kadar abu total yaitu 4,5709± 0,0006%, dan kadar abu tidak larut asam yaitu 1,5947±0,1259%.
4. Analisis Kualitatif dengan KLT diperoleh nilai
Rf sampel yaitu 0,60, Rf pembanding yaitu 0,61 dan Rf campuran sampel dan pembanding yaitu 0,61.
5. Kurva Kalibrasi α-mangostin diperoleh persamaan regresi linear y = 0,0008 + 0,0854x.
6. Pengujian linearitas diperoleh nilai koefisien korelasi (r) = 0,9997.
7. Penentuan batas deteksi dan batas kuantitasi yaitu 0,1159 μg/mL dan 0,3865 μg/mL. 8. Penentuan presisi intraday α-mangostin
pada konsentrasi 6 μg/mL diperoleh RSD berturut-turut 0,5869%; 0,2995% dan 0,4902%, konsentrasi 7 μg/mL diperoleh RSD berturut-turut 0,2544%; 0,5849% dan 0,5032% dan konsentrasi 8 μg/mL diperoleh RSD berturut-turut 0,2212%; 0,4425% dan 0,4427%. Penentuan presisi interday α-mangostin pada konsentrasi 6, 7 dan 8 μg/mL diperoleh RSD berturut-turut 1,1048%; 0,6300% dan 0,2908%.
9. Penentuan akurasi dari larutan standar α-mangostin 2,9370 μg/ml, 3,6713 μg/ml, dan 4,4056 μg/ml yang ditambahkan ke dalam ekstrak kulit batang asam kandis dengan kadar rata–rata 3,6713 μg/ml diperoleh persen recovery masing-masing yaitu 102,3323%; 108,3376% dan 112,8733%. 10. Kadar α-mangostin yang diperoleh 2,4302±
0,0158%.
Pada penelitian ini digunakan kulit batang asam kandis (Garcinia cowa Roxb. ex Choisy). Tanaman asam kandis yang digunakan diidentifikasi di Herbarium Universitas Andalas, jurusan Biologi, Fakultas MIPA Universitas Andalas, Padang, Sumatera Barat. Hasil identifikasi diperoleh bahwa tanaman yang digunakan adalah asam kandis dengan nama spesies Garcinia cowa Roxb. ex Choisy dari famili Clusiaceae. Ekstrak etanol kulit batang asam kandis diperoleh dengan metode ekstraksi yaitu maserasi. Pemilihan metode ini karena
139 bisa digunakan untuk sampel dengan jumlah
yang banyak, pelaksanaannya sederhana, tidak memerlukan perlakuan khusus dan kemungkinan terjadinya penguraian zat aktif oleh pengaruh suhu dapat dihindari karena tidak ada proses pemanasan.
Kulit batang asam kandis diambil sebanyak 2 kg, kemudian dirajang terlebih dahulu sebelum dimaserasi dengan tujuan agar pelarut dapat berpenetrasi dengan mudah sehingga penarikan zat aktif lebih sempurna (Harbone, 1987). Kemudian dilakukan pengeringan dan diperoleh kadar air 9,4902%. Sampel dihaluskan dengan alat grinder dan diperoleh serbuk simplisia sebanyak 400,152 g.
Maserasi sampel dilakukan dengan menggunakan pelarut etanol 70%. Penggunaan etanol sebagai pelarut universal disebabkan karena sifatnya yang mudah melarutkan senyawa zat aktif baik yang bersifat polar, semi polar dan non polar serta kemampuannya untuk mengendapkan protein dan menghambat kerja enzim sehingga dapat menghindari proses hidrolisa dan oksidasi (Harbone, 1987). Keuntungan lain etanol mudah berpenetrasi kedalam sel. Maserasi dilakukan selama tiga hari dengan tiga kali pengulangan.
Maserat yang didapat diuapkan dengan destilasi vakum tujuannya untuk mengurangi tekanan udara pada permukaan sehingga tekanan uap pelarut dan titik didih pelarut akan turun dan pelarut akan mendidih pada temperatur yang lebih rendah dari titik didihnya. Hal ini dapat mencegah rusaknya senyawa kimia yang tidak tahan terhadap pemanasan. Sisa pelarut kemudian dipekatkan lagi dengan rotary evaporator, sehingga diperoleh ekstrak kental 66,8332 g. Rendemen ekstrak diperoleh 16,7019%.
Kemudian dilakukan karakterisasi ekstrak yang terdiri dari karakterisasi spesifik dan non spesifik. Untuk karakterisasi spesifik meliputi identitas ekstrak, pemeriksaan organoleptis ekstrak, kadar sari larut air dan kadar sari larut etanol. Kadar sari larut air yaitu 51,8029±0,0891% dan kadar sari larut etanol yaitu 68,3208±0,0310%. Karakterisasi non spesifik meliputi susut pengeringan, kadar abu total dan kadar abu tidak larut asam. Susut pengeringan diperoleh 9,6446±0,0021%, kadar abu total yaitu 4,5709± 0,0006% dan kadar abu tidak larut asam yaitu 1,5947±0,1259%. Susut pengeringan dilakukan bertujuan untuk untuk memberikan batasan maksimal (rentang) tentang besarnya senyawa yang hilang pada proses pengeringan. Kadar abu total dan kadar abu tidak larut asam bertujuan untuk memberikan gambaran kandungan mineral internal dan eksternal yang berasal dari awal sampai terbentuknya ekstrak (Departemen Kesehatan Republik Indonesia, 2000).
Kemudian dilakukan uji kualitatif dengan KLT dengan tujuan untuk mengidentifikasi senyawa α-mangostin di dalam kulit batang asam kandis dengan dibandingkan dengan senyawa pembandingnya yaitu α-mangostin. Dalam pengujian ini, fase gerak yang digunakan yaitu kloroform : etil asetat (9:1). Dari pengujian diperoleh nilai Rf untuk pembanding 0,61; sampel kulit batang asam kandis 0,60 dan campuran sampel dan pembanding 0,61. Nilai Rr diperoleh yaitu 0,98. Harga Rr yaitu perbandingan jarak rambat suatu senyawa tertentu dengan jarak perambatan baku pembanding. Jika zat uji yang diidentifikasi dan baku pembanding itu sama terdapat kesesuaian dalam warna dan harga Rf. Berdasarkan data tersebut menunjukan bahwa sampel kulit batang asam kandis mempunyai
140 nilai Rf yang hampir sama dengan senyawa
pembandingnya. Hal ini menunjukan bahwa sampel kulit batang asam kandis mengandung senyawa α-mangostin.
Selanjutnya dilakukan pembuatan larutan induk α-mangostin dalam pelarut metanol dengan konsentrasi 1000 µg/mL. Kemudian dilakukan pembuatan larutan untuk penentuan panjang gelombang α-mangostin.
Larutan yang digunakan yaitu larutan standar α-mangostin dalam pelarut metanol dengan konsentrasi 6 µg/mL. Kemudian dilakukan penentuan panjang gelombang maksimum α-mangostin dengan spektrofotometer UV-Vis pada rentang panjang gelombang 200-400 nm. Dari hasil pengukuran diperoleh panjang gelombang α-mangostin yaitu 244 nm.
Gambar 1.
Panjang Gelombang Maksimum α-Mangostin Selanjutnya pembuatan larutan seristandar α-mangostin dalam pelarut metanol untuk pembuatan kurva kalibrasi dengan konsentrasi 4; 5; 6; 7 dan 8 µg/mL. Absorban masing-masingnya diukur dengan
spektrofotometer UV-Vis pada panjang gelombang maksimum α-mangostin. Dari kurva kalibrasi diperoleh persamaan regresi linearnya yaitu y = 0,0008 + 0,0854 x.
Gambar 2.
Kurva Kalibrasi α-Mangostin Kemudian dilanjutkan dengan validasimetode analisis. Validasi metode analisis
merupakan suatu tindakan penilaian terhadap parameter tertentu, berdasarkan percobaan
141 laboratorium, untuk membuktikan bahwa
parameter tersebut memenuhi persyaratan untuk penggunaannya (Harmita, 2004). Beberapa parameter yang diamati yaitu linearitas, batas deteksi, batas kuantitasi, akurasi dan presisi.
Uji linearitas dilakukan mengacu pada nilai koefisien korelasi (r) yang diperoleh dari kurva kalibrasi α-mangostin yaitu 0,9997. Berdasarkan nilai tersebut menunjukkan bahwa metode analisis tersebut memenuhi linearitas dimana 0,990 ≤ r ≤ 1. Penentuan batas deteksi dilakukan untuk mengetahui jumlah terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan dibandingkan dengan blanko. Sedangkan batas kuantitasi dilakukan untuk mengetahui jumlah terkecil analit dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama (Harmita, 2004). Nilai batas deteksi dan batas kuantitasi ditentukan dari persamaan regresi linear dan simpangan bakunya, dimana nilai batas deteksi dan batas kuantitasi yaitu 0,1159 µg/mL dan 0,3864 µg/mL.
Uji presisi (keseksamaan) dilakukan sebagai ukuran yang menunjukkan derajat kesesuaian antara hasil individu, diukur melalui penyebaran hasil individual dari rata–rata jika prosedur diterapkan secara berulang pada sampel-sampel yang diambil dari campuran homogen. Kriteria presisi diberikan jika metode memberikan simpangan baku relatif atau
relative standard deviation (RSD) atau koefisien variasi 2% atau kurang. Akan tetapi, kriteria ini sangat fleksibel tergantung pada kadar analit yang diperiksa, jumlah sampel, dan kondisi laboratorium. Dari penelitian diperoleh bahwa koefisien variasi meningkat dengan menurunnya kadar analit yang dianalisis. Ditemukan bahwa koefisien variasi meningkat
seiring dengan menurunnya kadar analit. Pada kadar 1% atau lebih, standar deviasi relatif antara laboratorium yaitu sekitar 2,5% ada pada satu perseribu yaitu 5%. Pada kadar satu per sejuta (ppm) RSD nya yaitu 16% dan pada kadar part per bilion (ppb) yaitu 32%. Pada metode yang sangat kritis, secara umum diterima bahwa RSD harus lebih dari 2% (Harmita, 2004).
Presisi interday dilakukan selama tiga hari berturut–turut terhadap larutan standar α-mangostin dengan kadar 6, 7 dan 8 µg/mL dan diperoleh nilai RSD berturut-turut 1,1048%; 0,6300% dan 0,2908%. Sedangkan pada presisi
intraday dilakukan pada hari yang sama terhadap larutan standar α-mangostin dengan kadar 6 µg/mL dengan nilai RSD berturut-turut 0,5869%; 0,2995% dan 0,4902%; kadar 7 µg/mL dengan nilai RSD berturut-turut 0,2544%; 0,5849% dan 0,5032% dan kadar 8 µg/mL dengan nilai RSD berturut-turut 0,2212%; 0,4425% dan 0,4427%. Dari nilai RSD yang didapatkan diperoleh nilai RSD kurang dari 16%, sehingga dapat dikatakan bahwa metode ini mempunyai nilai presisi yang baik.
Uji akurasi (kecermatan) merupakan ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit yang sebenarnya. Kecermatan dinyatakan sebagai persen perolehan kembali (% recovery) (Harmita, 2004). Pengujian akurasi pada penelitian ini menggunakan metode adisi. Metode adisi dilakukan dengan menambahkan sejumlah analit dengan kadar tertentu pada sampel yang dianalisis. Untuk perolehan kembali 80% yaitu dengan menambahkan 0,2937 mg standar α-mangostin diperoleh % perolehan kembali 102,3323%. Untuk perolehan kembali 100% yaitu dengan menambahkan 0,3671 mg standar α-mangostin diperoleh % perolehan kembali 108,3376%.
142 Untuk perolehan kembali 120% yaitu dengan
menambahkan 0,4046 mg standar α-mangostin diperoleh % perolehan kembali 112,8733%. Dari hasil uji akurasi diperoleh % perolehan kembali berada pada rentang yang diperbolehkan yaitu 80-110% (Harmita, 2004). Ini menunjukkan bahwa metode ini memberikan hasil yang akurat. Pada penetapan kadar α-mangostin dalam ekstrak kulit batang asam kandis dengan metode spektrofotometri UV diperoleh kadar α-mangostin yaitu 2,4302 ± 0,0158%.
KESIMPULAN
1. Hasil pengujian terhadap beberapa
parameter validasi metode analisis yaitu linearitas, batas deteksi, batas kuantitasi, akurasi dan presisi diperoleh bahwa metode analisis penetapan kadar α-mangostin dalam ekstrak etanol kulit batang asam kandis (Garcinia cowa Roxb. ex Choisy) dengan spektrofotometri UV memenuhi kriteria parameter validasi metode analisis.
2. Kadar α-mangostin dalam ekstrak kulit
batang asam kandis yaitu 2,4302 ± 0,0158%.
DAFTAR PUSTAKA
Adnan, A. Z. (1991). Penelitian Farmasi dalam Tantangan Masa. Padang: Pusat Penelitian Universitas Andalas.
Agustina, R. (2014). Analisis α-Mangostin dari Ekstrak Kulit Buah Muda, Kulit Buah Matang dan Kulit Batang Manggis (Garcinia mangostana, L) dengan TLC Scannner. Skripsi Fakultas Farmasi Universitas Andalas, Padang.
Ampofo, Stephen, A., & Waterman, P. G. (1986). Xanthones from Three Garcinia Species.
Phytochmistry, 25 (10): 2351-2355.
Badan Pengawasan Obat dan Makanan Republik Indonesia. (2004). Monografi Ekstrak Tumbuhan Obat Indonesia. Volume 1. Jakarta : Badan Pengawasan Obat dan Makanan Republik Indonesia
Chiang, Y., Kuo, Y., Oota, S., & Fukuyama, Y. (2003). Xanthones and Benzophenones from the Stems of
Garcinia multiflora. J Nat Prod, 66: 1070-1073. Darwati, Husen H. B., Supriyatna & Dachriyanus. (2009).
Kowanin Suatu Santon Dari Kulit Batang Garcinia cowa Roxb. JNatur Indonesia, 11(2): 109-114. Departemen Kesehatan Republik Indonesia. (1985).
Cara Pembuatan Simplisia. Jakarta: Direktorat Jendral Pengawasan Obat dan Makanan.
Departemen Kesehatan Republik Indonesia. (2000).
Parameter Standar Umum Ekstrak Tumbuhan Obat. (Edisi I). Jakarta: Direktorat Pengawasan Obat dan Makanan, Direktorat Pengawasan Obat Tradisional. Fotie, J. (2008). The Antiprotozoan Potential of Flavonoids. Pharmacognocosyreviews, 2(3): 6-19. Harbone, J. B. (1987). Metode Fitokimia, Penuntun Cara
Modern Menganalisis Tumbuhan. (edisi ke-2
cetakan 1). Diterjemahkan oleh K. Padmawinata dan I. Soediro. Bandung: Penerbit ITB.
Harmita, (2004).Petunjuk Pelaksanaan Validasi Metode
dan Cara Perhitungannya, Majalah Ilmu
Kefarmasian, 1(3): 117-135.
Ignatuschenko, M. V., Winter, R., Bachinger, H. P., Hincrichs, D. J., & Riscoe, M. K. (1997). Xanthone as Antimalarial AgentsStudies of a Possible Mode of Action. FEBS Lett, 409: 67-73.
Jena, B. S., Jayaprakasha, G. K., & Sakariah, K. K. (2002). Organic acids from leaves,fruits, and rinds of Garcinia cowa. Journal of Agricultural and food chemistry, 50(12): 3431-3434.
Kenji, M., Yukihiro, A., Emi, K., Tetsuro, I., Kenji, O., Toshiyuki, T., Munekazu, I., & Yoshinori, N. (2003). Cytotoxic benzophenone derivatives from Garcinia species display a strong apoptosis-inducing effect against human leukemia cell lines. Biol Pharm Bull,
26: 569-571.
Linuma, M., Tosa H., Tanaka, T., Riswan, S. (1996). Two New Dimeric Xantones In Mesua errea.
Phytochemistry, 43(9).
Mahabusarakam, W., Chairerk, P., & Taylor, W. C. (2005). Xanthones from Garcinia cowa Roxb. ex Choisy. Latex.Phytochemistry, 66, 1148-1153. Panthong, K., Pongcharoen, W., Phongpaichit, S. &
Taylor, W., C. (2006). Tetraoxygenated Xanthones From The Fruits Of Garcinia cowa. Phytochemistry, 67(10): 999-1004.
Pattalung, P., Thongtheeraparp, W., Wiriyachitra, P. & Taylor, W., C. (1994). Xanthones Of Garcinia cowa.
143
Pedraza-Chaverri J., Reyes-Fermin L. M., Nolasco-Amaya E. G., Orozco-Ibarra M., & Medina-Campos O. N. (2009), ROS scavenging capacity and
neuroprotective Effect of α-mangostin against 3-nitropropionic acid in cerebellar granula neurons.
Exp Toxicol Pathol, 61: 491-501.
Rukachaisirikul, V., Trisuwan, K., Sukpondma, Y., & Phongpaichit, S. (2008). A New Benzoquinone Derivative from the Leaves of Garcinia parvifolia.
Arch Pharm Res, 31: 17-20.
Wahyuni, F. S., Byrne, L. T., Dachriyanus, Dianita, R., Jubahar, J., Lajis, N. H., & Sargent, M. V. (2004). A New Ring-Reduced Tetraprenyltoluquinone and a Prenylated Xanthone from Garcinia cowa. Aust. J Chem. 57: 223-226.
Whitmore, T. C. (1973). Tree Flora of Malaya, A Manual For Forest volume 2. London: Longman Group Limited.
Yates, P., & Stout, Gh. (1958). The Structure of Mangostin. J Am Chem Soc 80: 1691-1700.