R e a k s i H i d r o l i s i s M i n y a k Z a i t u n M e n g g u n a k a n L i p a s e R h i z o p u s
o r y z a e y a n g d i I m o b i l i s a s i M e l a l u i M e t o d e A d s o r p s i
Praswasti PDK Wulan, Muhammad Titis Rejoso, Heri Hermansyah
Departemen Teknik Kimia, Fakultas Teknik, Universitas Indonesia
Kampus UI Depok 16424
Email:
wulan@che.ui.edu
Abstrak
Immobilisasi merupakan teknik recovery enzim yang menjadi perhatian dalam beberapa tahun belakangan, dilakukan dengan bantuan support sebagai media yang dapat mencegah terlarutnya enzim. Metode immobilisasi yang digunakan pada penelitian ini adalah metode adsorpsi, dengan menggunakan lipase Rhizopus oryzae. Reaksi yang diamati adalah reaksi hidrolisis minyak zaitun dalam sistem emulsi minyak-air. Beberapa macam support seperti kitin, silika gel, Al2O3, CaCO3,
dan latex diseleksi berdasarkan kemampuannya dalam mengadsorb lipase. Reaksi hidrolisis dengan free lipase pada jam ke-8 memperlihatkan konversi hidrolisis mencapai 29.46 %. Kitin dan silika gel memiliki enzim loading masing-masing 68.67 %, 56.62 %, lebih besar dibandingkan Al2O3 (50.60 %), CaCO3 (46.98 %), dan latex (43.37 %). Silika gel dan kitin
disimpulkan sebagai support terbaik untuk immobilisasi adsorpsi. Waktu adsorpsi optimal kitin dan silika gel dalam meng-immobilisasi lipase adalah selama 3 jam. Lipase pada support kitin memiliki konversi hidrolisis 24.7 %, lebih tinggi dibanding lipase silika gel sebesar 19.9 %. Lipase bekerja optimal pada pH 7 dan temperatur 37 oC. Hal ini berlaku untuk free lipase maupun lipase ter-immobilisasi. Lipase ter-immobilisasi dalam uji stabilitas dapat dioperasikan sampai pada penggunaan ke-3 kali, reaksi selanjutnya menghasilkan konversi hidrolisis dibawah 5 % yang dianggap sudah tidak ekonomis untuk dilanjutkan.
Kata kunci: lipase; immobilisasi; support; hidrolisis
Abstract
Enzyme immobilization is a recovery technique that has been studied in several years, using support as a media to help enzyme dissolutions to the reaction substrate. Immobilizing method used in this study was adsorption method, using specific lipase from Rhizopus oryzae. The reaction studied was olive oil hydrolysis in oil-water emulsion system. Several support such as chitin, silica gel, Al2O3, CaCO3, and latex were selected by its ability to adsorb lipase. Hydrolysis reaction using free lipase show the conversion reaches 29.46 % at 8 hours. Chitin and silica gel shows enzyme loading rate respectively 68.67 % and 56.62 %, giving more lipase to adsorb than Al2O3 (50.60 %), CaCO3 (46.98 %), and latex (43.37 %). Silica gel and chitin concluded as the best support for adsorption technique. Optimal time needed by this support to adsorb lipase is 3 hours. Lipase in chitin reaches 24.7 % for the conversion of hydrolysis, higher than silica gel support 19.9 %.Lipase reacts optimally in pH 7 and temperature 37 oC. Identical result showed for free lipase and immobilized lipase. Immobilized lipase shows stability until its 3rd uses, further reaction yielding hydrolysis conversion below 5 %, and considered uneconomic to be continued. Key words: lipase; immobilized; support; hydrolysis
Pendahuluan
Lipase merupakan enzim yang memiliki peran yang penting dalam bioteknologi modern. Banyak industri yang telah mengaplikasikan penggunaan enzim sebagai biokatalis. Lipase terkenal memiliki aktivitas yang tinggi dalam reaksi hidrolisis dan dalam kimia sintesis. Lipase dapat berperan sebagai biokatalis untuk reaksi reaksi hidrolisis, esterifikasi, alkoholisis, asidolisis and aminolisis. Candida dan Rhizopus yang merupakan organisme yang paling sering dipakai sebagai sumber sintesis penghasil lipase[Pandey, dkk, 1999]. Enzim lipase yang diamati berasal dari sekresi mikroba
Rhizopus oryzae, yaitu lipase yang bereaksi secara spesifik memutus rantai fatty acid trigliserol pada posisi 1 dan
harga lipase komersial biasanya sangat tinggi karena proses produksinya yang sulit dan memakan waktu. Selain itu, dalam proses reaksi enzimatis, lipase tidak dapat digunakan kembali lagi karena terlarut dalam media reaksi[Kirk, et.
Al. , 2002]. Hal ini menyebabkan biaya reaksi yang dikatalisis lipase menjadi meningkat. Perlu adanya penelitian tentang
teknik penggunakan kembali lipase, salah satunya adalah teknik reaksi immobilisasi dengan bantuan support sebagai media pembantu yang dapat menahan enzim dalam struktur molekulnya. diharapkan enzim dapat digunakan kembali sehingga biaya produksi reaksi enzimatis dapat ditekan[Scragg, A H].
Terdapat beberapa macam teknik immobilisasi yang dapat diaplikasikan. Setiap metode memiliki keunggulan dan kelemahan masing-masing. Pada penelitian ini, dilakukan pengamatan dengan teknik adsorpsi fisik sederhana karena kemudahannya dalam pengamatan dan nilai keekonomisannya yang cukup baik[Kennedy, J.].
Untuk melakukan immobilisasi enzim, perlu dilakukan pengamatan tentang support yang akan dipakai. Terdapat beberapa macam support yang dapat dipakai untuk metode adsorpsi, yaitu support organik seperti latex, kitin dan support anorganik seperti silica gel, CaCO3, Al2O3, dan lainnya. Tiap support memiliki karakteristik berbeda dalam
teknik immobilisasinya[Minovska, 2007].
Perlu dilakukan studi lebih lanjut untuk melakukan immobilisasi enzim untuk berbagai reaksi enzimatis. Efektivitas reaksi immobilisasi dilihat dengan menggunakan reaksi dasar yang paling mudah diamati, yaitu reaksi hidrolisis[Lehninger, 1982]. Pengamatan yang harus dilakukan adalah pemilihan support berdasarkan kemampuan bahan dalam membantu suatu reaksi enzimatis, dilihat dari konsentrasi enzim yang dapat terserap oleh support. Reaksi hidrolisis diamati sebagai reaksi dasar karena kemudahannya dalam melakukan reaksi dan dapat menghasilkan konversi yang baik.
Sebelum melakukan immobilisasi, enzim lipase akan dikarakterisasikan terlebih dahulu, dalam hubungannya dengan aktivitas enzimatis per satuan waktu[Biochemical engineering and biotechnology handbook]. Pengamatan awal dilakukan pada beberapa jenis support untuk membandingkan seberapa banyak support tersebut dapat menahan enzim. Selanjutnya pengamatan dilakukan untuk mengetahui waktu immobilisasi optimal, kondisi pH dan temperatur optimal dalam reaksi hidrolisis, dan pengujian stabilitas enzim pada support yang ditunjukkan dengan penggunaan kembali lipase ter-immobilisasi untuk reaksi. Dari hasil pengamatan ini, akan dibuat pemodelan matematika sederhana untuk menggambarkan reaksi hidrolisis enzimatis lipase.
Bahan Dan Metode
Bahan
Enzim yang digunakan adalah lipase Rhizopus oryzae (Fungal lipase 8000, Valley Research, Amerika Serikat) dalam fasa bubuk. Minyak zaitun (Virgin olive oil, Borges, Spain), dibeli dari supermarket. Support Latex, kitin, Al2O3
dan CaCO3 serta silika gel dan bahan kimia lain seperti air Reversed Osmosis (RO), Poly vinyl alkohol (PVA),
NaH2PO4, Na2HPO4.2H2O, Indikator Penolpthalein (pp), Na2CO3, NaOH, CuSO4, NaKC4H4O6, BSA, NaCl, KCl,
KH2PO4 dan Follin-Ciocalteu reagent didapat dari stok lab.
Reaksi hidrolisis
Dalam Erlenmeyer, lipase (120 mg) dilarutkan dalam 4 mL buffer Phosphate (0.1 M, pH 7), lalu distirer (1000 rpm) selama 30 menit untuk melarutkan enzim[Minovska, 2007].
Untuk immobilisasi, larutan enzim tersebut dicampurkan dengan 1 gram support (latex, kitin, Al2O3, CaCO3,
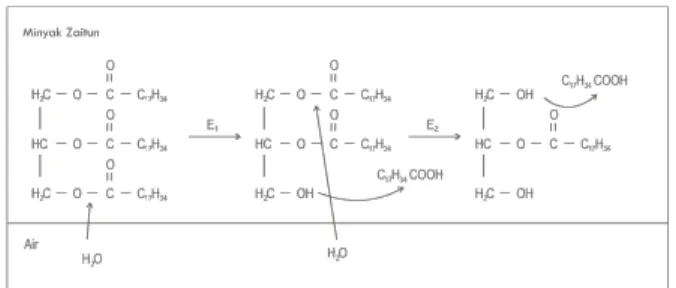
silika gel), lalu campuran di shaker secara perlahan selama 3 jam pada suhu ruang[Nawani]. Reaksi hidrolisis trigliserida spesifik adalah sebagai berikut:
(
17 34)
3 3 53
23
17 34 3 5(
)
3Lipase
C H COO
C H
+
H O
⎯⎯⎯→
C H COOH
+
C H
OH
Skema reaksi diatas ditunjukkan pada Gambar 2.1.
Minyak Zaitun sebanyak 5 ml ditambahkan dengan 15 ml air dan 0.3 gram PVA sebagai pengemulsi. Setelah itu ditambahkan larutan lipase, dan dicampurkan dengan 16 ml buffer phosphate (0.1 M, pH 7.0), dishaker pada 400 rpm, pada suhu ruang 33 oC[Minovska, 2007].
Dilakukan sampling sebanyak 2 ml minyak, lalu ditambahkan 3 tetes indikator pp dan dititrasi dengan NaOH 0.05 M. Aktivitas lipase yang semakin tinggi ditunjukkan oleh semakin banyaknya volume NaOH yang dibutuhkan untuk titrasi.
Gambar 2. 1 Skema reaksi hidrolisis enzimatis spesifik pada minyak zaitun
Mol Free Fatty Acid (FFA) dalam trigliserida secara teoritis dihitung dengan cara: Minyak zaitun seluruhnya terdiri dari trigliserida (trioleogliserol).
Tiap 2 ml sampel minyak zaitun memiliki berat 1.7 gram = 1700 mg
Trioleogliserol (trigliserida dari minyak zaitun) dengan rumus molekul (C17 H35 COO)3 C3H5 memiliki berat
molekul 884 g/mol, berarti dalam 2 ml sampel minyak zaitun terdapat mol trigliserida sebanyak 1.923 mmol. Mol FFA yang maksimal terbentuk secara teoritis dalam 2 ml sampel minyak zaitun adalah 3 x mol trigliserida,
yaitu sebesar 5.769 mmol
Reaksi NaOH dengan (FFA)adalah sebagai berikut: C17H34COOH + NaOH C17H34COONa + H2O
Banyaknya konsentrasi asam lemak bebas atau FFA (CFFA) yang terkandung dalam 2 ml substrat minyak dihitung
dengan:
Mol FFA = mol NaOH
= 0.05M x volume NaOH titrasi
teoritis ara FFA mol reaksi hasil FFA mol hidrolisis sec % = ... (1)
Pembuatan kurva kalibrasi
Kurva kalibrasi bertujuan untuk mengukur konsentrasi protein dalam larutan mengggunakan metode Lowry[10]. Larutan yang digunakan adalah Lowry A (Na2CO3 20 mg/ml, NaOH 4 mg/ml); lowry B (CuSO4 10 mg/ml);
lowry C (NaKC4H4O6 20 mg/ml) dengan persentase campuran masing-masing Lowry A:B:C adalah 98:1:1.
0.01 gram BSA dilarutkan kedalam 10ml buffer phosphate, lalu konsentrasi larutan BSA divariasikan dari 0.1 s/d 1 µg/ml. Sebanyak 20 µl sampel BSA ditambahkan ke dalam campuran yang mengandung 2000 µl Lowry reagent dan 180 µl PBS (Phosphate Buffer Saline) dalam tabung reaksi. Campuran divortex dan diinkubasi selama 10 menit. Campuran lalu ditambahkan 200 µl Follin-Ciocalteu reagent, divortex dan diinkubasi pada suhu ruang selama 30 menit. Absorbansi sampel BSA diukur dengan berbagai konsentrasi pada panjang gelombang 750 nm.
Seleksi support
Sebelum immobilisasi, free enzim diukur absorbansinya dan disetiap akhir masa inkubasi sebanyak 1 ml sample lipase diambil dan disentrifugasi pada 14000 rpm selama 3 menit untuk memisahkan cairan dari support.
Enzim loading dihitung dengan rumus:
CE = C0 – Ct ...…(2)
dimana:
CE (mg/ml)= konsentrasi enzim ter-immobilisasi
C0 (mg/ml)= konsentrasi enzim sebelum immobilisasi Ct (mg/ml)= konsentrasi enzim pada waktu t
Dua support dengan CE terbesar dipilih untuk diuji dalam percobaan selanjutnya.
Waktu immobilisasi : Membuat immobilisasi lipase pada 4 macam labu erlenmeyer yang berbeda untuk setiap waktu
immobilisasi.
Pengamatan pengaruh ph terhadap aktivitas lipase : Pengamatan pengaruh pH untuk reaksi hidrolisis menggunakan
lipase yang sudah diimobilisasi. Percobaan ini dilakukan dengan memvariasikan pH pada saat immobilisasi dan reaksi hidrolisis (pH 6, 6.5, 7, 7.5, dan 8). Pengaturan variasi pH dilakukan dengan mengatur pH buffer phosphat.
Pengamatan pengaruh temperatur aktivitas lipase : Membuat variasi suhu reaksi hidrolisis (33 oC, 37 oC, 47 oC, dan 57
o
C). Pengaturan temperatur dilakukan dengan menginkubasi campuran dalam shaker inkubator.
Uji stabilitas
Uji stabilitas dilakukan dengan menggunakan enzim yang diimmobilisasi dengan support terbaik hasil dari percobaan sebelumnya. Sampling dilakukan pada waktu yang ditentukan (waktu penghentian reaksi sama untuk setiap penggunaan ulang).
Lipase ter-immobilisasi dipisahkan dari substrat reaksi, kemudian digunakan kembali dalam reaksi dengan prosedur yang sama menggunakan lipase tersebut. Konversi hidrolisis dibandingkan untuk melihat bagaimana stabilitas lipase yang ter-immobilisasi. Reaksi perulangan dihentikan sampai konversi hidrolisis sudah berada dibawah 5 %. Dari tahapan percobaan ini akan diketahui stabilitas lipase dalam melakukan reaksi hidrolisis.
Hasil Dan Pembahasan
Reaksi Hidrolisis Menggunakan Free Lipase
Gambar 3.1 memperlihatkan kurva konversi hidrolisis sampai jam ke-12. Kurva konversi menunjukkan konsentrasi FFA pada jam ke-8 sebesar 1.7 mmol dari kemungkinan mol FFA maksimal teoritis 5.769 mmol, sehingga % hidrolisis didapat sebesar 29.46 %. Pada jam ke-10 dan jam ke-12 jumlah produksi FFA adalah masing-masing sebesar 1.85 mmol dan 2 mmol dengan % hidrolisis sebesar 32.06 % dan 34.66 %. Walaupun kecenderungan konversi reaksi akan terus berlanjut naik, diprediksi mulai dari jam ke-8 hasil konversi tidak akan jauh berbeda dari data ini. Konversi reaksi keseluruhan dapat disimpulkan terwakili pada jam tersebut.
0 10 20 30 40 0 4 8 12 % h id rol is is waktu [jam] 0 0.1 0.2 0.3 0 0.4 0.8 1.2 absor b ans i C BSA [mg/ml] y = 0.3064x R2 = 0.9983
Gambar 3. 1 Pengaruh waktu reaksi terhadap % hidrolisis pada free lipase
[pH: 7.0, Thidrolisis: 33 oC, shaking ratehidrolisis: 400 rpm]
Gambar 3. 2 Kurva kalibrasi standar protein
Enzim lipase yang digunakan pada pengamatan ini berasal dari sekresi mikroba Rhizopus oryzae yang bereaksi secara spesifik memutus rantai fatty acid trigliserol pada posisi sn-1 dan sn-3, sering disebut dengan lipase spesifik regio 1,3. Analisa aktivitas/konversi enzimatik pada penelitian ini dilakukan dengan melihat kandungan total FFA secara bulk, tanpa menghiraukan dari rantai berapa FFA tersebut berasal, sehingga konversi yang dihasilkan cenderung rendah, karena rantai FFA pada posisi -2 tidak terpotong. Konversi yang ditunjukkan dengan % hidrolisis ini tidak menunjukkan aktivitas enzim secara detail, hanya melihat seberapa banyak pembentukan FFA per waktu, sehingga konversi yang dihasilkan cenderung kecil. Ada dugaan kuat jika digunakan enzim yang memotong trigliserida secara acak, konversi dapat meningkat.
Immobilisasi Enzim
Kurva kalibrasi untuk konsentrasi enzim
Nilai konsentrasi protein terkandung dapat diketahui dengan menggunakan data kalibrasi standar protein, dimana kurva ini memberikan konversi absorbansi terhadap konsentrasi protein. Persamaan garis yang didapat adalah y
= 0.3064x, dimana y adalah adsorbansi dan x adalah konsentrasi protein. Protein terlarut didapatkan dengan mengalikan absorbansi dengan slope persamaan garis 0.3064 untuk mendapatkan konsentrasi protein terlarut.
Pengamatan Enzim Loading Pada Berbagai Macam Support
Dilakukan pengamatan terhadap lima jenis support, yaitu silika gel, kitin, Al2O3, CaCO3, dan latex. Kitin dan
latex mewakili polimer organik, Al2O3 dan silika gel adalah material inorganik, dan CaCO3 mewakili material garam
inorganik. Gambar 3.3 memperlihatkan hasil enzim loading dengan immobilisasi selama 3 jam, dengan massa support 1 gram terhadap 5 ml enzim terlarut dalam buffer pH 7.
Dari Gambar 3.3 dapat dilihat persentase penyerapan tiap support, dihitung dengan menganggap jumlah protein yang terkandung dalam larutan enzim bebas adalah 100 %, maka enzim yang teradsorb dalam tiap support dapat dipersentasikan dengan nilai masing-masing 56.62 % untuk silika gel, 68.67 % untuk kitin, 50.60 % untuk Al2O3, 46.98
% untuk CaCO3, dan 43.37 % untuk latex. Kitin menempati urutan tertinggi dalam hal adsorpsi lipase, diikuti silika gel,
Al2O3, CaCO3, dan latex.
0 40 80
silika kitin Al2O3 CaCO3 latex
lipase teradsorb % l o a d in g support 0 40 80 0 2 4 6 8
enzim loading kitin enzim loading silika gel
% l oad in g waktu immobilisasi
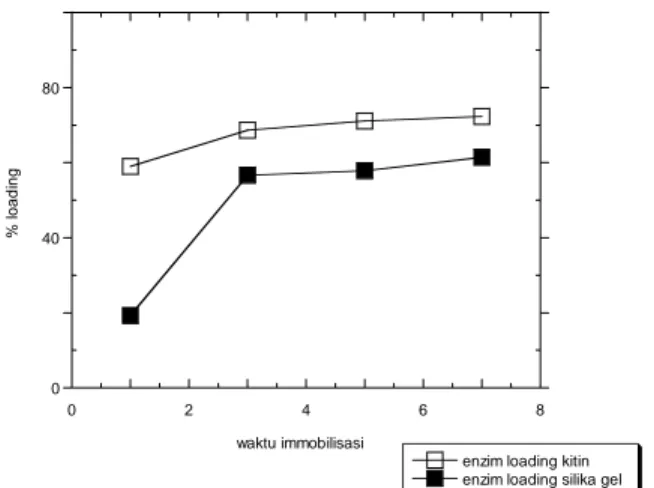
Gambar 3. 3 Pengaruh jenis support terhadap enzim loading
[pH: 7.0, Timmobilisasi: 33 oC, timmobilisasi: 3 jam, shaking rateimmobilisasi: 100 rpm]
Gambar 3. 4 Pengaruh waktu immobilisasi terhadap enzim loading
[pH: 7.0, Thidrolisis: 33 oC, shaking rateimmobilisasi: 100rpm]
Dari sisi struktur bahan, kitin dan latex adalah polimer, CaCO3 dan Al2O3 adalah garam, dan silika adalah
material Si yang porous dan amorphous. Kitin dan latex memiliki potensi untuk menahan enzim karena strukturnya yang besar sepanjang rantai polimer. Namun latex kurang mampu menahan lipase karena kemampuan ikatan inter molekulnya rendah. Kitin unggul dalam penyerapan lipase karena memiliki struktur bubuk yang menyerupai adsorben, seperti halnya bubuk kayu, dimana air dapat menyerap masuk secara kuat ke dalam pori-pori antar molekul. Ditambah dengan kemampuan adsorpsi intramolekul, kitin baik digunakan sebagai adsorben. Silika gel adalah partikel adsorben alamiah, dimana zat ini akan menyerap air dengan batas tertentu. Kemampuan adsorpsi permukaan dan intra molekul silika gel sudah terbukti secara luas, namun yang membuat silika gel tidak lebih baik dari kitin adalah kemampuan penyerapan intermolekul yang kurang kuat. Hal ini disebabkan karena silika gel berbentuk padat, sehingga kekuatan tarik antar partikel menjadi rendah. Hal ini yang membuat kitin unggul. Sedangkan untuk ketiga bahan yang lain, karena bentuknya yang bubuk halus, kemampuan mereka sebagai penyerap larutan enzim menjadi berkurang. Namun tidak menutup kemungkinan untuk menggunakan ketiga zat ini sebagai adsorben karena kemampuan serap bahan-bahan ini tidak kalah jauh dari kitin dan silika gel. Solusi yang dapat dilakukan adalah menambah jumlah massa support untuk volume larutan enzim yang tetap.
Dari pori-pori tiap bahan, ukuran pori terbesar dimiliki silika gel sebagai adsorben alami. Zat ini memiliki “ruang pengunci” (interlocking cavities) yang memberikan media dengan luas permukaan yang besar. Struktur inilah yang memberikan kemampuan silica gel sebagai media pengabsorb. Kitin adalah polimer organik yang sudah di-deproteinasi dan de-mineralisasi, meninggalkan pori yang dapat diisi oleh zat lain. Pori-pori ini merupakan tempat dimana protein alami kitin berasal, afinitas terhadap protein menjadi lebih besar, sehingga lipase yang merupakan
protein lebih tertarik masuk kedalam pori kitin. Karena itu, enzim loading pun menjadi semakin besar. Dengan pori yang besar dan luas permukaan yang besar, kitin dapat menyerap lipase dengan baik. Untuk ketiga bahan sisanya, hanya latex yang merupakan polimer alamiah yang mempunyai pori untuk ditempati enzim, sedangkan CaCO3 dan Al2O3
tidak/sedikit memiliki pori dibanding ketiga bahan diatas, namun support ini memiliki ikatan intermolekul dengan larutan lipase yang cukup baik, yang mengimbangi ketidakmampuan mereka dalam penyerapan kedalam pori. Latex yang memiliki pori lebih besar tidak mampu menahan lipase karena ikatannya dengan lipase tidak lebih kuat dari garam-garam CaCO3 dan Al2O3.
Berdasarkan kemampuan kedua support ini dalam mengadsorb lipase, kitin dan silika gel adalah material yang
potensial untuk dilanjutkan pengamatannya dalam aplikasinya untuk reaksi hidrolisis. Pada tahap ini, akan dipilih
support yang mampu memberikan kondisi dimana lipase dapat berkontribusi secara maksimal dalam reaksi.
Waktu Immobilisasi
Kitin memiliki persentase loading yang baik, mencapai nilai 72.29 % untuk adsorpsi maksimal, sedangkan adsorpsi maksimal silika gel sekitar 61 %. Dibandingkan kitin yang sudah memiliki loading yang hampir sama mulai dari jam pertama waktu immobilisasi, silika membutuhkan waktu agar lipase teradsorb. Pengamatan persen loading untuk kedua support dengan waktu immobilisasi bervariasi dapat dibandingkan pada Gambar 3.4.
Reaksi Hidrolisis Menggunakan Lipase Ter-Immobilisasi Pada Kitin Dan Silika Gel
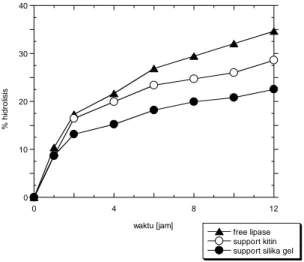
Gambar 3.5 menunjukkan engamatan pada kedua support, menghasilkan grafik aktivitas dengan kecenderungan yang sama. Konversi hidrolisis support kitin pada jam ke-8 adalah 24,7 %, dan konversi selanjutnya pada jam ke-10 dan -12 menghasilkan konversi 25.13 %. Untuk support silika gel, konversi sudah mengalami kestabilan pada jam ke-8 dan -10 dengan konversi 19.9 % dan 20.8 %. Konversi secara keseluruhan memiliki kecenderungan laju yang naik secara tajam sampai sekitar jam ke-6, dan cendering stabil setelah melewati jam ke-8.
Secara keseluruhan, support kitin memiliki aktivitas reaksi yang lebih baik dari support silika gel. Hal ini sebanding dengan kemampuan kitin dalam menyerap enzim lipase, ditunjukkan kemampuan enzim loading yang paling baik. 0 10 20 30 40 0 4 8 12 free lipase support kitin support silika gel
% hi dr o lis is waktu [jam] 0 10 20 30 40 5 6 7 8 free lipase support kitin % hi dr o lis is pH
Gambar 3. 5 Pengamatan reaksi hidrolisis menggunakan lipase ter-immobilisasi
[pH: 7.0, Thidrolisis: 33 oC, timmobilisasi: 3 jam, shaking rateimmobilisasi: 100 rpm, shaking ratehidrolisis: 400 rpm]
Gambar 3. 6 Pengaruh pH terhadap % hidrolisis untuk lipase pada support kitin
[Thidrolisis: 33 oC, timmobilisasi: 3 jam, shaking rateimmobilisasi:
100 rpm thidrolisis: 8 jam, shaking ratehidrolisis: 400 rpm]
Pengaruh Ph Terhadap Aktivitas Lipase
Lingkungan dimana enzim akan mengkatalis reaksi harus berada pada kondisi optimum enzim untuk bereaksi. Zona ini diberikan oleh parameter derajat keasaman (pH). Setiap enzim memiliki karakter yang berbeda dimana kondisi optimum pH lingkungan akan spesifik untuk tiap enzim. Kondisi pH yang jauh dari kondisi spesifik ini akan menyebabkan inaktivasi enzim karena enzim mengalami kerusakan struktur protein[Lehninger, A. L. 1982].
Pengamatan pada reaksi free enzim menunjukkan aktivitas optimal pada pH 7, dengan konversi sebesar 28.6 %.
Konversi untuk lipase ter-immobilisasi adalah sebesar 24.26 %.
Penurunan pH menjadi kondisi asam menyebabkan penurunan aktivitas, begitu juga kenaikan pH menjadi basa dapat menyebabkan struktur enzim menjadi rusak. Kondisi pH yang terlalu rendah mengakibatkan ion H+ akan berikatan dengan –NH3+ pada struktur asam amino protein membentuk –NH4. Proses pengikatan tersebut menyebabkan
ikatan antara atom nitrogen dengan atom hidrogen lainnya terputus, sehingga enzim terdenaturasi. Kondisi pH tinggi mengakibatkan ion -OH berikatan dengan atom hidrogen dari gugus COO- enzim, membentuk H2O. Hal tersebut
mengakibatkan rusaknya ikatan antara atom hidrogen dengan nitrogen atau oksigen, sehingga struktur enzim mengalami kerusakan.
Pengaruh Temperatur Terhadap Aktivitas Lipase
Seperti halnya perubahan kondisi pH, enzim memiliki kondisi optimal dengan adanya perubahan temperatur. Laju reaksi akan meningkat sejalan dengan kenaikan temperatur sampai pada batas optimalnya, kemudian aktivitas akan menurun setelah melewati kondisi tersebut karena enzim akan mengalami denaturasi. Suhu yang terlalu rendah akan menyebabkan aktivitas enzim kurang baik[Lehninger, A. L. 1982].
0 10 20 30 40 30 40 50 60 free lipase support kitin % h id ro lis is temperatur [ oC] 0 10 20 30 40 1 2 3 4 5 6 % h id ro lisis jumlah penggunaan
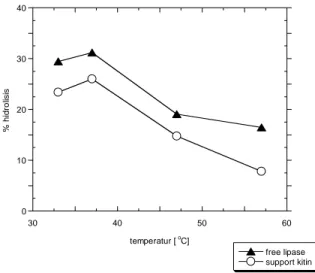
Gambar 3. 7 Pengaruh temperatur terhadap % hidrolisis
[pH: 7, timmobilisasi: 3 jam, shaking rateimmobilisasi: 100 rpm
thidrolisis: 8 jam, shaking ratehidrolisis: 400 rpm]
Gambar 3. 8 Penggunaan kembali lipase ter-immobilisasi
[Thidrolisis: 37 oC, pH: 7, timmobilisasi: 3 jam, shaking rateimmobilisasi: 100 rpm
thidrolisis: 8 jam, shaking ratehidrolisis: 400 rpm]
Gambar 3.7 memperlihatkan aktivitas hidrolisis lipase meningkat dari temperatur 33 oC dan akan menurun setelah melewati temperatur 37 oC. Konversi tertinggi pada temperatur optimal didapat sebesar 31.2 % untuk reaksi free enzim, sedangkan pada enzim ter-immobilisasi pada kitin didapat konversi sebesar 26 %. Disimpulkan bahwa lipase ini memiliki kondisi temperatur optimal pada temperatur 37 oC. Tidak terdapat perbedaan signifikan antara free lipase dengan lipase ter-immobilisasi.
Uji Stabilitas Lipase Ter-Immobilisasi
Tujuan utama dilakukan immobilisasi enzim adalah untuk melihat apakah enzim tersebut dapat digunakan kembali dalam reaksi selanjutnya (reuse). Enzim yang dapat dipakai ulang inilah yang akan membedakannya dengan reaksi free enzim, dimana pada aplikasi free enzim, enzim yang dipakai akan ikut terbuang dan tidak bisa diregenerasi kembali, dan cenderung sulit dipisahkan dan mengotori produk akhir. Reaksi dilakukan pada kondisi optimal, yaitu pH 7 dan temperatur 37 oC. Hal ini dapat dilihat pada Gambar 3.8.
Setelah dilakukan penggunaan kembali lipase dalam support kitin, terdapat penurunan aktivitas yang cukup drastis dimana konversi menurun dari reaksi pertama sebesar 28.6 % menjadi 14.7 % pada penggunaan kedua. Penggunaan yang efisien hanya dapat terjadi pada reaksi ke-3, dan untuk reaksi selanjutnya, konversi yang lebih kecil dari 5 % dianggap sudah tidak ekonomis lagi.
Penurunan aktivitas ini disebabkan karena lemahnya ikatan antara lipase dngan enzim karena hanya didukung oleh ikatan lemah seperti ikatan van der waals. Jika terdapat ’gangguan’ seperti halnya penggunaan kembali, ikatan ini dapat rusak yang menyebabkan enzim terlepas dari support.
Kesimpulan
Reaksi hidrolisis Lipase Rhizopus oryzae terwakili pada jam ke-8 dengan konversi 29.46 %. Metode adsorpsi cocok untuk diterapkan pada support kitin dan silika gel karena mempunyai kemampuan adsorpsi yang lebih baik. Waktu optimal yang dibutuhkan support kitin dan silika gel untuk mengadsorpsi lipase adalah selama 3 jam. Lipase pada support kitin lebih mendukung reaksi hidrolisis dibanding lipase pada support silika gel. Kondisi optimum reaksi hidrolisis baik untuk reaksi free lipase dan ter-immobilisasi adalah pH 7 dan temperatur 37 oC. Penggunaan reaksi berulang dalam uji stabilitas hanya efisien terjadi pada reaksi yang ke-3 kalinya, dan untuk reaksi selanjutnya dianggap sudah tidak ekonomis. Disimpulkan bahwa support kitin kurang memiliki kemampuan menahan enzim dalam struktur molekulnya.
Daftar Pustaka
Pandey, A., Benjamin, S., Soccol, C.R., Nigam, P., Krieger, N. and Soccol, V.T. 1999. The Realm of Microbial Lipases
in Biotechnology. Biotechnol. Appl. Biochem., 29, 119-131.
Valley research. Fungal lipase 8000 manual. Valley research, Amerika Serikat. 2007.
Kirk, Ole., Vedel, Torben., Crone, Clause. 2002. Industrial Enzyme Application. Current opinion on biotechnology, 13:345-351.
Scragg, A H. Biotechnogy for Engineers: Biological Systems in Technological Processes. Chapter 12. immobilized
enzymes and cells. John willey & sons. New york.
Kennedy, J., Melo, E. H. M., Immobilized Enzyme and cells. University of Birmingham. United Kingdom.
Minovska, Vilma.,Winkelhausen, Eleonora., dan Kuzmanova, Slobodan. Lipase immobilized by diffferent terchiques in
various support material applied in oil hydrolisis. University St Cyril and Methodious. Faculty of Technology and
Metalurgy. 25 june 2007.
Lehninger, A. L. 1982. Dasar-Dasar Biokimia. Terj, dari principles of biochemistry, oleh Thenawidjaja, M. Penerbit Erlangga, Jakarta:xv+369 hlm.
Biochemical Engineering and Biotechnology Handbook, Bab: Enzyme Activity.
Nawani, Neerupma., Rajvindaer Singh, Jagdeep Kaur. Immobilization and stability studies of a lipase from thermophilic
Bacillus sp: The Effect of Process Parameters on Immobilization of Enzyme. Electronic journal of Biotechnology ISSN
07173458. Vol. 9 No. 5.
Gerhardt, P.,Murray, R.G.E.,Wood, W.A.,Krieg, N.R Methods for General and Molecular Bacteriology. ASM, Washington DC, ISBN 1-55581-048-9, p518.