1 Artikel
Potensi Senyawa Derivat Kalkon Bersubstituen Fluoro
Sebagai Agen Ko-kemoterapi Doxorubicin Pada Sel Kanker Leher Rahim
Retno Arianingrum, Indyah Sulistyo Arty, dan Sri Atun Jurdik Kimia, FMIPA, Universitas Negeri Yogyakarta
1. Abstrak
Dalam upaya meningkatkan efektivitas dan mengurangi resistensi, serta efek samping agen kemoterapi, dewasa ini perkembangan terapi kanker mengarah pada kombinasi agen kemoterapi dengan agen kemopreventif. Kalkon merupakan senyawa golongan flavanoid yang telah diteliti berkhasiat menurunkan proliferasi banyak sel kanker. Tujuan jangka panjang dari penelitian ini adalah mengembangkan potensi senyawa derivat kalkon sebagai agen ko-kemoterapi Doxorubicin pada sel kanker leher rahim HeLa. Target khusus yang ingin dicapai adalah : menginvestigasi aktivitas sitotoksik senyawa derivat kalkon bersubstituen fluoro, Doxorubicin, dan kombinasi keduanya dan pemacuan apoptosis.
Uji sitotoksik secara invitro terhadap sel HeLa dilakukan dengan metode MTT [3-(4,5-dimethylthiazol-2-yl)-2.5-dipheniltetrazolium bromide] assay. Perubahan morfologi sel juga diamati menggunakan mikroskop fase kontras. Pengamatan apoptosis dengan flowcytometer.
Hasil penelitian menunjukkan bahwa senyawa derivat kalkon bersubstituen fluoro, yaitu 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on bersifat sitotoksik pada sel HeLa dengan IC50 sebesar 34 M, sedangkan nilai dengan IC50 doxorubicin diperoleh sebesar 1
M. Kombinasi senyawa tersebut dengan Doxorubicin di bawah nilai IC50 pada umumnya memberikan efek sinergi kuat dengan viabilitas sel terendah pada konsentrasi kombinasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on sebesar 17 M dan doxorubicin sebesar 0,5 M. Mekanisme aksi senyawa derivat kalkon bersubstituen fluoro tunggal dan kombinasinya dengan doksorubisin adalah melalui pemacuan apoptosis.
Kata kunci : kalkon, fluoro, Doxorubicin, HeLa, dan resistensi.
2. Pendahuluan
Kanker leher rahim merupakan salah satu kanker penyebab kematian kedua di dunia pada wanita setelah kanker payudara. Berdasarkan sepuluh kanker primer pada wanita di Indonesia, kanker leher rahim menempati posisi pertama (28,66%) (Tjindarbumi dan Mangunkusumo, 2002). Banyaknya faktor resiko yang dapat menyebabkan kanker leher rahim membuat angka kejadiannya sangat tinggi terutama di Negara berkembang seperti Indonesia. Oleh karena itu, pengembangan dan penemuan pengobatan kanker leher rahim perlu terus diupayakan.
Salah satu permasalahan yang sering timbul dalam pengobatan kanker adalah resistensi obat kemoterapi (drug-resistence) (Wong et al., 2006). Salah satu agen kemoterapi kanker yang telah menimbulkan resistensi adalah Doxorubicin. Senyawa golongan antrasiklin ini diberikan pada berbagai jenis kanker. Selain menimbulkan resistensi, Doxorubicin dapat menyebabkan kardiotoksisitas pada penggunaan jangka panjang (Ferreira et al., 2008). Salah satu
2
alternatif untuk mengatasi resistensi adalah kombinasi agen kemoterapi dengan agen kemopreventif sehingga dapat meningkatkan keberhasilan terapi.
Kalkon (1,3-difenilpropen-1-on) merupakan senyawa yang banyak di teliti sebagai
therapeutic, khususnya sebagai obat antitumor. Hasil penelusuran literatur menyebutkan bahwa
sebagian besar target utama dari senyawa-senyawa kalkon adalah mempengaruhi daur sel (cell
cycle) (Boumendjel, A., Ronox X., and Boutonnat, J., 2009).
Indyah, dkk. (2000), berhasil mensintesis beberapa senyawa derivat kalkon, yaitu mono para-hidroksi kalkon, diantaranya senyawa yang mengandung substituen fuoro, yaitu 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on. Berdasarkan uji aktivitas penghambatan lipid peroksidasi non enzimatis, dan aktivitas penghambatan siklooksigenase, senyawa ini menunjukkan sangat poten sebagai antioksidan. Penelitian lebih lanjut dalam kaitannyanya dengan efek sitotoksik menunjukkan bahwa senyawa dengan substituen fluoro ini bersifat sitotoksik pada sel HeLa, sel Raji dan sel T47D, dan efek sitotoksis tertinggi pada sel HeLa (Indyah, 2009 dan Retno A, dkk., 2010). Sejauh ini penelitian tersebut belum menginvestigasi lebih jauh mengenai mekanisme aksi dan target molekuler dari senyawa tersebut untuk cancer chemoprevention pada cancer cel lines HeLa.
Penelitian-penelitian tersebut menjadi dasar awal pengembangan senyawa derivat kalkon bersubstituen fluoro ini sebagai agen ko-kemoterapi untuk meningkatkan potensi agen kemoterapi Doxorubicin, sehingga diperoleh pengobatan kanker leher rahim yang efektif. Oleh karena itu, pada penelitian ini akan dieksplorasi apakah senyawa ini secara tunggal dan kombinasinya dengan Doxorubicin dapat memberikan efek sitotoksik dan memacu apoptosis 3. Metode Penelitian
a. Lokasi Penelitian
Sintesis dan analisis spektroskopi UV dan IR akan dilakukan di laboratorium Kimia Organik dan Biokimia, Jurdik Kimia FMIPA UNY. Uji aktivitas sebagai sitotoksik, flowcytometri, dan imunositokimia di lakukan di laboratorium Parasitologi Fakultas Kedokteran Universitas Gadjah Mada.
b. Rancangan Penelitian
1) Sintesis senyawa derivat kalkon bersubstituen fluoro dengan mereaksikan bromo asetofenon dengan 4-hidroksi-3-metoksi-benzaldehid, melalui reaksi kondensasi aldol silang dalam suasana asam.
2) Uji sitotoksisitas senyawa derivat kalkon bersubstituen fluoro, Doxorubicin dan kombinasi keduanya pada sel HeLa.
3) Pengamatan insidensi apoptosis perlakuan senyawa derivat kalkon bersubstituen fluoro, Doxorubicin, dan kombinasi keduanya pada sel HeLa.
c. Subyek dan Obyek Penelitian
Subyek penelitian ini adalah senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on hasil sintesis. Objek penelitiannya adalah potensinya sebagai agem ko-kemoterapi Doxoribicin pada sel HeLa, meliputi : (1) uji sitotoksik, dan (2) uji aktivitas pemacuan apoptosis. d. Prosedur Kerja
3
Turunan 4-hidroksi-3-metoksi-benzaldehid (26,6 mmol) dan dengan p-fluoroasetofenon (30 mmol) dilarutkan dalam etanol yang dijenuhkan dengan HCl. Tetes demi tetes HCl dimasukkan dalam campuran reaksi bersamaan dengan itu gas N2 juga dialirkan ke dalam campuran reaksi. Pengadukan dilakukan selama 6 jam dan setiap jam di cek dengan KLT. Pengadukan dihentikan ketika noktah produk reaksi nampak dominan. Kemudian campuran reaksi dituangkan ke dalam air es dan di aduk sampai terbentuk kristal. Setelah dibiarkan selama 3 jam campuran reaksi disaring dan kristalnya direkristalisasi menggunakan pelarut yang sesuai. Identifikasi dan elusidasi struktur dilakukan dengan membandingkan data kromatografi lapis tipis (KLT) pada berbagai eluen dengan senyawa yang telah ditemukan sebelumnya, dan menggunakan analisis data spektrum UV-VIS dan IR.
2) Uji Sitotoksisitas
Sel dengan konsentrasi 1 x 104 sel/sumuran didistribusikan ke dalam plate 96 sumuran dan diinkubasi selama 24 jam untuk beradaptasi dan menempel di sumuran. Keesokannya media diambil kemudian ditambahkan 100 μl media kultur yang mengandung DMSO 0,2% (kontrol) atau sampel, inkubasi selama 24 atau 48 jam. Pada akhir inkubasi, media kultur yang mengandung sampel dibuang, dicuci dengan 100 ul PBS. Kemudian ke dalam masing-masing sumuran ditambahkan 100 ul media kultur yang mengandung MTT 5 mg/ml, inkubasi lagi selama 4 jam pada suhu 37°C. Sel yang hidup akan bereaksi dengan MTT membentuk kristal formazan berwarna ungu. Setelah 4 jam, media yang mengandung MTT dibuang, kemudian ditambahkan larutan SDS untuk melarutkan kristal formazan. Digoyang di atas shaker selama 10 menit kemudian dibaca dengan dengan ELISA reader pada panjang gelombang 595 nm. Data absorbansi perlakuan tunggal dikonversi ke dalam persen sel. Potensi aplikasi dalam terapi kombinasi dianalisis dengan membandingkan viabilitas sel perlakuan tunggal dengan kombinasi. Data absorbansi perlakuan tunggal dikonversi ke dalam persen sel hidup dan digunakan untuk menghitung IC50. Potensi aplikasi dalam terapi kombinasi dianalisis dengan menggunakan metode indeks kombinasi (combinatorial index method/CI) berdasarkan Chou (Reynolds and Maurer, 2005).
3) Uji Pengamatan Apoptosis dengan Flowcytometer
a) Alat yang digunakan : Flowcytometer, perlengkapan perlindungan diri (sarung tangan steril, jas lab.), plate 6 well, Air Flow Hood (LAF), inkubator CO
2, tissue culture flask/dish, pen marker, mikropipet, tip, rak ampul/tempat eppendorf, tissue, alat-alat gelas, flakon, kamera digital, autoklaf, sentrifus
b) Bahan yang digunakan : Tripsin, media kultur, Phosphat Buffer Saline (PBS) dan Annexin- V-Fluos Staining Kit Roche.
c) Prosedur Penelitian
Sel (kepadatan 5 X 105 sel/sumuran) ditanam dalam plate 6 well sampai 50-60 % konfluen. Setelah itu diinkubasi dengan senyawa uji selama 24 jam. Medium diambil dan dimasukkan dalam tabung sentrifus. Sel di cuci dengan tripsin 0,25% untuk melepas sel dari plate dan dilakukan inkubasi selama 3 menit dalam inkubator CO2. Kemudian ditambahkan media kultur 1 mL. Sel beserta media kultur tersebut dipindahkan juga dalam tabung sentrifus. Selanjutnya sel yang masih tersisa dalam plate dicuci dengan PBS 2X masing-masing sebanyak 1 mL dan PBS ditambahkan dalam tabung sentrifus. Kemudian disentrifus pada 600 g selama 5 menit. Media dibuang dan sel dicuci dengan PBS 1 mL dan disentrifus pada 200 g selama 5 menit. Larutan PBS dibuang dan sel diresuspensi dengan 100 L Annexin-V-Fluos-labelling
4
solution yang terdiri dari (2 L Annexin-V-Fluos, 100 L buffer, dan 2 L propidium iodide ) untuk 1 kali reaksi. Inkubasi selama 10 menit pada ruang gelap dan dianalis dengan
flowcytometer.
4. Hasil Penelitian
a. Sintesis 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on
Identifikasi senyawa hasil sintesis yang dilakukan menggunakan KLT dengan eluen kloroforom : heksana = 2 : 1, dan heksana: metilen klorida = 1:2 menunjukkan hasil satu noda yang berarti bahwa senyawa hasil isolasi tersebut telah murni. Saat dibandingkan dengan senyawa marker, senyawa hasil sintesis memiliki harga Rf (Retardation factor) yang sama dengan senyawa marker, yang berarti bahwa senyawa hasil sintesis tersebut adalah senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on.
Berdasarkan data FT-IR (Tabel 1) diketahui bahwa senyawa hasil sintesis memiliki gugus fungsional yang sama dengan senyawa marker. Hal ini lebih memperkuat bukti bahwa senyawa hasil sintesis yang diperoleh adalah senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on.
Tabel 3. Hasil Analisis FTIR Senyawa Bilangan gelombang (cm
-1 )
Keterangan Gugus Fungsional Marker Hasil Sintesis
1-(4”- fluorofenil)- 3-(4’- hidroksi-3’- metoksifenil)- 2-propen-1-on
1637,67 1636,55 C=O, (gugus karbonil) 3439,30 3495,52 OH str aromatik 1597,16 1585,89 C=C str aromatik 3000-2800 & 1444,77 3000-2800 & 1444,46 alkil 1238,38 1340,73 metil
b. Uji Sitotoksik dengan MTT assay
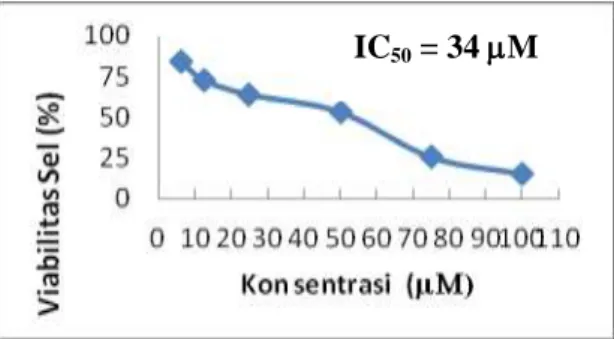
1) Uji sitotoksik senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on pada sel HeLa
Gambar 3. Hubungan Konsentrasi Senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on dengan % Viabilitas Sel HeLa.
5 2) Uji sitotoksik doxorubicin pada sel HeLa
Gambar 4. Hubungan Konsentrasi Doxorubicin dengan % Viabilitas Sel HeLa.
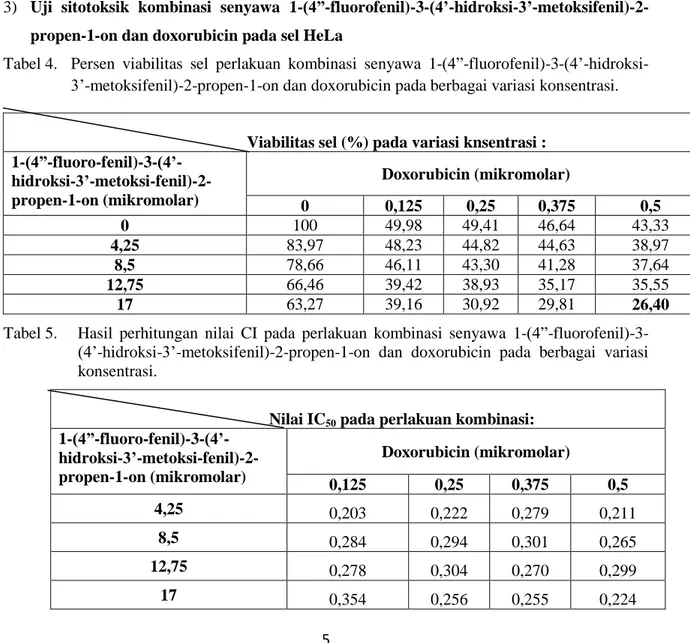
3) Uji sitotoksik kombinasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on dan doxorubicin pada sel HeLa
Tabel 4. Persen viabilitas sel perlakuan kombinasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on dan doxorubicin pada berbagai variasi konsentrasi.
Viabilitas sel (%) pada variasi knsentrasi : 1-(4”-fluoro-fenil)-3-(4’- hidroksi-3’-metoksi-fenil)-2-propen-1-on (mikromolar) Doxorubicin (mikromolar) 0 0,125 0,25 0,375 0,5 0 100 49,98 49,41 46,64 43,33 4,25 83,97 48,23 44,82 44,63 38,97 8,5 78,66 46,11 43,30 41,28 37,64 12,75 66,46 39,42 38,93 35,17 35,55 17 63,27 39,16 30,92 29,81 26,40
Tabel 5. Hasil perhitungan nilai CI pada perlakuan kombinasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on dan doxorubicin pada berbagai variasi konsentrasi.
Nilai IC50 pada perlakuan kombinasi: 1-(4”-fluoro-fenil)-3-(4’- hidroksi-3’-metoksi-fenil)-2-propen-1-on (mikromolar) Doxorubicin (mikromolar) 0,125 0,25 0,375 0,5 4,25 0,203 0,222 0,279 0,211 8,5 0,284 0,294 0,301 0,265 12,75 0,278 0,304 0,270 0,299 17 0,354 0,256 0,255 0,224 IC50 = 1 M
6
Senyawa-senyawa kalkon dapat memiliki substitusi yang berbeda pada posisi orto dan para. Selain itu kalkon memiliki ikatan rangkap terkonjugasi dan sistem electron- terdelokalisasi yang lengkap pada kedua cincin benzene. Molekul dengan sistem ini umumnya memiliki potensial redoks yang rendah dan mempunyai probabilitas tinggi untuk melakukan transfer elektron (Yadav, et.al., 2012). Senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on mempunyai gugus hidroksil dan fluoro pada posisi para dan metoksi pada posisi meta.
Hasil uji sitotoksik senyawa tunggal 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on pada sel HeLa menunjukkan senyawa ini bersifat toksik. Berdasarkan hasil pengamatan menunjukkan bahwa terdapat hubungan langsung antara perubahan konsentrasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on dengan tingkat kematian sel HeLa. Semakin tinggi konsentrasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on, semakin rendah viabilitas sel HeLa atau semakin banyak jumlah sel HeLa yang mengalami kematian. Berdasarkan hasil perhitungan diperoleh nilai IC50 dari senyawa ini terhadap sel HeLa sebesar 34 M yang termasuk kategori aktif. Adanya gugus OH dan gugus fluoro yang terdapat pada senyawa ini diperkirakan memberikan kontribusi pada sifat toksisitas senyawa terhadap sel HeLa. Pada beberapa hasil penelitian tentang aktivitas senyawa derivat kalkon, adanya substitusi gugus metoksi pada cincin A dan substitusi fluoro, kloro, bromo dan cincin B mampu meningkatkan penghambatan aktivitas NF-B, suatu faktor transkripsi yang berperan dalam pengembangan dan progresi kanker (Folmer, et.al., 2006, dan Kim, et. al., 2007). Selain itu adanya gugus karbonil tak jenuh -unsaturated
carbonylyang terdapat pada kalkon juga memberikan kontribusi pada aktivitas sitotoksik pada sel HeLa. Menurut Srinivasan, et al, 2009 adanya ikatan tak jenuh yang bersifat sangat elektrofilik dapat menimbulkan radikal thiyl yang mengarah ke pengurangan alkena melalui adisi Michaelis kovalen dari nukleofil, seperti SH dari cystin dari DNA, yang mengikat NF-B.
Perlakuan senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on juga menunjukkan perubahan morfologi sel yang signifikan seiring meningkatnya konsentrasi. Perubahan morfologi sel tersebut menyebabkan menurunnya viabilitas sel HeLa.
Bila dibandingkan dengan doxorubicin, senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on memiliki aktivitas lebih rendah. Doxorubicin merupakan agen kemoterapi yang banyak digunakan dalam terapi berbagai kanker epitel. Doxorubicin dapat berinterkelasi dengan DNA sehingga fungsi DNA sebagai template dan pertukaran sister
chromatid terganggu pada pita DNA terputus. Obat ini juga dapat bereaksi dengan sitokrom
P450 reduktase dengan adanya NADPH membentuk zat perantara yang akan bereaksi dengan oksigen menghasilkan radikal bebas yang dapat mengancurkan sel. Pada penelitian ini diperoleh nilai IC50 dari doxorubicin sebesar1 M.
Hasil penelitian menunjukkan bahwa kombinasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on dengan doxorubicin mampu meningkatkan aktivitas sitotoksik pada sel HeLa dibandingkan dengan perlakuan tunggal. Kombinasi keduanya menghasilkan efek yang saling menguatkan. Semakin tingi konsentrasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on, semakin kuat peningkatan efek sitotoksik doxorubicin oleh senyawa ini pada sel HeLa.
Berdasarkan perhitungan nilai CI, terlihat bahwa pada kombinasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on dengan konsentrasi sebesar 4,25; 8,5; 12,75; dan 17 M, dan konsentrasi doxorubicin sebesar 0,125; 0,25; 0,375; dan 0,5 M, memberikan interprestasi sinergi kuat, karena memiliki nilai CI antara 0,1-0,3. Namun pada kombinasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on dengan konsentrasi sebesar 17 M dan konsentrasi doxorubicin sebesar 0,125 M memiliki nilai CI di atas 0,3, sehingga masuk kategori sinergi. Dari hasil ini membuktikan bahwa senyawa
1-(4”-7
fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on berpotensi untuk digunakan sebagai agen ko-kemoterapi doxorubicin.
4) Uji Pengamatan Apoptosis dengan Flowcytometer
Tabel 6. Pengaruh perlakuan senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on, doxorubicin dan kombinasi keduanya terhadap kematian sel HeLa menggunakan Annexin dengan pembacaan Flowcytometer.
Perlakuan Prosentase (%) Sel HeLa
Sel Hidup Early Apoptosis Late Apoptosis Nekrosis
Tanpa Perlakuan 97,39 0,6 1,49 0,52 1-(4”-fluorofenil)-3-(4’- hidroksi-3’- metoksifenil)-2-propen-1-on 17 M 87,82 1,71 7,03 3,44 Doxorubicin 0,5 M 59,76 0,92 10,52 28,80 Kombinasi 1-(4”- fluorofenil)-3-(4’- hidroksi-3’- metoksifenil)-2-propen-1-on 17 M & Doxorubicin 0,5 M 49,73 0,83 11,24 38,20
Hasil pengamatan apoptosis menggunakan flowcytometer menunjukkan bahwa perlakuan senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on pada konsentrasi 17 M dengan waktu inkubasi 24 jam menyebabkan 8,74% sel HeLa mengalami apoptosis. Jumlah ini lebih tinggi dibandingkan dengan sel tanpa perlakuan (2,09%). Demikian juga perlakuan dengan doxorubicin pada konsentrasi 0,5 M menyebabkan 11,44% sel mengalami apoptosis, sedangkan kombinasi keduanya menyebabkan 12,07% sel mengalami apoptosis. Data ini menunjukkan bahwa senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on mampu memacu terjadinya apoptosis pada sel HeLa, dan kombinasi senyawa ini dengan doxorubicin meningkatkan kemampuan doxorubicin dalam memacu terjadinya apoptosis. Adanya sel yang mengalami apoptosis ini menyebabkan viabilitas sel HeLa menurun. Hasil penelitian ini sejalan dengan penelitian Hsu et al., (2006) yang menunjukkan bahwa struktur inti dari kalkon mampu menghambat proliferasi sel pada sel kanker payudara dengan menghambat progresi daur sel dan menginduksi apoptosis melalui jalur mitokondria dan
death receptor. Pada penelitian ini adanya substitusi gugus hidroksil, metoksi dan fluoro pada
senyawa kalkon ternyata juga mampu menghambat proliferasi sel dan memacu apoptosis. Selanjutnya perlu dikaji lebih lanjut mekanisme terjadinya apoptosis atau program bunuh diri sel, antara lain dengan melalui perubahan ekspresi protein pengatur apoptosis seperti Bcl-2, p53 dan Bax yang akan dilakukan pada tahun kedua.
Efek sitotoksik selain disebabkan oleh pemacuan apoptosis juga disebabkan oleh pemacuan penghambatan daur sel (cell cycle arrest). Oleh karena itu penelitian selanjutnya juga akan melakukan pengamatan penghambata siklus sel sebagai wujud nyata dari perubahan fisiologis atau morfologis.
5. Kesimpulan
a. Senyawa derivat kalkon bersubstituen fluoro bersifat sitotoksik pada sel HeLa dengan IC50 sebesar 34 mM, dan kombinasi senyawa tersebut dengan Doxorubicin memberikan efek sinergi kuat.
b. Mekanisme aksi senyawa derivat kalkon bersubstituen fluoro tunggal dan kombinasinya dengan doksorubisin melalui pemacuan apoptosis.
8 Daftar Pustaka
Afzal S., Asad M. K, Rumana Q. F, Ansari, Muhammad F. N, and Syed S. S. 2008. Redox Behavior of Anticancer Chalcone on a Glassy Carbon Electrode and Evaluation of its Interaction Parameters with DNA, Int. J. Mol. Sci. 2008, 9, 1424-1434
Bohm,T., (1998). An old paradigm for treating cancer and other disease in 21 st century, Cane and Met rev, 12: 149-154
Boumendjel A, Ronot X, Boutonnat. 2009 . Chalcone derivatives acting as cell cycle blockers :
potensial anticancer drugs ? J Curr Drug Targets. Apr;10(4):363-71.
Boyer, M.J., and Tannock, I.F., 2005, The Basic Science of Oncology: Cellular and Molecular Basis of Drug Treatment for Cancer, Mc Graw Hill Compay, forth edition, New York. Departemen Kesehatan RI. (1997). Profil Kesehatan Indonesia. Depkes RI. Jakarta
Fisher, D.E., (1994). Apoptosis in cancer therapy: crossing the threshold, Cell, 78, 539-542. Foster, J.S., Henley, D.C,. Ahamed, S., and Wimalasena, J., 2001, Estrogen and Cell Cycle
Regulation in Breast Cancer, Trend in Endocrinology and Metabolism, 12 (7), 320-327. Gerl, R., and Vaux, D.L., 2005, Apoptosis in The Development and Treatment of Cancer,
Carcin., 26 (2), 263-270.
Gibbs, J.B., (2000), Anticancer drug targets: growth factors and growth factor signaling, J. Clin
Invest, 105, 9-13.
Goldie, JH., (2001),Drug resistance in cancer: A perspective, Cancer and Metastasis Rev, 20: 63-68
Gondhowiardjo, S., 2004, Proliferasi Sel dan Keganasan, Majalah Kedokteran Indonesia, 54 (7), 289-299.
Hanahan, D., and Weinberg, R.A., 2000, The Hallmarks of Cancer, Cell, 100, 57-70
Indyah S.A., Henk T, Samhudi, Sastrohamidjojo, and Henk an der Goot., 2000., Synthesis of benzylideneacetophenones and their inhibition of lipidperoxidation., Eur. J., Med. Chem. 35, 449-457
Indyah S., A., 2007, Cyclooxygenase inhibitory activity of benzilideneacetofenone analogue. Recent Development in Curcumin Pharmacochemistry, Procedding of International Symposium on Recent Progress in Curcumin Research, 11-12 September.
Indyah S.A., Synthesize and Citotoxicity Test of Several Compounds of mono para hidroxy chalcone, 2010, Indo. J. Chem., 2010, 10 91), 110-115
Julia, S., 2001, Uji Sitotoksisitas Fraksi Protein Daun Erythrina fusca Luor (Cangkring) Pada Sel HeLa, Skripsi, Fakultas Farmasi Universitas Gadjah Mada, Yogyakarta.
Kampa, M., Alexaki, Vassilia-Ismini., Notas, George., Nifli, Artemissia-Phoebe., Nistikaki, Anatassia., Hatzoglou, Anastassia., Bakogeorge, Efstathia, Koumtzoglou, Elena., Blekas, George., Boskou, Dimitrios., Gravanis, Achille., and Castanas, E., 2004, Antiproliferatif and Apoptotic Effect of Selective Phenolic Acids on T47D uman Breast Cancer Cells: Potential Mechanisms of Action., Breast Cancer Res, 6: R63-R74
Keshet, E., and Bens Sasson, S.A., 1999, Anticancer drug targets: approching angiogenesis, J.
Clin. Invest., 104(11), 1497-1501.
King, R.J.B. (2000). Cancer Biology, 2nd ed. Pearson Education Limited, England
Lee, Y.S.; Lim, S.S.; Shin, K.H.; Kim, Y.S.; Ohuchi, K.; Jung, S.H.2006. Anti-angiogenic and antitumoractivities of 2-hydroxy-4- methoxychalcone. Biol. Pharm. Bull. 29, 1028-1031.
9
Lodish, H., Berk, A., Zipursky, Lawrence, S., Matsurada, P., Baltimore, D., and Darnel, J., 2000,
Molecular Cell Biology, 4
th
Edition, W.H. Freeman and Company, New York, 1054-1062.
Mathivadani, P., Shanthi, P., and Sachdanandam, P., 2007, Apoptotic Effect of Semecarpus
anacardium nut Extract on T47D Cancer Cell Line., Cell. Biol. Int., 31, 1198-1206
Meiyanto, E., 1999, Kurkumin Sebagai Obat Kanker : Menelusuri Mekanisme Aksinya, Majalah
Farmasi Indonesia, 10 (4), 224-236.
Meiyanto, E., 2002, Bahan Kuliah Biologi Molekuler: Signal Transduksi-Cell Cycle-Transposon,
Proyek Que Fakultas Farmasi UGM, Yogyakarta.
Petak, I., Houghton, Janet A., and Kopper, L., 2006, Molecular Targeting of Cell Death Signal Transduction Pathways in Cancer, Current Signal Transduction Therapy, 1, 113-131. Pines, J., 1997, Mammalian Cell Cycle, Oncogenes and Tumor Suppressors, IRL Press, Oxford
University Press, New York, 189-191.
Retno A, Indyah, S.A., dan Sri A., 2010, Uji Sitotoksisitas Senyawa Mono Para Hidroksi Kalkon terhadap Cancer cell lines T47D, Saintek Jurnal, UNY
Sasayama, T.; Tanaka, K.; Mizukawa, K.; Kawamura, A.; Kondoh, T.; Hosoda, K.; Kohmura, E. 2007. Trans-4-lodo,4-boranyl-chalcone induces antitumor activity against malignant glioma cell lines in vitro and in vivo. J. Neu-Onc. 85, 123-132
Shapiro, G.I. and Harper, J.W., (1999), Anticancer drug targets: cell cycle and chekpoint control,
J. Clin. Invest., 104, 1645-1653.
Teich, N. M., 1997, Oncogenes and Cancer in Franks, L.M. dan Teich, N.M., Cellular and
Molecular Biology of Cancer, 3
rd
Edition, Oxford University Press, London.
Toshio M. Li-Bo W. ,Seikou N. , Kiyofumi N., Eri Y., Hisashi M., Osamu .M., Li-Jun W., and Masayuki Y., 2009., Medicinal Flowers. XXVII.1) New Flavanone and Chalcone Glycosides, Arenariumosides I, II, III, and IV, and Tumor Necrosis Factor-a Inhibitors from Everlasting, Flowers of Helichrysum arenarium, Chem. Pharm. Bull. 57(4) 361— 367 (2009)
World Health Organization. (1998). The World Health Report : live in the 21st century, A vision for all, WHO, Geneva
Wyllie, A., Donahue, V., Fischer, B., Hill, D., Keesey, J., and Manzow, S., 2000, Cell Death
Apoptosis and Necrosis, Rosche Diagnostic Corporation
Xu, Z-X., Liang, J., Gaikwad, A., Connoly, F.P., Milss, G.B., and Guttermann, J.U., 2007, A plant Triterpenoid, avicin D, Induces Autophagy by Activation of AMP-activated Protein Kinase, Cell Death and Differentitaion, 14:1948-1957.
Ye, C.L.; Liu, J.W.; Wei, D.Z.; Lu, Y.H.; Qian, F.2004. In vitro anti-tumor activity of 2, 4-dihydroxy-6-methoxy-3, 5-dimethylchalcone against six established human cancer cell lines. Pharmacol. Res. 2004, 50, 505-510
Ye, C.L.; Liu, J.W.; Wei, D.Z.; Lu, Y.H.; Qian, F. 2005. In vivo antitumor activity by 2, 4-dihydroxy-6-methoxy-3, 5-dimethylchalcone in a solid human carcinoma xenograft model. Canc. Chemo.Pharm., 55, 447-452.