3
II. TINJAUAN PUSTAKA
A. TONGKOL JAGUNG
Tongkol jagung adalah tempat pembentukan lembaga dan gudang makanan untuk pertumbuhan biji. Jagung mengandung kurang lebih 30% tongkol jagung, sedangkan sisanya adalah kulit dan biji (Koswara, 1991). Panjang tongkol jagung bervariasi antara 8–12 cm (Effendi dan Sulistiati, 1991). Karakteristik dan komposisi kimia tongkol jagung dapat dilihat pada Tabel 1.
Tabel 1. Karakteristik dan komposisi tongkol jagung Kandungan (%) Jumlah Nutrisi (%)
Air 9,4 Protein, N x 6,25 2,5
Selulosa 41 Lemak, ester, dll 0,5
Hemiselulosa 36 Serat Kasar 32
Xilan 30 Abu 1,5
Lignin 6 Ekstrak nitrogen bebas 53,5
Pektin 3 Neutral Detergen Fiber (NDF) 83
Pati 0,014 Total nutrien dapat dicerna 42
Sumber : Johnson (1991)
Berdasarkan Tabel 1 dapat diketahui bahwa komposisi utama tongkol jagung adalah selulosa dan hemiselulosa. Dengan kandungan selulosa dan hemiselulosa yang tinggi, tongkol jagung dapat digunakan sebagai sumber energi, bahan pakan ternak dan sebagai sumber karbon bagi pertumbuhan mikroba (Irawadi, 1990). Oleh karena itu, tongkol jagung dapat dihidrolisis dengan menggunakan kapang selulolitik.
B. PAKAN TERNAK
Pakan ternak ruminansia dapat digolongkan menjadi dua bagian yaitu golongan pakan hijauan dan golongan pakan tambahan berupa konsentrat.
4 Pakan hijauan dapat diperoleh dari jenis rumput, legume (kacang-kacangan), daun pisang, daun nangka dan hijauan lain. Pakan konsentrat adalah pakan tambahan yang harganya murah dan tidak bersaing dengan kebutuhan manusia serta dapat diperoleh dari limbah pertanian seperti tongkol jagung, ampas bir, bekatul, pollard, onggok, dan tetes. Untuk memenuhi kebutuhan pakan ternak dikenal istilah complete feed atau pakan lengkap yang merupakan pakan yang terbuat dari limbah pertanian yang diformulasikan sedemikian rupa sehingga semua kebutuhan nutrisi ternak ruminansia dapat terpenuhi (Sutirtoadi, 2009). Kandungan protein dan serat kasar yang dapat memenuhi kebutuhan ternak ruminansia masing-masing sebesar lebih besar dari 8% dan 15% (Prihatman, 2000). Bahan pakan ternak yang baik mengandung protein kasar kurang dari 20%, dengan konsentrasi serat kasar di bawah 18% (Bappenass, 2001). Kandungan serat tongkol jagung yang cukup tinggi membutuhkan suatu proses hidrolisis untuk menurunkan kadar serat, salah satunya dihidrolisis dengan kapang selulolitik.
Menurut Riwantoro (2005), bahan-bahan yang biasa digunakan untuk pembuatan complete feed antara lain : (1) sumber serat kasar (jerami kedelai, tongkol jagung, pucuk tebu dan lain-lain), (2) sumber energi (pollard, dedak padi, bungkil tapioka, tetes dan lain-lain), (3) sumber protein (bungkil kopra, bungkil sawit, bungkil minyak biji kapok atau klenteng, kulit kopi, kulit kakao, urea dan lain-lain), (4) sumber mineral (tepung tulang, campuran mineral, garam dapur dan lain-lain).
C. SPORA INOKULUM
Sejak awal diaplikasikannya kultivasi media padat yang melibatkan fungi, inokulum spora telah umum digunakan. Kualitas inokulum spora sangat menentukan keberhasilan kultivasi media padat (Doelle et al., 1991). Bentuk, umur dan rasio inokulum adalah faktor kritis pada sistem kultivasi media padat yang mengandalkan pada rasio jumlah inokulum yang besar untuk mengontrol kontaminasi (Jonsane et al., 1991).
Inokulum yang digunakan dapat berupa spora atau miselium, atau kedua– duanya. Inokulum spora memberikan keleluasaan yang lebih besar, karena
5 viabilitas spora dapat dipertahankan untuk periode yang lama dibandingkan miselia fungi, sehingga dapat disimpan dan digunakan kapan dibutuhkan. Selain itu, spora bersifat kurang rentan terhadap kesalahan pemanenan/kultivasi. Spora memudahkan penyebaran yang merata. Namun kelemahan inokulum spora adalah perlunya waktu yang lebih lama (1–12 jam) untuk melakukan germinasi, kondisi optimal germinasi spora mungkin berbeda dengan pertumbuhan vegetatifnya atau perlu stimulasi oleh beberapa zat nutrisi atau faktor lingkungan. Inokulum dapat diproduksi baik pada media padat atau media cair. Sporulasi dari fungi umumnya lebih baik pada media padat daripada media cair (Doelle et al., 1991).
Spora hasil kultivasi dapat langsung digunakan atau langsung dapat dikeringkan pada 40–50oC sampai mencapai kandungan uap air 8–12%, tanpa kehilangan viabilitas spora yang besar (Roussos, et al., 1992). Lonsane dan Ghildyan (1991) telah memproduksi spora kapang yang dikeringkan pada suhu 35–40oC dan disimpan dalam kantong polietilen selama enam bulan pada suhu ruang tanpa terjadi efek penurunan pada viabilitas spora.
Densitas inokulum penting dipertimbangkan untuk berbagai kebutuhan kultivasi. Kepadatan spora yang berlebihan dari spora dapat menghambat germinasi dan perkembangannya (Doelle et al., 1991). Spora kapang merupakan bagian dorman dalam siklus hidup kapang, tetapi masih menunjukkan kemungkinan mengandung enzim dalam melakukan aktifitasnya. Inokulum yang berupa spora adalah starter yang baik dalam kultivasi (Wolf, 1949).
D. Aspergillus niger
Aspergillus niger adalah kapang anggota genus Aspergillus, famili Eurotiaceae, ordo Eutiales, sub-kelas Plectomycetetidae, kelas Ascomycetes, sub-divisi Ascomycotina dan divisi Amastigmycota (Hardjo et al., 1989). Aspergillus sangat mudah dikenali, baik dari morfologi selnya maupun dari morfologi koloninya. Genus Aspergillus mempunyai morfologi sel seperti pada Gambar 1.
6 Gambar 1. Morfologi sel Aspergillus : a. Vesikel, b. Metulae, c. Spora
(Malloch,1999).
A. niger mempunyai kepala pembawa konidia yang besar, padat, bulat dan berwarna hitam coklat atau ungu coklat. Kapang ini mempunyai bagian yang khas yaitu hifanya bersepta, spora yang bersifat seksual dan tumbuh memanjang di alas stigma, mempunyai sifat aerobik, sehingga dalam pertumbuhannya memerlukan oksigen yang cukup. A. niger termasuk mikroba mesofilik dengan pertumbuhan maksimum pada suhu 35-37°C. Derajat keasaman untuk pertumbuhannya adalah 2,0-8,5 tetapi pertumbuhan akan lebih baik pada kondisi keasaman atau pH yang rendah (Fardiaz, 1989).
A. niger dapat tumbuh dengan cepat, sehingga sering digunakan secara komersial dalam produksi asam sitrat, asam glukonat dan pembuatan berapa enzim seperti amilase, pektinase, amiloglukosidase dan selulase. A. niger dapat tumbuh pada suhu 35-37ºC (optimum), 6-8ºC (minimum), 45-47ºC (maksimum) dan memerlukan oksigen yang cukup (aerobik) (Fadli, 2009).
A. niger dalam pertumbuhannya berhubungan langsung dengan zat makanan yang terdapat dalam substrat. Molekul sederhana seperti gula dan komponen lain yang terdapat di sekeliling hifa dapat langsung diserap, sedangkan molekul yang lebih kompleks seperti selulosa, pati, protein, dan minyak lemak harus dipecah dahulu sebelum diserap ke dalam sel, dengan menghasilkan beberapa enzim ekstraseluler. Bahan organik dari substrat digunakan oleh A. niger untuk aktivitas transpor molekul, pemeliharaan struktur sel dan mobilitas sel (Fadli, 2009). A. niger merupakan kapang yang dapat menghasilkan beberapa enzim ekstraseluler. A. niger merupakan kapang penghasil enzim selulosa yang banyak mengandung β-glukosidase tetapi
7 rendah akan ekso dan endoglukanase (Sternberg et al., 1979 dan Mandels, 1982).
Kurva pertumbuhan kapang A. niger ditunjukkan pada Gambar 2. Pertumbuhan A. niger dimulai pada fase adaptasi pada jam ke 8, dilanjutkan dengan fase pertumbuhan cepat (eksponensial) pada jam ke 16–24. Fase pertumbuhan lambat terjadi setelah melewati jam ke 24. Kemudian diteruskan dengan fase stasioner, dimana jumlah kapang yang tumbuh sama dengan kapang yang mati pada jam ke 40–100. Pada jam diatas 100 terjadi penurunan biomassa kapang yang dinamakan fase kematian, dimana biomassa kapang yang mati lebih banyak dari pada yang tumbuh (Soeprijanto et al., 2009).
Gambar 2. Kurva pertumbuhan Aspergilus niger (Soeprijanto et al., 2009)
A. niger dalam pertumbuhannya sangat dipengaruhi oleh ketersediaan senyawa nitrogen, baik nitrogen organik maupun nitrogen anorganik. Sumber nitrogen organik yang baik adalah pepton, sedangkan sumber nitrogen anorganik yang sering digunakan untuk pertumbuhan kapang adalah garam– garam amonium dan nitrat (Enari, 1983).
E. Neurospora sitophila
Neurospora sitophila merupakan kapang yang termasuk dalam subdivisi Eumycophyta, kelas Ascomycetes, ordo Sphriales dan famili Sordoriaceae. Kapang ini mudah menyebar dan berkembang biak secara cepat terutama dengan aseksual, biasanya ditemukan pada tingkat konidia. Spora seksualnya
8 jarang ditemui karena hanya dalam jumlah sedikit (Alexopoulus dan Mims, 1996).
Kapang ini dikenal sebagai kapang oncom merah (Dwidjoseputro, 1961). N. sitophila memilki konidia berwarna jingga (oranye) yang tumbuh menyebar di atas permukaan substrat. Kapang ini dapat tumbuh dengan baik pada kelembaban yang tinggi dan mempunyai suhu pertumbuhan antara 20–30oC pada kondisi aerobik (Judoamidjojo et al., 1989). Menurut Amer dan Stephen (1982), Ascomycetes sebagai “soft rot fungi” dapat mendegradasi lignin dan bahan lignoselulosik. Gambar morfologi kapang N. sitophila dapat dilihat pada Gambar 3.
Gambar 3. Neurospora sitophila (Karmana, 2006)
N. sitophila berkembang dengan cara menyebarkan benang–benang miselium dan dengan menghasilkan spora (konidia). Jika miselium pecah, masing–masing hifa akan membentuk miselia. Demikian juga pemisahan konidia ini akan membentuk miselium yang serupa dengan miselium parentalnya (Swanson dan McElroy, 1975).
Reproduksi seksual N. sitophila berlangsung dengan cara somatogamy, yaitu melalui proses fusi dua hifa vegetatif yang kompatibel (Blod et al., 1980) atau disebut plasmogamy (Alexopoulus dan Mims, 1996). Plasmogamy (somatogamy) dapat terjadi dalam berbagai cara, suatu konidium atau mikrokonidium berperan sebagai sel jantan berhubungan dengan hifa vegetatif atau trikhogen yang berperan sebagai organ penerima betina. Plasmogamy akan membentuk peritesium (Alexopoulus dan Mims, 1996).
9 Proses plasmogamy diterangkan juga oleh Blod et al. (1980), yaitu setelah melalui tahapan miosis dan mitosis akan terbentuk spora seksual yang disebut askospora di dalam askus. Askus dewasa akan pecah dan mengeluarkan askospora yang selanjutnya akan dikeluarkan dari peritesium melalui ostiola dan siap tumbuh menjadi individu baru.
Menurut Griffin (1981), laju pertumbuhan spesifik N. sitophila sebesar 0,4/jam (µmax). Pertumbuhan hifa secara memanjang berlangsung dalam laju
yang linier dan pertambahan massa juga linier. Spora akan mati apabila berada pada suhu di atas 60oC.
Alberghina dan Sturan (1981), mengemukakan bahwa kultur Neurospora memiliki waktu penggandaan biomassa bervariasi dari 1 sampai 8 jam. Sementara Metzenberg (1979) menyebutkan bahwa pertambahan massa dari kultur bertambah dua kalinya setelah 2,5 jam, dan laju pertambahan panjang miselia N. sitophila sebesar 0,6 cm/jam. Jadi dalam sehari bertambah panjang 10–14 cm. Konidiumnya melakukan germinasi jika berada pada nutrisi yang cocok dan setelah 2–5 jam mulai membentuk hifa. Kurva pertumbuhan yang telah didapat dapat dilihat pada Gambar 4.
Gambar 4. Kurva pertumbuhan Neurospora sitophila (Metzenberg, 1979) Saono dan Budiman (1981) menyatakan bahwa kapang oncom merah bersifat amilolitik kuat, tetapi lemah sifat lipolitik dan proteolitiknya. Jenis enzim amilolitik yang diproduksi oleh N. sitophila adalah α-amilase dan
10 glukoamilase. Menurut Chandel et al. (2007), mengatakan bahwa N. sitophila memiliki kemampuan aktivitas selulolitik dan hemiselulolitik yang tinggi pada proses fermentasi untuk menghasilkan gula sederhana. Menurut Moat (1979), N. sitophila tumbuh secara normal pada substrat yang hanya mengandung sumber karbon, garam organik dan biotin. Sumber karbon tersebut berupa mono-, di-, atau polisakarida.
F. SUBSTRAT INOKULUM
Substrat digunakan sebagai bahan makanan bagi pertumbuhan mikroba. Beberapa bahan yang merupakan hasil samping dari industri dapat digunakan sebagai substrat inokulum. Limbah industri tersebut masih mengandung nutrisi yang cukup untuk pertumbuhan mikroba. Beberapa bahan yang merupakan hasil limbah industri yang masih dapat dimanfaatkan, diantaranya adalah : 1. Ampas Tapioka (Onggok)
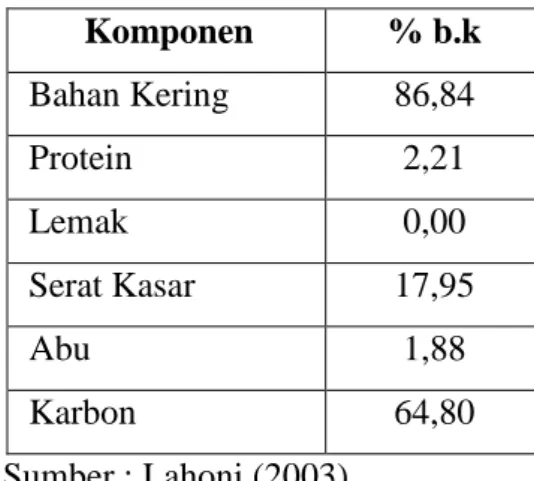
Pada proses pengolahan ketela pohon menjadi tapioka diperoleh dua jenis limbah, yaitu limbah padat dan cair. Limbah padat terdiri dari kulit ketela pohon, sisa potongan yang tidak terparut, ampas tapioka yang merupakan sisa proses ekstraksi pati, dan lindur (elot) yang berasal dari proses pengendapan air buangan (Moertinah, 1984). Pada Tabel 2 disajikan komposisi kimia ampas tapioka.
Tabel 2. Komposisi ampas tapioka Komponen % b.k Bahan Kering 86,84 Protein 2,21 Lemak 0,00 Serat Kasar 17,95 Abu 1,88 Karbon 64,80 Sumber : Lahoni (2003)
11 Pemanfaatan ampas tapioka selama ini diubah menjadi tepung asia. Pembuatan tepung asia dilakukan dengan cara menjemur singkong menggunakan panas sinar matahari dan kemudian digiling sampai menjadi tepung. Kandungan pati pada ampas tapioka sekitar 60–70% dari bobot keringnya, sehingga ampas tapioka sangat potensial sebagai sumber karbon dalam proses produksi spora inokulum. Kandungan protein pada ampas tapioka cukup rendah, sehingga diperlukan penambahan bahan lagi dalam produksi inokulum spora.
2. Ampas Tahu
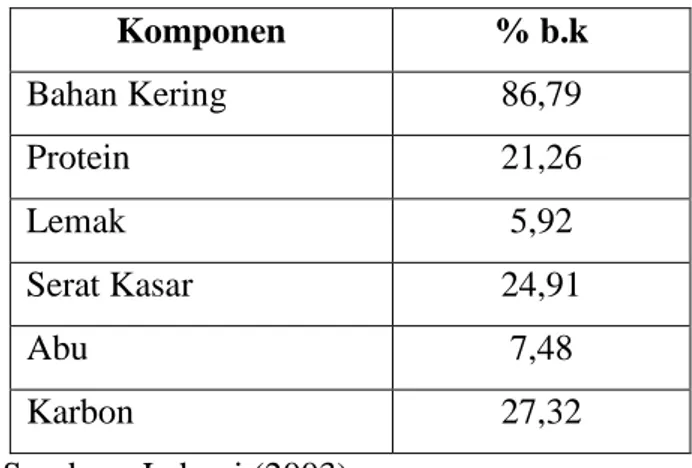
Pada pembuatan tahu akan dihasilkan hasil samping, yaitu ampas tahu. Pada proses pembuatan tahu hanya sebagian protein yang dapat diekstrak dan diolah menjadi tahu dan sebagian protein masih tertinggal di ampasnya. Menurut Shurtleff dan Aoyagi (1979), kandungan protein ampas tahu masih mengandung 7% dari jumlah protein kedelai. Pada Tabel 3 disajikan komposisi kimia ampas tahu kering.
Tabel 3. Komposisi kimia ampas tahu kering
Komponen % b.k Bahan Kering 86,79 Protein 21,26 Lemak 5,92 Serat Kasar 24,91 Abu 7,48 Karbon 27,32 Sumber : Lahoni (2003)
Ampas tahu yang baru dihasilkan memiliki tekstur yang kokoh walaupun mempunyai kadar air yang tinggi. Kandungan protein yang tinggi disebabkan adanya kandungan serat kasar yang mengikat air secara hidrofilik dan kompak. Ampas tahu yang berasal dari perasan bubur kedelai masak mempunyai daya tahan selama 24 jam dalam keadaan terbuka bebas.
12 Ampas tahu dapat diawetkan dengan mengubahnya menjadi tepung. Pengawetan dilakukan dengan cara ampas tahu yang segar diperas untuk mengurangi kandungan airnya, selanjutnya dijemur di bawah sinar matahari atau dikeringkan dengan bantuan oven pada suhu 45–50oC. Setelah kering kemudian ampas tahu digiling sampai menjadi tepung.
Pemanfaatan ampas tahu selama ini masih terbatas sebagai makanan ternak, bahan baku oncom dan tempe ampas tahu. Melihat kandungan protein yang cukup tinggi dan jumlah ampas tahu yang tersedia cukup banyak maka ampas tahu ini dapat berpotensi digunakan sebagai campuran media untuk memproduksi spora inokulum.
3. Bekatul
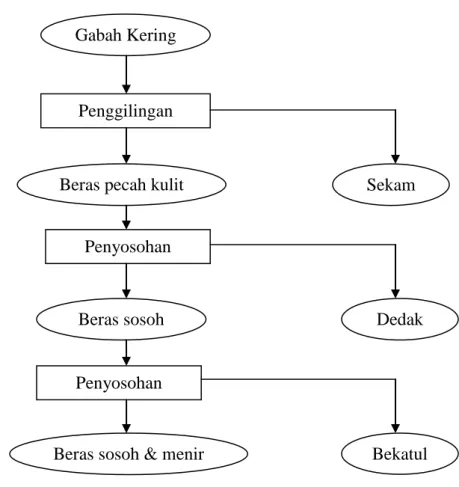
Gabah kering merupakan gabungan dari sekam, dedak, dan bekatul. Pada umumnya masyarakat Indonesia mengenal bekatul sebagai dedak. Persepsi tersebut kurang tepat karena dedak merupakan hasil penyosohan pertama, sedangkan bekatul merupakan hasil penyosohan kedua. Dedak lebih sesuai sebagai pakan ternak karena komponen silikanya tinggi, sedangkan bekatul berpotensi sebagai bahan pangan. Dedak terdiri atas lapisan dedak sebelah luar dari butiran padi dengan sejumlah lembaga padi. Bekatul merupakan lapisan dedak bagian dalam dan sebagian endosperm (Damardjati, 1983). Proses penggilingan gabah kering ditujukan pada Gambar 5.
Bekatul merupakan hasil samping penggilingan beras. Bekatul terdiri atas lapisan perikarp, testa, dan lapisan aleuron. Selama penggilingan gabah kering dihasilkan sekam 20%, 8% bekatul, lembaga 2% dan beras sosoh 70% (Orthoefer, 2001). Komposisi kimia bekatul disajikan dalam Tabel 4. Kandungan mineral dan protein yang cukup tinggi pada bekatul berpotensi digunakan sebagai campuran media inokulum.
13 Gambar 5. Skema proses penggilingan gabah kering
(modifikasi Damardjati, 1983)
Tabel 4. Komposisi kimia bekatul pada kadar air 14%
Komponen Jumlah Protein (%) 12,0 – 15,6 Lemak (%) 15,0 – 19,7 Serat Kasar (%) 7,0 – 11,4 Abu (%) 6,6 – 9,9 Karbohidrat (%) 34,1 – 52,3 Magnesium (mg/g) 5,0 – 13,0 Kalsium (mg/g) 0,3 – 1,2 Fosfor (mg/g) 11,0 – 25,0 Silika (mg/g) 5,0 – 11,0 Seng (µg/g) 43,0 – 258,0 Thiamin (µg/g) 12,0 – 24,0 Riboflavin/B2 (µg/g) 1,8 – 4,0 Tokoferol/E (µg/g) 149 – 154 Sumber : Luh (1991) Beras pecah kulit
Gabah Kering
Penggilingan
Penyosohan
Beras sosoh
Penyosohan
Beras sosoh & menir
Sekam
Dedak
14 4. Bungkil Kacang Tanah
Bungkil kacang tanah adalah ampas yang berasal dari kacang tanah yang telah diambil minyaknya dengan proses pemerasan mekanis atau proses ekstraksi. Bungkil kacang tanah memiliki warna lebih coklat dan kandungan lemaknya lebih tinggi bila dibanding dengan bungkil kedelai, sehingga menjadikannya mudah berbau tengik. Kadar proteinnya paling tinggi diantara bungkil lain yang umum digunakan (Anonima, 2010).
Bungkil kacang tanah digunakan sebagai komposisi dalam ransum konsentrat untuk sapi, babi dan ayam. Penggunaan bungkil kacang tanah perlu dibatasi jumlahnya karena kadar lemaknya yang cukup tinggi dan harganya relatif mahal. Komposisi zat gizi bungkil kacang tanah dapat dilihat pada Tabel 5.
Tabel 5. Komposisi zat gizi bungkil kacang tanah per 100 g bahan
Komposisi Jumlah Energi (kkal) 336 Protein (g) 37,4 Lemak (g) 13 Karbohidrat (g) 30,5 Kalsium (mg) 730 Fosfor (mg) 470 Besi (mg) 30,7 Vitamin B1 (mg) 0,0 Air (g) 14
Sumber : Direktorat Gizi, Departemen Kesehatan RI (1981)
J. NISBAH C/N
Mikroba membutuhkan karbon, nitrogen, ion organik, faktor tumbuh, energi, dan air untuk metabolisme dan pertumbuhannya yang diperoleh dari media. Media yang digunakan hendaknya memenuhi kebutuhan minimum pertumbuhan, kelangsungan hidup dan tidak terkontaminasi racun atau penghambat lainnya (Fardiaz, 1992).
Penggunaan nisbah C/N sebagai nilai pendekatan sistematis memberikan kemudahan untuk menganalisis komposisi media yang berhubungan dengan
15 sifat fisiologis mikroba. Menurut Walker (1999), ada beberapa dasar penting untuk mempersiapkan media, yaitu :
1. Komposisi bahan, meliputi kemurnian, perbandingan karbon dan nitrogen, perbedaan variasi tiap bagian, tersedianya kebutuhan tumbuh dan ion–ion. 2. Pengaruh dari perbedaan campuran tiap bahan, pH yang dibutuhkan
sebelum dan sesudah sterilisasi, efek sterilisasi pada mineral dan garam. 3. Perubahan pada media sebelum inokulasi, suhu, aerasi, pengadukan, dan
penggunaan senyawa antibusa.
Komposisi elemen–elemen mikroba dapat digunakan untuk menentukan kisaran nisbah C/N media. Hal ini karena pembentukan sel–sel mikroba membutuhkan sejumlah karbon dan nitrogen. Pada pengolahan kompos dengan menggunakan mikroba aerobik dibutuhkan 15 hingga 30 bagian karbon untuk setiap bagian nitrogen (Stentiford et al., 1992). Apabila digunakan nisbah C/N yang tinggi akan menyebabkan terjadinya penurunan proses biodegradasi karena keterbatasan nitrogen dan mempengaruhi hasil kultivasi. Pada Tabel 6 disajikan komposisi elemen–elemen bakteri, khamir, dan fungi. Dengan mengetahui komponen pada kapang maka dapat dibuat media yang sesuai dengan sifat fisiologis kapang.
Tabel 6. Komponen elemen–elemen bakteri, khamir, dan kapang Elemen Bakteri (% b.k) Khamir (% b.k) Kapang (% b.k)
Karbon 50 – 53 45 – 50 40 – 63 Hidrogen 7 7 – Nitrogen 12 – 15 7.5 – 11 7 – 10 Fosfor 2.0 – 3.0 0.8 – 2.6 0.4 – 4.5 Sulfur 0.2 – 1.0 0.01 – 0.24 0.1 – 0.5 Kalium 1.0 – 4.5 1.0 – 4.0 0.2 – 2.5 Natrium 0.5 – 1.0 0.01 – 0.1 0.02 – 0.5 Kalsium 0.01 – 1.1 0.1 – 0.3 0.1 – 1.4 Magnesium 0.1 – 0.5 0.1 – 0.5 0.1 – 0.5 Khlorida 0.50 – – Besi 0.02 – 0.2 0.01 – 0.05 0.1 – 0.2 (Doelle et al., 1992)
16 K. HIDROLISIS BAHAN LIGNOSELULOSA
Serat merupakan kelompok polisakarida yang tidak dapat dicerna yang terdapat dalam tanaman. Kelompok serat yang termasuk ke dalam yang tidak dapat dicerna adalah selulosa, hemiselulosa, lignin, pektin dan gum. Pada umumnya, serat berperan sebagai bahan penyusun dinding sel. Serat ada yang bersifat larut dan ada yang tidak larut dalam air. Selulosa, lignin dan hemiselulosa termasuk serat yang tidak dapat larut, sedangkan pektin dan gum termasuk serat yang dapat larut. Didasarkan pada fungsinya di dalam tanaman, serat dibagi menjadi 3 fraksi utama, yaitu (a) polisakarida struktural yang terdapat pada dinding sel, yaitu selulosa, hemiselulosa dan substansi pektat, (b) non-polisakarida struktural yang sebagian besar terdiri dari lignin, dan (c) polisakarida non-struktural, yaitu gum dan agar-agar (Kusnandar, 2010).
Kandungan serat yang tinggi pada tanaman memerlukan suatu proses untuk mendegradasi komponen serat tersebut agar dapat dimanfaatkan secara maksimal, salah satunya dengan cara hidrolisis. Hidrolisis meliputi proses pemecahan polisakarida di dalam biomassa lignoselulosa, yaitu: selulosa dan hemiselulosa menjadi monomer gula penyusunnya. Hidrolisis sempurna selulosa menghasilkan glukosa, sedangkan hemiselulosa menghasilkan beberapa monomer gula pentose (C5) dan heksosa (C6). Hidrolisis dapat dilakukan secara kimia (asam) atau enzimatik (Suhandono, 2010). Hidrolisis ini merupakan proses untuk menghasilkan gula sederhana. Gong (1981) menyebutkan bahwa hidrolisis bahan–bahan berselulosa ini akan menghasilkan campuran gula dan xilosa yang merupakan komponen yang utama.
Hidrolisis kimiawi dilakukan dengan asam. Asam adalah katalis yang non spesifik, karena struktur berkristal yang sangat kuat pada selulosa, maka hanya asam kuat saja yang dapat menghidrolisis selulosa tingkat konversi yang tinggi. Kelemahan metode ini adalah kebutuhan bahan kimia tinggi serta energi yang tinggi. Selain itu, limbah cair dari hidrolisis menggunakan bahan kimia tergolong limbah yang berbahaya karena bersifat toksik, mutagenik, persisten dan bioakumulasi (Clemants et al., 1985).
Hidrolisis enzimatis komplek lignoselulosa dapat menggunakan mikroba yang mampu menghasilkan ligninase dan selulase. Hidrolisis enzimatis
17 memiliki beberapa keuntungan dibandingkan hidrolisis asam, antara lain tidak terjadi degradasi gula hasil hidrolisis, kondisi proses yang lebih lunak (suhu rendah, pH netral), berpotensi memberikan hasil yang tinggi, dan biaya pemeliharaan peralatan relatif rendah karena tidak ada bahan yang korosif (Taherzadeh & Karimi, 2007). Proses enzimatis merupakan proses ramah lingkungan berbahan baku terbarukan (renewable raw material).
Enzim merupakan katalis yang spesifik. Dalam hal ini enzim selulase dapat menghidrolisis selulosa dengan sedikit hasil samping. Enzim selulase yang berasal dari kapang merupakan suatu campuran yang terdiri atas tiga enzim yaitu endo β-glukonase, selobiohidrolase dan β-glukosidase yang bekerja secara sinergi dalam hidrolisis selulosa berkristal menjadi glukosa (Sasaki, 1982). Selobiohidrolase menyerang struktur berkristal selulosa dan menghasilkan selobiosa (disakarida). Endo β-glukonase menghidrolisis bagian amorf selulosa menjadi senyawa–senyawa dengan bobot molekul yang lebih kecil (β-oligomer menjadi glukosa) (Sasaki, 1982).
Selulosa adalah polimer glukosa yang membentuk rantai linier dan dihubungkan oleh ikatan β-1,4-glikosidik. Struktur linier ini menyebabkan selulosa bersifat kristalin dan tidak mudah larut. Selulosa tidak mudah didegradasi secara kimia maupun mekanis. Di alam, biasanya selulosa berasosiasi dengan polisakarida lain seperti hemiselulosa atau lignin membentuk kerangka utama dinding sel tumbuhan (Holtzapple, 1993).
Degradasi selulosa merupakan proses pemecahan polimer anhidrogluksa menjadi molekul-molekul yang lebih sederhana. Proses tersebut akan menghasilkan oligosakarida, disakarida atau trisakarida seperti selobiosa, glukosa monomer atau produk degradasinya. Produk utama degradasi selulosa adalah glukosa dan selobiosa (Judoamidjojo et al., 1989).
Hemiselulosa merupakan heteropolisakarida yang mengandung berbagai gula, terutama pentosa. Hemiselulosa umumnya terdiri dari dua atau lebih residu pentosa yang berbeda. Komposisi polimer hemiselulosa sering mengandung asam uronat sehingga mempunyai sifat asam. Hemiselulosa memiliki derajat polimerisasi yang lebih rendah, lebih mudah terhidrolisis dalam asam, mempuyai suhu bakar yang lebih rendah dibandingkan selulosa
18 dan tidak berbentuk serat-serat yang panjang. Selain itu, umumnya hemiselulosa larut dalam alkali dengan konsentrasi rendah, yaitu semakin banyak cabangnya semakin tinggi kelarutannya. Hemiselulosa dapat dihidrolisis dengan enzim hemiselulase (xilanase) (Kusnandar, 2010).
Lignin merupakan zat organik polimer yang penting dalam dunia tumbuhan, karena lignin meningkatkan sifat-sifat kekuatan mekanik sedemikian rupa, sehingga tumbuhan yang besar seperti pohon yang tingginya puluhan meter dapat tetap berdiri. Lignin terdapat dalam jaringan vaskuler berfungsi sebagai pengangkut cairan. (Fengel dan Wegner, 1995). Mekanisme degradasi lignin oleh fungi adalah depolimerisasi dengan pemutusan ikatan molekul. Pemecahan tersebut menghasilkan senyawa fenol dengan bobot molekul rendah seperti fenol karboksilat (asam sinamat). Degradasi kemudian dilanjutkan melalui cicin aromatik (Fengel dan Wegner, 1995).