4.1 Gambaran Umum
Perairan pantai Subang yang terletak di pantai utara pulau Jawa berhadapan langsung dengan Laut Jawa yang berada di sebelah utaranya. Beberapa sungai utama bermuara di pantai Subang, seperti Sungai Cilamaya, Blanakan, Ciasem, Cipunagara dan Sungai Cileuleuy yang membentuk 5 anak sungai. Umumnya sungai-sungai tersebut dimanfaatkan oleh nelayan sebagai sarana keluar/masuk perahu saat melakukan penangkapan ikan di perairan pantai utara Subang.
Di antara sungai-sungai tersebut, Sungai Blanakan merupakan jalur yang paling ramai sebagai sarana keluar/masuk kapal penangkapan ikan dari luar Subang, karena di tepi sungai ini terdapat Tempat Pendaratan Ikan (TPI) Blanakan. Para nelayan dari lokasi perairan sekitar umumnya langsung mendaratkan ikan hasil tangkapannya di TPI tersebut (Ariawan & Irawanti 2005). Selain itu, di daerah pesisir dekat laut lepas terdapat unit penambangan minyak pertamina yang berjarak sekitar ± 1Km dari Muara Blanakan. Di bagian daratan Blanakan sangat dekat dengan jalur pantura yang termasuk daerah perlintasan kendaran yang tersibuk di Pulau Jawa. Selain itu, terdapat hamparan persawahan yang mengelilingi Kecamatan Blanakan, dimana buangan irigasi persawahan tersebut diantaranya masuk ke Sungai Blanakan. Salah satu mata pencaharian masyarakat Kecamatan Blanakan adalah bertambak ikan di daerah mangrove dengan konsepsylvofishery.
Beberapa aktivitas di sekitar Kecamatan Blanakan yang berpontensi meningkatkan kandungan logam berat dalam perairan adalah pengecatan untuk anti fouling pada kapal dan pencucian kapal di sungai dapat meningkatkan konsentrasi logam Cu. Kegiatan transportasi yang menghasilkan asap dari bahan bakar baik itu dari kapal tempel maupun kendaraan motor menjadi penyumbang Pb ke perairan Blanakan begitu juga halnya dengan penambangan minyak mentah yang ada didaerah laut Blanakan yang berpotensi penyumbang Pb ke pesisir Blanakan. Menurut penelitian Pacyna (1986) dalam Darmono (2001) minyak mentah mengandung logam Pb sebesar 1-310 µg/L dan Cd sebesar 30-2100 µg/L.
Sedangkan kegiatan perbaikan/ pengecatan kapal dan penggunaan pestisida merupakan penyumbang logam Cd ke perairan tersebut
4.2 Parameter Lingkungan
Parameter fisika dan k suhu, pH, oksigen terlarut (DO) pada Tabel 3.
Tabel 3. Parameter fisika dan kimia perairan Parameter
Suhu pH DO Salinitas
* KepMen LH Nomor 51 Tahun 2004
4.2.1 Suhu
Suhu merupakan salah satu faktor penting bagi kelangsungan hidup organisme dalam suatu ekosistem darat maupun perairan (Khazali
perairan dipengaruhi oleh musim, lintang, ketinggian dari permukaan laut, waktu dalam hari, sirkulasi udara, penutupan awan, aliran
Perubahan suhu air berpengaruh terhadap
Peningkatan suhu akan meningkatkan reaksi kimia,
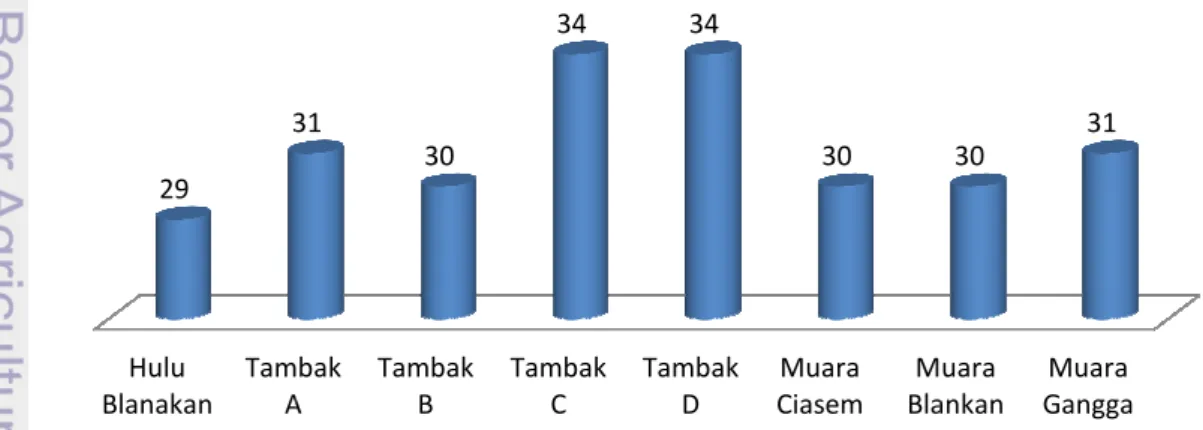
(Effendi 2003). Hasil pengukuran suhu di lokasi penelitian disajikan pada Gambar 3. Hulu Blanakan Tambak A 29 31 Gambar
Sedangkan kegiatan perbaikan/ pengecatan kapal dan penggunaan pestisida merupakan penyumbang logam Cd ke perairan tersebut (Mukhtasor 2007)
Lingkungan
Parameter fisika dan kimia yang diamati pada penelitian ini antara lain suhu, pH, oksigen terlarut (DO) dan salinitas. Hasil pengamatan tersebut tersaji
Parameter fisika dan kimia perairan Blanakan
Parameter Satuan Data Sampel Baku
Suhu 0C 29-34 28
- 5-8
mg/L 4,1-8,9
Salinitas psu 1-30 0,5
* KepMen LH Nomor 51 Tahun 2004
Suhu merupakan salah satu faktor penting bagi kelangsungan hidup organisme dalam suatu ekosistem darat maupun perairan (Khazali
perairan dipengaruhi oleh musim, lintang, ketinggian dari permukaan laut, waktu dalam hari, sirkulasi udara, penutupan awan, aliran dan kedalaman badan air.
suhu air berpengaruh terhadap sifat fisika, kimia, dan biologi
akan meningkatkan reaksi kimia, evaporasi dan votilisasi Hasil pengukuran suhu di lokasi penelitian disajikan pada Gambar
Tambak A Tambak B Tambak C Tambak D Muara Ciasem Muara Blankan 31 30 34 34 30
Gambar 3. Grafik nilai suhu (oC) di perairan lokasi penelitian
Sedangkan kegiatan perbaikan/ pengecatan kapal dan penggunaan pestisida (Mukhtasor 2007).
imia yang diamati pada penelitian ini antara lain ngamatan tersebut tersaji
Baku Mutu* 28-32
7-8,5 >5 0,5-30
Suhu merupakan salah satu faktor penting bagi kelangsungan hidup organisme dalam suatu ekosistem darat maupun perairan (Khazali 1998). Suhu di perairan dipengaruhi oleh musim, lintang, ketinggian dari permukaan laut, waktu kedalaman badan air. sifat fisika, kimia, dan biologi perairan. evaporasi dan votilisasi Hasil pengukuran suhu di lokasi penelitian disajikan pada Gambar
Muara Blankan Muara Gangga 30 31 lokasi penelitian
Berdasarkan Gambar 3 di atas dapat dilihat bahwa suhu perairan di lokasi penelitian berada pada rentang angka 29-34 oC dan hal ini sesuai dengan baku mutu KepMen LH (2004) yaitu sekitar 28-32 oC. Suhu pada kedelapan daerah tersebut masih dapat ditoleransi bagi kehidupan biota. Daerah tambak C dan D memiliki suhu paling tinggi dibandingkan dengan daerah perairan lainnya yaitu sebesar 34 oC, sedangkan daerah perairan hulu Blanakan memiliki suhu paling rendah yaitu sebesar 29 oC. Daerah tambak C dan D memiliki suhu yang paling tinggi karena daerah tersebut memiliki jumlah mangrove yang lebih sedikit dibandingkan daerah lainnya. Hal ini menyebabkan panas matahari yang sampai ke perairan tambak C dan D lebih besar daripada daerah lainnya. Hulu Blanakan memiliki suhu yang rendah karena perairannya tergolong perairan terbuka dimana perpindahan maupun perubahan suhu relatif lebih cepat berubah. Hal ini juga didukung oleh kondisi lingkungan hulu Blanakan yang didominasi oleh pepohonan rindang.
Berbeda halnya dengan daerah tambak A dan B yang memiliki populasi mangrove yang lebih lebat. Pada tambak A dan B, suhu perairannya relatif lebih rendah. Selain itu, perairan tambak merupakan perairan yang tergolong semi tertutup dimana debit air diatur oleh masukan dan keluaran air dari kalen (pintu). Berbeda halnya pula dengan daerah muara yang merupakan perairan terbuka, dimana terjadi perpindahan suhu yang relatih cepat. Suhu berbanding lurus dengan toksisitas dari logam berat, semakin tinggi suhu dari suatu perairan tersebut maka semakin tinggi juga tingkat toksisitas logam yang ada di perairan tersebut yang dapat membahayakan bahkan menyebabkan kematian biota.
4.2.2 Salinitas
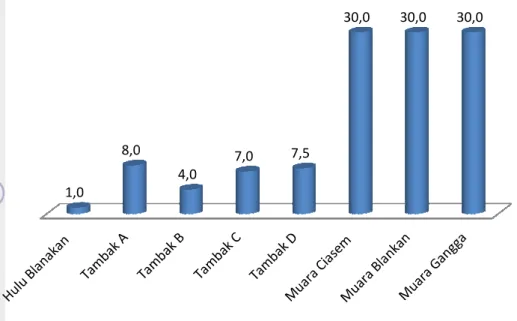
Setiap lokasi memiliki kadar salinitas yang berbeda-beda menurut sebaran horizontal salinitasnya, dimana semakin menuju laut maka salinitasnya semakin tinggi. Sebaran salinitas di laut dipengaruhi oleh beberapa faktor seperti pola sirkulasi air, penguapan (evaporasi), curah hujan (presipitasi) dan aliran sungai (run off) yang ada di sekitarnya (Effendi 2003). Hal tersebut sesuai dengan data salinitas yang ditampilkan pada Gambar 4 yang menunjukkan bahwa perairan yang posisinya semakin ke laut (muara), nilai salinitasnya semakin tinggi.
Gambar 4. Grafik
Berdasarkan grafik salinitas perairan tersebut dapat diketahui bahwa hulu Blankan memiliki salinitas paling kecil,
karena semakin ke arah hulu, salinitasnya akan tawar. Pada daerah tambak A, B, C, dan D masing psu, 7,0 psu dan 7,5 psu
dibanding tambak B dan D. Menurut Effendi 2003, akan semakin tinggi
dimana nilai salinitas tambak A dengan tambak C dan D (4
dengan hulu. Salinitas tertinggi terdapat pada daerah Muara Ciasem, Muara Blanakan, dan Muara Ga
sesuai dengan literatur yang menyebutkan bahwa perpaduan air laut yang lebih dominan
pengambilan sampel ini dilakukan tepat pada saat air pasang. Kondisi ini sesuai
bahwa kondisi perairan daerah estuari dipengaruhi oleh pengaruh dara
dan lautan. Salinitas tinggi terjadi saat pengaruh lautan lebih dominan dibandingkan pengaruh dari daratan, yaitu ketika terjadi pasang. Sedangkan nilai salinitas rendah dipengaruhi oleh pengaruh daratan, yaitu ketika air tawar masuk ke perairan melalui aliran sun
1,0
8,0
Grafik nilai salinitas (psu) di perairan lokasi penelitian
Berdasarkan grafik salinitas perairan tersebut dapat diketahui bahwa hulu emiliki salinitas paling kecil, yaitu sebesar 1psu. Hal tersebut wajar karena semakin ke arah hulu, salinitasnya akan semakin mendekati salinitas air tawar. Pada daerah tambak A, B, C, dan D masing-masing memiliki salinitas 8
psu. Tambak A dan C terletak lebih dekat ke arah laut (hilir) B dan D. Menurut Effendi 2003, nilai salinitas semakin ke tinggi nilainya. Hal ini sesuai dengan yang didapat di dimana nilai salinitas tambak A dan C lebih tinggi (8 psu dan 7,5
dengan tambak C dan D (4 psu dan 7 psu) yang letak tambaknya lebih dekat an hulu. Salinitas tertinggi terdapat pada daerah Muara Ciasem, Muara
Muara Gangga yaitu masing-masing sebesar 30 psu
teratur yang menyebutkan bahwa daerah muara memiliki perpaduan air laut yang lebih dominan dibandingkan dengan air tawar, selain itu pengambilan sampel ini dilakukan tepat pada saat air pasang.
Kondisi ini sesuai dengan yang dikemukakan oleh Nybakken (1992) bahwa kondisi perairan daerah estuari dipengaruhi oleh pengaruh dara
alinitas tinggi terjadi saat pengaruh lautan lebih dominan dibandingkan pengaruh dari daratan, yaitu ketika terjadi pasang. Sedangkan nilai salinitas rendah dipengaruhi oleh pengaruh daratan, yaitu ketika air tawar masuk ke perairan melalui aliran sungai. Hal inilah yang menyebabkan perairan muara
0
4,0 7,0
7,5
30,0 30,0 30
lokasi penelitian
Berdasarkan grafik salinitas perairan tersebut dapat diketahui bahwa hulu . Hal tersebut wajar semakin mendekati salinitas air sing memiliki salinitas 8,4 . Tambak A dan C terletak lebih dekat ke arah laut (hilir) as semakin ke laut . Hal ini sesuai dengan yang didapat di lapangan, 5 psu) dibanding ) yang letak tambaknya lebih dekat an hulu. Salinitas tertinggi terdapat pada daerah Muara Ciasem, Muara psu. Hal tersebut daerah muara memiliki dengan air tawar, selain itu
yang dikemukakan oleh Nybakken (1992) bahwa kondisi perairan daerah estuari dipengaruhi oleh pengaruh daratan (tawar) alinitas tinggi terjadi saat pengaruh lautan lebih dominan dibandingkan pengaruh dari daratan, yaitu ketika terjadi pasang. Sedangkan nilai salinitas rendah dipengaruhi oleh pengaruh daratan, yaitu ketika air tawar masuk gai. Hal inilah yang menyebabkan perairan muara
memiliki kisaran salinitas yang luas, sedangkan pada hulu Blanakan memiliki kisaran yang rendah.
4.2.3 pH
Derajat keasaman (pH) adalah suatu ukuran hidrogen dan menunjukan kondisi air. Deng
mengontrol tipe dan laju kecepatan reaksi beberapa bahan dalam perairan. Nilai pH suatu perairan memiliki ciri yang khusus
asam dan basa dalam air dan yang diukur
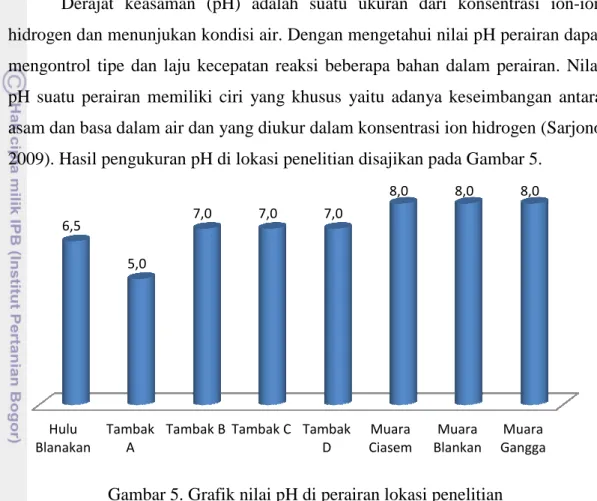
2009). Hasil pengukuran pH di lokasi penelitian disajikan pada Gambar 5.
Gambar
Berdasarkan hasil pengukuran nilai p menunjukan nilai pH
perairan muara, yaitu masing-masing sebesar
toksisitas logam berat di perairan ju
logam berat akan semakin meningkat seiring dengan meningk perairan. Hal ini karena
lebih banyak mengendap
air laut tidak bervariasi karena
capacity) dari sistem karbon dioksida dalam air tidak mudah berubah. Namun dem
perairan yang terus-Hulu Blanakan Tambak A 6,5 5,0
memiliki kisaran salinitas yang luas, sedangkan pada hulu Blanakan memiliki
Derajat keasaman (pH) adalah suatu ukuran dari konsentrasi ion gen dan menunjukan kondisi air. Dengan mengetahui nilai pH perairan dapat mengontrol tipe dan laju kecepatan reaksi beberapa bahan dalam perairan. Nilai iran memiliki ciri yang khusus yaitu adanya keseimbangan antara basa dalam air dan yang diukur dalam konsentrasi ion hidrogen (Sarjono Hasil pengukuran pH di lokasi penelitian disajikan pada Gambar 5.
Gambar 5. Grafik nilai pH di perairan lokasi penelitian
sarkan hasil pengukuran nilai pH perairan selama pengamatan n nilai pH berada pada kisaran 5-8. Nilai pH tertinggi terdapat pada
yaitu Muara Ciasem, Muara Blanakan, dan M
sebesar 8, sehingga perairan ini tergolong perairan basa. Tingkat toksisitas logam berat di perairan juga dapat dipengaruhi oleh pH. Toksisitas logam berat akan semakin meningkat seiring dengan meningk
perairan. Hal ini karena adanya logam yang sukar larut yang menyebabkan mengendap di dasar perairan (Sarjono 2009). Pada umumnya pH air laut tidak bervariasi karena adanya kapasitas penyangga
dari sistem karbon dioksida dalam air laut, hal ini berarti pH air laut tidak mudah berubah. Namun demikian apabila terjadi pembebanan pengotoran
-menerus, baik yang berasal dari limbah domestik Tambak B Tambak C Tambak
D Muara Ciasem Muara Blankan 7,0 7,0 7,0 8,0 8,0
memiliki kisaran salinitas yang luas, sedangkan pada hulu Blanakan memiliki
dari konsentrasi ion-ion an mengetahui nilai pH perairan dapat mengontrol tipe dan laju kecepatan reaksi beberapa bahan dalam perairan. Nilai adanya keseimbangan antara hidrogen (Sarjono Hasil pengukuran pH di lokasi penelitian disajikan pada Gambar 5.
lokasi penelitian
perairan selama pengamatan tertinggi terdapat pada ra Ciasem, Muara Blanakan, dan Muara Gangga, ini tergolong perairan basa. Tingkat ga dapat dipengaruhi oleh pH. Toksisitas logam berat akan semakin meningkat seiring dengan meningkatnya pH di yang menyebabkan logam Pada umumnya pH kapasitas penyangga (buffering berarti pH air laut pembebanan pengotoran limbah domestik maupun
Muara Gangga
industri, maka akan terjadi pula perubahan pH. Jika hal ini terjadi maka akan menimbulkan gangguan bagi biota laut (Nontji 1984 dalam Mulyawan 2005). Produktifitas perairan dapat dipengaruhi oleh pH, air yang bersifat basa dan netral cenderung lebih produktif dibanding dengan air yang bersifat asam.
4.2.4 Oksigen terlarut (DO)
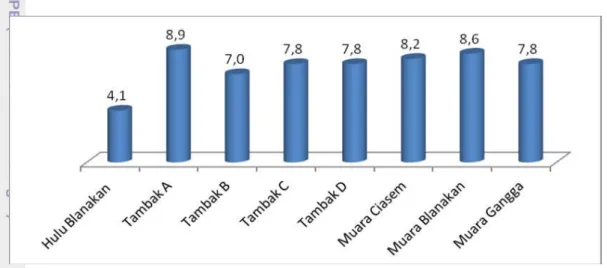
Oksigen terlarut merupakan salah satu parameter penting dalam analisis kualitas air. Oksigen terlarut dibutuhkan oleh seluruh jasad hidup untuk pernapasan, proses metabolisme atau pertukaran zat yang kemudian menghasilkan energi untuk pertumbuhan dan pembiakan (Salmin 2005). Hasil pengukuran oksigen terlarut di lokasi penelitian disajikan pada Gambar 6.
Gambar 6. Grafik kandunga DO (mg/L) di perairan lokasi penelitian
Berdasarkan hasil pengukuran nilai oksigen terlarut (DO) yang dilakukan di lapangan didapatkan nilai oksigen terlarut tertinggi terdapat pada daerah tambak A yaitu sebesar 8,9 mg/L. Nilai oksigen terendah terdapat pada daerah Hulu Blanakan yaitu sebesar 4,1 mg/L. Sedangkan kandungan oksigen terlarut pada stasiun pengamatan lainnya berkisar antara 7,0 mg/L hingga 8,6 mg/L . Hulu Blanakan memiliki nilai DO yang rendah disebabkan perairan tersebut dekat dengan perumahan penduduk dan sering menjadi tempat pembuangan limbah rumah tangga seperti limbah organik. Limbah rumah tanggga dapat menurunkan nilai DO perairan, karena mikroorganisme mempergunakan oksigen untuk mendegradasi organik tersebut (Nybakken 1982). Sungai Blanakan memiliki kedalaman yang lebih rendah dibanding perairan lainnya, sehingga suhu dari sinar matahari cepat masuk dan
mempengaruhi nilai DO sampel perairan. Stasiun pengamatan tambak A memiliki nilai DO yang tinggi dibandingkan dengan stasiun pengamatan lainnya. Hal tersebut diduga karena tambak A memiliki kepadatan pohon mangrove yang tinggi dibanding tambak B, C, dan tambak D. Sehingga pada saat masukan cahaya tinggi pada siang hari, akan terjadi proses fotosintesis yang tinggi pula (Effendi 2003).
Dalam suatu perairan seperti perairan pesisir, pasti memiliki nilai saturasi DO. Saturasi merupakan tingkat jenuh, dan saturasi DO merupakan tingkat terjenuh DO yang ada dalam suatu perairan. Umumnya saturasi oksigen dari hulu ke hilir perairan akan semakin. Muara memiliki DO yang cukup tinggi, disebabkan pada saat pasang terjadi pergerakan pengaduk-adukan air yang dapat meningkatkan nilai DO pada perairan tersebut. (Effendi 2003).
4.3 Logam Berat 4.3.1 Kadmium (Cd)
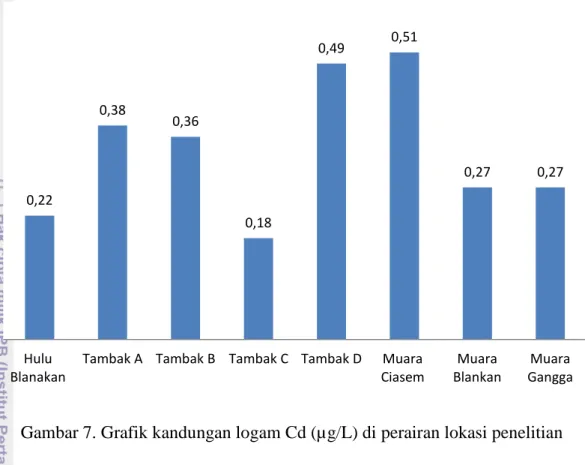
Hasil pengukuran Cd di perairan Blanakan menunjukkan bahwa kadar Cd rerata di perairan Blanakan relatif sama, yakni <1 µg/L. Perairan Hulu Blanakan memiliki nilai Cd sebesar 0,22 µg/L, pada daerah tambak A, B, C, dan D masing-masing sesuai urutan memiliki nilai sebesar 0,38 µg/L, 0,36 µg/L, 0,18 µg/L dan 0,49 µg/L. Daerah muara yaitu Muara Ciasem, Muara Blanakan dan Muara Gangga masing-masing memiliki nilai Cd sebesar 0,51 µg/L dan 0,27 µg/L. Berdasarkan baku mutu menurut KepMen LH No. 51 Tahun 2004, nilai Cd yang diperoleh dari 8 daerah pengambilan sampel tersebut belum melewati batas yang ditentukan yaitu sebesar 1 µg/L. Kandungan Cd tertinggi terdapat pada Muara Ciasem yaitu sebesar 0.51 µg/L, diikuti tambak D, tambak A, B, Muara Blanakan dan Muara Gangga, Hulu Blanakan dan yang terendah pada tambak C. Menurut Jaakola dkk. (1971) dalam Sanusi (1985), air laut yang belum tercemar mengandung 1-2 µg/L Cd. Sedangkan pada perairan laut yang tercemar antara 50-100 kali lebih besar. Secara ringkas, gambaran hasil pengukuran kandungan logam berat Cd di lokasi penelitian disajikan pada Gambar 7.
Gambar 7. Grafik kandungan logam Cd (µg/L) di perairan lokasi penelitian
Hart dan Davis (1981) dalam Anggraeny (2010) menyatakan bahwa Cd yang terdapat dalam air hampir 90 persen dalam bentuk terlarut, hanya sebagian kecil diabsorpsi oleh padatan tersuspensi atau partikel. Kadmium bersifat toksis terhadap hewan air disebabkan sifat logam berat tersebut yang mudah terikat pada gugus sulfhydri (-SH) protein tubuh hewan. Hal tersebut menyebabkan aglutinasi, aktivitas enzim terhambat, mengikat ligand fosfat, mengubah membran permeabilitas sel, bersifat anti metabolit terhadap Zn, merusak dan mereduksi sistem detoksifikasi mikrosomal dalam hati. Menurut Katz (1973) dalam Sanusi (1985), dikemukakan bahwa toksisitas Cd pada ikan dapat mengakibatkan terbentuknya lapisan mukus pada insang ikan. Hal itu menimbulkan gangguan terhadap respirasi dan sistem sirkulasi darah lewat insang.
Daerah Muara Ciasem memiliki nilai Cd yang tinggi karena daerah ini merupakan tempat perlintasan kapal-kapal penangkap ikan, dimana setiap kapal penangkap ikan tersebut akan melepaskan Cd yang berasal dari cat kapal (Syahminan 1996). Selain dari pada itu, pengambilan sampel ini dilakukan di saat pasang dimana sumber Cd dari laut lepas terbawa oleh arus laut. Dalam perairan sekalipun mengandung kadar Cd yang rendah, dapat menimbulkan tekanan fisiologis
0,22 0,38 0,36 0,18 0,49 0,51 0,27 0,27 Hulu
berat terhadap kehidupan tiram, yaitu melalui kerusakan sublethal terhadap efisiensi pemanfaatan makanan ( Sanusi 1985).
Berdasarkan hasil penelitian Widigdo & Pariwono (2000) (Lampiran 6) menunjukkan bahwa nilai logam berat Cd yang diperoleh pada penelitian ini jauh lebih rendah, dimana nilai logam berat Cd pada penelitian Widigdo & Pariwono (2000) berada pada kisaran nilai 3-36 µg/L, dengan nilai tertinggi terdapat pada daerah muara. Nilai logam berat tersebut berbeda dapat disebabkan karena perbedaan waktu pengambilan sampel yang memiliki rentang 10 tahun. Selain itu juga karena perairan Blanakan, khususnya daerah tambak, sudah banyak digalakkan dan disosialisasikan tentang pentingnya menanam mangrove pada tambak yang memiliki peran dalam mengasimilasi logam berat pada air (Gunawan & Anwar 2008). Berdasarkan hasil penelitian Gunawan & Anwar (2008) pada Lampiran 8 didapat nilai logam berat Cd < 4 µg/L yang diamati didaerah Ciasem pada tahun 2008. Nilai Cd di daerah Ciasem lebih tinggi disebabkan daerah Ciasem lebih dekat dengan jalur pantura, dimana terdapat banyak aktivitas transportasi kendaraan yang secara umum menjadi penyumbang logam Cd ke perairan.
Untuk kebutuhan budidaya udang, kandungan logam berat Cd yang diperbolehkan berada dalam perairan tambak adalah sebesar 0-10 µg/L (Prihatman 2000). Dalam badan perairan, kelarutan Cd dalam konsentrasi tertentu dapat membunuh biota perairan. Biota-biota yang tergolong kelompok udang-udangan akan mengalami kematian dalam selang waktu 96 jam bila di dalam badan perairan terlarut logam atau persenyawaan Cd pada rentang konsentrasi antara 5-150 µg/L. Untuk jenis biota laut seperti ikan akan mengalami kematian bila dalam badan perairan tersebut terkandung logam Cd pada rentang konsentrasi 22000-55000 µg/L (Lestari & Edward 2004).
4.3.2 Tembaga (Cu)
Berdasarkan Gambar 8 dapat diketahui bahwa nilai logam berat jenis Cu pada masing-masing stasiun pengamatan memiliki kadar < 8 µg/L. Pada daerah Hulu Blanakan memiliki nilai sebesar 2,21 µg/L, daerah Tambak A, B, C, dan D sesuai urutan sebesar 2,04 µg/L, 0,51 µg/L, 2,55 µg/L, dan 1,02 µg/L. Tiga daerah muara seperti Muara Ciasem, Muara Blanakan dan Muara Gangga masing-masing
sebesar 1,87 µg/L dan 2,89 µg/L. Dari kedelapan daerah tersebut, Muara Blanakan dan Muara Gangga memiliki kadar logam berat Cu paling tinggi dibandingkan dengan daerah lainnya. Nilai Cu yang diperoleh berdasarkan baku mutu KepMen LH Nomor 51 Tahun 2004 menunjukan bahwa nilai Cu pada kedelapan tempat belum melewati batas yang ditetapkan yaitu sebesar 8 µg/L, sehingga logam berat Cu belum begitu berbahaya bagi biota yang ada di perairan. Namun Cu termasuk kedalam kelompok logam esensial dimana dalam kadar yang rendah dibutuhkan oleh organisme sebagai Ko-enzim dalam proses metabolisme tubuh. Sifat racunnya baru muncul dalam kadar yang tinggi. Biota perairan sangat peka terhadap kelebihan Cu dalam badan perairan dimana ia hidup. Muara Gangga dan Muara Blanakan memiliki nilai Cu tertinggi dikarenakan perairan ini merupakan daerah tempat perlintasan kapal-kapal perikanan setiap waktu. Hal ini sesuai dengan pernyataan Mukhtasor (2007) bahwa logam berat Cu dipakai dalam pengawetan kayu dan cat antikarat pada lambung kapal.
Gambar 8. Grafik kandungan logam Cu (µg/L) di perairan lokasi penelitian
Jika dibandingkan dengan penelitian sebelumnya yang dilakukan oleh Widigdo & Pariwono (2000) pada daerah Subang, didapatkan nilai Cu yang sudah melewati batas baku mutu KepMen LH Nomor 51 Tahun 2004 yaitu sebesar 235 µg- 412 µg. Hal ini diduga karena pengambilan sampel pada penelitian Widigdo & Pariwono dilakukan pada tahun 2000, sehingga diduga terjadi pengendapan
2,21 2,04 0,51 2,55 1,02 1,87 2,89 2,89 Hulu Blanakan
Tambak A Tambak B Tambak C Tambak D Muara Ciasem
Muara Blankan
Muara Gangga
logam berat Cu ke dasar perairan. Selain itu, daerah pengambilan sampel penelitian yang dilakukan Widigdo & Pariwono (2000) lebih dekat dengan laut lepas, sehingga logam berat memiliki kecenderungan lebih cepat mengendap ke dasar laut, hal ini dikarenakan senyawa-senyawa logam Cu memiliki tingkat kelarutan yang relatif kecil dan kondisi perairan yang bersalinitas tinggi (Kadang 2005).
Untuk kebutuhan budidaya udang, kandungan logam berat Cu yang diperbolehkan berada dalam perairan adalah sebesar 0-20 µg/L (Prihatman 20000). Ikan sensitif terhadap logam Cu karena mempunyai penahan yang efektif pada proses absorpsi tembaga. Juga merupakan racun bagi algae dan moluska. Konsentrasi Cu sebesar 2.000 µg dapat membunuh ikan (Cannel 1974 dalam Syahminan 1996). Konsentrasi logam Cu sebesar 50 µg telah membahayakan lingkungan laut. Logam Cu dapat terakumulasi oleh organisme laut dengan faktor konsentrasi sebesar 5.000 kali besarnya dalam moluska dan seribu kali dalam ikan (Razak 1980 dalam Syahminan 1996). Konsentrasi Cu terlarut dalam air laut sebesar 10 µg dapat mengakibatkan kematian fitoplankton. Kematian tersebut disebabkan daya racun Cu telah menghambat aktivitas enzim dalam pembelahan sel fitoplankton. Jenis-jenis sumberdaya ikan yang termasuk dalam keluarga udang-udangan akan mengalami kematian dalam tenggang waktu 96 jam, bila konsentrasi Cu berada dalam kisaran 170-100.000 µg/L. Dalam tenggang waktu yang sama, biota yang tergolong ke dalam keluarga moluska akan mengalami kematian bila kadar Cu yang terlarut dalam badan perairan di mana biota tersebut hidup berkisar antara 160-500 µg/L, dan kadar Cu sebesar 2.500-3.000 µg/L dalam badan perairantelahdapat membunuh ikan-ikan (Lestari & Edward 2004).
Berdasarkan hasil penelitian (Lampiran 6) yang dilakukan oleh Widigdo & Pariwono (2000) menunjukan bahwa nilai logam berat Cu yang diperoleh jauh lebih tinggi dibanding dengan hasil data logam berat Cu yang diperoleh pada penelitian ini, dimana logam Cu memiliki rentang nilai dari 235-412 µg/L dengan nilai tertinggi terdapat pada daerah muara. Nilai logam berat tersebut berbeda bisa disebabkan karena selang tahun pengambilan sampel yang dilakukan yang memiliki rentang 10 tahun dimana logam berat tersebut mengalami pengendapan ke dasar laut.
4.3.3 Timbal (Pb)
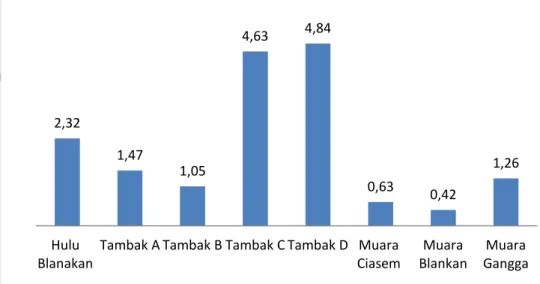
Berdasarkan Gambar 9 dapat diketahui nilai logam berat jenis Pb pada masing-masing stasiun pengamatan.
Gambar 9. Grafik kandungan logam Pb (µg/L) di perairan lokasi penelitian
Dari kedelapan stasiun pengamatan tambak D memiliki kadar logam berat timbal (Pb) paling tinggi dibandingkan dengan daerah lainnya. Kedelapan stasiun pengamatan tersebut memiliki kadar < 8 µg/L. Hal ini mengindikasikan bahwa masing-masing perairan tersebut belum tercemar oleh logam Pb sesuai dengan baku mutu KepMen LH No. 51 Tahun 2004. Berdasarkan data, Muara Blanakan dan Ciasem merupakan perairan dengan nilai logam berat Pb yang rendah. Hal ini sesuai dengan pustaka yang dikemukakan oleh Sudarmaji dkk. (2006) bahwa di dalam air laut kadar Pb lebih rendah dari pada air tawar. Walaupun di lapangan diketahui bahwa terdapat sebuah pabrik kilang minyak bumi di lepas pantai dimana minyak bumi ini merupakan salah satu sumber dari logam berat Pb. Menurut Millero & Sohn (1992) dalam Anggraeny (2010) timbal (Pb) merupakan jenis logam yang masuk ke perairan laut melalui atmosfer dan cepat menghilang dari perairan laut karena residence time-nya singkat dimana Pb memiliki residence timeselama 14 hari di perairan. Selain itu, Pb memiliki berat atom yang besar sehingga memiliki kemungkinan untuk mengendap ke sedimen lebih cepat.
Tambak C dan tambak D memiliki nilai Pb yang lebih tinggi. Jika dilihat dari kondisi lingkungannya tambak C dan D ditumbuhi oleh sedikit mangrove dibandingkan dengan tambak A dan B. Tambak yang memiliki sedikit mangrove,
2,32 1,47 1,05 4,63 4,84 0,63 0,42 1,26 Hulu Blanakan
Tambak A Tambak B Tambak C Tambak D Muara Ciasem
Muara Blankan
Muara Gangga
batuan maupun batuan pasir akan lebih mudah tergerus oleh air (laut dan darat) dan terbawa oleh air tambak baik saat pasang maupun surut dimana kadar Pb secara alami di dalam tanah sekitar 5.000-25.000 µg/kg (Sudarmaji dkk. 2006). Hal tersebut juga diperjelas oleh Gunawan dkk. (2007) yang mengatakan adanya fakta bahwa tambak empang parit yang masih mempertahankan mangrovenya mengandung bahan pencemar lebih rendah daripada tambak yang sudah tidak ada mangrovenya merupakan indikasi bahwa mangrove memiliki peranan yang penting dalam menjaga kualitas habitat perairan. Selain itu juga dengan adanya mangrove pada tambak akan berdampak pada meningkatnya keragaman makhluk hidup, yang mana makhluk hidup tersebut dapat menyerap logam berat (bioakumulasi), seperti pada tambak A & B. Unsur Pb cenderung mengalami bioakumulatif dalam tanaman dan tubuh hewan air. Senyawa ini dalam bentuk organik lebih beracun dibandingkan dalam bentuk anorganik.
Berdasarkan hasil penelitian (Lampiran 6) yang dilakukan oleh Widigdo & Pariwono (2000) menunjukan bahwa nilai logam berat Pb yang diperoleh jauh lebih tinggi dibanding dengan hasil data logam berat Pb yang diperoleh pada penelitian ini, dimana logam Pb memiliki rentang nilai dari 27-80 µg/L dengan nilai tertinggi terdapat pada daerah muara. Nilai logam berat tersebut berbeda dapat disebabkan karena selang tahun pengambilan sampel yang dilakukan yang memiliki rentang 10 tahun. Selain itu juga karena perairan Blanakan khususnya daerah tambak sudah banyak digalakkan dan disosialisasikan tentang pentingnya menanam mangrove pada tambak yang memiliki peran dalam mengasimilasi logam berat pada air (Gunawan & Anwar 2008). Selain itu juga penelitian terdahulu dilakukan di daerah laut dimana logam berat lebih cepat mengendap ke dasar perairan dan pengambilan logam berat Pb dilakukan hanya sekali sampling (spasial). Berdasarkan penelitian (Lampiran 8) yang dilakukan oleh Gunawan & Anwar (2008) di daerah tambak Ciasem didapat nilai logam berat Pb sebesar 562 µg/L, nilai Pb ini lebih besar ukurannya bila dibandingkan dengan parameter yang diamati lainnya. Hal ini diduga karena daerah tambak Ciasem lebih dekat dengan jalan raya (pantura) dan rumah penduduk, dimana jalan raya dan transportasi merupakan penyumbang Pb ke dalam perairan termasuk tambak.
Dari segi kebutuhan untuk budidaya udang/ikan, kandungan logam berat Pb yang diperbolehkan berada dalam perairan adalah sebesar 0-30 µg/L (Prihatman 2000). Berdasarkan penelitian Ghalib dkk.(2002) menyatakan bahwa keberadaan logam berat timbal sebanyak 50 µg/L terjadi laju penurunan konsumsi oksigen sebesar 0,0959 µl O2/mg berat basah/ jam pada perlakuan juvenil bandeng (Chanos chanos) sehingga akan mempengaruhi proses respirasi pada ikan yang dapat menyebabkan ikan lemas dan mati. Timbal dapat mempengaruhi kerja enzim-enzim atau fungsi protein, bahkan dapat menyebabkan kematian pada ikan dan organisme perairan lainya yaitu pada konsentrasi 50 µg/L (Hutagalung & Razak 1981 dalam Syahminan 1996). Pb bersifat toksis terhadap biota laut, kadar Pb sebesar 100 – 200 µg/L dapat menyebabkan keracunan pada jenis ikan tertentu dan pada kadar 188000 µg/L dapat membunuh ikan-ikan. Berdasarkan penelitian yang pernah dilakukan diketahui bahwa biota-biota perairan seperti krustakea akan mengalami kematian setelah 245 jam, bila pada badan perairan dimana biota itu berada terlarut Pb pada konsentrasi 2750-49000 µg/L (Lestari & Edward 2004).
4.4 Implikasi Pengelolaan
Berdasarkan hasil penelitian ini diketahui bahwa daerah Blanakan yang menjadi tempat pengambilan sampel belum terjadi indikasi pencemaran pada perairan baik itu pada tambak, sungai, maupun muara. Namun, logam berat Cd, Cu, dan Pb merupakan bahan inorganik yang bersifat tidak dapat diurai oleh makhluk hidup sehingga akan terakumulasi didalam tubuh biota dan juga manusia yang mengkonsumsinya.
Berdasarkan hasil penelitian logam berat (Lampiran 4) Cd, Cu, dan Pb oleh Napitu (2011) pada biota ikan dan udang di empat stasiun penelitian perairan Blanakan yang sama daerahnya yaitu tambak, hulu, dan muara didapatkan nilai Cu sebesar 18-381 µg/L dengan nilai terbesar terdapat pada udang di daerah muara. Nilai Cd berkisar dari 4-5 µg/L, dan nilai Pb memiliki rentang nilai 5-196,3 µg/L yang mana nilai tertinggi terdapat pada udang di daerah muara.
Dari data yang didapatkan oleh Napitu dan saya mengindikasikan bahwa nilai logam berat pada air lebih kecil dibandingkan pada biota,. Logam berat Cd, Cu, dan Pb merupakan logam berat yang bersifat non biodegradable sehingga
akan terus terakumulasi dalam tubuh yang mengkonsumsinya yang disebut proses bioakumulasi. Semakin tinggi tingkat tropic level-nya maka semakin banyak pula logam berat tersebut yang terakumulasi. Ini yang disebut prosesbiomagnification atau bioamplification. Sebagai gambaran bila kandungan pencemar non biodegradable dalam air 0,003 µg/L, maka di dalam plankton akan naik menjadi 40 µg/L, kemudian di dalam tubuh ikan-ikan kecil yang memakan plankton menjadi 500 µg/L, bila ikan-ikan kecil ini dimakan oleh ikan yang lebih besar maka kandungan pencemar dalam ikan besar ini menjadi 2000 µg/L. Kemudian bila ikan-ikan besar ini dimakan oleh burung elang maka kandungan bahan pencemar di dalam tubuh burung elang tersebut menjadi 25000 µg/L (Wardhana 1995 dalam Gunawan & Anwar 2008). Demikian juga sama halnya bila ikan tersebut dimakan oleh manusia, maka manusia yang menerima bahan pencemar tertinggi. Berdasarkan batasan dari Dirjen Perikanan Budidaya yang merujuk ke batasan dari Komisi Eropa, batasan maksimum residu yang dibolehkanMaximum Residual Limit (MRL) untuk jenis logam berat di dalam udang untuk Pb, dan Cd adalah 500 µg/L sedangkan pada ikan adalah berturut-turut untuk Pb, dan Cd adalah 200 µg/L, dan 50 µg/L (Putra dkk. 2008). Konsentrasi residu maksimum yang diizinkan bagi produk laut untuk kesehatan manusia adalah sebagai berikut, Pb 1500 µg/L dan Cd 200 µg/L, sedangkan Cu yang merupakan salah satu unsur essensial masing-masing adalah 10000 µg/L (FAO 1983 dalam Arifin 2011).
Salah satu upaya mengurangi dampak dari pencemaran tersebut adalah melalui mekanisme penyaringan alami oleh komponen biotik ekosistem, terutama vegetasi mangrove. Hasil penelitian Gunawan & Anwar (2008) membuktikan bahwa ekosistem mangrove mampu meredam pengaruh pencemaran perairan melalui proses asimilasi perairan. Hasil penelitian Gunawan dkk. (2007) menunjukkan bahwa pemanfaatan mangrove secara lestari melalui pola sylvofishery memberikan dampak ekologis yang baik. Bahkan dalam substrat tambak biasa mengandung bahan pencemar berbahaya merkuri 16 kali lebih besar dibandingkan substrat mangrove dan 14 kali lebih (Lampiran 5) besar dari tambak empang parit (sylvofishery). Meskipun demikian, saat ini ekosistem mangrove di lokasi tersebut banyak ditebang sehingga tidak mampu menjalankan mekanisme alaminya menyaring pencemaran air. Adanya fakta bahwa tambak empang parit
yang masih mempertahankan mangrovenya mengandung bahan pencemar lebih rendah daripada tambak yang sudah tidak ada mangrovenya merupakan indikasi bahwa mangrove memiliki peranan yang penting dalam menjaga kualitas habitat perairan. Hal ini seharusnya menjadi pembelajaran dan disebarluaskan kepada para petambak yang telah membabat mangrovenya agar mau menanaminya kembali.
Pemahaman juga diberikan, bahwa kualitas produk perikanan akan sangat menentukan harga jual di pasar. Oleh karena itu kualitas habitat perairan (dalam hal ini termasuk ekosistem mangrove) perlu dijaga kelestariannya. Dengan demikian produk perikanan dari Indonesia diharapkan dapat diterima pasar, baik dalam maupun luar negeri. Untuk memulihkan kembali fungsi ekologis dan mengoptimalkannya dengan fungsi ekonomis maka perlu dilakukan restorasi atau rehabilitasi tambak empang parit. Dalam kegiatan restorasi ini, tidak saja dengan menanami kembali kawasan hutan mangrove yang gundul tetapi juga mengembalikan disain empang parit yang telah banyak diubah. Dengan komposisi dan disain lanskap sylvofishery secara menyeluruh sehingga memenuhi perbandingan 80% mangrove dan 20% tambak secara merata, maka diharapkan fungsi ekologis dan ekonomis secara berangsur akan kembali optimal.