PENGARUH PERIODE SUBKULTUR
TERHADAP KADAR SAPONIN AKAR ADVENTIF TANAMAN GINSENG JAWA (Talinum paniculatum Gaertn.)
SKRIPSI
LINA IRONIKA
PROGRAM STUDI S-1 BIOLOGI DEPARTEMEN BIOLOGI
FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS AIRLANGGA
PENGARUH PERIODE SUBKULTUR
TERHADAP KADAR SAPONIN AKAR ADVENTIF TANAMAN GINSENG JAWA (Talinum paniculatum Gaertn.)
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Bidang Biologi
Pada Fakultas Sains dan Teknologi Universitas Airlangga Surabaya
Oleh :
LINA IRONIKA NIM. 080810090
Tanggal Lulus : 3 Agustus 2012
Disetujui oleh
Pembimbing I,
Dr.Y. Sri Wulan Manuhara, M.Si NIP. 19640303 198810 2 001
Pembimbing II,
LEMBAR PENGESAHAN SKRIPSI
Judul : Pengaruh Periode Subkultur Terhadap Kadar Saponin Akar Adventif Tanaman Ginseng jawa (Talinum paniculatum Gaertn.)
Penyusun : Lina Ironika NIM : 080810090
Pembimbing I : Dr.Y. Sri Wulan Manuhara, M.Si Pembimbing II : Dwi Kusuma Wahyuni, S.Si., M.Si Tanggal Ujian : 3 Agustus 2012
Disetujui oleh :
Pembimbing I,
Dr.Y. Sri Wulan Manuhara, M.Si NIP. 19640303 198810 2 001
Pembimbing II,
Dwi Kusuma Wahyuni, S.Si., M.Si NIP. 19770115 200604 2 002
Mengetahui,
Ketua Program Studi S-1 Biologi Departemen Biologi Fakultas Sains dan Teknologi
Universitas Airlangga
PEDOMAN PENGGUNAAN SKRIPSI
Skripsi ini tidak dipublikasikan, namun tersedia di perpustakaan dalam lingkungan, Universitas Airlangga, diperkenankan untuk dipakai sebagai referensi kepustakaan, tetapi pengutipan harus seizin penyusun dan harus menyebutkan sumbernya sesuai kebiasaan ilmiah.
KATA PENGANTAR
Dengan memanjatkan puji syukur kehadirat Allah Subhanallahu Wa Taala atas segala limpahan rahmat, karunia, dan hidayah-Nya, penyusun dapat menyelesaikan penyusunan skripsi yang berjudul “ Pengaruh Periode Subkultur Terhadap Kadar Saponin Akar Adventif Tanaman Ginseng jawa (Talinum paniculatum Gaertn.)”.
Skripsi ini disusun dengan tujuan untuk memenuhi salah satu syarat untuk memperoleh gelar Sarjana Sains (S.Si) pada Fakultas Sains dan Teknologi Universitas Airlangga.
Penulis menyadari bahwa dalam penyusunan skripsi ini masih jauh dari sempurna, hal ini mungkin terjadi baik sengaja maupun tidak sengaja mengingat segala keterbatasan yang ada dalam diri manusia. Oleh karena itu dengan segala kerendahan hati, izinkanlah penulis menyampaikan permohonan maaf jika terjadi sesuatu yang kurang berkenan.
Saran dan kritik membangun akan penulis harapkan dan terima demi kesempurnaan naskah selanjutnya. Penulis berharap penelitian yang telah dilakukan ini dapat memberikan informasi bagi perkembangan ilmu pengetahuan di masa mendatang.
Surabaya, Juli 2012
UCAPAN TERIMA KASIH
Kelancaran dan keberhasilan dalam penulisan skripsi ini merupakan ridha Yang Maha Kuasa, Allah Subhanahu wa Ta’ala melalui bantuan, dukungan dan doa dari berbagai pihak yang turut membantu. Oleh karena itu penulis ingin mengucapkan terima kasih kepada :
1. Kedua orang tua tercinta, bapak dan ibu, terima kasih atas segala pengorbanan yang selama ini kalian berikan hingga penulis dapat menjalani setiap ujian.
2. Dr. Y. Sri Wulan Manuhara, M.Si dan Dwi Kusuma Wahyuni, S.Si., M.Si selaku dosen pembimbing I dan II yang senantiasa mencurahkan segenap ilmu, waktu, dan tenaga untuk memberi arahan, bimbingan, serta masukan yang sangat berharga.
3. Dr. Edy Setiti Wida Utami, M.S selaku dosen penguji yang bersedia membagi ilmu dan saran-saran yang membangun.
4. Dr. Ni’matuzahroh selaku dosen wali yang telah banyak memberi nasehat, arahan, doa, dan bantuan dalam perkuliahan selama penulis berada di Fakultas Sains dan Teknologi Universitas Airlangga.
5. Prof. Dr. H. Fasich, Apt. sebagai rektor Universitas Airlangga dan jajaran pengurus kantor manajemen yang telah membantu penulis dalam menempuh pendidikan. Prof. Win Darmanto, M.Si., Ph.D sebagai dekan Fakultas Sains dan Teknologi, beserta para pengurus bidang kemahasiswaan yang memudahkan penulis dalam menjalani hari-hari di almamater tercinta.
6. Bapak dan ibu dosen yang tiada lelah membagi ilmu demi kebaikan penulis.
7. Pegawai dan laboran Departemen Biologi, Mas Joko, Pak. Warni, Pak. Sukadji, Bu. Ambar, Mas Eko, Pak. Sunar, Mbak Ari, Mbak Yatminah, Mas Catur, dan Mas Yanto, atas bantuan dan informasi yang diberikan kepada penulis.
8. Abiq yang telah membantu dan memberi masukan yang berharga demi kebaikan penulis.
9. Teman-temanku biologi 2008, Rivia, Dwi Putri, Izza, Aila, Indah, Muhimmatus, Liza, Rochma, Anita, Arista, dan semua himbionist’08 yang telah membagi keceriaan dan dukungan kepada penulis selama menjalani perkuliahan.
Lina Ironika, 2012, Pengaruh periode subkultur terhadap kadar saponin akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.), SKRIPSI, di bawah bimbingan Dr. Y. Sri Wulan Manuhara, M.Si., dan Dwi Kusuma Wahyuni S.Si, M.Si., Departemen Biologi, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya.
ABSTRAK
Penelitian ini bertujuan untuk mengetahui pengaruh periode subkultur terhadap berat kering dan kadar saponin akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.). Akar diinduksi dari daun di dalam media Murashige dan Skoog (MS) padat ditambah zat pengatur tumbuh IBA 2 mg/L. Akar adventif yang berumur 11 hari (± 2 cm) disubkultur dengan periode subkultur 2, 3, dan 4 minggu dalam media Murashige dan Skoog (MS) semisolid. Kultur dipelihara selama 10 minggu (70 hari) dan masing-masing perlakuan diulang 10x. Pengambilan data berupa berat segar, berat kering, dan kadar saponin dilakukan pada akhir periode subkultur. Analisis data berat kering menggunakan ANOVA satu arah dan dilanjutkan dengan Uji LSD (taraf signifikasi 5%). Kadar saponin dianalisis deskriptif menggunakan Kromatografi Lapis Tipis (KLT) dan Spektrofotometer UV-Vis. Hasil penelitian menunjukkan rerata berat kering paling tinggi didapatkan pada periode subkultur 4 minggu yaitu 0,0332 gram, luas noda paling tinggi didapatkan pada subkultur 2 minggu yaitu 47 mm2/0,1 g berat kering, dan kadar saponin paling tinggi yaitu 3235 mg/g didapatkan pada subkultur 4 minggu. Kesimpulan dari penelitian ini yaitu ada pengaruh periode subkultur terhadap berat kering dan kadar saponin akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.). Rerata berat kering paling tinggi didapatkan pada periode subkultur 4 minggu yaitu 0,0332 gram. sedangkan kadar saponin paling tinggi ditunjukkan dengan rerata luas noda paling besar pada plat KLT yaitu 47 mm2/0,1 g berat kering.
Kata kunci: akar adventif, saponin, subkultur, Talinum paniculatum Gaertn.
Lina Ironika, 2012, The effect of subculture cycle on saponin content adventitious roots of ginseng plants of java (Talinum paniculatum Gaertn.), This script is guided by Dr. Y. Sri Wulan Manuhara, M.Si., and Dwi Kusuma Wahyuni S.Si, M.Si., Departement of Biology, Fakulty of Science and Technology, Airlangga University, Surabaya.
ABSTRACT
The aims of this study were to determine the effect of subculture period on dry weight and saponin content in adventitious roots ginseng plant of java (Talinum paniculatum Gaertn.). Roots induced from leaves in solid Murashige and Skoog medium (MS) were added growth regulators IBA 2 mg / L. Adventitious roots that were 11 days (± 2 cm) were subjected to period of subculture 2, 3, and 4 weeks in semisolid Murashige and Skoog medium (MS). Cultures maintained for 10 weeks (70 days) and each treatment was repeated 10 times. Retrieval of data in the form of fresh weight, dry weight, and saponin content at the end of subculture period. The data of dry weight were analyzed using one-way ANOVA followed by LSD Test (significance of 5%). Saponin content was descriptive analyzed using Thin Layer Chromatography (TLC) and Spektrofotometer UV-Vis. The results of this study showed that highest average of dry weight obtained at 4-weeks subculture period was 0.0332 gram, the highest average of spot wide obtained at 2-weeks subculture period was 47 mm2 / 0.1 g dry weight, and the highest saponin content was 3235 mg/g obtained at 4-weeks subculture period. The conclusion of this study were there was the influence of subculture period on dry weight and saponin content in adventitious roots ginseng plant of java (Talinum paniculatum Gaertn.). Highest average dry weight obtained at 4-weeks subculture period was 0.0332 gram, while the highest saponin content indicated by the mean area of the spot on a TLC plate was 47 mm2 / 0.1 g dry
weight.
Keyword: adventitious roots, saponin, subculture, Talinum paniculatum Gaertn.
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
LEMBAR PERNYATAAN ... ii
LEMBAR PENGESAHAN ... iii
PEDOMAN PENGGUNAAN SKRIPSI ... iv
KATA PENGANTAR ... v
2.1 Tinjauan Tentang Ginseng jawa ... 11
2.1.1 Klasifikasi ... 11
2.1.2 Ciri morfologi ginseng jawa ... 11
2.1.3 Manfaat ginseng jawa ... 13
2.1.4 Kandungan kimia ginseng jawa ... 14
2.2 Tinjauan Tentang Kultur Jaringan Tanaman ... 15
2.2.1 Pengertian kultur jaringan tanaman ... 15
2.2.2 Manfaat kultur jaringan tanaman ... 17
2.2.3 Media kultur jaringan tanaman ... 18
2.2.4 Auksin ... 20
2.2.5 Subkultur jaringan tanaman ... 21
2.3 Tinjauan Tentang Saponin ... 22
BAB III METODE PENELITIAN ... 24
3.1 Waktu dan Tempat Penelitian ... 24
3.2 Bahan dan Alat Penelitian ... 24
3.2.1 Bahan penelitian ... 24
3.3 Rancangan Penelitian ... 25
3.4 Variabel Penelitian ... 26
3.5 Cara Kerja Penelitian ... 26
3.5.1 Induksi akar dari eksplan daun ... 26
3.5.2 Sterilisasi ruang kerja ... 26
3.5.3 Sterilisasi alat ... 27
3.5.4 Pembuatan larutan stok mikronutrien ... 27
3.5.5 Pembuatan larutan stok zat besi ... 28
3.5.6 Pembuatan larutan stok vitamin ... 28
3.5.7 Pembuatan larutan stok zat pengatur tumbuh ... 29
3.5.8 Pembuatan media kultur jaringan ... 29
3.5.9 Subkultur ... 30
3.6.0 Uji KLT (Kromatografi Lapis Tipis) ... 30
3.6.1 Ekstraksi saponin ... 31
3.7 Analisis Data ... 32
BAB IV HASIL DAN PEMBAHASAN ... 33
4.1 Hasil Penelitian ... 33
4.1.1 Pengaruh periode subkultur terhadap berat kering ... 33
4.1.2 Pengaruh periode subkultur terhadap kadar saponin ... 37
4.1.3 Analisis kadar saponin secara kuantitatif ... 41
4.2 Pembahasan ... 43
4.2.1 Pengaruh periode subkultur terhadap berat kering ... 43
4.2.2 Periode subkultur terhadap kadar (luas noda) saponin ... 46
4.2.3 Analisis kadar saponin secara kuantitatif ... 48
BAB V KESIMPULAN DAN SARAN ... 50
5.1 Kesimpulan ... 50
5.2 Saran ... 50
DAFTAR TABEL
Nomor Judul Halaman
4.1 Rerata berat segar dan berat kering akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.) pada berbagai periode subkultur ... 35 4.2 Rerata kadar (luas noda) saponin akar adventif tanaman ginseng jawa
(Talinum paniculatum Gaertn.) pada berbagai periode subkultur ... 40 4.3 Rerata berat kering dan kadar saponin pada berbagai periode subkultur
yang berbeda ... 42
DAFTAR GAMBAR
Nomor Judul Halaman
2.1 Daun ginseng jawa (Talinum paniculatum Gaertn.) ... 12 2.2 Bunga malai terminal tanaman ginseng jawa (Talinum
paniculatum Gaertn.) ... 12 2.3 Tanaman ginseng jawa (Talinum paniculatum Gaertn.)... 13 4.1 Akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.) ... 34 4.2 Rerata berat kering (gram) akar adventif tanaman ginseng jawa
(Talinum paniculatum Gaertn.) ... 37 4.3 Hasil ekstraksi saponin ... 38 4.4 Spot (noda) saponin akar adventif pada plat kromatografi lapis
tipis silica gel GF254 (Merck) ... 39
4.5 Rerata luas noda saponin akar adventif tanaman ginseng jawa
DAFTAR LAMPIRAN Nomor Judul Lampiran
1. Ringkasan
2. Komposisi Media Murashige dan Skoog (MS) 2. Uji Normalitas
3. Analisa Varians (ANAVA) 4. Tabel Hasil Pengamatan
5. Luas Noda Saponin dan Kurva Standar Saponin 6. Alat penelitian
BAB I PENDAHULUAN
1.1Latar Belakang
Di Indonesia dunia obat-obatan berkembang cukup pesat, terbukti dengan semakin banyaknya obat-obatan yang beredar di masyarakat. Beredarnya obat dengan merk dagang tertentu, menunjukkan kebutuhan masyarakat akan obat sangat tinggi, namun obat dengan merk impor atau dengan komponen impor harganya sulit dijangkau oleh masyarakat. Menyikapi hal tersebut, obat tradisional dipilih sebagai obat alternatif karena mudah didapat di alam, sehingga relatif murah dibanding obat impor. Selain itu, obat tradisional mempunyai efek samping yang sedikit atau bahkan tanpa efek samping. Hal tersebut memperbesar peluang untuk dikembangkan dan disosialisasikan (Hidayat, 2005).
2011). Di Indonesia, ginseng telah lama dikenal dengan nama Talinum yang termasuk Portulacaceae.
Tanaman ginseng jawa (Talinum paniculatum Gaertn.) merupakan tanaman yang telah dikenal oleh masyarakat Indonesia sebagai tanaman hias, tanaman obat, dan terkadang sebagai tanaman liar. Ginseng jawa (Talinum paniculatum Gaertn.) mempunyai bentuk akar yang menggembung seperti halnya ginseng cina (Panax sp.) (Wijayakusuma, 1994).
Umbi atau akar ginseng jawa mempunyai kandungan senyawa kimia yang berkhasiat bagi kesehatan manusia, di antaranya untuk menyembuhkan penyakit jantung dan insomnia (Rubatzky, 1998). Senyawa kimia yang terdapat dalam akar tanaman ginseng jawa (Talinum paniculatum Gaertn.) di antaranya adalah golongan terpenoid dan steroid yang berpotensi sebagai bahan pengganti ginseng korea (Panax sp.) yang masih diimpor dari Cina dan Korea (Sukardiman, 1996; Hidayat, 2005). Di Indonesia tanaman ginseng jawa (Talinum paniculatum Gaertn.) dipakai sebagai pengganti ginseng korea karena harganya relatif lebih murah, mudah diperoleh dan mudah dibudidayakan (Widiyani, 2006).
merupakan senyawa metabolit sekunder yang berasal dari bagian tanaman tertentu yang mampu menghambat pertumbuhan kanker kolon dan membantu kadar kolesterol menjadi normal (Arnelia, 2004).
Oleh karena kegunaan dan keampuhannya, ginseng telah banyak dipakai dalam pengobatan di klinik. Nugroho et al., (2005) telah melakukan penelitian tentang khasiat dan keamanan ginseng jawa dan diperoleh kesimpulan bahwa ginseng jawa aman berdasarkan uji toksisitas akut.
Budidaya tanaman ginseng jawa (Talinum paniculatum Gaertn.) relatif mudah, karena dapat dilakukan dengan cara generatif (biji), vegetatif (stek batang) dan dengan teknik kultur jaringan (Hendaryono & Wijayani, 1994). Tanaman yang berasal dari biji memiliki kelemahan yaitu hasil yang didapat memerlukan waktu yang relatif lama, dan mempunyai sifat yang tidak sama dengan induknya, sedangkan perbanyakan dengan stek, harus memangkas bagian dari tanaman yang cenderung berakibat menunda perolehan pucuk atau pertumbuhan cabang yang baru dan juga berdampak memutus siklus bunga, buah atau biji akibat pemotongan cabang atau ranting tanaman (Pitojo, 2006).
senyawa kimia dalam waktu yang relatif singkat. Hal ini didasari oleh sifat totipotensi sel tanaman (Fowler,1983). Teknik kultur jaringan penting untuk meningkatkan ketersediaan akar, mengingat kandungan senyawa saponin banyak terdapat di bagian akar.
Kultur jaringan tanaman merupakan teknik yang digunakan untuk menumbuhkan organ, jaringan, dan sel tanaman dalam kondisi aseptik dalam medium buatan (Wetter dan Constabel, 1991). Di dalam medium kultur jaringan harus terdapat unsur-unsur yang dibutuhkan untuk pertumbuhan jaringan tanaman yaitu garam organik dan zat-zat organik termasuk zat pengatur tumbuh. Zat pengatur tumbuh pada tanaman diperlukan sebagai komponen medium pertumbuhan dan differensiasi. Tanpa penambahan zat pengatur tumbuh dalam medium, pertumbuhan sangat terhambat bahkan mungkin tidak tumbuh sama sekali (Hendaryono dan Wijayani, 1994).
Kurz dan Constabel (1991), menyatakan bahwa kultur sel tanaman secara in vitro, dapat menghasilkan produksi metabolit sekunder terutama senyawa-senyawa obat lebih baik dibandingkan tanaman utuh. Kadar metabolit sekunder dapat ditingkatkan antara lain dengan penambahan zat pengatur tumbuh. Pengaruh pemberian zat pengatur tumbuh terhadap kadar metabolit sekunder memberikan hasil yang bervariasi di antaranya ditentukan oleh spesies tumbuhan yang dibudidayakan, serta jenis dan konsentrasi zat pengatur tumbuh yang ditambahkan.
flavonoid, saponin dan tanin yang dikandungnya. Salah satu penggunaan zat pengatur tumbuh tersebut, di antaranya adalah auksin. Syahid (2010) telah berhasil menumbuhkan kalus dengan diameter terbesar yaitu 28,7 mm dan kadar tannin lebih tinggi melalui kombinasi perlakuan 2,4-D 0,3 mg/l + Benzyl Adenin 0,1 mg/l.
Penambahan zat pengatur tumbuh auksin terutama IAA dan NAA pada akar dapat menyebabkan terhambatnya perpanjangan akar tetapi dapat meningkatkan jumlah akar (Abidin, 1983). Aina (2008) telah berhasil menginduksi akar dari hipokotil dan epikotil ginseng jawa (Talinum paniculatum Gaertn.) dengan mengkombinasikan zat pengatur tumbuh (Auksin dan BAP) pada media MS. Hasil yang paling baik diperoleh dari kombinasi NAA 2 mg/l dan BAP 0,25 mg/l. Fitriyah (2008) juga telah berhasil menginduksi akar menggunakan eksplan hipokotil ginseng jawa (Talinum paniculatum Gaertn.) dengan zat pengatur tumbuh auksin secara in vitro. Dari hasil penelitiannya diketahui bahwa zat pengatur tumbuh IBA pada konsentrasi 2 ppm merupakan zat pengatur tumbuh auksin yang sesuai untuk induksi akar eksplan hipokotil ginseng jawa (Talinum paniculatum Gaertn.).
coklat lama kelamaan pertumbuhannya akan terhenti (Hendaryono dan Wijayani, 1994). Selain nutrisi pertumbuhan organ khususnya pertumbuhan akar adventif diperlukan suplai oksigen yang baik (Abbas, 2011). Oleh karena itu diperlukan suatu teknik subkultur dalam memenuhi nutrisi dan oksigen yang diperlukan oleh jaringan tersebut untuk tumbuh.
Subkultur adalah usaha untuk mengganti media tanam kultur jaringan dengan media yang baru, sehingga kebutuhan nutrisi untuk pertumbuhan kalus atau protokormus dapat terpenuhi (Hendaryono dan Wijayani, 1994). Sub kultur bertujuan untuk memperbanyak bahan tanaman sehingga dapat digunakan untuk analisis kandungan kimia tertentu yang diinginkan (Syahid, 2010). Rijhwani, dan Shanks (1998) telah berhasil melakukan penelitian tentang efek dari siklus subkultur terhadap pertumbuhan dan produksi indol alkaloid pada akar rambut Catharanthus roseus. Dari hasil penelitiannya diketahui bahwa indeks pertumbuhan akar rambut terbaik yaitu 115 ± 2 didapatkan dari siklus subkultur setiap 2 minggu bila dibandingkan dengan subkultur 3 minggu dan 4 minggu. Hasil produksi tabersonin tertinggi didapatkan pada 2 minggu siklus subkultur.
abiotik) selama periode kultur dan faktor lainnya akan mempengaruhi sintesis metabolit sekunder.
Pada saat ini penelitian tentang pengaruh periode subkultur terhadap kadar saponin ginseng jawa (Talinum paniculatum Gaertn.) belum pernah dilakukan, sehingga perlu dilakukan penelitian untuk memberikan informasi tentang pengaruh periode subkultur yang terbaik untuk meningkatkan kadar saponin akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.).
1.2Rumusan Masalah
1. Apakah ada pengaruh periode subkultur terhadap berat kering akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.)?
2. Manakah periode subkultur terbaik untuk mendapatkan berat kering paling tinggi akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.)?
3. Apakah ada pengaruh periode subkultur terhadap kadar saponin akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.)?
1.3Asumsi Penelitian
Subkultur adalah usaha untuk mengganti media tanam kultur jaringan dengan media yang baru, sehingga kebutuhan nutrisi untuk pertumbuhan kalus atau protokormus dapat terpenuhi (Hendaryono dan Wijayani, 1994). Pertumbuhan organ khususnya pertumbuhan akar adventif diperlukan suplai oksigen yang baik (Abbas, 2011). Subkultur dengan periode yang singkat (periode 2 minggu) menunjukkan indeks pertumbuhan akar yang optimum (Rijhwani dan Shanks, 1998).
Semakin singkat periode subkultur maka kebutuhan nutrisi dan oksigen terpenuhi sehingga pertumbuhan akar dan biomassa akar semakin meningkat. Pertumbuhan akar dan biomassa meningkat maka produksi saponin yang dihasilkan juga akan semakin meningkat, sehingga dapat di asumsikan jika periode subkultur berpengaruh terhadap kadar saponin akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.) maka terdapat perbedaan kadar saponin akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.).
1.4Hipotesis Penelitian 1.4.1. Hipotesis Kerja
1.4.2. Hipotesis Statistik
H01: Tidak ada pengaruh periode subkultur terhadap berat kering akar
adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.).
Ha1: Ada pengaruh periode subkultur terhadap berat kering akar adventif
tanaman ginseng jawa (Talinum paniculatum Gaertn.).
1.5Tujuan Penelitian
1. Mengetahui pengaruh periode subkultur terhadap berat kering akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.).
2. Mengetahui periode subkultur terbaik untuk mendapatkan berat kering paling tinggi akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.).
3. Mengetahui pengaruh periode subkultur terhadap kadar saponin akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.).
1.6Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA 2.1. Tinjauan tentang Ginseng jawa
2.1.1. Klasifikasi
Kedudukan tanaman ginseng jawa dalam klasifikasi taksonomi menurut Simpson (2006) dan van Steenis (2002) adalah sebagai berikut:
Regnum : Plantae
Divisi : Magnoliophyta Classis : Magnoliopsida Ordo : Carryophyllales Familia : Portulacaceae Genus : Talinum
Species : Talinum paniculatum Gaertn. (Simpson, 2006 dan van Steenis, 2002).
2.1.2. Ciri morfologi ginseng jawa
Gambar 2.1 Daun ginseng jawa (Talinum paniculatum Gaertn.), skala = 2 cm.
Bunga terutama dalam malai yang terletak di terminal, berbunga banyak, cabang terujung bercabang lagi dengan cara menggarpu. Tangkai bunga langsing. Daun kelopak lepas, bunga berwarna ungu, berbentuk bulat telur, panjang benang sari 2 mm. Daun mahkota berjumlah 5, berbentuk oval atau bulat telur terbalik, memiliki panjang 3-4 mm, warna mahkota merah atau ungu. Benang sari mempunyai jumlah 5-15, kebanyakan 8-12. Tangkai putik bercabang 3 (Gambar 2.2).
Buah berbentuk bola, berwarna merah coklat, dinding terluar rontok. Di Jawa menjadi tanaman hias, kadang-kadang menjadi tanaman liar (van Steenis, 2002). Umbi mempunyai warna gelap, berakar tunggang dengan banyak cabang (Gambar 2.3) (Hidayat, 2005).
Gambar 2.3 Tanaman ginseng jawa (Talinum paniculatum Gaertn.), A. umbi akar, skala = 1 cm.
2.1.3. Manfaat ginseng jawa
Ginseng jawa (Talinum paniculatum Gaertn.) merupakan salah satu tanaman obat yang akarnya dipercaya berkhasiat sebagai afrodisiaka, tonikum (Sa’roni et al., 1999; Widowati et al., 1999). Akar dan daun ginseng jawa mengandung saponin dan flavonoid, serta tanin (Harmanto, 2007). Akar ginseng jawa (Talinum paniculatum Gaertn.) dapat meningkatkan vitalitas, mengurangi resiko terkena penyakit kanker, mengurangi kadar kolesterol, meningkatkan sistem kekebalan tubuh dari bakteri dan virus, dan dapat meningkatkan stamina tubuh (Cahyo, 2011).
Daun ginseng jawa (Talinum paniculatum Gaertn.) dapat dimanfaatkan sebagai obat bisul, dan pembengkakan (anti radang),
memperlancar Air Susu Ibu (ASI), sebagai lalapan dan sayur tumis (Hidayat, 2005), berkhasiat stomakik atau meningkatkan nafsu makan (Harmanto, 2007).
2.1.4. Kandungan kimia ginseng jawa
Manurut Kadarwati (2006), Ginseng mengandung dua bahan aktif, yakni fitokimia dan nutrien. Fitokimia berupa betasitosterol, kampestrol,
kariofilen, asam sinamik, escin, asam ferulik, asam fumarik, ginsenosides, kaempferol, asam oleanolik, asam panaxik, panaxin, saponin, stigmasterol, dan asam vanilik. Sedangkan nutrien yang dikandung yaitu adalah kalsium, serat, folat, zat besi, magnesium, mangan, fosfor, potasium, silikon, zinc, serta vitamin B1, B2, B3, B5, dan
C.
Kadarwati (2006) juga mengungkap beberapa hasil penelitian lainnya yang mengungkapkan beberapa hasil penelitian yang lainnya tentang kandungan ginseng. Di antaranya ialah asam askorbat (vitamin C) yang berfungsi membantu memelihara dan membentuk kolagen, serta
betakaroten (provitamin A) yang diperlukan tubuh untuk mempertahankan jaringan kulit ari agar selalu dalam keadaan sehat sehingga kulit menjadi lembut dan lembab.
Selain itu, ginseng juga mengandung vitamin B2 yang sangat penting
dunia. Selain itu, kandungan kimia yang paling penting dan dominan dalam ginseng adalah saponin dan glikosida. Glikosida pada akar ginseng dikenal sebagai ginsenosida. Akar ginseng juga mengandung 16 jenis ginsenosida, seperti minyak atsiri, panasena, resih, musilago, asam panax, fitosterol, hormon, vitamin B, karbohidrat, dan selulosa (Cahyo, 2011).
Ginseng jawa mengandung senyawa saponin, alkaloid, tannin, dan senyawa-senyawa tertentu lain yang secara fisiologis dapat melancarkan sirkulasi darah. Peningkatan sirkulasi darah tersebut akan memperbaiki aktivitas jaringan tubuh sehingga secara tidak langsung akan memperbaiki fungsi organ, sehingga dapat digunakan untuk meningkatkan stamina (Hidayat, 2005).
Kandungan kimia yang terdapat dalam akar ginseng jawa ini meliputi steroid, triterpenoid (Kalium 41,44 %, Natrium 10,03 %, Kalsium 2,21 %, Magnesium 5,50 % dan Besi 0,32 %,), tannin, saponin, dan minyak atsiri, sedangkan kandungan kimia yang terdapat pada daun ginseng jawa adalah saponin dan flavonoid, dan tannin (Hidayat, 2005).
2.2. Tinjauan kultur jaringan tanaman 2.2.1. Pengertian kultur jaringan tanaman
jaringan berarti membudidayakan suatu jaringan tanaman yang mempunyai sifat sama seperti induknya (Prakoeswa et al., 2009).
Kultur jaringan dan kultur in vitro secara harfiah memiliki pengertian yang berbeda. Kultur jaringan berarti jaringan yang dikulturkan (bukan sel, jaringan, atau organ) di dalam wadah gelas atau plastik yang transparan dan dalam kondisi yang aseptik. Meskipun demikian berdasarkan terminologi kultur jaringan dan kultur in vitro memiliki pengertian yang sama yaitu suatu metode untuk mengisolasi seperti protoplas, sel, jaringan, embrio, atau organ tanaman, kemudian menumbuhkan dalam kondisi aseptik dalam wadah yang transparan (botol gelas atau tabung reaksi) (Abbas, 2011).
Kultur jaringan tanaman merupakan usaha untuk menumbuhkan sel, jaringan, dan organ tanaman pada medium buatan secara aseptik dalam lingkungan yang terkendali (Roedyarto, 1997). Kultur jaringan berhubungan erat dengan teori totipotensi sel. Setiap sel yang hidup dari organisme sel banyak mempunyai kemungkinan untuk tumbuh dan berkembang bila tersedia lingkungan yang sesuai. Kegiatan kultur jaringan dilakukan untuk mendapatkan tanaman yang memiliki sifat-sifat unggul, eliminasi patogen, konservasi plasma nutfah, ekstraksi senyawa metabolit sekunder, dan perbanyakan klonal secara cepat yang sulit atau tidak mungkin dilakukan secara konvensional (Abbas, 2011).
dan polen, meningkatkan variabilitas genetik dengan cara induksi mutasi dan klon somatik, dan pembentukan kalus dari kultur sel untuk mempelajari pengaruh nutrien, vitamin, dan zat pengatur tumbuh terhadap pertumbuhan dan perkembangan sel (Abbas, 2011).
Jaringan dapat dikulturkan pada agar padat atau dalam medium hara cair. Jika ditanam dalam agar, jaringan akan membentuk kalus, yaitu massa atau sel-sel yang tidak tertata. Kultur agar juga merupakan teknik untuk meristem dan untuk mempelajari organogenesis. Sel yang berasal dari spesies tanaman apapun dapat dibiakkan atau dikulturkan secara aseptik pada medium hara. Kultur biasanya dimulai dengan menanamkan satu iris jaringan steril pada medium hara yang dipadatkan dengan agar. Dalam waktu 2-3 minggu akan terbentuk kalus. Kalus semacam ini dapat disubkulturkan dengan memindahkan potongan kecil pada medium agar (Wetter dan Constabel, 1991).
2.2.2. Manfaat kultur jaringan tanaman
Kultur jaringan juga mempunyai manfaat yang besar di bidang farmasi karena dari usaha itu dapat menghasilkan metabolit sekunder untuk upaya pembuatan obat-obatan, yaitu dengan memisahkan unsur-unsur yang terdapat di dalam kalus steroid dan terpenoid (Hendaryono dan Wijayani, 1994).
Kultur jaringan tanaman memiliki beberapa keuntungan antara lain, menghasilkan tanaman baru dalam jumlah banyak dalam waktu yang relatif cepat, hemat waktu dan hemat lahan, membentuk tanaman terbebas dari penyakit dan virus, tidak bergantung musim atau iklim, memudahkan dalam pengangkutan ekspor dan impor bibit lebih mudah, mengatasi kegagalan konvensional seperti inkompatibilitas, dan untuk koleksi plasmanutfah (Prakoeswa et al., 2009).
Melalui teknik kultur jaringan dapat dihasilkan produk metabolit sekunder yang merupakan bahan obat yang berguna dalam waktu yang lebih cepat jika dibandingkan dengan metode konvensional. Selain itu, hasil metabolit sekunder yang didapat lebih banyak dengan kualitas yang baik dan kadar metabolitnya dapat diperkirakan sesuai dengan komposisi media dan tidak tergantung pada kondisi lingkungan (Wetter dan Constabel, 1991).
2.2.3. Media kultur jaringan tanaman
kandungan hara atau hormon dan sangat tergantung pada komoditas dan sasaran produk yang akan dihasilkan. Selain itu, terdapat suatu teknik elisitasi yaitu penambahan komponen media sesuai sasaran, elisitor yang digunakan bisa elisitor organik seperti karbohidrat, protein, dan dapat pula elisitor anorganik, seperti penambahan unsur makro maupun unsur mikro. Pada umumnya, bahan media terdiri atas bahan padat untuk pembuatan terbatas penimbangan bahan sangat kecil jumlahnya, sangat sulit dilakukan, untuk praktisnya perlu dibuat larutan stok. Dengan demikian, setiap pembuatan media hanya mengambil volume tertentu dari larutan stok (Prakoeswa et al., 2009).
Keberhasilan dalam teknologi serta penggunaan metode in vitro terutama disebabkan pengetahuan yang lebih baik tentang kebutuhan hara sel dan jaringan yang dikulturkan. Hara terdiri dari komponen yang utama dan komponen tambahan. Komponen utama meliputi garam mineral, sumber karbon (gula), vitamin dan pengatur tumbuh. Komponen lain seperti senyawa nitrogen organik, berbagai asam organik, metabolit dan ekstrak tambahan tidak mutlak, tetapi dapat menguntungkan ketahanan sel dan perbanyakannya (Wetter dan Constabel, 1991).
Regional Laboratory untuk menumbuhkan jaringan kedelai juga berhasil digunakan dalam menumbuhkan sel dari bermacam-macam varietas jaringan tumbuhan. Umumnya kadar hara anorganiknya lebih rendah daripada dalam medium MS, suatu kondisi yang seringkali lebih baik bagi sel spesies tertentu. Baik medium MS maupun medium B5 tampaknya mengandung jumlah hara anorganik yang layak untuk memenuhi kebutuhan banyak jenis sel tanaman dalam kultur. Banyak sel tidak memerlukan tambahan senyawa organik seperti asam amino, kasein hidrolisat, ekstrak ragi atau air kelapa (Wetter dan Constabel, 1991). 2.2.4. Auksin
Istilah auksin (dari bahasa Yunani auxein, meningkatkan) pertama kali digunakan oleh Fritz Went, seorang mahasiswa pasca sarjana di negeri Belanda pada tahun 1926, yang menemukan bahwa suatu senyawa yang belum dapat dicirikan mungkin menyebabkan pembengkokan koleoptil zat ke arah cahaya. Senyawa yang ditemukan Went didapati cukup banyak di ujung koleoptil (Salisbury & Ross, 1995).
Auksin sangat berpengaruh terhadap ekspresi gen di berbagai jaringan dan menyebabkan perubahan fisiologi juga morfologi pada tanaman (Kimball, 2001). Auksin juga menyebabkan perpanjangan batang, internode, tropism, apikal dominan, absisi, dan perakaran. Dalam kultur jaringan auksin digunakan untuk pembelahan sel dan differensiasi akar. IBA dan NAA secara luas digunakan untuk perakaran dan interaksi antara sitokinin untuk proliferasi tunas (Abbas, 2011).
IBA dan IAA memiliki sifat kimia lebih stabil dan mobilitasnya di dalam tanaman rendah. Sifat-sifat inilah yang menyebabkan pemakaian IBA dan IAA dapat lebih berhasil karena sifat kimianya yang stabil dan pengaruhnya yang lebih lama (Hendaryono dan Wijayani, 1994).
Hormon IBA adalah salah satu hormon yang termasuk dalam kelompok auksin. Selain dipakai untuk merangsang perakaran, hormon IBA juga mempunyai manfaat yang lain seperti mempercepat perkecambahan, dan merangsang perkembangan buah (Kusumo, 1984). 2.2.4. Subkultur jaringan tanaman
volume media semula. Subkultur dianggap sudah selesai apabila kalus sudah tidak tampak perkembangannya lagi. Jika sudah tidak tampak tidak ada perkembangan, maka kalus dapat segera dipindahkan ke dalam media padat untuk menumbuhkan tunas dan akarnya sehingga membentuk planlet, ataupun diisolasi protoplasnya (Hendaryono dan Wijayani, 1994).
2.3. Tinjauan tentang Saponin
Saponin adalah suatu glikosida yang ada pada banyak macam tanaman (Nio, 1989). Glikosida merupakan metabolit sekunder yang banyak terdapat di alam, terdiri dari gugus gula yang berikatan dengan aglikon atau sapogenin (Prihatman, 2001).
BAB III
METODE PENELITIAN 3.1. Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Februari sampai bulan Juli 2012 di Laboratorium Fisiologi Tumbuhan Departemen Biologi Fakultas Sains dan Teknologi, Universitas Airlangga Surabaya.
3.2. Bahan dan Alat Penelitian 3.2.1. Bahan penelitian
A. Bahan tanaman
Bahan tanaman yang digunakan dalam penelitian ini adalah akar adventif ginseng jawa (Talinum paniculatum Gaertn.) dari hasil induksi akar menggunakan eksplan daun dengan zat pengatur tumbuh auksin IBA 2 ppm.
B. Bahan kimia
Bahan kimia yang digunakan dalam penelitian ini adalah bahan penyusun media Murashige dan Skoog (1962) yang meliputi stok makronutrien (NH4NO3, KNO3, CaCl2.7H2O, MgSO4.7H2O, dan KH2PO4),
3.2.2. Alat penelitian
Alat-alat yang digunakan dalam penelitian ini meliputi autoclave, Laminar Air Flow (LAF), oven, timbangan analitik, magnetic stirer, dan waterbath, botol kultur, pinset, scalpel, alat-alat dari gelas (erlenmeyer, cawan petri, gelas ukur, gelas beker labu ukur, corong), bunsen, spatula, sprayer, kompor listrik, mortar, mikropipet, plat Kromatografi Lapis Tipis silica gel GF254 (Merck), spektrofotometer UV-Vis, oven, transluminator
white light (UV) dan kamera
3.3. Rancangan Penelitian
3.4. Variabel Penelitian
Variabel penelitian yang digunakan dalam penelitian ini meliputi: 1. Variabel bebas terdiri dari periode subkultur (0, 2, 3, dan 4 minggu). 2. Variabel terikat terdiri dari berat segar akar, berat kering akar, dan kadar
saponin akar.
3. Variabel terkendali terdiri dari media MS, pH media, dan suhu.
3.5. Cara Kerja
3.5.1. Induksi akar dari eksplan daun
Eksplan daun tanaman ginseng jawa (Talinum paniculatum Gaertn.) dilakukan sterilisasi bertingkat dengan menggunakan larutan detergen selama 3 menit dan larutan klorox 10 % selama 4 menit kemudian dibilas dengan menggunakan akuades sebanyak tiga kali. Daun yang telah disterilisasi kemudian dipotong 1-2 cm dan ditanam dalam media MS padat yang mengandung zat pengatur tumbuh auksin IBA 2 ppm di dalam botol kultur selama 11 hari.
3.5.2. Sterilisasi ruang kerja
3.5.3. Sterilisasi alat
Sterilisasi alat dilakukan dengan menggunakan autoclave pada suhu 121oC, tekanan 1 atm selama 20 menit. Alat-alat yang disterilkan dengan
menggunakan autoclave adalah botol kultur, cawan petri, gelas ukur, erlenmeyer, pinset, dan scalpel. Sebelum disterilisasi, alat-alat yang akan digunakan dicuci terlebih dahulu. Untuk alat-alat pinset, scalpel, cawan petri setelah dicuci kemudian dikeringkan dan dibungkus dengan menggunakan kertas payung.
3.5.4. Pembuatan larutan stok mikronutrien (100 x konsentrasi)
3.5.5. Pembuatan larutan stok zat besi (40 x konsentrasi)
Untuk pembuatan larutan stok zat besi dengan volume 200 mL (40 kali konsentrasi), maka menimbang 1.492 mg/L Na2EDTA dan 1.112 mg/L
Fe2SO4. 7H2O ditimbang terlebih dahulu dengan menggunakan timbangan
analitik. Kemudian bahan-bahan tersebut dimasukkan ke dalam dua erlenmeyer berbeda berisi 75 mL akuades. Larutan Fe2SO4. 7H2O
dipanaskan sampai hampir mendidih, kemudian ditambahkan larutan Na2EDTA sedikit demi sedikit sambil diaduk hingga larutan tercampur dan
berwarna kuning. Larutan yang sudah jadi dibiarkan dingin pada suhu kamar, kemudian ditambahkan akuades sampai volumenya menjadi 200 mL. Larutan tersebut dimasukkan ke dalam botol, menutup dengan menggunakan aluminium foil dan diberi label: ZAT BESI MS 40X, 5 mL/L dan disimpan dalam lemari es.
3.5.6. Pembuatan larutan stok vitamin (50 x konsentrasi)
3.5.7. Pembuatan larutan stok zat pengatur tumbuh auksin IBA 1000 ppm (100 mg/100 mL)
Untuk pembuatan larutan stok zat pengatur tumbuh auksin IBA 1000 ppm yaitu dengan menimbang sebanyak 0,1 g, kemudian memasukkan ke dalam erlenmeyer 100 mL. Meneteskan larutan KOH 1N dan memanaskan sampai larut (jernih) sambil diaduk. Untuk mempercepat proses kelarutan maka ditambahkan akuades sebanyak 50 mL. Bila sudah larut kemudian ditambah dengan akuades sampai volumenya menjadi 100 mL. Memasukkan dalam botol dan menutup dengan aluminium foil dan disimpan dalam lemari es. Untuk membuat media MS dengan zat pengatur tumbuh IBA 2 ppm maka mengambil 2 mL/L
3.5.8. Pembuatan media kultur jaringan tanaman
terlalu basa ditambah beberapa tetes HCl. Setelah pH sesuai, ditambahkan akuades sampai volume 1000 mL dan 4 g agar-agar ke dalam erlenmeyer, kemudian dipanaskan (sambil diaduk) sampai agar-agar larut. Dalam keadaan masih cair, media dibagi ke dalam beberapa botol kultur. Ditutup rapat dengan aluminium foil. Media disterilkan dalam autoclave pada suhu 1210C, tekanan 1,2 atm selama 15 menit. Setelah tekanan pada autoclave
menunjukkan angka 0, media segera dikeluarkan dari autoclave (tidak boleh menunggu sampai dingin di dalam autoclave) dan disimpan di dalam ruang inkubator.
3.5.9. Subkultur
Akar adventif yang berumur 11 hari dengan panjang akar ± 2 cm disubkultur dengan cara mengambil daun beserta akar hasil induksi dan disubkultur pada cawan petri yang berisi media MS semi-solid (agar 0,4 %). Kemudian diinkubasi dan dilakukan subkultur dengan periode 2 minggu, 3 minggu, dan 4 minggu dalam kondisi gelap selama 10 minggu.
3.6.0. Uji KLT (Kromatografi Lapis Tipis)
Uji kromatografi lapis tipis dilakukan dengan cara menimbang 0,1 gram berat kering akar kemudian menggerus menggunakan mortar dan diberi 10 ml etanol 96 % selanjutnya dipanaskan selama 45 menit di dalam waterbath dengan suhu 800C, kemudian menotolkan sampel sebanyak 5 μL dengan
kandungan saponin di dalam sampel maka dibuat larutan standart dengan cara mengambil 0,1 gr saponin standart dan dilarutkan ke dalam 1 mL etanol 96 % kemudian dilakukan elusi dengan menggunakan plat KLT. 3.6.1. Ekstraksi saponin
Eksplan yang telah dipanen ditimbang berat basah, kemudian memasukkan ke dalam oven untuk menghilangkan kadar air akar pada suhu 500C selama 7 hari kemudian menimbang berat kering akar adventif. Untuk mengekstraksi saponin akar adventif yang telah didapatkan ditimbang 0,1 gram kemudian digerus dengan menggunakan mortar hingga menjadi serbuk dan diberi 10 mL etanol 96 % selanjutnya dipanaskan selama 45 menit di dalam waterbath dengan suhu 800C, kemudian diukur
absorbansinya dengan menggunakan spektrofotometer dengan panjang gelombang 365 nm (Stahl, 1985). Untuk mengetahui kandungan saponin yang didapatkan, maka terlebih dahulu dibuat kurva standar saponin dengan konsentrasi 2,5; 5; 7,5; 10 ppm dengan panjang gelombang 365 nm. Kurva standar yang diperoleh (Lampiran 5) menunjukkan hubungan antara nilai absorbansi dengan konsentrasi saponin, sehingga dapat diketahui kandungan saponin sampel dari nilai absorbansinya. Untuk mengetahui nilai saponin dalam mg/g (Suskendriyati et al., 2004)maka digunakan rumus:
S = Saponin di dalam sampel x fp Berat sampel
3.7.Analisis Data
Data yang diperoleh pada penelitian ini berupa berat kering dan kadar saponin. Berat kering dianalisis secara statistik dengan menggunakan uji parametrik menggunakan one way ANOVA dengan taraf signifikasi 5%. Cara pengambilan keputusan dari uji ANOVA satu arah adalah:
Jika F hitung > F tabel maka H0 ditolak dan H1 diterima.
Jika F hitung < F tabel maka H0 diterima dan H1 ditolak.
Selanjutnya dilakukan analisis Post Hoc Test dengan Uji LSD dengan taraf signifikasi 5 % untuk mengetahui perbedaan nyata antar variabel.
BAB IV
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
4.1.1. Pengaruh periode subkultur terhadap berat kering akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.).
Akar adventif berasal dari eksplan daun yang diinduksi dengan menggunakan media MS padat yang ditambahkan dengan zat pengatur tumbuh IBA 2 ppm. Setelah akar adventif mempunyai panjang ± 2 cm yaitu selama 11 hari kemudian eksplan daun dan juga akar dilakukan subkultur selama 10 minggu di dalam media MS semisolid. Penelitian ini terdapat 3 perlakuan yaitu periode subkultur 2 minggu, subkultur 3 minggu, dan subkultur 4 minggu dan kontrol yaitu tanpa dilakukan subkultur.
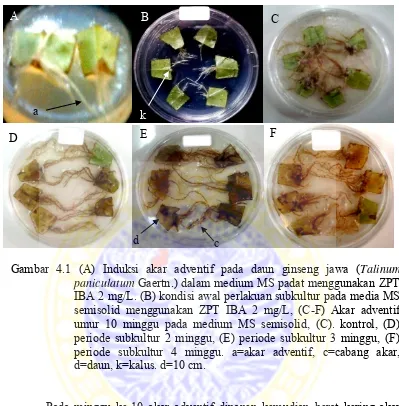
Gambar 4.1 (A) Induksi akar adventif pada daun ginseng jawa (Talinum paniculatum Gaertn.) dalam medium MS padat menggunakan ZPT IBA 2 mg/L. (B) kondisi awal perlakuan subkultur pada media MS semisolid menggunakan ZPT IBA 2 mg/L, (C-F) Akar adventif umur 10 minggu pada medium MS semisolid, (C). kontrol, (D) periode subkultur 2 minggu, (E) periode subkultur 3 minggu, (F) periode subkultur 4 minggu. a=akar adventif, c=cabang akar, d=daun, k=kalus. d=10 cm.
Pada minggu ke-10 akar adventif dipanen kemudian berat kering akar diukur dengan penimbangan akar yang telah dikeringkan dalam oven pada suhu 500C selama 7 hari sehingga didapatkan berat kering akar. Pada periode
subkultur 2 minggu didapatkan rerata berat segar akar 0,4298 gram, sedangkan pada perlakuan periode subkultur 3 minggu dan 4 minggu berturut-turut yaitu 0,3074 dan 0,4578 gram. Rerata berat segar pada kontrol relatif lebih tinggi bila dibandingkan dengan berat segar hasil dari perlakuan periode subkultur yaitu 0,4706 gram. Rerata berat kering akar pada perlakuan periode subkultur 2 minggu relatif lebih rendah bila dibandingkan dengan kontrol (tanpa subkultur)
a
d
k
c
B C
D E F
yaitu 0,0318 gram pada perlakuan dan 0,0319 gram pada kontrol. Hal ini terjadi juga pada periode subkultur 3 minggu yaitu 0,0251 gram. Sedangkan pada periode subkultur 4 minggu rerata berat kering yang dihasilkan bila dibandingkan dengan kontrol relatif lebih tinggi yaitu 0,0332 gram (Tabel 4.1).
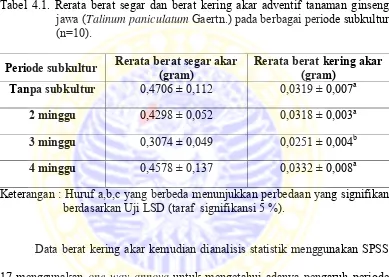
Tabel 4.1. Rerata berat segar dan berat kering akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.) pada berbagai periode subkultur (n=10).
Periode subkultur Rerata berat segar akar (gram) Rerata berat kering akar (gram) Tanpa subkultur 0,4706 ± 0,112 0,0319 ± 0,007a
2 minggu 0,4298 ± 0,052 0,0318 ± 0,003a 3 minggu 0,3074 ± 0,049 0,0251 ± 0,004b
4 minggu 0,4578 ± 0,137 0,0332 ± 0,008a
Keterangan : Huruf a,b,c yang berbeda menunjukkan perbedaan yang signifikan berdasarkan Uji LSD (taraf signifikansi 5 %).
Data berat kering akar kemudian dianalisis statistik menggunakan SPSS 17 menggunakan one way annova untuk mengetahui adanya pengaruh periode subkultur terhadap berat kering akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.). Dari analisis statistik diketahui bahwa perlakuan periode subkultur berpengaruh terhadap berat kering akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.). Hal ini ditunjukkan dengan nilai F hitung > F tabel yaitu 3.686 > 2,92 sehingga H0 ditolak dan H1 diterima. Hasil ini didukung
Data berat kering akar setelah dianalisis statistik menggunakan SPSS 17 diketahui bahwa data berdistribusi normal 0,639 (α > 0,05) namun setelah diuji test of homogenity of variances diketahui bahwa data tidak homogen 0,024 (α < 0,05) maka data dihomogenkan dengan cara transformasi (Dahlan, 2011) sehingga data menjadi homogen 0,111 (α > 0,05). Untuk mengetahui periode subkultur yang berbeda nyata dilakukan uji lanjutan (posthoc) menggunakan Uji LSD (Lampiran 3).
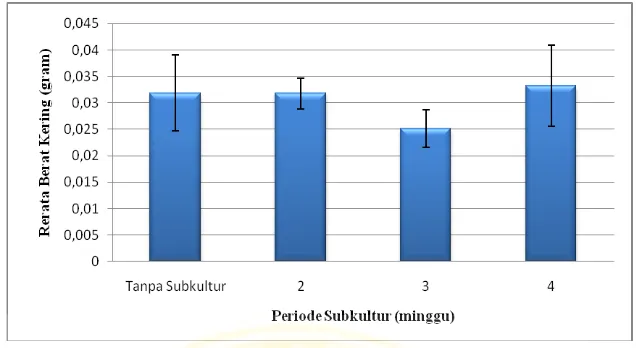
Hasil berbeda nyata diketahui dari taraf signifikansi α < 0,05 dan ditandai dengan tanda bintang (Lampiran 3). Dari lampiran 3 diketahui bahwa berat kering pada kontrol (tanpa subkultur) berbeda nyata dengan periode subkultur 3 minggu, namun tidak berbeda nyata pada subkultur 2 minggu dan 4 minggu. Pada subkultur 2 minggu berat kering berbeda nyata dengan periode subkultur 3 minggu dan tidak berbeda nyata pada kontrol dan subkultur 4 minggu .
Gambar 4.2. Rerata berat kering (gram) akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.) pada perlakuan periode subkultur yang berbeda.
Gambar 4.3 Hasil ekstraksi saponin menggunakan etanol 96%. (A) larutan standart saponin 100.000 mg/L, (B) tanpa subkultur, (C) perlakuan periode subkultur 2 minggu, (D) subkultur 3 minggu, (E) subkultur 4 minggu. skala 1 cm.
Dari gambar 4.3 dapat diketahui bahwa pada kontrol dan masing-masing perlakuan hasil ekstraksi menunjukkan warna yang berbeda. Pada kontrol warna yang dihasilkan adalah warna kuning terang sedangkan pada perlakuan subkultur 4 minggu menunjukkan warna kuning oranye yang relatif lebih tua bila dibandingkan dengan perlakuan subkultur 2 minggu dan 3 minggu. Pada perlakuan periode subkultur 2 minggu menghasilkan warna kuning yang relatif lebih tua bila dibandingkan dengan perlakuan subkultur 3 minggu. Warna yang dihasilkan menunjukkan adanya senyawa metabolit sekunder yang mampu terikat oleh etanol 96% pada proses ekstraksi.
Kadar saponin diketahui dari luas noda yang berwarna hijau pada plat KLT (Gambar 4.4). Berdasarkan gambar tersebut diketahui bahwa akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.) mempunyai kadar saponin yang berbeda-beda dari masing-masing perlakuan. Hal ini dibuktikan dengan perbedaan luas noda saponin pada plat KLT. Pada kontrol intensitas warna hijau pada noda tidak begitu terlihat jelas, sedangkan warna hijau pada noda yang
diberi perlakuan periode subkultur 2 minggu, 3 minggu, dan 4 minggu
mempunyai intensitas warna yang hampir sama (Gambar 4.4).
Gambar 4.4 Spot (noda) saponin akar adventif pada plat kromatografi lapis tipis silica gel GF254 menggunakan eluen isopropanol:air (14:3), (S)
saponin standart, (K) Tanpa subkultur, (A) Subkultur 2 minggu, (B) Subkultur 3 minggu, (C) Subkultur 4 minggu. Skala 1 cm. Dari gambar 4.1 diketahui bahwa saponin standart (Calbiochem) terdapat 2 jenis saponin. Hal ini dibuktikan dengan adanya 2 noda berwarna hijau. Sedangkan pada akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.) baik pada kontrol maupun pada perlakuan tidak hanya terdapat senyawa metabolit sekunder saponin, tetapi juga didapatkan beberapa senyawa metabolit sekunder yang lain. Hal ini dibuktikan dengan adanya warna biru-keunguan pada plat KLT yang telah disemprot menggunakan penampak noda anisaldehide-H2SO4 setelah dipanaskan selama 7-10 menit pada suhu 100-1100C (Gambar
4.4).
Rerata luas noda saponin relatif lebih tinggi pada perlakuan periode subkultur bila dibandingkan dengan kontrol. Pada periode subkultur 2 minggu
rerata luas noda saponin yang dihasilkan adalah 47 mm2/0,1 g berat kering,
sedangkan pada periode subkultur 3 minggu rerata luas noda saponin yang dihasilkan adalah 46 mm2/0,1 g berat kering dan pada periode subkultur 4
minggu rerata luas noda saponin adalah 28,5 mm2/0,1 g berat kering (Tabel 4.2).
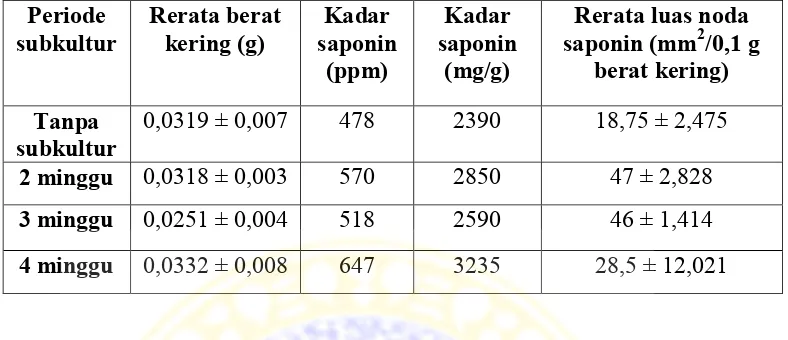
Tabel 4.2. Rerata kadar (luas noda) saponin akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.) pada berbagai periode subkultur (n=2).
Periode subkultur Rerata luas noda saponin (mm2/0,1 g berat kering )
Tanpa subkultur 18,75 ± 2,475
2 minggu 47 ± 2,828
3 minggu 46 ± 1,414b
4 minggu 28,5 ± 12,021
Periode subkultur 2 minggu mempunyai rerata luas noda saponin yang paling besar bila dibandingkan dengan periode subkultur 3 minggu dan 4 minggu yaitu 47 mm2/0,1 g berat kering. Pada perlakuan, rerata luas noda
saponin yang paling kecil dihasilkan oleh periode subkultur 4 minggu yaitu 28,5 mm2/0,1 g berat kering, namun bila dibandingkan dengan kontrol, pada
Gambar 4.5 Rerata luas noda saponin akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.) pada berbagai periode subkultur hasil analisis menggunakan kromatografi lapis tipis (KLT).
Periode subkultur berpengaruh terhadap kadar saponin akar adventif tanaman ginseng jawa (Talinum paniculatum gaertn.). Hal ini ditunjukkan dengan adanya perbedaan rerata kadar saponin pada berbagai perlakuan periode subkultur (Tabel 4.2). Untuk mengetahui periode subkultur terbaik didapatkan dari rerata luas noda saponin paling tinggi pada berbagai perlakuan periode subkultur.
4.1.3. Analisis kadar saponin secara kuantitatif menggunakan spektrofotometer UV-Vis.
Tabel 4.3. Rerata berat kering dan kadar saponin pada berbagai periode subkultur yang berbeda.
Periode
subkultur Rerata berat kering (g) saponin Kadar (ppm)
Dari tabel 4.3 diketahui bahwa kadar saponin yang paling tinggi terdapat pada periode subkultur 4 minggu 3235 mg/g, sedangkan kadar saponin paling rendah terdapat pada kontrol 2390 mg/g. Kadar saponin pada periode subkultur 2 minggu lebih tinggi bila dibandingkan dengan kadar saponin pada periode subkultur 3 minggu yaitu 2850 mg/g, sedangkan pada periode subkultur 3 minggu 2590 mg/g. Urutan kadar saponin dari yang terbesar hingga terkecil adalah 3235; 2850; 2590; 2390 mg/g.
4.2. Pembahasan
4.2.1. Pengaruh periode subkultur terhadap berat kering akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.).
Pada penelitian ini menggunakan eksplan daun tanaman ginseng jawa (Talinum paniculatum Gaertn.). Eksplan daun yang digunakan adalah daun yang masih muda karena masih belum kehilangan sifat embrionik atau meristematiknya. Penambahan zat pengatur tumbuh auksin IBA mampu menginduksi akar adventif dari eksplan daun pada tanaman ginseng jawa. Hal ini sesuai dengan hasil penelitian Fitriyah (2008) yang berhasil menginduksi akar menggunakan eksplan hipokotil ginseng jawa (Talinum paniculatum Gaertn.) dengan zat pengatur tumbuh IBA pada konsentrasi 2 ppm.
Zat pengatur tumbuh sangat diperlukan sebagai komponen media bagi pertumbuhan dan differensiasi kalus. Tanpa penambahan zat pengatur tumbuh dalam media, pertumbuhan akan terhambat bahkan mungkin tidak tumbuh sama sekali (Hendaryono dan Wijayani, 1994). Rostiana dan Seswita (2007) menyatakan bahwa auksin memicu terjadinya pembelahan sel, sehingga diperlukan untuk pembentukan akar. Menurut Wattimena (1992) auksin sintetik perlu ditambahkan karena auksin yang terbentuk secara alami sering tidak mencukupi untuk pertumbuhan jaringan eksplan.
Penelitian ini menunjukkan hasil bahwa periode subkultur berpengaruh terhadap berat kering akar adventif (Tabel 4.1) tanaman ginseng jawa (Talinum paniculatum Gaertn.). Hasil penelitian Rijhwani dan Shanks (1998) membuktikan bahwa periode subkultur berpengaruh terhadap berat kering akar
frekuensi subkultur dan jumlah inokulum berpengaruh terhadap berat kering dan kandungan artemisin pada Artemisia annua L. Berat kering tumbuhan merupakan parameter yang sering digunakan untuk menggambarkan dan mempelajari pertumbuhan tumbuhan karena mudah diukur dan merupakan integrasi dari hampir semua peristiwa yang dialami tumbuhan. Pengeringan dimaksudkan untuk menghilangkan semua kandungan air bahan dan menghentikan aktivitas metabolisme (Sitompul dan Guritno, 1995).
Dari tabel 4.1 diketahui bahwa rerata berat kering paling tinggi terdapat pada perlakuan periode subkultur 4 minggu bila dibandingkan dengan kontrol (tanpa subkultur). Hal ini menunjukkan bahwa nutrisi dan oksigen yang terdapat di dalam media mampu mendukung pertumbuhan optimal akar adventif tanaman ginseng jawa sampai 4 minggu, sehingga perlakuan subkultur berpengaruh dalam menyuplai nutrisi dan oksigen untuk pertumbuhan akar. Hal ini sesuai dengan penelitian Yann, et al., (2012) bahwa subkultur 4 minggu secara terus-menerus mampu meningkatkan biomassa kalus pada Artemisia annua L. Keng, et al., (2008) juga menyebutkan bahwa periode subkultur 4 minggu yang dilakukan hingga lima kali periode subkultur mampu meningkatkan biomassa kalus pada Melastoma malabathricum.
dikarenakan pada penelitian Rijhwani dan Shanks (1998) berat kering akar diukur mulai umur akar 0 hari hingga akar berumur 35 hari, dimana pertumbuhan akar rambut masih dalam fase eksponensial, sedangkan pada penelitian ini berat kering diukur pada umur akar 10 minggu (70 hari) sehingga pertumbuhan akar adventif sudah mencapai fase stasioner atau bahkan fase kematian. Abbas (2011) menyatakan kebutuhan hara untuk pertumbuhan optimal eksplan yang dikultur secara in vitro bervariasi di antara tiap-tiap spesies tanaman.
Pertambahan ukuran maupun berat kering tanaman mencerminkan bertambahnya protoplasma, yang terjadi karena bertambahnya ukuran dan jumlah sel (Khristyana et al., 2005). Menurut Lakitan (1996) berat kering tumbuhan menggambarkan akumulasi senyawa organik yang berhasil disintesis tumbuhan dari senyawa-senyawa anorganik terutama air dan CO2. Pertambahan
berat kering tumbuhan berasal dari unsur hara yang telah terserap oleh akar. Unsur hara ini digunakan dalam proses sintesis senyawa organik.
4.2.2. Pengaruh periode subkultur terhadap kadar (luas noda) saponin akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.). Saponin merupakan glikosida dari steroid atau triterpenoid, saponin dapat dideteksi sebagai spot (noda) berwarna hijau atau coklat ketika disemprot dengan menggunakan reagen anisaldehyde-asam sulfat (Itakura et al., 2001). Stahl, 1985 juga menjelaskan saponin ditandai dengan munculnya noda hijau setelah pelat KLT disemprot dengan reagen anisaldehid-asam sulfat dan diikuti dengan pemanasan 100-110 0C selama 7-10 menit.
Kromatografi lapis tipis mempunyai keuntungan memerlukan waktu yang singkat (15 - 60 menit), memerlukan jumlah cuplikan yang sangat sedikit (0,1 g), dan hasil palsu yang disebabkan oleh metabolit sekunder lain tidak mungkin terjadi (Stahl, 1985).
Kadar saponin dalam ekstrak etanol ginseng jawa dideteksi dengan membandingkan nilai Rf (retardation factor) noda yang terbentuk pada ekstrak etanol akar adventif ginseng jawa dengan larutan saponin standar (Calbiochem) dan warna noda setelah mendapat perlakuan pereaksi penampak noda anisaldehid-asam sulfat. Nilai Rf diperoleh dari perbandingan antara jarak titik pusat noda dari titik awal dengan jarak garis depan dari titik awal (Stahl, 1985). Menurut Yachya (2012) kedua zat dikatakan sama bila perbandingan fingerprint sampel dengan sebuah standar obat, jumlah, sekuen, posisi dan warna dari zona identik atau sama.
dari perlakuan periode subkultur 2 minggu dan terus menurun pada periode subkultur 3 minggu dan 4 minggu. Hal ini menunjukkan bahwa kadar saponin yang terdapat pada akar adventif tanaman ginseng jawa tidak tergantung laju pertumbuhan akar adventif.
Biomassa paling tinggi didapatkan dari perlakuan periode subkultur 4 minggu dan kadar saponin paling tinggi didapatkan dari perlakuan periode subkultur 2 minggu. Hal ini dikarenakan pada perlakuan periode subkultur 4 minggu akar adventif mampu tumbuh hingga mencapai fase eksponensial dimana terjadi pertumbuhan yang maksimal, sedangkan pada akar adventif yang diberi perlakuan periode subkultur 2 minggu laju pertumbuhan akar masih mencapai fase lag dimana masih terjadi fase adaptasi terhadap nutrisi dalam media yang baru sehingga tanaman dalam kondisi stres. Kondisi stres pada tanaman menyebabkan tanaman mengeluarkan metabolit sekunder berupa saponin, sehingga kadar saponin paling tinggi didapatkan pada perlakuan periode subkultur 2 minggu.
Penelitian ini sesuai dengan penelitian yang dilakukan oleh Rijhwani dan Shanks (1998) bahwa siklus subkultur berpengaruh terhadap pertumbuhan dan produksi indol alkaloid pada akar rambut tanaman Catharanthus roseus. Rijhwani dan Shanks (1998) menyatakan bahwa kandungan alkaloid lochnerine paling tinggi didapatkan dari siklus subkultur 2 minggu.
stasioner (fase dimana tidak ada lagi pertumbuhan). Pada fase stasioner pertumbuhan sel terhenti dan selama inilah terjadi produksi metabolit sekunder. Pada fase pertumbuhan (eksponensial) biosintesis metabolit sekunder amat lambat bahkan seringkali belum dimulai.
Menurut Bhojwani dan Razdan (1996), produksi metabolit sekunder umumnya terjadi pada akhir stasioner ketika persediaan nutrisi pada media menipis. Wattimena et al., (1992) menambahkan bahwa pigmen antosianin maksimum diproduksi pada saat fase stasioner.
4.2.3. Analisis kadar saponin secara kuantitatif menggunakan spektrofotometer UV-Vis.
Kadar saponin selain dianalisis secara semikuantitatif menggunakan kromatografi lapis tipis juga dilakukan secara kuantitatif menggunakan spektrofotometer UV-Vis pada λ = 365 nm.
senyawa saponin ditunjukkan dengan adanya noda berwarna hijau atau coklat (Itakura, 2001).
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Dari hasil penelitian pengaruh periode subkultur (2 minggu, 3 minggu, dan 4 minggu) terhadap kadar saponin akar adventif tanaman ginseng jawa (Talinum
paniculatum Gaertn.) dapat disimpulkan bahwa:
1. Periode subkultur berpengaruh terhadap berat kering akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.).
2. Periode subkultur terbaik untuk mendapatkan berat kering paling tinggi akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.) adalah periode subkultur 4 minggu yaitu 0,0332 gram.
3. Periode subkultur berpengaruh terhadap kadar saponin akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.).
4. Periode subkultur yang terbaik untuk meningkatkan kadar saponin akar adventif tanaman ginseng jawa (Talinum paniculatum Gaertn.) adalah periode subkultur 2 minggu yaitu 47 mm2 / 0,1 berat kering.
5.2. Saran
Daftar Pustaka
Abbas, B., 2011, Prinsip-prinsip teknik kultur jaringan, Penerbit Alfabeta, Bandung
Abidin, Z., 1983, Dasar-dasar pengetahuan tentang zat pengatur tumbuh, Penerbit Angkasa, Bandung
Aina, N., 2008, Induksi akar dari eksplan hipokotil dan epikotil tanaman ginseng Jawa (Talinum paniculatum Gaertn.) dengan zat pengatur tumbuh auksin dan BAP, Skripsi, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya
Arnelia, 2004, Fito-kimia Komponen Ajaib Cegah PJK, DM dan Kanker Puslitbang Gizi Bogor
Aslam, J., A. Mujib., S.A. Nasim, dan M.P. Sharma, 2009, Screening of vincristine yield in ex vitro and in vitro somatic embryo derived plantlets of Catharanthus roseus L. (G) Don. Scientia Horticulturae 119: 325-329 Bhad, M. A., S. Ahmad, A. Junaid, A Mujib, dan M. Dufan, 2008, Salinity stress
enchanced production of solasodine in Solanum ningrum L. Chem.
Dahlan, M.S., 2011, Statistik untuk Kedokteran dan Kesehatan Edisi 5, Penerbit Salemba Medika, Jakarta
Fitriyah, R., 2008, Induksi akar eksplan hipokotil ginseng jawa (Talinum paniculatum Gaertn.) dengan zat pengatur tumbuh auksin secara in vitro, skripsi, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya Fowler, M.W. (1983). Commercial application and economics aspects of plant
mass cell culture, Dalam Mathius, N.T., Reflini., H. Nurhaimi., J. Santoso., dan A.P. Roswiem., 2004, Kultur akar rambut Cinchona ledgeriana dan C. succirubra dalam kultur in vitro, Menara Perkebunan, 72(2), 72-87
Hendaryono, D.P.S., dan A. Wijayani., 1994, Teknik kultur jaringan, pengenalan dan petunjuk perbanyakan tanaman secara vegetatif modern, Kanisus, Yogyakarta
Hidayat, S., 2005, Ginseng multivitamin alami berkhasiat, Penebar Swadaya, Bogor
Itakura Y., M. Ichikawa., Y. Mori., R. Okino., M. Udayama dan T. Morita, 2001, How to Distinguish Garlic from the Other Allium Vegetables, Journal Nutrition 131: 963S-967S
Kadarwati, 2006, Pengaruh akar ginseng (wild ginseng) dalam ransum mencit (Mus musculus) terhadap jumlah anak dan pertumbuhan anak dari lahir sampai dengan sapih, skripsi, Program Studi Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor, Bogor
Keng, C.L., K.S. See., L.P. Hoon., dan B.P. Lim., 2008, Effect of Plant Growth Regulators and Subculture Frequency on Callus Culture and the Establishment of Melastoma malabathricum Cell Suspension Cultures for the Production of Pigments, Journal Biotechnology 7 (4): 678-685 Khristyana, L., E. Anggarwulan., Marsusi., 2005, Pertumbuhan, Kadar Saponin
dan Nitrogen Jaringan Tanaman Daun Sendok (Plantago major L.) pada Pemberian Asam Giberelat (GA3), Jurnal Biofarmasi 3 (1): 1693-2242.
Jurusan Biologi FMIPA UNS Surakarta
Komatsu, M., 1982, Studies on the Constituens of Talinum paniculatum Gaertener, Yakugaku. Zasshi. Vol.102 (5)
Kimball, J.W., 1983, Biologi, Penerbit Erlangga, Jakarta
Kurz, W.G.W., dan. F. Constabel., 1991, Produksi dan isolasi metabolit sekunder, Dalam Wetter, L.R dan F. Constabel (ed), Metode Kultur Jaringan Tanaman, Penerjemah: Widianto dan B. Mathilda, Penerbit ITB, Bandung
Kusumo, S., 1984, Zat Pengatur Tumbuh Tanaman, Penerbit CV. Yasaguna, Jakarta
Lakitan, B., 1996, Fisiologi Pertumbuhan dan Perkembangan Tanaman, Raja Grafindo Persada, Jakarta
Nio, O.K., 1989, Zat-zat Toksik yang Secara Alamiah Ada pada Bahan Makanan Nabati, Cermin Dunia Kedokteran 58: 24-30
Nugroho, Y.A., L. Widowati, Pudjiastuti, dan B. Nuratmi, 2005, Toksisitas Akut dan Khasiat Ekstrak Som Jawa (Talinum paniculatum Gaertn) sebagai stimulan, Jurnal Ilmu Kefarmasian Indonesia 3 (1): 17-20
Pitojo, S., 2006, Talesom, Sayuran Berkhasiat Obat. Penerbit Kanisus, Yogyakarta
Prakoeswa, S.A., Ribkahwati., dan D.R. Suryaningsih., 2009, Teknik Kultur Jaringan Tanaman; Implementasi Beserta Aplikasi, dan Hasil Penelitian, CV. Dian Prima Lestari, Sidoarjo
Prihatman, K., 2001, Saponin Untuk Pembasmi Hama, TTG BUDIDAYA PERIKANAN, Jakarta
Rahmawati, E.S., 1999, Variasi Kadar Kalium Dihidrogenafosfat dalam Medium MS Terhadap Sintesis Minyak Atsiri pada Tunas Hasil Kultur in vitro Daun Nilam Aceh (Pogostemon cablin), Skripsi, Fakultas Biologi UGM Yogyakarta
Rijhwani, S.K., and J.V. Shanks, 1998, Effect of subculture cycle on growth and indol alkaloid production by Catharanthus roseus hairy root cultures. Journal Enzyme and Microbial Technology 22: 606-611, 1998
Robinson, T, 1995, Kandungan Organik Tumbuhan Tinggi, Penerbit ITB, Bandung
Roedyarto, 1997, Budidaya Pisang Ambon. Trubus angrisarana, Surabaya
Rostiana, O, dan D. Seswita., 2007, Pengaruh indole butyric acid dan naphtalane acetic acid terhadap induksi perakaran tunas Piretrum [Chrysanthemum cinerariifolium (Trevir.) Vis.] Klon Prau 6 secara in vitro. Buletin Littro. vol. XVII No. 1: 39-48.
Rubatzky, V.E., 1998, Sayuran Dunia: Prinsip, Produksi dan Gizi Edisi kedua, ITB press, Bandung
Salisbury, F., Dan Ros C.W., 1995, Fisiologi tumbuhan jilid 3, ITB, Bandung Sa’roni, N.Y., dan Adjirni, 1999, Pengaruh infus akar som jawa (Talinum