Soal Latihan
UJIAN NASIONAL
TAHUN PELAJARAN 2011/2012
Disusun Sesuai Indikator Kisi-Kisi SKL UN 2012
Kimia SMA
Written by :
Team MKKS Jakarta
PEMERINTAH PROVINSI DAERAH KHUSUS IBUKOTA JAKARTA
DINAS PENDIDIKAN
MUSYAWARAH KERJA KEPALA SEKOLAH SMA
Sekretariat : SMA Negeri 70 Jakarta
Jalan Bulungan No. 1C, Jakarta Selatan - Telepon (021) 7222667, Fax (021) 7221343
PEMBAHASAN
TRY OUT UJIAN NASIONAL
Mata Pelajaran :
KIMIA
Program Studi : Ilmu Pengetahuan Alam [IPA]
Hari / Tanggal : Selasa, 13 Maret 2012
Waktu : 10.00 – 12.00 WIB
Petunjuk Umum
1. Isikan identitas Anda ke dalam Lembar Jawaban Try Out Ujian Nasional (LJTOUN) yang tersedia dengan menggunakan pensil 2B.
2. Tersedia waktu 120 menit untuk mengerjakan paket TO UN ini.
3. Jumlah soal 40 (empat puluh) butir, pada setiap butir terdapat 5 (lima) pilihan jawaban. 4. Periksa dan bacalah soal-soal sebelum Anda menjawabnya.
5. Laporkan kepada Pengawas Try Out apabila terdapat soal yang kurang jelas, rusak, atau tidak lengkap. 6. Tidak diizinkan menggunakan kalkulator, HP, tabel matematika, atau alat bantu hitung lainya.
7. Periksa pekerjaan Anda sebelum diserahkan kepada Pengawas Try Out. 8. Lembar soal boleh dicoret-coret untuk mengerjakan perhitungan.
Pilihlah satu jawaban yang menurut Anda paling tepat!
1. Atom magnesium (Mg) memiliki nomor atom 12 dan nomor massa 24. Dalam ion Mg2+ terdapat … A. 12 proton, 12 elektron, 12 neutron
B. 12 proton, 10 elektron, 12 neutron C. 12 proton, 14 elektron, 12 neutron D. 10 proton, 12 elektron, 12 neutron E. 14 proton, 12 elektron, 12 neutron
Jawab : B Pembahasan :
2. Jika diketahui nomor atom H=1, Be= 4, B=5, C= 6, N=7, O= 8, Cl=17, pasangan yang tepat antara rumus molekul, bentuk molekul dan jenis kepolaran ikatannya adalah… .
Rumus Molekul
Bentuk Molekul
Jenis Kepolaran
A
BCl3
Trigonal Planar
Non polar
B
NH3
Segitiga Sama Sisi
Polar
C
H2O
Linier
Polar
D
BeCl2
Bentuk V
Non polar
E
CCl4
Tetra Hedral
Polar
Jawab :
Pembahasan : A
BCl3 , atom pusatnya B , konfigurasi elektron B = 2, 3 . PEI = 3 ( dari rumus kimianya) , PEB = 0,
segitiga datar / trigonal planar ( non polar, tdk ada PEB ) NH3 , atom pusatnya N, konfigurasi electron = 2, 5.
PEI = 3, PEB = electron valensi - PEB /2 =( 5-3)/2 = 1
Piramida trigonal, bersifat polar ( ada PEB ) dst
3. Suatu unsur memiliki konfigurasi elektron (Ar) 3d5 4s1. Unsur tersebut dalam sistem periodik terletak pada ….
A. golongan I A, periode 4 B. golongan I B, periode 4
C. golongan IV B, periode 4 D. golongan VI A, periode 4 E. golongan VI B, perode 4
Jawab : E Pembahasan :
4. Etanol (C2H5OH) dan eter (CH3OCH3) mempunyai Mr yang sama. Meskipun demikian eter lebih mudah menguap dibandingkan etanol. Pernyataan yang sesuai dari informasi tersebut adalah….
A. Etanol polar dan eter non polar B. Eter lebih ringan dari pada etanol
C. Eter lebih sukar larut dalam air dibandingkan etanol D. Eter memiliki ikatan hidrogen sedangkan etanol tidak E. Dalam etanol terdapat ikatan hydrogen
Jawab : E
Ikatan hydrogen menyebabkan titik didih lebih tinggi dan lebih sukar menguap, Etanol memiliki atom H yang terikat pada atom O ( - OH )
5. Perbandingan massa besi dan belerang dalam FeS adalah 7 : 4, bila terdapat data sebagai berikut:
No Percobaan Massa Besi (gram)
Massa Belerang (gram)
Massa Sisa (gram)
1 14 A 0
2 B 22 2
3 32 16 C
Maka massa A, B dan C berturut-turut yang benar adalah… gram
A. 4 ; 21 dan 4 B. 8 ; 35 dan 4 C. 8 ; 28 dan 4 D. 10 ; 35 dan 4 E. 10 ; 28 dan 4
Jawab : B
Pembahasan : Massa Fe : S = 7 : 4
6. Diantara persamaan reaksi berikut yang sudah setara adalah …. A. C( s) + O2 (g) ─> 2CO( g )
B. 4 Al ( s ) + 2 O2 (g) ─> 2Al2O3 ( s) C. 2 Na( s ) + O2 (g) ─> Na 2O( g )
D. 4 NH3 ( g ) + 5O2 (g) ─> 4NO( g ) +6H 2O( g ) E. Al2O3 ( s) + H2SO4 (l ) ─> Al2 (SO4)3 ( aq) + H2O(l)
Jawab : D
7. Perhatikan gambar pengujian daya hantar beberapa larutan berikut ini!
Larutan yang bersifat elektrolit kuat dan elektrolit lemah berturut-turut adalah .... A. 1 dan 2
B. 1 dan 3 C. 1 dan 4 D. 2 dan 3 E. 2 dan 5
Jawab : C ( jelas )
8. Dari hasil pengujian terhadap sampel air limbah A dan B dengan beberapa indikator asam-basa, diperoleh data sebagai berikut:
Indikator Trayek pH Perubahan Warna Warna Larutan Sampel A Sampel B Metil Merah 4,2 – 6,3 Merah - kuning Kuning Kuning
Brom Tymol Biru 6.0 – 7,6 Kuning - Biru Biru Biru
Phenolphtalein 8,3 – 10,0 Tidak berwarna - Merah Tidak berwarna Merah
Harga pH untuk sampel A dan B berturut-turut adalah …
A. ≤ 6,3 dan 7,6 ≤ pH ≤ 8,3 B. ≥ 10,0 dan 7,6 ≤ pH ≤ 8,3
C. ≤ 10,0 dan 7,6 ≤ pH ≤ 8,3 D. 7,6 ≤ pH ≤ 8,3 dan ≥ 10,0 E. 7,6 ≤ pH ≤ 8,3 dan ≤ 10,0
Pembahasan :
Sample A : MM = 6,3 --- >
BTB = 7,6 ---- --- --- >
PP = < ---8,3
A = 7,6 ≤pH ≤ 8,3
Sample B : MM = 6,3 --- >
BTB = 7,6 --- >
PP = 10 --->
B = pH≥ 10
9. Sebanyak 10 mL larutan asam lemah HA 0,1 M ditambah air sehingga volumenya menjadi 1000 mL. Jika Ka = 1 x 10-5, pH larutan berubah dari….
A. 1 menjadi 3 B. 1 menjadi 4 C. 3 menjadi 4 D. 3 menjadi 5 E. 3 menjadi 8
Jawab : C
Pembahasan :
Hitung konsentrasi hasil pengenceran : V1 x M1 = V2 x M2
10 mL x 0,1 M = 1000 mL x M2 M2 = 0,001 M = 1 x 10-3 M Maka
Sebelum diencerkan
10. Sekelompok siswa melakukan percobaan untuk menentukan molaritas larutan HCl yang tulisan pada label botolnya kurang jelas, dengan cara titrasi. Titrasi dilakukan dengan menggunakan larutan standar NaOH 0,10 M sampai terbentuk warna merah muda dengan indikator fenolftalein. Dari titrasi tersebut diperoleh data sebagai berikut :
Percobaan Volume larutan HCl (mL) Volume larutan NaOH (mL)
1 20 8,5
3 20 8,6
4 20 8,5
Konsentrasi larutan HCl yang tertulis pada label botol tersebut adalah .... A. 0,0425 M
B. 0,043M C. 0,100 M D. 0,170 M E. 0,172 M
Jawab : B
Volume NaOH rata-rata yg terpakai = 8,533 mL
Maka ketika tercapai titik ekivalen mol H+ = mol OH -Valensi x Va x Ma = -Valensi x Vb x Mb
1 x 20 x Ma = 1 x 8,533 x 0,1
Ma = 0,8533/20 M = 0,0426 M
11. Sekelompok siswa melakukan percobaan terhadap larutan dengan data hasil percobaan sebagai berikut:
No Penambahan larutan pH larutan 0,1 M
Larutan mula-mula A B C D E
1 pH mula-mula 7,25 5,02 1,50 9,01 13,30
2 Di tambah sedikit HCl 2,55 4,98 1,50 8,99 10,75 3 Di tambah sedikit NaOH 12,35 5,05 3,35 9,02 13,55
4 Di tambah air 7,25 5,02 1,50 9,01 12,50
Dari data tersebut yang terrmasuk larutan yang bersifat buffer (penyangga) adalah... A. A dan B
B. A dan C C. B dan D D. B dan E E. D dan E
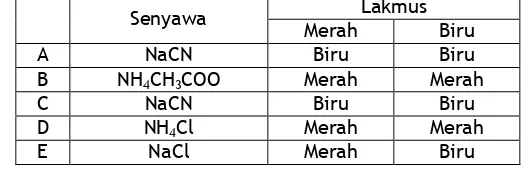
12. Data yang menunjukkan garam terhidrolisis parsial dan bersifat asam adalah...
Senyawa Lakmus
Merah Biru
A NH4CN Biru Biru
B CH3COO NH4 Merah Merah
C NaCN Biru Biru
D NH4Cl Merah Merah
E NaCl Merah Biru
Jawab : D
13. Dalam 4 wadah terdapat masing-masing 100 mL larutan Ba2+, Pb2+, Ni2+, dan Sr2+ yang konsentrasinya 1 x 10-4 M. Ke dalam masing-masing wadah tersebut ditambahkan 100 mL H2C2O4 1 x 10-4 M. Jika Ksp BaC2O4 = 2,3 x 10-8; NiC2O4 = 4 x 10-10; PbC2O4 = 4,8 x 10-10; SrC2O4 = 1,6 x 10-7; senyawa yang mengendap adalah…. A. BaC2O4 dan SrC2O4
B. BaC2O4 dan PbC2O4 C. NiC2O4 dan PbC2O4 D. NiC2O4 dan SrC2O4 E. SrC2O4 dan PbC2O4
Jawab : C
Pembahasan :
Karena volume dan konsentrasi ion yang ditambahkan sama , volume serta konsentrasi ion oksalat sama , tipe perkalian Ksp ( tipt 1,1 ) maka untuk menentukan yang paling mudah mengendap adalah
yang memiliki Ksp terkecil. Yaitu NiC2O4 dan PbC2O4
14. Fraksi mol larutan urea dalam air adalah 0,2. Tekanan uap jenuh air pada suhu 20oC adalah 17,5 mmHg. Maka penurunan tekanan uap larutan adalah….mmHg
A. 3,5 B. 14 C. 17,5 D. 17,7 E. 21
Jawab : A
Pembahasan :
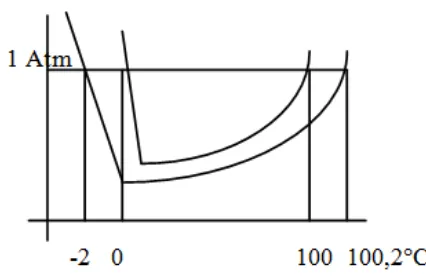
15. Dari diagram P-T H2O berikut, garis beku larutan ditunjukkan oleh….
A. A dan B B. B dan C
C. G dan H D. I dan J E. D dan E
Jawab : E ( garis beku berbeda dengan perubahan titik beku (GH )
16. Perhatikan beberapa proses pembuatan koloid berikut: 1. H2S ditambahkan ke dalam endapan NiS
2. Sol logam dibuat dengan cara busur bredig 3. Larutan AgNO3 diteteskan ke dalam larutan HCl 4. Larutan FeCl3 diteteskan ke dalam air mendidih 5. Agar-agar dipeptisasi dengan air
Contoh pembuatan koloid dengan cara kondensasi adalah…. A. 1 dan 2
B. 1 dan 3 C. 3 dan 4 D. 3 dan 5 E. 4 dan 5
Jawab : C
Pwmbuatan koloid ada 2 cara :
Larutan/ gas --- > koloid < --- suspense/endapan/ padatan
Kondensi Dispersi
17. Berikut ini beberapa sifat koloid: 1. Dialysis
2. Koagulasi 3. Adsorbsi 4. Efek tyndall 5. Koloid pelindung
Proses penghilangan bau badan menggunakan bedak MBK dan cuci darah merupakan penerapan sifat koloid berturut-turut adalah….
A. 1 dan 3 B. 3 dan 1 C. 3 dan 2 D. 3 dan 4 E. 4 dan 5
18. Senyawa organik C4H10O dapat bereaksi dengan logam natrium, dan jika direaksikan dengan suatu oksidator menghasilkan senyawa yang dapat bereaksi dengan larutan Fehling. Senyawa organik tersebut adalah …
Jawab : A
Pembahasan : ( oksidasi )
Alkohol primer ======> Aldehid ( positif dengan fehling/tollens )
A. Alcohol primer B. Alkohol sekunder C. Eter
D. Alcohol tersier E. Eter
Pembahasan :
Ciri senyawa yang memiliki isomer optik adalah yang memiliki atom C kiral/asimetris ( memiliki atom C yg tangannya berbeda semua.
Atom C asimetris ( C kiral)
OH
CH
3– C – COOH
H
20. Pasangan antara senyawa dan kegunaannya yang tepat adalah...
Senyawa
Kegunaan
A
CF2Cl2
Pembius
B
CHCl3
Refrigerant
C
CHI3
Desinfektan
D
CH3COOH
Antiseptik
E
C6H5COOH
Pengawet
Jawab : C dan E
Pembahasan
C6H5COOH adalah asam benzoate dapat digunakan sebagai pengawet.
21. Reaksi adisi antara 1-propena dengan asam bromida (HBr)menghasilkan senyawa…. A. 1- bromo propana
B. 1-bromo propena C. 2 – bromo propana D. 2 – bromo propena E. Propil bromide
Jawab : C
Pembahasan :
Reaksinya adalah eaksi adisi
CH2 = CH – CH3 + H - Br ---> CH3 - CH – CH3 Br
22. Suatu senyawa turunan benzena memiliki sifat-sifat:
Ø memerahkan lakmus biru
Ø digunakan sebagai bahan desinfektan
Ø terdapat ikatan hidrogen antar molekulnya
Diperkirakan senyawa tersebut memiliki rumus struktur....
Jawab : A
Pembahasan :
Fenol adalah asam lemah yang dapat digunakan sebagai desinfektan ( pada karbol )
23. Pasangan yang tepat antara nama polimer, monomer, jenis reaksi dan kegunaannya adalah....
Polimer Monomer Reaksi Kegunaan
A Teflon Etilen Kondensasi Zat anti lengket
B Protein Asam amino Adisi Pembangun sel
C Karbohidrat Glukosa Adisi Sumber energi
D PVC Vinil klorida Kondensasi Pipa air
E Karet alam Isopren Adisi Ban mobil
Jawab : E
24. Suatu karbohidrat memiliki ciri-ciri: 1. memiliki gugus fungsi keton
2. dapat bereaksi positif dengan larutan fehling maupun tollens 3. banyak terdapat dalam madu dan buah-buahan
Diperkirakan senyawa tersebut adalah .... A. galaktosa
B. glukosa
C. fruktosa D. maltosa
E. laktosa
Jawab : C.
Pembahasan :
Fruktosa memiliki gugus keton, dan terdapat pada madu dan buah-buahan . Fruktosa berada dalam kesetimbangan dengan bentuk monosakarida yg memiliki gugus aldehid ( dapat bereaksi dengan fehling dan tollens )
25. Proses pelarutan beberapa zat terjadi perubahan suhu sebagai berikut:
Pernyataan yang benar dari proses pelarutan tersebut adalah... .
A. Zat V bersifat endoterm karena sistem melepaskan panas B. Zat R bersifat eksoterm karena sistem melepaskan panas C. Zat P dan zat T bersifat eksoterm karena selisih suhunya sama D. Zat P dan V bersifat eksoterm karena sistem mengambil panas
E. Zat R dan zat T bersifat endoterm karena sistem mengambil panas
Jawab : E
Pada reaksi endoterm terjadi penurunan suhu , system menyerap panas .
T
250C
U
150C
V
250C
W
450C
R
250C
S
200C
P
250C
Q
26. Data energi ikatan rata-rata:
C = C : 609 kJ/mol
C ─ H : 412 kJ/mol
H ─ Cl : 426 kJ/mol
C ─ Cl : 326 kJ/mol
C ─ C : 345 kJ/mol
Besarnya entalpi reaksi : CH2 = CH2 + HCl à CH3CH2Cl adalah .... A. -312 kJ/mol
B. -48 kJ/mol C. +48 kJ/mol D. +100 kJ/mol E. +312 kJ.mol
Jawab : B
H H H H
C
=
C + H - Cl
à
H – C – C - Cl
H H H H
Kiri ( reaktan )
4 x C – H = 4 x 412 kJ /mol = 1648 kJ/mol 1 x C = C = 1 x 609 kJ/mol = 609 kJ/mol 1 x H – Cl = 1 x 426 kJ/mol = 426 kJ/mol
Total = 2683 kJ/mol
Kanan ( produk )
5 x C – H = 5 x 412 kJ /mol = 2060 kJ/mol
1 x C ─ C = 1 x 345 kJ/mol = 345 kJ/mol
1 x C ─ Cl = 1 x 326 kJ/mol = 326 kJ/mol
Total = 2731 kJ/mol
27. Berikut ini diberikan data percobaan laju reaksi: A(g) + 2B(g) à B2A(g) pada beberapa kondisi:
No.
[A] M
[B] M
V (M/det)
1
0,1
0,1
0,02
2
0,2
0,1
0,08
3
0,1
0,2
0,04
Jika [A] dan [B] masing-masing diubah menjadi 0,5 M, maka harga laju reaksi (V) pada saat itu adalah ... M/det.
A. 2,5 B. 5,0
C. 7,5 D. 10,5 E. 12,5
Jawab : A
Pembahasan :
V1/V2 => [0,1/0,2]x [0,1/0,1]y = 0,02/0,08 [1/2]x = ¼
X = 2
V1/V3 => [0,1/0,1]x [0,1/0,2]y = 0,02/0,04 [1/2 ]y = ½
y = 1
Misalkan laju yang dicari V4
V1 = k [0,1]2 [0,1] V4 = k [0,5]2 [0,5]
0,02 = k [0,1]2 [0,1] V4 = k [0,5]2 [0,5]
28. Perhatikan gambar ilustrasi berikut:
Laju reaksi yang dipengaruhi oleh konsentrasi terdapat pada erlenmeyer nomor... . A. (1) dan (2)
B. (1) dan (3) C. (1) dan (5) D. (2) dan (4) E. (3) dan (5)
Jawab : B ( jelas ), faktor yang lain dibuat sama.
29. Diketahui beberapa reaksi kesetimbangan sebagai berikut :
(1) 2SO2 (g) + O2 (g) ⇌⇌⇌⇌ 2 SO3 (g) ; ∆H = – 197,8 kJ (2) COCl2 (g) ⇌⇌⇌⇌ CO2 (g) + Cl2 (g) ; ∆H = +108,3 kJ (3) H2 (g) + ½ O2 (g) ⇌⇌⇌⇌ H2O (g) ; ∆H = – 242 kJ (4) 2NO (g) ⇌⇌⇌⇌ N2 (g) + O2 (g) ; ∆H = - 180,4 kJ
Untuk mendapatkan hasil reaksi yang lebih banyak bila suhu diturunkan dan tekanan sistemnya diperbesar, terjadi pada reaksi ...
A. (1) dan (2) B. (1) dan (3) C. (1) dan (4) D. (2) dan (4) E. (3) dan (4)
Jawab : B
Pembahasan :
P
N2O430. Sebanyak 1 mol N2O4 dipanaskan dalam suatu ruangan sehingga 50% terurai membentuk NO2(g). Jika tekanan total campuran gas adalah 6 atm, maka harga Kp reaksi:
N2O4(g) ↔ 2NO2(g) pada suhu itu adalah....
A. ⅟8 B. ¼ C. 1 D. 8 E. 16
Jawab : D
N2O4 yang terurai adalah 50% = 50% x 1 mol = 0,5 mol N2O4(g) ↔ 2NO2(g)
Mula : 1 mol -
Reaksi : 0,5 mol 1 mol Setimbang : 0,5 mol 1 mol
Mol total saat setimbang = 1,5 mol
P NO2 = 1/1,5 x P total = 1/1,5 x 6 atm = 4 atm
PN2O4 = 0,5/1,5 x P total = 0,5/1,5 x 6 atm = 2 atm
Kp =
P
2NO =4
2/2 = 8
31. Diantara persamaan reaksi berikut:
1. NaOH (aq) + HCl(aq) à NaCl (aq) + H2O (l) 2. Zn(s) + CuSO4 (aq) à ZnSO4 (aq) + Cu(s)
3. Pb(s) + PbO2(s) + 2H2SO4(aq) à 2PbSO4(aq) + 2H2O(l) 4. Pb(NO3)2 (aq) + 2 KI(aq) à PbI2 (s) + 2 KNO3 (aq)
yang merupakan persamaan reaksi redoks adalah....
32. Perhatikan gambar sel volta berikut ini:
Jika Eo Ag = +0.80 volt dan Eo Cu = +0.34 volt, maka pernyataan yang benar adalah....
A. Anode Cu, katode Ag B. katode – anode +
C. anode Ag katode Cu
D. Elektron mengalir dari katode ke anode E. Menghasilkan potensial sel +1,14 Volt
Jawab : A
Pembahasan
Jika Eo Ag = +0.80 volt > Eo Cu = +0.34 volt, maka Reduksi oksidasi
Katode (+) anode (-)
E sel = 0,8 V – 0,34 V = + 46 volt
33. Perhatikan gambar elektrolisis berikut:
Jika digunakan elektrode karbon, maka reaksi yang terjadi pada katode adalah….
A. 2H2O(l) + 2e à H2(g) + 2OH-(aq) B. Ag+(aq) + 1e à Ag(s)
C. Ag(s) à Ag+(aq) + 1e
D. 2H2O(l) à O2(g) + 4H+(aq) + 4e E. 2NO3-(aq) à N2(g) + 3O2(g) + 6e
Jawab : B
Pembahasan :
34. Arus listrik 5 ampere dialirkan ke dalam larutan Na2SO4 melalui elektrode-elektrode karbon selama 1930 detik. Volume gas yang dihasilkan di katoda pada (0oC, 1 atm) adalah ….(1 Faraday = 96.500 C/mol) A. 0,56 liter
B. 1,12 liter
C. 6,72 liter D. 11,20 liter E. 22,40 liter
Jawab : B
Pembahasan :
Jumlah arus = i x t /96500 = 5 x 1930/96500 Faraday = 5 x 0,02 = 0,1 F Reaksi di katoda = 2 H2O + 2 e à 2 OH- + H2
1 F setara dengan 1 mol elektron 0,1 F setara dengan 0,1 mol elektron
Berdasarkan perbadingan koefisien
Sehingga didapat mol gas H2 = ½ x mol e = ½ x 0,1 mol = 0,05 mol Jadi Volume gas H2 (STP ) = 0,05 mol x 22,4 L/mol = 1,12 L
35. Diketahui potensial reduksi:
Fe2+(aq) + 2e →Fe(s) E° = –0,44 volt Cu2+(aq) + 2e→Cu(s) E° = +0,34 volt Zn2+(aq) + 2e→Zn(s) E° = –0,76 volt Mg2+(aq)+2e →Mg(s) E° = –2,37 volt Sn2+(aq) + 2e→Sn(s) E° = –0,14 volt
Logam yang dapat digunakan untuk mencegah perkaratan pada besi adalah....
A. Sn B. Zn
C. Mg D. Cu dan Mg E. Mg dan Zn
Pembahasan
Logam yang dapat digunakan untuk mencegah perkaratan besi dengan metode perlindungan katodik adalh logam yang memiliki potensial reduksi lebih kecil atau yg terletak dosebelak kiri Fe dalam deret volta.
36. Batuan yang mengandung kalsium adalah…. A. Karnalit dan dolomite
B. Magnetit dan kriolit C. Bauksit dan kriolit D. Gypsum dan dolomit E. Pirit dan bauksit
Jawab : D
Pembahasan :
Gypsum : CaSO4
Dolomit : CaCO3. MgCO3
37. Berikut ini ciri – ciri unsur 1. elektron valensi unsurnya 7 2. oksidanya dalam air bersifat asam 3. digunakan sebagai tambahan pasta gigi 4. asamnya digunakan untuk melarutkan kaca
Sifat-sifat tersebut dimiliki oleh unsur .... A. Fluorin
B. Klorin C. Bromin D. Iodin E. Astatin Jawab : A
38. Reaksi yang menghasilkan partikel beta (β) adalah...
A. 8O 17
→ 8O 16
+ ….. B. 6C13 → 5B13 + ….. C. 13Al26 → 11 Na24 + ….. D. 92U
238
→ 90Th 234
+ ….. E. 6C14 → 7B14 + …..
39. Logam aluminium dibuat dari bijih bauksit melalui tahapan pelarutan, pemurnian dan elektrolisis. Persamaan reaksi pembuatan logamnya adalah sebagai berikut:
Al2O3(s) à 2Al 3+
(l) + 3O2-(l) Katode : 2Al3+ + 6e à 2Al Anode : 3O2-à 3/2 O2 + 6e
Proses pembuatan unsur tersebut dikenal dengan nama….
A. Hall – Herault B. Down
C. Deacon D. Wohler E. Frasch
Jawab : A
40. Pasangan yang tepat tentang unsure/senyawa, proses pembuatan dan kegunaan dalam kehidupan sehari-hari adalah….
Unsur Proses pembuatan Kegunaan
A Aluminium Tanur tinggi Peralatan rumah tangga
B Besi Hall – Herault Bahan bangunan
C Asam sulfat Frasch Obat-obatan
D Belerang Proses kontak pelarut
E Magnesium Down Antasida
PEMERINTAH PROVINSI DAERAH KHUSUS IBUKOTA JAKARTA
DINAS PENDIDIKAN
MUSYAWARAH KERJA KEPALA SEKOLAH SMA
Sekretariat : SMA Negeri 70 Jakarta
Jalan Bulungan No. 1C, Jakarta Selatan - Telepon (021) 7222667, Fax (021) 7221343
SOAL DAN KUNCI
TRY OUT UJIAN NASIONAL
Mata Pelajaran :
KIMIA
Program Studi : Ilmu Pengetahuan Alam [IPA]
Hari / Tanggal : Selasa, 13 Maret 2012
Waktu : 10.00 – 12.00 WIB Petunjuk Umum
1. Isikan identitas Anda ke dalam Lembar Jawaban Try Out Ujian Nasional (LJTOUN) yang tersedia dengan menggunakan pensil 2B.
2. Tersedia waktu 120 menit untuk mengerjakan paket TO UN ini.
3. Jumlah soal 40 (empat puluh) butir, pada setiap butir terdapat 5 (lima) pilihan jawaban. 4. Periksa dan bacalah soal-soal sebelum Anda menjawabnya.
5. Laporkan kepada Pengawas Try Out apabila terdapat soal yang kurang jelas, rusak, atau tidak lengkap. 6. Tidak diizinkan menggunakan kalkulator, HP, tabel matematika, atau alat bantu hitung lainya.
7. Periksa pekerjaan Anda sebelum diserahkan kepada Pengawas Try Out. 8. Lembar soal boleh dicoret-coret untuk mengerjakan perhitungan.
Pilihlah satu jawaban yang menurut Anda paling tepat!
1. Atom klorin (Cl) memiliki nomor atom 17 dan nomor massa 35. Dalam ion Cl- terdapat … A. 17 proton, 17 elektron, 18 neutron
B. 18 proton, 17 elektron, 18 neutron C. 16 proton, 17 elektron, 18 neutron D. 17 proton, 18 elektron, 18 neutron E. 17 proton, 16 elektron, 18 neutron
2. Jika diketahui nomor atom H=1, Be= 4, B=5, C= 6, N=7, O= 8, Cl=17, pasangan yang tepat antara rumus molekul, bentuk molekul dan jenis kepolaran ikatannya adalah…
Rumus Molekul Bentuk Molekul Jenis Kepolaran
A BCl3 Trigonal Planar Polar
B NH3 Piramida trigonal Polar
C H2O Linier Polar
D BeCl2 Bentuk V Non polar
E CCl4 Tetra Hedral Polar
Jawab : B
Pada NH3 --- > PEI = 3, PEB = 1
3. Suatu unsur memiliki konfigurasi elektron (Ar) 3d5 4s2. Unsur tersebut dalam sistem periodik terletak pada ….
A. golongan II A, periode 4 B. golongan II B, periode 4 C. golongan VII B, periode 4 D. golongan VII A, periode 4 E. golongan VIII B, perode 4
Jawab : C
4. Asam klorida (HCl) mempunyai Mr yang lebih tinggi dibandingkan asam fluoride (HF), tetapi HCl mempunyai titik didih yang lebih rendah dibandingkan HF. Pernyataan yang sesuai dari informasi tersebut adalah….
A. HF lebih polar dari pada HCl B. HCl lebih polar dari pada HF
C. Kekuatan asam HF lebih lebih lemah dari pada HCl D. Antar molekul HF terdapat ikatan hidrogen
E. Kekuatan asam HCl lebih lebih kuat dari pada HF
Jawab : D
5. Perbandingan massa besi dan belerang dalam FeS adalah 7 : 4, bila terdapat data sebagai berikut:
No Percobaan Massa Besi (gram) Massa Belerang (gram) Massa Sisa (gram)
1 7 A 0
2 B 14 2
3 32 16 C
Maka massa A, B dan C berturut-turut yang benar adalah… gram A. 4; 21 dan 4
B. 8; 35 dan 4 C. 8; 28 dan 4 D. 10; 35 dan 4 E. 10; 28 dan 4
Jawab : A
6. Soda kue (natrium bikarbonat) jika dipanaskan bersama dengan adonan kue akan menghasilkan gas CO2
yang berfungsi mengembangkan adonan kue, natrium karbonat dan uap air. Persamaan reaksi yang tepat adalah….
A. NaHCO3(s) →NaCO3(s) + CO2(g) + H2O(l)
B. 2NaHCO3(s) →Na2CO3(s) + CO2(g) + H2O(l)
C. Na2CO3(s) + CO2(g) + H2O(l) → NaHCO3(s)
D. Na2CO3(s) + CO2(g) + H2O(l) → 2NaHCO3(s)
E. 2NaHCO3 (s) →Na2CO3(s) + CO2(g) + 2H2O(l)
Jawab : B
7. Perhatikan gambar pengujian daya hantar beberapa larutan berikut ini!
8. Dari hasil pengujian terhadap sampel air limbah A dan B dengan beberapa indikator asam-basa, diperoleh data sebagai berikut:
Indikator Trayek pH Perubahan Warna Warna Larutan Sampel A Sampel B Metil Merah 4,2 – 6,3 Merah - kuning kuning jingga Brom Tymol Biru 6.0 – 7,6 Kuning - Biru hijau hijau
Phenolphtalein 8,3 – 10,0 Tidak berwarna - Merah Tidak berwarna Tidak berwarna Harga pH untuk sampel A dan B berturut-turut adalah …
A. ≤ 8,3 dan 4,2 ≤ pH ≤ 6,3
B. 6,0 ≤ pH ≤ 7,6 dan 6,0 ≤ pH ≤ 8,3 C. 6,3 ≤ pH ≤ 7,6 dan 6,0 ≤ pH ≤ 6,3 D. 6,0 ≤ pH ≤ 8,3 dan 6,0 ≤ pH ≤ 6,3 E. 6,3 ≤ pH ≤ 8,3 dan 6,0 ≤ pH ≤ 8,3
Jawab : C
6,3 --- > 6 ---7,6 ß---8,3
4,2 --- 6,3 6 ---7,6 < ---8,3
9. Sebanyak 10 mL larutan basa lemah MOH 0,1 M ditambah air sehingga volumenya menjadi 1000 mL. Jika Kb = 1 x 10-5, pH larutan berubah dari….
A.
13 menjadi 11 B. 13 menjadi 10 C. 11 menjadi 10 D. 11 menjadi 9 E. 11 menjadi 6Jawab : C
[OH- ] =
V
Kb x Mb =V
10-5 x 10-1 = 10-3pOH = 3
pH = 14 – 3 = 11
Pengenceran = V1 . M1 = V2 . M2 10 . 0,1 = 1000. M2
M2 = 0,001 M = 10-3 M
[OH- ] =
V
Kb x Mb =V
10-5 x 10-3 = 10-410. Sekelompok siswa melakukan percobaan untuk menentukan molaritas larutan HCl yang tulisan pada label botolnya kurang jelas, dengan cara titrasi. Titrasi dilakukan dengan menggunakan larutan standar NaOH 0,10 M sampai terbentuk warna merah muda dengan indikator fenolftalein. Dari titrasi tersebut diperoleh data sebagai berikut :
Percobaan Volume larutan HCl (mL) Volume larutan NaOH (mL)
1 10 17
3 10 18
4 10 17
Konsentrasi larutan HCl yang tertulis pada label botol tersebut adalah .... A. 0,0173 M
B. 0,017 M C. 0,018 M D. 0,17 M E. 0,18 M
Jawab : D
NaOH terpakai = 17,33 mL Va x Ma = Vb x Mb
11. Sekelompok siswa melakukan percobaan terhadap larutan dengan data hasil percobaan sebagai berikut: No Penambahan larutan pH larutan 0,1 M
Larutan mula-mula K L M N O 1 pH mula-mula 7,25 5,02 1,50 9,01 13,30 2 Di tambah sedikit HCl 2,55 4,98 1,50 8,99 10,75 3 Di tambah sedikit NaOH 12,35 5,05 3,35 9,02 13,55 4 Di tambah air 7,25 5,02 1,50 9,01 12,50 Dari data tersebut yang terrmasuk larutan yang bersifat buffer (penyangga) adalah... A. K dan L
B. K dan M C. L dan N D. L dan O E. N dan O
12. Data yang menunjukkan garam terhidrolisis parsial dan bersifat basa adalah... Senyawa Lakmus
Merah Biru A NH4CN Biru Biru
B CH3COO NH4 Merah Merah
C NaCN Biru Biru D NH4Cl Merah Merah
E NaCl Merah Biru
Jawab : C
Senyawa Pembentuknya Asam Basa A NH4CN Lemah Lemah
B CH3COO NH4 Lemah Lemah
C NaCN Lemah Kuat D NH4Cl Kuat Lemah
E NaCl Kuat kuat
13. Dalam 4 wadah terdapat masing-masing 10 mL larutan Ba2+, Pb2+, Ni2+, dan Sr2+ yang konsentrasinya 1 x 10-4 M. Ke dalam masing-masing wadah tersebut ditambahkan 10 mL H2C2O4 1 x 10-4 M. Jika Ksp BaC2O4 =
2,3 x 10-8; NiC2O4 = 4 x 10-10; PbC2O4 = 4,8 x 10-10; SrC2O4 = 1,6 x 10-7; senyawa yang mengendap adalah….
A. BaC2O4 dan SrC2O4
B. BaC2O4 dan PbC2O4
C. NiC2O4 dan PbC2O4
D. NiC2O4 dan SrC2O4
E. SrC2O4 dan PbC2O4
Jawab : C
Karena tipe nya sama, volume serta konsentrasinya sama, maka pilih saja yang Ksp nya paling
kecil
14. Fraksi mol larutan urea dalam air adalah 0,2. Tekanan uap jenuh air pada suhu 20oC adalah 17,5 mmHg. Maka tekanan uap larutan adalah….mmHg
A. 3,5 B. 14 C. 17,5 D. 17,7 E. 21
∆ P = X t . Po = 0,2 . 17,5 mmHg = 3,5 mmHg P larutan = 17,5 mmHg – 3,5 mmHg = 14 mmHg
15. Dari diagram P-T H2O berikut, perubahan titik beku
larutan ditunjukkan oleh…. A. A dan B
B. B dan C C. G dan H D. I dan J E. D dan E
Jawab : C
16. Perhatikan beberapa proses pembuatan koloid berikut:
1. H2S ditambahkan ke dalam endapan NiS
2. Sol logam dibuat dengan cara busur bredig 3. Larutan AgNO3 diteteskan ke dalam larutan HCl
4. Larutan FeCl3 diteteskan ke dalam air mendidih
5. Agar-agar dipeptisasi dengan air
Contoh pembuatan koloid dengan cara dispersi adalah…. A. 1, 2 dan 3
B. 1, 2 dan 4 C. 2, 3 dan 4 D. 2, 3 dan 5 E. 2, 4 dan 5
Jawab : anulir Kondensasi : 3, 4 Dispersi : 1,2,5
17. Berikut ini beberapa sifat koloid: 1. Dialysis
2. Koagulasi 3. Adsorbsi 4. Efek tyndall 5. Koloid pelindung
18. Senyawa organik C4H10O tidak dapat bereaksi
dengan logam natrium, dan jika direaksikan dengan HI menghasilkan metil iodida dan 1- propanol. Senyawa organik tersebut adalah …
Jawab : C
C4H10O mengikuti rumus CnH2n+2O ,
kemungkinannya eter atau alkohol.
Bereaksi dengan Na ciri dari alkohol.Tdak bereaksi dengan Na : ciri dari eter.
Eter + HI -à CH3I + CH3 – CH2 – CH2 – OH, maka
eternya adalah CH3 – CH2 – CH2 – O-CH3
19. Di antara senyawa karbon berikut, yang memiliki isomer geometri adalah....
Jawab : A
Syarat suatu senyawa memiliki isomer geometri adalah : 1. memiliki ikatah rangkap 2 ( alkena ).
2. Atom C yag berikatan rangkap tidak boleh mengikat gugus yang sama
A D
C = C
B E
A ≠ B
20. Pasangan antara senyawa dan kegunaannya yang tepat adalah... Senyawa Kegunaan A CF2Cl2 Desinfektan
B CHCl3 Pembius
C CHI3 Refrigerant
D CH3COOH Pengawet
E C6H5COOH Antiseptik
Jawab : B
21. Reaksi adisi antara 1-propena dengan asam bromida (HBr) menghasilkan senyawa…. A. bromo propana
B. 1-bromo propena C. 2 – bromo propena D. 2 – bromo propana E. Propil bromide Jawab : D
CH2 = CH – CH3 + HBr à CH3 – CHBr – CH3
22. Suatu senyawa turunan benzena memiliki sifat-sifat:
Ø memerahkan lakmus biru
Ø digunakan sebagai bahan pengawet
Ø terdapat ikatan hidrogen antar molekulnya
Diperkirakan senyawa tersebut memiliki rumus struktur....
Jawab : B
23. Pasangan yang tepat antara nama polimer, monomer, jenis reaksi dan kegunaannya adalah.... Polimer Monomer Reaksi Kegunaan A Teflon Etilen Kondensasi Zat anti lengket B Protein Asam amino Adisi Pembangun sel C Karbohidrat Glukosa kondensasi Sumber energi D PVC Vinil klorida Kondensasi Pipa air E Karet alam Isopren kondensasi Ban mobil
Jawab : C
24. Suatu karbohidrat memiliki ciri-ciri: 1. memiliki gugus fungsi aldehid
2. dapat bereaksi positif dengan larutan fehling maupun tollens
3. banyak terdapat dalam susu
Diperkirakan senyawa tersebut adalah
....
A. galaktosa B. glukosa
C. fruktosa D. maltosa
E. laktosa
Jawab : E
25. Proses pelarutan beberapa zat terjadi perubahan suhu sebagai berikut:
Eksoterm ( suhu naik) : P dan V
Pernyataan yang benar dari proses pelarutan tersebut adalah... . A. Zat V bersifat endoterm karena sistem melepaskan panas B. Zat R bersifat eksoterm karena sistem melepaskan panas C. Zat P dan zat T bersifat eksoterm karena selisih suhunya sama D. Zat P dan V bersifat eksoterm karena sistem melepaskan panas E. Zat R dan zat T bersifat endoterm karena sistem melepaskan panas
Jawab : D
26. Data energi ikatan rata-rata: C ═ C : 609 kJ/mol
C ─ H : 412 kJ/mol H ─ Cl : 426 kJ/mol C ─ Cl : 326 kJ/mol C ─ C : 345 kJ/mol
Besarnya entalpi reaksi : CH2=CH— CH3+ HCl à CH3CH(Cl) CH3 adalah ....
A. +312 kJ.mol B. +100 kJ/mol C. +48 kJ/mol D. -48 kJ/mol E. -312 kJ/mol
Jawab : D
T
250C
U
150C
V
250C
W
450C
R
250C
S
200C
P
250C
Q
H H H H
C
=
C + H - Cl
à
H – C – C - Cl
H H H H
Kiri ( reaktan )
4 x C – H = 4 x 412 kJ /mol = 1648 kJ/mol 1 x C = C = 1 x 609 kJ/mol = 609 kJ/mol 1 x H – Cl = 1 x 426 kJ/mol = 426 kJ/mol Total = 2683 kJ/mol
Kanan ( produk )
5 x C – H = 5 x 412 kJ /mol = 2060 kJ/mol 1 x C ─ C = 1 x 345 kJ/mol = 345 kJ/mol 1 x C ─ Cl = 1 x 326 kJ/mol = 326 kJ/mol Total = 2731 kJ/mol
∆ H = kiri – kanan = ( 2683 – 2731) kJ/mol = - 48 kJ/mol
27. Berikut ini diberikan data percobaan laju reaksi: A(g) + 2B(g) à B2A(g) pada beberapa kondisi:
No. [A] M [B] M V (M/det) 1 0,1 0,1 0,1 2 0,2 0,1 0,4 3 0,1 0,2 0,2
Jika [A] dan [B] masing-masing diubah menjadi 0,5 M, maka harga laju reaksi (V) pada saat itu adalah ... M/det.
A. 5,0 B. 7,5 C. 10,5
D. 12,5
E. 39,0
Jawab : D
28. Perhatikan gambar ilustrasi berikut:
Laju reaksi yang dipengaruhi oleh suhu terdapat pada erlenmeyer nomor... . A. (1) dan (2)
B. (1) dan (3) C. (1) dan (5) D. (2) dan (4) E. (3) dan (5)
P
N2O429. Diketahui beberapa reaksi kesetimbangan sebagai berikut : (1) 2SO2 (g) + O2 (g) ⇌⇌⇌⇌ 2 SO3 (g) ; ∆H = – 197,8 kJ
(2) COCl2 (g) ⇌⇌⇌⇌ CO2 (g) + Cl2 (g) ; ∆H = +108,3 kJ
(3) H2 (g) + ½ O2 (g) ⇌⇌⇌⇌ H2O (g) ; ∆H = – 242 kJ
(4) 2NO (g) ⇌⇌⇌⇌ N2 (g) + O2 (g) ; ∆H = - 180,4 kJ
Untuk mendapatkan hasil reaksi yang lebih banyak bila suhu diturunkan dan tekanan sistemnya diperbesar, terjadi pada reaksi ...
A. (1) dan (2) B. (1) dan (3) C. (1) dan (4) D. (2) dan (4) E. (3) dan (4)
Jawab : B
30. Sebanyak 1mol N2O4 dipanaskan dalam suatu ruangan sehingga 50% terurai membentuk NO2(g). Jika
tekanan total campuran gas adalah 12 atm, maka harga Kp reaksi: N2O4(g) ↔ 2NO2(g) pada suhu itu adalah....
A. ⅟8
B. ¼ C. 1 D. 8 E. 16
Jawab : E
N2O4 yang terurai adalah 50% = 50% x 1 mol = 0,5 mol
N2O4(g) ↔ 2NO2(g)
Mula : 1 mol - Reaksi : 0,5 mol 1 mol Setimbang : 0,5 mol 1 mol
Mol total saat setimbang = 1,5 mol
P NO2 = 1/1,5 x P total = 1/1,5 x 12 atm = 8 atm
PN2O4 = 0,5/1,5 x P total = 0,5/1,5 x 12 atm =4 atm
Kp =
P
2NO2 =8
2
/4 = 16
31. Diantara persamaan reaksi berikut:
1. Pb(s) + PbO2(s) + 2H2SO4(aq) à 2PbSO4(aq) + 2H2O(l)
2. Pb(NO3)2 (aq) + 2 KI(aq) à PbI2 (s) + 2 KNO3 (aq)
32. Perhatikan gambar sel volta berikut ini:
Jika Eo Ag = +0.80 volt dan Eo Zn = -0,76 volt, maka pernyataan yang benar adalah....
A. Anode Zn, katode Ag B. katode – anode + C. anode Ag katode Zn
D. Elektron mengalir dari katode ke anode E. Menghasilkan potensial sel +0,04 volt.
Jawab : A
33. Perhatikan gambar elektrolisis berikut:
Jika digunakan electrode karbon, maka reaksi yang terjadi pada anode adalah….
A. 2H2O(l) + 2e à H2(g) + 2OH-(aq)
B. Ag+(aq) + 1e à Ag(s) C. Ag(s) à Ag+(aq) + 1e
D. 2H2O(l) à O2(g) + 4H+(aq) + 4e
E. 2NO3-(aq) à N2(g) + 3O2(g) + 6e
Jawab : D
34. Arus listrik 5 ampere dialirkan ke dalam larutan Na2SO4 melalui elektrode-elektrode karbon selama 1930
detik. Volume gas yang dihasilkan di anode pada (0oC, 1 atm) adalah ….(1 Faraday = 96.500 C/mol) A. 0,56 liter
B. 1,12 liter C. 6,72 liter D. 11,20 liter E. 22,40 liter
Jawab : A
35. Diketahui potensial reduksi:
Fe2+(aq) + 2e →Fe(s) E° = –0,44 volt Mg2+(aq)+2e →Mg(s) E° = –2,37 volt Cu2+(aq) + 2e→Cu(s) E° = +0,34 volt Sn2+(aq) + 2e→Sn(s) E° = –0,14 volt Zn2+(aq) + 2e→Zn(s) E° = –0,76 volt
Logam yang dapat digunakan untuk mencegah perkaratan pada besi adalah.... A. Cu dan Mg
B. Mg dan Zn C. Sn
D. Zn E. Cu
36. Batuan yang mengandung magnesium adalah…. A. Karnalit dan dolomit
B. Magnetit dan dolomite C. Bauksit dan kriolit D. Gypsum dan karnalit E. Pirit dan bauksit
Jawab : A
37. Berikut ini ciri – ciri unsur
Ø Merupakan unsur periode ketiga
Ø oksidanya dalam air bersifat amfoter
Ø digunakan sebagai perkakas rumah tangga
Ø Terdapat dalam bijih bauksit
Sifat-sifat tersebut dimiliki oleh unsur .... A. Natrium
B. Magnesium C. Aluminium D. Silikon E. Sulfur
Jawab : C
38. Reaksi yang menghasilkan partikel positron adalah... A. 8O17 → 8O16 + …..
B. 6C13 → 5B13 + …..
C. 13Al26 → 11 Na24 + …..
D. 92U238 → 90Th234 + …..
E. 6C14 → 7B14 + …..
Jawab : B
39. Logam besi dibuat dari bijih besi melalui reaksi: Fe2O3(s) + CO(g) à Fe3O4(s) + CO2(g)
Fe3O4(s) + CO(g) àFeO(s) + CO2(g)
FeO(S) + CO(g) àFe(s) + CO2(g)
Proses pembuatan unsur tersebut dikenal dengan nama…. A. Hall – Herault
40. Pasangan yang tepat tentang unsur/senyawa, proses pembuatan dan kegunaan dalam kehidupan sehari-hari adalah….
Unsur Proses pembuatan Kegunaan A Aluminium Hall – Herault Peralatan rumah tangga B Besi Proses kontak Bahan bangunan C Asam sulfat Tanur tinggi Obat-obatan D Belerang Down pelarut E Magnesium Frasch Antasida
PEMERINTAH PROVINSI DAERAH KHUSUS IBUKOTA JAKARTA
DINAS PENDIDIKAN
MUSYAWARAH KERJA KEPALA SEKOLAH SMA
Sekretariat : SMA Negeri 70 Jakarta
Jalan Bulungan No. 1C, Jakarta Selatan - Telepon (021) 7222667, Fax (021) 7221343
PEMBAHASAN
TRY OUT UJIAN NASIONAL
Mata Pelajaran :
KIMIA
Program Studi : Ilmu Pengetahuan Alam [IPA]
Hari / Tanggal : Selasa, 13 Maret 2012
Waktu : 10.00 – 12.00 WIB
Petunjuk Umum
1. Isikan identitas Anda ke dalam Lembar Jawaban Try Out Ujian Nasional (LJTOUN) yang tersedia dengan menggunakan pensil 2B.
2. Tersedia waktu 120 menit untuk mengerjakan paket TO UN ini.
3. Jumlah soal 40 (empat puluh) butir, pada setiap butir terdapat 5 (lima) pilihan jawaban. 4. Periksa dan bacalah soal-soal sebelum Anda menjawabnya.
5. Laporkan kepada Pengawas Try Out apabila terdapat soal yang kurang jelas, rusak, atau tidak lengkap. 6. Tidak diizinkan menggunakan kalkulator, HP, tabel matematika, atau alat bantu hitung lainya.
7. Periksa pekerjaan Anda sebelum diserahkan kepada Pengawas Try Out. 8. Lembar soal boleh dicoret-coret untuk mengerjakan perhitungan.
Pilihlah satu jawaban yang menurut Anda paling tepat!
1. Atom magnesium (Na) memiliki nomor atom 11 dan nomor massa 23. Dalam ion Na+terdapat … A. 12 proton, 12 elektron, 12 neutron
B. 12 proton, 10 elektron, 12 neutron C. 12 proton, 13 elektron, 12 neutron D. 11 proton, 10 elektron, 12 neutron E. 10 proton, 120 elektron, 12 neutron
Jawab : D
Pembahasan
O X
OX
2. Jika diketahui nomor atom H=1, Be= 4, B=5, C= 6, N=7, O= 8, Cl=17, pasangan yang tepat antara rumus molekul, bentuk molekul dan jenis kepolaran ikatannya adalah….
Rumus Molekul Bentuk Molekul Jenis Kepolaran
A BCl3 piramidal Non polar
B NH3 Segitiga Sama Sisi Non Polar
C H2O Bentuk V Polar
D BeCl2 Linier polar
E CCl4 Tetra Hedral Polar
Jawab : C
Pembahasan :
H2O, atom pusat adalah atom O, konfigurasi eleketronnya = 2, 6
PEI = 2 ( dari rumus molekulnya )
PEB = ( electron valensi atom pusat – PEI ) /2 = ( 6-2)/2 = 2
Bentuk molekul = huruf V , bersifat polar ( ada PEB )
3. Suatu unsur memiliki konfigurasi elektron (Ar) 3d5 4s2. Unsur tersebut dalam sistem periodik terletak pada ….
A. golongan IIA, periode 4 B. golongan II B, periode 4 C. golongan V B, periode 4 D. golongan VII A, periode 4 E. golongan VII B, perode 4 Jawab = E
4. Jenis ikatan dalam NH4Cl adalah . . . .
A. kovalen
B. ion dan kovalen
C. ion dan kovalen koordinat D. kovalen dan kovalen koondinat E. ion, kovalen, dan kovalen koordinat
Jawab : E
Pembahasan :
Antara ion NH4+ dan ion Cl- : ilatan ion
Dalam ion NH4+ terdapat ikatan kovalen dan kovalen koordinat
H +
H
N
H
5. Perbandingan massa besi dan belerang dalam FeS adalah 7 : 4, bila terdapat data sebagai berikut:
No Percobaan Massa Besi (gram) Massa Belerang (gram) Massa Sisa (gram)
1 28 A 0
2 B 10 2
3 35 16 C
Maka massa A, B dan C berturut-turut yang benar adalah… .. gram
A. 14 ; 22 dan 7 B. 16 ; 14 dan 7 C. 14 ; 28 dan 4 D. 10 ; 35 dan 4 E. 16 ; 30 dan 4
Jawab : B
6. Diantara persamaan reaksi berikut yang sudah setara adalah …. A. C( s) + O2 (g) ─> 2CO( g )
B. 4 Al ( s ) + 2 O2 (g) ─> 2Al2O3 ( s)
C. 2 Na( s ) + O2 (g) ─> 2Na 2O( g )
D. 4 NH3 ( g ) + 5O2 (g) ─> 4NO( g ) +6H 2O( g )
E. Al2O3 ( s) + H2SO4 (l ) ─> Al2 (SO4)3 ( aq) + H2O(l)
Jawab : D
7. Perhatikan gambar pengujian daya hantar beberapa larutan berikut ini!
Larutan yang bersifat non elektrolit dan elektrolit lemah berturut-turut adalah ....
A. 1 dan 2 B. 1 dan 5 C. 2 dan 4 D. 3 dan 4 E. 3 dan 5 Jawab : D atau E
8. Dari hasil pengujian terhadap sampel air limbah A dan B dengan beberapa indikator asam-basa, diperoleh data sebagai berikut:
Indikator Trayek pH Perubahan Warna Warna Larutan
Sampel A Sampel B
Metil Merah 4,2 – 6,3 Merah - kuning jingga Kuning
Brom Tymol Biru 6.0 – 7,6 Kuning - Biru kuning Biru
Phenolphtalein 8,3 – 10,0 Tidak berwarna - Merah Tidak berwarna Merah
Harga pH untuk sampel A dan B berturut-turut adalah … A. ≤ 6,3 dan 7,6 ≤ pH ≤ 8,3
9. Sebanyak 1 mL larutan asam lemah HX 0,1 M ditambah air sehingga volumenya menjadi 10 L. Jika Ka = 1 x 10-5, pH larutan berubah dari….
A. 1 menjadi 3 B. 1 menjadi 4 C. 3 menjadi 4 D. 3 menjadi 5 E. 3 menjadi 8
Jawab : D
10. Sekelompok siswa melakukan percobaan untuk menentukan molaritas larutan HCl yang tulisan pada label botolnya kurang jelas, dengan cara titrasi. Titrasi dilakukan dengan menggunakan larutan standar NaOH 0,10 M sampai terbentuk warna merah muda dengan indikator fenolftalein. Dari titrasi tersebut diperoleh data sebagai berikut :
Percobaan Volume larutan HCl (mL) Volume larutan NaOH (mL)
1 10 9,5
3 10 9,6
4 10 9,4
Konsentrasi larutan HCl yang tertulis pada label botol tersebut adalah ....
A. 0,0425 M B. 0,0430 M C. 0,0450 M D. 0,0900 M E. 0,0950 M Jawab : E
10 x Ma = 9,5 x 0,1
Ma = 0,95/10 = 0,095 M
11. Sekelompok siswa melakukan percobaan terhadap larutan dengan data hasil percobaan sebagai berikut:
No Penambahan larutan pH larutan 0,1 M
Larutan mula-mula A B C D E
1 pH mula-mula 5,00 7,35 1,50 9,01 13,30
2 Di tambah sedikit HCl 4,98 2,55 1,50 8,95 10,75
3 Di tambah sedikit NaOH 5,05 12,35 3,35 9,02 13,95
4 Di tambah air 5,02 7,25 1,50 9,01 12,50
Dari data tersebut yang terrmasuk larutan yang bersifat buffer (penyangga) adalah... A. A dan B
B. A dan C C. A dan D D. B dan E E. D dan E Jawab : C
12. Tabel dibawah ini yang menunjukkan larutan garam terhidrolisis total adalah...
Jawab : B
Pembahasan :
Garam yang terhidrolisis total adalah garam yang terbentuk dari asam lemah dan basa lemah.
13. Di dalam suatu larutan terdapat ion-ion X2+, Y2+; Dan Z2+ dengan konsentrasi masing-masing 0,1 M. Kedalam larutan ditambahkan NaOH sehingga pH larutan menjadi 8. Berdasarkan data berikut:
Ksp X(OH)2 = 2,8 × 10–10
Ksp Y(OH)2 = 4,5 × 10–11
Ksp Z(OH)2 = l,6 × 10–14
Maka hidroksida yang mengendap adalah ....
A.
X(OH)2B. Y(OH)2
C. Z(OH)2
D. X(OH)2dan Y(OH)2
E. Y(OH)2 dan Z(OH)2
Jawab : C
Endapan akan terjadi jika : Q > Ksp
Jika diasumsikan bahwa NaOH yang ditambahkan adalah padat maka volume larutan tidak berubah, maksudnya konsentrasi ion pada awal reaksi sama dengan konsentrasi sebelum penambahan NaOH.
Disebabkan Molaritas ionnya sama , maka cukup dicari satu harga Q saja:
pH akhir = 8 maka pOH = 14-8 = 6
[OH-] = 1 x 10-6
Untuk X(OH)2 , Q = [X2+] [OH-]2 = [ 10-1] [10-6]2 = 10-13
Q < Ksp X (OH)2 dan Y(OH)2 : tidak mengendap
Q > Ksp Z(OH)2 : mengendap
°
Senyawa Lakmus
Merah Biru
A NaCN Biru Biru
B NH4CH3COO Merah Merah
C NaCN Biru Biru
D NH4Cl Merah Merah
Pembahasan :
Mol air = massa/Mr = 72/18 mol = 4 mol Mol glikol = 62/62 mol = 1 mol
Tekanan uap air ( Po ) = 18 mmHg
P = X pelarut Po = 4/(1+4) x 18 = 72/5 mmHg = 14,4 mmHg
15. Perhatikan gambar berikut:
A. −8 °C D. −0,8 °C
B. −4 °C E. −0,4 °C
C. −2 °C Jawab : D
Pembahasan :
Urea adalah zat non elektrolit : Penurunan titik beku urea = 2oC
∆ Tf = m x Kf 2 = 1 x Kf Kf = 2 oC / m
Maka untuk larutan NaCl ( elektrolit kuat ) harga i = 2 ∆ Tf = m x Kf x i = 0,2 x 2 x 2 = 0,8 Titik beku naCl 0,2 m = - 0,8 0C
16. Pembuatan koloid yang tergolong cara dispersi adalah . . .
A
. redoks dan pergantian pelarut D. agregasi dan kondensasi B. peptisasi dan busur Bredig E. hidrolisis dan busur Bredig C. cara mekanik dan pergantian pelarutJawab : B
17. Proses berikut ini berkaitan dengan sifat-sifat koloid, kecuali . . . .
A.
penyaringan asap industriB. pembentukan delta di muara sungai
C. desinfeksi air minum dengan menambahkan kaporit D. penghilangan bau udara dengan arang
E. cara kerja mesin cuci darah Jawab : C
18. Hasil utama adisi HBr pada 3,4-dimetil-2-pentena adalah . . . .
A.
3-bromo-3,4-dimetilpentanaB. 2-bromo-3,4-dimetilpentana C. 3-bromo-2,3-dimetilpentana D. 4-bromo-2,3-dimetilpentana E. 1-bromo-3,4-dimetilpentana Jawab : A
Pembahasan :
CH
3CH
3CH
3CH
3CH
3– CH = C – CH – CH
3+ H-Br
à
CH
3– CH
2- C – CH – CH
3Br
19. Senyawa berikut yang berisomer dengan asam butanoat adalah . . . .
A. etil asetat B. metil etil keton
C. 2-metilpropanal
D. dietil eter E. isobutyl alkohol
Jawab : A
Pembahasan :
Etil asetat berisomer fungsi dengan asam butanoat.
C
3H
7COOH ( asam butanoat ) , CH
3COOC
2H
5( etil asetat )
20. Pasangan antara senyawa dan kegunaannya yang tepat adalah...
Senyawa Kegunaan
A CF2Cl2 Antiseptik
B CHCl3 Refrigerant
C CHI3 Pembius
D C6H5OH Desinfektan
Pembahasan :
Data yang benar :
Senyawa Kegunaan
A CF2Cl2 ( Freon ) Refrigerant
( pendingin )
B CHCl3 ( kloroform ) Pembius
C CHI3 ( iodoform ) Antiseptik
D C6H5OH ( fenol) Desinfektan
E C6H5COOH asam benzoat ) Pengawet
21. Dari reaksi: dapat terbentuk suatu . . . .
A. karbohidrat D. alkohol
B. ester E. aldehida
C. keton Jawab : B
Pembahasan :
Terjadi reaksi esterifikasi ( pembentuka ester )
Asam Propanoat + methanol ---- > metal propanoat ( ester ) + air
22. Suatu senyawa turunan benzena memiliki sifat-sifat:
Ø Dibuat dengan cara oksidasi toluena
Ø digunakan sebagai bahan pengawet
senyawa dengan cirri-ciri tersebut memiliki rumus struktur....
Jawab : B
23. Pasangan yang tepat antara nama polimer, monomer, jenis reaksi dan kegunaannya adalah....
Polimer Monomer Reaksi Kegunaan
A Teflon Tetra flouroetena adisi Zat anti lengket
B Protein Asam amino Adisi Pembangun sel
C Karbohidrat Glukosa Adisi Sumber energi
D PVC Vinil klorida Kondensasi Pipa air
E Karet alam Isopren kondensasi Ban mobil
Jawab : A
Pembahasan :
Data yang benar :
Polimer Monomer Reaksi Kegunaan
A Teflon Tetra flouroetena adisi Zat anti lengket
B Protein Asam amino kondensasi Pembangun sel
C Karbohidrat Glukosa Kondensasi Sumber energi
D PVC Vinil klorida Adisi Pipa air
E Karet alam
(poli isoprena) Isoprena Adisi Ban mobil
24. Suatu karbohidrat memiliki ciri-ciri:
Ø Bersifat optis aktif putar kanan.
Ø Tidak dapat mereduksi larutan fehling dan tollens.
Ø Dapat mengalami hidrolisis menghasilkan glukosa dan fruktosa
Diperkirakan senyawa tersebut adalah ....
A. galaktosa B. glukosa
C. sukrosa
D. maltosa
25. Proses pelarutan beberapa zat terjadi perubahan suhu sebagai berikut:
Pernyataan yang benar dari proses pelarutan tersebut adalah... .
A. Zat V bersifat endoterm karena sistem melepaskan panas B. Zat R bersifat eksoterm karena sistem menyerap panas C. Zat P dan zat T bersifat eksoterm karena suhunya turun D. Zat P dan V bersifat eksoterm karena sistem mengambil panas E. Zat R dan zat V bersifat eksoterm karena sistem melepas panas Jawab : E
Pembahasan :
Reaksi eksoterm : terjadi kenaikan suhu ( system melepaskan kalor )
Reaksi endoterm : terjadi penurunan suhu ( system menyerap kalor ) T
250C
U
150C
V
250C
W
450C R
250C
S
280C P
A
250C
Q
26. Diketahui energi ikatan:
C = C : 612 kJ mol−1 ; C − C : 348 kJ mol−1; H − O :463 kJ−1 C − O : 358 kJ mol−1 ; C − H : 414 kJ mol−1
Berdasarkan data di atas, dapat diramalkan besarnya entalpi reaksi:
CH2 = CH2 + H2O → CH3− CH2− OH adalah . . . .
A. −309 kJ mol−1 D. +309 kJ mol−1 B. −45 kJ mol−1 E. +355 kJ mol−1 C. + 45 kJ mol−1
H H H H
C
=
C + H – O
à
H – C – C – O - H
H H H H H
Kiri ( reaktan )
4 x C – H = 4 x 412 kJ /mol = 1648 kJ/mol
1 x C = C = 1 x 609 kJ/mol = 609 kJ/mol
2 x H – O = 2 x 463 kJ/mol = 926 kJ/mol
Total = 3183 kJ/mol
Kanan ( produk )
5 x C – H = 5 x 412 kJ /mol = 2060 kJ/mol
1 x C ─ C = 1 x 345 kJ/mol = 345 kJ/mol
1 x C ─ O = 1 x 358 kJ/mol = 358 kJ/mol
1 x H – O = 1 x 463 kJ/mol = 463 kJ/mol
Total = 3226 kJ/mol
27. Untuk reaksi: A + B → hasil, ternyata:
1. Bila konsentrasi awal A dinaikkan jadi dua kali, pada konsentrasi B yang tetap, kecepatan reaksi dua
kali lebih besar.
2. Bila konsentrasi awal A dan B masing-masing dinaikkan dua kali, kecepatan reaksi jadi delapan kali
lebih besar.
Persamaan kecepatan reaksi tersebut ialah . . . . A. k [A]
B. k[A]2 C. k [A][B] D. k[A]2[B]2 E. k[A][B]2
Jawab : E
Pembahasan :
Terjemahkan kalimat menjadi persamaan :
1.
Bila konsentrasi awal A dinaikkan jadi dua kali, pada konsentrasi B yang tetap, kecepatan reaksi dua
kali lebih besar.
Jika V
1= 1 maka V
2= 2
V
1 == >A
X= 1
V
22A 2
X = 1
2.
Bila konsentrasi awal A dan B masing-masing dinaikkan dua kali, kecepatan reaksi jadi delapan kali
lebih besar.
Jika V
1= 1 maka V
2= 8
V
1 == >A
1B
Y= 1
V
22A 2B 8
y = 2
28. Perhatikan gambar ilustrasi berikut:
Laju reaksi yang diduga berlangsung paling cepat terdapat pada percobaan nomor... .
A. (1) B. (2) C. (3) D. ( 4) E. (5)
Jawab : E
29. Besi pijar dapat bereaksi dengan uap air membentuk gas hidrogen menurut reaksi kesetimbangan,
3Fe(s) + 4H2O(g) ⇔ Fe3O4(s) + 4H2(g) ∆H = −144 kJ
Konsentrasi kesetimbangan gas hidrogen akan bertambah jika . . . .
A. Tekanan diperbesar
B. Ditambah besi
C. Digunakan katalis D. Volum diperbesar E. Temperatur dinaikkan
Jawab : B
30. Sebanyak 1 mol gas SO3 dipanaskan dalam ruang bervolume 5 liter, membentuk gas SO2 dan gas O2, saat
kesetimbangan tercapai diperoleh gas O2 sebanyak 0,25 mol. Pada keadaan tersebut tetapan
kesetimbangan Kc adalah . . . .
A. 0,01
B. 0,05
C. 0,25 D. 10,0 E. 20,0 Jawab : B
Pembahasan :
2 SO3 (g) <--> 2SO2 (g) + O2 (g)
Mula2 : 1 mol - - Reaksi : 0,5 mol 0,5 mol 0,25 mol Setimbang : 0,5 mol 0,5 mol 0,25 mol
Kc = [SO2]2 [O2] = [0,5/5]2 [0,25/5] = 0,05
31. Di antara reaksi-reaksi berikut :
(1) Zn(s) + Sn2+(aq) → Zn2+(aq) + Sn(s)
(2) 2CrO42−(aq) + 2H+(aq) → Cr2O72−(aq) + H2O(l)
(3) Mg(s) + 2H+(aq) → Mg2+(aq) + H2(g)
(4) Ca(OH)2(aq) + CO2(g) → CaCO3(s) + H2O(l)
yang merupakan reaksi redoks adalah . . . .
A.
1,2,3, dan 4B.
1,2 dan 3C.
1 dan 3D.
2 dan 4E.
4Jawab : C
32. Perhatikan gambar sel volta berikut ini:
Jika Eo Zn = - 0.76 volt dan Eo Cu = +0.34 volt, maka pernyataan yang benar adalah....
A. Anode Cu, katode Zn
B. Katodenya ( – ) sedangkan anodenya ( + ) C. Potensialnya sel -1,10 Volt
D. Potensialnya sel +0,42 Volt E. Potensialnya sel +1,10 Volt Jawab : E
Pembahasan :
Potensial sel = besar – kecil = +0,34 v – (-0,76 ) v = + 1,10 volt
33. Perhatikan gambar elektrolisis berikut:
Jika digunakan elektrode karbon, maka reaksi yang terjadi pada katoda adalah….
A. 2H2O(l) + 2e à H2(g) + 2OH-(aq)
B. Na+(aq) + 1e à Na(s) C. Na(s) à Na+(aq) + 1e D. 2H2O(l) à O2(g) + 4H
+
(aq) + 4e E. 2Cl-(aq) à Cl2(g) + 2e
34. Arus listrik 20 ampere dialirkan ke dalam larutan H2SO4 melalui elektrode-elektrode karbon selama 4825
detik, Volume gas yang dihasilkan di katoda pada (0oC, 1 atm) adalah ….(1 Faraday = 96.500 C/mol) A. 0,56 liter
B. 1,12 liter C. 6,72 liter D. 11,20 liter E. 22,40 liter Jawab : D
Pembahasan :
H2SO4 -- > 2 H+ + SO4
2-Katoda : 2H+ (aq) + 2 e ---> H2 (g)
1 F setara dengan 1 mol elektron
Faraday = (i x t ) / 96.500 = ( 20 x 4825)/96.500 F = 1 F Jumah elektron yang terlibat setara denga 1 F yaitu = 1 mol
Katoda : 2H+ (aq) + 2 e ---> H2 (g)
Berdasarkan perbandingan koefisien , jika elektron = 1 mol maka gas H2 = ½ x 1 mol =0,5 mol
Volume gas H2 = 0,5 mol x 22,4 L/mol = 11,2 L
35. Diketahui potensial reduksi:
Fe2+(aq) + 2e →Fe(s) E° = –0,44 volt
Cu2+(aq) + 2e→Cu(s) E° = +0,34 volt
Zn2+(aq) + 2e→Zn(s) E° = –0,76 volt
Mg2+(aq)+2e →Mg(s) E° = –2,37 volt
Sn2+(aq) + 2e→Sn(s) E° = –0,14 volt
Ni2+(aq) +2e →Ni(s) E° = −0,25 volt
Besi paling lama berkarat, apabila dihubungkan dengan logam....
A. Sn
B. Zn
36. Batuan yang mengandung Aluminium adalah…. A. Kaolin dan pirit
B. Magnetit dan kriolit C. Bauksit dan kriolit D. Gypsum dan dolomit E. Pirit dan bauksit
Jawab : C
Kaolin : Al2O3.2SiO2.2H2O
Pirit : FeS2
Magnetit : Fe3O4
Bauksit : Al2O3
Kriolit : Na3AlF6
Gypsum : CaSO4.2H2O
37. Berbagai sifat unsur berikut: 1. energi ionisasi relatif tinggi 2. bersifat paramagnetik
3. mempunyai beberapa bilangan oksidasi 4. membentuk senyawa kompleks
5. membentuk senyawa berwarna
Sifat yang umum dimiliki unsur transisi adalah . . . .
A. 1, 2 dan 3
B. 1, 3 dan 5
C. 2, 3, 4 dan 5 D. 1, 2, 3 dan 4 E. 1,2,3,4 dan 5
Jawab : C
Pembahasan :
Energi ionisasi unsur transisi relatif rendah ( kurang dari 1000 kJ/mol ), bandingkan dengan unsur He yg energi ionisasinya = 2640 kJ/mol )
38. Reaksi yang menghasilkan partikel beta (α) adalah...
A. 8O17 → 8O16 + …..
B. 6C 13
→ 5B 13
+ …..
C. 13Al26 → 11 Na24 + …..
D. 92U 238
→ 90Th 234
+ …..
E. 6C14 → 7B14 + …..
39. Pada pembuatan baja digunakan oksigen dan kapur (CaO). Fungsi dari kedua bahan ini adalah . . . .
Oksigen Kapur
A. mengurangi kadar karbon mengikat pengotor
B. campuran bahan bakar mengikat pengotor
C. mengurangi kadar karbon sumber logam alloi
D. campuran bahan bakar sumber kalsium
E. mengoksidasi besi(II) menjad besi(III) membentuk terak Jawab : B
Pembahasan :
Fungsi :
Kokas ( C) = sebagai reduktor
Kapur ( CaO ) = mengikat zat pengotor
Oksigen = mengurangi kadar karbon
40. Pasangan yang tepat tentang unsur/senyawa, proses pembuatan dan kegunaan dalam kehidupan sehari-hari adalah….
Unsur Proses pembuatan Kegunaan
A Aluminium Tanur tinggi Peralatan rumah tangga
B Besi Proses kontak Bahan bangunan
C Asam sulfat Hall – Herault Obat-obatan
D Belerang Frasch pelarut
E Magnesium Down Antasida
Jawab : -
Pembahasan :
Proses Dow = adalah suatu proses elektrolisis MgCl2 yang menghasilkan logam Mg dan gas Cl2