BAB II
TINJAUAN PUSTAKA
2.1 Bentonit
Bentonit merupakan suatu lempung yang terutama terdiri dari monmorilonit. Selain monmorilonit, bentonit juga mengandung sedikit kuarsa, kalsit, dolomite dan feldspar (Alemdar et. al. 2005). Bentonit terjadi karena adanya proses devitrivikasi abu vulkanik. Proses ini dipengaruhi oleh adanya air, seperti air laut, danau alkali atau air segar lainnya. Istilah bentonit pertama kali digunakan untuk lempung yang ditemukan oleh Fort Benton seorang ahli geologi Amerika pada tahun 1890 di Wyoming, Amerika Serikat.
Bentonit memiliki warna yang bervariasi, diantaranya putih, krem, kuning, abu-abu, merah muda dan kuning kehijauan. Bentonit dibedakan menjadi dua jenis, yaitu Natrium bentonit (swelling bentonit) dan Kalsium bentonit (non-swelling bentonit). Na-bentonit memiliki kemampuan mengembang ((non-swelling) yang lebih besar daripada Ca-bentonit ketika dimasukan ke dalam air. Kendati demikian Ca-bentonit dapat menyerap dengan baik dalam keadaan alami maupun diaktifasi. Perbedaan sifat Ca-bentonit dan Na-bentonit disajikan dalam Tabel berikut:
Tabel 2.1. Perbedaan sifat Na-bentonit dan Ca-bentonit
No Sifat Fisik Na-bentonit Ca-bentonit
1. Daya mengembang*, ** Sangat baik Tidak baik 2. Kekuatan dalam keadaan basah* Sedang Tinggi 3. Perkembangan daya ikat* Sedang Cepat
4. Kekuatan tekanan* Tinggi Sedang
5. Daya tahan terhadap penyusutan* Tinggi Rendah 6. Daya mengalirkan pasir* Sedang Sangat baik 7. Warna dalam keadaan kering** Putih atau
krem
Abu-abu, biru, kuning, merah atau coklat 8. Perbandingan Na dan Ca** Tinggi Rendah
9. pH suspensi koloidal** 8,5 – 9,8 4-7 Sumber : *Kunrat (1994) dan **Tirani (2006)
Monmorilonit yang merupakan penyusun utama bentonit dengan luas permukaan 750 m2/gram bentonit. Monmorilonit termasuk ke dalam golongan smektit dengan rumus kimia (Na,Ca)0.33(Al,Mg)2(Si4O10)(OH)2·nH2O. Struktur
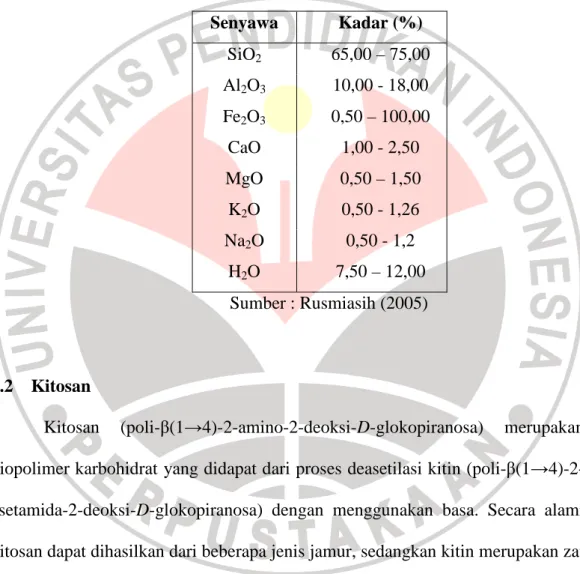
monmorilonit terdiri atas lapisan alumina oktrahedral yang terdapat diantara dua lapisan silika tetrahedral. Atom yang terdapat di masing-masing lapisan adalah oksigen. Ketiga unit lapisan ini rigid dengan oksigen sebagai pembatas dengan lapisan lainnya, seperti terlihat pada gambar berikut:
Gambar 2.1 Struktur montmorillonit Sumber: Othmer (2005)
Di lapisan tetrahedral, kation Si4+ seringkali digantikan oleh kation Al3+, padahal pada lapisan oktrahedral juga dimungkinkan adanya subtitusi Al oleh Fe atau Mg. Subtitusi isomorfik ini menyebabkan permukaan montmorilonit bermuatan negatif sehingga memungkinkan terjadinya adsropsi kation di daerah interlayer (Grim, 1986). Keberadan kation anorganik di daerah interlayer tersebut menyebabkan bentonit bersifat hidrofilik. Karakteristik montmorilonit disajikan dalam tabel berikut:
Tabel 2.2 Karakteristik Monmorilonit
Karakteristik Nilai
Massa jenis 2,2-2,8 gram/L
Massa molekul relatif 549,07 gram/mol
Indeks bias 1,547-1,557
Titik leleh 1330-1430
Penyebaran bentonit di Indonesia terdapat di Pulau Jawa, Sumatera, Kalimantan Tengah dan Selawesi Selatan. Bentonit yang terdapat di Indonesia
pada umumnya merupakan jenis Kalsium Bentonit (Ca-bentonit), salah satunya terdapat di daerah Karangnunggal, Tasikmalaya. Komposisi kimia bentonit yang berasal dari Karangnunggal Tasikmalaya yang telah dianalisis oleh PD. Agribisnis dan Pertambangan ditunjukkan pada Tabel 2.3.
Tabel 2.3. Komposisi kimia bentonit Senyawa Kadar (%) SiO2 65,00 – 75,00 Al2O3 10,00 - 18,00 Fe2O3 0,50 – 100,00 CaO 1,00 - 2,50 MgO 0,50 – 1,50 K2O 0,50 - 1,26 Na2O 0,50 - 1,2 H2O 7,50 – 12,00 Sumber : Rusmiasih (2005) 2.2 Kitosan
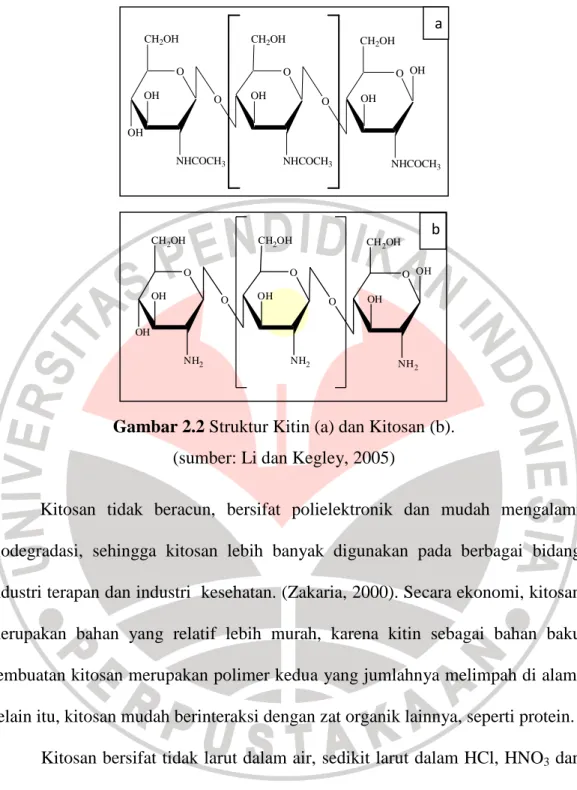
Kitosan (poli-β(1→4)-2-amino-2-deoksi-D-glokopiranosa) merupakan biopolimer karbohidrat yang didapat dari proses deasetilasi kitin (poli-β(1→4)-2-asetamida-2-deoksi-D-glokopiranosa) dengan menggunakan basa. Secara alami kitosan dapat dihasilkan dari beberapa jenis jamur, sedangkan kitin merupakan zat penyusun utama pada kulit/cangkang Crustaceace. Suatu kitin dapat dikatakan telah menjadi kitosan apabila derajat deasetilasinya telah mencapai 70%-80%. Perbedaan struktur selulosa, kitin dan kitosan terlihat pada gambar berikut:
O OH OH NH2 O CH2OH O OH NH2 O CH2OH O OH NH2 OH CH2OH
Gambar 2.2 Struktur Kitin (a) dan Kitosan (b). (sumber: Li dan Kegley, 2005)
Kitosan tidak beracun, bersifat polielektronik dan mudah mengalami biodegradasi, sehingga kitosan lebih banyak digunakan pada berbagai bidang industri terapan dan industri kesehatan. (Zakaria, 2000). Secara ekonomi, kitosan merupakan bahan yang relatif lebih murah, karena kitin sebagai bahan baku pembuatan kitosan merupakan polimer kedua yang jumlahnya melimpah di alam. Selain itu, kitosan mudah berinteraksi dengan zat organik lainnya, seperti protein. Kitosan bersifat tidak larut dalam air, sedikit larut dalam HCl, HNO3 dan
H3PO4, namun tidak larut dalam H2SO4. Dalam air, kitosan dapat larut jika
kondisi air memiliki pH di bawah 4. Namun kelarutan kitosan ini akan menurun dengan semakin tingginya derajat deasetilasi.
O OH OH NHCOCH3 O CH2OH O OH NHCOCH3 O CH2OH O OH NHCOCH3 OH CH2OH a b
Kitosan memiliki konstanta disosiasi asam (Ka) yang dipengaruhi oleh derajat deasetilasi. Peningkatan derajat deasetilasi akan meningkatkan Ka dan kelarutan kitosan (Domard dalam Li dan Kegley, 2005).
Kitosan merupakan adsorben yang baik untuk logam berat, seperti Cu dan juga untuk senyawa organik, baik netral maupun bermuatan. (Wu et al, 1999). Hal ini dikarenakan adanya gugus amino (-NH2) dan hidroksil (-OH) yang reaktif
pada rantai polimer dan dapat digunakan untuk ikatan koordinasi. Kemampuan sebagai agen pengkelat dan elektrolitnya ditentukan oleh derajat protonasi dari gugus –NH3+ (pK=6,3), derajat protonasi ini tergantung pada keasaman (pH) (Dambies et al, 2001). Walaupun kitosan menunjukan hasil yang baik sebagai adsorben, di dalam air kitosan akan sangat mengembang dan kitosan memilki daya apung tinggi, sehingga kitosan sulit digunakan sebagai adsorben baik di model batch maupun kolom. Sifat fisik dari kitosan ini dapat diperbaiki, jika kitosan diadsorpsikan pada bentonit (Dultz et al, 2006).
2.3 Kitosan-Bentonit
Pada tahun 1980-an, untuk pertama kalinya Wolfe memperkenalkan organoclay, yaitu suatu lempung yang dimodifikasi dengan senyawa organik. Tujuan dari modifikasi ini adalah untuk meningkatkan daya adsorpsi lempung terhadap polutan organik, dengan memodifikasi monmorilonit dengan senyawa amina alifatik. Salah satu organoclay yang banyak dikembangkan saat ini adalah organo-bentonit.
Organo-bentonit dibuat dengan cara mempertukarkan kation anorganik (seperti Na+, Ca2+ dan H+) pada daerah interlayer dan outlayer. Hal ini dapat dilakukan karena adanya subtitusi isomorfik pada lapisan oktahedral dan tetrahedral. Subtitusi isomorfik ini diimbangi dengan adanya pertukaran kation. Modifikasi bentonit dengan senyawa organik dilakukan untuk meningkatkan kinerjanya, terutama untuk keperluan adsorpsi senyawa organik dalam air minum (Akcay et al., 1999).
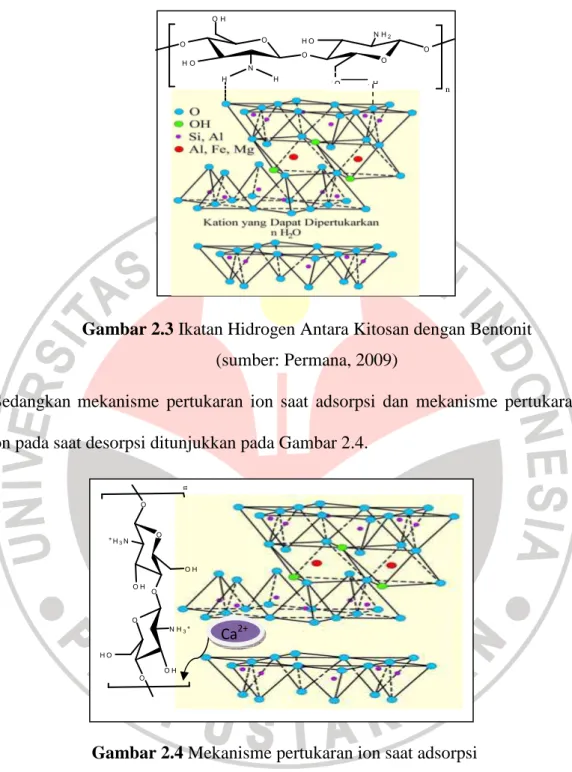
Salah satu organo-bentonit yang saat ini sedang diteliti adalah kitosan-bentonit. Aldiantono (2009), telah berhasil mensintesis kitosan-bentonit dengan perbandingan 1:180 pada kecepatan pengadukan 160 rpm. Setelah dilakukan uji kinerja adsorpsi terhadap pestisida didapat bahwa kitosan-bentonit dapat mengadsorpsi diazinon sebesar 79,04%. Permana (2009), telah melakukan penelitian mengenai mekanisme adsorpsi kitosan terhadap bentonit. Mekanisme yang terjadi ketika kitosan berinteraksi dengan bentonit didominasi oleh interaksi ikatan hidrogen (91,37), pertukaran ion (5,18%), dan 3,45% kontribusi interaksi kitosan dengan bentonit diduga terjadi melalui mekanisme lainnya seperti interaksi ion-dipol, dipol-dipol, atau dipol-dipol terinduksi. Gambar 2.3 menunjukan ikatan hidrogen yang terjadi antara atom H yang terikat pada atom N dari molekul kitosan dengan atom O pada bentonit.
Gambar 2.3 Ikatan Hidrogen Antara Kitosan dengan Bentonit (sumber: Permana, 2009)
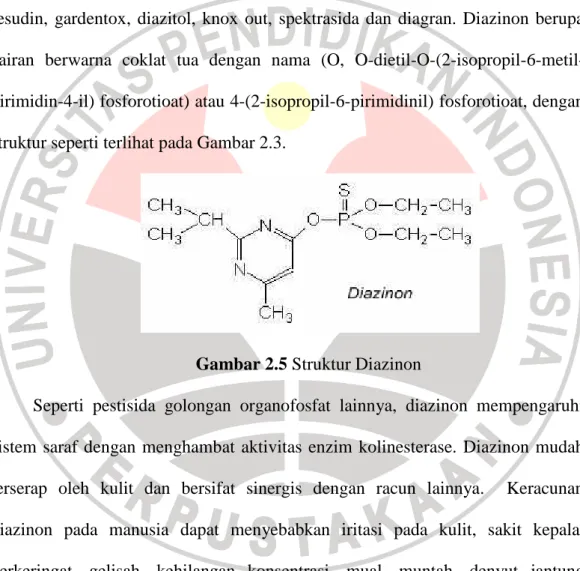
Sedangkan mekanisme pertukaran ion saat adsorpsi dan mekanisme pertukaran ion pada saat desorpsi ditunjukkan pada Gambar 2.4.
Gambar 2.4 Mekanisme pertukaran ion saat adsorpsi (sumber: Permana, 2009) O O H O O H N H2 O O N O H O H O n H H O H O O O H O H +H3N O O N H3+ H O O O H n Ca2+
2.4 Diazinon
Diazinon merupakan salah satu pestisida golongan organofosfat yang digunakan untuk membasmi kutu, ngengat, kecoa dan tungau. Diazinon banyak digunakan dalam bidang pertanian, perkebunan dan perhutanan. Diazinon dikenal dengan nama dagang dianon, dizinon, antigal, alfa tox, basudin, galesan, nipsan, fesudin, gardentox, diazitol, knox out, spektrasida dan diagran. Diazinon berupa cairan berwarna coklat tua dengan nama (O, O-dietil-O-(2-isopropil-6-metil-pirimidin-4-il) fosforotioat) atau 4-(2-isopropil-6-pirimidinil) fosforotioat, dengan struktur seperti terlihat pada Gambar 2.3.
Gambar 2.5 Struktur Diazinon
Seperti pestisida golongan organofosfat lainnya, diazinon mempengaruhi sistem saraf dengan menghambat aktivitas enzim kolinesterase. Diazinon mudah terserap oleh kulit dan bersifat sinergis dengan racun lainnya. Keracunan diazinon pada manusia dapat menyebabkan iritasi pada kulit, sakit kepala, berkeringat, gelisah, kehilangan konsentrasi, mual, muntah, denyut jantung melemah, sakit perut, diare, pingsan, koma dan kematian. Pada manusia nilai LD50 diazinon sebesar 340-400 mg/kg berat badan, sedangkan ambang batas
konsentrasinya dalam air sebesar 0,014 mg/L. Beberapa sifat fisik dan kimia dari diazinon, disajikan dalam Tabel 2.4:
Tabel 2.4 Sifat Fisika dan Kimia Diazinon Rumus molekul C12H21N2O3PS
Massa Molekul Relatif 304,36 gram/mol Warna tak berwarna sampai coklat Kelarutan Air, eter, alkohol, benzena Kelarutan (H2O, 20oC) 40 mg/L
Massa Jenis (20oC) 1,116-1,118
Titik Didih 120oC
Tekanan Uap (200C) 1,9 x 10-2
2.5 Adsorpsi
Adsorpsi merupakan suatu proses pengikatan molekul oleh permukaan luar padatan atau oleh permukaan cairan (Benefield et al., 1982), sedangkan menurut Lyman (dalam Khoerunnisa, 2005) adsorpsi merupakan proses yang melibatkan pemusatan subtansi adsorbat pada permukaan adsorben yang dapat terjadi pada antarmuka antara dua fasa, misalnya fasa cair dengan fasa cair, fasa gas dengan fasa cair, fasa gas dengan fasa padat, dan fasa cair dengan fasa padat.
Adsorpsi dapat juga terjadi karena adanya interaksi pada permukaan adsorben. Berdasarkan besarnya interaksi antara adsorbat dengan adsorben, adsorpsi dibedakan menjadi dua yaitu adsorpsi fisika (physisorption) dan adsorpsi kimia (chemisorption).
Pada adsorpsi fisika terjadi proses interaksi antara adsorben dengan adsorbat yang melibatkan gaya-gaya antar molekul seperti gaya van der Waals. Ikatatan yang dihasilkan pada adsorpsi fisika merupakan ikatan yang lemah, yaitu
molekul yang teradsorpsi dapat dilepaskan kembali dengan cara menurunkan tekanan gas atau konsentrasi zat. Sedangkan adsorpsi kimia melibatkan ikatan koordinasi sebagai hasil pemakaian elektron oleh adsorben dan adsorbat (Oscik, 1982). Menurut Adamson, batas minimal energi adsorpsi kimia adalah 20,92 kJ/mol. Sedangkan menurut Oscik perkiraan harga energi adsorpsi kimia berkisar antara 80-650 kJ/mol dan menurut Lyman besar energi adsorpsi kimia adalah sebesar 42 - 420 kJ/mol (Khoerunnisa, 2005). Menurut Benefield (1984), faktor-faktor yang mempengaruhi adsorpsi adalah karakteristik adsorben, kelarutan adsorbat, ukuran molekul adsorbat, keasaman (pH), suhu dan kejenuhan adsorbat.
2.5.1 Isoterm Adsorpsi
Isoterm adsorpsi merupakan suatu persamaan matematis yang dikembangkan untuk menggambarkan distribusi kesetimbangan molekul teradsorpsi diantara fasa cair dan fasa padat yang dilakukan pada suhu tetap. Persamaan yang sering digunakan untuk menjelaskan isoterm adsorpsi adalah persamaan isoterm Langmuir dan persamaan isoterm Freundlich.
Pada tahun 1918, menggambarkan model sederhana pada permukaan zat padat pada saat terjadi adsorpsi ke dalam suatu persamaan. Persamaan Langmuir merupakan teori untuk adsorpsi yang terjadi pada permukaan datar (flat surface), yang didasarkan dari sudut pandang kinetika, dimana terjadi proses kontinu pada saat molekul teradsorpsi dan yang terdesorpsi di permukaan hingga terjadinya kesetimbangan.
Asumsi dari model persamaan Langmuir adalah:
1. Seluruh permukaan adsorben adalah homogen (seragam), sehingga energinya konstan (tetap) di semua situs.
2. Adsorpsi pada permukaan terlokalisasi, sehingga atom atau molekul adsorbat teradsorpsi pada situs yang terlokalisasi.
3. Masing-masing situs aktif adsorben hanya dapat mengadsorpsi hanya satu atom atau molekul adsorbat.
Dengan kata lain, Langmuir mengasumsikan bahwa permukaan zat padat seragam, dan molekul adsorben tidak berinteraksi satu sama lain. Pada permukaan adsorben terdapat situs aktif yang sebanding dengan luas permukaan. Setiap situs aktif hanya memungkinkan untuk dapat mengadsorpsi satu molekul sehingga laju pengadsorpsi akan menjadi satu lapisan tebal. Semua bagian yang mengadsopsi memiliki afinitas yang sama terhadap molekul adsorbat dan molekul yang telah teradsorpi pada satu sisi tidak mempengaruhi adsorpsi molekul pada sisi yang lain, dengan demikian adsorpsi hanya terbatas pada pembentukan lapisan tunggal (monolayer). Berikut merupakan persamaan Isoterm Langmuir:
q = q
୫ KadsCଵାKadsC
…(1)
Keterangan:
q = densitas adsorpsi (massa adsorbat/massa adsorben)
qm = kapasitas maksimum adsorben untuk adsorbat (massa
adsorbat/massa adsorben)
C = konsentrasi adsorbat pada saat setimbang (massa/volum)
Persamaan isoterm adsorpsi Langmuir di atas dapat ditulis dalam bentuk persamaan linier yaitu :
m mKads C q q q 1 1 1 1 = + ....(2)
dengan mengukur q sebagai fungsi C dan memplot (1/q) terhadap (1/C), maka nilai
(1/qmKads) dan (1/qm) dapat ditentukan dari slop dan intersep.
2.5.2 Kinetika Adsorpsi
Kinetika adsorpsi penting untuk dipelajari dalam aplikasi pengolahan limbah pada air. Parameter yang sering dipakai untuk menentukan kinetika adsorpsi adalah laju adsorpsi (k) dan tetapan kesetimbangan adsorpsi (K), yang nilainya khas untuk setiap reaksi. Nilai tetapan laju adsorpsi memberikan gambaran tentang kecepatan suatu adsorbat teradsorpsi ke dalam suatu adsorben. Jika tetapan laju adsorpsinya besar, maka adsorben dapat mengadsorpsi adsorbat dengan cepat.
Kinetika adsorpsi bergantung pada interaksi antara adsorben dengan adsorbat dan kondisi sistem. Hal lain yang erat kaitannya dengan laju adsorpsi adalah proses difusi. Jenis difusi yang terjadi pada gugus aktif adsorben dapat dibedakan menjadi dua yaitu difusi fisika dan difusi kimia. Menurut Effendi (dalam Ferdiyana, 2007) difusi fisika merupakan difusi perpindahan massa yang disebabkan tumbukan molekul adsorbat dengan adsorben. Sedangkan difusi kimia merupakan suatu proses adsorpsi molekul adsorbat terikat dalam gugus aktif adsorben.
Difusi kimia melalui tahapan berikut :
1. Perpindahan adsorbat dari fasa larutan menuju permukaan yang mengelilingi partikel adsorben,
2. Perpindahan adsorbat melewati lapisan bidang batas menuju permukaan adsorben,
3. Difusi adsorbat dari permukaan adsorben menuju bagian situs aktif adsorben,
4. Pengikatan adsorbat secara fisika atau kimia pada bagian situs aktif adsorben.
Penentuan parameter kinetika adsorpsi dapat menggunakam persamaan kinetika adsorpsi. Model kinetika Langmuir–Hinshelwood dapat digunakan untuk menetapkan laju adsorpsi. Menurut Jin dkk dalam (Khoerunnisa, 2005), model ini memberikan persamaan :
)
3
....(
)
(
)
/
o
ln(
K
Ca
Co
kt
Ca
Co
Ca
C
−
−
=
−
Keterangan;Co = konsentrasi awal adsorbat
Ca = konsentrasi akhir adsorbat setelah adsorpsi
t = waktu kontak adsorbat dengan adsorben K = konstanta kesetimbangan laju adsorpsi k = tetapan laju adsorpsi.
Persamaan di atas menunjukkan harga tetapan kesetimbangan negatif. Secara termodinamika hal ini tidak dimungkinkan karena K = e−∆G0/RT
sehingga tetapan kesetimbangan akan memiliki harga 0<K<∞. Oleh karena itu, pada penelitian ini digunakan persamaan kinetika adsorpsi orde satu yang dikembangkan oleh Santosa (2001).
) 4 ....( ) / ln( K Ca kt Ca Ca Co + =
Besarnya jumlah energi adsorpsi yang terlibat dapat dihitung dengan menggunakan persamaan:
E= RT ln K …. (5)
Keterangan:
E = energi (kJ/mol)
R = konstanta gas (8,314 J/mol K) T = suhu (K)