6
BAB II
TINJAUAN PUSTAKA
2.1
Bentonit
Bentonit adalah istilah pada lempung yang mengandung monmorillonit
dalam dunia perdagangan dan termasuk kelompok dioktohedral. Penamaan jenis
lempung tergantung dari penemu atau peneliti, misal ahli geologi, mineralogi,
mineral industri dan lain-lain (Pusat Penelitian dan Pengembangan Teknologi
Mineral dan Batubara, 2005). Istilah “bentonit” pertama kali diberikan oleh W.C.
Knight untuk jenis clay yang ditemukan dekat Fort Benton, Wyoming atau
Montana USA pada tahun 1898. Istilah bentonit tersebut menjadi umum bagi
lempung yang mempunyai tipe dasar sama seperti yang ditemukan di Fort Benton
tetapi kondisi pembentukannya yang berbeda mengakibatkan perbedaan kapasitas
pengembangan di dalam air.
Bentonit dihasilkan dari pelapukan abu vulkanik dan pada dasarnya
mengandung monmorilonit (Othmer, dalam Deskawati 2007). Bentonit
merupakan lempung jenis smektit, yang kandungan utamanya montmorillonit
yaitu sekitar 85%-90% dan mineral lainnya seperti kalsit, kristobalit, illit, kuarsa
dalam jumlah yang relatif kecil. Rumus kimia dari monmorilonit yaitu
(OH)4Si8Al4O20.xH2O.
Dalam keadaan kering, bentonit memiliki sifat fisik seperti berikut:
Warna
: Bervariasi dari krem sampai kuning kehijauan
Berat jenis
: 2.2 – 2.8 g/L
Indeks bias
: 1.547 – 1.557
Titik lebur
: 1330 – 1430
oC
Struktur Kristal
: Monoklonik
Sementara itu, komposisi senyawa kimia penyusun bentonit ditunjukkan
pada Tabel 2.1 berikut:
Tabel 2.1 Komposisi Kimia Bentonit*
Senyawa Kimia
Kadar (%)
SiO
2Al
2O
3Fe
2O
3MgO
CaO
Na2O
K2O
51,14
19,76
0,83
3,22
1,62
0,11
0,04
*Sumber : http://rruff.geo.arizona.edu/doclib/hom/montmorillonite.pdf.Secara umum bentonit dikelompokkan menjadi dua golongan, yaitu (Pusat
Penelitian dan Pengembangan Teknologi Mineral dan Batubara, 2005):
a.
Natrium-Bentonit (Swelling Bentonit)
Na-bentonit memiliki daya mengembang hingga delapan kali apabila
dicelupkan ke dalam air, dan tetap terdispersi beberapa waktu di dalam air.
Dalam keadaan kering berwarna putih atau krem, pada keadaan basah dan
terkena sinar matahari akan berwarna mengkilap. Perbandingan soda dan
kapur tinggi, suspensi koloid mempunyai pH 8,5-9,8, tidak dapat diaktifkan,
posisi pertukaran diduduki oleh ion-ion natrium (Na
+).
b.
Kalsium-Bentonit (Non Swelling Bentonit)
Tipe bentonit ini kurang mengembang apabila dicelupkan ke dalam air,
dan tetap terdispersi di dalam air, tetapi secara alami atau setelah diaktifkan
mempunyai sifat menyerap yang baik. Perbandingan kandungan Na dan Ca
rendah, suspensi koloidal memiliki pH: 4-7. Posisi pertukaran ion lebih
banyak diduduki oleh ion-ion kalsium dan magnesium. Dalam keadaan kering
berwarna abu-abu, biru, kuning, merah dan coklat. Penggunaan bentonit dalam
proses pemurnian minyak goreng perlu aktivasi terlebih dahulu.
Seperti telah dikemukakan sebelumnya penyusun utama bentonit adalah
monmorillonit yang merupakan sejenis clay mineral, dimana strukturnya terdiri
dari dua lapisan silika tetrahedron yang disispi satu lapisan alumina oktahedron
(2:1). Pada lapisan silika tetrahedron, atom silikon diikat oleh 4 atom oksigen
sedangkan pada lapisan alumina oktahedron atom alumunium atau atom
magnesium dan ion hidroksida diikat oleh 6 atom oksigen. Struktur umum
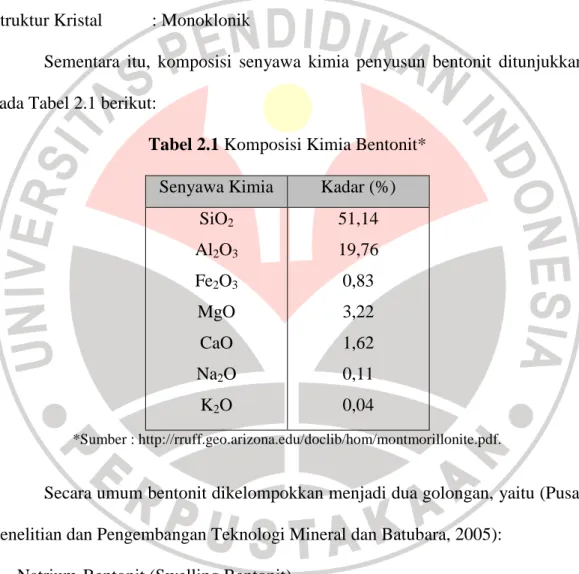
monmorillonit dapat dilihat pada Gambar 2.1 berikut:
Gambar 2.1 Struktur Monmorillonit
Rumus kimia teoritis dari montmorillonit tanpa adanya substitusi adalah
(OH)
4Si
8Al
4O
20.xH
2O, namun substitusi isomorf Si
4+oleh Al
3+pada lapisan
tetrahedral dan Mg
2+atau Zn
2+untuk Al
3+pada lapisan oktahedral menghasilkan
muatan permukaan negatif pada montmorillonit. Muatan ini diimbangi secara
eksternal oleh adanya kation yang dipertukarkan (khususnya Na
+dan Ca
2+) pada
permukaan montmorillonit sehingga rumus ideal untuk montmorillonit adalah
(OH)
4Si
8(Al
3.34Mg
0.66)O
20M
0.66.xH
2O, dimana M dapat berupa Ca, Na, atau Mg.
(Othmer, 1964). Keberadaan kation-kation anorganik tersebut mengakibatkan
karakter hidrofilik pada permukaan montmorillonit sehingga montmorillonit
merupakan adsorben yang sangat polar namun kapasitas adsorpsinya kecil untuk
senyawa organik nonionik
Lapisan tetrahedral
(SiO4 tetrahedral)
Lapisan octahedral
(AlO6, FeO6 oktahedral)
Lapisan tetrahedral
Interlayer
molekul air
Lapisan
lempung
Daerah
interlayer
Kation
interlayer
2.2
Kitosan
Kitosan adalah polimer alam yang merupakan heteropolisakarida polimer
linier derivat dari kitin. Kitin merupakan polimer alam yang keberadaannya
melimpah di alam setelah selulosa. Secara umum kitin banyak terdapat pada
eksoskeleton atau kutikula serangga, crustacea, dan jamur (Tsigos dalam Emma,
2004).
Kitosan merupakan polimer kitin yang telah mengalami proses
penghilangan gugus asetil. Proses penghilangan gugus asetil (CH3-CO) dari
molekul polimer kitin dilakukan dengan menggunakan larutan NaOH yang
disebut dengan proses deasetilasi. Polimer kitosan ataupun kitin akan selalu
berupa komposisi gugus amina dan asetilamin, yang berarti bahwa pada setiap
rantai kitin atau kitosan akan selalu terdapat kedua gugus tersebut secara
bersamaan. Yang membedakan kedua polimer tersebut adalah derajat
desetilasinya (DD). Jika polimer tersebut memiliki derajat deasetilasi lebih besar
dari 50 % maka polimer tersebut dikatakan sebagai kitosan, sebaliknya jika
derajat deasetilasi kurang dari 50 %, maka polimer tersebut dikatakan sebagai
kitin (Li dan Kegley, 2005).
Semakin tinggi derajat deasetilasi yang dimiliki sebuah polimer kitosan
maka semakin tinggi pula kelarutannya. Derajat deasetilasi dapat dihitung melaui
persamaan 2.1.
33
,
1
100
100
×
−
=
OH AmidaA
A
DD
...(2.1)
dengan
A
Amida= puncak serapan gugus amida
AOH
= merupakan puncak serapan gugus OH
1,33 = merupakan faktor koreksi dari A
Amida/ A
OHuntuk kitosan dengan
N-terasetilasi penuh
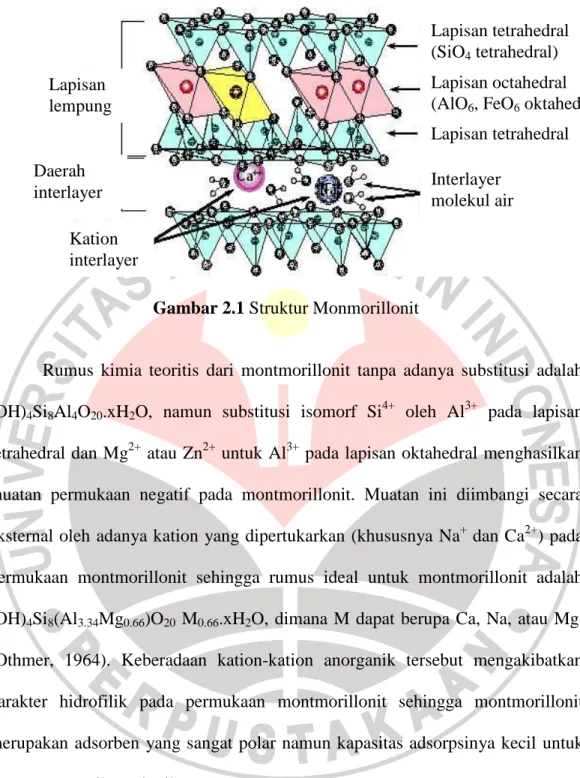
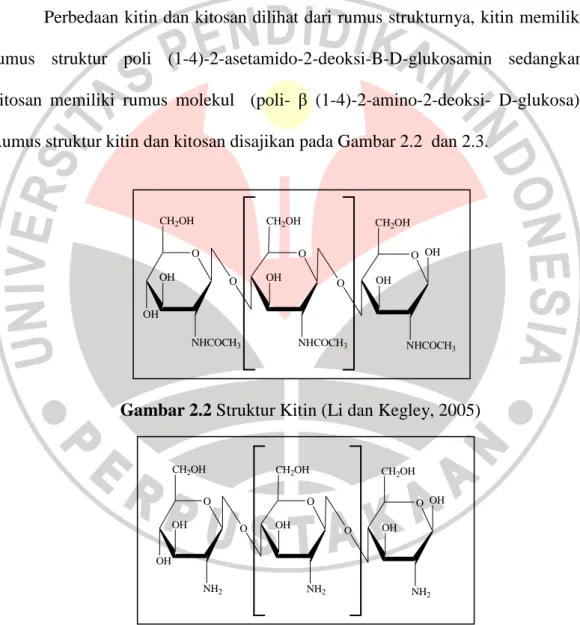
Perbedaan kitin dan kitosan dilihat dari rumus strukturnya, kitin memiliki
rumus struktur poli (1-4)-2-asetamido-2-deoksi-B-D-glukosamin sedangkan
kitosan memiliki rumus molekul (poli- β (1-4)-2-amino-2-deoksi- D-glukosa).
Rumus struktur kitin dan kitosan disajikan pada Gambar 2.2 dan 2.3.
Gambar 2.2 Struktur Kitin (Li dan Kegley, 2005)
O OH OH NH2 O CH2OH O OH NH2 O CH2OH O OH NH2 OH CH2OH
Gambar.2.3 Struktur Kitosan (Li dan Kegley, 2005)
Kitosan tidak bersifat racun dan merupakan polimer dengan rantai yang
sangat panjang. Panjangnya rantai tersebut menyebabkan kitosan memiliki berat
O OH OH NHCOCH3 O CH2OH O OH NHCOCH3 O CH2OH O OH NHCOCH3 OH CH2OH
molekul yang besar. Dalam keadaan larutan, kitosan berwarna kuning pucat dan
memiliki bau yang tajam.
Kitosan memiliki kelarutan yang lebih bervariasi dibandingkan kitin.
Kitosan dapat larut dalam air bersuasana asam dengan pH dibawah 6,5. Kelarutan
kitosan sangat bergantung pada banyaknya gugus amina yang terdapat pada
kitosan. Kitosan larut dengan baik dalam HCl, HClO4, HNO3, HBr dan
asam-asam organik. Namun kitosan tidak larut dengan baik dalam H
2SO
4karena ion
sulfat akan membentuk kompleks yang tidak larut dengan kitosan (Domard dalam
Li dan Kegley, 2005).
2.3
Kitosan-Bentonit
Kitosan–bentonit merupakan salah satu jenis organo-bentonit hasil
modifikasi antara bentonit dengan kitosan. Pada umumnya, organo-bentonit
merupakan hasil modifikasi bentonit menggunakan kation organik. Kation
organik yang digunakan harus memiliki bagian bermuatan positif dan bagian yang
bersifat hidrofobik. Kation organik tersebut akan menggantikan posisi kation
anorganik pada daerah interlayer bentonit sehingga dapat meningkatkan afinitas
bentonit terhadap senyawa organik.
Berdasarkan penelitian Dimas (2009), kitosan-bentonit memiliki kinerja
yang baik sebagai adsorben untuk pestisida diazinon dengan nilai persen adsorpsi
rata-rata sebesar 79,04%. Adapun kondisi optimum dalam sintesis
kitosan-bentonit yaitu 30 menit waktu kontak kitosan terhadap kitosan-bentonit dengan
kecepatan pengadukan 160 rpm, dan perbandingan komposisi kitosan terhadap
bentonit 1:180.
Berdasarkan kondisi medium dan struktur kitosannya sendiri, kitosan
dapat berinteraksi dengan bentonit melalui berbagai cara, yaitu melalui
pemerangkapan, melalui pembentukan kompleks, melalui pertukaran ion, dan
pembentukan ikatan hidrogen.
Pada kondisi pH di bawah 4, kation anorganik pada bentonit, yaitu Ca
2+dapat digantikan oleh kitosan. Nilai pH ini mengakibatkan kitosan berada dalam
bentuk kation yang dapat berinteraksi dengan pemukaan bentonit. Oleh karena itu,
pada pH asam, kemungkinan kitosan dapat dengan mudah menggantikan Ca
2+pada permukaan bentonit melalui reaksi pertukaran kation. Hasil yang diperoleh
berupa kitosan-bentonit yang memiliki karakter hidrofobik dan dapat digunakan
sebagai adsorben untuk senyawa organik seperti diazinon.
2.4
Diazinon
Diazinon merupakan insektisida golongan organofosfat yang ditemukan
pada tahun 1952. Nama kimia dari diazinon adalah O,O-dietil
O-2-isopropil-6-metil (pirimidin-4yl)fosfortioat. Diazinon dapat bersifat racun jika terjadi kontak
dengan saluran pernapasan dan pencernaan dengan cara menghambat kerja
asetilkolinesterase, suatu enzim yang berfungsi untuk menormalkan transmisi
impuls pada syaraf. Diazinon juga dapat menyebabkan gangguan pernafasan,
iritasi mata, dan iritasi kulit.
Bentuk fisik diazinon adalah cairan tak berwarna hingga coklat dan
bersifat tidak stabil pada suasana asam dan alkali, larut dalam alkohol, eter,
benzena, sikloheksana, dan senyawa hidrokarbon lainnya yang serupa. Struktur
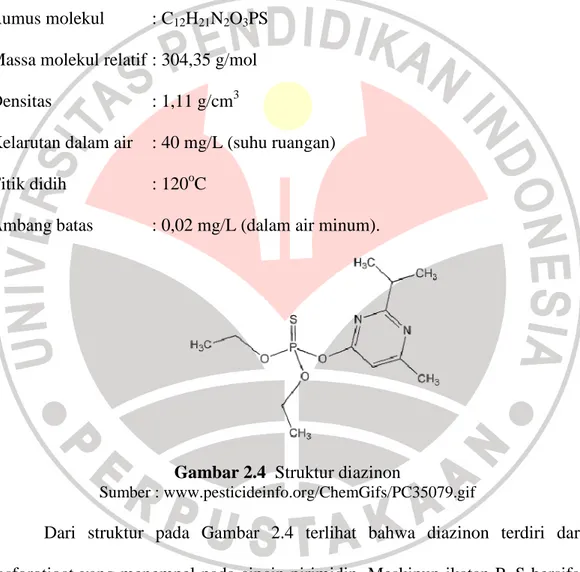
diazinon diperlihatkan pada Gambar 2.4. Adapun sifat-sifat diazinon adalah
berikut:
Rumus molekul
: C12H21N2O3PS
Massa molekul relatif : 304,35 g/mol
Densitas
: 1,11 g/cm
3Kelarutan dalam air : 40 mg/L (suhu ruangan)
Titik didih
: 120
oC
Ambang batas
: 0,02 mg/L (dalam air minum).
Gambar 2.4 Struktur diazinon
Sumber : www.pesticideinfo.org/ChemGifs/PC35079.gif
Dari struktur pada Gambar 2.4 terlihat bahwa diazinon terdiri dari
fosforotioat yang menempel pada cincin pirimidin. Meskipun ikatan P=S bersifat
polar, tapi cincin pirimidin non polar yang memiliki subsituen alkil menyebabkan
senyawa diazinon relatif bersifat hidrofobik.
Diazinon biasa digunakan untuk mengontrol hama serangga pada tanah,
tanaman, buah dan sayuran. Selain itu, diazinon juga biasa digunakan untuk
mengontrol lalat, kutu, kecoa dan semut di rumah-rumah, perkantoran dan
tempat-tempat umum lainnya. Penggunaan dan pembuangan diazinon yang tidak
benar dapat menyebabkan pestisida tersebut memasuki sumber air minum,
sehingga membahayakan kesehatan manusia dan merugikan lingkungan.
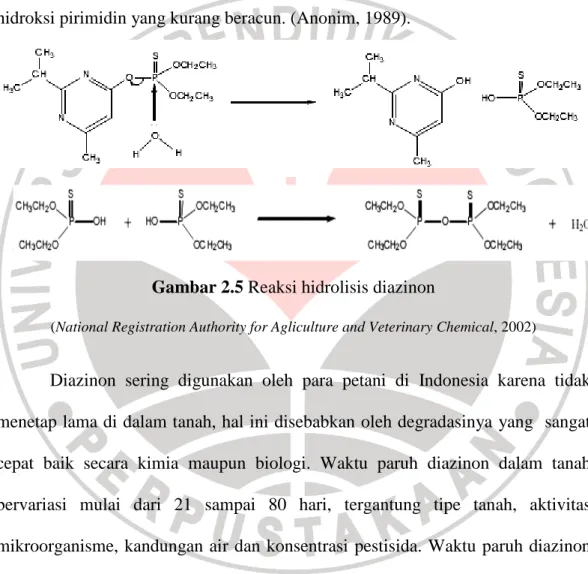
Diazinon terhidrolisis secara lambat oleh air menjadi
2-isopropil-6-metil-4-hidroksi pirimidin yang kurang beracun. (Anonim, 1989).
Gambar 2.5 Reaksi hidrolisis diazinon
(National Registration Authority for Agliculture and Veterinary Chemical, 2002)