LAPORAN RESMI
PRAKTIKUM DASAR TEKNIK KIMIA II
MATERI : ELEKTROKIMIA
Oleh:
Abrar Harist : 21030112120011 Afin Nurdiansyah Putra : 21030112130117 Kusuma Betha C. I : 21030112130086
LABORATORIUM DASAR TEKNIK KIMIA II TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS DIPONEGORO SEMARANG
LAPORAN RESMI
PRAKTIKUM DASAR TEKNIK KIMIA II
MATERI : ELEKTROKIMIA
Oleh:
Abrar Harist : 21030112120011 Afin Nurdiansyah Putra : 21030112130117 Kusuma Betha C. I : 21030112130086
LABORATORIUM DASAR TEKNIK KIMIA II TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS DIPONEGORO SEMARANG
HALAMAN PENGESAHAN
Laporan resmi berjudul “ELEKTROKIMIA” yang disusun oleh : Kelompok : 4/Rabu siang
Anggota : 1. Abrar Harist 21030112120011 2. Afin Nurdiansyah Putra 21030112130117 3. Kusuma Betha C. I. 21030112130086
telah diterima dan disetujui oleh Supriyandi selaku asisten Laboraturium Dasar Teknik Kimia II pengampu materi Elektrokimia pada :
Hari : Rabu Tanggal : 5 Juni 2013 Semarang, 5 Juni 2013 Asisten Pengampu Supriyandi NIM. L2C009060
KATA PENGANTAR
Puji syukur kami panjatkan kepada Tuhan Yang Maha Esa berkat rahmat dan hidayah-Nya sehingga kami dapat menyelesaikan Laporan Resmi Praktikum Dasar Teknik Kimia II berjudul ELEKTROKIMIA dengan lancar dan sesuai dengan harapan kami.
Penyusun menyadari sepenuhnya bahwa tanpa bantuan dan kerja sama dari berbagai pihak maka laporan ini tidak akan dapat terselesaikan. Oleh karena itu dalam kesempatan ini penyusun mengucapkan terima kasih kepada :
1. Ir. C. Sri Budiarti, MT selaku Dosen penanggung jawab Laboratorium Dasar Teknik Kimia II Jurusan Teknik Kimia Fakultas Teknik Universitas Diponegoro Semarang tahun 2013.
2. Supriyandi Asisten Laboratorium Dasar Teknik Kimia II selaku asisten pembimbing penyusunan laporan resmi materi Elektrokimia
3. Segenap asisten Laboratorium Dasar Teknik Kimia II Jurusan Teknik Kimia Fakultas Teknik Universitas Diponegoro Semarang.
4. Bapak Rustam dan Ibu Dini selaku Laboran Laboratorium Dasar Teknik Kimia II JurusanTeknik Kimia Fakultas Teknik Universitas Diponegoro Semarang.
Laporan resmi ini merupakan laporan resmi terbaik yang saat ini bisa kami ajukan, namun kami menyadari pasti ada kekurangan yang perlu kami perbaiki. Maka dari itu kritik dan saran yang sifatnya membangun sangat kami harapkan
Semarang, Juni 2013
DAFTAR ISI
HALAMAN PENGESAHAN ii
KATA PENGANTAR iii
DAFTAR ISI iv
DAFTAR TABEL vi
DAFTAR GAMBAR vii
INTISARI viii
SUMMARY ix
BAB I PENDAHULUAN
I.1. Latar belakang 1
I.2. Rumusan masalah 1
I.3. Tujuan Percobaan 1
BAB II TINJAUAN PUSTAKA 2
BAB III METODOLOGI PERCOBAAN
III.1.Bahan dan Alat yang Digunakan 5
III.2. Gambar Alat 5
III.3. Variabel Percobaaan 6
III.4. Cara Kerja 6
BAB IV HASIL PERCOBAAN DAN PEMBAHASAN
IV.2. Pembahasan 10 BAB V PENUTUP V.1. Kesimpulan 20 V.2. Saran 20 DAFTAR PUSTAKA 21 LAMPIRAN
DAFTAR TABEL
Tabel 1. Variabel Arus I=60mA 8
Tabel 2. Variabel Arus I=80mA 8
Tabel 3. Variabel Pengadukan 250 rpm 8 Tabel 4. Variabel Pengadukan 300 rpm 9 Tabel 5. Variabel Waktu Interval 3 menit 9 Tabel 6. Variabel Waktu Interval 5 menit 9
DAFTAR GAMBAR
Gambar 1. Rangkaian Alat Elektrolisis 5
Gambar 2. Rangkaian Alat Titrasi 6
Gambar 3. Grafik Hubungan Konversi Massa vs Waktu Variabel Arus 10 Gambar 4. Grafik Hubungan Konversi Massa vs Waktu Variabel Pengadukan 10 Gambar 5. Grafik Hubungan Konversi Massa vs Waktu Variabel Waktu 11 Gambar 6. Grafik Hubungan Konversi Volume vs Waktu Variabel Arus 12 Gambar 7. Grafik Hubungan Konversi Volume vs Waktu Variabel Pengadukan
13 Gambar 8. Grafik Hubungan Konversi Volume vs Waktu Variabel Waktu 14 Gambar 9. Grafik Hubungan Massa Katoda Praktis vs Teoritis Arus = 60mA 17 Gambar 10. Grafik Hubungan Massa Katoda Praktis vs Teoritis Arus = 80mA 17 Gambar 11. Grafik Hubungan Massa Katoda Praktis vs Teoritis Pengadukan
250rpm 17
Gambar 12. Grafik Hubungan Massa Katoda Praktis vs Teoritis Pengadukan
300rpm 18
Gambar 13. Grafik Hubungan Massa Katoda Praktis vs Teoritis Waktu Interval 3
menit 18
Gambar 14. Grafik Hubungan Massa Katoda Praktis vs Teoritis Waktu Interval 5
INTISARI
Tujuan dari percobaan ini adalah menentukan berat Cu yang menempel pada katoda setelah elektrolisa. Elektrolisa adalah proses penguraian suatu elektrolit yang disebabkan oleh adanya arus listrik searah. Pada percobaan ini digunakan larutan CuSO4. 5H2O sebagai elektrolitnya. Faktor-faktor yang mempengaruhi proses elektrokimia adalah : arus listrik, konsentrasi larutan, pengadukan, dan waktu. Aplikasi proses elektrokimia adalah elektroplatting, elektroreffining, dan elektrowinning.
Bahan yang digunakan adalah CuSO4.5H2O 0,45N sebanyak 475ml, KI 10%W sebanyak 250ml, Na2S2O3.5H2O 0,25N sebanyak 250ml, amilum, dan aquadest secukupnya. Sedangkan alat yang digunakan adalah batang tembaga, grafit, batang besi, voltmeter/amperemeter, adaptor,dan magnetic stirrer. Cara kerjanya adalah memasukkan tangki elektrolisis dengan 475ml larutan CuSO4.5H2O. Menghubungkan anoda dengan dengan kutub positif dan katoda dengan kutub negatif penyearah arus. Mengalirkan arus dan menjalankan pengadukan. Menghentikan pengadukan dan arus listrik ketika mencapai waktu yang ditentukan. Mengeringkan dan menimbang katoda. Menganalisa cairan bekas elektrolisa dengan metode titrasi iodometri untuk mengetahui kandungan Cu2+ yang tersisa.
Berdasarkan hasil praktikum, semakin besar arus, konversi massa semakin besar, namun beberapa penyimpangan terjadi karena arus yang terlalu tinggi menyebabkan fluktuasi dan overpotensial. Pada variable pengadukan, semakin cepat maka konversi massa semakin besar, namun bila terlalu cepat akan menyebabkan Cu2+ yang menempel di katoda jatuh kembali (rontok). Sedangkan pada variable waktu, semakin lama waktu maka konversi massa semakin besar. Pada dasarnya, semakin besar arus, semakin cepat pengadukan, dan waktu yang semakin lama akan menyebabkan konversi volume semakin besar. Saran dari praktikum ini, menimbang katoda dengan hati-hati, menjaga larutan tiosulfat dan indikator, menjaga amperemeter, memperhatikan TAT dengan cermat.
SUMMARY
The purpose of this experiment is to determine the weight attached to the Cu cathode after electrolysis. Electrolysis is the decomposition of the electrolyte caused by electric current. In this experiment used CuSO4.5H2O as the electrolyte solution. Factors affecting the electrochemical process are: electric current, solution concentration, mixing, and time. Application of electrochemical process is elektroplatting, elektroreffining, and elektrowinning.
Materials used are CuSO4.5H2O 0.45N 475ml, 10% KI W 250ml, Na2S2O3.5H2O 0.25 N 250ml, amylum, and aquadest. While the tools used are copper stick, graphites stick, iron stick, voltmeters / ammeters, adapter, and a magnetic stirrer. The way it works is the inclusion of electrolysis tank with 475ml solution CuSO4.5H2O. Connecting the anode to the cathode to the positive pole and the negative pole rectifier currents. Current drain and run stirring. Stop stirring and electric current when it reaches the specified time. Drying and weighing the cathode. Analyze liquid ex-electrolysis with iodometric titration method to determine the content of Cu 2+ remaining.
Based on the lab results, the greater the flow, the greater the mass conversion, but some deviations occur because the current is too high and causes fluctuations and overpotensial. On variable stirring, the faster the greater the mass conversion, but if too quickly will cause the Cu2+ attached to the cathode fall back (fall). While at variable time, the longer the time the greater the mass conversion. Basically, the greater the flow, the faster the stirring, and the longer time will cause the conversion of the greater volume. Suggestion of this lab, weigh carefully cathode, keeping thiosulfate solution and indicators, keeping ammeters, with careful attention to TAT.
BAB 1
PENDAHULUAN
I. 1. Latar Belakang
Elektrokimia memiliki banyak kegunaan yang penting untuk kehidupan sehari-hari. Diantaranya membuat senyawa lain, seperti unsur logam , halogen, gas hidrogen , dan gas oksigen. Contohnya pada elektrolisa larutan NaCl. Cara itu untuk mengetahui konsentrasi ion logam dalam larutan. Kegunaan lainnya yaitu melapisi permukaan suatu logam dengan logam yang lain.
Mahasiswa teknik kimia harus memahami teori yang berkaitan dengan proses elektrolisis. Banyak aplikasi elektrolisis seperti elektroplatting, elektroreffining, dan juga juga elektrowinning. Oleh karena itu, mahasiswa teknik kimia perlu melakukan percobaan elektrolisis, seperti menentukan berat Cu yang menempel pada katoda setelah proses elektrolisis.
I. 2. Rumusan Masalah
Praktikum elektrokimia dilakukan untuk mengetahui konsep elektrolisis dengan benar, faktor-faktor yang mempengaruhi proses elektrolisis, dan bagaimana menentukan berat Cu2+ yang menempel pada katoda setelah proses elektrolisis.
I. 3. Tujuan Percobaan
Menentukan berat Cu yang menempel pada katoda setelah proses elektrolisis.
BAB II
TINJAUAN PUSTAKA
Elektrolisa adalah proses peruraian suatu elektrolit yang disebabkan oleh adanya arus listrik searah. Dalam percobaan ini digunakan larutan CuSO4.5H2O sebagai elektrolitnya. Pada larutan CuSO4.5H2O tidak terbentuk endapan tembaga sulfit sehingga proses ini menunjukkan proses pengolahan yang bersih, sederhana, dan sangat baik untuk mengambil kembali tembaga yang mempunyai kemurnian tinggi yaitu sekitar 99% (Brady and Humitson,1975)
Pada sel elektrolisa terjadi proses pelucutan ion-ion bermuatan. Selama proses berlangsung, arus listrik mengalir melalui elektrolit, memberikan energi yang cukup untuk menjalankan reaksi oksidasi dan reduksi. Ion-ion yang bermuatan bergerak, setelah arus listrik mengalir dalam elektrolit. Ion positif bergerak ke elektroda negatif (katoda) dan ion negatif bergerak ke elektroda positif (anoda). Saat ion-ion bermuatan saling bersinggungan dengan elektroda akan terjadi reaksi elektrokimia. Pada elektroda positif, ion negatif melepaskan elektron dan teroksidasi. Pada elektroda negatif, ion positif menangkap elektron dan tereduksi.
Reaksi pada proses elektrolisis
Reaksi-reaksi pada proses elektrolisis merupakan reaksi reversible dan merupakan reaksi redoks. Pada katoda berlangsung reaksi reduksi dan pada anoda berlangsung reaksi oksidasi. Pada percobaan ini, sebagai katoda digunakan batang tembaga dan sebagai anoda digunakan grafit. Elektrolitnya adalah larutan
CuSO4 Cu2+ + SO4 2-2H2O 2H+ + 2OH -Anoda 2OH- H2O + ½ O2 + 2e
CuSO4.5H2O. Reaksi yang terjadi :
Berdasarkan persamaan reaksi di atas, pada larutan akan tinggal asam sulfat. Pada anoda akan terbentuk gas O2 dan logam Cu akan menempel pada katoda.
Untuk analisa larutan sisa elektrokimia digunakan metode titrasi iodometri. Metode ini dilakukan untuk mengetahui kadar Cu2+ yang masih menempel pada katoda.
Untuk analisa larutan sisa elektrokimia digunakan metode titrasi iodometri. Metode ini dilakukan untuk mengetahui kadar Cu2+ yang masih tersisa dalam larutan.
Faktor-faktor yang mempengaruhi proses elektrokimia • Arus Listrik
Semakin beasr arus listrik maka elektrokimia akan berlangsung lebih cepat karena proses penghantaran ion-ion dalam larutan ke katoda lebih cepat. • Konsentrasi Larutan
Konsentrasi larutan akan mempengaruhi jumlah ion-ion yang terdapat dalam larutan, sehingga konsentrasi yang semakin tinggi akan mempercepat proses elektrokimia.
• Pengadukan
Pengadukan akan membantu mengarahkan kation-kation dalam melapisi katoda, sehingga pengadukan akan mempengaruhi proses elektrokimia. • Waktu
Semakin lama waktu untuk melakukan proses elektrokimia maka semakin banyak pula kation yang akan tereduksi dan menempel pada katoda.
Reaksi : 2Cu2+ + 4I- 2CuI + I2 I2 + S2O32- 2I- + S4O6 2-I2 + I- I3
Aplikasi Proses Elektrokimia • Elektroplatting
Yaitu proses pelapisan suatu logam pada logam lain dengan cara elektrolisis.
Prinsipnya : 1. Katoda sebagai logam yang dilapisi 2. Anoda sebagai pelapis
3. Menggunakan elektrolit garam dari logam anoda
• Elektroreffining
Yaitu cara mendapatkan logam dengan kemurnian yang tinggi dan logam yang kadarnya rendah.
• Elektrowinning
Yaitu cara mendapatkan logam dengan kemurnian yang tinggi dari logam yang kadarnya rendah, sebagai contohnya adalah pada proses pengambilan emas yang bertujuan untuk mengambil ion emas terlarut didalam air kaya dengan proses elektrolisa menggunakan anoda dan katoda dari stainless tipe wath yang dikhususkan untuk elektrolisa. Yang harus diperhatikan adalah konduktivitas larutan yang stabil.
BAB III
METODOLOGI PERCOBAAN
III. 1. Bahan dan Alat yang Digunakan
Bahan : 1. CuSO4. 5H2O 0,45N 475ml 2. KI 10% berat 50ml 3. Na2S2O3.5H2O 0,25N 250ml 4. Amylum secukupnya 5. Aquadest secukupnya Alat : 1. Tangki Elektrokimia 2. Batang Tembaga 3. Batang Karbon 4. Batang Besi 5. Voltmeter/Amperemeter 6. Adaptor 7. Magnetic Stirrer
III. 2. Gambar Alat Utama
Keterangan : 1. Tangki Elektrokimia 2. Katoda 3. Anoda 4. Adaptor, amperemeter, voltmeter
III. 3. Variabel Operasi
-Variabel arus : K=Cu; A=C; arus 60mA; 250 rpm; t= 0, 5, 10, 15 menit K=Cu; A=C; arus 80mA; 250 rpm; t= 0, 5, 10, 15 menit -Variabel putaran: K=C; A=Cu; arus 60mA; 250 rpm; t= 0, 4, 8, 12 menit
K=C; A=Cu; arus 60mA; 300 rpm; t= 0, 4, 8, 12 menit -Variabel waktu : K=Fe; A=Cu; arus 60mA; tanpa pengadukan; t= 0, 3, 6,
9 menit
K=Fe; A=Cu; arus 60mA; tanpa pengadukan; t= 0, 5, 10, 15 menit
III. 4. Cara Kerja
1. Isi tangki elektrolisis dengan 475ml larutan CuSO4. 5H2O.
2. Letakkan katoda dan anoda pada tangki dengan posisi yang permanen. Hubungkan anoda dengan kutub positif dan katoda dengan kutub negatif penyearah arus.
3. Alirkan arus bertegangan rendah (besar arus bisa divariasi) dan jalankan pengadukan dengan perlahan-lahan.
4.Ketika mencapai waktu yang ditentukan, hentikan pengadukan dan arus listrik dan ambil katoda. Selanjutnya keringkan dan timbang. Analisa
Keterangan: 1. Statif 2. Klem 3. Buret 4. Erlenmeyer
cairan bekas elektrolisa dengan metode titrasi iodometri untuk mengetahui kandungan Cu2+ yang tersisa.
Keterangan : Variabel berubah : arus listrik, kecepatan pengadukan, waktu elektrolisis.
Analisa Hasil
1. Ambil 5ml cairan sisa hasil elektrolisis, masukkan dalam Erlenmeyer dan selanjutnya tambahkan 3ml KI 10% berat.
2. Tutup mulut labu Erlenmeyer dengan gelas arloji kecil dan biarkan 5 menit di tempat gelap agar reaksi berlangsung sempurna. Selanjutnya cuci tutup gelas arloji dengan aquadest dan masukkan air cucian dalam Erlenmeyer.
3. Titrasi larutan tersebut dengan larutan Na2S2O3. 5H2O sampai warna larutan berubah menjadi kuning.
4. Selanjutnya tambahkan 3 tetes amylum ke dalam campuran dan titrasi lagi Na2S2O3. 5H2O sampai warna biru tepat hilang (putih susu)
Cara Perhitungan 1. 𝑋𝑋1 = 𝑀𝑀−𝑀𝑀𝑀𝑀
𝑀𝑀𝑀𝑀𝑀𝑀
Keterangan : X1 = konversi massa
M = berat katoda setelah elektrolisa M0 = berat katoda sebelum elektrolisa MCu = berat tembaga dalam cairan mula-mula
2. 𝑋𝑋2 = 𝑉𝑉𝑀𝑀.𝑁𝑁−𝑉𝑉.𝑁𝑁
𝑉𝑉𝑀𝑀.𝑁𝑁 = 𝑉𝑉𝑀𝑀−𝑉𝑉
𝑉𝑉𝑀𝑀
Keterangan : Vo = Volume larutan Na2S2O3.5H2O sebelum elektrolisis V = Volume larutan Na2S2O3.5H2O setelah elektrolisis N = Normalitas larutan Na2S2O3. 5H2O
BAB IV
HASIL PERCOBAAN dan PEMBAHASAN
IV. 1. Hasil Percobaan • Variabel Arus
Tabel 1. Variabel arus pada I=60mA ; 250 rpm; K=Cu; A=C
t(menit) m(gram) v(ml) Xm Xv 0 2,63 8,6 0 0 5 2,71 10,3 0,0123 -0,197 10 2,73 11,7 0,0154 -0,36 15 2,74 11 0,0169 -0279
Tabel 2. Variabel arus pada I=80mA; 250 rpm; K=Cu; A=C
t(menit) m(gram) v(ml) Xm Xv 0 2,66 11 0 0 5 2,73 9,7 8,439x10-3 0,1181 10 2,69 10,2 3,61689x10-3 0,0727 15 2,71 10,5 6,028x10-3 0,045 • Variabel Pengadukan
Tabel 3. Variabel pengadukan pada I=60mA; 250 rpm; K=C; A=Cu t(menit) m(gram) v(ml) Xm Xv
0 0,43 10,5 0 0
4 0,40 10,2 -3.978x10-3 0,028 8 0,47 9,9 5,3x10-3 0,0371 12 0,45 9,6 2,65x10-3 0,0857
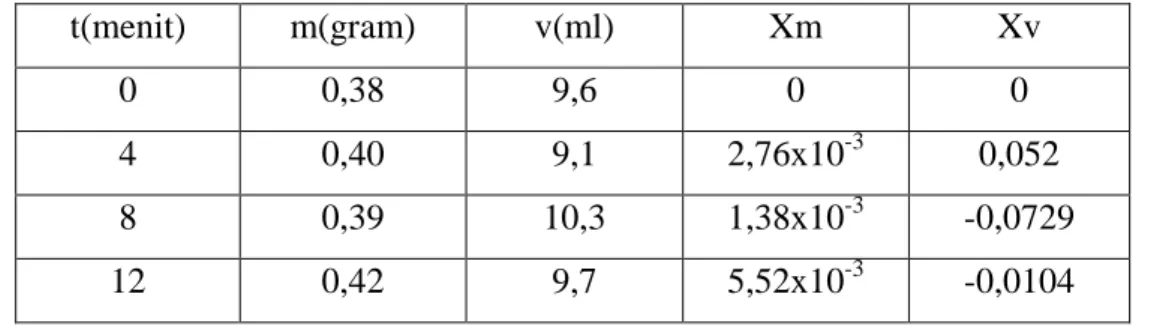
Tabel 4. Variabel pengadukan pada I=60mA; 300 rpm; K=C; A=Cu t(menit) m(gram) v(ml) Xm Xv 0 0,38 9,6 0 0 4 0,40 9,1 2,76x10-3 0,052 8 0,39 10,3 1,38x10-3 -0,0729 12 0,42 9,7 5,52x10-3 -0,0104 • Variabel waktu
Tabel 5. Variabel waktu pada I=60mA; tanpa pengadukan; K= Fe; A=Cu t(menit) m(gram) v(ml) Xm Xv
0 1,43 9,7 0 0
3 1,46 10,2 4,1014x10-3 -0,103
6 1,48 9,7 -0,142 0
9 1,50 9,2 -0,138 0,0515
Tabel 6. Variabel waktu pada I=60mA; tanpa pengadukan; K=Fe; A=Cu t(menit) m(gram) v(ml) Xm Xv
0 1,43 9,7 0 0
5 1,48 9,8 6,835x10-3 -0,0103 10 1,50 11,1 9,57x10-3 -0,1443
IV. 2. Pembahasan
IV.2.1. Hubungan Konversi Massa Terhadap Waktu
1. Variabel Arus
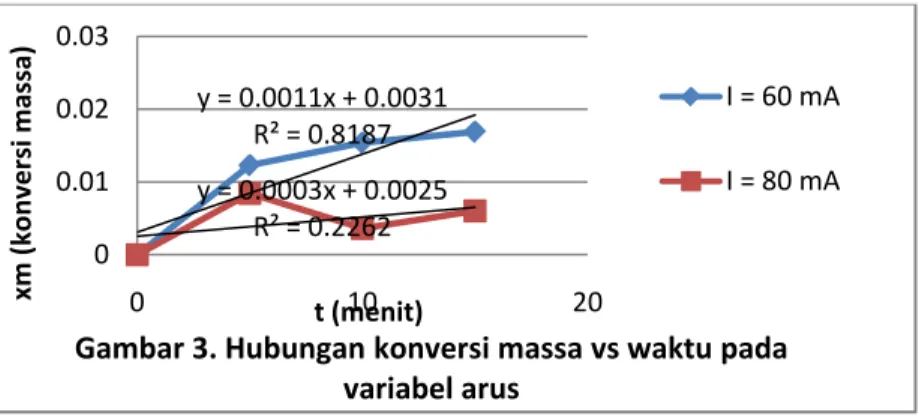
Berdasarkan grafik, diperoleh hasil konversi massa pada arus 60mA lebih besar daripada dengan arus 80mA. Seharusnya, semakin besar arus, penghantaran ion-ion dalam larutan katoda lebih cepat, sehingga semakin banyak Cu yang menempel di katoda dan konversi massa lebih besar. Namun penyimpangan yang terjadi disebabkan arus yang dapat berfluktuasi apabila menggunakan arus yang besar. Meskipun arus dapat disesuaikan kembali dengan amperemeter sesegera mungkin, tapi tetap saja ada jeda waktu dimana fluktuasi arus mempengaruhi hasil. Selain itu juga disebabkan karena terjadinya overpotensial, sehingga konversi massa yang didapat pada arus 80mA lebih kecil daripada arus 60mA.
(http://www.123helpme.com/view.asp?id=122540) 2. Variabel Pengadukan y = 0.0011x + 0.0031 R² = 0.8187 y = 0.0003x + 0.0025 R² = 0.2262 0 0.01 0.02 0.03 0 10 20 xm (k onv er si m assa ) t (menit)
Gambar 3. Hubungan konversi massa vs waktu pada variabel arus I = 60 mA I = 80 mA y = 0.0004x - 0.0016 R² = 0.3158 y = 0.0004x + 0.0001 R² = 0.6914 -0.005 0 0.005 0.01 0 5 10 15 xm (k onv er si m assa ) t ( menit)
Gambar 4. Hubungan konversi massa vs waktu pada variabel pengadukan
250 rpm 300 rpm
Berdasarkan grafik, dapat dilihat bahwa secara keseluruhan pada pengadukan 300 rpm konversi massa lebih besar, karena pengadukan dapat mengarahkan ion Cu2+ ke katoda sehingga mempercepat proses elektrokimia. Semakin cepat pengadukan, semakin banyak kation yang menempel. Namun, pada menit ke-8, konversi massa pada pengadukan 300 rpm lebih rendah dari konversi massa pada pengadukan 250 rpm. Hal ini disebabkan karena pengadukan yang terlalu cepat, sehingga terdapat kation yang jatuh kembali (rontok) dari katoda sehingga mengurangi massa yang tertimbang.
(www.essaymania.com/52017/the_electrolysis_of_chopper_sulphate/soluti on_using_copper_electrode)
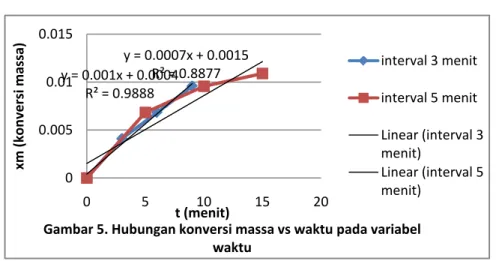
3. Variabel Waktu
Berdasarkan grafik di atas, dapat dilihat bahwa konversi massa pada interval waktu 5 menit lebih besar dari konversi massa pada interval waktu 3 menit. Hal ini sesuai dengan rumus hukum Faraday I, yaitu :
𝑊𝑊 =96500𝑒𝑒. 𝐼𝐼. 𝑡𝑡
Pada Hukum tersebut, dinyatakan bahwa semakin lama waktu elektrolisis, semakin besar massa ion Cu2+ yang menempel pada katoda, sehinga konversi massa juga lebih besar.
(www.scribd.com/doc/23178504/55095478/VOLTAMETER_TEMBAGA) y = 0.001x + 0.0004 R² = 0.9888 y = 0.0007x + 0.0015 R² = 0.8877 0 0.005 0.01 0.015 0 5 10 15 20 xm (k onv er si m assa ) t (menit)
Gambar 5. Hubungan konversi massa vs waktu pada variabel waktu interval 3 menit interval 5 menit Linear (interval 3 menit) Linear (interval 5 menit)
IV.2.2. Hubungan Konversi Volume Terhadap Waktu
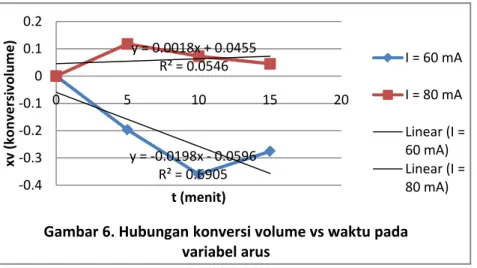
1. Variabel Arus
Pada grafik di atas dapat diketahui bahwa konversi volume pada arus 80mA lebih besar dibanding pada arus 60mA. Pada rumus Hukum Faraday I:
𝑊𝑊 =96500𝑒𝑒.𝐼𝐼.𝑡𝑡
Semakin besar arus, penghantaran ion-ion dalam larutan ke katoda lebih cepat, sehingga semakin banyak Cu yang menempel pada katoda. Banyaknya Cu yang menempel di katoda menyebabkan kandungan Cu2+ pada larutan CuSO4.5H2O berkurang. Sehingga volume titran yang dibutuhkan sedikit. Sesuai dengan rumus : 𝑋𝑋𝑋𝑋 = 𝑉𝑉𝑀𝑀−𝑉𝑉
𝑉𝑉𝑀𝑀
Pada arus 80mA, Cu2+ yang tereduksi semakin banyak sehingga volume titran yang dibutuhkan kecil dan konversi volume semakin besar.
(www.scribd.com/doc/73178504/5905478-VOLTAMETER_TEMBAGA) ( www.lab.tekim.undip.ac.id/dtk2/2013/04/12/elektrokimia) y = -0.0198x - 0.0596 R² = 0.6905 y = 0.0018x + 0.0455 R² = 0.0546 -0.4 -0.3 -0.2 -0.1 0 0.1 0.2 0 5 10 15 20 xv ( ko nver si vo lu m e) t (menit)
Gambar 6. Hubungan konversi volume vs waktu pada variabel arus I = 60 mA I = 80 mA Linear (I = 60 mA) Linear (I = 80 mA) Reaksi : CuSO4 Cu2+ + SO4 2-2 H2O 2H+ + 2OH -Anoda : 2OH- H2O + 12 O2 + 2e- Katoda : Cu2+ + 2e- Cu
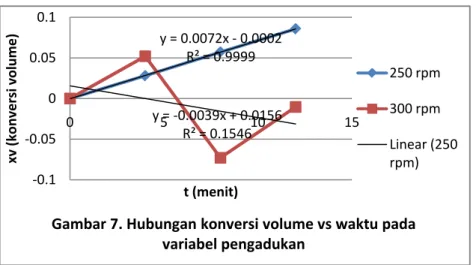
2. Variabel Pengadukan
Pada grafik di atas, dapat diperoleh bahwa seberapa besar konversi volume pada pengadukan 250 rpm lebih besar daripada pengadukan 300 rpm. Seharusnya dengan adanya pengadukan yang lebih cepat, Cu2+ lebih mudah diarahkan ke katoda sehingga Cu yang menempel di katoda semakin banyak. Banyaknya Cu yang menempel di katoda menyebabkan kandungan Cu2+ pada larutan CuSO4.5H2O berkurang. Sehingga volume titran yang dibutuhkan sedikit dan konversi volume besar. Pada rumus :
𝑋𝑋𝑋𝑋 = 𝑉𝑉𝑀𝑀 − 𝑉𝑉𝑉𝑉𝑀𝑀
Namun, pada percobaan kami dengan pengadukan yang lebih besar, konversi volumenya lebih kecil.Pengadukan yang terlalu cepat dapat merontokkan kembali Cu yang sudah menempel di katoda, sehingga konsentrasi Cu2+ dalam larutan elektolisa tetap tinggi, dan didapat konversi volume yang kecil. Penyebab lainnya adalah oksidasi ion iodide pada KI oleh oksigen menjadi I2, pada reaksi :
Selain penyebab di atas, fenomena yang terjadi juga disebabkan karena sifat larutan Na2S2O3 yang tidak stabil, sesuai dengan reaksi:
y = 0.0072x - 0.0002 R² = 0.9999 y = -0.0039x + 0.0156 R² = 0.1546 -0.1 -0.05 0 0.05 0.1 0 5 10 15 xv ( ko nver si vo lu m e) t (menit)
Gambar 7. Hubungan konversi volume vs waktu pada variabel pengadukan 250 rpm 300 rpm Linear (250 rpm) O2 + 4I- + 4H+ 2I2 + 2H2O 2Cu2+ + 4I- 2CuI + I2
Pada proses iodometri , perlu dihindari konsentrasi asam yang terlalu tinggi karena asam tiosulfat dibebaskan akan mengendap dengan pemisahan belerang, sesuai dengan reaksi :
Larutan tiosulfat tidak stabil dalam waktu lama. Bakteri yang memakan belerang akan masuk ke dalam larutan ini dan proses metabolitiknya akan mengakibatkan pembentukan SO42-, SO32-, dan belerang Kjeldahl. Dengan demikian volume yang digunakan kurang akurat. Namun, pada dasarnya pada menit ke-4 dengan pengadukan 300 rpm, nilai konversi volume lebih besar daripada 250 rpm, dan hal ini telah sesuai dengan teori yang sebenarnya.
(www.scribd.com/doc/73178504/5905478-VOLTAMETER_TEMBAGA) ( www.nurirjawati.wordpress.com/2012/02/06/iodo-iodimetri)
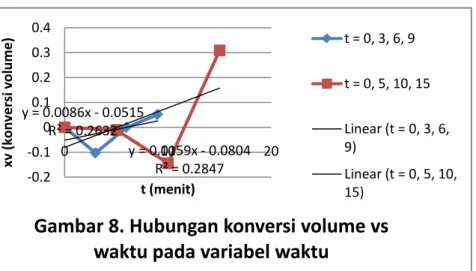
3. Variabel Waktu
Berdasarkan grafik di atas, secara keseluruhan konversi volume pada interval waktu 5 menit lebih besar dari konversi volume pada interval 3 menit sesuai dengan Hukum Faraday. Akan tetapi, pada menit ke-10, konversi volume
S2O32- 2H+ + H2S2O3 8H2S2O3 8 H2O + 8SO2 + 8S y = 0.0086x - 0.0515 R² = 0.2632 y = 0.0159x - 0.0804 R² = 0.2847 -0.2 -0.1 0 0.1 0.2 0.3 0.4 0 10 20 xv ( ko nver si vo lu m e) t (menit)
Gambar 8. Hubungan konversi volume vs
waktu pada variabel waktu
t = 0, 3, 6, 9 t = 0, 5, 10, 15 Linear (t = 0, 3, 6, 9) Linear (t = 0, 5, 10, 15) S2O32- + H+ HS2O32- + HSO3- + S
-pada interval 5 menit lebih rendah dari konversi volume -pada interval 3 menit. Hal ini disebabkan oleh larutan Na2S2O3 yang tidak stabil.
Pada proses iodometri, perlu dihindari konsentrasi asam yang tinggi, karena asam tiosulfat dibebaskan akan mengendap dengan pemisahan belerang sesuai reaksi :
Larutan tiosulfat tidak stabil dalam waktu lama. Bakteri yang memakan belerang akan masuk ke dalam larutan ini dan proses metabolitiknya akan mengakibatkan pembentukan SO42-, SO32-, dan belerang Kjeldahl. Dengan demikian volume yang digunakan kurang akurat.
( www.graciez_pharmacy.blogspot.com) IV.2.3. Titrasi Iodometri
Merupakan titrasi tidak langsung dan digunakan untuk menetapkan senyawa-senyawa yang mempunyai oksidasi lebih tinggi dari sistem iodium-iodida atau senyawa-senyawa yang bersifat oksidator seperti CuSO4.5H2O. Pada iodometri, sampel yang bersifat oksidator direduksi dengan barium iodide berlebih dan akan menghasilkan iodium yang selanjutnya dititrasi dengan iod yang dihasilkan dan setara dengan banyaknya sampel. Prinsip penetapannya yaitu bila zat uji (oksidator) mula-mula direaksikan dengan iodide berlebih, kemudian iodium yang terjadi dititrasi dengan larutan tiosulfat.
S2O32- 2H+ + H2S2O3
8H2S2O3 8 H2O + 8SO2 + 8S
Reaksinya : Oksidator + KI I2
Larutan harus dijaga supaya pH lebih kecil dari 8 karena dalam larutan alkali, iodium bersifat bereaksi dengan hidroksida (OH-) menghasilkan ion hipoiodit yang pada akhirnya menghasilkan ion iodat menurut reaksi :
Sehingga potensial oksidasinya lebih besar dari iodium dan mengoksidasi tiosulfat (S2O32-), tapi juga menghasilkan (SO42-) sehingga menyulitkan perhitungan stoikiometri (reaksi berjalan tidak kuantitatif). Oleh karena itu pada metode iodometri tidak pernah dilakukan dalam larutan basa kuat.
Indikator
Amilum kanji dapat digunakan sebagai indikator dalam titrasi iodo-iodimetri karena dapat membentuk kompleks yang dalam air berwarna biru.
Larutan kanji lebih umum dipergunakan karena warna biru gelap dari iodine bertindak sebagai suatu tes yang amat sensitive untuk iodine. Mekanisme pembentukan kompleks yang berwarna ini tidak diketahui, namun ada pemikiran bahwa molekul-molekul iodium tertahan di permukaan amilopektin dan lapisan yang digunakan sebagai indikator dalam percobaan ini lapisan beta amilosa. Lapisan lain dari kanji yaitu alfa amilosa dan amilopektin. Keduanya tidak dapat digunakan sebab membentuk kompleks kemerahan, dimana warna tersebut tidak mudah dihilangkan.
(www.chem-is-try.org/materi_kimia/instrument_analisis/iodometri/indikator/ ) (www.graciez_pharmacy.blogspot.com/2012/11/titrasi-iodo-iodimetri.html)
I2 + OH- HI + IO -3IO- IO3- + 2I
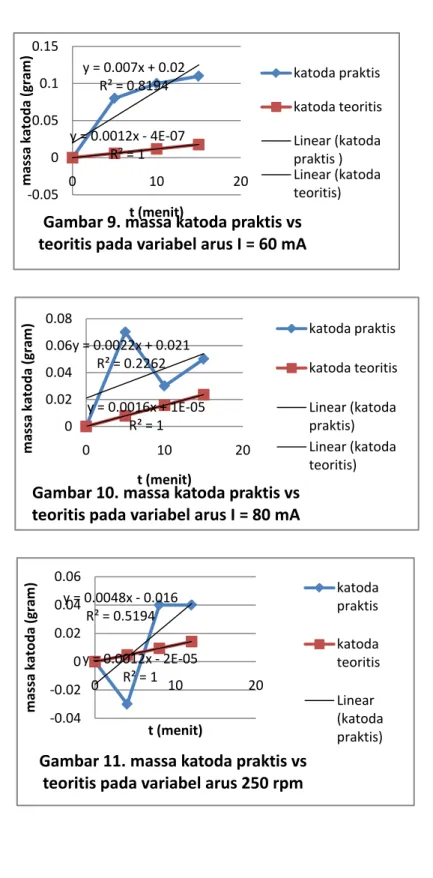
IV.2.4. KatodaPraktis VS Katoda Teoritis y = 0.007x + 0.02 R² = 0.8194 y = 0.0012x - 4E-07 R² = 1 -0.05 0 0.05 0.1 0.15 0 10 20 m as sa k at od a (g ram ) t (menit)
Gambar 9. massa katoda praktis vs teoritis pada variabel arus I = 60 mA
katoda praktis katoda teoritis Linear (katoda praktis ) Linear (katoda teoritis) y = 0.0022x + 0.021 R² = 0.2262 y = 0.0016x + 1E-05 R² = 1 0 0.02 0.04 0.06 0.08 0 10 20 m as sa k at od a (g ram ) t (menit)
Gambar 10. massa katoda praktis vs teoritis pada variabel arus I = 80 mA
katoda praktis katoda teoritis Linear (katoda praktis) Linear (katoda teoritis) y = 0.0048x - 0.016 R² = 0.5194 y = 0.0012x - 2E-05 R² = 1 -0.04 -0.02 0 0.02 0.04 0.06 0 10 20 m as sa k at od a (g ram ) t (menit)
Gambar 11. massa katoda praktis vs teoritis pada variabel arus 250 rpm
katoda praktis katoda teoritis Linear (katoda praktis)
y = 0.0028x + 0.001 R² = 0.6914 y = 0.0012x - 1E-06 R² = 1 -0.01 0 0.01 0.02 0.03 0.04 0.05 0 5 10 15 m as sa k at od a (g ram ) t (menit)
Gambar 12. massa katoda praktis vs teoritis pada variabel arus 300 rpm
katoda praktis katoda teoritis Linear (katoda praktis) y = 0.0077x + 0.003 R² = 0.9888 y = 0.0012x - 2E-06 R² = 1 -0.02 0 0.02 0.04 0.06 0.08 0 5 10 m as sa k at od a (g ram ) t (menit)
Gambar 13. massa katoda praktis vs teoritis pada variabel waktu interval 3 menit
katoda praktis katoda teoritis Linear (katoda praktis) Linear (katoda teoritis) y = 0.0052x + 0.011 R² = 0.8895 y = 0.0012x + 1E-05 R² = 1 0 0.02 0.04 0.06 0.08 0.1 0 10 20 m as sa k at od a (g ram ) t (menit)
Gambar 14. massa katoda praktis vs teoritis pada variabel waktu interval 5 menit
katoda praktis katoda teoritis Linear (katoda praktis) Linear (katoda teoritis)
Berdasarkan grafik-grafik tersebut, dapat dilihat bahwa massa katoda praktis yang lebih besar dari massa katoda teoritis dan terdapat pula massa katoda praktis yang lebih kecil. Massa katoda praktis yang lebih besar disebabkan oleh pengadukan yang membantu mengerahkan kation-kation dalam melapisi katoda. Sedangkan pada Hukum Faraday I, ( 𝑊𝑊 = 𝑒𝑒.𝐼𝐼.𝑡𝑡
96500 ) pengadukan tidak berpengaruh.
Kemudian jarak antar elektroda yang berubah-ubah juga berpengaruh terhadap perbedaan hasil. Massa katoda praktis lebih kecil pada massa katoda teoritis yang ditunjukkan pada grafik 9 menit ke-4 dapat disebabkan oleh pengadukan yang terlalu cepat, sehingga kation yang menempel di katoda rontok kembali.
(www.essaymania.com/52017/the_electrolysis_of_copper_sulphate_soluti on_using_choppers_electrode)
BAB V
PENUTUP
V. 1. Kesimpulan
1. Semakin besar arus yang digunakan, maka semakin besar jumlah kation yang menempel pada katoda, akan tetapi apabila arus terlalu besar, tidak semua kation dapat menempel pada katoda dan bisa menimbulkan fluktuasi, sehingga massa katoda justru kecil. Pada arus yang terlalu besar terkadang terjadi penyimpangan berupa overpotensial.
2. Semakin cepat pengadukan, semakin banyak kation yang menempel pada katoda. Namun apabila pengadukan terlalu cepat, kation bisa rontok kembali.
3. Semakin lama elektrolisis, semakin besar massa katoda.
4. Semakin besar arus, waktu, dan pengadukan, semakin besar konversi volumenya. Namun terkadang terjadi penyimpangan karena Cu pada katoda yang rontok kembali akibat pengadukan yang terlalu cepat sehingga membuat konsentrasi Cu2+ pada larutan elektrolit tetap tinggi dan didapat konversi volume yang kecil, serta sifat Na4S4O3 yang tidak stabil sebagai titran.
V. 2. Saran
1. Melakukan penimbangan katoda dengan hati-hati 2. Menjaga larutan tiosulfat dengan baik.
3. Indikator amilum harus terlindung dari cahaya.
4. Mengamati amperemeter dengan seksama untuk menghindari fluktuasi. 5. Memperhatikan TAT saat titrasi dengan cermat.
DAFTAR PUSTAKA
Badger, W. Z. and Bachero, J. F. “Introduction to Chemical Engineering”, International Student Edition, Mc Graw Hill Book Co. Kogakusha. Tokyo Daniels, f. 1961. “Experimental Physical Chemistry”. 6th ed. Mc Graw Hill Book ,
Kogakusha. Tokyo. www.123helpme.com/view.asp?id=122540 www.chem-is-try.org/materi_kimia/instrumen_analysis/iodometri/indikator/ www.chem-is-try.org/materi_kimia/kimia_industri/utilitas_pabrik/dasar_teori_ elektroplatting/ www.essaymania.com/52017/the_electrolysis_of_copper_sulphate_solution_usin g_copper_electrodes/ www.graciez-pharmacy.blogspot.com/ www.lab.tekim.undip.ac.id/dtk2/2013/04/12/elektrokimia/ www.scribd.com/doc/73178504/55095478-VOLTAMETER_TEMBAGA/
LEMBAR PERHITUNGAN
1. Variabel Arus
a) I = 60mA; 250 rpm; K=Cu; A=C
• (V.N) CuSO4.5H2O = (V.N) Na2S2O3.5H2O 5 .N = 8,6 . 0,25 N = 0,43 M = 0,215 N • 𝑀𝑀 =𝑀𝑀𝑔𝑔𝑔𝑔𝑔𝑔 𝑥𝑥 1000𝑉𝑉 0,215 =249,5𝑀𝑀𝑔𝑔 𝑥𝑥 𝑔𝑔𝑔𝑔 1000475 gr = 25,48 gram • 𝑚𝑚 𝑀𝑀𝑀𝑀 = 249,563,5 𝑥𝑥 25,48 m Cu = 6,48 gram t = 0 menit 𝑋𝑋𝑚𝑚 = 2,63 − 2,636,48 = 0 𝑋𝑋𝑋𝑋 = 8,6 − 8,68,6 = 0 t = 5 menit 𝑋𝑋𝑚𝑚 = 2,71 − 2,636,48 = 0,0123 𝑋𝑋𝑋𝑋 = 8,6 − 10,38,6 = 0,197 t = 10 menit 𝑋𝑋𝑚𝑚 = 2,73 − 2,636,48 = 0,0154 𝑋𝑋𝑋𝑋 = 8,6−10,78,6 = −0,36
t = 15 menit
𝑋𝑋𝑚𝑚 = 2,74 − 2,636,48 = 0,0169 𝑋𝑋𝑋𝑋 = 8,6 − 118,6 = −0,279
b) I = 80mA; 250 rpm; K=Cu; A=C
• (V.N) CuSO4.5H2O = (V.N) Na2S2O3.5H2O 5 .N = 11 . 0,25 N = 0,55 M = 0,275 N • 𝑀𝑀 =𝑀𝑀𝑔𝑔𝑔𝑔𝑔𝑔 𝑥𝑥 1000𝑉𝑉 0,275 =249,5𝑀𝑀𝑔𝑔 𝑥𝑥 𝑔𝑔𝑔𝑔 1000475 gr = 32,59 gram • 𝑚𝑚 𝑀𝑀𝑀𝑀 = 249,563,5 𝑥𝑥 32,59 m Cu = 8,9244 gram t = 0 menit 𝑋𝑋𝑚𝑚 = 2,66 − 2,668,2944 = 0 𝑋𝑋𝑋𝑋 = 11 − 1111 = 0 t = 5 menit 𝑋𝑋𝑚𝑚 = 2,73 − 2,668,2944 = 0,008439 𝑋𝑋𝑋𝑋 = 11 − 9,711 = 0,1181 t = 10 menit 𝑋𝑋𝑚𝑚 = 2,69−2,668,2944 = 0,00361689
𝑋𝑋𝑋𝑋 = 11 − 10,211 = 0,0727 t = 15 menit 𝑋𝑋𝑚𝑚 = 2,71 − 2,668,2944 = 0,006028 𝑋𝑋𝑋𝑋 = 11 − 10,511 = 0,045 2. Variabel Pengadukan a) I = 60mA; 250 rpm; K=C; A=Cu • (V.N) CuSO4.5H2O = (V.N) Na2S2O3.5H2O 5 .N = 10,5 . 0,25 N = 0,5 M = 0,25 N • 𝑀𝑀 =𝑀𝑀𝑔𝑔𝑔𝑔𝑔𝑔 𝑥𝑥 1000𝑉𝑉 0,25 =249,5𝑀𝑀𝑔𝑔 𝑥𝑥 𝑔𝑔𝑔𝑔 1000475 gr = 29,628 gram • 𝑚𝑚 𝑀𝑀𝑀𝑀 = 249,563,5 𝑥𝑥 29,628 m Cu = 7,54 gram t = 0 menit 𝑋𝑋𝑚𝑚 = 0,43 − 0,437,54 = 0 𝑋𝑋𝑋𝑋 = 10,5 − 10,510,5 = 0 t = 4 menit 𝑋𝑋𝑚𝑚 = 0,4 − 0,437,54 = −0,003978 𝑋𝑋𝑋𝑋 = 10,5−10,210,5 = 0,028
t = 8 menit 𝑋𝑋𝑚𝑚 = 0,47 − 0,437,54 = 0,0053 𝑋𝑋𝑋𝑋 = 10,5 − 9,910,5 = 0,0571 t = 12 menit 𝑋𝑋𝑚𝑚 = 0,45 − 0,437,54 = 0,00265 𝑋𝑋𝑋𝑋 = 10,5 − 9,610,5 = 0,0857 b) I = 60mA; 300 rpm; K=C; A=Cu • (V.N) CuSO4.5H2O = (V.N) Na2S2O3.5H2O 5 .N = 9,6 . 0,25 N = 0,48 M = 0,24 N • 𝑀𝑀 =𝑀𝑀𝑔𝑔𝑔𝑔𝑔𝑔 𝑥𝑥 1000𝑉𝑉 0,24 = 𝑔𝑔𝑔𝑔 249,5𝑀𝑀𝑔𝑔 𝑥𝑥 1000 475 gr = 28,443 gram • 𝑚𝑚 𝑀𝑀𝑀𝑀 = 249,563,5 𝑥𝑥 28,443 m Cu = 7,239 gram t = 0 menit 𝑋𝑋𝑚𝑚 = 0,38 − 0,387,239 = 0 𝑋𝑋𝑋𝑋 = 9,6 − 9,69,6 = 0 t = 4 menit
𝑋𝑋𝑚𝑚 = 0,4 − 0,387,239 = 0,00276 𝑋𝑋𝑋𝑋 = 9,6 − 9,19,6 = 0,052 t = 8 menit 𝑋𝑋𝑚𝑚 = 0,39 − 0,387,239 = 0,00138 𝑋𝑋𝑋𝑋 = 9,6 − 10,39,6 = −0,0729 t = 12 menit 𝑋𝑋𝑚𝑚 = 0,42 − 0,387,239 = 0,005525 𝑋𝑋𝑋𝑋 = 9,6 − 9,79,6 = −0,0104 3. Variabel Waktu
a) I = 60mA; tanpa pengadukan; K=Fe; A=Cu • (V.N) CuSO4.5H2O = (V.N) Na2S2O3.5H2O 5 .N = 9,7 . 0,25 N = 0,485 M = 0,2425 N • 𝑀𝑀 =𝑀𝑀𝑔𝑔𝑔𝑔𝑔𝑔 𝑥𝑥 1000𝑉𝑉 0,2425 =249,5𝑀𝑀𝑔𝑔 𝑥𝑥 𝑔𝑔𝑔𝑔 1000475 gr = 28,739 gram • 𝑚𝑚 𝑀𝑀𝑀𝑀 = 249,563,5 𝑥𝑥 29,628 m Cu = 7,3144 gram t = 0 menit
𝑋𝑋𝑚𝑚 = 1,43 − 1,437,3144 = 0 𝑋𝑋𝑋𝑋 = 9,7 − 9,79,7 = 0 t = 3 menit 𝑋𝑋𝑚𝑚 = 1,46 − 1,437,3144 = 0,0041014 𝑋𝑋𝑋𝑋 = 9,7 − 10,29,7 = −0,0103 t = 6 menit 𝑋𝑋𝑚𝑚 = 1,48 − 1,437,3144 = 0,006835 𝑋𝑋𝑋𝑋 = 9,7 − 9,79,7 = 0 t = 9 menit 𝑋𝑋𝑚𝑚 = 1,5 − 1,437,3144 = 0,00957 𝑋𝑋𝑋𝑋 = 9,7 − 9,29,7 = 0,0515
b) I = 60mA; tanpa pengadukan; K=Fe; A=Cu • (V.N) CuSO4.5H2O = (V.N) Na2S2O3.5H2O 5 .N = 9,7 . 0,25 N = 0,485 M = 0,2425 N • 𝑀𝑀 =𝑀𝑀𝑔𝑔𝑔𝑔𝑔𝑔 𝑥𝑥 1000𝑉𝑉 0,2425 =249,5𝑀𝑀𝑔𝑔 𝑥𝑥 𝑔𝑔𝑔𝑔 1000475 gr = 28,739 gram • 𝑚𝑚 𝑀𝑀𝑀𝑀 = 249,563,5 𝑥𝑥 29,628 m Cu = 7,3144 gram
t = 0 menit 𝑋𝑋𝑚𝑚 = 1,43 − 1,437,3144 = 0 𝑋𝑋𝑋𝑋 = 9,7 − 9,79,7 = 0 t = 5 menit 𝑋𝑋𝑚𝑚 = 1,48 − 1,437,3144 = 0,006835 𝑋𝑋𝑋𝑋 = 9,7 − 9,89,7 = −0,0103 t = 10 menit 𝑋𝑋𝑚𝑚 = 1,5 − 1,437,3144 = 0,00957 𝑋𝑋𝑋𝑋 = 9,7 − 11,19,7 = −0,1443 t = 15 menit 𝑋𝑋𝑚𝑚 = 1,51 − 1,43 7,3144 = 0,0109 𝑋𝑋𝑋𝑋 = 9,7 − 9,49,7 = 0,309
4. Perbandingan Massa Katoda Praktis dan Teoritis • Massa Praktis
1. I=60mA; 250 rpm; K=Cu; A=C t = 0 menit W=W-Wo = 2,63-2,63 = 0 gram t = 5 menit W=W-Wo = 2,71-2,63 = 0,08 gram t = 10 menit W=W-Wo = 2,73-2,63 = 0,10 gram t = 15 menit W=W-Wo = 2,74-2,63 = 0,11 gram
2. I=80mA; 250 rpm; K=Cu; A=C t = 0 menit W=W-Wo = 2,66-2,66 = 0 gram t = 5 menit W=W-Wo = 2,73-2,66 = 0,07 gram t = 10 menit W=W-Wo = 2,69-2,66 = 0,03 gram t = 15 menit W=W-Wo = 2,71-2,66 = 0,05 gram 3. I=60mA; 250 rpm; K=C; A=Cu t = 0 menit W=W-Wo = 0,43-0,43 = 0 gram t = 4 menit W=W-Wo = 0,40-0,43 = -0,03 gram t = 8 menit W=W-Wo = 0,47-0,43 = 0,04 gram t = 12 menit W=W-Wo = 0,45-0,43 = 0,04 gram 4. I=60mA; 300 rpm; K=C; A=Cu t = 0 menit W=W-Wo = 0,38-0,38 = 0 gram t = 4 menit W=W-Wo = 0,40-0,38 = 0,02 gram t = 8 menit W=W-Wo = 0,39-0,38 = 0,01 gram t = 12 menit W=W-Wo = 0,42-0,38 = 0,04 gram
5. I=60mA; tanpa pengadukan; K=Fe; A=Cu; interval 3 menit t = 0 menit W=W-Wo = 1,43-1,43 = 0 gram t = 3 menit W=W-Wo = 1,46-1,43 = 0,03 gram t = 6 menit W=W-Wo = 1,48-1,43 = 0,05 gram t = 9 menit W=W-Wo = 1,50-1,43 = 0,07 gram
6. I=60mA; tanpa pengadukan; K=Fe; A=Cu; interval 5 menit t = 0 menit W=W-Wo = 1,43-1,43 = 0 gram t = 5 menit W=W-Wo = 1,48-1,43 = 0,05 gram t = 10 menit W=W-Wo = 1,50-1,43 = 0,07 gram t = 15 menit W=W-Wo = 1,51-1,43 = 0,08 gram • Massa Teoritis
1. I=60mA; 250 rpm; K=Cu; A=C 𝑚𝑚 =𝑉𝑉𝑉𝑉𝑉𝑉𝑒𝑒𝑉𝑉𝑉𝑉𝑉𝑉 𝑋𝑋𝐴𝐴𝑔𝑔 𝑀𝑀𝑀𝑀 96500𝑉𝑉 𝑥𝑥 𝑡𝑡 t = 0 menit 𝑚𝑚 =63,52 𝑋𝑋0,06 𝑥𝑥 096500 = 0 𝑔𝑔𝑔𝑔𝑉𝑉𝑚𝑚 t = 5 menit 𝑚𝑚 =63,5 2 𝑋𝑋 0,06 𝑥𝑥 300 96500 = 0,005922 𝑔𝑔𝑔𝑔𝑉𝑉𝑚𝑚
t = 10 menit
𝑚𝑚 =63,52 𝑋𝑋0,06 𝑥𝑥 60096500 = 0,011844 𝑔𝑔𝑔𝑔𝑉𝑉𝑚𝑚 t = 15 menit
𝑚𝑚 =63,52 𝑋𝑋0,06 𝑥𝑥 90096500 = 0,017766 𝑔𝑔𝑔𝑔𝑉𝑉𝑚𝑚
2. I=80mA; 250 rpm; K=Cu; A=C 𝑚𝑚 =𝑉𝑉𝑉𝑉𝑉𝑉𝑒𝑒𝑉𝑉𝑉𝑉𝑉𝑉 𝑋𝑋𝐴𝐴𝑔𝑔 𝑀𝑀𝑀𝑀 96500𝑉𝑉 𝑥𝑥 𝑡𝑡 t = 0 menit 𝑚𝑚 =63,52 𝑋𝑋0,08 𝑥𝑥 096500 = 0 𝑔𝑔𝑔𝑔𝑉𝑉𝑚𝑚 t = 5 menit 𝑚𝑚 =63,52 𝑋𝑋0,08 𝑥𝑥 30096500 = 0, ,00789 𝑔𝑔𝑔𝑔𝑉𝑉𝑚𝑚 t = 10 menit 𝑚𝑚 =63,52 𝑋𝑋0,08 𝑥𝑥 60096500 = 0,01579 𝑔𝑔𝑔𝑔𝑉𝑉𝑚𝑚 t = 15 menit 𝑚𝑚 =63,52 𝑋𝑋0,08𝑥𝑥 90096500 = 0,0236 𝑔𝑔𝑔𝑔𝑉𝑉𝑚𝑚 3. I=60mA; 250 rpm; K=C; A=Cu 𝑚𝑚 =𝑉𝑉𝑉𝑉𝑉𝑉𝑒𝑒𝑉𝑉𝑉𝑉𝑉𝑉 𝑋𝑋𝐴𝐴𝑔𝑔 𝑀𝑀𝑀𝑀 96500𝑉𝑉 𝑥𝑥 𝑡𝑡 t = 0 menit 𝑚𝑚 =63,5 2 𝑋𝑋 0,06 𝑥𝑥 0 96500 = 0 𝑔𝑔𝑔𝑔𝑉𝑉𝑚𝑚 t = 4 menit 𝑚𝑚 =63,52 𝑋𝑋0,06 𝑥𝑥 24096500 = 0,0047 𝑔𝑔𝑔𝑔𝑉𝑉𝑚𝑚
t = 8 menit 𝑚𝑚 =63,52 𝑋𝑋0,06 𝑥𝑥 48096500 = 0,0094 𝑔𝑔𝑔𝑔𝑉𝑉𝑚𝑚 t = 12 menit 𝑚𝑚 =63,52 𝑋𝑋0,06 𝑥𝑥 72096500 = 0,0142 𝑔𝑔𝑔𝑔𝑉𝑉𝑚𝑚 4. I=60mA; 300 rpm; K=C; A=Cu 𝑚𝑚 =𝑉𝑉𝑉𝑉𝑉𝑉𝑒𝑒𝑉𝑉𝑉𝑉𝑉𝑉 𝑋𝑋𝐴𝐴𝑔𝑔 𝑀𝑀𝑀𝑀 96500𝑉𝑉 𝑥𝑥 𝑡𝑡 t = 0 menit 𝑚𝑚 =63,52 𝑋𝑋0,06 𝑥𝑥 096500 = 0 𝑔𝑔𝑔𝑔𝑉𝑉𝑚𝑚 t = 4 menit 𝑚𝑚 =63,52 𝑋𝑋0,06 𝑥𝑥 24096500 = 0,00473 𝑔𝑔𝑔𝑔𝑉𝑉𝑚𝑚 t = 8 menit 𝑚𝑚 =63,52 𝑋𝑋0,06 𝑥𝑥 48096500 = 0,00947𝑔𝑔𝑔𝑔𝑉𝑉𝑚𝑚 t = 12 menit 𝑚𝑚 =63,52 𝑋𝑋0,06 𝑥𝑥 72096500 = 0,0142 𝑔𝑔𝑔𝑔𝑉𝑉𝑚𝑚
5. I=60mA; tanpa pengadukan; K=Fe; A=Cu, 3 menit 𝑚𝑚 =𝑉𝑉𝑉𝑉𝑉𝑉𝑒𝑒𝑉𝑉𝑉𝑉𝑉𝑉 𝑋𝑋𝐴𝐴𝑔𝑔 𝑀𝑀𝑀𝑀 96500𝑉𝑉 𝑥𝑥 𝑡𝑡 t = 0 menit 𝑚𝑚 =63,52 𝑋𝑋0,06 𝑥𝑥 096500 = 0 𝑔𝑔𝑔𝑔𝑉𝑉𝑚𝑚 t = 3 menit 𝑚𝑚 =63,52 𝑋𝑋0,06 𝑥𝑥 18096500 = 0,00355 𝑔𝑔𝑔𝑔𝑉𝑉𝑚𝑚 t = 6 menit
𝑚𝑚 =63,52 𝑋𝑋0,06 𝑥𝑥 36096500 = 0,0071 𝑔𝑔𝑔𝑔𝑉𝑉𝑚𝑚
t = 9 menit
𝑚𝑚 =63,52 𝑋𝑋0,06 𝑥𝑥 54096500 = 0,01066 𝑔𝑔𝑔𝑔𝑉𝑉𝑚𝑚
6. I=60mA; tanpa pengadukan; K=Fe; A=Cu, 5 menit 𝑚𝑚 =𝑉𝑉𝑉𝑉𝑉𝑉𝑒𝑒𝑉𝑉𝑉𝑉𝑉𝑉 𝑋𝑋𝐴𝐴𝑔𝑔 𝑀𝑀𝑀𝑀 96500𝑉𝑉 𝑥𝑥 𝑡𝑡 t = 0 menit 𝑚𝑚 =63,52 𝑋𝑋0,06 𝑥𝑥 096500 = 0 𝑔𝑔𝑔𝑔𝑉𝑉𝑚𝑚 t = 5 menit 𝑚𝑚 =63,52 𝑋𝑋0,06 𝑥𝑥 30096500 = 0,005922 𝑔𝑔𝑔𝑔𝑉𝑉𝑚𝑚 t = 10 menit 𝑚𝑚 =63,52 𝑋𝑋0,06 𝑥𝑥 60096500 = 0,011844 𝑔𝑔𝑔𝑔𝑉𝑉𝑚𝑚 t = 15 menit 𝑚𝑚 =63,52 𝑋𝑋0,06 𝑥𝑥 90096500 = 0,0177 𝑔𝑔𝑔𝑔𝑉𝑉𝑚𝑚
MATERI : Elektrokimia I. VARIABEL
Variabel I : K=Cu; A=C; I=60mA dan 80mA; 250 rpm; t=0,5,10,15 menit
Variabel II : K=C; A=Cu; I=60mA; 250 rpm dan 300 rpm; t=0,4,8,12 menit
Variabel III : K=Fe; A=Cu; I=60mA; tidak ada pengadukan; t=0,3,6,9 menit dan t=0,5,10,15 menit
II. BAHAN DAN ALAT • CuSO4.5H2O • KI • Na2S2O3.5H2O • Amilum • Aquadest • Tangki elektrokimia • Batang tembaga • Batang Grafit • Batang besi • voltmeter/amperemeter • adaptor
• magnetic stirrer dan magnetic bar
DATA HASIL PERCOBAAN
LABORATURIUM DASAR TEKNIK KIMIA II JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS DIPONEGORO
III. CARA KERJA
1. Isi tangki elektrolisis dengan 475ml larutan CuSO4. 5H2O.
2. Letakkan katoda dan anoda pada tangki dengan posisi yang permanen. Hubungkan anoda dengan kutub positif dan katoda dengan kutub negatif penyearah arus.
3. Alirkan arus bertegangan rendah (besar arus bisa divariasi) dan jalankan pengadukan dengan perlahan-lahan.
4.Ketika mencapai waktu yang ditentukan, hentikan pengadukan dan arus listrik dan ambil katoda. Selanjutnya keringkan dan timbang. Analisa cairan bekas elektrolisa dengan metode titrasi iodometri untuk mengetahui kandungan Cu2+ yang tersisa.
Keterangan : Variabel berubah : arus listrik, kecepatan pengadukan, waktu elektrolisis.
Analisa Hasil
1. Ambil 5ml cairan sisa hasil elektrolisis, masukkan dalam Erlenmeyer dan selanjutnya tambahkan 3ml KI 10% berat.
2. Tutup mulut labu Erlenmeyer dengan gelas arloji kecil dan biarkan 5 menit di tempat gelap agar reaksi berlangsung sempurna. Selanjutnya cuci tutup gelas arloji dengan aquadest dan masukkan air cucian dalam Erlenmeyer.
3. Titrasi larutan tersebut dengan larutan Na2S2O3. 5H2O sampai warna larutan berubah menjadi kuning.
4. Selanjutnya tambahkan 3 tetes amylum ke dalam campuran dan titrasi lagi Na2S2O3. 5H2O sampai warna biru tepat hilang (putih susu)
Cara Perhitungan 1. 𝑋𝑋1 = 𝑀𝑀−𝑀𝑀𝑀𝑀
𝑀𝑀𝑀𝑀𝑀𝑀
Keterangan : X1 = konversi massa
M0 = berat katoda sebelum elektrolisa MCu = berat tembaga dalam cairan mula-mula
2. 𝑋𝑋2 = 𝑉𝑉𝑀𝑀.𝑁𝑁−𝑉𝑉.𝑁𝑁
𝑉𝑉𝑀𝑀.𝑁𝑁 = 𝑉𝑉𝑀𝑀−𝑉𝑉
𝑉𝑉𝑀𝑀
Keterangan : Vo = Volume larutan Na2S2O3.5H2O sebelum elektrolisis V = Volume larutan Na2S2O3.5H2O setelah elektrolisis N = Normalitas larutan Na2S2O3. 5H2O
IV. HASIL PERCOBAAN
Variabel 1 I=60mA ; 250 rpm; K=Cu; A=C
t(menit) m(gram) v(ml) Xm Xv 0 2,63 8,6 0 0 5 2,71 10,3 0,0123 -0,197 10 2,73 11,7 0,0154 -0,36 15 2,74 11 0,0169 -0279
Variabel 2 I=80mA; 250 rpm; K=Cu; A=C
t(menit) m(gram) v(ml) Xm Xv
0 2,66 11 0 0
5 2,73 9,7 8,439x10-3 0,1181 10 2,69 10,2 3,61689x10-3 0,0727 15 2,71 10,5 6,028x10-3 0,045
Variabel 3 I=60mA; 250 rpm; K=C; A=Cu
t(menit) m(gram) v(ml) Xm Xv
0 0,43 10,5 0 0
4 0,40 10,2 -3.978x10-3 0,028 8 0,47 9,9 5,3x10-3 0,0371 12 0,45 9,6 2,65x10-3 0,0857
Variabel 4 I=60mA; 300 rpm; K=C; A=Cu t(menit) m(gram) v(ml) Xm Xv 0 0,38 9,6 0 0 4 0,40 9,1 2,76x10-3 0,052 8 0,39 10,3 1,38x10-3 -0,0729 12 0,42 9,7 5,52x10-3 -0,0104
Variabel 5 I=60mA; tanpa pengadukan; K= Fe; A=Cu
t(menit) m(gram) v(ml) Xm Xv
0 1,43 9,7 0 0
3 1,46 10,2 4,1014x10-3 -0,103
6 1,48 9,7 -0,142 0
9 1,50 9,2 -0,138 0,0515
Variabel 6 I=60mA; tanpa pengadukan; K=Fe; A=Cu
t(menit) m(gram) v(ml) Xm Xv 0 1,43 9,7 0 0 5 1,48 9,8 6,835x10-3 -0,0103 10 1,50 11,1 9,57x10-3 -0,1443 15 1,51 9,4 0,0109 0,309 MENGETAHUI ASISTEN Supriyandi NIM. L2C009060
PRAKTIKUM KE : 4
MATERI : ELEKTROKIMIA HARI/TANGGAL : 16 APRIL 2013 KELOMPOK : 4/RABU SIANG
NAMA : 1. AFIN NURDIANSYAH 2. ABRAR HARIST
3. KUSUMA BETHA CAHAYA IMANI ASISTEN : SUPRIYANDI
KUANTITAS REAGEN
NO JENIS REAGEN KUANTITAS
1. 2. 3. 4. 5. CuSO4.5H2O Na2S2O3.5H2O KI Amylum Aquadest 0,45N 475ml 0,25N 250ml 10% W 50ml secukupnya secukupnya TUGAS TAMBAHAN CATATAN Semarang, 16 April 2013 ASISTEN NIM L2C009060 LEMBAR KUANTITAS REAGEN
LABORATURIUM DASAR TEKNIK KIMIA II JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS DIPONEGORO
• Jurnal Aplikasi Elektrokimia • MSDS setiap Reagen
1. Variabel 1 : K=Cu;A=C;;250 rpm; I=60 & 80mA;t=0,5,10,15 menit
2. Variabel 2 : K=C;A=Cu;I=60mA;250 rpm & 300 rpm;t=0,4,8,12 menit
3. Variabel 3 :
K=Fe;A=Cu;I=60mA;tanpa pengadukan t=0,5,10,15 menit & t=0,3,6,9 menit
bgnhqwAw cff*
DIPERIKSA NO TANGGAL KETERANGAN TANDA TANGAN 1 3 Juni 2013 P1 - Hal. Pengesahan - Kata Pengantar - Daftar Isi - Intisari - Lengkapi Bab II- Perbaiki BAB IV dan BAB V
2 4 Juni 2013 - Hal 2. Daftar Isi (jangan di bold) - Intisari
- Aplikasi Bab II - ganti “arus” dengan “over”
- Hal 19 - Penutup
3 5 Juni 2013 - Lembar Pengesahan - Halaman 4
- Bab V
- Intisari dan Summary 1 spasi