4. HASIL DAN PEMBAHASAN
4.1. Kualitas Perairan Pulau Onrust, Teluk Jakarta
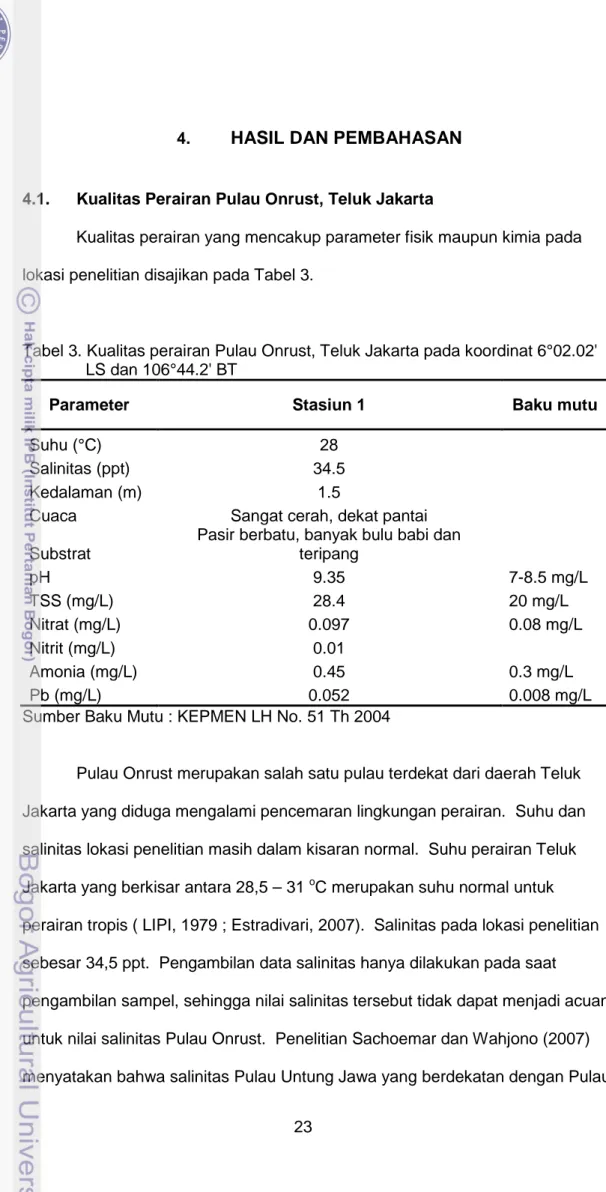
Kualitas perairan yang mencakup parameter fisik maupun kimia pada lokasi penelitian disajikan pada Tabel 3.
Tabel 3. Kualitas perairan Pulau Onrust, Teluk Jakarta pada koordinat 6°02.02' LS dan 106°44.2' BT
Parameter Stasiun 1 Baku mutu
Suhu (°C) 28
Salinitas (ppt) 34.5
Kedalaman (m) 1.5
Cuaca Sangat cerah, dekat pantai
Substrat
Pasir berbatu, banyak bulu babi dan
teripang
pH 9.35 7-8.5 mg/L
TSS (mg/L) 28.4 20 mg/L
Nitrat (mg/L) 0.097 0.08 mg/L
Nitrit (mg/L) 0.01
Amonia (mg/L) 0.45 0.3 mg/L
Pb (mg/L) 0.052 0.008 mg/L
Sumber Baku Mutu : KEPMEN LH No. 51 Th 2004
Pulau Onrust merupakan salah satu pulau terdekat dari daerah Teluk Jakarta yang diduga mengalami pencemaran lingkungan perairan. Suhu dan salinitas lokasi penelitian masih dalam kisaran normal. Suhu perairan Teluk Jakarta yang berkisar antara 28,5 – 31 oC merupakan suhu normal untuk perairan tropis ( LIPI, 1979 ; Estradivari, 2007). Salinitas pada lokasi penelitian sebesar 34,5 ppt. Pengambilan data salinitas hanya dilakukan pada saat
pengambilan sampel, sehingga nilai salinitas tersebut tidak dapat menjadi acuan untuk nilai salinitas Pulau Onrust. Penelitian Sachoemar dan Wahjono (2007) menyatakan bahwa salinitas Pulau Untung Jawa yang berdekatan dengan Pulau
23
Onrust pada tahun 2004 mencapai 33 ppt. Phallusia sp. ditemukan pada daerah pasir berbatu dan berasosiasi dengan biota laut yang bergerak seperti bulu babi dan teripang. Semua parameter kimia perairan pada lokasi penelitian terlihat bahwa konsentrasinya melebihi kadar baku mutu yang ditetapkan untuk biota laut ( KEPMEN LH No. 51, 2004). Nilai derajat keasaman berbeda jauh dengan kondisi umum perairan laut yang rata-rata memiliki pH 8. Hal ini diduga karena terjadinya penambahan limbah yang terjadi terus menerus baik limbah domestik maupun industri (organik). Limbah organik tersebut terdekomposisi di perairan.
Proses dekomposisi (penguraian oleh mikroorganisme) bahan organik
berlangsung cepat dan dapat terjadi ketika pH perairan dalam keadaan alkalis (pH tinggi) (Effendi, 2007). Hal ini juga membuktikan bahwa tunikata dapat ditemukan di perairan yang memiliki pH di atas ambang batas untuk sebagian besar biota akuatik. Effendi (2007) menyebutkan bahwa sebagian besar biota akuatik sensitif terhadap perubahan pH dan menyukai pH dengan rentang 7 - 8,5.
Total Suspended Solid (TSS) atau zat padat tersuspensi merupakan partikel yang melayang di dalam air dan berasal dari komponen hidup seperti mikroorganisme serta komponen mati seperti detritus. TSS adalah partikel organik maupun anorganik yang tertahan pada kertas saring miliopore dengan pori 0,45 µm. TSS merupakan salah satu faktor yang mempengaruhi kadar logam berat di kolom perairan. Semakin banyak TSS dalam suatu perairan maka konsentrasi ion logam berat akan berkurang, karena semakin luas permukaan partikel untuk mengarbsorpsi ion logam dalam perairan (Effendi, 2007).
Konsentrasi Pb di sekitar Pulau Onrust menunjukkan nilai di atas baku mutu. Hal ini disebabkan oleh beberapa faktor seperti korofikasi mineral dan aktivitas manusia seperti buangan limbah, juga terdapat adanya aktivitas kapal
(tumpahan minyak dan oli bekas). Dua pabrik cat yaitu P.T Pasifik Paint dan P.T Nippon Paint yang menghasilkan limbah campuran pembuat cat untuk bahan pewarna juga menjadi salah satu penyebab terjadinya pencemaran
(Estradivari,2007; Rochyatun dan Razak, 2007).
Pulau Onrust yang meskipun kondisi perairannya tercemar masih bisa ditemukan tunikata. Berdasarkan penelitian Carman et al (2007), beberapa jenis tunikata ditemukan pada kondisi perairan yang memiliki kandungan nitrogen yang tinggi dan kejernihan air yang buruk. Tunikata juga sangat adaptif
terhadap polutan dan dapat hidup di perairan yang tercemar berat serta memiliki sedimentasi yang tinggi. Hal ini disebabkan tunikata dapat menyaring partikel organik dan anorganik, sehingga organisme ini menjadi salah satu biota uji bioassay (Abrar, 2004; Draughon, 2010).
4.2. Isolasi dan Hasil TPC Bakteri Asosiasi dari Phallusia sp.
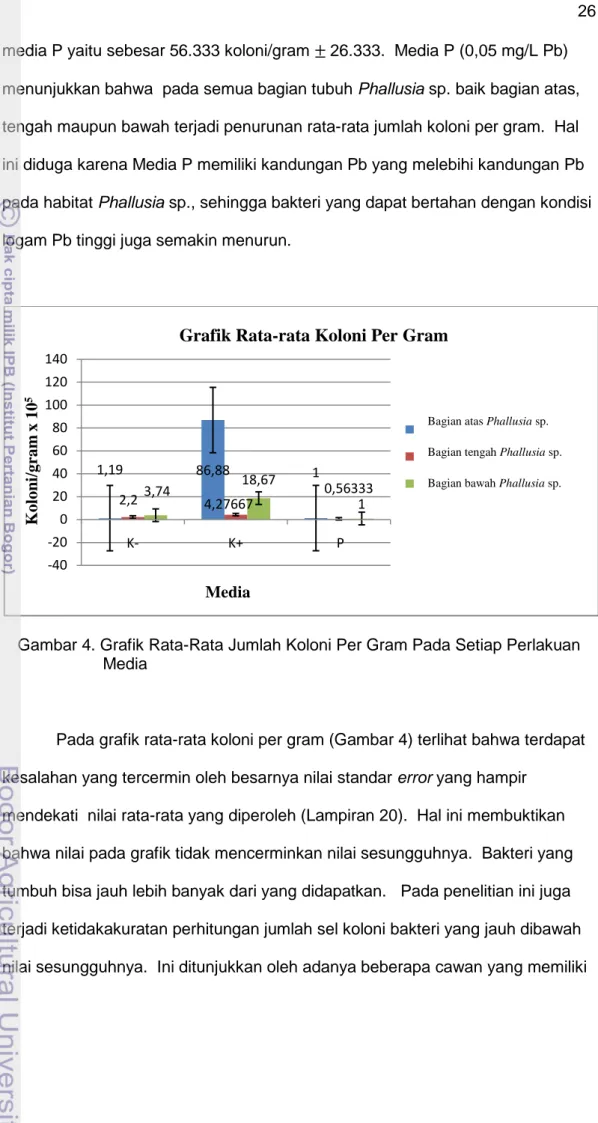
Isolasi bakteri dilakukan dengan menginokulasikan 0,1 ml yang diambil dari pengenceran 10-3, 10-4, dan 10-5. Pengenceran tersebut bertujuan untuk mengurangi jumlah mikroorganisme yang tumbuh. Isolasi bakteri untuk masing- masing pengenceran dilakukan sebanyak tiga kali ulangan. Hasil perhitungan jumlah rata-rata koloni per gram dengan metode TPC dapat dilihat pada Gambar 4 dan hasil pengukuran jumlah TPC dapat dilihat pada Lampiran 20. Hasil perhitungan menunjukkan perbedaan nilai tertinggi dan terendah dari rata-rata jumlah (koloni per gram) yang terdapat di setiap perlakuan media. Rata-rata jumlah koloni per gram tertinggi terdapat pada bagian atas Phallusia sp. yang ditumbuhkan pada media K+ yaitu mencapai 8.688 x 103
koloni/gram 8.656.006. Sedangkan untuk rata-rata jumlah koloni/gram terendah terdapat pada bagian tengah Phallusia sp. yang ditumbuhkan pada
media P yaitu sebesar 56.333 koloni/gram 26.333. Media P (0,05 mg/L Pb) menunjukkan bahwa pada semua bagian tubuh Phallusia sp. baik bagian atas, tengah maupun bawah terjadi penurunan rata-rata jumlah koloni per gram. Hal ini diduga karena Media P memiliki kandungan Pb yang melebihi kandungan Pb pada habitat Phallusia sp., sehingga bakteri yang dapat bertahan dengan kondisi logam Pb tinggi juga semakin menurun.
Gambar 4. Grafik Rata-Rata Jumlah Koloni Per Gram Pada Setiap Perlakuan Media
Pada grafik rata-rata koloni per gram (Gambar 4) terlihat bahwa terdapat kesalahan yang tercermin oleh besarnya nilai standar error yang hampir
mendekati nilai rata-rata yang diperoleh (Lampiran 20). Hal ini membuktikan bahwa nilai pada grafik tidak mencerminkan nilai sesungguhnya. Bakteri yang tumbuh bisa jauh lebih banyak dari yang didapatkan. Pada penelitian ini juga terjadi ketidakakuratan perhitungan jumlah sel koloni bakteri yang jauh dibawah nilai sesungguhnya. Ini ditunjukkan oleh adanya beberapa cawan yang memiliki
1,19 86,88 1
2,2 3,74 4,2766718,67 0,56333 1
-40 -20 0 20 40 60 80 100 120 140
K- K+ P
bagian atas bagian tengah bagian bawah
Media
Koloni/gram x 105
Grafik Rata-rata Koloni Per Gram
Bagian atas Phallusia sp.
Bagian tengah Phallusia sp.
Bagian bawah Phallusia sp.
nilai yang terlalu tinggi sehingga dikategorikan sebagai TBUD (Tidak Bisa Untuk Dihitung). TBUD merupakan cawan yang berisi koloni bakteri di luar rentang jumlah 30 – 300 koloni. TBUD pada penelitian ini terhitung di atas 300 koloni.
Pada cawan yang mengalami TBUD, tidak dilakukan perhitungan. Media K- memiliki cawan TBUD yang lebih banyak. Hal ini memberi dugaan bahwa jumlah total koloni per gram pada media K- mempunyai jumlah total koloni per gram yang lebih banyak. Sehingga tidak tepat jika media K+ memiliki nilai tertinggi karena terdapatnya cawan TBUD pada media lainnya. Cawan yang mengalami TBUD dapat dilihat pada Tabel 4. Wahl (1995) menyatakan bahwa rata-rata jumlah koloni bakteri asosiasi yang ditemukan pada ascidian di daerah Bahamian dan Pasifik mencapai 1,2 x 107/cm2 . Sedangkan pada penelitian ini hanya dilakukan hingga pengenceran 105 yang ternyata pengenceran tersebut belum optimal untuk isolasi bakteri pada tunikata.
Tabel 4. Cawan yang Mengalami TBUD (Tidak Bisa Untuk Dihitung)
RATA-RATA JUMLAH KOLONI/GRAM K-
Pengenceran 0.5 gr atas 0.5 gr tengah 0.5 gr bawah
103 27x103 100x103 * 12x103 *
104 3x104 * 16x104 * 1x104 *
105 3x105 * 4x105 * 11x105 *
RATA-RATA JUMLAH KOLONI/GRAM K+
Pengenceran 0.5 gr atas 0.5 gr tengah 0.5 gr bawah
103 14x103 23x103 * 34x103
104 5x104 * 16x104 * TBUD
105 260x105 * 11x105 * 37x105
RATA-RATA JUMLAH KOLONI/GRAM P
Pengenceran 0.5 gr atas 0.5 gr tengah 0.5 gr bawah 103 34x103 * 9x103 7x103
104 14x104 6x104 * 5x104
105 2x105 1x105 * 2x105 *
*Tidak mencerminkan nilai sesungguhnya karena mengalami TBUD
Perbedaan pola pertumbuhan rata-rata jumlah koloni per gram ini juga diduga karena adanya perbedaan jumlah konsentrasi Pb yang terkandung dalam tiap media. Kemampuan mengakumulasi logam berat yang berbeda dari
masing-masing koloni juga mempengaruhi pola pertumbuhan bakteri asosiasi.
Hal lain yang menyebabkan perbedaan pola pertumbuhan adalah faktor-faktor fisik perairan (dinamika air laut) yang dapat mempengaruhi sebaran bakteri di laut secara bebas maupun berasosiasi dengan organisme laut, sehingga
menyebabkan perhitungan jumlah sel/koloni bakteri bervariasi (Sidharta, 2006).
Inkubasi dilakukan pada suhu 37 oC. Suhu inkubasi ini tidak sesuai dengan suhu dimana biota tersebut hidup yaitu sebesar 28 oC. Meskipun pada suhu yang jauh lebih tinggi dari suhu habitat asalnya, namun koloni bakteri masih bisa tumbuh dan diperkirakan akan jauh lebih banyak jika bakteri diinkubasi pada suhu habitat aslinya.
Tunikata diketahui memiliki kemampuan menyaring 3-4 L air/jam. Air tersebut masuk melalui inhalant siphon yang terdapat pada bagian atas tubuh tunikata. Pada proses penyaringan air tersebut menyebabkan bakteri atau organisme lainnya akan ikut tersaring masuk ke tubuhnya. Kemungkinan ini yang menyebabkan pada bagian atas tunikata jumlah koloni bakteri lebih banyak ditemukan. Pada tunikata bakteri asosiasi banyak ditemukan pada gonad dan di jaringan permukaan tunik yang berfungsi membantu proses reproduksinya (Rheinheimer, 1992; Tait et al, 2007). Hal ini yang menyebabkan jumlah total koloni per gram pada bagian bawah Phallusia sp. yang mana terdapat saluran reproduksinya, lebih tinggi dibanding bagian tengah tubuhnya.
Bakteri yang hidup di laut memiliki kecenderungan untuk berasosiasi dengan suatu lapisan benda padat, termasuk didalamnya organisme invertebrata seperti tunikata (jenis Phallusia sp.). Sebagian besar bakteri laut menjadi
teradaptasi dengan kehidupan sesil yang diakibatkan oleh rendahnya kandungan nutrien dalam air laut dan konsentrasi nutrien lebih tinggi pada benda padat, sehingga bakteri bersimbiosis dengan hewan untuk mendapatkan makanan dari tubuh hewan tersebut (Rheinheimer, 1992; Sidharta, 2006).
4.3. Karakterisasi Bakteri Asosiasi dari Phallusia Sp.
Hasil isolasi dari bakteri asosiasi Phallusia sp. yang diuji didapat keduapuluh empat isolat terbaik. Isolat tersebut mempunyai keragaman baik sifat Gram dan bentuk selnya untuk dikarakterisasi secara morfologi dan
fisiologis. Keduapuluh empat isolat tersebut 6 diantaranya berasal dari media K- , 7 dari media K+, dan 11 dari media P. Identifikasi morfologi dan fisiologi koloni terpilih dapat dilihat pada Tabel 5.
4.3.1. Sifat morfologi koloni dan sel bakteri
Hasil pengamatan terhadap morfologi terpilih dapat diketahui bahwa semua koloni memiliki warna dan elevasi yang sama yaitu putih susu dan timbul, sedangkan untuk bentuk koloninya beragam (Tabel 5.).
Bakteri memiliki warna karena terjadinya ekskresi zat warna ke dalam medium atau yang disebut dengan pigmentasi sel. Zat-zat warna pada bakteri terdiri atas karotenoid yang memberi warna kuning, jingga, dan merah. Zat fenazin yang menghasilkan jingga-kuning, jingga tua, dan merah jingga. Selain itu terdapat zat pirol, zat melanin yang memberi warna coklat, hitam, jingga, dan merah (Schlegel, 1994). Hasil penelitian Savitri (2006) menyebutkan bahwa warna koloni bakteri putih susu disebabkan karena adanya zat karotenoid.
Pigmen dari mikroorganisme merupakan salah satu proses metabolit sekunder yang dapat membentuk zat berkhasiat lain (Schlegel, 1994). Pigmen yang
terdapat pada bakteri juga diduga berfungsi sebagai sistem pengangkut dalam proses respirasi (Salle, 1961 dalam Savitri, 2006).
Morfologi sel bakteri yang diamati meliputi bentuk sel, pewarnaan Gram, pewarnaan spora, dan uji motilitas yang dapat dilihat pada Tabel 5.
Dokumentasi dari pengamatan morfologi sel dapat dilihat Lampiran 21.
Pada tabel terlihat bahwa isolat memiliki bentuk sel dominan yaitu basil pendek, akan tetapi ada beberapa isolat yang memiliki bentuk sel kokus dan basil panjang. Hasil uji pewarnaan Gram didapat bakteri dominan bersifat Gram negatif.
Uji pewarnaan spora hanya dilakukan pada bakteri basil yang bersifat Gram positif dan hanya satu isolat yang memiliki sifat tersebut. Bakteri yang memiliki sel vegetatif berarti bakteri tersebut tidak memiliki spora. Bentuk sel vegetatif sama dengan bentuk sel asalnya. Hal ini di duga dapat disebabkan oleh pecahnya sel spora ketika masa inkubasi. Pada pewarnaan spora, pewarna utama (malachite green) dilakukan dengan proses pemanasan agar dapat merembes ke spora, sedangkan pada sel vegetatifnya akan menyerap safranin (Pelczar, 1986). Pembentukan spora bukan merupakan tahap siklus hidup, akan tetapi baru akan dibentuk apabila tidak tersedia nutrien atau produksi metabolismenya menumpuk.
Pada uji motilitas hampir semua isolat memiliki sifat motil. Hasil
penelitian ZoBell (1946) dalam Sidharta (2006) menyatakan bahwa sekitar 80%
jenis bakteri yang hidupnya di laut diketahui berbentuk batang dan memiliki sifat Gram negatif juga jarang ditemukannya bakteri pembentuk spora. Sebagian besar bakteri laut bersifat motil (bergerak) karena memiliki flagella sebagai adaptasi terhadap lingkungannya yang hidup di perairan sebelum bertemu dengan hewan asosiasinya (Rheinheimer, 1992).
4.3.2. Sifat fisiologis koloni bakteri
Uji fisiologis digunakan untuk mengetahui sifat-sifat biokimia bakteri yang diisolasi . Uji ini meliputi uji hidrolisis pati, uji hidrolisis protein, uji hidrolisis lemak, uji katalase, uji oksidase, uji H2S, uji indol, dan uji fermentasi gula yang meliputi glukosa, sukrosa, laktosa, dan mannose. Hasil pengamatan uji fisiologis dapat dilihat pada Tabel 5.
Hidrolisis merupakan proses pemecahan molekul menjadi dua bagian atau menjadi bagian yang lebih kecil dengan bantuan reaksi air. Uji hidrolisis dilakukan untuk mengetahui apakah bakteri memiliki kemampuan untuk
menghasilan enzim yang dapat memecah pati, protein, dan karbohidrat. Hasil uji hidrolisis pati yang dilakukan menunjukkan adanya 16 isolat yang mampu
menghidrolisis pati menjadi molekul maltose, glukosa, dan dekstrin (Hadioetomo, 1985). Bakteri yang dapat menghidrolisis pati memiliki enzim amilase dan dapat memecah pati menjadi molekul yang lebih sederhana. Pati sendiri merupakan partikel berukuran besar yang terdiri dari polimer berantai lurus yang memiliki 200-300 unit glukosa dan amilopektin (Hadioetomo, 1985). Zat pati bereaksi secara kimia dengan iodium dan terlihat sebagai warna biru kehitaman. Warna ini terjadi apabila iodium masuk ke dalam bagian yang kosong pada molekul zat pati. Jika zat pati telah diuraikan menjadi maltose atau glukosa maka warna biru tidak terbentuk. Tidak terbentuknya warna biru merupakan petunjuk adanya hidrolisis pati (Lay, 1994).
Hasil uji hidrolisis protein ditemukan satu isolat yang mampu
menghidrolisis protein. Bakteri yang mampu menghidrolisis protein mempunyai enzim proteinase ekstraseluler. Enzim tersebut merupakan enzim pemecah protein yang diproduksi di dalam sel dan kemudian dikeluarkan dari sel (Fardiaz, 1987). Media untuk pengujian ditambah dengan susu skim. Bakteri yang tidak
memiliki aktivitas proteolitik (memecah protein) menyebabkan media disekeliling tempat tumbuh tetap keruh, sedangkan bakteri yang memiliki aktivitas proteolitik akan memecah protein sehingga perubahan dapat dilihat disekeliling koloni dengan terbentuknya areal bening.
Hasil uji hidrolisis lemak ditemukan 20 isolat yang mampu menghidrolisis lemak. Bakteri yang mampu menghidrolisis lemak mempunyai enzim lipase ekstraseluler yang akan memecah lemak menjadi asam lemak dan gliserol yang ditandai dengan terbentuknya warna merah pada bagian bawah koloni. Hal ini disebabkan karena terjadinya penurunan pH. Apabila bakteri tidak dapat
menghidrolisis lemak, indikator neutral red akan tetap bewarna kuning, sehingga pH mendekati netral (Fardiaz, 1989). Semua isolat bakteri yang didapatkan menunjukkan hasil uji katalase positif. Ini merupakan indikasi bahwa bakteri- bakteri tersebut memiliki enzim katalase yang berperan memecah hidrogen peroksida menjadi air dan oksigen. Uji tersebut dilakukan untuk mengetahui sifat bakteri terhadap kebutuhan oksigen.
Uji indol bertujuan untuk mengetahui adanya enzim triptofanase. Pada pengujian indol tidak didapatkan bakteri yang memiliki enzim tersebut. Enzim triptofanase dapat menghidrolisis asam amino triptofam menjadi senyawa indol dan asam piruvat. Penumpukkan indol dalam media biakan dapat diketahui ketika menambahkan reagen Kovac’s yang akan bereaksi dengan indol dan menghasilkan senyawa tidak larut dalam air dan akan berwarna merah pada permukaan medium (Lay, 1994). Hasil uji Indol menunjukkan bahwa semua isolat tersebut tidak memiliki enzim triptofanase karena tidak terbentuknya warna merah pada media setelah ditambahkan pereaksi Kovac’s (Gambar 5.).
Gambar 5. Hasil Uji Indol
Pada uji fermentasi gula, gula yang termasuk karbohidrat (glukosa, sukrosa, laktosa, dan mannose) ditambahkan ke medium Oksidative Fermentative. Uji ini bertujuan mengetahui kemampuan bakteri dalam memfermentasi gula dengan menghasilkan asam atau gas. Hasil uji ini menunjukkan bahwa semua isolat bakteri dapat memfermentasi glukosa dan mannose, sementara untuk fermentasi laktosa dan sukrosa ditemukan bahwa 22 isolat mampu memfermentasi gula tersebut (Tabel 5). Perubahan dapat dilihat dari media yang semula berwarna hijau menjadi kuning atau oranye (Gambar 6) yang menandakan terjadinya reaksi asam. Bakteri yang tidak memiliki
kemampuan untuk memfermentasi gula terlihat pada warna media yang tidak berubah.
Gambar 6. Hasil Uji Fermentasi Gula Sebelum reaksi Sesudah reaksi (+)
(-)
Pada uji H2S terlihat bahwa semua isolat tidak dapat memecah sistin (asam amino yang berasal dari senyawa belerang) yang terkandung dalam media dan tidak menghasilkan H2S karena tidak terbentuknya warna hitam, namun menghasilkan gas lain sehingga media terangkat dan pecah (Gambar 7.).
Gambar 7. Hasil Uji H2S (-)
Uji oksidase bertujuan untuk menentukan adanya enzim oksidase sitokrom. Hasil uji tersebut ditemukan 21 isolat yang mampu menghasilkan enzim tersebut. Enzim oksidase sitokrom berfungsi sebagai pigmen respirasi dan merupakan hemoprotein yang mirip dengan hemoglobin dan berperan sebagai pembawa hidrogen (Salle, 1961). Pengujian tersebut menggunakan Oksidase stripe dimana isolat akan berubah menjadi ungu jika mempunyai oksidase sitokrom (Gambar 8).
Gambar 8. Hasil Uji Oksidase (+)
4.4. Perbandingan Jumlah Genus Bakteri dari Phallusia sp.pada Setiap Kandungan Pbyang berbeda
Hasil uji morfologi dan fisiologi keseluruhan isolat bakteri menunjukkan adanya lima kelompok bakteri yang teridentifikasi dalam empat genus berbeda dan satu genus yang belum dapat teridentifikasi. Karakterisitik morfologi dan fisiologi dari masing-masing genus dapat dilihat pada Tabel 6. dengan mengacu pada buku Bergey’s Mannual.
Genus A berasal dari kelompok Gram negatif,bentuk basil, motil dan oksidase positif. Beberapa isolat memiliki kemampuan menghidrolisis pati dan lemak, namun ada isolat yang tidak memiliki kemampuan tersebut. Semua isolatnya dapat memfermentasi glukosa, namun tidak semuanya dapat menghidrolisis laktosa, sukrosa, dan mannosa. Genus ini akan tumbuh pada media agar TCBS (Thiosulfate Citrate Bile Salt-sucrose). Kelompok ini
terdistribusi luas khususnya pada lingkungan akuatik baik air tawar maupun laut dan biasa ditemukan berasosiasi dengan hewan air baik vertebrata maupun invertebrata, sehingga diduga sebagai genus Vibrio (Holt et al, 1994; Selvin et al, 2009).
Genus B teridentifikasi sebagai kelompok bakteri Gram negatif, bentuk basil, oksidase dan katalase positif, bersifat motil serta dapat memfermentasi glukosa, laktosa, sukrosa, dan mannose. Genus ini biasa ditemukan pada habitat perairan dangkal, perairan terbuka dan dapat juga ditemukan pada laut dekat hidrotermal vent , sehingga diperkirakan genus tersebut adalah
Alteromonas (Holt et al, 1994; Trappen et al, 2004).
Genus C termasuk kelompok bakteri Gram negatif, bentuk basil, motil, tidak dapat menghidrolisis pati, oksidase positif serta dapat memfermentasi glukosa, laktosa, sukrosa, dan mannosa. Bakteri ini dapat ditemukan dari isolasi
perairan yang memiliki kadar garam tinggi seperti pada laut dan tanah
hypersaline. Kelompok ini diperkirakan berasal dari genus Deleya (Valderrama et al, 1991; Holt et al, 1994).
Genus D termasuk kelompok bakteri Gram positif, bentuk basil, mempunyai endospora, motil, beberapa spesiesnya memiliki kemampuan menghidrolisis pati dan oksidase negatif, katalase positif, dan mampu
memfermentasi glukosa. Genus ini juga terdistribusi luas dan ditemukan patogen terhadap vertebrata dan invertebrata dan diduga kelompok ini berasal dari genus Bacillus (Holt et al, 1994).
Pendugaan persentase jumlah keragaman genus diperoleh berbeda pada setiap perlakuan media. Persentase jumlah keragaman genus disajikan pada Gambar 9, 10, dan 11.
Gambar 9. Persentase Jumlah Keragaman Genus Bakteri Asosiasi Phallusia sp. pada Media K-
Gambar 10. Persentase Jumlah Keragaman Genus Bakteri Asosiasi Phallusia sp. pada Media K+
Gambar 11. Persentase Jumlah Keragaman Genus Bakteri Asosiasi Phallusia sp. pada Media P
A D
Unidentified
66,67%
16,67%
16,67%
Unidentified
A B C
Unindentified
42,86%
28,57%
14,28%
Unidentified
A C
Unidentified
54,54%
36,36%
9%
Unidentified
Diagram diatas menunjukkan adanya genus paling dominan yang ditemukan dari ketiga media. Pada media K- genus A yang merupakan genus Vibrio diduga mencapai 66,67% dari keseluruhan jumlah bakteri, sementara pada media K+ sebesar 42,86%, dan media P sebesar 54,4%. Hasil tersebut menunjukkan bahwa genus Vibrio dapat dikatakan sebagai bakteri yang mempunyai daya adaptasi yang tinggi karena ditemukan pada media yang mengandung Pb maupun tidak. Genus B yang teridentifikasi sebagai
Alteromonas diduga ditemukan sebesar 28,5% pada media K+ dan pada media P sebesar 36,36%, sedangkan pada media K- tidak ditemukannya genus Alteromonas. Genus C dan D teridentifikasi sebagai Deleya dan Bacillus.
Genus ini hanya ditemukan pada media K+ (Deleya 14,28%) dan pada media K- (Bacillus 16,67%). Di lain sisi terdapat pula kelompok bakteri yang tidak dapat teridentifikasi dari ketiga media yang diuji walaupun dalam persentase kecil.
Bakteri tersebut tidak dapat diidentifikasi karena hasil uji morfologi maupun fisiologi yang dilakukan tidak cocok dengan informasi bakteri yang terdapat pada Bergey’s Mannual (Determinative Bacteriology). Genus tersebut di duga
berpotensi sebagai spesies baru, sehingga perlu dilakukan identifikasi lebih lanjut.
Bakteri yang hidup pada kondisi menyimpang dari kondisi normalnya seperti pada media yang mengandung logam berat diatas batas normal, mampu beradaptasi secara sempurna pada habitatnya. Bakteri tersebut
mungkin tidak akan tumbuh jika faktor yang menyimpang tersebut tidak terdapat pada habitatnya (Schelgel, 1994). Mikroorganisme dapat digunakan untuk mengevaluasi kualitas air dan berperan sebagai biological process yang memegang peran penting dalam proses purifikasi air yang salah satunya menggunakan bakteri. Bakteri ini dapat mereduksi material organik dan efektif
meremineralisasi banyak polutan (Rheinheimer, 1992). Pada penelitian ini bakteri yang mampu beradaptasi dengan Pb berarti bakteri tersebut resisten terhadap logam Pb.
Starr (1981) dalam Rheinheimer (1992) dan Sidharta (2006) menyatakan bahwa Pseudomonas, Benecka, Vibrio, Deleya, Spirillium, Alcaligenia,
Flavobacterium, Bacillus, dan Achromobacter merupakan genus terbanyak yang terdapat dilaut dan mempunyai sifat menempel atau berasosiasi. Penelitian Selvin et al (2009) menunjukkan bahwa genus Alteromonas dan Vibrio yang berasosiasi dengan spons jenis Fasciospongia cavernosa memiliki kemampuan resisten terhadap logam berat Hg, Cd, Pb, Co, dan Zn. Sedangkan pada penelitian lain diketahui bahwa spesies Bacillus megaterium mempunyai kemampuan menyerap logam berat Hg dan Pb (Badjoeri, 2008).
Mikroorganisme selalu dapat ditemukan pada keadaan yang terpolusi logam berat. Mereka memiliki relung ekologi khusus di daerah yang
terkontaminasi oleh logam berat yang toksik. Kemampuan resistansi bakteri terhadap suatu jenis logam berat tersebut dikarenakan bakteri tersebut memiliki gen resisten terhadap logam berat dan juga dapat dikarenakan adanya
ekstrakromosom plasmid di kromosom bakteri. Selain itu sel bakteri mempunyai mekanisme transport logam dan dapat mensintesisnya menjadi protein. Proses penyerapan logam oleh bakteri terjadi melalui proses uptake yaitu ion logam yang diserap terjadi di bagian dalam sel baik secara aktif maupun pasif. Pada umumnya mekanisme resisten logam terjadi melalui proses efflux yaitu
penyerapan ion logam yang terjadi pada bagian luar sel bakteri. Proses efflux ini merupakan sistem homeostatis normal yang terjadi pada sel bakteri di bagian kromosom dan plasmid bakteri, dengan cara mengatur konsentrasi logam yang ada. Proses penyerapan ini juga terjadi sejalan dengan konsumsi ion logam
untuk pertumbuhan (metabolisme) bakteri. Bentuk ionik logam juga dapat direduksi oleh bakteri dari bentuk elememnya dan menjadikannya bentuk yang lebih aktif (Saruar, 2002; Badjoeri, 2008).
Logam berat yang diserap dan diakumulasi bakteri juga dapat terjadi melalui proses pengikatan logam. Pengikatan logam berat oleh bakteri dapat dibedakan menjadi fase pengikatan dan dengan cara transport aktif. Fase pengikatan yaitu arbsorpsi logam berat melalui dinding sel atau pada permukaan eksternal. Fase pengikatan terjadi melalui dinding sel. Pada struktur bakteri, dinding sel merupakan sel pertama yang terkena kontak dengan logam berat dan akan terakumulasi disana. Dinding sel bakteri mempunyai unsur penting untuk mengatasi pemasukan logam yang tinggi. Kandungan yang terdapat pada dinding sel adalah peptidoglikan. Peptidoglikan mengandung gugus karboksil, gugus amino, dan fosfat yang berperan dalam proses pengikatan dan
bioarbsorpsi. Gugus karboksil pada peptidoglikan aktif dalam mengikat logam seperti hasil peneltian Golab (1995) yang menyatakan bahwa gugus karboksil pada spesies bakteri Streptomyces pilarus dapat mengikat logam Cu. Demikian juga pada Bacillus sp., gugus karboksilnya dapat mengikat logam Pb dan Cu (Tunali et al, 2006).
Penyerapan secara transport aktif melalui metabolisme sel yang akan terakumulasi pada membran sel (ekstraseluler) dan pada sitoplasma
(intraseluler). Pada transport aktif, akumulasi ekstraseluler terjadi dengan mekanisme pengikatan ion logam oleh polimer polisakarida pada membran sel antara ion logam bermuatan positif dengan sisi reaktif membran sel yang bermuatan negatif. Sedangkan akumulasi intraseluler pada aktivitas mikroba tidak selalu terjadi secara langsung tetapi ada campur tangan gen yang
mengendalikan plasmid pada proses metabolismenya (Wulandari, 2005;
Yeoung-sang Yun, 2011).
Penyerapan oleh organisme dalam hal ini dengan menggunakan bakteri memberi beberapa keunggulan dibanding dengan teknologi lain (teknologi membran dan elektrokimia). Keunggulan yang pertama yaitu efisiensi dan kapasitas pengikatan logam yang cukup besar. Selanjutnya bakteri juga
memiliki mekanisme yang memungkinkan mengubah logam menjadi bentuk lain yang lebih efisien seperti ke dalam bentuk protein. Penyerapan dan
pengakumulasian oleh bakteri juga diketahui tidak menimbulkan banyak endapan. Keunggulan keempat yaitu bahan baku bakteri mudah didapat dan dapat dikultur pada skala laboratorium sehingga tidak memakai banyak biaya (Macek dan Mackova, 2011). Hasil peneltian Badjoeri (2008) didapatkan bahwa Bacillus megaterium yang ditumbuhkan pada media yang mengandung logam Hg sebesar 20 mg/L dan diinokulasi bakteri sebanyak 4 ml memiliki kemampuan menyerap kadar logam tersebut hingga 99,58%.