ASETILASI DAN KARAKTERISTIK PATI AREN ASETAT
ABDUL RAHIM SYAHRAENI KADIR
JUSMAN
i
Edisi Pertama
Penerbit
2017
PATI AREN ASETAT
Oleh:
ABDUL RAHIM SYAHRAENI KADIR
JUSMAN
ii
Kutipan Pasal 72:
Sanksi Pelanggaran Undang-Undang Hal Cipta No. 19 Tahun 2002
1. Barangsiapa dengan sengaja dan tanpa hak melakukan perbuatan sebagaimana dimaksud dalam Pasal 2 ayar (1) atau Pasal 49 ayat (1) dan ayat (2) dipidana dengan pidana penjara masing-masing paling singkat 1 (satu) bulan dan/atau denda paling sedikit Rp1.000.000 (satu juta rupiah), atau pidana penjara paling lama 7 (tujuh) tahun dan/atau denda paling banyak Rp5.000.000.000 (lima miliar rupiah)
2. Barangsiapa dengan sengaja menyiarkan, memamerkan, mengedarkan atau menjual kepada umum suatu ciptaan atau barang hasil pelanggaran Hak Cipta atau Hak Terkait sebagaimana dimaksud pada ayat (1) dipidana dengan pidana penjara paling lama 5 (lima) tahun dan/atau denda paling banyak Rp500.000.000 (lima ratus juta rupiah).
Asetilasi Dan Karakteristik Pati Aren Asetat Abdul Rahim. Palu: Untad Press, 2017 vi hal + 76 hal.; 15,5 x 23 cm
ISBN: 978-602-6619-28-0
© Hak Cipta 2017
1. Non Fiksi i. Judul ii. Abdul Rahim
Penerbit:
UNTAD Press
Jl. Soekarno Hatta KM. 9 Palu Sulawesi Tengah 94118
iii
Puji syukur penulis panjatkan kehadirat Allah SWT karena berkat rahmat dan hidayahNya, penulis dapat menyelesaikan penyusunan buku referensi dengan judul “Asetilasi dan Karakteristik Pati Aren Asetat” untuk dapat digunakan sebagai salah satu pegangan dalam membantu proses belajar mengajar dalam bidang Teknologi Hasil Pertanian (THP) karena perkembangan ilmu dan teknologi modifikasi pati sangat pesat, maka dalam proses belajar mengajar perlu perlengkapan sumber-sumber baru. Meskipun demikian, diharapkan buku ini dapat memberikan informasi yang lengkap mengenai proses asetilasi dan karakteristik fisik, kimia dan fungsional pati aren alami dan termodifikasi dalam menunjang keamanan dan ketahanan pangan nasional.
Buku referensi ini disusun berdasarkan hasil penelitian oleh tim yang dilakukan di Indonesia melalui skim hibah penelitian Strategis Nasional (Stranas) 2015-2017. Hasil-hasil penelitian tersebut telah dipublikasikan pada jurnal nasional terakreditasi dan bereputasi internasional yang terindeks pada scopus, EBSCO, Thompson serta sebagian telah diseminarkan baik nasional maupun internasional. Buku ini ditulis dengan tujuan dapat digunakan sebagai salah satu sumber bahan ajar atau referensi untuk meningkatkan wawasan di bidang THP khususnya teknologi modifikasi pati aren dengan asetilasi dan pemanfaatannya. Pada kesempatan ini, penulis mengucapkan terima kasih kepada:
iv
Kementerian Riset, Teknologi dan Pendidikan Tinggi RI yang telah memberikan kesempatan sebagai penerima hibah penelitian Stranas Tahun pendanaan 2015-2017.
2. Rektor Universitas Tadulako yang telah menyediakan fasilitas administrasi, sarana dan prasarana dalam penyusunan buku ini.
3. Ucapan terima kasih juga penulis sampaikan kepada pihak- pihak lain yang tidak dapat disebutkan satu persatu atas dorongan dan masukannya, baik secara langsung maupun tidak langsung terhadap penulisan dan penyempurnaan buku ini.
Penulis mengharapkan kritik, saran dan koreksi dari para pembaca demi sempurnanya buku ini. Semoga buku Asetilasi dan Karakteristik Pati Aren Asetat ini dapat memberikan manfaat bagi mahasiswa dan pembaca. Amin.
Penulis
Tim Penulis
v
HALAMAN SAMPUL ... i
PRAKATA... ii
DAFTAR ISI... iv
BAB 1. PENDAHULUAN……… 1
BAB 2. KARAKTERISTIK FISIKOKIMIA PATI AREN ASETAT PADA JUMLAH PATI AREN BERBEDA ………... BAB 3. KARAKTERISTIK FUNGSIONAL PATI AREN ASETAT PADA DS BERBEDA…… 1.1. Latar Belakang ……….. 1
1.2. Modifikasi pati ..…….………... 3
1.3. Pentingnya modfikasi pati….……… 7
1.4. Tujuan………... 8
1.5. Asetilasi pati……….. 9
13 2.1. Pengikatan gugus fungsional………. 13
2.2. Kristalinitas ………..………. 14
2.3. Kemampuan menahan air dan minyak ……….. 15
2.4. Daya mengembang dan kelarutan ………. 17
2.5. Viskositas………... 18
2.6. Kestabilan emulsi…………..………. 19
2.7. Kadar air……… 20
23 3.1. Rendemen resistant starch ……… 23
3.2 Pengikatan asam/garam empedu……… 25
vi
AREN ASETAT………...
BAB 5. KARAKTERISTIK FISIK DAN KIMIA ROTI PREBIOTIK...
BAB 4. KARAKTERISTIK PREBIOTIK PATI
31
4.1. Pola pertumbuhan bakteri……….. 31
4.2. Indeks prebiotik……….……… 33
4.3. Perubahan pH………. 35
4.4. Produksi SCFA……….………. 37
41 5.1. Prebiotik………... 41
5.2. Bahan roti prebiotik………... 42
5.3. Proses pembuatan roti prebiotik……… 48
5.4. Karakteristik fisik roti prebiotik……… 52
5.5. Karakteristik kimia roti prebiotik……….. 55
DAFTAR PUSTAKA ……….. 59
GLOSARIUM………... 68
INDEKS ……… 75
1 BAB 1. PENDAHULUAN
1.1. Latar Belakang
Sumber karbohidrat yang diperlukan oleh tubuh banyak terkandung pada berbagai makanan pokok yang sering dikonsumsi sehari-hari seperti beras, jagung, kentang, ubi kayu, ubi jalar, sagu dan aren. Pada tanaman pangan tersebut, karbohidrat tersimpan dalam bentuk pati. Kandungan utama pati terdiri dari amilosa dan amilopektin, dimana komposisinya bervariasi untuk masing-masing jenis pati. Di industri makanan, pati digunakan sebagai binding dan thickening agent. Oleh karena itu, karakteristik pati seperti swelling power, solubility, freeze-thaw stability, paste clarity, dan gel strength berperan penting untuk menghasilkan produk makanan berbasis pati yang berkualitas.
Di era otonomi daerah, pemerintah daerah berusaha mencari pontensi daerah yang dapat dikembangkan, yang pada dasarnya bertujuan untuk meningkatkan kesejahteraan masyarakat. Untuk mencapai tujuan tersebut pemanfaatan komoditi potensial yang berperan terhadap pemenuhan bahan baku agro-industri merupakan langkah yang tepat. Salah satu potensi bahan baku dalam pengembangan agro-industri yang belum dimanfaatkan secara maksimal adalah tanaman aren (Arenga pinnata (Wurb) MERR). Tanaman aren merupakan salah satu jenis tanaman yang telah lama dikenal petani di
2 pedesaan karena banyak memiliki manfaat, bahkan di saat krisis ekonomi terjadi tanaman aren merupakan salah satu alternatif yang banyak menolong petani.
Pohon aren memiliki manfaat yang banyak, yaitu antara lain berperan dalam konservasi lahan dan air, penghasil ijuk, nira untuk pembuatan gula, buah kolang-kaling, dan sebagai sumber pati. Pati aren banyak digunakan terutama untuk membuat starch noodle (sohun), hung kwe dan cendol (Haryadi, 2002). Pohon aren hidup di wilayah ketinggian yang luas, sehingga potensinya sangat besar. Batang aren mengandung pati dalam batangnya. Usaha-usaha ekstraksi pati dari batang aren sudah berkembang berupa sentra-sentra industri kecil (Haryadi, 2002). Pohon aren juga dapat dimanfaatkan sebagai penghasil nira atau buah kolang-kaling, sering pohon yang sudah terlalu tua yang kurang produktif menghasilkan nira atau buah kolang-kaling ditebang untuk dimanfaatkan sebagai sumber pati.
Batang aren ditebang saat kandungan patinya paling tinggi (saat produksi nira atau kolang-kaling menurun), setelah pohon ditebang, empulur batang diolah untuk mendapatkan pati aren. Pati aren dapat digunakan sebagai bahan baku dalam pembuatan makanan seperti roti, mie, industri kerupuk, kue kering, dan sirup berfruktosa tinggi. Dengan kemajuan teknologi pangan, aren dapat dibuat menjadi instant artificial rice siap santap yang dapat bersaing dengan beras alami.
3 Berbagai macam formulasi dapat dikembangkan untuk meningkatkan cita rasa, dan penampilan produk. Pati aren juga dapat menunjang berbagai macam industri, baik industri kecil, menengah, maupun industri berteknologi tinggi. Pati aren yang telah dimodifikasi dapat memberikan lebih banyak manfaat dalam industri pangan, bahkan farmasi. Manfaat yang dimaksud antara lain pada produksi makanan beku, rerotian, bahan minuman prebiotik, bahan penyalut lapis tipis (film coating) tablet, dan lain sebagainya.
Batang aren mengandung karbohidrat yang tinggi dengan komponen utama adalah pati sebesar 90,49% berat kering (Alam, 2006) dengan kadar amilosa 31% (Rahim dan Haryadi, 2008). Pati aren sebagaimana jenis pati lainnya dapat dimanfaatkan untuk produk pangan dan non pangan. Namun demikian pati aren alami pemanfaatannya masih terbatas karena mudah mengalami retrogradasi, tidak stabil terhadap panas dan asam. Selain itu sifat fisik dan kimia sebagai ingridien pangan dan fungsional untuk kesehatan belum optimal. Untuk memperbaiki sifat-sifat tersebut, maka pati aren harus dimodifikasi secara kimiawi.
1.2. Modifikasi pati
Modifikasi merupakan perubahan struktur molekul pati yang dapat dilakukan dengan cara fisik, kimia (eterifikasi, esterifikasi, oksidasi dan ikatan silang) dan enzimatik.
4 Beberapa faktor diketahui berpengaruh terhadap kecepatan reaksi kimia antara lain lama waktu reaksi, pH, konsentrasi reaktan, suhu, dan jenis pati (Clark, 2002). Setiap cara modifikasi menghasilkan karakteristik pati modifikasi yang berbeda-beda (Sriroth et al., 2002; Volkert et al., 2010).
Modifikasi pati secara kimia dapat dilakukan seperti eterifikasi, esterifikasi, cross-linking, grafting, dekomposisi asam, hidrolisa dengan menggunakan enzim, dan oksidasi. Ciri modifikasi kimia adalah dengan menambahkan gugus fungsional baru pada molekul pati sehingga mempengaruhi sifat fisika-kimia dari pati tersebut. Modifikasi secara kimia dapat dilakukan dengan cara penambahan reagen atau bahan kimia tertentu dengan tujuan mengganti gugus hidroksil (OH-) pada molekul pati. Modifikasi secara kimia, terdapat tiga gugus OH pada atom C2, C3, dan C6 pada satuan glukosa yang dapat disubstitusi oleh gugus fungsi reagen, sehingga derajat substitusi (DS) maksimal 3. Reaktivitas hidrogen pada gugus OH berbeda pada atom C2, C3, dan C6. Gugus OH pada atom C primer (C6) lebih reaktif daripada gugus OH pada atom C sekunder (C2 dan C3) (Xu et al., 2004) dan gugus OH pada atom C2 lebih reaktif daripada C3 karena sifat sterik atom C3 (Diop et al., 2011).
Modifikasi pati secara asetilasi, cross-linking, hydroxypropylation, atau kombinasi dari dua macam modifikasi (contoh: gabungan asetilasi dan hydroxypropylation
5 pada pati beras) adalah empat metode modifikasi yang banyak diterapkan di industri pangan (Raina et al, 2006). Dengan menerapkan metode modifikasi tersebut pada pati, karakteristik pati dapat ditingkatkan dan akan dihasilkan tekstur produk yang lebih lembut, stabil, tahan terhadap asam, panas, dan air, serta memiliki shell-life yang lebih lama jika dibandingkan dengan pati yang tidak dimodifikasi.
Metode modifikasi pati secara asetilasi dengan DS yang rendah telah digunakan secara luas oleh industri makanan selama bertahun-tahun. Hal ini disebabkan oleh keunggulan sifat fisikokimia yang dimiliki oleh pati terasetilasi seperti suhu gelatinisasi, swelling power, solubility, dan tingkat kejernihan pasta (paste clarity) yang tinggi, serta memiliki stabilitas penyimpanan dan pemasakan yang lebih baik jika dibandingkan dengan pati alaminya (Raina et al., 2006). Selain itu, kualitas produk yang dihasilkan dari pati terasetilasi lebih stabil dan tahan terhadap retrogradasi. Sifat fisika-kimia pada pati yang terasetilasi ini dipengaruhi oleh jumlah distribusi gugus asetil yang menggantikan gugus hidroksil (OH-) pada molekul pati.
Metode asetilasi merupakan metode yang sangat penting untuk memodifikasi karakteristik pati karena metode ini dapat memberikan efek pengentalan pada berbagai makanan. Pati yang diperoleh melalui asetilasi biasa disebut pati asetat. Pati asetat merupakan hasil modifikasi pati secara kimia dengan asetat anhidrida melalui esterifikasi yang mempunyai peran
6 sebagai pangan fungsional untuk menunjang ketahanan dan keamanan pangan nasional. Pati asetat tahan pada suhu dan asam tinggi dibandingkan pati alaminya serta memiliki pati tahan cerna (resistant starch, RS) yang memberikan efek fungsional terhadap kesehatan. Pati asetat dapat juga digunakan sebagai bahan pembuat olahan produk pangan sebagai pengganti tepung terigu sehingga dapat menekan impor terigu dan meningkatkan devisa negara (Rahim et al., 2016).
Modifikasi pati dengan cara esterifikasi diantaranya asetilasi, butirilisasi dan fosforilasi ditujukan untuk memperbaiki sifat fisik dan kimia pati serta dihasilkan pati termodifikasi dengan kandungan RS yang tinggi. Pati ester termodifikasi lebih sulit dicerna oleh enzim amilolitik yang menyisakan sejumlah RS karena perubahan struktur beberapa satuan glukosa pada molekul pati (Haryadi, 2002; Perera et al., 2010). RS mempunyai potensi fungsional sebagai serat pangan (Candela et al., 2010), mampu mengikat dan memerangkap air (Sajilata et al., 2006; Rahim et al., 2012; Rahim et al., 2013;
Rahim et al., 2015), mampu mengabsorpsi asam/garam empedu dan kolesterol (Perera et al., 2010; Rahim et al., 2013). RS tidak dapat dicerna di usus halus dan akan difermentasi oleh mikroflora kolon (Gibson, 2004). Menurut Yadav et al. (2010) bahwa hasil fermentasi RS dalam kolon menghasilkan asam lemak rantai pendek (short chain fatty acid, SCFA) terutama asam asetat, asam propionat dan asam butirat yang bermanfaat
7 bagi kesehatan kolon, mencegah terjadinya kanker kolon, menaikkan volume feses dan menurunkan pH kolon (Topping et al., 2003). RS diduga sebagai prebiotik untuk menstimulasi aktivitas dan atau mendorong pertumbuhan beberapa bakteri selektif yang menguntungkan seperti Bifidobacteria dan Lactobacilli dan menghambat atau menurunkan bakteri patogen di dalam kolon (Brouns et al., 2002; Harmayani et al., 2006; Rahim et al., 2013; Sajilata et al. 2006).
1.3. Pentingnya modifikasi pati
Pati modifikasi secara asetilasi menghasilkan pati termodifikasi yang memiliki potensi fungsional sebagai ingridien pangan dan kesehatan bahkan dapat juga sebagai pengganti penggunaan plastik. Pati asetat memberikan efek fungsional bagi kesehatan manusia karena kandungan RS yang tinggi. RS tahan terhadap enzim pencernaan sehingga tidak mampu diserap oleh usus halus, selanjutnya RS masuk ke dalam kolon dan difermentasi oleh bakteri kolon yang menghasilkan SCFA diketahui cukup efektif sebagai sumber energi dalam kolon, menurunkan kolesterol, asam empedu, mereduksi pembentukan batu empedu, mencegah kanker kolon, kanker prostat, peradangan kolon dan sebagai anti karsinogenik (Bajka et al., 2010; Barsby et al., 2000; Fuentes et al., 2010; Hamer et al., 2009; Rodriguez et al., 2010; Perera et al., 2010). Pati modifikasi dapat dimanfaatkan oleh stake holders di bidang
8 industri pangan dan non pangan, membantu pemerintah dari aspek meningkatkan pendapatan dan kesehatan masyarakat.
Pati asetat memiliki karakteristik yang mirip dengan karakteristik tepung terigu sehingga dapat digunakan untuk substitusi tepung terigu dalam olahan produk pangan. Proses asetilasi umumnya dapat diterapkan pada semua jenis pati- patian dan dapat dilakukan pada tingkat petani dan masyarakat, yang kemudian dapat diterima oleh industri dengan harga yang layak, sehingga berdampak pada kenaikan pendapatan petani dan masyarakat. Diharapkan pula penerapan ini mendorong kenaikan penerimaan devisa negara. Diharapkan cara asetilasi dapat diterapkan pada skala industri besar, sehingga mengurangi impor tepung terigu yang saat ini dikenal bermutu lebih baik daripada tepung/pati rakyat dan diharapkan pati asetat yang dihasilkan mempunyai sifat fisik, kimia dan fungsional mirip dengan tepung terigu sehingga dapat menggantikan sebagian atau seluruh penggunaan terigu yang berkaitan langsung dengan peningkatan ekonomi masyarakat.
1.4. Tujuan
Tujuan khusus dari penyusunan buku ini ialah (1) mendapatkan informasi mengenai teknik asetilasi pati aren, (2) membahas karakteristik fisik, kimia dan fungsional pati aren asetat, (3) mendapatkan teknik produksi pati aren asetat skala menengah, (4) membahas karakteristik prebiotik pati aren asetat
9 sebagai ingridien pangan fungsional secara in vitro melalui proses fermentasi, (5) memahami aplikasi pati aren asetat sebagai bahan substitusi tepung terigu untuk pembuatan roti prebiotik dan (6) membahas karakteristik fisik, kimia dan fungsional produk roti prebiotik yang dihasilkan sebagai produk olahan pangan fungsional.
1.5. Asetilasi pati aren
Produksi pati aren asetat dapat dilakukan dengan membuat suspensi pati aren terdiri dari 50, 200, 350, 500, 650, 800, 950 gram dengan menambahkan akuades berturut-turut 113; 450; 787; 1.124; 1.461; 1.798; 2.135 mL diaduk selama satu jam pada suhu ruang. Selanjutnya ditambahkan asetat anhidrida 15% (v/b) secara tetes demi tetes sambil mempertahankan pH suspensi 8 dengan menambahkan NaOH 3% yang dilakukan pada suhu kamar dengan lama reaksi 60 menit. Setelah itu ditambahkan HCl 0,5 N sampai pH 4,5 untuk menghentikan reaksi. Proses selanjutnya adalah pengendapan dan pencucian dengan menggunakan akuades dua kali dan etanol satu kali, kemudian pengeringan dengan cabinet drier pada suhu 50oC selama 12 jam sehingga diperoleh pati aren asetat yang dapat digunakan untuk bahan pangan fungsional.
Penentuan asetilasi didasarkan pada persen asetil dan DS. Pola produksi pati aren asetat pada jumlah pati yang berbeda dapat dilihat pada Gambar 1. Persen asetil dan DS pati
10 aren asetat tertinggi pada jumlah pati aren 200 g, kemudian menurun sampai 500 g dan selanjutnya meningkat sampai 800 g dan kemudian mengalami pemurunan pada sampel 950 g.
Pola peningkatan persen asetil dan DS tidak bersifat linier, akan tetapi bersifat kuadratik. Persen asetil dan DS yang bervariasi pada setiap jumlah pati aren yang digunakan menunjukkan bahwa produksi pati aren asetat dapat dilakukan dengan variasi jumlah pati aren yang menghasilkan pati termodifikasi yang memiliki nilai DS relatif rendah dan karakteristik semacam ini dapat diaplikasikan sebagai bahan pangan fungsional. Pati aren yang digunakan dalam proses asetilasi mengalami difusi dan absorbsi gugus asetil ke dalam molekul pati sehingga dihasilkan pati termodifikasi.
Gambar 1. Pola produksi pati aren asetat pada jumlah pati aren yang berbeda.
Menurut Hui et al. (2009) bahwa sintesis pati oktenil suksinat dari pati kentang menunjukkan pola peningkatan DS
0.00 0.10 0.20 0.30 0.40 0.50
0.00 0.50 1.00 1.50 2.00 2.50 3.00 3.50 4.00
50 200 350 500 650 800 900
Derajat Substitusi (DS)
Kadar Asetil (%)
Pati Aren (g)
Asetil DS
11 tidak linier, akan tetapi berbentuk kuadratik. Lebih lanjut dijelaskan bahwa DS pati kentang oktenil suksinat meningkat (0,0133- 0,0143) seiring dengan meningkatnya waktu reaksi dari 2 sampai 3 jam yang disebabkan oleh adanya tumbukan partikel antara pati kentang dengan oktenil suksinat, dan kemudian DS menurun (0,0143-0,0135) sampai dengan waktu reaksi 4 jam karena jumlah oktenil suksinat anhidrida semakin berkurang dan terjadi reaksi hidrolisis pada pati kentang suksinat. Pola tersebut memiliki kecenderungan yang mirip untuk semua proses asetilasi pati namun tergantung pada faktor- faktor yang berpengaruh dalam proses modifikasi.
12
13 BAB 2. KARAKTERISTIK FISIKOKIMIA PATI AREN
ASETAT PADA JUMLAH PATI YANG BERBEDA
2.1. Pengikatan gugus fungsional
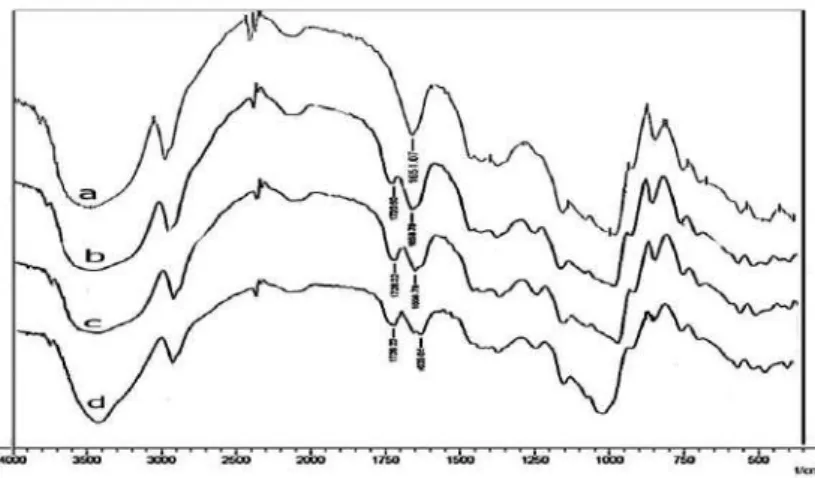
Spektra fourier transform infra red (FTIR) pati aren alami dan pati aren asetat pada jumlah pati yang berbeda disajikan pada Gambar 2. Spektra pati aren alami memiliki puncak pada bilangan gelombang 3510, 2932 dan 1651,07 cm-
1 yang masing-masing merupakan vibrasi dari gugus OH, metilen (CH2), dan pengikatan air (H2O). Menurut Rahim et al.
(2012) bahwa spektra pati aren alami memiliki puncak pada bilangan gelombang 3426, 2932 dan 1651 cm-1 yang masing- masing merupakan vibrasi O-H dari gugus hidroksi, C-H, dan pengikatan H2O dalam molekul pati.
Gambar 2. Spektra FTIR pati aren alami dan asetat pada jumlah pati aren berbeda: pati aren alami (a), 200g (b), 650g (c) dan 950g (d).
14 Spektra pati aren asetat memiliki puncak baru pada bilangan gelombang 1720 cm-1 yang menunjukkan terjadinya inkorporasi gugus asetil mensusbsitusi gugus hidroksi dalam molekul pati. Menurut Rahim et al. (2012) bahwa pati aren asetat memiliki puncak baru pada bilangan gelombang 1728 cm-1. Di samping itu pati aren asetat memiliki ikatan hidrogen yang lebih kecil dibandingkan pati aren alami karena terjadi reaksi gugus asetil dengan gugus hidroksi pada molekul glukosa dan terjadi penurunan gugus hidroksi pada daerah bilangan gelombang 3000 – 3700 cm-1.
2.2. Kristalinitas
Pola X-ray diffraction (XRD) pati aren alami dan pati aren asetat dapat dilihat pada Gambar 3. Pati aren alami dan pati aren asetat mempunyai kristalin tipe A dengan pola puncak utama pada 2θ = 15o, 17o, 18o dan 23o. Derajat kristalinitas granula pati aren asetat lebih rendah dibandingkan dengan pati alami yang disebabkan karena telah terjadi kerusakan ikatan hidrogen intra dan antar molekul kristalin akibat proses asetilasi. Derajat kristalinitas dari granula pati jagung asetat lebih rendah dibandingkan dengan pati alaminya (Lopez et al., 2010) derajat kristalinitas dari granula pati beras asetat lebih rendah dari pada pati beras alami akibat proses asetilasi (Sha et al., 2012).
15 Gambar 3. Kristalinitas pati aren asetat pada lama reaksi berbeda: pati aren alami (a), 200g (b), 650g (c), 800g (d) dan 950g (e).
2.3. Kemampuan menahan air dan minyak
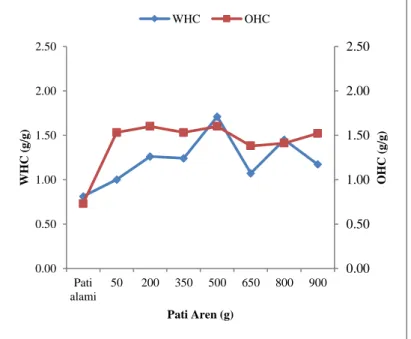
Pola kemampuan menahan air dan minyak (water-oil holding capacity WHC-OHC) pati aren alami dan asetat pada jumlah pati yang berbeda dapat dilihat pada Gambar 4. WHC dan OHC pati aren asetat meningkat seiring dengan meningkatnya jumlah pati aren. Data ini menunjukkan bahwa sifat hidrofilik dan hidrofobik cenderung lebih baik setelah asetilasi. Peningkatan WHC dan OHC disebabkan oleh adanya perubahan geometrik dan gugus fungsional asetat pada molekul pati yang memfasilitasi kemampuan menahan air dan minyak.
Inkorporasi gugus asetat dalam molekul pati dapat melemahkan
16 ikatan hidrogen intra dan antar molekul pati sehingga menyebabkan perubahan geometrik molekul pati dan gugus karbonil pada asetat memiliki kemampuan menahan air, sedangkan gugus metil pada asetat memiliki kemampuan menahan minyak.
Gambar 4. Pola WHC dan OHC pati aren alami dan asetat pada jumlah pati yang berbeda
WHC dan OHC pati new cocoyam asetat lebih tinggi daripada pati new cocoyam alami yang disebabkan oleh inkorporasi gugus fungsi asetil ke dalam molekul pati yang akan memfasilitasi meningkatnya kapasitas pengikatan molekul air dan minyak (Lawal, 2004). Pati aren asetat dapat digunakan sebagai pengental atau penstabil dalam produk pangan.
0.00 0.50 1.00 1.50 2.00 2.50
0.00 0.50 1.00 1.50 2.00 2.50
Pati alami
50 200 350 500 650 800 900
OHC (g/g)
WHC (g/g)
Pati Aren (g)
WHC OHC
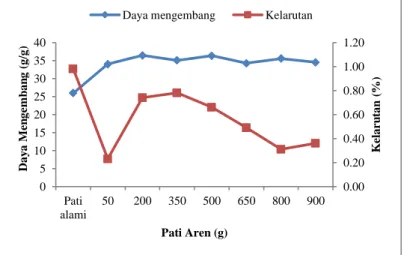
17 2.4. Daya mengembang dan kelarutan
Daya mengembang pati aren asetat cenderung meningkat seiring dengan meningkatnya jumlah pati aren, sedangkan kelarutan pati aren asetat mengalami penurunan pada 50 g, kemudian meningkat sampai 350 g dan selanjutnya menurun seiring dengan bertambahnya jumlah pati aren (Gambar 5).
Gambar 5. Daya mengembang dan kelarutan pati aren alami dan asetat pada jumlah pati aren yang berbeda.
Daya mengembang pati aren asetat cenderung meningkat seiring dengan meningkatnya jumlah pati aren.
Kelarutan pati aren asetat cenderung menurun seiring dengan meningkatnya jumlah pati aren yang digunakan. Menurunnya kelarutan pati aren asetat seiring dengan meningkanya jumlah pati aren dapat menyebabkan sifat hidrofobik meningkat akibat
0.00 0.20 0.40 0.60 0.80 1.00 1.20
0 5 10 15 20 25 30 35 40
Pati alami
50 200 350 500 650 800 900
Kelarutan (%)
Daya Mengembang (g/g)
Pati Aren (g)
Daya mengembang Kelarutan
18 adanya inkorporasi gugus asetil pada molekul pati. Pati semacam ini memiliki sifat pengemulsi sebagai bahan tambahan makanan.
2.5. Viskositas
Viskositas pati aren asetat umumnya lebih kecil daripada pati aren alami. Viskositas pati aren asetat untuk semua jumlah pati aren lebih kecil dibandingkan dengan pati alami, hal ini diduga disebabkan oleh adanya inkorporasi gugus asetil ke dalam molekul pati secara maksimal sehingga gugus OH lebih banyak disubstitusi oleh gugus asetil yang bersifat mempertahankan sifat viskositas stabil, sedangkan pati alami viskositasnya tinggi dan akan mengarah membentuk proses retrogradasi yang menyebabkan terjadinya sineresis pada pasta dan akhirnya mengeras. Sifat tersebut kurang bagus diaplikasikan pada pangan yang mempertahankan sifat pasta dan emulsi tetap stabil diantaranya pudding dan sejenisnya. Hal ini menunjukkan bahwa pati aren asetat dapat diaplikasikan sebagai bahan tambahan pangan untuk memperbaiki tekstur dan mempertahankan konsistensi olahan produk pangan. Pola viskositas pati aren alami dan asetat pada jumlah pati yang berbeda dapat dilihat pada Gambar 6.
19 Gambar 6. Pola viskositas pati aren alami dan asetat pada jumlah pati yang berbeda
2.6. Kestabilan emulsi
Pola kestabilan emulsi pada jumlah pati aren yang berbeda selama penyimpanan 24, 48 dan 72 jam dapat dilihat pada Gambar 7. Kestabilan emulsi pati aren alami lebih kecil daripada pati aren asetat. Hal ini disebabkan karena pati aren asetat memiliki kemampuan mengikat air dan minyak yang lebih besar dibandingkan dengan pati alami, sehingga emulsi yang terbentuk selama penyimpanan stabil. Kestabilan emulsi ini diduga adanya gugus asetil pada molekul pati yang menyebabkan molekul pati dapat bersifat hidrofobik atau biasa disebut emulsifiyer (Perrachil and Cunha, 2010).
0 500 1000 1500 2000 2500 3000 3500
Pati alami
50 200 350 500 650 800 900
Viskositas (CP)
Pati Aren (g)
20 Gambar 7. Kestabilan emulsi pada jumlah pati aren yang berbeda selama penyimpanan 24, 48 dan 72 jam
2.7. Kadar air
Kadar air pati aren asetat pada umumnya lebih kecil daripada pati aren alami. Kadar air pati aren asetat untuk semua jumlah pati aren asetat lebih kecil dibandingkan dengan pati alami, hal ini diduga disebabkan oleh adanya inkorporasi gugus asetil ke dalam molekul pati secara maksimal sehingga gugus OH lebih banyak disubstitusi oleh gugus asetil yang dibuktikan dengan adanya persen asetil dan terjadi substitusi yang dibuktikan dengan adanya DS yang bervariasi untuk pati aren asetat. Hal lainnya adalah terjadinya kerusakan kristalin akibat asetilasi yang meyebabkan ikatan intra dan inter molekul melemah sehingga air dalam molekul pati lebih banyak menguap. Pola kadar air pati aren alami dan asetat pada jumlah pati yang berbeda dapat dilihat pada Gambar 8.
88 90 92 94 96 98 100 102
24 48 72
Kestabilan emulsi (%)
Waktu Pemisahan emulsi (Jam)
50g 200g 350g
500g 650g 800g
950g alami
21 Gambar 8. Pola kadar air pati aren alami dan asetat pada
jumlah pati yang berbeda
9.00 10.00 11.00 12.00 13.00 14.00 15.00
Pati alami
50 200 350 500 650 800 900
Kadar Air (%)
Pati Aren (g)
22
23 BAB 3. KARAKTERISTIK FUNGSIONAL PATI AREN
ASETAT PADA DS BERBEDA
Penentuan potensi fungsional pati aren asetat pada DS berbeda untuk kesehatan dapat dilakukan secara in vitro dengan mengevaluasi karakteristik fungsional meliputi kadar RS, kemampuan pengikatan asam/garam empedu dan penurunan kolesterol.
3.1. Rendemen Resistant starch
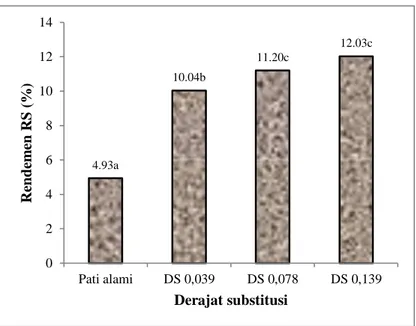
Rendemen RS merupakan jumlah RS yang diperoleh dibagi dengan berat pati dikalikan dengan 100%. Rendemen RS suatu bahan dipengaruhi oleh beberapa faktor antara lain sumber botani pati, proses isolasi yang digunakan dan tingkat perbedaan DS. Setiap sumber pati memilki tingkat kecernaan pati yang berbeda, hal ini mengakibatkan perbedaan rendemen RS untuk sumber pati yang berbeda pula. Proses isolasi RS yang berbeda akan mengakibatkan rendemen RS yang dihasilkan juga berbeda. Selain disebabkan oleh perbedaan sumber botani pati dan cara isolasi, perbedaan rendemen RS juga disebabkan oleh perbedaan DS yang dimiliki oleh masing- masing sumber pati, rasio amilosa dan amilopektin dan kondisi penyimpanan (Zhang dan Jin., 2011). Rendemen RS dari pati aren asetat pada DS berbeda dapat dilihat pada Gambar 9.
24
4.93a
10.04b
11.20c
12.03c
0 2 4 6 8 10 12 14
Pati alami DS 0,039 DS 0,078 DS 0,139
Rendemen RS (%)
Derajat substitusi
Gambar 9. Rendemen RS dari pati aren asetat pada DS berbeda
Rendemen RS dari pati aren alami berbeda nyata dengan ketiga jenis pati aren asetat, dan rendemen RS dari pati aren asetat DS 0,039 berbeda nyata dengan DS 0,078 dan DS 0,139, sedangkan rendemen RS antara DS 0,078 dan DS 0,139 terlihat tidak berbeda nyata. Hal ini menunjukkan bahwa rendemen RS dari pati aren asetat meningkat seiring dengan meningkatnya DS. Hidrolisis pati aren alami oleh enzim α-amilase dan amiloglukosidasi lebih mudah dibanding dengan pati aren asetat, hal ini disebabkan karena pati aren asetat mengalami esterifikasi dengan asetat anhidrida yang dapat menyebabkan perubahan struktur molekul pati sehingga berpengaruh terhadap kemampuan enzim membentuk kompleks dengan substrat (Rahim et al., 2016).
25 3.2. Pengikatan asam/garam empedu
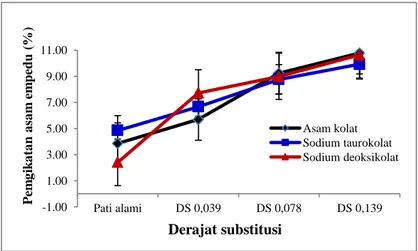
Di dalam usus, asam empedu primer dikonversi oleh bakteri menjadi asam empedu sekunder yaitu asam kolat menjadi asam deoksikolat dan asam kenodeoksikolat menjadi asam litokolat (Yoshi dan Wasche, 2004). Asam empedu primer maupun sekunder keduanya direabsorpsi oleh usus dan kembali ke hati melalui siklus enterohepatik. Apabila reabsorpsi asam empedu dihambat, misalnya oleh serat makanan termasuk RS maka jumlah asam empedu yang kembali ke hati menjadi lebih rendah. Hal ini berakibat pada peningkatan sintesis asam empedu untuk memenuhi kebutuhan tubuh. Oleh karena asam empedu disintesis oleh kolesterol, maka peningkatan sintesis asam empedu mengakibatkan penurunan kadar kolesterol darah. Pengujian pengikatan asam/garam empedu yaitu asam kolat, sodium taurokolat, dan sodium deoksikolat pada variasi DS dari pati aren asetat dapat dilakukan secara in vitro. Pola pengikatan asam/garam empedu pada DS berbeda dari pati aren asetat dapat dilihat pada Gambar 10.
Pengikatan asam / garam empedu (asam kolat, asam taurokolat dan asam deoksikolat) semakin meningkat seiring dengan meningkatnya DS pati aren asetat. Pengikatan asam atau garam empedu oleh pati aren asetat diduga diinisiasi oleh adanya interaksi hidrofobik diantara kedua senyawa tersebut.
Sifat hidrofobik pati aren asetat semakin meningkat seiring meningkatnya DS, sehingga pengikatan asam / garam empedu
26
-1.00 1.00 3.00 5.00 7.00 9.00 11.00
Pati alami DS 0,039 DS 0,078 DS 0,139
Pemgikatan asam empedu (%)
Derajat substitusi
Asam kolat Sodium taurokolat Sodium deoksikolat
juga semakin tinggi yang disebabkan oleh banyaknya gugus OH pada anhiroglukosa yang tersubstitusi oleh gugus asetil.
Asam/garam empedu dan pati aren asetat sama-sama memiliki gugus yang bersifat hidrofobik yang memungkinkan kedua senyawa tersebut membentuk interaksi hidrofobik. Selain interaksi hidrofobik, ikatan elektrostatik juga diduga mempunyai peranan dalam pengikatan asam / garam empedu oleh pati aren asetat. Pati aren asetat bersifat kationik, sedangkan asam / garam empedu bersifat anionik yang memungkinkan kedua senyawa tersebut membentuk ikatan elektrostatik (Rahim et al., 2016).
Gambar 10. Pola pengikatan asam/garam empedu pada DS berbeda dari pati aren asetat
Menurut Thongngam dan Clements, (2005) bahwa pengikatan garam empedu (sodium taurokolat) oleh kitosan disebabkan interaksi hirofobik dan elektrostatik. Hal yang sama
27 juga dinyatakan oleh Cornfine et al, (2010) bahwa pengikatan asam empedu oleh dietary fibre lupins asetat disebabkan interaksi hidrofobik. Di samping interaksi hidrofobik dan elektrostatik serta pengikatan asam / garam empedu dengan pati aren asetat juga diduga terjadi pengikatan secara fisik. Hal ini disebabkan karena pati aren asetat dapat bersifat sebagai emulsifiyer yang meningkatkan viskositas cairan uji sehingga dapat memerangkap asam / garam empedu. Sifat emulsifiyer meningkat dengan meningkatnya RS yang berkorelasi positif dengan kemampuan pengikatan asam / garam empedu. Menurut Barbana et al. (2011) bahwa mekanisme interaksi antara dietary fibre dengan asam empedu melibatkan ikatan kimia dan pemerangkapan dalam matriks gel akibat interaksi hidrofilik atau hidrofobik. Besar kecilnya pengikatan terhadap asam / garam empedu diduga ada kaitannya dengan struktur kimia dan sifat ionik dari asam / garam empedu. Sodium deoksikolat dan sodium taurokolat mempunyai muatan pada gugus R sehingga mempunyai kemampuan interaksi ionik yang lebih tinggi dibandingkan asam kolat yang gugus R-nya tidak bermuatan.
Berdasarkan hal tersebut kemungkinan ada faktor lain yang juga berperan dalam proses pengikatan selain interaksi hidrofobik, elektrostatik, dan secara fisik (Rahim et al., 2016).
28
89.24c
85.03b
83.24b
79.93a
74 76 78 80 82 84 86 88 90
Pati alami DS 0,039 DS 0,078 DS 0,139
Kolesterol (%)
Derajat Substitusi
3.3. Penurunan kolesterol
Pengukuran kadar kolesterol pada emulsi yang ditambah dengan pati aren asetat dilakukan secara in vitro. Pola penurunan kolesterol pada DS berbeda dari pati aren asetat dapat dilihat pada Gambar 11. Data tersebut terlihat bahwa pati alami menyisakan kolesterol 89,24% dalam cairan uji, pati aren asetat DS 0,039 sebesar 85,03%, DS 0,078 sebesar 83,24% dan DS 0,139 sebesar 79,93%. Kolesterol menurun seiring dengan meningkatnya DS, hal ini menunjukkan bahwa pati aren asetat mampu menurunkan/menyerap kolesterol dan semakin meningkat dengan meningkatnya nilai DS.
Gambar 11. Pola penurunan kolesterol pada DS berbeda dari pati aren asetat.
Penurunan kolesterol tersebut disebabkan karena pati aren asetat mempunyai gugus hidrofobik yang dapat berikatan dengan kolesterol melalui interaksi hidrofobik. Selain itu, pati aren asetat juga sebagai emulsifiyer sehingga dapat
29 meningkatkan viskositas suspensi yang menyebabkan kolesterol terperangkat di dalam matriks gel dan menghambat absorpsi berbagai jenis makronutrien, lipid, dan asam / garam empedu. Kitosan suksinat mengikat kolesterol melalui interaksi hidrofobik (Chen-Minmao et al., 2011).
Mekanisme kerja pati aren asetat untuk menurunkan kolesterol masih belum dapat dipahami. Namun diduga pati aren asetat sebagai pengikat kolesterol melalui beberapa mekanisme, yaitu (1) Pati aren asetat dapat meningkatkan aktifitas enzim hepatik cholesterol 7α-hidroksilase, yaitu enzim di dalam usus halus yang berperan dalam mengkonversi kolesterol menjadi asam empedu dan kemudian disekresikan bersama senyawa steroid lainnya melalui feces. (2) Pati asetat mempunyai sifat viskos yang tinggi sehingga menyebabkan absorpsi kolesterol dan asam empedu ke usus halus menurun dan mengalami fermentasi oleh bakteri kolon menghasilkan SCFA yang menghambat metabolism kolesterol. (3) Pati asetat dapat menurunkan availabilitas kolesterol karena kemampuannya untuk mengikat senyawa organik. (4) Pati asetat mempunyai sifat meruah (Rahim et al., 2016).
30
31 BAB 4. KARAKTERISTIK PREBIOTIK PATI AREN
ASETAT
Pati aren hasil modifikasi secara asetilasi termasuk golongan prebiotik karena memenuhi kriteria antara lain tidak dihidrolisis maupun diserap (non-digestible) di saluran cerna bagian atas traktus gastrointestinal sehingga dapat mencapai usus besar secara utuh. Selain itu prebiotik juga menjadi substrat selektif bagi satu atau sejumlah terbatas bakteri dalam kolon yang distimulasi untuk tumbuh dan menjadi aktif secara metabolik. Prebiotik dapat mengubah keseimbangan flora usus besar ke arah komposisi yang menguntungkan kesehatan.
Evaluasi potensi prebiotik pati aren alami dan pati aren asetat dengan DS 0,039; DS 0,078; dan DS 0,139 dengan menggunakan inokulum dari feses segar manusia secara in vitro dengan melalui fermentasi. Potensi prebiotik dapat dievaluasi berdasarkan pertumbuhan bakteri kolon, indeks prebiotik, penurunan pH dan produksi SCFA.
4.1. Pola pertumbuhan bakteri
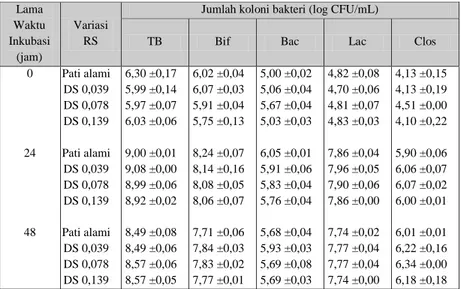
Penentuan pertumbuhan bakteri kolon didasarkan pada jumlah koloni yang tumbuh pada media selektif yang diinkubasi pada suhu 37°C selama 48 jam dengan lama waktu inkubasi 0, 24, dan 48 jam. Pola pertumbuhan bakteri pada variasi DS pati aren asetat dapat dilihat pada Tabel 1. Populasi jumlah sel bakteri total, Bifidobacteria, Bacteroides, Lactobacilli dan
32 Clostridia untuk semua sampel mempunyai pola yang sama, masing-masing meningkat pada lama waktu inkubasi 0 - 24 jam dan konstan pada lama waktu inkubasi 24 - 48 jam. Pada lama waktu inkubasi 0 - 24 jam bakteri kolon mengalami fase eksponensial dalam pertumbuhannya, pada fase eksponensial ini pembelahan sel berlangsung cepat, massa menjadi dua kali lipat. Sedangkan pada lama waktu inkubasi 24 - 48 jam, pertumbuhannya telah masuk dalam fase stasioner dan pada fase ini pertumbuhan mulai diperlambat.
Tabel 1. Pola pertumbuhan bakteri pada variasi DS pati aren asetat yang berbeda (pati alami, DS 0,039; DS 0,078; DS 0,139) dengan lama waktu inkubasi 0, 24, dan 48 jam.
Lama Waktu Inkubasi
(jam)
Variasi RS
Jumlah koloni bakteri (log CFU/mL)
TB Bif Bac Lac Clos
0
24
48
Pati alami DS 0,039 DS 0,078 DS 0,139 Pati alami DS 0,039 DS 0,078 DS 0,139 Pati alami DS 0,039 DS 0,078 DS 0,139
6,30 ±0,17 5,99 ±0,14 5,97 ±0,07 6,03 ±0,06 9,00 ±0,01 9,08 ±0,00 8,99 ±0,06 8,92 ±0,02 8,49 ±0,08 8,49 ±0,06 8,57 ±0,06 8,57 ±0,05
6,02 ±0,04 6,07 ±0,03 5,91 ±0,04 5,75 ±0,13 8,24 ±0,07 8,14 ±0,16 8,08 ±0,05 8,06 ±0,07 7,71 ±0,06 7,84 ±0,03 7,83 ±0,02 7,77 ±0,01
5,00 ±0,02 5,06 ±0,04 5,67 ±0,04 5,03 ±0,03 6,05 ±0,01 5,91 ±0,06 5,83 ±0,04 5,76 ±0,04 5,68 ±0,04 5,93 ±0,03 5,69 ±0,08 5,69 ±0,03
4,82 ±0,08 4,70 ±0,06 4,81 ±0,07 4,83 ±0,03 7,86 ±0,04 7,96 ±0,05 7,90 ±0,06 7,86 ±0,00 7,74 ±0,02 7,77 ±0,04 7,77 ±0,04 7,74 ±0,00
4,13 ±0,15 4,13 ±0,19 4,51 ±0,00 4,10 ±0,22 5,90 ±0,06 6,06 ±0,07 6,07 ±0,02 6,00 ±0,01 6,01 ±0,01 6,22 ±0,16 6,34 ±0,00 6,18 ±0,18
Keterangan: TB: Total bakteri, Bif: Bifidobacteria, Bac: Bacteroides, Lac: Lactobacilli, Clos: Clostridia, DS: derajat substitusi.
Pati alami, DS 0,039, DS 0,078, dan DS 0,139 menunjukkan bahwa pertumbuhan populasi jumlah sel
33 Bifidobacteria dan Lactobacilli meningkat 3 log siklus, sedangkan Clostridia meningkat 2 log siklus dan Bacteroides 1 log siklus setelah fermentasi selama 24 jam, dan selanjutnya konstan sampai 48 jam inkubasi. Dengan demikian dapat dinyatakan bahwa pati alami, DS 0,039, DS 0,078 dan DS 0,139 dapat dimanfaatkan oleh bakteri kolon sebagai sumber karbon dan bersifat selektif terhadap pertumbuhan bakteri kolon terutama Bifidobacteria dan Lactobacilli. Kedua kelompok bakteri tersebut diketahui mampu memberikan efek yang menguntungkan bagi kesehatan manusia.
Dalam menjaga kesehatan tubuh (diet) perlu diet pati modifikasi termasuk pati aren asetat yang sulit dicerna untuk menjaga keseimbangan mikroflora di usus, yang akhirnya memunculkan konsep prebiotik. Pati aren asetat memiliki kemampuan untuk memacu pertumbuhan populasi Bifidobacteria dan Lactobacilli. Namun bakteri Bacteroides dan Clostridia juga memiliki kemampuan untuk menggunakan pati aren asetat sebagai sumber karbon meskipun pertumbuhan relatif lebih kecil daripada Bifidobacteria dan Lactobacilli (Rahim et al., 2016)
4.2. Indeks prebiotik
Indeks prebiotik (IP) menggambarkan hubungan antara perubahan mikroflora yang menguntungkan dengan yang tidak diinginkan terkait dengan kadar awal mikrobia tersebut.
34
0.91a 0.94a
0.82a
0.75a
1.17b 1.16b
0.94a
0.86a
0.0 0.2 0.4 0.6 0.8 1.0 1.2 1.4
24 48
Indeks Prebiotik (IP)
Lama inkubasi (Jam)
Pati Alami DS 0.039 DS 0.078 DS 0.139
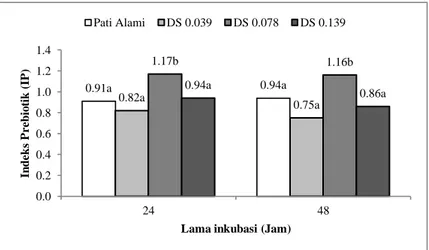
Pengujian IP dari pati aren alami dan pati aren asetat menggunakan metode yang dikembangkan oleh Palframan et al. (2003), dan Vardakou et al. (2008). Inokulum yang digunakan berasal dari feses manusia. Nilai indeks prebiotik pada 24 dan 48 jam yang disuplemantasi dengan berbagai DS (pati alami, DS 0,039, DS 0,078, DS 0,139) dapat dilihat pada Gambar 12. Nilai IP pada lama waktu inkubasi 24 jam (IP 0,82 – 1,17) lebih tinggi dibanding lama waktu inkubasi 48 jam (IP 0,75 – 1,16) untuk semua variasi DS. IP pada lama waktu inkubasi 24 jam dan 48 jam berbeda nyata untuk sampel DS 0,078. Nilai IP yang positif pada masing-masing substrat mengindikasikan terjadinya peningkatkan populasi Bifidobacteria dan Lactobacilli dibandingkan populasi Bacteroides dan Clostridia.
Gambar 12. Nilai indeks prebiotik pada 24 dan 48 jam yang disuplemantasi dengan berbagai DS (pati alami, DS 0,039, DS 0,078, DS 0,139).
35 Pati aren alami, DS 0,039, DS 0,078, dan DS 0,139 memiliki kemampuan untuk memacu pertumbuhan bakteri Bifidobacteria dan Lactobacilli sehingga dapat berpotensi sebagai sumber baru prebiotik. Indeks prebiotik frukto oligosakarida (FOS), trans-galaktooligosakarida (TOS), dan FOS:TOS (50:50) pada fermentasi 37oC selama 24 jam oleh bakteri kolon berturut-turut adalah 0,2; 0,8; dan 1,3 (Vulevic et al., 2004). Ghoddusi et al. (2007) menggunakan inulin, FOS, dan inulin : FOS (50:50) pada fermentasi 37oC selama 24 jam oleh bakteri kolon, dimana hasilnya menyatakan bahwa IP inulin, FOS, dan inulin : FOS (50:50) berturut-turut adalah 1,0;
2,3; dan 1,2. Menurut Licht et al. (2012) bahwa prebiotik dapat difermentasi oleh bakteri kolon menghasilkan SCFA (asam butirat) yang berfungsi untuk menstimulasi pertumbuhan dan diferensiasi sel-sel epitelium serta meregulasi sel proinflamasi.
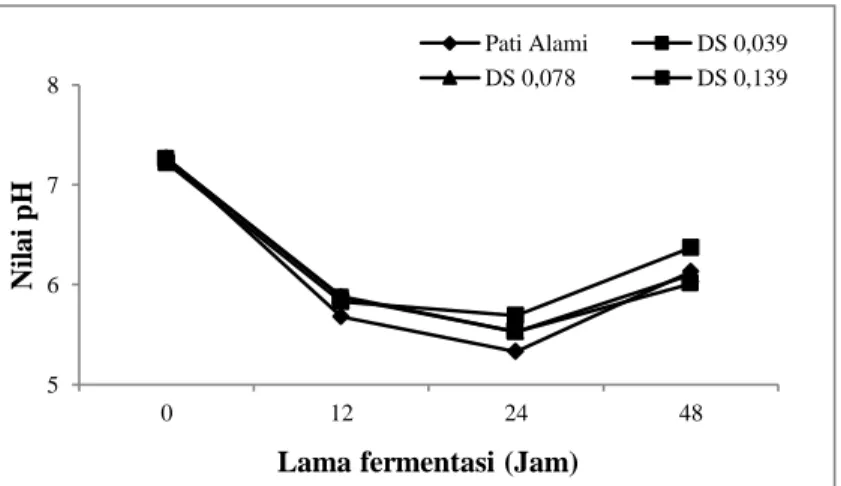
4.3. Perubahan pH
Nilai derajat keasaman (pH) diukur pada setiap DS dengan lama waktu inkubasi 0, 12, 24, dan 48 jam menggunakan pH meter. Nilai pH dengan lama waktu inkubasi 0, 12, 24, dan 48 jam pada pati alami, DS 0,039, DS 0,078, dan DS 0,139 dapat dilihat pada Gambar 13. Lama waktu inkubasi (sampai jam ke-24) nilai pH semakin menurun dan selanjutnya meningkat sampai akhir fermentasi (jam ke-48). Penurunan pH terkait langsung oleh adanya akumulasi SCFA yang bersifat
36
5 6 7 8
0 12 24 48
Nilai pH
Lama fermentasi (Jam)
Pati Alami DS 0,039
DS 0,078 DS 0,139
asam dan peningkatan jumlah proton (H+) sebagai hasil metabolisme bakteri yang ada dalam media fermentasi.
Perubahan pH menjadi asam akan menyebabkan efek antimikroba bagi mikroba patogen, sebaliknya bakteri menguntungkan masih dapat hidup dalam suasana asam dengan pH optimum 3–8 (Rahim et al., 2016).
Gambar 13. Nilai pH media fermentsi pada 0, 12, 24, dan 48 jam yang disuplementasi dengan pati aren alami dan pati aren asetat dengan DS 0,039, DS 0,078, dan DS 0,139.
Topping et al. (2007) menyatakan bahwa asam lemak rantai pendek berpengaruh secara langsung dalam mengasamkan kandungan digesta. Menurut Rathore et al.
(2012) bahwa fermentasi gandum oleh inokulum murni dari Lactobacillus plantarum (NCIMB 8826) dan Lactobacillus acidophilus (NCIMB 8821) yang diinkubasi pada suhu 37oC menunjukkan penurunan pH dari 6,32 menjadi 3,5 pada akhir
37 fermentasi 28 jam, yang disebabkan oleh produksi asam-asam organik selama fermentasi. Hal yang serupa dijelaskan oleh Madhukumar dan Muralikrishna (2010) bahwa fermentasi oligosakarida dari dedak gandum oleh inokulum Bifidobacterium asdolescentis NDRI 236 pada suhu 37oC selama 48 jam terlihat adanya penurunan pH yang disebabkan oleh produksi SCFA. Menurut O’Callaghan et al. (2012) bahwa tikus yang diberi pakan RS dari pati jagung amilosa tinggi mempunyai digesta yang bersifat asam karena terbentuknya SCFA. Sebagaimana dikemukakan oleh Poulsen et al. (2012) bahwa fermentasi pati jagung, gandum, inulin oleh mikroflora dari cairan rumen sapi menghasilkan SCFA yang membuat asam di sekitarnya (Rahim et al., 2016).
4.4. Produksi SCFA
Penentuan short chain fatty acid (SCFA) pada media fermentasi menggunakan gas kromatografi dengan lama waktu inkubasi 0, 24, dan 48 jam. Konsentrasi SCFA pada 0, 24, dan 48 jam yang disuplementasi dengan pati aren alami dan pati aren asetat pada DS 0,039, DS 0,078 dan DS 0,139 dapat dilihat pada Tabel 2. Produksi SCFA mengalami fluktuasi dan bervariasi dimana asam asetat diproduksi dalam jumlah tertinggi dibanding asam propionat dan asam butirat dengan rasio molar yang berbeda.
38 Tabel 2. Konsentrasi SCFA pada 0, 24, dan 48 jam yang disuplementasi dengan pati aren alami dan pati aren asetat pada DS 0,039, DS 0,078 dan DS 0,139.
Lama Waktu Inkubasi
(jam)
Variasi DS
Konsentrasi SCFA (mM)
Rasio Molar AA:AP:AB
(%) Asam
Asetat (AA)
Asam Propionat
(AP)
Asam Butirat
(AB)
Total SCFA
0
24
48
Pati alami DS 0,039 DS 0,078 DS 0,139 Pati alami DS 0,039 DS 0,078 DS 0,139 Pati alami DS 0,039 DS 0,078 DS 0,139
2,656 0,992 1,032 1,073 6,986 7,800 8,046 8,481 1,873 1,068 3,074 1,034
0,955 TT 0,990 0,976 2,562 1,629 2,306 2,457 0.562 0,210 1,325 1,213
1,071 TT O,513
0,451 1,022 0,701 0,913 0,982 TT TT 0,859 0,574
4,682 0,992 2,535 2,500 10,570 10.130 11,265 11.920 2,435 1,278 5,258 2,821
57 : 20 : 23 100 : 0 : 0
41 : 39 : 20 43 : 39 : 18 66 : 24 : 10 77 : 16 : 7 71 : 21 : 8 71 : 21 : 8 77 : 23 : 0 84 : 16 : 0 59 : 25 : 16 37 : 43 : 20
Keterangan: TT= tidak terdeteksi
Produksi asam asetat meningkat seiring bartambahnya lama inkubasi 0-24 untuk semua sampel dan menurun sampai jam ke-48, sedangkan produksi butirat mengalami peningkatan mulai dari awal sampai akhir fermentasi meskipun dalam jumlah yang sedikit dan bahkan ada yang tidak terdeteksi. Pola produksi asam propionat juga mempunyai kecenderungan yang mirip dengan produksi asam asetat, meningkat seiring bartambahnya lama inkubasi 0-24 dan dan selanjutnya menurun sampai jam ke-48. Produksi asam butirat meningkat seiring bertambahnya lama inkubasi 0, 24, dan 48 jam namun untuk sampel DS 0,078 dan DS 0,139 sedangkan sampel lainnya ada
39 yang tidak terdeteksi (TT). Pada Tabel 2, terlihat konsentrasi SCFA (asam asetat, propionat dan butirat) berbeda untuk setiap perlakuan pada lama waktu inkubasi jam ke-0. Hal ini disebabkan karena SCFA tersebut berasal feses yang konsentrasinya berbeda-beda dan adanya perbedaan jalur metabolisme produksi SCFA oleh mikrobia.
Pati alami, DS 0,039, DS 0,078, dan DS 0,139 sebagai sumber karbon dalam fermentasi dengan bakteri kolon menghasilkan konsentrasi SCFA yang berbeda. Hal ini diduga karena adanya perbedaan jenis ikatan dan komposisi penyusun jenis monosakarida. Lebih lanjut dijelaskan oleh Jonathan et al.
(2012) bahwa fermentasi glukomannan dan RS oleh mikrobia kolon dari feses menghasilkan konsentasi SCFA yang berbeda, hal ini disebabkan karena glukomannan mempunyai ikatan (1,4)-β-D-mannan dengan monosakarida dari mannosa, sedangkan RS mempunyai ikatan (1,4)-α-D-glukosa dengan monosakarida dari glukosa (Rahim et al., 2016).
Di samping jenis ikatan dan komposisi penyusun monosakarida, maka derajat polimerisasi (DP) juga berpengaruh dalam fermentasi untuk produksi SCFA. Struktur molekul yang kecil dari arbinoksilooligosakarida (DP ≤ 12) menghasilkan efek bifidogenik dan konsentrasi SCFA yang tinggi daripada struktur molekul yang besar (DP 61). Menurut Ramnani et al. (2012) bahwa agar dan alginat dengan berat
40 molekul rendah memproduksi SCFA yang lebih tinggi dan berpotensi prebiotik dibandingkan dengan berat molekul tinggi.
Pada produksi SCFA, pemanfaatan pati modifikasi akan didegradasi oleh enzim ekstraseluler yang dihasilkan oleh bakteri kolon menjadi glukosa. Selanjutnya glukosa yang merupakan pentosa melalui fermentasi mengalami proses glikolisis menjadi asam piruvat. Dalam proses metabolisme selanjutnya asam piruvat akan diubah menjadi asam asetat, asam propionat dan asam butirat. Hal ini dikarenakan bakteri kolon merupakan kelompok jenis bakteri yang bersifat heterofermentatif fakultatif yang dapat menghasilkan SCFA dari fermentasi pati modifikasi / RS melalui jalur heksosa monofosfat (HMP) atau biasa juga disebut jalur fosfoketolase atau jalur pentosa fosfat (Rahim et al., 2016).
41 BAB 5. TEKNIK PEMBUATAN DAN
KARAKTERISTIK FISIK DAN KIMIA ROTI PREBIOTIK
5.1. Prebiotik
Prebiotik adalah komponen makanan yang menguntungkan bagi kesehatan konsumen karena merangsang pertumbuhan atau aktivitas kelompok mikroba tertentu di dalam kolon. Prebiotik menyebabkan komposisi mikroflora dalam kolon akan berubah. Populasi mikroba yang menguntungkan, terutama Lactobacillus sp dan Bifidobaciterium sp akan meningkat dan sebaliknya pertumbuhan bakteri yang merugikan terutama Escerichia coli dan Clostridium sp dihambat. Jika prebiotik dalam makanan tidak cukup maka jumlah bakteri pathogen akan dominan sehingga zat – zat beracun akan terbentuk (Silalahi, 2006).
Salah satu komponen bahan pangan fungsional yang dikembangkan saat ini adalah pati termodifikasi termasuk pati aren asetat yang memiliki sifat prebiotik dan dapat digunakan sebagai bahan pensubstitusi sebagian atau seluruhnya tepung terigu dalam olahan produk pangan seperti roti, mie dan sebagainya, sehingga diperoleh olahan pangan yang sehat.
Prebiotik adalah komponen bahan pangan yang bermanfaat bagi manusia karena dapat menstimulasi pertumbuhan dan aktivitas sejumlah bakteri probiotik dalam kolon sehingga dapat memperbaiki kesehatan saluran pencernaan manusia (Toma, 2006).
42 5.2. Bahan roti prebiotik
5.2.1. Tepung Terigu
Tepung terigu merupakan hasil penggilingan biji gandum. Gandum bisa dibedakan berdasarkan kebiasaan tumbuh (musim dingin atau panas), warna (merah putih sampai kuning) dan kekerasan biji (keras atau lunak) sehingga dikenal gandum jenis: hard/soft red winter, soft white winter, soft white spring, red/yellow spring durum. Beberapa istilah untuk tepung terigu antara lain: tepung kuat, tepung lemah, selfraising flour, all purpose flour, instanized flour, enriched flour, whole wheat flour, whole meal flour dan phospated flour. Tepung kuat dan lemah dipakai untuk menunjukkan kandungan protein dalam terigu. Kandungan protein tepung kuat lebih tinggi dari tepung lemah sehingga cocok untuk membuat roti yang memerlukan pengadukan dan fermentasi lebih lama (Koswara, 2009).
5.2.2. Pati aren asetat
Pati aren asetat marupakan hasil modifikasi pati aren melalui proses asetilasi yang memiliki karakteristik fisik, kimia dan fungsional yang mirip dengan tepung terigu. Pati aren asetat memiliki daya mengembang yang besar dan juga memiliki kadar RS yang tinggi sehingga dapat digunakan sebagai sumber bahan pangan prebiotik. Produk pangan yang menggunakan pati aren asetat ini dapat digolongkan sebagai olahan produk pangan yang memiliki sifat prebiotik.
43 5.2.3. Garam
Fungsi garam dalam pembuatan roti adalah sebagai penambah rasa gurih, pembangkit rasa bahan-bahan lain, pengontrol waktu fermentasi, penambah kekuatan gluten, pengatur warna kulit, dan pencegah timbulnya bakteri-bakteri dalam adonan. Syarat garam yang baik yaitu harus 100% larut air, jernih, tidak menggumpal, murni dan bebas dari rasa pahit.
Garam pada roti mempunyai fungsi yang lebih penting daripada sekedar memperbaiki rasa. Garam membantu aktifitas amilase dan menghambat aktifitas protease pada tepung. Adonan tanpa garam akan menjadi lengket (agak basah) dan sukar dipegang (Koswara, 2009).
Garam adalah salah satu bahan pengeras, bila adonan tidak memakai garam, maka adonan agak basah.Garam memperbaiki pori-pori roti dan tekstur roti akibat kuatnya adonan, dan secara tidak langsung berarti membantu pembentukan warna. Garam membantu mengatur aktifitas ragi roti dalam adonan yang sedang difermentasi dan dengan demikian mengatur tingkat fermentasi. Garam juga mengatur mencegah pembentukan dan pertumbuhan bakteri yang tidak diinginkan dalam adonan yang diragikan (Koswara, 2009).
5.2.4. Gula
Gula digunakan sebagai bahan pemanis dalam pembuatan roti. Jenis gula yang paling banyak digunakan adalah sukrosa. Selain sebagai pemanis sukrosa juga berperan
44 dalam penyempurnaan mutu panggang dan warna kerak, dan memungkinkan proses pematangan yang lebih cepat, sehingga air lebih banyak dipertahankan dalam roti (Koswara, 2009).
Gula sangat penting peranannya dalam pembuatan roti diantaranya sebagai makanan ragi, memberi rasa, mengatur fermentasi, memperpanjang umur roti, menambah kandungan gizi, memberikan warna cokelat yang menarik pada kulit karena proses maillard atau karamelisasi (Mudjajanto dan Yulianti, 2004).
Gula juga ditujukan sebagai sumber karbon pertama dari sel khamir yang mendorong keaktifan fermentasi. Gula yang dimanfaatkan oleh sel khamir, umumnya hanya gula-gula sederhana, glukosa atau fruktosa, yang dihasilkan oleh pemecahan enzimatik molekul yang lebih kompleks, seperti sukrosa, maltosa, pati atau karbohidarat lainnya. Sukrosa dan maltosa dapat dipecah menjadi gula sederhana (heksosa) oleh enzim yang ada dalam sel khamir, sedangkan pati dan dekstrin tak dapat diserang oleh khamir. Enzim-enzim yang terdapat dalam tepung atau malt diastatik, berfungsi memproduksi gula dekstrosa atau maltosa dari pati yang ada dalam adonan (Koswara, 2009).
5.2.5. Susu Bubuk
Susu bubuk digunakan untuk produk-produk bakery berfungsi membentuk flavor, mengikat air, sebagai bahan
45 pengisi, membentuk struktur yang kuat dan porous karena adanya protein berupa kasein, membentuk warna karena terjadi reaksi pencoklatan dan menambah keempukan karena adanya laktosa (Koswara, 2009).
Roti yang terbuat dari tepung jenis lunak (soft) atau berprotein rendah, penambahan susu lebih banyak dibandingkan tepung jenis keras (hard) atau berprotein tinggi.
Penambahan susu sebaiknya berupa susu padat. Alasannya, susu padat menambah penyerapan (absorpsi) air dan memperkuat adonan. Bahan padat bukan lemak pada susu padat tersebut berfungsi sebagai bahan penyegar protein tepung sehingga volume roti bertambah (Mudjajanto dan Yulianti, 2004).
5.2.6. Ragi
Ragi termasuk bahan baku utama pada pembuatan roti.
Ragi untuk roti dibuat dari sel khamir Saccharomyces cereviceae, dengan memfermentasi gula, khamir menghasilkan karbondioksida yang digunakan untuk mengembangkan adonan (Mudjajanto dan Yulianti 2004). Ragi berfungsi untuk mengembangkan adonan dengan memproduksi gas CO2, memperlunak gluten dengan asam yang dihasilkan dan juga memberikan rasa dan aroma pada roti. Dengan memfermentasi gula, khamir menghasilkan gas karbodioksida yang digunakan untuk mengembangkan adonan (Koswara, 2009).
46 Ragi mengandung beberapa enzim yaitu protease, lipase, invertase, maltase dan zymase. Protease memecah protein dalam tepung menjadi senyawa nitrogen yang dapat diserap sel khamir untuk membentuk sel yang baru. Lipase memecah lemak menjadi asam lemak dan gliserin. Invertase memecah sukrosa menjadi glukosa dan fruktosa. Maltase memecah maltosa menjadi glukosa dan zymase memecah glukosa menjadi alkohol dan karbondioksida. Akibat dari fermentasi ini timbul komponen-komponen pembentuk flavor roti, diantaranya asam asetat, aldehid dan ester (Koswara, 2009).
Aktivitas ragi roti di dalam adonan dipengaruhi oleh beberapa faktor antara lain enzim-enzim protease, lipase, invertase dan maltase, kandungan air, suhu, pH, gula dan garam. Enzim protease dapat mengurangi kekuatan jaringan zat gluten sehingga adonan menjadi lebih mudah untuk diolah.
Sedangkan enzim lipase berfungsi melindungi selselragi roti sewaktu menjadi spora. Enzim invertase merubah gula menjadi glukosadan fruktosa, sedangkan enzim maltase merubah maltosa menjadi dekstrosa. Adanya komponen garam akan memperlambat kerja ragi roti. Kondisi optimal bagi aktivitas ragi roti dalam proses fermentasi adalah pada activity water (aw) = 0,905 suhu antara 25oC sampai 30oC dan pH antara 4.0 sampai 4.5 (Koswara, 2009).