OBAT LEVOFLOXACIN (LFX)
SKRIPSI
WINA MIRANTI 170801026
PROGRAM STUDI S1 FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2021
OBAT LEVOFLOXACIN (LFX)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
WINA MIRANTI 170801026
PROGRAM STUDI S1 FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2021
SINTESIS DAN KARAKTERISASI NANOPARTIKEL CuFe2O4
DENGAN METODE HYDROTHERMAL SEBAGAI ADSORBEN OBAT LEVOFLOXACIN (LFX)
ABSTRAK
Telah berhasil dilakukan sintesis nanopartikel Copper Ferrite (CuFe2O4) dengan menggunakan metode hydrothermal. Pembuatan nanopartikel ini dilakukan dengan memvariasikan komposisi mol CuCl2.2H2O dan FeCl2.4H2O yang dinyatakan dalam perbandingan mol (1:1, 1:2, 2:1, dan 2:3). Untuk mengetahui sifat- sifat bahan dari sampel CuFe2O4 maka dilakukan karakterisasi sampel menggunaakan FESEM (Field Emission Scanning Electron Microscopy), XRD (X- ray Diffraction), FTIR (Fourier Transform Infrared), dan VSM (Vibrating Sample Magnetometer), serta mekanisme adsorptansi levofloxacin menggunakan UV-Vis Spectrophotometer. Dari hasilFESEM menunjukkanbahwa sampel CuFe2O4-
berukuran nanometer. Pola difraksi yang dihasilkan dari analisa menggunakan XRD terlihat bahwa nanopartikel CuFe2O4membentuk fasa tunggal yaitu Copper Ferrite, struktur kristal kubik, dan parameter kisi yang semakin meningkat seiring meningkatnya konsentrasi Cu yaitu 3,685 – 3,693 Å, serta ukuran partikel terkecil terdapat pada sampel 2:1 yaitu 5,2 nm. Hasil FTIR menunjukkan bahwa struktur kimia CuFe2O4sesuai dengan bahan penyusunnya. Sifat magnetik yang diperoleh dari hasil VSM menunjukkan bahwa CuFe2O4termasuk pada sifat superparamagnetik. UV-Vis Spectrophotometer menunjukkan bahwa variasi nanopartikel CuFe2O4 yang paling optimal dalam mengadsorpsi LFX yaitu pada variasi mol 2:1 dengan konsentrasi PS 1 g/L dan suhu 45˚C dengan persentase adsorptansi sebesar 87,47%.
Kata kunci : Adsorben, Levofloxacin, Metode Hydrothermal, Nanopartikel CuFe2O4
AS ADSORBENT OF LEVOFLOXACIN (LFX) DRUG
ABSTRACT
The synthesis of Copper Ferrite (CuFe2O4) nanoparticles has been successfully carried out using the hydrothermal method. The manufacture of these nanoparticles was carried out by varying the mole composition of CuCl2.2H2O and FeCl2.4H2O expressed in mole ratios (1:1, 1:2, 2:1, and 2:3). To determine the material properties of the CuFe2O4 sample, sample characterization was carried out using FESEM (Field Emission Scanning Electron Microscopy), XRD (X-ray Diffraction), FTIR (Fourier Transform Infrared), and VSM (Vibrating Sample Magnetometer), as well as the adsorption mechanism of levofloxacin. using a UV- Vis Spectrophotometer. FESEM results show that the CuFe2O4 sample is nanometer in size. The diffraction pattern resulting from the analysis using XRD shows that CuFe2O4 nanoparticles form a single phase, namely Copper Ferrite, cubic crystal structure, and lattice parameters which increase with increasing Cu concentration, namely 3.685 – 3.693 , and the smallest particle size is found in the 2:1 sample, which is 5.2 nm. The FTIR results show that the chemical structure of CuFe2O4
corresponds to its constituent materials. The magnetic properties obtained from the VSM results indicate that CuFe2O4 is included in the superparamagnetic properties.
The UV-Vis Spectrophotometer showed that the most optimal variation of CuFe2O4
nanoparticles in adsorption of LFX was at a mole variation of 2:1 with a PS concentration of 1 g/L and a temperature of 45˚C with an adsorption percentage of 87.47%. The magnetic properties obtained from the VSM results indicate that CuFe2O4 is included in the superparamagnetic properties. The UV-Vis Spectrophotometer showed that the most optimal variation of CuFe2O4 nanoparticles in adsorption of LFX was at a mole variation of 2:1 with a PS concentration of 1 g/L and a temperature of 45˚C with an adsorption percentage of 87.47%. The magnetic properties obtained from the VSM results indicate that CuFe2O4 is included in the superparamagnetic properties. The UV-Vis Spectrophotometer showed that the most optimal variation of CuFe2O4 nanoparticles in adsorption of LFX was at a mole variation of 2:1 with a PS concentration of 1 g/L and a temperature of 45˚C with an adsorption percentage of 87.47%.
Keywords : Adsorbent, CuFe2O4Nanoparticles, Hydrothermal Method, Levofloxacin
PENGHARGAAN
Alhamdulillah, segala puji dan syukur penulis panjatkan kehadirat Allah SWT atas rahmat dan karunia-Nya sehingga penulisan Skripsi dengan judul“Sintesis dan Karakterisasi Nanopartikel CuFe2O4Dengan Metode Hydrothermal Sebagai Adsorben Obat Levofloxacin (LFX)” dapat diselesaikan.
Ucapan terimakasih yang setulusnya dan penghargaan yang setingginya disampaikan kepada Bapak Dr. Perdinan Sinuhaji, MS selaku dosen pembimbing yang telah memberikan kesempatan, ilmu, motivasi, nasihat dan dukungan serta bersedia meluangkan waktunya untuk mendampingi penulis dalam setiapbimbingannya. Bapak Dr. Syahrul Humaidi, M.Sc, Ibu Dra. Sudiati, M.Si, dan Bapak Dr. Kurnia Sembiring, MS selaku dosen penguji yang memberi kritik serta saran yang membangun bagi penulis. Ibu Dr. Martha Riana, M.Si dan Abangda Muhammadin Hamid yang juga telah membimbing dan meluangkan waktunya dalam penelitian ini. Nurul Yaumilda Hasibuan selaku partner penelitian penulis yang sama-sama merasakan suka duka dalam penelitian ini. Shulthanah Amin, Rini Rahmawati, Novia Prastika, dan Agusdini Auryanti yang telah mendengarkan keluh kesah serta memberi dukungan dan semangat kepada penulis. Sisterfillah dan Sejolid Sejati yang dari awal perkuliahan telah memberi banyak dukungan kepada penulis.Teman-teman Fisika 2017 atas bantuan dan kebersamaan selama ini. Ibu Dr.
Nursahara Pasaribu, M.Sc selaku Dekan FMIPA USU, Bapak Dr. Perdinan Sinuhaji, MS dan Awan Maghfirah S.Si, M.Si selaku ketua dan sekretaris Departemen Fisika FMIPAUSU, dan seluruh staf dosen dan staf pegawai Departemen Fisika FMIPA USU yang telah memberikan fasilitas kepada penulis selama perkuliahan. Akhirnya ucapan terima kasih yang setinggi-tingginya penulis sampaikan kepada kedua orang tua Ibunda Nur’aini, Ayahanda Wahyudi, Adik Fani Febriyanti dan Shakira Myieshanti atas doa, perhatian, dukungan dan pengorbanan yang tak terkira hingga penulis berada ditahap ini serta untuk keluarga besar dan teman-teman yang tidak dapat disebutkan namanya satu persatu terimakasih untuk motivasi, dukungan dan perhatiannya. Dan tak lupa penulis berterimakasih kepada diri sendiri karena masih tetap menjaga kewarasan hingga akhir dan sampai dititik ini.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaaan. Oleh karena itu dengan besar hati penulis sangat berterimakasih terhadap saran dan kritik yang akan dijadikan masukan guna perbaikan. Semoga skripsi ini bermanfaat bagi penulis dan pembaca yang budiman.
Medan, Juli 2021
Wina Miranti
DAFTAR ISI
Halaman
PENGESAHAN SKRIPSI i
ABSTRAK ii
ABSTRACT iii
PENGHARGAAN iv
DAFTAR ISI v
DAFTAR TABEL vii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN ix
DAFTAR SINGKATAN x
BAB 1PENDAHULUAN 1
1.1 LatarBelakang 1
1.2 Rumusan Masalah 2
1.3 Batasan Masalah 3
1.4 Tujuan Penelitian 3
1.5 Manfaat Penelitian 4
BAB 2TINJAUAN PUSTAKA 5
2.1Levofloxacin(LFX) 5
2.2Metode Persulfate (PS) 6
2.3Nanopartikel CuFe2O4 8
2.4Metode Hydrothermal 9
2.5 Sifat-sifat Magnet 10
2.5.1Diamagnetik 13
2.5.2Paramagnetik 14
2.5.3Ferromagnetik 14
2.5.4Antiferromagnetik 15
2.5.5Ferrimagnetik 15
2.6 Kurva Histerisis 15
2.7 Karakterisasi Material 17
2.7.1 X-Ray Diffraction (XRD) 17
2.7.2 Field Emission-Scanning Electron Microscope (FE-SEM) 19
2.7.3Fourier Transform Infrared (FT-IR) 20
2.7.4Vibrating Sample Magnetometer (VSM) 20
2.7.5UV-Visible Spectrophotometer 21
BAB 3METODE PENELITIAN 22
3.1 Tempat dan Waktu Penelitian 22
3.1.1Tempat Penelitian 22
3.1.2Waktu Penelitian 22
3.2 Peralatan dan Bahan Penelitian 22
3.2.1Alat 22
3.2.2Bahan 24
Molnanopartikel CuFe2O4
3.3.3Pengujian Adsorptansi Levofloxacin Menggunakan Variasi Konsentrasi Pottasium Persulfate
27 3.3.4Pengujian Adsorptansi Levofloxacin Menggunakan Variasi
Suhu
28
3.4. Diagram Alir penelitian 30
BAB 4HASIL DAN ANALISA 31
4.1 Sintesis Nanopartikel CuFe2O4 31
4.1.1 Rasio mol 1:1 (0.1 M : 0.1 M) 31
4.1.2 Rasio 1:2 (0.1 M : 0.2 M) 31
4.1.3 Rasio mol 2:1 (0.2 M : 0.1 M) 32
4.1.4 Rasio mol 2:3 (0.2 M : 0.3 M) 33
4.2 Karakterisasi CuFe2O4 33
4.2.1 Morfologi (FESEM) 33
4.2.2 Struktur (XRD) 34
4.2.3 Kimia (FTIR) 36
4.2.4 Magnet (VSM) 37
4.3 Pengujian Adsorptansi Levofloxacin 38
4.3.1 Pengujian Adsorptansi Levofloxacin Menggunakan Variasi Mol nanopartikel CuFe2O4
39 4.3.2 Pengujian Adsorptansi Levofloxacin Menggunakan Variasi
Konsentrasi Pottasium Persulfate
40 4.3.3 Pengujian Adsorptansi Levofloxacin Menggunakan Variasi
Suhu
41
BAB 5 KESIMPULAN DAN SARAN 43
5.1 Kesimpulan 43
5.2 Saran 43
DAFTAR PUSTAKA 45
LAMPIRAN 47
DAFTAR TABEL
Nomor
Tabel Judul Halaman
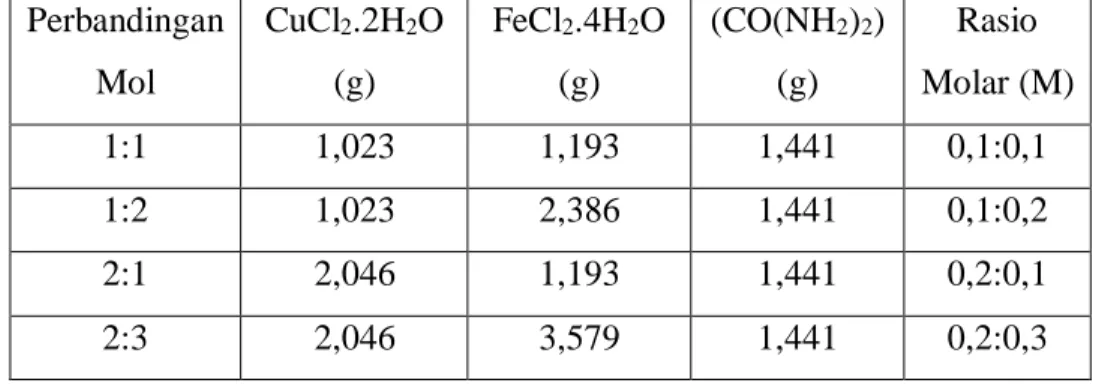
3.1 Variasi Perbandingan mol prekursor CuCl2.2H2O dan
FeCl2.4H2O 25
4.1 Nilai magnetik nanopartikel CuFe2O4 37
4.2 Nilai puncak adsorptansi dan C/Co dari LFX dengan
menggunakan variasi mol 39
4.3 Nilai puncak adsorptansi dan C/Co dari LFX dengan
menggunakan variasi konsentrasi 40
4.4 Nilai puncak adsorptansi dan C/Co dari LFX dengan
menggunakan variasi suhu 41
DAFTAR GAMBAR
Nomor
gambar Judul Halaman
2.1 Struktur LFX 5
2.2
(a) Struktur spinel Fe3O4, (b) Skema untuk konfigurasi yang berbeda dari atom Cu pada sisi oktahedral: tipe I, II, III, dan IV.
8
2.3 Autoclave dengan penutup flat plate 9
2.4 Arah domain: (a) paramagnetik (b) ferromagnetik (c)
antiferromagnetik (d) ferrimagnetik 13
2.5 Kurva Induksi Normal 16
2.6 Kurva Histerisis Magnetik 16
2.7 DiagramX-ray diffractometer 18
2.8 Difraksi bidang atom 19
3.1 Diagram alir penelitian 30
4.1 Sampel CuFe2O4 1:1 31
4.2 Sampel CuFe2O4 1:2 32
4.3 Sampel CuFe2O4 2:1 32
4.4 Sampel CuFe2O42:3 33
4.5
Mikrostruktur CuFe2O4 dengan variasi mol (a) 1:1 (b)
1:2 (c) 2:1 (d) 2:3 34
4.6 Pola difraksi CuFe2O4 34
4.7 Kurva hasil uji FTIR CuFe2O4 36
4.8 Kurva Histerisis CuFe2O4 37
4.9 Adsorptansi LFX Variasi Mol 39
4.10 Adsorptansi LFX Variasi PS 40
4.11 Adsorptansi LFX Variasi Suhu 41
DAFTAR LAMPIRAN
Nomor
lampiran Judul Halaman
1 Gambar alat dan bahan 47
2 Perhitungan komposisi CuFe2O4 50
3 Hasilmapping FESEM (ukuran nanopartikel CuFe2O4) 51 4 Hasil XRD : perhitungan parameter kisi dan diameter
kristal CuFe2O4
54
5 Data FTIR 62
6 Kurva VSM CuFe2O4 63
DAFTAR SINGKATAN
LFX = Levofloxacin
AOPs = Advanced Oxidation Processes
FE-SEM = Field Emition – Scanning Scanning Electron Microscopy FQs = Fluoroquinolones
FTIR = Fourier Transform Infrared
PS = Persulfate
PMS =Peroxymonosulfate
SR-AOPs = Sulfate Radicals-based Advanced Oxidation Process VSM = Vibrating Sample Magnetometer
XRD = X-ray Diffractometer
WWTPs = Wastewater Treatment Plants
JCPDS = Joint Committee on Powder Diffraction Standards
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Levofloxacin (LFX) sebagai anggota dari antibiotik fluoroquinolone yang digunakan untuk mengobati infeksi bakteri pada manusia seperti disentri, TBC, bahkan HIV (Ma et al., 2019). Levofloxacin juga digunakan pada hewan, bidang pertanian, dan bidang budidaya perairan, yang mau tidak mau limbahnya akan terbuang ke lingkungan (Qiao et al., 2018). Namun, beberapa tahun terakhir diketahui bahwa levofloxacin telah terdeteksi di lingkungan perairan yang akan membawa efek buruk bagi kesehatan lingkungan dan manusia (Hamdi El Najjar et al., 2013). Sejauh ini, proses pengolahan limbah kurang efektif dalam menghilangkan residu levofloxacin karena sifat antibakterinya (Van Doorslaer et al., 2014). Oleh karena itu, sangat diperlukan metode yang efektif dan efisien untuk mengadsorpsikan levofloxacin.
Pemanfaatan radikal sulfat (SO42-) pada proses oksidasi lanjutan (AOPs) diketahui telah berhasil dalam mengadsorpsikan polutan organik berbahaya di dalam air dengan menggunakan metode Peroxymonosulfate (PMS) atau Persulfate (PS) (Lyu et al., 2020). PS digunakan sebagai oksidan untuk menghasilkan SO4•- karena sifatnya yang stabil, kelarutan dalam cairan yang tinggi, dan biaya yang relatif lebih rendah dibanding PMS (Wacławek et al., 2017). PS dapat dengan mudah diaktifkan untuk menghasilkan SO42-dengan menggunakan katalis logam transisi. Logam transisi telah banyak dipelajari sebagai katalis dalam beberapa reaksi organik, baik katalis homogen maupun heterogen. Katalis homogen merupakan katalis yang berada pada fase yang sama dengan reaktan, sedangkan katalis heterogen merupakan katalis yang berada pada fase yang berbeda dengan reaktan (Li et al., 2019).
Baru-baru ini, aplikasi spinel ferrit dengan formula MFe2O4 (M = Cu, Zn, Co, Mn, dan sebagainya) digunakan sebagai katalis heterogen untuk pengaktivasian PS dalam mengurangi limbah cair farmasi (H. Zhang et al., 2020). Nanopartikel Copper ferrite (CuFe2O4) terdiri dari ion oksigen (O2–) yang menempati struktur kubik, kation Fe3+ yang menempati setengah dari lubang oktahedral, dan ion Cu2+
adalah kation divalen yang menempati delapan lubang tetrahedral.
NanopartikelCuFe2O4memiliki sifat magnetik yang baik, struktur kristalin yang stabil, kelarutan yang rendah, dan luas permukaan spesifik yang tinggi (Calvo-De La Rosa and Segarra, 2019). Berbagai metode eksperimental telah digunakan untuk preparasi nanopartikelCuFe2O4seperti metode hydrothermal, sol–gel, co- precipitation, dan microwave sintering. Di antara metode sintesis ini, metode hydrothermal mempunyai beberapa keunggulan seperti menggunakan suhu rendah, metodenya sederhana dan murah, preparasi tidak membutuhkan waktu yang lama dan luas permukaan yang tinggi (Nakhate and Yadav, 2017).
Dalam penelitian ini, nanopartikelCuFe2O4akan disintesis menggunakan metode hydrothermal sebagai adsorben LFX dengan pengaktivasian persulfate.
Dimana CuFe2O4disintesis dari prekursor CuCl2.2H2O (Copper (II) Chloride Dihydrate) dan FeCl2.4H2O (Iron (II) Chloride Tetrahydrate) dengan beberapa variasi perbandingan mol (1:1, 1:2, 2:1, dan 2:3) serta penambahan Urea (CO(NH2)2) yang akan dikarakterisasi dengan menggunakan XRD (untuk menganalisis pengaruh komposisi terhadap struktur dan identifikasi fasa kristal), FE- SEM (untuk menganalisis struktur morfologi), FTIR (untuk menganalisis struktur kimia), dan VSM (untuk menganalisis pengaruh sifat magnet dari berbagai variasi mol). Kemudian pengaktifan PS dari nanopartikelCuFe2O4akan dipreparasikan untuk menguraikan levofloxacin dengan parameter pengontrol (termasuk PS dan suhu) yang akan dianalisis mekanisme adsorptansi LFX menggunakan UV-Vis Spectrophotometer.
1.2 RumusanMasalah
Adapun rumusan masalah dalam penelitian ini adalah :
1. Bagaimana cara mensintesis nanopartikel CuFe2O4 menggunakan metode hydrothermal?
2. Bagaimana morfologi nanopartikel CuFe2O4?
3. Bagaimanastruktur kristal dan ukuran kristal nanopartikel CuFe2O4? 4. Bagaimanakandungan kimia nanopartikel CuFe2O4?
5. Bagaimana sifat kemagnetan nanopartikel CuFe2O4?
6. Bagaimana pengaruh variasi mol nanopartikel CuFe2O4, PS, dan
suhuterhadap adsorptansi LFX?
1.3 Batasan Masalah
Adapun batasan masalah dalam penelitian ini adalah :
1. Prekursor yang digunakan untuk mensintesis nanopartikel CuFe2O4
adalah CuCl2.2H2O dan FeCl2.4H2O.
2. Pengaruh variasi perbandingan mol antara CuCl2.2H2O dan FeCl2.4H2O yang akan diuji adalah 1:1, 1:2, 2:1 dan 2:3.
3. Massa Urea (CO(NH2)2) yang akan digunakan adalah sama untuk semua variasi perbandingan mol yaitu sebanyak 1,44 g.
4. Metode yang digunakan untuk mensintesis nanopartikel CuFe2O4 adalah metode hydrothermal dengan temperatur 200˚C selama 5 jam.
5. Pencucian sampel nanopartikel CuFe2O4 yang telah dihydrothermal adalah 2 kali pencucian menggunakan aquadest dan 1 kali pencucian menggunakan etanol.
6. Temperatur pengeringan nanopartikel CuFe2O4 adalah 100˚C selama 30 menit dan kalsinasi nanopartikel CuFe2O4 adalah 300˚C selama 1 jam.
7. Karakterisasi nanopartikel CuFe2O4 meliputi: stuktur (XRD), morfologi (FE-SEM), kimia (FTIR), dan magnet (VSM). Kemudian pengadsorpsian levofloxacin akan dianalisis oleh UV-Vis Spectrophotometer.
8. Variasi PS untuk mengadsorpsi LFX yaitu 1 g/L, 1,5 g/L, dan 2 g/L.
9. Variasi suhu untuk mengadsorpsi LFX yaitu 30˚C, 35˚C, dan 45˚C.
10. Massa LFX yang akan digunakan adalah sama untuk semua uji adsorpsi LFX yaitu sebanyak 1mg.
11. LFX yang diadsorpsi berbentuk larutan sehingga aplikasinya nanti dilakukan untuk penanganan limbah obat farmasi LFX yang terdapat di lingkungan akuatik/perairan.
1.4 Tujuan Penelitian
Adapun tujuan dalam penelitian ini adalah :
1. Untuk mengetahui cara mensintesis nanopartikel CuFe2O4 menggunakan
metode hydrothermal
2. Untuk mengetahui morfologi nanopartikel CuFe2O4
3. Untuk mengetahui struktur kristal dan ukuran kristal nanopartikel CuFe2O4
4. Untuk mengetahui kandungan kimia nanopartikel CuFe2O4
5. Untuk mengetahui sifat kemagnetan nanopartikel CuFe2O4
6. Untuk mengetahui pengaruh variasi mol nanopartikel CuFe2O4, PS, dan suhu terhadap adsorptansi LFX?
1.5 Manfaat Penelitian
Adapun manfaat dari penilitian ini adalah memberikan informasi mengenai proses sintesis nanopartikelCuFe2O4dan diharapkan nanopartikel CuFe2O4 dapat mengadsorpsi LFX dengan baik sehingga dapat diterapkan pada pengolahan limbah obat LFX agar lebih aman untuk makhluk hidup dan ramah lingkungan.
BAB 2
TINJAUAN PUSTAKA
2.1 Levofloxacin (LFX)
Menurut Moffat, dkk., (2005) sifat fisikokimia levofloxacin adalah sebagai berikut:
Rumus Kimia :
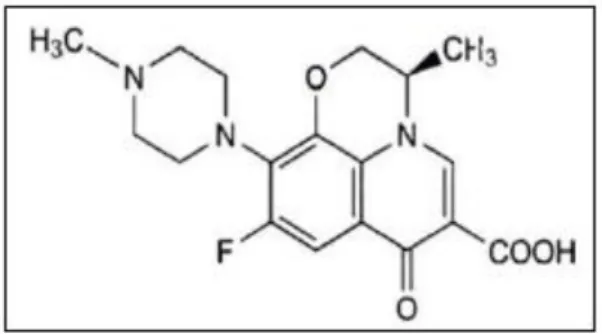
Gambar 2.1 Struktur LFX
Nama Kimia : (-)-(S)-9-fluoro-2,3-dihidro-3-metil-10-(4-metil-1- piperazinil)-7-okso-7-7H-pirido[1,2,3-de]-1,4- benzoksasin-6-karboksilat
Rumus Molekul : C18H20FN3O4
Berat Molekul : 361,4
Karakteristik : Serbuk kristal berwarna putih kekuningan, tidak berbaudan rasa pahit
Kelarutan : Mudah larut dalam asam asetat glasial dan kloroform, sedikitlarut dalam air, metanol, etanol atau aseton, sangat sukar larut dalam etil asetat.
Fluoroquinolones (FQs), sebagai salah satu obat antibakteri utama untuk aplikasi klinis, memiliki aktivitas antibakteri yang kuat pada bakteri gram-negatif, bakteri gram-positif dan Pseudomonas aeruginosa. Mirip dengan banyak obat- obatan, fluoroquinolon seperti LFX tidak dapat sepenuhnya dimetabolisme di dalam tubuh, dan beberapa dikeluarkan dalam bentuk obat atau metabolit asli bersama dengan urin dan tinja, sehingga memasuki lingkungan, yang mengancam kesehatan manusia dan ekosistem. Beberapa peneliti telah mengkonfirmasi adanya berbagai
senyawa fluoroquinolone dalam air limbah dari instalasi pengolahan air limbah (WWTP). Meskipun konsentrasi antibiotik yang lebih rendah di lingkungan, mereka akan menimbulkan potensi bahaya jangka panjang bagi kesehatan manusia dan seluruh ekosistem melalui bioakumulasi dan gangguan endokrin. Misalnya, akan menyebabkan resistensi obat bakteri pada konsentrasi yang sangat rendah, menyebabkan teratogenesis fisiologis tumbuhan / alga dan menjadi genotoksik / karsinogenik untuk organ(H. Zhang et al., 2020).
Pada tahun 2011, di Amerika Serikat, antibiotik fluoroquinolones digunakan oleh sekitar 23,1 juta pasien rawat jalan (70% diantaranya adalah ciprofloxacin, 28%
levofloxacin) dan 3,8 juta pasien rawat inap (diantaranya 63% levofloxacin, 28%
ciprofloxacin). Meskipun demikian, pada tahun 2011, di Amerika Serikat kedua antibiotik tersebut mendapat lebih dari 2000 tuntutan hukum karena efek samping yang ditimbulkan. Levofloxacin, merupakan fluorokuinolon generasi ketiga mempunyai aktifitas yang lebih luas mencakup gram positif dan patogen atypica (Raini, 2016). Levofloxacin, sebagai obat antibakteri spektrum luas, dapat mengobati infeksi bakteri yang parah. Levofloxacin secara luas digunakan pada manusia, hewan, pertanian dan akuakultur, yang pasti dibuang ke lingkungan. Dalam beberapa tahun terakhir, levofloxacin telah terdeteksi di permukaan air, air tanah, dan bahkan air minum di banyak negara. Kehadiran levofloxacin dalam air dapat menimbulkan efek buruk bagi spesies air dan meningkatkan resistensi bakteri (Lyu et al., 2020).
Tetapi, FQs yang tersisa di lingkungan hanya biodegradable yang lemah dan sebagian dihilangkan dengan pengolahan air limbah konvensional. Oleh karena itu, mencari strategi perawatan yang efektif untuk menghilangkan FQs di lingkungan air dan menghambat efek ekotoksikologisnya sangat penting(H. Zhang et al., 2020).
2.2 Metode Persulfate (PS)
Pemanfaatan radikal sulfat (SO4•-) pada proses oksidasi lanjutan (AOPs) diketahui telah berhasil dalam mengadsorpsikan polutan organik berbahaya di dalam air dengan menggunakan metode Peroxymonosulfate (PMS) atau Persulfate (PS) (Hao et al., 2020). PS digunakan sebagai oksidan untuk menghasilkan SO4• - karena sifatnya yang stabil, kelarutan dalam cairan yang tinggi, dan biaya yang relatif lebih rendah dibanding PMS (Wacławek et al., 2017). PS dapat dengan mudah diaktifkan
untuk menghasilkan SO4•- dengan menggunakan katalis logam transisi. Logam transisi telah banyak dipelajari sebagai katalis dalam beberapa reaksi organik, baik katalis homogen maupun heterogen. Katalis homogen merupakan katalis yang berada pada fase yang sama dengan reaktan, sedangkan katalis heterogen merupakan katalis yang berada pada fase yang berbeda dengan reaktan (Li et al., 2019).
Proses oksidasi lanjutan (Advanced oxidation processes/AOPs) adalah teknologi yang efektif dan umum untuk mengurangi bahan organik sulit dihilangkan dalam pengolahan air limbah, diketahui berbagai oksidan, seperti persulfate (PS), hidrogen peroksida, ozon (O3) dan reagen Fenton. Oksidan ini dapat secara efisien mengadsorpsi polutan dengan kapasitas pengoksidasi yang kuat, namun penggunaan oksidan ini memiliki kelemahan yang tidak dapat dihindari. Misalnya, ketika hidrogen peroksida dan pereaksi Fenton bertindak sebagai oksidan, nilai pH sistem perlu dikontrol secara ketat, karena nilai pH optimal larutan adalah 2,5–3,5 dengan adanya pereaksi Fe. Selain itu, ketika O3 bertindak sebagai oksidan, peralatan lebih sulit dan mahal untuk disediakan. Sementara itu, O3 relatif sulit digunakan sebagai oksidan karena kelarutannya yang buruk dalam air. Di sini, PS, sebagai oksidan yang paling efektif, karena telah banyak dilakukan penelitian yang menunjukkan beberapa keuntungan, seperti kinerja oksidasi yang kuat, adaptasi nilai pH yang luas, kelarutan dalam air dan biaya yang lebih rendah. Oleh karena itu, PS, sebagai salah satu jenis proses oksidasi lanjut berbasis radikal sulfat (Sulfate Radicals-based Advanced Oxidation Process / SR-AOPs), telah menarik banyak perhatian dalam mengadsorpsi kontaminan organic (Wang, 2019).
Dengan jarak ikatan relatif tinggi dan energi ikatan O-O (SO4-SO4) terdeteksi menjadi 1,497 Å dan 140 kJ/mol, PS sendiri menunjukkan potensi oksidasi yang rendah untuk mengadsorpsi kontaminan organik sehingga perlu diaktivasi. PS dapat diaktivasi dengan bantuan berbagai aktivator termasuk panas, ultraviolet, alkali dan menggunakan katalis. Namun, pemanfaatan katalis diketahui sebagai cara yang layak dan efisien daripada aktivator lain karena metode panas, UV atau alkali mengalami beberapa kekurangan, seperti pengoperasian yang relatif sulit dan biaya perawatan yang tinggi. Bahan ferit tipe spinel magnetik dengan formula umum MFe2O4 (M = Co, Fe, Ni, Zn dan Cu, dll.) telah diterapkan sebagai katalis padatan untuk menghilangkan polutan berbahaya karena kemampuan katalisis yang luar
biasa, stabilitas yang sangat baik, dan pemisahan sesuai yang diinginkan (Wang et al., 2019).
2.3 Nanopartikel CuFe2O4
Copper ferit (CuFe2O4) merupakan ferit spinel yang unik karena
kemampuannya untuk
berubahsifatfisisyangmampumenunjukkansifattransisifase,listrik,switching,semikond uktor, sifat magnetik, dan kestabilan kimiawi ketika dikondisikan dalam keadaan yang berbeda-beda (Anandan et al., 2017). Struktur morfologi material CuFe2O4
telah dilaporkan dalam referensi sebelumnya dimana telah membuat CuFe2O4 dalam bentuk nanotube, nanorods (Huang et al., 2006), nanofibers (Ponhan and Maensiri, 2009), nanospheres (Shen et al., 2013).
Copper ferrit (CuFe2O4) juga merupakan logam oksida semikonduktor tipe-p dan digunakan sebagai baterai, perangkat elektronik, dan katalis dalam sintesis organik (E. Zhang et al., 2019). Material magnetik CuFe2O4 ini telah banyak dilakukan sintesis tanpa pemurnian lebih lanjut dan nanopartikel ini memiliki stabilitas yang tinggi pada variasi temperatur. Penelitian sebelumnya, Nasiridkktelahmembuatsintesisnanokristalincopperferitdanmenganalisaperbedaanmo rfologi untuk aplikasi fotokatalis (Nasiri et al., 2017). Yadav dkk, telah berhasil menganalisa struktur, dielektrik, sifat listrik dan sifat magnetik dari nanopartikel CuFe2O4 disintesis menggunakan metode sol gel (Yadav et al., 2017). Kemudian penelitian oleh Rani telah berhasil melakukan sintesis superparamagnetik nanopartikel CuFe2O4 dengan metode co-presipitasi (Rani et al., 2018).
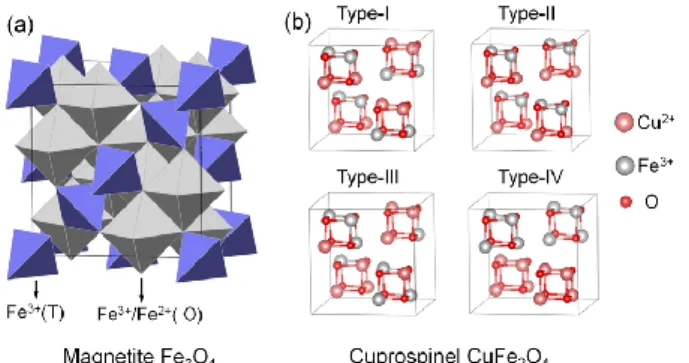
Gambar 2.2. (a) Struktur spinel Fe3O4, (b) Skema untuk konfigurasi yang berbeda dari atom Cu pada sisi oktahedral: tipe I, II, III, dan IV.
Baru-baru ini, aplikasi spinel ferrit dengan formula MFe2O4 (M = Cu, Zn, Co,
Mn, dan sebagainya) digunakan sebagai katalis heterogen untuk pengaktivasian PS dalam mengurangi limbah cair farmasi (H. Zhang et al., 2020). Nanopartikel Copper ferrite (CuFe2O4) terdiri dari ion oksigen (O2–) yang menempati struktur kubik, kation Fe3+ yang menempati setengah dari lubang oktahedral, dan ion Cu2+ adalah kation divalen yang menempati delapan lubang tetrahedral. Nanopartikel CuFe2O4
memiliki sifat magnetik yang baik, struktur kristalin yang stabil, kelarutan yang rendah, dan luas permukaan spesifik yang tinggi (Calvo-De La Rosa and Segarra, 2019). Berbagai metode eksperimental telah digunakan untuk preparasi nanopartikel CuFe2O4 seperti metode hydrothermal, sol–gel, co-precipitation, dan microwave sintering. Di antara metode sintetis ini, metode hydrothermal mempunyai beberapa keunggulan seperti menggunakan suhu rendah, metodenya sederhana dan murah, preparasi tidak membutuhkan waktu yang lama dan luas permukaan yang tinggi (Nakhate and Yadav, 2017).
2.4 Metode Hydrothermal
Hydrothermalterbentuk dari kata hidro yang berarti air dan thermal yang berarti panas.Jadi,metode hydrothermaladalah metode yang menggunakan air dan panas yang sifatnya mengubah larutan menjadi kristal. Metode hydrothermalharus dilakukan pada sistem tertutup untuk mencegah hilangnya pelarut saat dipanaskan diatas titik didihnya. Metode hydrothermal dapat menghasilkan kristalinitas dan kemurnian yang lebih tinggi.
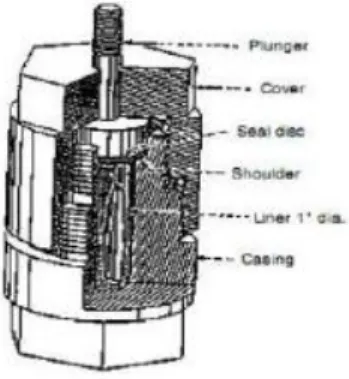
Gambar 2.3Autoclave dengan penutup flat plate
Prinsip teknik hydrothermal yaitu pemanasan reaktan dalam wadah tertutup dengan menggunakan medium air dimana sistem yang tertutup ini memungkinkan tekanan dan suhu yang meningkat dengan cepat. Sintesis hydrothermal secara umum
dapat diartikan sebagai sintesis kristal atau pertumbuhan kristal pada temparatur dan tekanan tinggi. Sintesis hydrothermal dilakukan pada suhu dibawah 300°C. Sehingga memperoleh hasil kemurnian dan kristalinitas yang tinggi dengan hanya memanfaatkan mineral alam Indonesia yang berkualitas rendah sebagai bahan utama dalam metode hydrothermal. Kelebihan dari teknik sintesis hydrothermal diantaranya adalah :
1. Terbentuk serbuk secara langsung dari larutan, karena sudah dikalsinasi pada suhu tinggi (1100˚C) selama 10 jam sehingga terjadinya serbuk dalam larutan secara langsung.
2. Ukuran partikel dan bentuknya dapat dikontrol dengan menggunakan material awal dan kondisi hydrothermal yang berbeda.
3. Kereaktifan bubuk yang dihasilkan tinggi, ini disebabkan oleh penggunaan suhu yang sangat tinggi.
4. Pada kondisi super-heated water, oksida logam yang tidak larut dalam air dapat menjadi larut. Atau bila temperatur dan tekanan tersebut belum mampu, maka dapat ditambahkan garam alkali atau logam yang anionnnya dapat membentu kompleks dengan padatan sehingga padatan menjadi larut.
2.5 Sifat-Sifat Magnet
Fenomena magnet dimana material kekuatan yang menarik atau pengaruh padabahan lain telah dikenal selama ribuan tahun. Namun, prinsip-prinsip yangmendasari dan mekanisme yang menjelaskan fenomena magnet yang kompleksdan halus. Banyak perangkat teknologi modern kita bergantung pada daya tarikdan bahan magnetik, ini termasuk pembangkit listrik tenaga dan transformer,motor listrik, radio, televisi, telepon, komputer dan komponen suara dan videosistem reproduksi(William D. Callister, 2007).Sifat-sifat yang terdapat dalam benda magnetik antaralain adalah :
a) Induksi remanen (Br)
Induksi magnetik yang tertinggal dalam sirkuit magnetik (besi lunak) setelah memindahkan/menghilangkan pengaruh bidang magnetik. Ketika arus dialirkan pada sebuah kumparan yang melilit besi lunak maka terjadi
orientasi pada partikel-partikel yang ada dalam besi. Orientasi ini mengubah/mengarahkan pada kutub utara dan selatan.
b) Permeabilitas magnet (μ)
Daya hantar atau permeabilitas magnet (diberi lambang μ) merupakan parameter bahan yang menentukan besarnya fluks magnetik. Bahan feromagnetik memiliki permeabilitas yang tinggi.
μ = µo x µr (2.1)
dimana μo = 1,256 G.cm/A
Untuk bahan ferromagnetik, permeabilitas relatif μr jenis bahan tersebut lebih besar daripada 1. Permeabilitas dari beberapa media yang hendak diukur pada prinsipnya adalah dengan menempatkannya dalam suatu kawat yang lurus dan panjang atau dalam gulungan yang melingkar atau solenoida, kemudian diukur resultante induksi kemagnetannya, sehingga diperoleh sebuah tetapan baru μ dan diturunkan menjadi suseptibilitas relatif. Dengan nilai suseptibilitas inilah maka akan dapat diketahui jenis bahan magnet.
(2.2)
m= untuk 1 vakum
> 1 untuk bahan paramagnetik
< 1 untuk bahan diamagnetik
>> 1 untuk bahan ferromagnetik c) Gaya koersif (Hc)
Medan daya yang diperlukan untuk menghilangkan induksi remanen setelah melalui proses induksi elektromagnetik. Pada besi lunak atau soft magnetic alloys besarnya gaya koersif yang diperlukan lebih kecil daripada magnet permanen.
d) Gaya gerak magnetis (Θ)
Gaya gerak magnetis ialah jumlah dari semua arus dalam beberapa penghantar yang dilingkupi oleh medan magnet (atau oleh garis fluks magnet)
e) Fluks magnetik (Φ)
Fluks magnetik total ialah jumlah dari semua garis fluks magnetik; ini berarti bahwa fluks sama besar disebelah dalam dalam dan di sebelah luar
kumparan.
f) Reluktansi magnet (Rm)
Relukstansi magnet tergantung dari panjang jejak fluks magnetik, bidang penampang lintang A yang ditembus fluks magnetik dan sifat magnet bahan, tempat medan magnet.
g) Suseptibilitas Magnetik
Suatu solenoida panjang dengan n lilitan per panjang satuan, menyalurkan arus I. Medan magnetik akibat arus dalam solenoida tersebut disebut sebagai medan yang dikerahkan, Bo. Bahan berbentuk silinder kemudian ditempatkan di dalam solenoida. Medan yang dikerahkan solenoida ini akan memagnetkan bahan tersebut sehingga bahan tersebut memiliki magnetisasi M. Medan magnet resultan B di suatu titik di dalam solenoida dan di tempat yang jauh dari ujung-ujungnya akibat arus dalam solenoida ditambah bahan yang dimagnetkan ini ialah
B = Bo + μoM (2.3)
B = μoH + μoM (2.4)
Untuk bahan paramagnetik dan feromagnetik, M mempunyai arah yang sama dengan Bo. Untuk bahan paramagnetik dan feromagnetik pemagnetan adalah berbanding lurus dengan medan magnetik yang dikerahkan untuk menghasilkan penyearahan dipol magnetik dalam bahan tersebut. Dengan demikian dapat ditulis :
(2.5)
dengan m merupakan bilangan tanpa dimensi yang disebut suseptibilitas magnetik. Persamaan 2.6 dengan demikian dapat dituliskan :
B = Bo + µoM = B(1 + m) (2.6)
Suseptibilitas magnetik adalah ukuran dasar bagaimana sifat kemagnetan suatu bahan yang merupakan sifat magnet bahan yang ditunjukkan dengan adanya respon terhadap induksi medan magnet yang merupakan rasio antara magnetisasi dengan intensitas medan magnet. Dengan mengetahui nilai suseptibilitas magnetik suatu bahan, maka dapat diketahui sifat-sifat magnetik lain dari bahan tersebut. Suseptibilitas magnetik sebagian besar material tergantung pada temperatur, tetapi beberapa material (feromagnetik
dan ferrite) tergantung pada H. Secara umum dapat ditulis sebagai berikut:
B = µo(H+M) =µoH + µom H = µo (1+m) H (2.7) dan
µr = 1 + m (2.8)
sehingga dari persamaan 2.1; 2.7 dan 2.8 didapatkan:
B = μ H (2.9)
dimana µo adalah permeabilitas ruang hampa 1,256 gauss.cm/Ampere.
Logam feromagnetik memiliki permeabilitas magnetik sangat tinggi, mineral dan batuan memiliki suseptibilitas kecil dan permeabilitas magnetik µ=1. Untuk bahan paramagnetik, m berupa bilangan positif kecil yang bergantung pada temperatur. Untuk bahan diamagnetik, m berupa konstanta negatif kecil yang tidak bergantung pada temperatur. Persamaan (2.8) dan (2.9) tidak terlalu berguna untuk bahan feromagnetik karena m bergantung pada Bo dan pada keadaan pemagnetan bahan itu sebelumnya. Untuk medan magnet, H, yang berjenis solenoida bisa diketahui dengan persamaan :
H = N x I/L (2.10)
dimana N adalah jumlah kumparan solenoida, I adalah arus yang megalir, dan L adalah panjang solenoida.
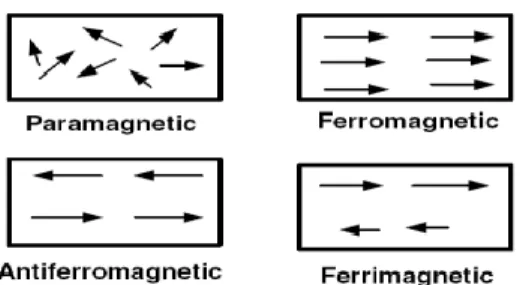
Semua bahan dapat diklasifikasikan jeniskemagnetannya menjadi lima kategori yaitu ferromagnetik, paramagnetik, diamagnetik, antiferromagnetik, dan ferrimagnetik. Semuanya dibedakan dari keteraturan arah domain pada bahan magnet tersebut (Ratih Resti, 2010).
Gambar 2.4Arah domain: (a) paramagnetik (b) ferromagnetik (c) antiferromagnetik (d) ferrimagnetik (Ratih Resti, 2010)
2.5.1 Diamagnetik
Diamagnetisme adalah bentuk magnet yang sangat lemah yang tidak tetap
dan tetap hanya sementara pada bidang eksternal sedang diterapkan. Hal ini disebabkan oleh perubahan dalam gerakan orbital elektron melewati medanmagnet.
Besarnya momen magnetik induksi sangat kecil, dan dalam arah yangberlawanan dengan medan yang diterapkan. Dengan demikian, permeabilitas μr relatif kurang dari kesatuan (namun hanya sangat sedikit) dan kerentanan magnet negatif m yang besarnya bahan diamagnetik adalah 10-5. Ketika ditempatkan di antara kutub dari elektromagnet yang kuat, bahan diamagnetik tertarik ke daerah lemah.
Diamagnetisme ditemukan di semua bahan, tetapi karena begitu lemah, dapat diamati hanya ketika jenis magnet sama sekali tidak ada (William D. Callister, 2007).
Bahan diamagnetik adalah bahan yang resultan medan magnet atomis masing-masing atom atau molekulnya nol, tetapi orbit dan spinnya tidak nol.cBahan diamagnetik tidak mempunyai momen dipol magnet permanen. Jika bahan diamagnetik diberi medan magnet luar, maka elektron-elektron dalam atom akan berubah gerakannya sedemikian hingga menghasilkan resultan medan magnet atomis yang arahnya berlawanan. (Ratih Resti, 2010)
2.5.2 Paramagnetik
Bahan paramagnetik adalah bahan yang resultan medan magnet atomis masing-masing atom/molekulnya tidak nol, tetapi resultan medan magnet atomis totalseluruh atom/molekul dalam bahan nol. Hal ini disebabkan karena Gerakan atom/molekul acak, sehingga resultan medan magnet atomis masing-masing atom saling meniadakan. Bahan ini jika diberi medan magnet luar, maka electron- elektronnya akan berusaha sedemikian rupa sehingga resultan medan magnet atomisnya searah dengan medan magnet luar. Sifat paramagnetik ditimbulkan oleh momen magnetik spin yang menjadi terarah oleh medan magnet luar. Padabahan ini, efek diamagnetik (efek timbulnya medan magnet yang melawan medan magnet penyebabnya) dapat timbul, tetapi pengaruhnya sangat kecil (Ratih Resti, 2010).
2.5.3 Ferromagnetik
Bahan ferromagnetik adalah bahan yang mempunyai resultan medan atomis besar. Hal ini terutama disebabkan oleh momen magnetik spin elektron. Pada bahan
ferromagnetik banyak spin elektron yang tidak berpasangan, misalnya pada atom besi terdapat empat buah spin elektron yang tidak berpasangan. Masing-masing spin elektron yang tidak berpasangan ini akan memberikan medan magnetik, sehingga total medan magnetik yang dihasilkan oleh suatu atom lebih besar (Ratih Resti, 2010).
Dengan sifatnya yang khas ternyata bahan feromagnetik tidak selalu ideal.
Pada beberapa contoh aplikasi untuk rangkaian magnetik seringkali kita menginginkan suatu medan magnet yang kuat dengan arus yang sekecil mungkin.
Karena arus sebanding dengan intensitas medan magnet H dan B berbanding lurus dengan μH, maka dengan pertimbangan tersebut menuntut agar bahan memiliki permeabilitas yang tinggi. Dengan permeabilitas tinggi yang dimiliki oleh bahan ferromagnetik maka didapat rapat fluks magnet B yang kuat.
2.5.4 Antiferromagnetik
Jenis ini memiliki arah domain yang berlawanan arah dan sama pada kedua arah domain magnet. Arah domain magnet tersebut berasal dari jenis atom sama pada suatu kristal. Contohnya MnO, MnS, dan FeS. Pada unsur dapat ditemui pada unsur Cromium, tipe ini memiliki arah domain yang menuju dua arah dan saling berkebalikan. Jenis ini memiliki temperature Curie yang rendah sekitar 37º C untuk menjadi paramagnetik (Ratih Resti, 2010).
2.5.5 Ferrimagnetik
Jenis tipe ini hanya dapat ditemukan pada campuran dua unsur antara paramagnetik dan ferromagnetik seperti magnet barium ferrite dimana barium adalah jenis paramagnetik dan Fe adalah jenis unsur yang masuk ferromagnetik (Astari et al., 2017). Dengan ferrimagnet magnetisasi tetap dimungkinkan karena pembatalan saat putaran tidak lengkap (William D. Callister, 2007).
2.6 Kurva Histerisis
Histerisis adalah suatu sifat yang dimiliki oleh suatu bahan dimana bahan itutidak secara spontan dapat dipengaruhi oleh gaya yang diberikan kepadanya,tetapi memberikan reaksi secara perlahan, atau bahkan bahan tersebut tidakkembali lagi ke
keadaan awalnya. Untuk bahan ferromagnetik magnetisasi bahanM tidaklah berbanding lurus dengan intensitas magnet H. Hal ini tampak darikenyataan bahwa harga suseptibilitas magnetik Km bergantung dari hargaintensitas magnet H. Bentuk umum kurva medan magnet B sebagai fungsiintensitas magnet H terlihat pada gambar 2.5 kurva B(H) seperti ini disebut kurvainduksi normal.
Gambar 2.5Kurva Induksi Normal (Ratih Resti, 2010)
Gambar 2.6Kurva Histerisis Magnetik (Ratih Resti, 2010)
Pada gambar 2.6 tampak bahwa setelah mencapai nol harga intensitasmagnet H dibuat negatif (dengan membalik arus lilitan), kurva B(H) akanmemotong sumbu pada harga Hc. Intensitas Hc inilah yang diperlukan untukmembuat rapat fluks B = 0 atau menghilangkan fluks dalam bahan. Intensitasmagnet Hc ini disebut koersivitas bahan. Bila selanjutnya harga diperbesar padaharga negatif sampai mencapai saturasi dan dikembalikan melalui nol, berbalikarah dan terus diperbesar pada harga H positif hingga saturasi kembali, makakurva B(H) akan membentuk satu lintasan tertutup yang disebut kurva histerisis.Bahan yang mempunyai koersivitas tinggi kemagnetannya tidak mudah hilang.Bahan seperti itu baik untuk membuat magnet permanen. (Ratih Resti, 2010)Domain dan histerisis :
a) Menurut suhu curie, sebuah bahan feromagnetik atau ferrimagnetik terdiri daridomains daerahvolume kecil dimana semua momen dipol saling selaras danmagnetisasi jenuh.
b) Total magnetisasi padat hanyalah jumlah vektor tepat tertimbang magnetisasidari semuadomain.
c) Total di kejenuhan, seluruh padat adalah satu domain dan magnetisasi sejajardengan arah medan.
d) Perubahan struktur domain dengan kenaikan atau pembalikan medan magnetdilakukan dengan gerakan dinding domain. baik histerisis (bidang B dibelakang lapangan H diterapkan) serta magnetisasi permanen (atau remanen)akibat dari perlawanan terhadap gerakan dinding domain tersebut.
e) Dari kurva histerisis lengkap untuk feromagnetik/ferrimagnetik berikut dapatditentukan:
- Nilai remanen dari B ketika H = 0
- Nilai koersivitas bidang H ketika B = 0 (William D. Callister, 2007).
2.7 Karakterisasi Material
Untuk mengetahui sifat-sifat dan kemampuan suatu material maka perlu dilakukan pengujian dan analisis. Beberapa jenis pengujian dan analisis yang dibahas untuk keperluan penelitian ini antara lain: XRD (struktur), FE-SEM (morfologi), FTIR (kimia), UV-Vis Spectrophotometer (optik), dan VSM (magnet).
Hasil yang diharapkan dalam penelitian ini adalah dapat menghasilkan magnet permanen dengan struktur dan morfologi CuFe2O4berukuran nano dan bersifat magnetik.
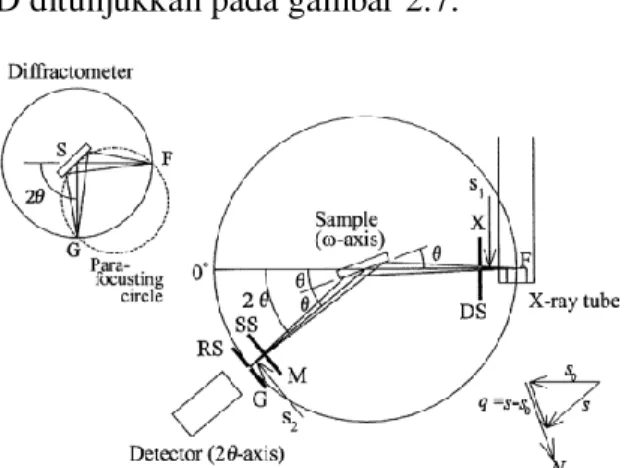
2.7.1 X-Ray Diffraction (XRD)
X-ray diffractometer (XRD) merupakan alat untuk mengidentifikasi struktur kristal dan fasa dalam suatu bahan dengan memanfaatkan radiasi gelombang elektromagnetik sinar-X. XRD dilengkapi beberapa komponen penting seperti:
tabung sinar-X, monokromator, detektor dan beberapa alat optik lain. Sinar-X dihasilkan pada suatu tabung sinar katode dengan pemanasan kawat pijar untuk menghasilkan elektron-elektron, kemudian elektron-elektron tersebut dipercepat terhadap suatu target dengan memberikan suatu voltase tertentu dan menembak target dengan elektron. Ketika elektron-elektron mempunyaienergi yang cukupuntuk
mengeluarkan elektron-elektron dalam target, spektrum karakteristik sinar-X dihasilkan.Spektrum ini terdiri atas beberapa komponen-komponen dan yang paling umum adalah Kα dan Kβ. Kαterdiri dariKα1 danKα2.Kα1 mempunyai panjang gelombang sedikit lebih pendek dari Kα2. Panjang gelombang yang spesifik merupakan karakteristik dari bahan target (Cu, Fe, Mo, Cr). Kertas perak atau kristal monokromator akan menyaring dan menghasilkan sinar-X monokromatik yang diperlukan untuk difraksi. Tembaga adalah bahan sasaran yang paling umum untuk difraksi kristal tunggal, dengan radiasi CuKα = 1,5406 Å. Saat sampel dan detektor diputar, intensitas Sinar-X pantul itu direkam. Ketika geometri dari peristiwa sinar-X tersebut memenuhi persamaan Bragg, interferensi konstruktif terjadi dan suatu puncak di dalam intensitas terjadi. Detektor akan merekam sinyal penyinaran ini dan mengkonversi sinyal itu menjadi suatu arus yang akan dikeluarkan pada layar komputer. Bagian XRD ditunjukkan pada gambar 2.7.
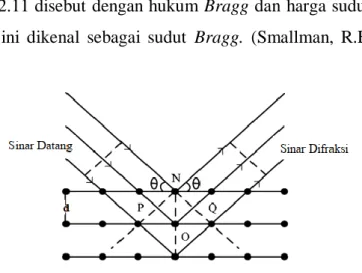
Gambar 2.7Diagram X-ray diffractometer (Waseda et al., 2011) Fenomena difraksi sudah dikenal pada ilmu optik. Standar pengujian di laboratorium fisika adalah untuk menentukan jarak antara dua gelombang dengan mengetahui panjang gelombang sinar, dengan mengukur sudut berkas sinar yang terdifraksi. Pengujian ini merupakan aplikasi langsung dari pemakaian sinar-X untuk menentukan jarak antara kristal dan jarak antara atom dalam kristal. Gambar 2.8 menunjukkan suatu berkas sinar-X dengan Panjang gelombang λ, jatuh pada sudut θ pada sekumpulan bidang atom berjarak d. Sinar yang dipantulkan dengan sudut θ hanya dapat terlihat jika berkas dari setiapbidang yang berdekatan saling menguatkan. Oleh sebab itu, jarak tambahan satu berkas dihamburkan dari setiap bidang yang berdekatan dan menempuh jarak sesuai dengan perbedan kisi, yaitu
sebesar nλ. Sebagai contoh, berkas ke dua yangditunjukkan gambar 2.8 harus menempuh jarak lebih jauh dari berkas pertama sebesar PO + OQ. Syarat pemantulan dan saling menguatkan dinyatakan oleh :
nλ = PO + OQ = 2 ON, sin θ = 2 d sin θ (2.11) Persamaan 2.11 disebut dengan hukum Bragg dan harga sudut kritis θ untuk memenuhi hukum ini dikenal sebagai sudut Bragg. (Smallman, R.E., and Bishop, 2000)
Gambar 2.8 Difraksi bidang atom (Smallman, R.E., and Bishop, 2000) Untuk mengetahui fasa dan struktur material yang diamati dapat dilakukan dengan cara membandingkan nilai d yang terukur dengan nilai d pada data standar.
Data standar dapat diperoleh melalui Joint Committee on Powder Diffraction Standards (JCPDS) atau dengan Hanawalt File.
2.7.2 Field Emission-Scanning Electron Microscope (FE-SEM)
Field Emission Scaning Electron Microscopy (FE-SEM) adalah alat yang sangat berguna untuk pencitraan permukaan beresolusi tinggi di bidang nanomaterial. Pengujian FE-SEM juga dilakukan untuk menguji penumbuhan nanopartikel pada bahan dengan menggunakan imbasan eletron mikroskop emisi medan. Cara kerja FE-SEM adalah menggunakan sinar elektron yang dipercepat dengan anoda dan difokuskan menuju sampel. Sinar elektron yang terfokus memindai keseluruhan sampel dengan diarahkan oleh koil pemindai. Ketika elektron mengenai sampel maka sampel akan mengeluarkan elektron baru yang akan diterima oleh detektor dan dikirim ke monitor. Intensitas elektron baru ini tergantung pada nomor atom unsur yang ada pada permukaan spesimen. Mikroskop elektron mampu mencapai resolusi yaitu sekitar 10-1-10-2 nm. Dengan menggunakan elektron kita juga bisa mendapatkan beberapa jenis pantulan yang berguna untuk kepentingan
karakterisasi. Jika elektron mengenai suatu benda maka akan timbul dua jenis pantulan yaitu pantulan elastis dan pantulan non elastis. Elektron dihasilkan dari katoda (electroda gun) melalui efek foto listrik dan dipercepat menuju anoda.
Filamen yang digunakan pada umumnya adalah tungsten atau Lanthanum Heksaborida (LaB6). Kumparan pemindai akan melakukan pembelokan pada elektron sehingga menjadi sekumpulan susunan berkas yang lebih kecil yang disebut pelebaran pemindai (scanning beam) dan lensa objektif (magnetik) yang akan memfokuskannya pada permukaan sampel. Tumbukan dengan atom material menyebabkan electron kehilangan energi. Sehingga mengakibatkan hamburan dan absorbsi pada daerah interaksi dengan kedalaman 100 nm hingga 2 μm. Pada FE- SEM, sinyal yang diolah merupakan hasil deteksi dari elektron yang berpindah dari permukaan sampel (Oliver et al., 1996).
2.7.3 Fourier Transform Infrared (FT-IR)
FT-IR merupakan metode yang menggunakan spektroskopi inframerah.
Pada spektroskopi inframerah, radiasi inframerah dilewatkan pada sampel.
Sebagian radiasi inframerah diserap oleh sampel dan sebagian lagi dilewatkan/ditransmisikan. Hasil dari spektrum merupakan besarnya absorpsi molekul dan transmisi yang membentuk sidik jari molekul dari suatu sampel.
Seperti sidik jari pada umumnya, struktur sidik jari dari spektrum inframerah yangdihasilkan tidak ada yang sama. Inilah yang membuat spektroskopi inframerahberguna untuk beberapa jenis analisis. Manfaat informasi/data yang dapat diketahuidari FT-IR untuk dianalisis adalah identifikasi material yang tidak diketahui,menentukan kualitas sampel dan menentukan banyaknya komponen dalam suatucampuran (Utomo, 2013).
2.7.4 Vibrating Sample Magnetometer (VSM)
Untuk mengetahui sifat magnetik dilakukan pengujian dengan menggunakan alat pengujian VSM. Pengujian VSM ini akan menghasilkan sebuah kurva histerisis.
Kurva histerisis ini akan menggambarkan bagaimana sifat magnetik yang terjadi.
Nilai sifat magnetik yang dapat diketahui dari pengujian VSM ini diantaranya, nilai dari koersivitas (Hc), saturasi magnetic (Ms), dan remanensinya (σr). Kurva
histerisis dari suatu magnet permanen memperlihatkan perbedaan yang sangat mencolok. Ketika medan magnetik dihilangkan, sebagian besar induksi dipertahankan agar menghasilkan induksi remanen, Br. Medan dengan arah yang berbeda (negatif), disebut medan koersif (-Hc), diperlukan sebelum induksi turun menjadi nol. Sama dengan kurva lengkap dari suatu magnet lunak, kurva lengkap suatu magnet permanen mempunyai simetri 180o(Kristiputra, 2015).
2.7.5 UV-Visible Spectrophotometer
UV-Visible Spectrophotometeradalah teknik analisis spektroskopik yang memakai sumber radiasi elektromagnetik ultra violet dekat (190 – 380 nm) dan sinar tampak (380 –780 nm). Sinar ultraviolet dan sinar tampak memberikan energi yang cukup untuk terjadinya transisi elektronik. Dengan demikian,spectra ultraviolet dan spectra tampak dikatakan sebagai spectra elektronik. Keadaan energi yang paling rendah disebut dengan keadaan dasar (ground state). Transisi–transisi elektronik akan meningkatkan energi molekular dari keadaan dasar ke satu atau lebih tingkat energi tereksitasi. Analisis dengan spektrofotometri UV-Vis selalu melibatkan pembacaan absorbansi radiasi elektromagnetik oleh molekul atau radiasi elektromagnetik yang diteruskan keduanya dikenal sebagai absorbansi (A) tanpa satuan dan transmitan dengan satuan (%T). Hukum Lambert Beer menyatakan bahwa “Intensitas yang diteruskan oleh larutan zat penyerap berbanding lurus dengan tebal dan konsentrasi larutan. Spectrum UV-Vis yang merupakan korelasi antara absorbansi (sebagai ordinat) dan panjang gelombang (sebagai absis) bukan merupakan garis spectrum akan tetapi merupakan suatu pita spectrum. Terbentuknya pita spectrum UV-Vis tersebut disebabkan oleh terjadinya eksitasi elektronik lebih dari satu macam pada gugus molekul yang sangat kompleks (Ibnu, 2007).
BAB 3
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian 3.1.1 Tempat Penelitian
Sintesis nanopartikel CuFe2O4 dan pengujian adsorpsi Levofloxacin menggunakan Uv-Vis Spectrophotometer dilakukan di Laboratorium NRE Research Center di Jl. Bunga Asoka, Medan. Pengujian mikrostruktur, morfologi, unsur dan sifat magnet menggunakan XRD, FE-SEM, dan VSM dilakukan di P2F LIPI (Pusat Penelitian Fisika Lembaga Ilmu Pengetahuan Indonesia), serta pengujian kandungan kimia menggunakan FTIR dilakukan di Universitas Negeri Lampung.
3.1.2 Waktu Penelitian
Penelitian ini dilakukan selama 3 bulan, dimulai tanggal 22 Juni 2020 sampai dengan tanggal 20 September 2020.
3.2 Peralatan dan Bahan 3.2.1 Alat
Peralatan yang digunakan dalam penelitian ini adalah : 1. Hotplate and Magnetic Stirrer
Berfungsi sebagai pengaduk campuran larutan agar homogen 2. Magnetic Bar
Berfungsi sebagai media pengaduk pada alat magnetic stirrer 3. Beaker Glass
Berfungsi sebagai tempat atau wadah untuk mencampur bahan-bahan yang digunakan
4. Gelas Ukur
Berfungsi untuk mengukur jumlah volume larutan yang digunakan 5. Spatula
Berfungsi untuk mengaduk bahan-bahan yang digunakan dan untuk mengambil sampel berupa serbuk
6. Neraca Digital
Berfungsi untuk menimbang massa bahan – bahan yang digunakan dan menimbang massa sampel
7. Kaca Arloji
Berfungsi sebagai tempat reagen saat ditimbang 8. Pipet Tetes
Berfungsi untuk memindahkan larutan dari satu tempat ke tempat yang lain
9. Magnet Permanen
Berfungsi untuk menahan endapan serbuk agar tidak hilang ketika sedang dibersihkan
10. Oven
Berfungsi sebagai tempat untuk melakukan hydrothermal danmengeringkan endapan serbuk
11. Autoclave
Berfungsi sebagai wadah larutan pada saat proses hydrothermal 12. Ultrasonic
Berfungsi untuk sonifikasi larutan 13. Alat Centrifuge
Berfungsi sebagai alat untuk memisahkan larutan dengan padatan (separasi) menggunakan gaya sentrifugal dengan kecepatan rotasi tertentu
14. Petridish
Berfungsi sebagai wadah saat pengeringan 15. Crussible
Berfungsi sebagai wadah saat kalsinasi 16. Pinset
Berfungsi untuk menjepit magnetic bar agar dapat diangkat dari beaker glass
17. Kertas Saring
Berfungsi untuk menyaring larutan 18. Corong
Berfungsi sebagai alat bantu untuk memindahkan dan memasukkan larutan ke wadah yang mempunyai dimensi pemasukan sampel yang bahan kecil dan untuk menyaring campuran kimia
19. Botol Vial
Berfungsi sebagai wadah sampel yang telah disintesis 20. Cuvet
Berfungsi sebagai tempat larutan LFX yang akan diadsorpsi 21. X-Ray Diffraction (XRD)
Berfungsi sebagai alat untuk menganalisa struktur dan ukuran kristal nanopartikelCuFe2O4
22. Field Emission-Scanning Electron Microscopy (FE-SEM)
Berfungsi sebagai alat untuk menganalisa morfologi partikel dari nanopartikelCuFe2O4
23. Vibrating Sample Magnetometer (VSM)
Berfungsi sebagai alat untuk menganalisa sifat magnetik serbuk CuFe2O4dalam bentuk kurva histerisis
24. Fourier Transform Infrared (FT-IR)
Berfungsi sebagai alat untuk menganalisa struktur kimia (gugus fungsi) dari nanopartikelCuFe2O4
25. UV-Vis Spectrophotometer
Berfungsi sebagai alat untuk menganalisa adsorptansi levofloxacin
3.2.2 Bahan
Peralatan yang digunakan dalam penelitian ini adalah : 1. Serbuk CuCl2.2H2O (Copper (II) Chloride Dihydrate)
Berfungsi sebagai bahan baku pembuatan nanopartikelCuFe2O4
2. Serbuk FeCl2.4H2O (Iron (II) Chloride Tetrahydrate)
Berfungsi sebagai bahan baku pembuatan nanopartikelCuFe2O4
3. Serbuk Urea (CO(NH2)2)
Berfungsi sebagai bahan baku pembuatan nanopartikel CuFe2O4
4. Larutan Bidest
Berfungsi sebagai bahan pelarut dalam mensintesis nanopartikel CuFe2O4
5. Larutan Aquadest
Berfungsi untuk membersihkan endapan yang tersisa 6. Larutan Etanol
Berfungsi untuk membersihkan endapan yang tersisa 7. Levofloxacin
Berfungsi sebagai bahan yang akan diadsorpsi 8. Serbuk Potassium Persulfate (K2S2O8)
Berfungsi sebagai bahan yang mengadsorpsi Levofloxacin
3.3 Prosedur Penelitian
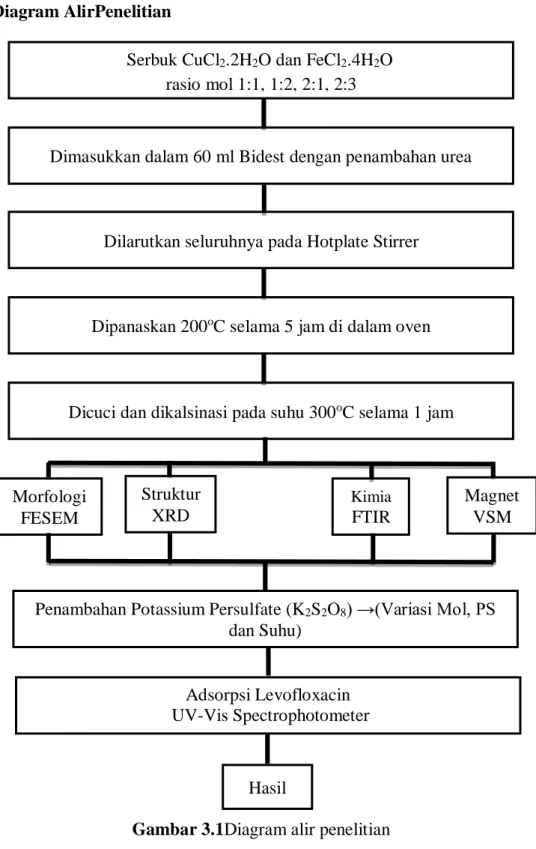
3.3.1 Sintesis nanopartikel CuFe2O4
Berbagai metode eksperimental telah digunakan untuk preparasi nanopartikel CuFe2O4 seperti metode hydrothermal, sol–gel, co-precipitation, dan microwave sintering(Nakhate and Yadav, 2017).Metode sintesis nanopartikel CuFe2O4 yang digunakan pada penelitian ini yaitu metode hydrothermal. Dengan prekursornya ialah CuCl2.2H2O dan FeCl2.4H2O. Adapun langkah-langkah untuk mensintesis nanopartikel CuFe2O4 ialah :
1. Ditimbang bahan prekursor yang digunakan pada sintesisnanopartikel CuFe2O4sesuai dengan tabel 3.1 berikut :
Tabel 3.1 Variasi Perbandingan mol prekursor CuCl2.2H2O dan FeCl2.4H2O
Perbandingan Mol
CuCl2.2H2O (g)
FeCl2.4H2O (g)
(CO(NH2)2) (g)
Rasio Molar (M)
1:1 1,023 1,193 1,441 0,1:0,1
1:2 1,023 2,386 1,441 0,1:0,2
2:1 2,046 1,193 1,441 0,2:0,1
2:3 2,046 3,579 1,441 0,2:0,3
2. Disediakan bidest 60 ml didalam beaker glass 150 ml, kemudian dilarutkan CuCl2.2H2O di dalam beaker glass tersebut menggunakan magnetic stirrer dengan kecepatan 200 rpm hingga homogen. Setelah
homogen, dimasukkan FeCl2.4H2O dan urea. Diaduk selama beberapa menit. Selanjutnya, disonifikasi selama 5 menit menggunakan Ultrasonic.
3. Diaduk kembali menggunakan magnetic stirrer dengan kecepatan 200 rpm dan suhu 100˚C sampai larutan larut seluruhnya dan berwarna lebih gelap kurang lebih 30 menit. Dimasukkan ke autoclave dan dihydrothermal dengan suhu 200˚C selama 5 jam di dalam oven.
Dimasukkan larutan ke dalam tip centrifuge untuk mendapatkan endapan lalu dicentrifuge dengan kecepatan 4000 rpm selama 5 menit.
Selanjutnya air residu dapat dibuang.
4. Dimasukkan aquadest kedalam tip centrifuge yang berisi endapan, lalu dicentrifuge dengan kecepatan 4000 rpm selama 5 menit. Selanjutnya air residu dibuang. Pada saat membuang air residu hendaklah dilakukan dengan perlahan agar endapan tidak ikut terbuang. Lakukan sebanyak 2 kali menggunakan aquadest dan 1 kali menggunakan etanol.
5. Dimasukkan endapan yang telah dicuci ke dalam petridish untuk dikeringkan menggunakan hotplate dengan suhu 100˚C selama 30 menit.
6. Digerus sampel di petridish menggunakan spatula, lalu dimasukkan ke crussible untuk dikalsinasi menggunakan oven dengan suhu 300˚C selama 1 jam.
7. Ditimbang nanopartikelCuFe2O4yang dihasilkan dan dimasukkan ke botol vial.
3.3.2 Pengujian Adsorptansi Levofloxacin Menggunakan Variasi Mol nanopartikel CuFe2O4
Pada pengujian ini digunakan larutan LFX dengan konsentrasi 10 mg/L dengan menggunakan 1 mg LFX dilarutkan dalam 100 ml aquadest. Selanjutnya nanopartikel CuFe2O4sebanyak 50 mg dan Potassium Persulfate sebanyak 0,1 gram.
Adapun langkah-langkahnya yaitu sebagai berikut:
1. Ditimbang massa LFX sebanyak 1 mg dan dilarutkan dalam 100 ml aquadest menggunakan magnetic Stirer dan disonifikasi selama 2 menit.
Lalu diaduk lagi di magnetic stirrer.
2. Ditimbang nanopartikelCuFe2O4sebanyak 50 mg, lalu dimasukkan ke
larutan LFX. Kemudian diaduk beberapa menit dan disonifikasi selama 2 menit. Lalu diaduk lagi di magnetic stirrer.
3. Diambil 5 ml larutan tersebut dan dimasukkan ke dalam tip centrifuge dan dicentrifuge selama 5 menit dengan kecepatan 4000 rpm. Hasil ini digunakan sebagai sampel 0 menit.
4. Diambil 3 ml larutan yang telah dicentrifuge dan dimasukkan ke cuvet lalu diuji ke dalam UV-Vis Spectrophotometer. Setelah terlihat puncak adsorptansi LFX setelah ditambahkan nanopartikelCuFe2O4, maka data bisa disimpan.
5. Ditimbang Potassium Persulfate sebanyak 0.1 g dan dimasukkan ke dalam larutan LFX + nanopartikelCuFe2O4. Lalu diaduk kembali selama 20 menit. Lakukan langkah pada poin 3 dan 4 agar diketahui puncak adsorptansi LFX setelah penambahan Potassium Persulfate.
6. Pengujian dilakukan selama 120 menit dengan pengambilan larutan setiap selang waktu 20 menit (dilakukan di menit ke 20 menit, 40 menit, 60 menit, 80 menit, 100 menit dan 120 menit) lalu dilanjutkan langkah pada poin 3 dan 4
7. Data disimpan dan dianalisis.
3.3.3 Pengujian Adsorptansi Levofloxacin Menggunakan Variasi Konsentrasi Pottasium Persulfate (PS)
Setelah didapat perbandingan nanopartikel CuFe2O4yang paling efektif untuk mengadsorpsi LFX, maka dilakukan pengujian adsorpsi LFX pada perbandingan nanopartikel CuFe2O4tersebut. Dimana sebelumnya digunakan konsentrasiPottasium Persulfate sebesar 1g/L. Pengujian ini bertujuan untuk membuktikan jika konsentrasi Pottasium Persulfateditambah apakah nanopartikel CuFe2O4masih mampu mengadsorpsi LFX. Variasi konsentrasiPottasium Persulfateyang digunakan yaitu 1,5 g/L (0,15 g dalam 100 ml aquadest) dan 2 g/L (0,2 g dalam 100 ml aquadest). Pada pengujian ini digunakan nanopartikel CuFe2O4sebanyak 50 mg dan LFX sebanyak 1mg. Adapun langkah-langkahnya yaitu sebagai berikut:
1. Ditimbang massa LFX sebanyak 1 mg kemudian dilarutkan dalam 100 ml aquadest menggunakan magnetic stirer dan disonifikasi selama 2
menit. Lalu distir lagi.
2. Ditimbang nanopartikelCuFe2O4sebanyak 50 mg, lalu dimasukkan ke larutan LFX. Kemudian diaduk beberapa menit dan disonifikasi selama 2 menit. Lalu distir lagi.
3. Diambil 5 ml larutan tersebut dan dimasukkan ke dalam tip centrifuge dan dicentrifuge selama 5 menit dengan kecepatan 4000 rpm. Hasil ini digunakan sebagai sampel 0 menit.
4. Diambil 3 ml larutan yang telah dicentrifuge dan dimasukkan ke cuvet lalu diuji ke dalam UV-Vis Spectrophotometer. Setelah terlihat puncak adsorptansi LFX setelah ditambahkan nanopartikelCuFe2O4, maka data bisa disimpan.
5. Ditimbang Potassium Persulfate sebanyak 0.15 gram dan dimasukkan ke dalam larutan LFX + nanopartikelCuFe2O4. Lalu diaduk kembali selama 20 menit. Lakukan langkah pada poin 3 dan 4 agar diketahui puncak absorbansi LFX setelah penambahan Potassium Persulfate.
6. Pengujian dilakukan selama 120 menit dengan pengambilan larutan setiap selang waktu 20 menit (dilakukan di menit ke 20 menit, 40 menit, 60 menit, 80 menit, 100 menit dan 120 menit) lalu dilanjutkan langkah pada poin 3 dan 4.
7. Data disimpan dan dianalisis.
8. Setelah selesai, lakukan poin 1-7 untuk variasi Potassium Persulfate sebanyak 0,2 gram.
3.3.4 Pengujian Adsorptansi Levofloxacin Menggunakan Variasi Suhu
Setelah didapat perbandingan nanopartikel CuFe2O4dan konsentrasi pottasium persulfate yang paling efektif untuk mengadsorpsi LFX, maka dilakukan pengujian adsorptansi LFX dengan variasi suhu yaitu suhu 30˚C, 35˚C dan 45˚C.
Pengujian ini bertujuan untuk mengetahui pengaruh suhu pada adsorptansi LFX.Pada pengujian ini digunakan larutan LFX dengan konsentrasi 10 mg/L dengan menggunakan 1 mg LFX dilarutkan dalam 100 ml aquadest. Selanjutnya, perbandingan mol nanopartikel CuFe2O4 yang digunakan ialah nanopartikel yang paling efektif dalam Adsorptansi LFXyaitu pada perbandingan mol 2:1.