Susadi Nario Saputra, 2013
Analisis Sekuen Poliketida Sintase Domain Ketosintase Pada Bakteri Endofit Akar Ageratum conyzoides L.
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
ANALISIS SEKUEN POLIKETIDA SINTASE DOMAIN KETOSINTASE
PADA BAKTERI ENDOFIT AKAR Ageratum conyzoides L.
SKRIPSI
Disusun untuk Memenuhi Sebagian dari Syarat
Memperoleh Gelar Sarjana Sains Program Studi Biologi
Jurusan Pendidikan Biologi
Oleh
Susadi Nario Saputra
0800664
PROGRAM STUDI BIOLOGI
JURUSAN PENDIDIKAN BIOLOGI
FAKULTAS PENDIDIKAN MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS PENDIDIKAN INDONESIA
Analisis Sekuen Poliketida Sintase
Domain ketosintase pada Bakteri
Endofit Akar Ageratum conyzoides L
Oleh
Susadi Nario Saputra
Susadi Nario Saputra, 2013
Analisis Sekuen Poliketida Sintase Domain Ketosintase Pada Bakteri Endofit Akar Ageratum conyzoides L.
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu © Susadi Nario Saputra 2013
Universitas Pendidikan Indonesia Oktober 2013
Hak Cipta dilindungi undang-undang.
SUSADI NARIO SAPUTRA
ANALISIS SEKUEN POLIKETIDA SINTASE DOMAIN KETOSINTASE
PADA BAKTERI ENDOFIT AKAR Ageratum conyzoides L
DISETUJUI DAN DISAHKAN OLEH:
Pembimbing I
Dr. Hj. Any Fitriani, M.Si. NIP. 196502021991032001
Pembimbing II
Any Aryani, M.Si. NIP. 197105302001122001
Mengetahui,
Ketua Jurusan Pendidikan Biologi FPMIPA UPI
Susadi Nario Saputra, 2013
Analisis Sekuen Poliketida Sintase Domain Ketosintase Pada Bakteri Endofit Akar Ageratum conyzoides L. Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Analisis Sekuen Poliketida Sintase Domain Ketosintase pada Bakteri Endofit Akar
Ageratum conyzoides L
Abstrak
Polyketida synthase (PKS) merupakan kelompok enzim multi kompleks yang bertanggungjawab dalam proses biosintesis berbagai macam senyawa poliketida. Poliketida sintase mempunyai beberapa modul yang terdiri atas beberapa domain dengan fungsi yang berbeda. Ketosintase (KS) merupakan salah satu domain yang diperlukan untuk proses elongasi atau pemanjangan rantai poliketida. Ketersediaan dan diversitas domain ketosintase di alam penting dalam usaha penemuan obatan – obatan baru. Telah dilakukan kloning gen ketosintase bakteri endofit akar Ageratum conyzoides L ke dalam vektor pGEMT – Easy. Gen ketosintase diperoleh dari bakteri endofit akar Ageratum conyzoides dengan metode isolasi DNA secara lansung melaui proses enrichment. Primer DKF/DKR dan HGLF/HGLR digunakan untuk mengamplifikasi domain ketosintase secara lansung dari berbagai sampel lingkungan. Amplikon diklon kedalam plasmid pGEMT – Easy dan ditransformasikan kedalam bakteri Escherichia coli DH5α. Seleksi transforman dilakukan dengan metode seleksi biru putih. Efesiensi transformasi diperoleh sebesar 6.68 X 103 CFU/µg untuk gen ketosintase heterokyst glicolipid dan 3.12 X 103 CFU/µg untuk gen ketosintase non heterokyst glicolipid. Hasil analisis filogenetik menunjukkan bahwa telah berhasil teridentifikasi domain ketosintase dari berbagai kelompok bakteri meliputi, Actinobacteria, Cyanobacteria, Proteobacteria, dan beberapa mikroorganisme yang belum teridentifikasi.
ABSTRACT
Polyketide synthase (PKS) are known to produce a class of medically and industrially include a broad range of bioactive compound such antibiotics. PKSs are multifungsional enzyme that organized into module and consist of several domain. KS domain is responsible for the condensation of an extender unit onto the growing polyketide chain during polyketide biosynthesis. The diversity of modular polyketide synthase (PKS) gene in root of Ageratum conyzoides were studied by sequencing analysis than before clone in DH5α bacteria. Primer for the amplification of PKS domain were DKF and DKR for non heterocyst glicolipid and HGLF and HGLR for heterocyst glikolipid. The eficience of transformation 6.68 X 103 CFU/µg for heterokyst glicolipid gene and 3.12 X 103 CFU/µg for heterokyst glicolipid gene. Phylogenetic analysis of 20 amino acid (AA) sequences indicates that the identified ketosynthase (KS) domains were clustered with those from diverse bacterial groups, including Cyanobacteria, Proteobacteria, Actinobacteria and some unidentified microorganisms. Phylogenetic result show DK10 DK8 and DK3 include protobacteria group, DK6 DK7 and DK9 include Cyanobacteria, DK4 DK7 include Actinobacteria group. Phylogentic analysis of heterocyst glycolipid biosynthetic ketoshynthase region with respect to diverse range of ketosynthase domain, including type I and II
v
Susadi Nario Saputra, 2013
Analisis Sekuen Poliketida Sintase Domain Ketosintase Pada Bakteri Endofit Akar Ageratum conyzoides L.
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu DAFTAR ISI
BAB II Ageratum conyzoides, MIKROBA ENDOFIT, METAGENOMIK, POLIKETIDA, KLONING DAN STUDI FILOGENETIK A. Morfologi Ageratum conyzoides L... 6
B. Manfaat dan Kandungan metabolit sekunder A. conyzoides... 7
C. Mikroba Endofit... 10
1. Mikroba endofit penghasil zat anti malaria... 11
2. Mikroba endofit yang menghasilkan metabolit sebagai antikanker... 11
3. Mikroba endofit yang menghasilkan antibiotika... 12
D. Metagenomik... 13
E. Poliketida, Poliketida Sintase dan Domain Ketosyntase... 14
F. Kloning... 16
1. Sumber DNA... 17
2. Vektor... 17
3. Plasmid... 17
4. Polymerase Chain Reaction (PCR)... 24
5. Elektroforesis hasil PCR... 24
6. Purifikasi Hasil PCR... 24
7. Kloning Gen Ketosintase... 25
8. Transformasi Hasil Kloning... 25
9. Isolasi DNA Plasmid Rekombinan... 25
10.Sekuensing Plasmid Rekombinan... 26
11.Alur Penelitian... 26
BAB IV HASIL DAN PEMBAHASAN A. Hasil Isolasi DNA Genom dan Spektrofotometer ... 28
B. Hasil Amplifikasi DNA dan Elektroforesis... 29
C. Hasil Purifikasi DNA... 30
D. Ligasi Insert Kedalam Vektor... 30
E. Transformasi... 31
F. Analisis Sekuen Domain Ketosintase... 36
BAB V KESIMPULAN DAN SARAN A. Kesimpulan... 48
B. Saran... 48
vii
LAMPIRAN
BAB I
PENDAHULUAN
A.Latar Belakang
Pemanfaatan tanaman sebagai obat sudah seumur dengan peradaban manusia.
Dari zaman nenek moyang kita dahulu tanaman sudah dipercaya sebagai gudang bahan
kimia yang memiliki manfaat sebagai obat dari berbagai macam penyakit. Berdasarkan
bukti sejarah, produk alam berupa tanaman telah menjadi basis utama penemuan obat
baru dan berbagai jenis senyawa bioaktif, peran ini tergambar keberlansungannya pada
sistem pengobatan tradisional yang saat ini masih ada pada berbagai macam
kebudayaan (Miller et al., 2012). WHO memperkirakan 80% penduduk negara
berkembang masih mengandalkan pemeliharaan kesehatan pada pengobatan tradisional,
dan 85% dari pengobatan tradisional tersebut dalam prakteknya masih melibatkan
tumbuh-tumbuhan (Suganda, 2008).
Kemampuan tanaman menyembuhkan berbagai macam penyakit disebabkan
salah satunya adanya bahan kimia (fitokimia) tertentu yang dihasilkan tanaman sebagai
bentuk adaptasi perlindungannya terhadap lingkungan (Vickrey & Vickrey, 1981).
Salah satu bentuk bahan kimia yang dihasilkan oleh tumbuhan disebut dengan
metabolit sekunder, metabolit sekunder didefenisikan sebagai senyawa dengan berat
molekul rendah yang tidak diperlukan untuk pertumbuhan dan dihasilkan sebagai
bentuk adaptasi terhadap lingkungannya (Prasetyoputri & Armosukarto, 2006).
Dalam perkembangannya, pada awalnya peneliti mengira bahwa kemampuan
menghasilkan metabolit sekunder ini murni hanya dimiliki oleh tumbuhan itu sendiri
namun dalam penelitian lebih lanjut ditemukanlah mikroba yang mampu bersimbiosis
dengan tumbuhan, baik yang hidup sebagai endofit pada jaringannya maupun yang
epifit pada permukaannya (Ikeda et al., 2010). Mikroba endofit adalah mikroba yang
hidup pada jaringan tumbuhan dan dapat membentuk koloni tanpa menyebabkan
penyakit pada tumbuhan itu sendiri (Strobel et al., 2003). Saat ini mikroba endofit
mendapat perhatian lebih dari para peneliti dikarenakan kemampuan mikroba ini
memproduksi senyawa metabolit sekunder sesuai dengan metabolit yang dihasilkan
2
Susadi Nario Saputra, 2013
Analisis Sekuen Poliketida Sintase Domain Ketosintase Pada Bakteri Endofit Akar Ageratum conyzoides L.
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
mikroba endofit sejalan dengan adanya koevolusi atau rekombinasi genetik alami yang
dilakukan inangnya sepanjang waktu evolusinya.
Berbagai senyawa metabolit sekunder yang memilki berat molekul rendah
dengan berbagai tingkatan struktur yang sangat beranekaragam telah dihasilkan oleh
bakteri endofit dan beberapa senyawa itu termasuk dalam kelompok senyawa penting
diantaranya poliketida, berbagai macam senyawa turunanan asam amino, dan terpen.
Potensi mikroba endofit menghasilkan senyawa metabolit sekunder memang cukup
potensial, hasil dari sekuensing genom Streptomycetes saja misalnya menunjukkan
bahwa kapasitas genetik mikroba ini paling tidak mampu menghasilkan lebih dari 25
senyawa metabolit sekunder yang berbeda (Curtis et al., 2005). Tentu saja mempelajari
mikroba endofit terkait kemampuannya yang bisa menghasilkan senyawa metabolit
sekunder yang sama dengan inangnya penting dilakukan terkait sifat mikroba yang
mudah dipelajari, pertumbuhannya yang cepat dan sifat genetiknya yang mudah
dinalisis atau dimanipulasi. Penggunaan mikroba endofit dalam menghasilkan senyawa
metabolit sekunder ini juga akan mengurangi ketergantungan kita dalam menghasilkan
senyawa bioaktif dengan bahan baku berupa tumbuhan herbal itu sendiri, dengan
demikian sumberdaya hayati yang berharga ini bisa dilestarikan (Radji, 2005). Tidak
hanya itu mikroba endofit ternyata juga mampu menghasilkan senyawa metabolit
sekunder yang memiliki manfaat ekologi bagi tanaman inangnya diantaranya
menghasilkan hormon pertumbuhan (Compant et al., 2005), menghasilkan senyawa
yang menyebabkan tanaman inangnya resisten terhadap berbagai serangan predator dan
patogen (Arnold, 2003); (Maynard, 2008), dan resisten terhadap kekeringan
(Kannadan, 2008).
Salah satu tanaman obat yang cukup populer dalam kajian etnobotani dan cukup
dikenal di kalangan masyarakat Indonesia adalah Ageratum conyzoides L, tanaman ini
di Indonesia diantaranya disebut dengan nama babadotan. Tumbuhannya ini tumbuh
tersebar didaerah tropis dan sudah banyak digunakan sebagai pengobatan di berbagai
belahan dunia, misalnya saja : di Afrika Tengah A.conyzoides L. digunakan sebagai
obat pneumonia. Di India species ini digunakan sebagai bakteri, fungi,
anti-disentri dan anti-lisis. Di Asia, Amerika Selatan dan Afrika, ekstrak aqueous dari
3
Menurut Pari et al., (1998) akar A. Conyzoides mengandung senyawa kimia yang
mengandung terpenoid yang terdiri dari Ageratochromene (precocene 2), dan
7-methoxy-2,2-dimethylchromene (precocene 1). Selain itu, ekstrak akar A. conyzoides L.
Juga mengandung senyawa fenolik yang terdiri dari Flavonoid :
1-(7-hydroxy-5-methoxy-2,2-dimethyl-2H-1-benzopyran-6-yl) disamping senyawa di atas akar A.
conyzoides L juga mengandung metanol dan alkaloid yang dapat menghambat pertumbuhan mikroba patogen seperti Staphylococcus aures (Desiariyanti, 2009).
Adanya senyawa metabolit sekunder yang bermanfaat secara medis yang dihasilkan A.
conyzoides L menjadi ketertarikan tersendiri untuk diteliti secara lebih lanjut khususnya dalam kaitannya dengan mikroba endofitnya.
Akan tetapi, mikroba endofit sebagai bagian dari komunitas mikroba memiliki
keanekaragaman spesies yang sangat tinggi saat ini diperkirakan mikroba yang hidup di
bumi berjumlah 4 – 6 × 1030 (Johri, 2005), dan menurut Dreyfus dan Hoffman (2006)
untuk spesies kapang saja yang hidup sebagai mikroba endofit paling tidak berjumlah
satu juta jenis. Sebagaimana kita tahu metode konvensional dalam mempelajari dan
mengetahui potensi suatu mikroba masih mengandalkan proses pengkulturan. Dengan
mengkultur mikroba dari suatu lingkungan peneliti bisa mempelajari bentuk morfologi,
struktur sel, maupun berbagai macam sifat biokimia mikroba itu sendiri. Akan tetapi
metode ini tidak cukup menjadi dasar dalam mempelajari keanekaragaman maupun
potensi suatu komunitas mikroba dilingkungan dikarenakan sedikitnya mikroba dialam
yang mampu dikulturkan. Padahal dari total mikroba yang ada dialam hanya 1% yang
mampu dikulturkan. Kegagalan ini ini disebabkan sangat beragamnya kebutuhan nutrisi
dan kondisi fisologi berbagaimacam mikroba yang ada dilingkungan (Yusuf et al.,
2002). Padahal mikroba yang belum di kulturkan bisa jadi merupakan salah satu
komunitas utama dalam suatu lingkungan (Kusharyoto 2006).
Atas dasar pemikiran itulah perlu diadakan penelitian “Analisis Sekuen
Poliketida Sintase Domain Ketosintase pada Bakteri Endofit Akar Ageratum conyzoides” dengan metode isolasi DNA secara lansung untuk melihat hubungan kekerabatan domain ini yang mempunyai potensi besar dalam penemuan obat baru
kedepannya.
4
Susadi Nario Saputra, 2013
Analisis Sekuen Poliketida Sintase Domain Ketosintase Pada Bakteri Endofit Akar Ageratum conyzoides L.
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Bagaimanakah hasil analisis sekuen poliketida sintase domain ketosintase pada
bakteri endofit akar Ageratum conyzoides L?
C.Pertanyaan Penelitian
1. Bagaimanakah efisiensi transformasi gen ketosintase yang di transformasikan pada
bakteri E.coli DH5α
2. Bagaimanakah verifikasi hasil kloning bakteri endofit akar Ageratum conyzoides
yang telah ditransformasikan kedalam bakteri E.coli DH5α?
3. Berapakah jumlah koloni hasil transforman yang positip mengandung gen
ketosintase yang sudah ditransformasikan kedalam bakteri E.coli DH5α?
4. Bagaimanakah bentuk pohon filogenetik dan hubungan kekerabatan hasil analisis
sekuen DNA gen ketosintase?
D. Batasan Masalah
1. Metode isolasi DNA yang digunakan adalah metode isolasi DNA lansung dari alam
melalui proses enrichment
2. Vektor yang digunakan dalam penelitian ini adalah plasmid pGEMT - Easy
3. Amplifikasi gen poliketida sintase dilakukan dengan menggunakan primer DKF dan
DKR serta HGLF dan HGLR
4. Bakteri yang digunakan dalam proses transformasi adalah DH5α
5. Software yang digunakan untuk membuat pohon filogenetik adalah Mega 5
E.Tujuan Penelitian
Untuk mengetahui, mengidentifikasi, menganalisis, dan membandingkan hasil
analisis sekuen poliketida sintase domain ketosintase pada bakteri endofit akar
Ageratum conyzoides L untuk kemudian dapat dijadikan acuan dalam menemukan suatu senyawa bioaktif tertentu.
5
1. Memberikan informasi dalam bidang kesehatan maupun industri dalam upaya
eksplorasi senyawa bioaktif baru khususnya poliketida yang berpotensi digunakan
sebagai antibiotik baru.
2. Mengetahui hubungan kekerabatan dan peran ekologis spesifik dari suatu gen
tertentu pada mikroba dalam suatu lingkungan.
21
Susadi Nario Saputra, 2013
Analisis Sekuen Poliketida Sintase Domain Ketosintase Pada Bakteri Endofit Akar Ageratum conyzoides L.
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu BAB III
METODE PENELITIAN
A.Jenis Penelitian
Jenis penelitian yang digunakan adalah penelitian dasar dengan metode
deskriptif (Nazir, 1983).
B.Populasi dan Sampel
Populasi dalam penelitian ini adalah populasi mikroba endofit yang terdapat
dalam akar tumbuhan Ageratum conyzoides L. sedangkan untuk sampel yang diamati
adalah DNA mikroba endofit yang positif mengandung gen poliketida sintase
khususnya domain ketosintase pada akar A.conyzoides L
C.Objek Penelitian
Objek penelitian ini adalah materi genetik (DNA) terutama domain gen
ketosintase pada mikroba endofit akar A. conyzoides L.
D.Tempat Penelitian
Penelitian ini dimulai pada bulan Maret 2012 sampai bulan Agustus 2012 yang
dilaksanakan di Laboratorium Mikrobiologi, dan Laboratorium Fisiologi Fakultas
FPMIPA Universitas Pendidikan Indonesia.
E. Alat dan Bahan
Peralatan yang digunakan dalam penelitian ini terdapat dalam laboratorium
Mikrobiologi, adapun daftar alat dan bahan yang digunakan selama penelitian ini dapat
dilihat dalam Lampiran 2 dan Lampiran 3.
F. Cara Kerja
1. Pengambilan sampel
Isolasi mikroba endofit dilakukan menurut metode F. Tomita Akar tanaman A.
22
kemudian sampel tanaman dibersihkan dari kotoran dengan cara mencucinya dengan
air mengalir. Kemudian akar tanaman dipotong-potong agar tidak terlalu panjang,
selanjutnya disterilisasi permukaan menggunakan larutan etanol 75% selama 1 menit,
bayclin 25% selama 5 menit, dan terakhir dengan etanol kembali selama 30 detik.
Setelah itu sampel dibilas dengan air steril beberapa kali. Selanjutnya, potongan tadi
direndam dalam larutan fisiologis sambil divortex untuk mengeluarkan bakteri endofit
dalam jaringan tumbuhan (Modifikasi Lumyong et al., 2001).
2. Enricment Media
Sebanyak 1 ml larutan hasil vortex diambil kemudian dimasukkan kedalam medium
LB (LB) Broth. Medium diinkubasi sambil dihomogenkan dengan shaker dengan
kecepatan 125 rpm selama 16 jam dalam suhu ruang (Modifikasi Sambrook & Russel ;
Wahyudi et al., 2010).
3. Isolasi DNA
Isolasi DNA dilakukan dengan mengambil 1.5 ml kultur hasil enrichment
dimasukkan kedalam tabung eppendorf selanjutnya disentrifugasi dengan kecepatan
7500 rpm selama 3 menit. Selanjutnya supernatan dibuang dan pellet diisolasi dengan
metode yang tersedia pada katalog “FERMENTAS DNA Purification KIT”. Pellet hasil sentrifugasi ditambahkan 200 µl larutan TE buffer lalu diresuspensikan hingga
homogen. Selanjutnya, ditambahkan 400 µl larutan lysis solution ke dalam tabung
eppendorf. Tabung tersebut kemudian diinkubasi dalam waterbath pada suhu 65°C selama 10 menit. Setelah diinkubasi, kemudian ditambahkan 600 µl kloroform ke
dalam tabung tersebut dan dihomogenkan dengan cara dibolak-balik 3-5 kali.
Sentrifugasi suspensi pada tabung tersebut pada kecepatan 10.000 rpm selama 2 menit.
Setelah sentrifugasi, fasa cair atas yang terbentuk dipindahkan pada tabung
mikrosentrifugasi yang baru dan ditambahkan 800 µl larutan presipitasi (80 µ l larutan
precipitation solution dilarutkan dengan 720 µl ddH2O steril) lalu disentrifugasi pada
kecepatan 10.000 rpm selama 2 menit. Supernatan yang terbentuk dibuang secara
hati-hati lalu ditambahkan 100 µl NaCl solution (1,2 M) pastikan pelet DNA larut.
Kemudian ditambahkan RNAse A free DNAse sebanyak 10 µl lalu diinkubasi pada
23
Susadi Nario Saputra, 2013
Analisis Sekuen Poliketida Sintase Domain Ketosintase Pada Bakteri Endofit Akar Ageratum conyzoides L.
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
kemudian disimpan pada suhu -20°C selama 1-20 jam. Sampel kemudian disentrifugasi
pada kecepatan 12.000 rpm selama 5 menit. Supernatan pada lapisan atas dibuang
secara hati-hati sampai habis. Tutup tabung mikrosentrifugasi dibiarkan terbuka sampai
alkohol menguap dan pelet DNA mengering. Pelet DNA kemudian dilarutkan dalam 20
µl ddH2O steril dan disimpan pada suhu -20°C untuk digunakan pada proses
amplifikasi.
4. Polymerase Chain Reaction (PCR)
Proses amplifikasi KS domain non heterokits glikolipid dilakukan dengan
memasukkan 3µl DNA sampel kedalam tabung PCR yang sudah berisi 5 µl 10x Taq
Buffer, 5 µl dNTP Mix 2mM, 2.5 µl primer DKF 10 mM, 2.5 µl primer DKR 10 mM,
0.25 µl Taq Polimerase 5U dan 32.75 µl ddH2O (Fermentas, 2011). Selanjutnya
dilakukan perbanyakkan sampel DNA dengan menggunakan mesin PCR eppendorf
tube dengan kondisi : pre start pada suhu 94°C selama 5 menit, denaturasi 94°C selama 1 menit, annealing 51°C selama 1 menit, extention 720C selama 1 menit, post
PCR 720C selama 10 menit, dilakukan perbanyakkan sebanyak 35 siklus (Jing et al.,
2011).
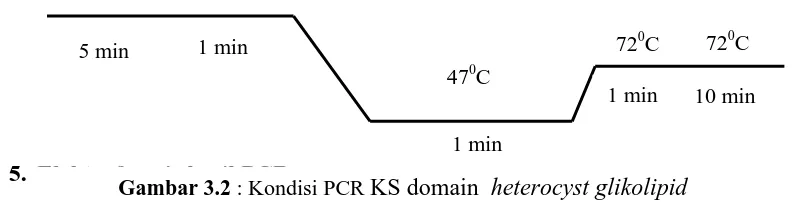
Sedangkan amplifikasi KS domain heterokits glikolipid dilakukan dengan
memasukkan 2µl DNA sampel kedalam tabung PCR yang berisi 5 µl Buffer A, 5 µl 5x
KAPA Enhancer, 0.5 µldNTP Mix 10 mM, 1.25 µl primer HGLF 10 mM, 1.25 µl
primer HGLR 10 mM, 0.2 µl Taq Polimerase 1U dan 9.8 µl ddH2O (Kapabiosystem,
2012). Selanjutnya juga dilakukan perbanyakkan dengan menggunakan mesin PCR
eppendorf tube dengan siklus : pre start pada suhu 94°C selama 5 menit, denaturasi 94°C selama 1 menit, annealing 47°C selama 1menit, extention 720C selama 1 menit,
post PCR 720C selama 10 menit, juga dilakukan perbanyakkan sebanyak 35 siklus.
940C
24
5. Elektroforesis hasil PCR
Elektroforesis dilakukan secara horizontal pada agarose 2% dengan tegangan 75
volt dan di running selama 45 menit dalam buffer TBE 1× dengan menggunakan alat
elektroforesis BIORAD.
6. Purifikasi Hasil PCR
Proses purifikasi dilakukan dengan metode sentrifugasi dimana hasil amplikon
atau potongan gel agarose yang positif mengandung gen yang diinginkan dipotong
selanjutnya dilakukanlah proses purifikasi berdasarkan protokol yang sudah tersedia
didalam katalog WIZARD DNA Purification System (Promega, USA). Dimana tabung
eppendorf dan potongan gel yang positif mengandung gen yang diinginkan ditimbang untuk mengetahui berat masing – masing, selanjutnya tambahkan membrane binding solution dengan perbandingan berat gel sama dengan volume yang ditambahkan, campuran divortex dan diinkubasi pada suhu 50 - 600 C sampai potongan gel
terlarutkan semuanya. Tabung disentrifugasi secara singkat untuk memastikan DNA
berada pada dasar tabung. Masing – masing SV minicolumb diambil dan diletakkan pada collection tube kemudian diinkubasi 1 menit pada suhu kamar untuk selanjutnya
disentrifugasi dengan kecepatan 14.000 rpm selama 1 menit, cairan yang yang terdapat
pada collection tube dibuang kemudian SV minicolumb dikembalikan pada collection
tube, kemudian tambahkan 700 µl membrane wash solution. Sentrifugasi lagi dengan kecepatan 14.000 rpm selama 1 menit, buang lagi cairan pada collection tube untuk
kemudian ditambahkan lagi 500 µl membrane wash solution. Sentrifugasi lagi SV
minicolumb dengan kecepatan 14.000 rpm selama 5 menit. Kosongkan collection tube dan sentrifugasi SV minicolumb bersama collection tube dalam keadaan kosong dengan
kecepatan 14.000 rpm selama 1 menit untuk menguapkan residu etanol. Selanjutnya SV
minicolumb dipindahkan ke tabung eppendorf yang baru untuk kemudian ditambahkan 50 µl nuclease free water, sentrifugasi 14.000 rpm selama 1 menit. Selanjutnya DNA
hasil purifikasi disimpan pada suhu - 200C..
5 min 72
0
C 720C
470C
Gambar 3.2 : Kondisi PCR KS domain heterocyst glikolipid 1 min
25
Susadi Nario Saputra, 2013
Analisis Sekuen Poliketida Sintase Domain Ketosintase Pada Bakteri Endofit Akar Ageratum conyzoides L.
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu 7. Kloning Gen Ketosintase
Gen ketosintase dikloning kedalam pGEM – T Easy vector (Promega, USA). Dimana sebanyak 11 µl ddH2O, 2 µl 2X Buffer ligasi, 1 µl vektor PGEM-T Easy, 5 µl
insert dan 1 µl enzim T4 Ligasi di masukkan kedalam tabung eppendorf steril. Setelah
itu sampel disimpan pada suhu 4oC dan diamkan bermalam. Besok paginya sampel
dipindahkan ke freezer bersuhu -20oC.
8. Transformasi Hasil Kloning
DNA yang sudah dikloning selanjutnya ditransformasikan kedalam bakteri E.coli
DH5α yang sebelumnya sudah dibuat kompetent dengan teknik CaCl2 dingin
(Sambrook & Russel 2001). Selanjutnya dilakukan seleksi biru – putih dimana sampel disebarkan diatas medium LA yang sudah ditambahkan X-gal (40µg/µl) dan Ampisilin
(100 µg/µl) kemudian di inkubasi pada suhu 370C selama 24 jam.
9. Isolasi DNA Plasmid Rekombinan
Isolasi DNA plasmid dilakukan berdasarkan metode yang tersedia dalam
Sambrook & Russel 2001. Sebanyak 1.5 kultur bakteri yang telah berumur 16 jam
dimasukkan kedalam tabung eppendorf kemudian sisentrifugasi dengan kecepatan
12.000 rpm selama 2 menit. Supernatan dibuang selanjutnya pellet diresuspensikan
dengan 100 µl solution I dingin kemudian di vortex sampai homogen. Tambahkan 200
µl solution II segar homogenkan dengan membalik tabung secara cepat. Tambahkan
150 µl solution III dingin vortex halus dan simpan tabung diatas es selama 3-5 menit.
Sentrifugasi dengan kecepatan 10000 rpm selama 5 menit pindahkan supernatan
ketabung eppendorf yang baru. Tambahkan etanol absolut 2X volume inkubasi pada
suhu ruang selama 2 menit. Sentrifugasi lagi dengan kecepatan 10000 rpm selama 5
menit buang supernatan dan keringkan tabung, tambahkan lagi 1 ml etanol 70%
kemudian keringkan diudara selama ± 10 menit. Selanjutnya resuspensikan plasmid
dengan menambahkan 20 µl ddH2O.
26
Susadi Nario Saputra, 2013
Proses sequensing dilakukan dengan mengirimkan sampel pada perusahaan
Macrogen Sequensing Order System,Macrogen Inc. Geumchen-gu Seoul, Korea. Selanjutnya hasil sequensing dianalisis berdasarkan analisis bioinformatika.
11.Alur Penelitian
Skema alur penelitian “Analisis Hasil Kloning Domain Kethosynthase pada
Mikroba Endofit Akar Ageratum conyzoides L
Isolasi DNA Mikroba Endofit Akar A.conyzoides
PCR dengan Menggunakan Primer DKF - DKR dan HGLF - HGLR
Elektroforesis Hasil PCR dengan Agarose 2 %
Purifikasi DNA
Kloning
Pembuatan Sel Kompeten
Transformasi dengan Menggunakan Metode Heat Shock
Seleksi Biru - Putih
Isolasi Plasmid Rekombinan Studi Pustaka
Pembuatan Proposal
27
Susadi Nario Saputra, 2013
Analisis Sekuen Poliketida Sintase Domain Ketosintase Pada Bakteri Endofit Akar Ageratum conyzoides L.
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan hasil penelitian diatas didapatkan kesimpulan bahwa gen ketosintase
bakteri endofit akara Ageratum conyzoides L berhasil diklon kedalam vektor pGEMT –
Easy dengan efisiensi transformasi sebesar 6.68 X 103 CFU/µg dan 3.12 X 103 CFU/µg. Selain itu hasil sekuensing dan pembuatan pohon filogenetiknya
menunjukkan bahwa gen ketosintase untuk primer degenerate nucleotida telah berhasil
mengamplifikasi ketosintase tipe I dari berbagai jenis taksa bakteri dengan kekerabatan
yang juga bervariasi, sedangkan primer heterocyst glicolipid telah berhasil
mengamplifikasi gen ketosintase tipe II dan tipe I yang digunakan sebagai pembanding
diversitas berbagai tipe ketosintase dalam suatu lingkungan.
B. Saran
Berdasarkan hasil penelitian dan kesimpulan di atas, terdapat saran untuk lebih
mengembangkan pengetahuan dan menambah informasi yang lebih banyak mengenai
penelitian yang terkait, yaitu:
1. Perlu dilakukan penelitian lebih lanjut mengenai jenis protein yang diekspresikan
oleh beberapa bakteri endofit akar Ageratum conyzoides L yang telah terdeteksi
memiliki gen domain Ketosynthase tipe I
2. Gen yang berhasil dikloning ke dalam vector pGEMT – Easy perlu diisolasi lagi
untuk kemudian dikloning kedalam vector ekpresi untuk kemudian protein hasil
ekpresi diuji apakah termasuk senyawa baru atau tidak.
3. Perlu dilakukan analisis hasil cloning yang lebih besar untuk mengetahui
keaneragaman yang sesungguhnya dari bakteri akar Ageratum conyzoides.
4. Penambahan waktu penelitian dan pengulangan untuk memastikan ke validan dan
41
Susadi Nario Saputra, 2013
Analisis Sekuen Poliketida Sintase Domain Ketosintase Pada Bakteri Endofit Akar Ageratum conyzoides L.
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu DAFTAR PUSTAKA
Arnold, F.H., (2001). “Combinatorial and Computational Challenges for Biocatalyst Design Nature” 409, : 253-258.
Baldwin, B.G., M.J. Sanderson, J.M. Porter, M.F. Wojciechowski, C.S. campbell, and M.J. Donoghue. (1995).“The ITS region of nuclear ribonsomal DNA: Avaluable source of evidence on Angiosperm phylogeny” Annual Missouri Botanic Garden 82 : 247-277.
Bills, G., A. Dombrowski, F. Pelaez, J. Polishook, and Z. An. (2002).” Recent and future discoveries of pharmacologically active metabolitis from tropical fungi”, p. 165-194. In R. Watling, J. C. Frankland, A. M. Ainsworth, S. Issac, and C. H. Robinson. (ed.), “Tropical mycology: micromycetes”, 2. CABI Publishing, New York, N.Y.
Burkill, H.M. (1985). “The Useful Plants of West Tropical Africa”. 1. Royal Botanic Gardens, Kew.
Castillo UF., GA. Strobel, EJ. Ford, WM Hess, H. Poter, JB. Jenson, H. Albert, R. Robinson, MA. Condron, DB. Teplow, D. Stevens and D. Yaver. (2002). “Munumbicins, wide spectrum antibiotics produced by Streptomyces NRRL 30562, endophytic on Kennedia nigriscans”. Microbiology 148 :2675-2685.
C.Moffitt, M and A. Neilan, B. (2003). “Evolusionary Affiliation the Superfamily of Ketosyntase Reflect Complex Pathway Assosiation” Molecular Evolution.,65: 446-457.
Chase, M.W., D.E. Soltis, and R.G. Olmstead. (1993). “Phylogenetics of seed plants: An analysis of nucleotide sequences from the plastid gene rbcL”. Annual Missouri Botanic Garden 80 :528-580.
Chelius, M. K., & Triplett, E. W. (2000). “Immunolocalization of dinitrogenase reductase produced by Klebsiella pneumoniae in association with Zea mays L”. Applied and Environmental Microbiology, 66 (2), 783-787
42
D.Hranueli, J. Cullum, (2001) “Molecular Biology of polyketide Biosynthesis” Kem. Ind. 50 381-412.
Desiarianty, R. (2009). Aktivitas Antibakteri Ekstrak Agertaum conyzoides L. Terhadap Bakteri Staphylococcus aureus Secara In Vitro. Skripsi Sarjana. UPI : tidak diterbitkan
Donadio S, Staver MJ, Mc Alpine JB, Swanson SJ, Katz L. (1991) “Modular Organisation of Gene Require for complex polyketide biosintesis”. Science 252: 675-679.
Dreyfuss, M.E., H.H. Hoffman, H. Kobel, W.Pache, and H. Tsecherter. C.Cyclosporin, (1986). “New Metabolites from Trichoderma polysporum”. Appl. Environ. Microbiol .3:125-133.
Dung, N.X. and D.T. Loi. (1991). “Selection of traditional medicines for study”.Journal of Ethnopharmacology 32: 57-70.
Ekundayo, O., S. Sharma and E.V. Rao. (1988). “Essential oil of Ageratum conyzoides”.Planta Med. 54: 55-57.
Entcheva, P., Liebl, W., Johann, A., Hartsch, T., and Streit, W.R (2001) “Direct cloning from enrichment culture, a reliable strategy for isolation of complete operons and genes from microbial aoncortia”. Appl. Environ. Micrbiol. 67: 89
Funa, N Ohnishi, Y Fuji, I Shibuya, M Ebizuka, Y Horinouchi, S (1999) “A new pathway for polyketide synthesis in microorganism” 400:798-799.
Glick, B.R. and J.J. Pasternak. 1994. Molekuler Biotechnology, Principles and applications of Recombinan DNA. ASM Press. Washinton D.C.
43
Susadi Nario Saputra, 2013
Analisis Sekuen Poliketida Sintase Domain Ketosintase Pada Bakteri Endofit Akar Ageratum conyzoides L.
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Hardiksari, F.(2009). Aktifitas Antifungi Ekstrak Tumbuhan Ageratum conyzoides L. Terhadap candida albicans Seacara In Vitro. Skripsi sarjana pada FPMIPA UPI Bandung : tidak diterbitkan.
Harrison L., C.Teplow., M. Rinaldi., and GA Strobel., (1991) “Pseudomycins, a family of novel peptides from Pseudomonas Syringae, possessing broad spectrum antifungal activity”. J.Gen.Microbiol.137 : 2857-2865.
Hill, D.M., Moritz, C. and Mable, B.K (1996). Molecular Systematic 2 and Edition. Massachussetts, USA: Sinauer Assosiaciates Insc
Hongsachum, B.(2008). PhytochemiStry and bioassay fornatural weed control compounds from Ageratum conyzoides L.Thesis. KASETSART UNIVERSITY.
Horn WS., MSJ.Simmonds, RE. Schartz, and WM. Blaney. (1995). “Phomopsichalasin, a novel antimicrobial agent from an endophytic Phomopsis Spp. Tetrahedron” 14: 3969-3978.
Hui, W.H. and W.K. Lee. (1971). “Triterpenoid and steroid constituents of some Lactuca and Ageratum species of Hong Kong”. Phytochemistry 10: 899-901.
Hutchinson, C (1999) “Polyketide and non-ribosomal peptide synthases”: Falling together by coming apart. 100:3010–3012
Ikeda,s.Okubo,T.Anda,M. Nakashita, H. (2010) “Community- and Genome-Based Views of Plant-Associated Bacteria: Plant–Bacterial Interactions in Soybean and Rice”, Plant Cell Physiol. 51 (9): 1398–1410
44
Johnson, M.F. (1971). “A monograph of the genus Ageratum L”. (Compositae, Eupatorieae). Ann. Missouri Bot. Gard. 58: 6-88. Diambil dari L.C. Ming. 1999. A Tropical Source of Medicinal and Agricultural Products. In J. Janick, ed. Perspectives on New Crops and New Uses. ASHS Press, Alexandria.
Johri, B.M.(2005) “Microbial Diversty”. Current Science 89:3-4
Kissmann, G. and D. Groth. (1993). “Plantas infestantes e nocivas. Sau Paulo, Basf Brasileira”. Cited A.L. Okunade. 2002. Review: Ageratum conyzoides L. (Asteraceae). Fitoterapia 73: 1-16.
Kostla, C. Gokhale, S Rajesh. R. Jacobsen, J. E. Cane, D. (1999). “Tolerance and Specificity of Polyketide Synthetase”. Biochem. 68:219-253.
Kusharyoto, W. (2006). “Metagenomik, lebih besar dari sekedar pencarian biokatalis dan antibiotik baru”. Biotrend. 68:16-18.
Li JY., JK. Harper, DM. Grant, BO. Tombe, B. Basyal, WM. Hess, and GA.Srobel. “Ambuic acid, a highly functionalized cyclohexenone with antifungal activity from Pestalotiopsis spp. And Monochaetia spp”. Pytochemistry 56:463-468.
Lu H., WX. Zou, JC. Meng, J. Hu, and RX Tan. (2000). “New Bioactive metabolites produced by Colletotrichum sp., an endophytic fungus in Artemisia annua”. Plant Sci.151: 76-73.
Miller,Kristin.,Qing,Chin.,Man-Yuen-Sze,Daniel.,A-Neilan,Brett.,’Investigation of the Biosynthetic Potential of Endophytesin Traditional Chinese Anticancer Herbs”,PLoSONE 7(5):1-12
Moritz, C. And D.M. hilis. (1996). Molecular systematics: Context and controversies. In Hilis, D.M., C. Moritz, B.K. Mable. (Eds.). Molecular Systematics, 2nd edition, Sinauer Associate, Sunderland, MA, USA. P. 1-13.
45
Susadi Nario Saputra, 2013
Analisis Sekuen Poliketida Sintase Domain Ketosintase Pada Bakteri Endofit Akar Ageratum conyzoides L.
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Pari, K., P.J. Rao, B. Subrahmanyam, J.N. Rasthogi and C. Devakumar. Benzofuran and other constituents of the essential oil of Ageratum conyzoides. 1998.Phytochemistry 49(5): 1385-1388.
P.Ridley, C, Young Lee, h and Khostla, C. (2008). “Evolution of Polyketide Sunthasein Bacteria. PNAS Ecology, 105, No. 12, p. 4595-4600.
Pelezar, M.J. dan Chan, E.C.S. (2005). Dasar-dasar Mikrobiologi 1. Jakarta: UI-Press.
Prasetyoputri, A dan Ines Atmosukarto. (2006). “Biotrend”. Mikroba Endofit Sumber Acuan Baru yang Berpotensi. Vol I, No.2, p. 13-15
Promega. (2006) Life Science Catalog. Promega Coorporation. USA: Woods Hollow Road Madison.
Radji, M. (2005). “Peranan Bioteknologi dan Mikroba Endofit Dalam Pengembangan Obat Herbal”. Majalah Ilmu Kefarmasian, Vol. II, No. 3, p. 113 – 126.
Rao, J.T. & S.S. Nigam. (1973). “Chemical investigation of ether oils recovered from Ageratum conyzoides”. Riechstoffe Aromen Koerperpflegemittel 23(7): 209-212.
Robert, U, A, Fawzyah, Y & Chasana, E. (2005). “Eksplorasi Enzim Mikroba dari Lingkungan Laut Melalui Pendekatan Metagenaomika. WPPI. Vol. 11, No. 7, p. 17-24.
Sambrook J dan Russel. (2001). “Molecular Cloning - A Laboratory Manual”. Cold Spring Harbor Laboratory Press, New York.
Schwecke T, et al,. (1995) “The biosyntesis gene clustar for polyketide immunosupresant rapamycin”. Proc natl Acad Sci USA 92:7839-7843.
46
Suganda, A. G. (2008). Standardisasi dari Hulu sampai Hilir Syarat Tegaknya Keamanan, Manfaat dan Kualitas Obat Bahan Alam. Orasi Ilmiah Profesor. ITB: Tidak diterbitkan.
Sultana, A. (2006). “Mecanistics insghts into the biosyntesis of polyketide antibiotics:. Sweeden”. Karolinka Institute.
Tan.R.X and W.X.Zou, (2001). “Endophyte : A rich source of fungtional metabolite”. Nat. Prod, Rep., 18:448-459
Topik, H & Pancoro, A. (2006). “Sistematika dan Filogenetika Molekuler” makalah kursus singkat aplikasi perangkat lunak PAUP dan Mr Bayes untuk penelitian filogenetika Molekuler. Bandung : Institut Teknologi Bandung.
Tsen et al. (2002). “Natural Plasmid transformation in Eschericia coli”. Journal of Biomedical Science 9, 246 – 252
Tu et al. (2004). “An improved system for competent cell preparation and high efficiency plasmid transformation using different Escherichia coli strain”. Electronic Journal of Biotechnology : 8 : 0717 - 3458
Vicrey,M & Vicrey. B (1981). Secondary Plant Metabolism, Maryland: University Park Press
Wong et al . (1995). “Genome organization of Ageratum yellow veon virus, a monopartite whitefly-transmited geminivirus isolated from a common weed”. Journal of general virology.76.2915-292.
47
Susadi Nario Saputra, 2013
Analisis Sekuen Poliketida Sintase Domain Ketosintase Pada Bakteri Endofit Akar Ageratum conyzoides L.
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu