MAKALAH
KALOR DAN HUKUM PERTAMA TERMODINAMIKA
Disusun sebagai salah satu tugas mata kuliah Termodinamika Dosen Pengampu : Atsnaita Yasrina, M.Sc
Disusun Oleh :
Puri Arya Puspita Fisika 13620005
Juraidah Fisika 13620010
Lathifa Hanun I. Fisika 13620020
Adik Merisa Fisika 13620022
Fitroh Merkuri W. Fisika 13620023
Dwi Aryani Fisika 13620039
Syafa’atun Zidni Fisika 13620031
KEMENTERIAN AGAMA
UNIVERSITAS ISLAM NEGERI SUNAN KALIJAGA YOGYAKARTA FAKULTAS SAINS DAN TEKNOLOGI
BAB I PENDAHULUAN
A. LATAR BELAKANG
Termodinamika adalah salah satu cabang fisika teoritik yang berkaitan dengan hukum-hukum pergerakan panas dan perubahan dari panas menjadi bentuk-bentuk energi yang lain. Istilah termodinamika diturunkan dari bahasa Yunani Therme (panas) dan dynamis (gaya). Cabang ilmu ini berdasarkan pada dua prinsip dasar yang aslinya diturunkan dari eksperimen, tetapi kini dianggap sebagai sebagai suatu pernyataan yang diterima kebenarannya dan bersifat umum, tanpa memerlukan pembuktian. Prinsip pertama hukum kekekalan energi, yang mengambil bentuk hukum kesetaraan panas dan kerja. Prinsip yang kedua menyatakan bahwa panas itu sendiri tidak dapat mengalir dari benda yang lebih dingin ke lebih panas tanpa adanya perubahan dikedua benda tersebut.
B. TUJUAN
1. Mengetahui definisi dari kalor.
BAB II PEMBAHASAN
A. KERJA DAN KALOR KERJA :
- pertukaran energi antara sistem dengan lingkungan selain dalam bentuk kalor.
- Perpindahan energi dari suatu benda ke benda lain tanpa terikat dengan perbedaan temperatur.
- “usaha yang dilakukan oleh sebuah sistem bukan hanya tergantug pada keadaan awal dan akhir, tetapi juga tergantung pada proses perantara antara keadaan awal dan keadaan akhir”
Misalkan ada sebuah piston, mula – mula gas ideal menempati ruang dengan volume V dan tekanan P. Kemudian gas mengalami pemuaian secara perlahan sehingga setiap saat terjadi kesetimbangan (proses kuasistatik).
KALOR :
- Perpindahan energi dari suatu benda ke benda lain karena adanya perbedaan temperatur.
- Kalor bukanlah suatu jenis energi, melainkan energi yang berpindah.
Jika beban di kenakan gaya ke bawah. Maka pengaduk akan berputar karena adanya tali yang terhubung dengan katrol. Ketika pengaduk berputar, pengaduk melakukan usaha alias kerja pada air. Besarnya kerja/usaha yang dilakukan oleh pengaduk pada air sebanding dengan besarnya kerja/usaha yang dilakukan oleh gaya gravitasi terhadap beban hingga beban jatuh. Ketika pengaduk melakukan kerja terhadap air, pengaduk menambahkan energi pada air. Karenanya kita bisa mengatakan bahwa kenaikan suhu air disebabkan oleh energi yang dipindahkan dari pengaduk menuju air. Semakin besar kerja yang dilakukan, semakin banyak energi yang dipindahkan. Semakin banyak energi yang dipindahkan, semakin besar kenaikan suhu air (air semakin panas).
Ketika berputar dalam air, pengaduk melakukan kerja/usaha pada air sehingga energi pengaduk dipindahkan ke air. Adanya tambahan energi dari pengaduk ini yang membuat suhu air meningkat.
Satuan kalor adalah kalori (disingkat kal). Kalori adalah jumlah kalor yang diperlukan untuk menaikan suhu 1 gram air sebesar 1 Co (Tepatnya dari 14,5 oC menjadi 15,5 oC). Jumlah kalor yang diperlukan berbeda-beda untuk suhu air yang berbeda. Untuk jumlah kalor yang sama, kenaikan suhu air sebesar 1 oC hanya terjadi antara suhu 14,5 oC sampai 15,5 oC. Satuan kalor yang sering digunakan, terutama untuk menyatakan nilai energi makanan adalah kilokalori (kkal). 1 kkal = 1000 kalori. Nama lain dari 1 kkal = 1 Kalori (huruf K besar).
B. KERJA DIABATIK
PROSES ADIABATIK :
- Proses yang muncul tanpa perpindahan panas dan massa antara sistem dengan lingkungan.
(gambar a)
Menunjukkan kerja adiabatik, pada proses ini terjadi kesetimbangan karena fluida mengalami pemuaian dengan proses kuasistatik ( pemuaian secara perlahan namun tetap terjadi kesetimbangan).
Menunjukkan aliran kalor saja (tanpa kerja). Terdapat cairan dan uap dalam suatu sistem. Dengan menggunakan bunsen dan cairan akan mengalami penguapan dan kenaikan temperatur.
(gamabar c)
Menunjukkan kerja dan kalor. Sama seperti kerja adiabatik, tetapi ini menggunakan bunsen. Sehingga terjadi kenaikan temperatur.
C. FUNGSI ENERGI INTERNAL
Fungsi energi internal atau energi dalam (U) merupakan fungsi keadaan suatu sistem. Perubahan energi dalam suatu sistem akan meningkat sebanding dengan jumlah kalor yang ditambahkan pada suatu sistem. Banyaknya fungsi koordinat termodinamik (P,V, θ ) sama dengan energi yang diperlukan untuk melakukan keadaan suatu sistem. Jadi energi internal dapat dikatakan sebagai fungsi dari dua koordinat termodinamika.
Misalnya di dalam sistem termodinamika, terdapat tiga fungsi koordinat termodinamika P, V, . Apabila diukur maka akan ada satu variable yang kehilangan kebebasannya. Jadi pengukuran hanya ditentukan oleh dua koordinat saja, sehingga yang ketiga itu ditentukan oleh persamaan keadaan. Contohnya, ketika mengukur nilai V dengan P dan θ nilainya sembarang. Maka V merupakan variable terikat, sedangkan P dan T variable bebas.
Apabila koordinat yang dipakai untuk menghitung kedua keadaan hanya berbeda infinitesimal, maka perubahan energi dalamnya adalah dU. Infinitesimal yaitu perubahan keadaan yang sangat kecil sehingga tidak boleh diukur.
Di ambil contoh kasus pada sistem hidrostatik. Dalam sistem hidrostatik, jika U dipandang sebagai fungsi θ dan V, maka:
dU=
(
∂ U∂θ
)
vdθ+
(
∂ U∂V
)
θdV (1.1)
dU=
(
∂ UD. PERUMUSAN MATEMATIS HUKUM PERTAMA TERMODINAMIKA
Untuk menyatakan atau menganalisis perubahan keadaan pada kasus perumusan matematis pada hukum pertama termodinamika dapat dilakukan dua percobaan yang berbeda, yaitu perubahan keadaan dengan proses adiabatik dan non adiabatik dengan sistem yang sama.
Proses adiabatik yaitu suatu proses perubahan energi yang terjadi tanpa adanya perpindahan kalor antara sistem dengan lingkungan. Sedangkan proses non adiabatik yaitu suatu proses perubahan energi yang memungkinkan adanya pertukaran energi antara sistem dengan lingkungan.
Hukum pertama Termodinamika mengatakan bahwa “kenaikan energi internal dari suatu sistem termodinamika sebanding dengan energi panas yang ditambahkan ke dalam sistem dikurangi dengan kerja yang dilakukan oleh sistem terhadap lingkungannya.”
dU=dQ−dW (1.2)
Dimana:
dU = energi internal
dQ = energi yang ditambahkan ke sistem dW = kerja yang dilakukan oleh sistem Q positif = energi masuk ke dalam sistem Q negatif = energi keluar dari sistem W positif = memerlukan usaha W negatif = melakukan usaha
Dalam perumusan matematis hukum pertama termodinamika mencoba menjelaskan definisi kalor sebagai energi dalam perpindahan yang ditimbulkan oleh perbedaan temperature. Pembuktian kalor adalah berhasil dibuktikan oleh Joule pada selang tahun antara 1840-1849 dengan berbagai percobaan yang dilakukannya.
E. KONSEP KALOR
Kalor merupakan perpindahan energi internal dari suau sistem ke sistem lain karena adanya perbedaan suhu, dari temperatur tinggi ke temperatur rendah. Perpindahan energi tersebut tidak dapat diketahui prosesnya, namun diketahui laju aliran Q´ yang merupakan fungsi waktu
Q=
∫
t1 t2
´
Q dt (1.3)
dapat diketahui bila t1 – t2 telah berlalau dan setah aliran berhenti.
Sistem A dalam sentuhan termal sistem B yang kedua sistem tersebut dilindungi dinding adiabat.
Untuk sistem A:
Uf−Ui=Q+W
Untuk sistem B:
Uf '
−Ui'=Q’+W ’ Dengan menjumlahkannya didapat
(Uf– Ui)–(Uf'−Ui’)=Q+Q ’+W+W ’
(
Uf+Ui')
−(Ui+Ui') merupakan energi sistem gabungan dan W+W ’ merupakan kerja yang dilakukan oleh sistem gabungan, maka Q+Q' adalah kalor yang dipindahkan oleh sistem gabuangan. Karena sistem dilindungi dinding adiabat,Q+Q'
=0
Q=−Q '
Dalam kondisi adiabat kalor yang dibuang sistem A sama dengan kalor yang diterima sistem B.
F. BENTUK DIFFERENSIAL HUKUM PERTAMA TERMODINAMIKA
Proses infinitesimal adalah suatu proses yang menyangkut peubahan infinitesimal dari koordinat termodinamik. Maka hukum pertama termodinamika dalam proses tersebut menjadi
dU=đQ+dW (1.4)
Proses infinitesimal kuasa-statik merupakan proses yang sistemnya berpindah dari keadaan setimbang awal ke keadaan serimbang berikutnya.
Untuk proses kuasa statik infinitesimal dari suatu sistem hidrostatik hukum pertama menjadi
Misal, dalam kasus sistem gabungan yang terdiri atas dua bagian hidrostatik yang dipisahkam oleh dinding diaterm nilai dQ dapat diungkapkan sebagai berikut
đQ=dU+PdV+P ' dV ’ (1.6)
dinding diaterm adalah dinding pemisah yang menyebabakan adanya interaksi dari sistem-sistem yang bersentuhan.
Ruas kanan pada persamaan (1.5) dan (1.6) dikenal dengan bentuk differensial Pfaff. Ruas kiri dalam persamaaan (1.5) dan (1.6) menggambarkan sejumlah infinitesimal kalor đQ dan transfer kalor bergantung pada lintasan maka đQ adalah differensial taksaksama dan bentuk differensial Pfaff adalah differensial taksaksama. Differensial taksaksama dapat dibuat saksama dengan mengalikannya dengan faktor integrasi. Pada umumnya bentuk differensial Pfaff yang mengandung tiga differensial tidak memperbolehkan adanya faktor integrasi, tetapi karena adanya hukum alam yang baru (hukum kedua termodinamika) maka bentuk differensial Pfaff yang menggambarkan dQ mempunyai faktor integrasi. Faktor integrasi dQ yang didapatkan untuk sistem dengan peubah bebas yang bnyaknya sekehendak merupakan fungsi sembarang dari temperatur empris saja dan sama untuk segala sistem.
G. KAPASITAS KALOR DAN PENGUKURANNYA
Suatu sistem yang menyerap kalor, tidak selalu akan mengalami perubahan temperatur. Kapasitas kalor atau kapasitas panas (biasanya dilambangkan dengan kapital C) adalah besaran terukur yang menggambarkan banyaknya kalor Q yang diperlukan untuk menaikkan suhu suatu zat (benda) dari θf ke θi sebesar jumlah tertentu. Kapasitas kalor didefinisikan sebagai:
C = ðQdθ (1.7)
Pada umumnya kapasitas panas C berubah dengan suhu θ , jadi C adalah fungsi
θ , sehingga:
Kapasitas panas merupakan kuantitas ekstensif (berbanding lurus dengan massa) agar mudah dalam pengoperasiannya, kita bagi dengan massa sehingga menjadi ‘per satuan massa’ yang berarti kuantitas spesifik. Kapasitas kalor spesifik diukur dalam J/kg.K atau kJ/kg.K.
Apabila C menyatakan kapasitas kalor dari n mol zat, maka kapasitor kalor molar atau panas jenis c ialah:
c diukur dalam J/mol.K atau kJ/mol.K. Dengan n adalah banyaknya mol, yaitu:
n=massa total
m
Dengan m adalah massa molar atau massa satu mol atom yang bergantung pada bilangan Avogadro NA sebesar 6,023 X 1023 partikel/mol. Besarnya kita dapatkan:
m ¿m NA Dengan 1 kalori = 4,1858 J.
Panas yang masuk atau keluar dari sistem adalah:
Q=
∫
memenuhi nilai konstan atau dianggap konstan.Penyerapan panas dapat melalui berbagai proses yang menyebabkan kapasitas kalor dapat bernilai positif, negatif, nol ataupun tak terhingga. Banyaknya panas yang diserap berbeda untuk proses yang berbeda. Sehingga, setiap sistem sederhana memiliki kapasitas kalornya tersendiri. Sebagai contoh, dalam hal sistem hidrostatik
hasil bagi ðQ
dθ memiliki harga tetap apabila tekanan atau volume dijaga tetap.
Kapasitas kalor pada tekanantetap cP=
(
ðQdθ
)
PKapasitas kalor pada volume tetap cV=
(
ðQdθ
)
V(1.10)
Tabel 4.2 Kapasitas kalor sistem sederhana
Sistem Kapasitas Kalor Lambang
Hidrostatik Pada tekanan tetap Pada volume tetap
CP
CV Linear Pada gaya tegang tetap
Pada panjang tetap
CI
CL Permukaan Pada tegangan permukaan tetap
Pada luas tetap Dielektrik Pada medan listrik tetap
Pada polarisasi tetap
CE
Cn Magnetik Pada medan magnetik tetap
Pada magnetisasi tetap
CH
CM
H. KAPASITAS KALOR AIR (KALORI)
Kalori merupakan satuan kalor yang didefinisikan sebagai banyaknya kalor yang diperlukan untuk menaikkan temperatur 1g air sebesar 1 derajat celcius. Namun setelah dilakukan pengukuran lebih tepat dan koreksi lebih teliti didapatkan kalor yang diperlukan untuk mengubah 1g air dari 0 ℃ menjadi 1 ℃ ternyata berbeda apabila mengubah dari 30 ℃ menjadi 31 ℃ . Sehingga lebih tepatnya, kalori didefinisikan sebagai banyaknya kalor yang diperlukan untuk menaikkan temperatur 1g air dari 14,5 ℃ menjadi 15,5 ℃ (kalori 15-derajat). Dalam mengukur jumlah kalor yang dipindahkan antara suatu sistem dengan sejumlah air hanya dibutuhkan dua pengukuran yaitu massa air dan perubahan temperatur.
yang ada hanyalah kalor spesifik air dinyatakan dalan kJ/kg.K dengan variasi temperatur berkisar antara 0 ℃ hingga 100 ℃ seperti pada gambar 4-6.
I. PERSAMAAN UNTUK SISTEM HIDROSTATIK
Rumusan matematis hukum pertama untuk sistem hidrostatik adalah:
dQ = dU + P dV (1.11)
dengan U fungsi dua perubah diantara P,V,dan ϴ,dengan memilih ϴ dan V sebagai variabel bebas maka didapatkan :
dU =
∂ U ∂V
(
∂U∂ θ
)
v dθ+¿) θ dV
sehingga:
dQ =
∂ U ∂V
¿
(
∂U∂ θ
)
v dθ+¿) θ+P¿ dV (dengan membagi dengan d θ )
karena berlaku pada segala perubahan temperatu dan volume (d θ dan dV ¿
dQ
Ketika terjadi beberapa kondisi yaitu:
a. Jika V tetap, dV=0 maka persamaan diatas berlaku:
(
dQ dθ)
v=(
∂ U ∂ θ
)
vSedangkan kapasitas kalor pada volume tetap Cv; sehingga:
Cv=( ∂U
∂ θ ¿v dengan mengingat bahwa
(
dQdθ
)
v adalah sama dengan kapasitas kalor.b. Jika P tetap maka persamaannya berubah menjadi :
(
dQ perubahan volume dengan melalui kuantitas Cp,Cv,dan β yang bisa diukur.J. ALIRAN KUASI STATIK; TANDON KALOR
sama diseluruh bagian dan perubahannya sangat lambat dapat digunakan koordinat termodinamika secara keseluruhan sistem.
Sebagai contoh yaitu jika sepotong es dengan ukuran yang biasa dilemparkan kedalam lautan, temperatur laut tidk akan turun. Dan sejumlah kalor berhingga yang mengalir selama proses ini tidak akan menimbulkan perubahan yang berarti sehingga tidak ada aliran biasa kalor keudara yang menimbulkan kenaikan temperatur udara. Lautan dan udara luar pada contoh tersebut merupakan contoh hamparan benda ideal yang disebut tandon kalor. Tandon kalor adalah benda yang massanya demikian besar sehingga benda itu bisa menyerap atau membuang jumlah kalor yang tak terbatas banyaknya tanpa menimbulkan perubahan temperatur atau perubahan koordinat termodinamika lainnya.
Suatu proses kuasi statik suatu sistem yang bersentuhan dengan suatu tandon kalor maka dipertahankan supaya dalam keadaan isotermal.ketika sederatan tandon bertemperatur ɵi hingga ɵf bersentuhan dengan sistem tekanan tetap dengan kapasitas kalor Cp sehingga yang bersetuhan itu infinitesimal.
Maka untuk aliran kuasi statik dapat dihitung dengan:
Cp = (dQ
dθ) p
Qp =
∫
θi θfCp dθ (ketika tejadi proses isobar kuasi statik)
Ketika Cp tetap maka:
Qp = Cp ( θf−θi¿ (1.12)
Dan untuk proses isovolum:
Qv =
∫
θi θfCv dθ (1.13)
Dan peninjauan serupa itu berlaku pada proses kuasi stasik lainnya.
Penghantaran kalor merupakan transpor energi antara elemen volum yang ditimbulkan oleh perbedaan temperatur antar elemen tersebut.
Sepotong bahan berbentuk lempengan dengan tebal ∆x dan luas A .Salah satu permukaannya dipertahankan pada temperatur θ dan yang lainnya dengan temperatur θ+ ∆θ.Kalor Q yang mengalir tegak lurus permukaan selama waktu τ tertentu. Rumus penghantaran kalor :
Suatu zat yang memiliki konduktivitas termal yang besar disebut penghantar termal dan zat dengan harga K kecil disebut penyekat termal. Dalam kasus ini menunjukkan bahwa K bergantung pada temperatur. Elemen volum bahan penghantar konduktivitas termalnya bisa berbeda. Jika perbedaan temperatur antar bagian zat kecil, maka harga K tetap pada seluruh zat.
L. KONDUKTIVITAS TERMAL
a. Benda yang diteliti logam (berbentuk batang)
Salah satu ujung batang di panaskan dengan dialiri arus listrik dan salah satu ujung lainnya di dinginkan dengan dialiri air. Pada permukaan batang tersekat termal dan kalor hilang melalui penyekat tersebut, kalor yang hilang dapat di hitung dengan mengurangi laju kalor yang memasuki air dari laju energi yang diberikan. Hampir semua logam , kalor yang hilang melalui permukaan batang sangat kecil jika di bandingkan dengan kalor yang mengalir.
Lempengan tipis diletakkan diantara dua balok tembaga yang salah satu ujungnya dipanaskan dengan dialiri arus listrik dan ujung yang lain didinginkan dengan dialiri air.Lempengan tipis dan balok tembaga bersentuhan termal. Laju pemberian kalor sama dengan laju pemberian kalor oleh air, berarti hanya sedikit kalor yang hilang melalui pinggirannya.
Konduktivitas termal besar merupakan penghantar kalor yang baik, sedangkan konduktivitas termal kecil merupakan penghantar kalor yang buruk. Gas pada umumnya merupakan penghantar kalo yang paling buruk. Pada tekanan di atas nilai tertentu bergantung pada sifat gas dan dimensi bejana tempat gas tersebutdan konduktivitas termalnya tidak bergantung pada tekanan.
M. KONVEKSI KALOR
Apabila kalor berpindah dengan cara gerakan partikel yang telah dipanaskan dikatakan perpindahan kalor secara konveksi. Jika perpindahannya dikarenakan perbedaan kerapatan karena perbedaan temperatur disebut konveksi alamiah. Jika gerakan fluida disebabkan oleh gaya pemaksa dari luar contohnya dari pompa atau kipas, maka disebut konveksi paksa.
Besarnya konveksi tergantung pada :
a. Luas permukaan benda yang bersinggungan dengan fluida (A).
b. Perbedaan suhu antara permukaan benda dengan fluida (ϴ).
c. Koefisien konveksi (h), yang tergantung pada : # viscositas fluida (kekentalan fluida)
# kecepatan fluida
# kapasitas panas fluida # rapat massa fluida
# bentuk permukaan kontak
Konveksi : Q = h A ϴ (1.14)
N. RADIASI TERMAL ; BENDA HITAM
Radiasi termal yaitu radiasi yang dipancarkan oleh zat padat, zat cair atau gas menurut temperaturnya. benda akan memancarkan radiasi elektromagnetik jika memiliki suhu tinggi. eksitansi radian adalah daya radiasi total yang dipancarkan per-satuan luas benda tersebut (R.)
Radiasi termal sebagian dipantulkan
(benda) Isotropik
Sebagian diteruskan
Laju pemancaran radiasi termal (isotropik) dari benda bergantung pada temperatur dan sifat permukaan benda.Fraksi ini disebut keserapan [absorbtivitas (α)]. Benda hitan adalah suatu zat ideal (sistem) yang dapat menyerap semua radiasi kalor yang mengenai benda atau sistem tersebut.
Jika suatu benda hitam ditunjukkan dengan tikalas B,maka αB =1 . Irradiansi adalah energi radian yang jatuh per-satuan waktu per-satuan luas pada permukaan dalam rongga (H). Karena temperatur benda hitam tetap, laju terserapnya energi harus sama dengan laju terpancarnya, sehingga :
(1.15) Dimana : daya radian yang diserap per-satuan luas = αB H = H,
daya radian yang dipancarkan per-satuan luas = RB sebagian diserap
(absorbsi)
Irradiansi dalam suatu rongga yang dindingnya bertemperatur θ sama dengan eksitansi radian benda hitam pada temperature yang sama.Karna itu radiasi dalam rongga disebut radiasi benda hitam. Karna H tidak bergantung pada bahan yang membentuk dindingnya, maka eksitansi radian suatu benda hitam adalah fungsi dari temperature saja.
O. HUKUM KIRCHOFF; KALOR TERADIASI
Pemancaran radiasi bukan benda hitam bergantung pada sifat permukaan dengan hukum sederhananya yang dikenal sebagai Hukum Kirchoff:
“Andaikan benda bukan benda hitam pada temperatur θ , dengan pemancaran radian R dan keserapan α , dimasukkan ke dalam rongga yang dinding dalamnya bertemperatur sama dengan irradiansi H . Jadi,
Daya radian yang diserap per satuan luas = αH , dan Daya radian yang dipancarkan per satuan luas = R . Karena benda itu dalam kesetimbangan,
R=αH
Menurut persamaan (1.15), H=RB ; sehingga
R=α RB (1.16)
Atau eksitansi radian setiap benda pada setiap temperatur sama dengan fraksi eksitasi radian benda hitam pada temperatur itu, fraksi ini sama dengan keserapan pada temperatur itu. (Zemansky dan Dittman, 1986)
Hukum Kirchhoff memiliki kesimpulan bahwa keserapan tidak bisa melebihi jumlah energi yang diserap (berdasarkan hukum kekekalan energi), sehingga tidak mungkin suatu benda memancarkan energi radiasi yang lebih besar dibandingkan benda hitam sempurna pada kesetimbangan.
R RB=α
Hubungan dengan kalor adalah mengacu pada definisi kalor sebelumya, karena pertambahan atau kehilangan energi melalui radiasi dan penyerapan hanya terjadi jika ada perbedaan temperatur antara benda dan lingkungannya sehingga terjadi pemindahan kalor. Apabila mempunyai kesamaan temperatur maka tidak ada pemindahan kalor atau tidak ada pertambahan atau pengurangan energi internal benda atau lingkungannya.
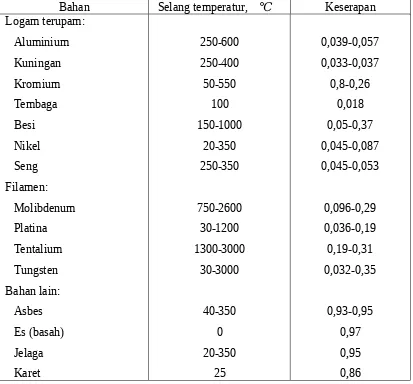
Tabel 4.3 Keserapan hampiran berbagai permukaan menurut data yang dikumpulkan oleh Hottel
Bahan Selang temperatur, ℃ Keserapan
Logam terupam:
Suhu
semakin tinggi suhu suatu benda maka radiasi yang dipancarkan juga akan samakin besar.
Luas permukaan
semakin besar luas permukaan suatu benda maka radiasi termal yang dipancarkan juga akan semakin banyak.
Sifat permukaan
Sifat permukaan sangat berpengaruh terhadap pancaran radiasi termal, permukaan benda yang kasar akan lebih banyak memancarkan radiasi termal daripada benda dengan permukaan halus atau licin.
Jenis material
Jenis material antara satu benda dengan benda lain berbeda-beda. Benda yang memiliki material yang bagus akan memancarkan radiasi termal yang lebih banyak pula.
Pada tahun 1879 Stefan mengemukakan bahwa kalor yang diradiasi berbanding lurus dengan pangkat empat dari perbedaan temperatur mutlak. Kemudian diturunkan secara termodinamis oleh Boltzman yang menyatakan bahwa pemancaran radiasi suatu benda hitam pada sembarang temperatur θ yaitu sama dengan :
RB(θ)=σ θ 4
(1.17)
BAB III PENUTUP
A. KESIMPULAN
1. Kalor adalah perpindahan energi dari satu benda ke benda lain karena adanya perbedaan temperatur
2. Hukum Pertama Termodinamika berbunyi “Kenaikan energi internal dari suatu sistem termodinamika sebanding dengan energi panas yang ditambahkan ke dalam sistem dikurangi dengan kerja yang dilakukan oleh sistem terhadap lingkungannya”
dU = dQ – dW Keterangan:
Q bernilai positif apabila energi masuk ke dalam sistem
Q bernilai negatif apabila energi keluar dari sistem
W bernilai positif apabila memerluka kerja
W bernilai negatif apabila melakukan kerja