Volume 10, No. 1, Agustus 2017
1
AKTIVITAS SITOTOKSIK EKSTRAK AIR DAN ETANOL KULIT MANGGIS
(
Garcinia mangostana
Linn.) PADA
BEBERAPA MODEL SEL KANKER
Cytotoxic activity of aqueous and ethanolic extract from mangosteen
rinds to some cancer cell lines
Sari Haryanti*, Elok Widayanti**, Yuli Widiyastuti** *
Balai Besar Penelitian dan Pengembangan Tanaman Obat dan Obat Tradisional, Badan
Penelitian dan Pengembangan Kesehatan, Kementerian Kesehatan RI
Email : sariharyanti@yahoo.com
ABSTRACT
Mangosteen (Garcinia mangostana Linn.) rinds is well recognized as “the queen of fruits”. It is used by Indonesian peoplefor cancer treatment nowadays. They usually prepared the mangosteen rinds with boiling water. Research data on the efficacy of mangosteen decoction for cancer has not been widely published. This research aimed to evaluate cytotoxic activity of mangosteen-rinds aqueous and ethanolic extract on HeLa, MCF-7, T47D, and HepG2 cancer cell line. This research also characterize the major compound of the extracts by TLC. Aqueous extract (EAM) was obtained by infusion, while ethanolic extract (EEM) by maceration method. MTT assay was done to determine viability of HeLa, MCF-7, T47D, and HepG2 cell line. The treatment of both extract against all cells caused morphological changes similar to apoptosis. The results of MTT assay revealed that EEM and EAM was effective against HepG2 with IC50of 96,1 and 87,3 μg/mL
respectively. Both had low activity against the other cell, with the IC50 137-660 μg/ml. The result of
TLC characterization of both extracts revealed terpenoid and flavonoid as the major compound. This research suggest the mangosteen rind extract as potential candidate for hepatocarcinoma treatment.
Keywords : Garcinia mangostana Linn., cytotoxicity, cancer cell, hepatocarcinoma
ABSTRAK
Kulit buah manggis (Garcinia mangostana Linn.), sering dimanfaatkan oleh masyarakat untuk mengobati kanker. Data riset mengenai efikasi rebusan kulit manggis untuk kanker belum banyak dipublikasikan. Penelitian ini bertujuan untuk mengkaji aktivitas sitotoksik ekstrak air dan etanol dengan MTT assay pada sel HeLa, MCF-7, T47D, dan HepG2, serta karakterisasi golongan kimia menggunakan KLT. Ekstrak air kulit buah manggis (EAM) diperoleh dengan metode infusa, sedangkan ekstrak etanol 96% (EEM) dengan maserasi. Pengamatan sel setelah perlakuan kedua ekstrak memperlihatkan perubahan morfologi yang mirip dengan kondisi apoptosis. Hasil MTT assay menunjukkan perlakuan EEM dan EAM efektif terhadap sel kanker hepar HepG2 dengan IC50 berturut-turut 96,1 and 87,3 μg/mL. Kedua ekstrak memiliki aktivitas
sitotoksik lemah terhadap sel HeLa, MCF-7, dan T47D dengan rentang IC50 137-660 μg/ml.
Berdasarkan karakterisasi KLT, kedua ekstrak mengandung senyawa terpenoid dan flavonoid. Berdasarkan hasil penelitian ini, ekstrak kulit manggis potensial untuk dikembangkan sebagai salah satu alternatif dalam pengobatan kanker hepar.
PENDAHULUAN
Tumbuhan merupakan bahan alam yang berpotensi sebagai sumber molekul berkhasiat terapetik dan inisiator dalam riset penemuan obat baru untuk mengatasi berbagai penyakit, terutama kanker. Kanker merupakan salah satu penyebab utama kematian di dunia. Berdasarkan estimasi WHO 2011, jumlah kematian karena kanker jauh lebih banyak dibandingkan penyakit jantung koroner dan stroke (Ferlay et al.., 2015). Pada tahap metastasis, kanker menjadi penyakit yang sangat sulit disembuhkan. Riset untuk menemukan dan mengkaji agen kemopreventif masih perlu dilakukan untuk terapi kanker yang lebih efektif, efisien, dan relatif lebih aman (Wang et al.., 2012). Beberapa senyawa dari tumbuhan berperan penting dalam terapi antikanker saat ini, seperti paklitakseldan derivatnya dari spesies Taxus, vinkristin dan vinblastin dari Catharanthus roseus (L.) G. Don, serta kamptotekin dan analognya dari Camptotheca acuminata Decne (Atanasov et al., 2015).
Manggis (Garcinia mangostana Linn) merupakan salah satu jenis buah yang tumbuh dan dibudidayakan di Asia Tenggara termasuk Indonesia, Malaysia, srilanka, Thailand, dan Filipina (Pedraza-Chaverri et al.., 2008). Manggis dikenal sebagai “queen of fruits” karena bentuk dan rasanya yang unik. Kulit manggis digunakan sejak lama sebagai obat tradisional untuk mempercepat penyembuhan luka, infeksi kulit, nyeri perut, dan disentri (Ibrahim et al.., 2016). Metabolit sekunder utama yang terdapat dalam kulit manggis adalah xanthones, dan senyawa fenolik termasuk afzelekin, epiafzelekin, katekin, epikatekin, dan epigalokatein. Senyawa tersebut memiliki aktivitas antioksidan yang sangat tinggi, sehingga banyak dimanfaatkan sebagai suplemen kesehatan (nutraceutical) (Karim dan Azlan, 2012). Walaupun termasuk buah tropis Asia, namun produk nutraceutical kulit manggis ternyata
dipatenkan pada tahun 2002 oleh Garrity AR et al dari Amerika Serikat dan sukses dipasarkan di dunia (Garrity et al.., 2009).
Xanthones terdistribusi di kulit buah, buah, kayu, dan daun manggis, dengan aktivitas farmakologi yang cukup luas yaitu antioksidan, antitumor, antiinflamasi, antibakteri, antifungal, dan antiviral. Xanthones potensial menghambat tahapan karsinogenesis tumor pada fase inisiasi, promosi, dan progresi (Shan et al.., 2011). Xanthone mempengaruhi regulasi jalur signal yang terlibat dalam induksi apoptosis dan modulasi siklus sel kanker (Li et al.., 2013). Xanthones merupakan senyawa polifenol dengan isopren trisiklik, jenis α- dan γ-mangostin terdapat melimpah di dalam kulit manggis (Gutierrez-Orozco dan Failla, 2013).
Beberapa riset mengisolasi
xanthones dari kulit manggis melalui ekstraksi dengan pelarut organik seperti toluen (Aisha et al., 2012), etanol (Fu et al.., 2013), metanol (Negi et al., 2013), aseton, heksan dan etil asetat (Li dan Xu, 2015). Metode ekstraksi tersebut memiliki beberapa kelemahan di antaranya waktu
yang cukup lama, dilakukan di
Cytotoxic activity of aqueous and ethanolic extract from mangosteen rinds to some cancer cell lines
mengalami mutasi pada gen CASP3 sehingga ekspresi protein caspase-3 menjadi jauh berkurang atau bahkan tidak terjadi ekspresi. Caspase-3 merupakan suatu protein yang berperan penting dalam eksekusi apoptosis (kematian sel secara terprogram). Gangguan signaling apoptosis mengakibatkan sel MCF-7 menjadi tidak responsif atau mengalami resistensi terhadap beberapa agen kemoterapi seperti doksorubisin, cisplatin, dan etoposid. Sedangkan sel T47D tidak mengalami mutasi pada gen penyandi caspase-3, sehingga induksi apoptosis oleh agen kemoterapi tidak mengalami gangguan (Devarajan et al., 2002). Selain uji sitotoksik, juga dilakukan uji kualitatif kandungan golongan kimia kedua ekstrak dengan kromatografi lapis tipis (KLT).
METODE PENELITIAN
Tempat dan waktu penelitian.
Penelitian dilakukan di Laboratorium Biologi Molekuler dan Laboratorium Fitokimia, Balai Besar Penelitian dan Pengembangan Tanaman Obat dan Obat Tradisional (B2P2TO-OT), Tawangmangu, Jawa Tengah.
Bahan tumbuhan dan preparasi ekstrak. Kulit manggis diperoleh dari daerah Matesih, dideterminasi dan diolah di B2P2TO-OT. Kulit dikeringkan dalam oven suhu 400C kemudian diserbuk. Ekstrak air
diperoleh dengan metoda infusa selama 10 menit kemudian diuapkan dalam oven 400C.
Ekstrak etanol diperoleh dengan maserasi menggunakan penyari etanol teknis 95% selama 3x24 jam. Uji sitotoksik dari laboratorium Biologi Molekuler B2P2TO-OT. Sel ditumbuhkan dalam media
kultur cair DMEM (Sigma) yang
mengandung fetal bovine serum (FBS) 10% (Sigma), 100 µg/ml penicillin-streptomisin (Gibco), dan diinkubasi dalam inkubator 5% CO2 suhu 370C.
Uji sitotoksik dan pengamatan morfologi sel in-vitro. Uji dilakukan dengan metode MTT [3-(4,5-dimetiltiazol-2-il)-2,5 difeniltetrazolium bromida]. Sel dengan kepadatan 8000 sel/sumuran didistribusikan ke dalam 96 well plate, diinkubasi selama 24 jam dalaminkubator CO2 5% dengan suhu 370C. Setelah 24 jam,
sel diberi perlakuan ekstrak dengan rentang konsentrasi masing-masing 25-800 µg/mL. Perlakuan ekstrak dilakukan selama 24 jam dalam inkubator inkubator CO2 5% dengan
suhu 370C.
Pengamatan morfologi sel dilakukan pada akhir perlakuan ekstrak menggunakan mikroskop inverted. Morfologi sel didokumentasikan dengan kamera Canon Ixus 145. Kemudianke dalam masing-masing sumuran ditambahkan 100 μL media kultur yang dengan MTT 5 mg/mL, kemudian diinkubasi selama 3 jam pada inkubator CO2 5% dengan suhu 370C. Sel
hidup akan bereaksi dengan MTT
membentuk kristal formazan berwarna
ungu. Kristal dilarutkan dengan
penambahan reagen stopper (SDS 10% dalam HCL 0,01N), dibiarkan di tempat gelap selama semalam, kemudian dibaca serapannya dengan ELISA reader pada panjang gelombang 595 nm. Besaran serapan berbanding lurus dengan viabilitas sel (Riss et al.., 2004).
ungu atau biru dengan pereaksi asam sulfat pekat 10% dalam metanol. Golongan alkaloid, menggunakan fase gerak etil asetat-metanol-air (100:13,5:10), plat KLT Silika gel GF 254, hasil positif jika diamati dibawah sinar UV 365 nm terdapat fluoresensi hijau/berwarna jingga dengan pereaksi Dragendorf. Golongan flavonoid, menggunakan fase gerak kloroform-etil asetat (6:4), plat KLT Silika gel GF 254, hasil positif jika diamati dibawah sinar UV 365 nm terdapat fluoresensi hijau/berwarna biru atau kuning dengan pereaksi sitroborat (Harborne, 1996).
HASIL DAN PEMBAHASAN
Kemampuan untuk terus menerus
berproliferasi melalui signal pertumbuhan secara mandiri merupakan karakteristik paling fundamental dari sel kanker.
Deregulasi signal pertumbuhan
menyebabkan sel kanker dapat terus bertahan hidup dan menginvasi jaringan normal di seluruh bagian tubuh melalui proses metastasis (Hanahan and Weinberg, 2011). Dengan demikian, strategi terapi
kanker mengarah pada penggunaan
senyawa/agen yang mampu menghambat proliferasi dan menginduksi kematian sel. Berdasarkan aktivitas dinamis seluler, kematian sel dapat dikategorikan menjadi
apoptosis, autophagy, nekrosis, mitotic catasthrope, dan senescence. Salah satu penanda dan pembeda kategori kematian sel adalah perubahan morfologi yang diikuti terjadinya perubahan fungsi biokimia (Ricci and Zong, 2006).
Cytotoxic activity of aqueous and ethanolic extract from mangosteen rinds to some cancer cell lines
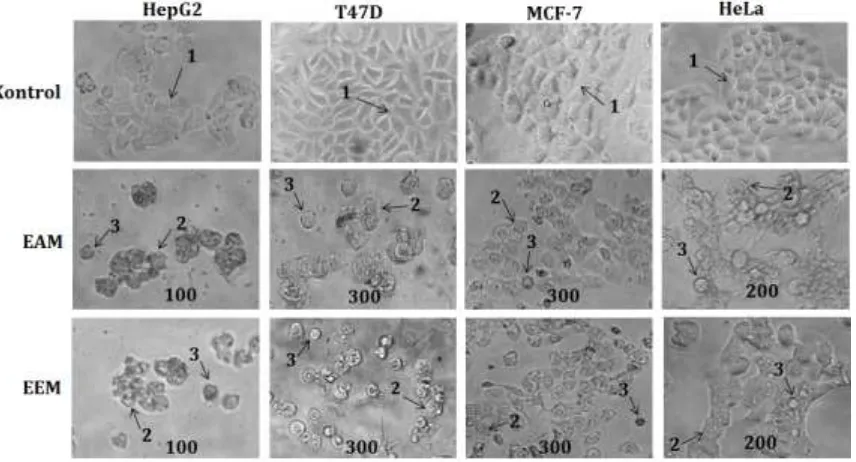
Gambar 1. Perubahan morfologi sel karena perlakuan EAM dan EEM. Sel dikultur dalam 96 well plate, kemudian diberi perlakuan EAM dan EEM konsentrasi seperti tersebut dalam cara kerja. Perubahan morfologi sel diamati di bawah mikroskop inverted perbesaran 200x. Tanda panah (1) menunjukkan sel
normal, (2) membrane blebbing, (3) cell shrinkage.
Perubahan morfologi yang terjadi pada sel dengan perlakuan EEM dan EAM merupakan penanda awal terjadinya induksi apoptosis. Penentuan dan kuantifikasi apoptosis harus dipastikan lebih lanjut, dengan metode pengecatan double stainning, Tunnel assay, maupun flow cytometry. Apoptosis merupakan salah satu bentuk kematian sel terprogram dan teratur, yang dapat terjadi dalam kondisi fisiologis maupun patologis. Deregulasi apoptosis berperan penting dalam perkembangan dan pertumbuhan kanker (karsinogenesis), sehingga agen yang mampu menginduksi apoptosis menjadi salah satu target terapi yang cukup penting dan menjanjikan (Wong, 2011). Induksi apoptosis mengakibatkan terjadinya gangguan siklus sel yang akan berlanjut pada hambatan proses proliferasi (Hassan et al.., 2014). Induksi apoptosis adalah salah satu penanda penting pada agen antitumor
dengan aktivitas sitotoksik (Safarzadeh et al.., 2014).
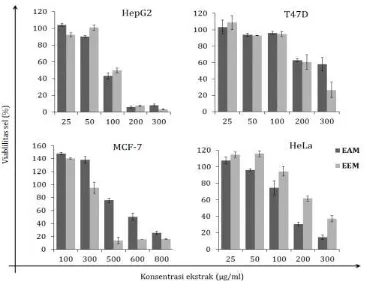
Aktivitas sitotoksik oleh EEM dan EAM dalam penelitian ini dibuktikan menggunakan MTT assay. Sel hidup dengan metabolisme aktif, akan mengkonversi MTT
(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide) menjadi
kristal formazan berwarna ungu.
Absorbansi kristal terlarut (sebanding dengan jumlah sel hidup) dapat dianalisa dengan metoda spektrofotometri. Nilai IC50
diperoleh berdasarkan kurva relasi antara % viabilitas dengan konsentrasi ekstrak (Riss et al.., 2004). Sesuai dengan hasil observasi morfologi, EEM dan EAM menunjukkan aktvitas paling poten pada sel HepG2 dengan nilai IC50 berturut-turut 96,1
Gambar 2. Penurunan viabilitas sel karena perlakuan EAM dan EEM. Viabilitas sel ditetapkan dengan metode MTT, data yang ditampilkan dalam grafik merupakan representasi rerata tiga kali ulangan + SD.
Menurut Kuete and Efferth, 2015, nilai IC50 EAM dan EEM terhadap sel HepG2
tergolong kuat, sedangkan terhadap sel kanker payudara (T47D dan MCF-7) serta serviks (HeLa) tergolong lemah dengan nilai IC50 >100 µg/ml (Kuete and Efferth, 2015).
Secara umum, EAM lebih potensial dibandingkan EEM karena nilai IC50nya lebih rendah.
Sel HepG2 merupakan cell line murni karsinoma hepatoseluler manusia tanpa infeksi virus, digunakan sebagai model in vitro dalam riset kanker hati (Costantini et al., 2013). Karsinoma hepatoseluler adalah jenis kanker hati yang paling mendominasi di berbagai negara dan
penyebab kematian terkait kanker di urutan ketiga di region Asia-Pasifik. Pengembangan terapi karsinoma hepatoseluler masih sangat diperlukan untuk mencapai hasil pengobatan yang efektif dan efisien (Zhu et al.., 2016).
Perbedaan aktivitas tersebut terkait
dengan komponen senyawa yang
Cytotoxic activity of aqueous and ethanolic extract from mangosteen rinds to some cancer cell lines
Gambar 3. Profil KLT EEM dan EAM. Eluen yang digunakan metanol-etil asetat (97:3).
Karakterisasi golongan kimia kedua ekstrak dengan KLT juga menunjukkan adanya kesamaan jenis, namun kuantitas
EEM lebih besar. Kedua ekstrak
mengandung senyawa terpenoid dan flavonoid (Tabel 1.). Sesuai dengan hasil penelitian ini, Manasathien and Khanema,
2015, melaporkan jumlah fenolik total dari ekstrak etanol 70% kulit manggis lebih besar hingga dua kali lipat jika
dibandingkan ekstrak air dengan
menggunakan metode Folin-Ciocalteu
(Manasathien and Khanema, 2015).
Tabel 1. Karakterisasi kandungan senyawa EEM dan EAM dengan kromatografi lapis tipis No Golongan
senyawa
Eluen Penampak
bercak
Spot di UV 366 nm
Hasil
EAM EEM
1. Terpenoid Heksan-etil asetat (1:1)
Asam sulfat 10%
Biru kehijauan
+ Rf 0,40
+ + Rf 0,42 2. Flavonoid Kloroform-etil
asetat (6:4)
Sitroborat Hijau +
Rf 0,92
++ Rf 0,94 3. Alkaloid Etil
asetat-metanol-air (100:13,5:10)
Dragendorf - - -
Mangostin merupakan kandungan utama dalam kulit buah manggis. Mangostin dan turunannya tergolong dalam senyawa xanton, suatu pigmen fenol berwarna kuning. Reaksi warna dan profil kromatografi xanton mirip dengan flavonoid. Xanton memiliki efek biologis yang cukup luas, di antaranya antioksidan,
antiinflamasi, antihipertensi,
immunomodulator, dan antikanker (Putri, 2015).
Akao et al., 2008, melaporkan aktivitas antikanker xanton pada sel hepatokarsinoma melalui mekanisme antioksidan, induksi apoptosis, dan induksi
enzim fase II. Dengan demikian, ekstrak kulit buah manggis berpotensi untuk dikembangkan lebih lanjut sebagai agen alternatif dalam pengobatan antikanker, terutama hepatokarsinoma.
KESIMPULAN
sebagai pengembangan alternatif pengobatan antikanker
UCAPAN TERIMA KASIH
Penulis mengucapkan terimakasih kepada pimpinan Balai Besar Penelitian dan Pengembangan Tanaman Obat dan Obat Tradisional yang telah memberikan kesempatan, sarana, dan prasarana sehingga penelitian ini dapat terlaksana.
DAFTAR PUSTAKA
Aisha, A.F.A., Abu-Salah, K.M., Ismail, Z., dan Majid, A.M.S.A., 2012. In vitro and in vivo anti-colon cancer effects of Garcinia mangostana xanthones extract. BMC Complementary and Alternative Medicine, 12: 104.
Akao, Y., Nakagawa, Y., Iinuma, M., dan
Nozawa, Y., 2008. Anti-Cancer
Effects
of
Xanthones
from
Pericarps
of
Mangosteen.
International Journal of Molecular
Sciences
,
9
: 355
–
370.
Atanasov, A.G., Waltenberger, B., Pferschy-Wenzig, E.-M., Linder, T., Wawrosch, C., Uhrin, P.et al., 2015. Discovery and resupply of pharmacologically active plant-derived natural products: A review. Biotechnology Advances, 33: 1582–1614.
cancer: a possible mechanism for
chemoresistance.
Oncogene,
21(57): 8843-8851.
Ferlay, J., Soerjomataram, I., Dikshit, R., Eser, S., Mathers, C., Rebelo, M., dkk., 2015. Cancer incidence and
mortality worldwide: Sources, methods and major patterns in GLOBOCAN 2012: Globocan 2012. International Journal of Cancer, 136: E359–E386.
Fu, M., Qiu, S.X., Xu, Y., Wu, J., Chen, Y., Yu, Y.,et al.., 2013. A new xanthone from the pericarp of e. Natural Product Communications, 8: 1733–1734. Garrity, A.R., Morton, G.A.R., dan Morton, J.C.,
2009. 'Nutraceutical Mangosteen Composition'. US20090062378 A1. Gutierrez-Orozco, F. dan Failla, M.L., 2013.
Biological Activities and
Bioavailability of Mangosteen Xanthones: A Critical Review of the Current Evidence. Nutrients, 5: 3163–3183.
Hanahan, D. dan Weinberg, R.A., 2011. Hallmarks of cancer: the next generation. Cell, 144: 646–674.
Harborne, J., 1996.
Metode Fitokimia:
Penuntun
Cara
Modern
Menganalisis Tumbuhan
. Cetakan
kedua.
Penerjemah:
Padmawinata, K. dan I. Soediro.
Bandung: Penerbit ITB
Hassan, M., Watari, H., AbuAlmaaty, A., Ohba, Y., dan Sakuragi, N., 2014. Apoptosis and Molecular Targeting Therapy in Cancer. BioMed Research International, 2014: e150845. Ibrahim, M.Y., Hashim, N.M., Mariod, A.A.,
Mohan, S., Abdulla, M.A.,
Abdelwahab, S.I., et al., 2016. α
-Mangostin from Garcinia
mangostana Linn: An updated review of its pharmacological properties. Arabian Journal of Chemistry, 9: 317–329.
Karim, A.A. dan Azlan, A., 2012. Fruit Pod
Extracts as a Source of
Nutraceuticals and Pharmaceuticals. Molecules, 17: 11931–11946.
Kuete, V. dan Efferth, T., 2015. African Flora Has the Potential to Fight Multidrug Resistance of Cancer. BioMed Research International, 2015: e914813.
Cytotoxic activity of aqueous and ethanolic extract from mangosteen rinds to some cancer cell lines
breast and prostate cancer. Frontiers in Pharmacology, 4: 1-4.
Li, W.Q. dan Xu, J.G., 2015. Profile of DNA Damage Protective Effect and Antioxidant Activity of Different Solvent Extracts from the Pericarp of Garcinia mangostana, Journal of Food and Nutrition Sciences, 3: 1–6. Manasathien, J. dan Khanema, P., 2015.
Antioxidant and Cytotoxic Activities of Mangosteen Garcinia mangostana Pericarp Extracts. Suranaree J. Sci. Technol., 22: 357–367.
Negi, J.S., Bisht, V.K., Singh, P., Rawat, M.S.M., dan Joshi, G.P., 2013. Naturally Occurring Xanthones: Chemistry and Biology. Journal of Applied Chemistry, 2013: e621459.
Pedraza-Chaverri, J., Cárdenas-Rodríguez, N., Orozco-Ibarra, M., dan Pérez-Rojas, J.M., 2008. Medicinal properties of mangosteen (Garcinia mangostana). Food and Chemical Toxicology, 46: 3227–3239.
Putri, I.P., 2015. Effectivity of xanthone of mangosteen (Garcinia mangostana L.) rind as anticancer. Majority, 4(1):33-38.
Ricci, M.S. dan Zong, W.-X., 2006. Chemotherapeutic Approaches for Targeting Cell Death Pathways. The Oncologist, 11: 342–357.
Riss, T.L., Moravec, R.A., Niles, A.L., Benink, H.A., Worzella, T.J., dan Minor, L., 2004. Cell Viability Assays, dalam:
Sittampalam, G.S., Coussens, N.P., Nelson, H., Arkin, M., Auld, D., Austin, C., dkk. (Eds.), Assay Guidance Manual. Eli Lilly & Company and the National Center for Advancing Translational Sciences, Bethesda (MD).
Safarzadeh, E., Sandoghchian Shotorbani, S., dan Baradaran, B., 2014. Herbal Medicine as Inducers of Apoptosis in
Cancer Treatment. Advanced
Pharmaceutical Bulletin, 4: 421–427. Shan, T., Ma, Q., Guo, K., Liu, J., Li, W., Wang, F., et al., 2011. Xanthones from Mangosteen Extracts as Natural Chemopreventive Agents: Potential Anticancer Drugs. Current molecular medicine, 11: 666–677.
Wang, H., Khor, T.O., Shu, L., Su, Z., Fuentes, F., Lee, J.H., dkk., 2012. Plants Against Cancer: A Review on Natural Phytochemicals in Preventing and Treating Cancers and Their Druggability. Anti-cancer agents in medicinal chemistry, 12: 1281–1305. Wong, R.S., 2011. Apoptosis in cancer: from pathogenesis to treatment. Journal of Experimental & Clinical Cancer Research, 30: 1–14.
Zhu, R.X., Seto, W.K., Lai, C.L., dan Yuen,
M.-F., 2016. Epidemiology of