PANDUAN PENGUKURAN
PARAMETER FISIKA DAN KIMIA PERAIRAN BUDIDAYA
Penyusun :
1. Yuni Puji Hastuti, M.Si
2. Jajang Ruhyana, ST
LABORATORIUM LINGKUNGAN PERAIRAN
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
2010
A. Bekerja di Laboratorium
Bekerja di laboratorium (praktikum) adalah suatu pekerjaan yang harus memperhatikan beberapa hal penting, sehingga suatu pengujian parameter dapat dilakukan secara tepat, teliti, tidak berbahaya dan selamat. Pekerjaan praktikum perlu mengembangkan pendekatan yang sehat dan professional terhadap pekerjaan di laboratorium. Prosedur yang benar dan aman tidak saja melindungi diri sendiri, tetapi juga demi berhasilanya percobaan di laboratorium. Secara umum bekerja di laboratorium harus membuat rencana (metode dan pereaksi yang digunakan, pelajari keamanannya, pencatatan data). Beberapa hal yang berkenaan dengan bekerja di laboratorium adalah sebagai berikut :
Prinsip umum dalam bekerja di laboratorium 1. Hanya percobaan sah yang dilakukan
2. Anggap semua bahan kimia yang digunakan berbahaya dan hindari kontak antara bahan kimia dan praktikan
3. Bahan kimia disimpan di wadah tertutup 4. Gunakan ruang asam
5. Gunakan jas lab, sarung tangan, pelindung tangan dan alat pelindung lain yang diperlukan 6. Jangan tinggalkan alat bekerja sendiri
7. Jangan memimet menggunakan mulut tapi gunakan bulp 8. Jika mencium bahan kimia, tepiskan uapnya dari muka Cara membawa bahan kimia yang benar
1. Asam dan alkali kuat harus dibawa didalam kemasan sekunder
2. Bahan kimia atau pelarut organik dibawa dengan cara menopang bagian bawa wadahnya
B. Pengambilan Sampel Uji
Peralatan yang digunakan untuk sampling dan analisa di laboratorium ada yang memerlukan keahlian khusus dalam pemakaiannya ada pula yang sederhana. Dalam penggunaan alat dilaboratorium praktikan harus terlebih dahulu mengetahui nama dan kegunaan alat tersebut.
C. Prosedur Sampling
Prosedur sampling yang benar merupakan bagian penting dari penelitian/survey untuk menentukan kualitas air atau limbah dan/atau untuk mengecek kesesuaian dengan standar kualitas air atau limbah. Ada tiga tipe prosedur pengambilan sampling dasar, yaitu grap sampling, composite sampling dan composit sampling prosional dengan debit.
1.Grap sampling : pengambilan sampel air dilakukan pada saat waktu tertentu kemudian dianalisis. Perlu diperhatikan bahwa pengujian berdasarkan grap sampling hanya menyatakan kondisi air atau air limbah pada waktu dan lokasi pengambilan sampel tersebut.
2. Composite sampling : pengambilan sampel pada interval waktu tertentu selama periode waktu sampling.
3. Composit sampling prosional dengan debit : pengambilan sampel air berdasarkan debit atau laju aliran air. Hal ini bertujuan untuk mendapatkan hasil yang akurat. Contoh jika pada debit alir 10L/s diambil sampel sebanyak 100 ml maka pada debit alir 20L/s diambil sampel sebanyak 200 ml.
D. Teknik Sampling
Alat yang paling sederhana untuk mengambil sampel adalah dengan menggunakan botol yang diikat dengan tali dan diberi beban sehingga mudah tenggelam. Syarat peralatan sampling yang akan digunakan untuk sampling harus bersih dan kering. Kontaminasi dari bahan alat pengambil atau wadah sampel harus dicegah. Dalam transportasi sampel harus disimpan dalam
cool box untuk mempertahankan sifat fisik, kimia dan biologis sampel.
FISIKA PERAIRAN
Suhu
Suhu adalah besaran yang menyatakan derajat panas atau dingin suatu zat yang dapat diukur menggunakan thermometer. Satuan suhu yang banyak digunakan di Indonesia adalah 0C.
Suhu pada suatu perairan berpengaruh terhadap kondisi perairan dan biota yang hidup didalamnya. Suhu optimum bagi perairan khususnya untuk kegiatan budidaya adalah 26-310C
(New, 2002). Suhu periaran yang berada dibawah kisaran optimum akan menghambat metabolisme biota perairan dan dapat menurunkan nafsu makan ikan. Sedangkan untuk suhu yang tinggi dapat membuat ikan stress dan mempercepat kelarutan/ reaksi zat pencemar perairan.
Tahap pengukuran suhu dengan alat di laboratorium
Penyiapan alat
1. Tekan tombol ON sampai layar menyala dan memperlihatkan angka-angka
2. Tekan tombol “FUNC” untuk memfungsikan alat dan merubah satuan dari mg/l menjadi % atau ºC atau mg/l
3. Jika ingin membulatkan angka dibelakan desimal, maka tekan tombol LSD, jika tombol ini ditekan lagi, maka nilai asli akan muncul lagi
4. Mengecek baterai dengan melihat “BATT.CHANGE”
Kalibrasi
1. Putuskan sambungan elektrrode dari alat dan kemudian tekan atus FUNCTION menjadi mg/L atau %. Layar akan menunjukkan E-l”
2. Kemudian tekan tombol “CAL” sampai keluar angka 0,00, jika belum keluar angka 0,00 maka tekan tombol “CAL” lagi sampai muncul angka 0,00.
Pengukuran
1. Masukkan elektrode ke air sampel yang sudah dipastikan bahwa tidak ada gelembung udaranya
2. Atur FUNCTION ke ºC dan lihat angka yang tertera pada layar
Setelah proses pengukuran
1. Tekan tombol POWER Switch OFF
2. Bersihkan air yang menempel pada elektrode dan kemudian simpan elektrode. A) jika digunakan lagi dalam waktu 1-2 hari maka biarkan elektrode masih tersambung dengan alat. B) jika tidak digunakan selama 1 minggu maka lepaskan elektrode dari alat.
Salinitas
Salinitas adalah tingkat keasinan atau kadar garam (ion-ion) terlarut dalam air (anonim, 2012). Alat untuk mengukur salinitas dinamakan refraktometer atau salinometer (Gambar 1) dengan satuan perseribu (parts per thousand , ppt) atau permil (‰), misalnya 35 gram dalam 1 liter air (1000 ml) maka kandungan salinitasnya 35‰. Kandungan garam pada sebagian besar danau, sungai, dan saluran air alami sangat kecil sehingga air di tempat ini dikategorikan sebagai air tawar yaitu kurang dari 0,5 ppt. Jika lebih dari itu, air dikategorikan sebagai air payau atau menjadi saline bila konsentrasinya 3 sampai 5%. Lebih dari 5%, ia disebut brine (anonim, 2012). pengkelompokkan air berdasarkan salinitas dapat dilihat pada table 1 dibawah ini
Tabel. 1 Menyajikan Klasifikasi Air Berdasarkan Salinitas
Sebutan/istilah Salinitas (ppt)
Sumber : Mc Lusky, 1971 dalam Kordi, 1996 dalam Ghufran dkk 2007
Berdasarkan kemampuan ikan menyesuaikan diri pada salinitas tertentu, dapat digolongkan menjadi dua yaitu ikan yang mempunyai toleransi salinitas yang kecil (Ctenohaline) dan ikan yang mempunyai toleransi salinitas yang lebar (Euryhaline). Salinitas suatu perairan sangat erat kaitannya dengan osmoregulasi biota yang hidup didalamnya. Osmoregulasi adalah pengontrolan kadar air dan garam mineral di dalam darah. Setiap organisme mempunyai kemampuan yang berbeda-beda untuk menghadapi masalah osmoregulasi sebagai respon atau tanggapan tehadap perubahan osmotik lingkungan eksternalnya.
Pengukuran salinitas
2. Atur dengan menggunakan atau kisaran nilai salinitas yang akan diukur.
3. Tekan tombol “ENTER” dan alat siap untuk digunakan untuk pengukuran.
Gambar 1. Refraktometer
KEKERUHAN
Kekeruhan menunjukkan sifat optik air yang ditentukan berdasarkan banyaknya cahaya yang diserap dan dipancarkan oleh bahan-bahan yang terdapat dalam air. Hal ini dapat disebabkan oleh adanya bahan organic dan anorganik yang tersuspensi dan terlarut, maupun bahan organic yang berupa mikroorganisme (APHA; Davis dan Cornwell dalam Effendi, 2003). Padatan tersuspensi erat hubungannya dengan kekeruhan semakin tinggi nilai padatan tersuspensi, nilai kekeruhan juga semakin tinggi. Namun nilai padatan terlarut yang tinggi tidak selalu diikuti dengan nilai kekeruhan yang tinggi pula. Nilai kekeruhan dapat diukur dengan alat turbidimeter (Gambar 2) yang memiliki satuan JTU (Jackson Turbidity Unit) yang setara dengan 1 mg/l SiO2.
Faktor-faktor kekeruhan air ditentukan oleh:
a. Benda-benda halus yang disuspensikan (seperti lumpur dsb) b. Jasad-jasad renik yang merupakan plankton
Tingginya kadar kekeruhan akan menghambat proses penetrasai cahaya matahari ke kolam air dan pada akhirnya akan perpengaruh terhadap proses fotosintesis diperairan. Selain itu tingginya nilai kekeruhan dapat menurunkan kemampuan ikan untuk bernafas karena proses penyaringan air oleh insang terhambat (Wardoyo dalam Sajiah, 2003)
Pengukuran Kekeruhan
1. Air sampel tidak direkomendasikan air yang disimpan, sesegera mungkin air sampel diperikasa kekeruhannya.
3. Tombol A/C ditekan untuk menyalakan alat, kemudian ditunggu selama 10 sampai 15 menit
4. Pada alat, diawal dimasukkan air yang sudah didestilasi kemudian tekan tombol zero untuk meng nol kan. Setelah itu dimasukkan standar yang sudah tersedia dan diketahui nilainya ke dalam alat dan kemudian nilai yang muncul pada layar dicocokan dengan nilai yang sudah diketahui (Kalibrasi).
5. Kemudian air sampel dimasukkan ke alat dan dilihat nilai yang muncul pada layar.
Gambar 2. Turbidimeter
Zat Padat (TDS dan TSS)
Zat padat pada badan air dikelompokkan menjadi dua, yaitu zat padat terlarut (TDS : Total dissolved Solid) dan zat padat tersuspensi (TSS : Total Suspended Solid). Keduanya dibedakan berdasarkan ukuran diameter partikel-partikel penyusunya. Gabungan nilai TDS dan TSS dinamakan Zat padat total. Jumlah zat padat tersuspensi terdiri dari zat padat tersuspensi organic (Volatil) dan zat padat tersuspensi inorganic (tetap)
Cara Penetapan Zat Padat Total
1. Sebanyak 25-50 ml contoh yang telah diaduk di masukkan ke dalam cawan. Sebelum digunakan cawan dibersihkan dan dikeringkan dalam oven pada suhu 100-105oC selama
1 jam. Setelah itu cawan didinginkan di dalam desikator dan ditimbang (W1).
3. Setelah didinginkan di dalam desikator, cawan ditimbang sebagai W2.
(W2-W1} Zat Padat Total {mg/L} = ml contoh
Cara Penetapan Zat Padat Terlarut
1. Sebanyak 25-50 ml contoh yang telah disaring dimasukkan ke dalam cawan alumunium yang telah diketahui beratnya (B1).
2. Contoh dalam cawan tersebut diuapkan dan diteruskan pengeringannya di dalam oven dengan suhu 100-105oC sampai berat konstan (B2)
(B2-B1) Zat Padat terlarut (mg/L) = ml contoh
Cara Penetapan Zat Padat Tersuspensi
1. Diambil sebanyai 50 ml contoh dan disaring dengan kertas saring yang telah diketahui beratnya (S)
2. Keringkan padatan yang tersaring dengan kertas saring pada oven 100-10SoC sehingga berat konstan dan ditimbang setelah didinginkan pada desikator (A)
3. Kertas saring dengan padatan yang tetah kering ditempatkan pada cawan pengabuan yang telah diketahui beratnya (B).
4. Selanjutnya dimasukkan pada oven pengabuan (600 DC) dan ditunggu sampai menjadi abu, lalu ditimbang setelah dingin (D).
KIMIA PERAIRAN
OKSIGEN TERLARUT (DO)
Oksigen terlarut ( DO ) adalah jumlah oksigen terlarut dalam air yang berasal dari fotosintesa dan absorbsi atmosfer/udara. Oksigen terlarut (Dissolved Oxygen = DO) dibutuhkan oleh semua jasad hidup untuk pernapasan, proses metabolisme atau pertukaran zat yang kemudian menghasilkan energi untuk pertumbuhan dan pembiakan. Disamping itu, oksigen juga dibutuhkan untuk oksidasi bahan-bahan organik dan anorganik dalam proses aerobik (Anonim, 2012).
Jumlah oksigen yang dibutuhkan untuk pernapasan biota budidaya tergantung ukuran, suhu dan tingkat aktivitasnya dan batas minimumnya adalah 3 ppm atau 3 mg/l. Kandungan oksigen di dalam air yang dianngap optimum bagi budidaya biota air adalah 4 – 10 ppm, tergantung jenisnya. Laju respirasi terlihat tetap pada batas kelarutan oksigen 3 – 4 ppm pada suhu 20 – 30 °C. Sumber oksigen terlarut dalam air berasal dari difusi oksigen yang terdapat di atmosfer, arus atau aliran air melalui air hujan serta aktivitas fotosintesis oleh tumbuhan air dan fitoplankton (Novonty and Olem, 1994).
Oksigen (O2) adalah satu jenis gas terlarut dalam air dengan jumlah yang sangat banyak,
yaitu menempati urutan kedua setelah nitrogen. Namun jika dilihat dari segi kepentingan untuk budidaya perairan, oksigen menempati urutan teratas. Oksigen merupakan salah satu faktor pembatas sehingga bila ketersediaannya di dalam air tidak mencukupi kebutuhan biota budidaya, maka segala aktivitas biota akan terhambat.
Prinsip analisa
Nilai DO pada perairan dapat kita ukur dengan metode titrasi yang dikenal dengan metode winkler. Prinsip metode ini……….. adapun reaksi yang terjadi dapat dilihat pada reaksi dibawah ini…
Reaksi
MnSO4 + NaOH --- Mn(OH)2 + Na2SO4
2 Mn(OH)2 + 2 O --- 2 H2MnO3 (endapan coklat)
Pembuatan Pereaksi
a. Sulfamic Acid
Ke dalam 80 ml akuades pada erlenmeyer tambahkan 20 ml H2SO4 pekat (hati-hati).
Kemudian tambahkan 4 gr Sulfamic Acid, aduk sampai larut simpan dalam botol coklat (gelap) dengan penutup gelas.
b. Copper Sulfamic Acid
Sebanyak 16 gr Sulfamic Acid dilarutkan ke dalam 200 ml akuades. Larutkan 25 gr CuSO4, 5H20 ke dalam 250 ml akuades. Campurkan kedua larutan tersebut dan tambahkan 12 ml
Glacial Acetic Acid.
c. Larutan MnSO4. H2O
Larutan 182 gr MnSO4 dengan akuades hingga volume 500 ml labu takar.
d. Larutan NaOH + KI
Larutan 250 gr NaOH dan 75 gram KI dalan akuades hingga volume 500 ml simpan dalam botol bertutup karet.
e. Larutan Na2S203 0,025 N (Na-thiosulfat )
Pada reaksi 4 (Standar Winkler), dua molekul Na-thiosulfat bereaksi dengan dua kivalen Iodium. Oleh karena itu nilai normalitas N per liter larutan Na-thio mengandung sejumlah berat molekul (BM) dari komponen itu dalam gram perliter larutan. Garam yang digunakan adalah Na2S2O3. 5H2O dengan berat molekul 248,19 ; maka larutan 0,025 N berisi: 248,19 x 0,025 =
6,2048 g/1 Larutan
Timbang dengan tepat 6,205 gram kristal Na2S2O3.5H2O, larutkan sampai menjadi 1000
ml dengan akudes bebas CO2. Akuades bebas CO2 diperoleh dengan cara mendidihkan akuades
selama 30 menit kemudian didinginkan. Tambahkan beberapa tetes Chloroforn sebagai bahan pengawet. Simpan dalam botol coklat di tempat gelap.
f. Larutan Standar K2Cr2O7 0,0250 H
6 KI + K2Cr27 + 14 HCl 6 KCl + 2 CrCl3 + H2O + I2
6KI + K2Cr2O7 + 7H2SO4 4K2SO4 + 2Cr2(SO4)3 + 2Cr2(SO4)3 +7H2O+ I2
I2 dititrasi dengan larutan Na-thiosulfat. Dalam reaksi di atas 1 ml K2Cr2O7 bereaksi
dengan 6 ml I ekivalen, maka 1 N K2Cr2O7 sebanding dengan 1/6 dari berat molekulnya (dalam
gram). Berat molekul Potassium (Kalium) dichromate adalah 294,2 sehingga 0.025 N dari larutan ini berisi:
(gram/l) 1,2258
6 294,2 x
0,025
Timbang dengan tepat 0,6129 gram kristal murni K2Cr2O7 (sudah dikeringkan pada 105 0C) dan didinginkan dalam desikator), larutkan dalam akuades bebas CO
2 sampai volume 500 ml.
g. Larutan H2SO4 10%
Tambahkan 5 ml H2SO4 pekat ke dalam 45 ml akuades bebas CO2 dengan hati-hati.
h. Indikator amylium ( Starch Indikator)
Sebanyak 2 gr Soluble Starch dilarutkan dalam 100 ml akuades, panaskan sambil diaduk, kemudian tambahkan 0,5 ml formalin sebagai bahan pengawet. Larutan ini hanya bertahan 1 bulan.
Standarisasi Larutan Natrium Thiosulfate
Larutan Na-thiosulfat berubah normalitasnya secara bertahap sehingga perlu distandarisasi dengan 0,0250 N larutan standar Potassium dichromate (K2Cr2O7). Standarisasi ini
sebaiknya dilakukan pada setiap analisa DO dilakukan (tiap hari).
a. Siapkan 100 ml akuades bebas CO2 dalam labu erlenmeyer 500 ml.
b. Timbang 2 gr KI dan larutkan dalam akuades tersebut, kemudian tambahkan 10 ml H2SO4 10 ml.
c. Tambahkan 10,00 ml larutan standar K2Cr2O7 0,025 N, (gunakan pipet volumetrik),
letakkan dan biarkan ditempat gelap selama + 5 menit.
e. Titrasi dengan Na-thiosulfat 0,025. N sampai warna berubah dari kuning tua menjadi kuning muda, tambahkan 8 tetes indikator amylum hingga warna biru, kemudian lanjutkan tirasi dengan Na-thioslfat sampai tidak berwarna.
f. Faktor koreksi untuk 0,025 N Na-thiosulfat adalah (= f):
Prosedur Pengukuran DO dengan metode winkler
Analisa DO secara titrimetrik ini dilakukan dengan menggunakan botol yang dirancang khusus untuk menghindari terjadinya gelembung udara pada saat botol ditutup, yang disebut botol BOD. Pemindahan air sampel ke dalam botol BOD dilakukan dengan hati-hati untuk menghindari terjadinya gelembung udara (“ bubling “) yang dapat mengakibatkan terbebasnya jumlah gas dari air atau terjadi aerasi, sehingga kadar oksigen terlarut kurang atau melebihi kadar sesungguhnya. Adapun tahapan pengukuranya sebagai berikut:
a. Pindahkan air sampel ke dalam botol BOD (Gambar 3a) sampai meluap, (jangan sampai terjadi gelembung udara), tutup kembali.
b. Tambahkan 1 ml Sulfamic Acid dengan pipet dibawah permukaan tutup dan aduk dengan membolak-balik botol.
c. Tambahkan 2 ml mangan Sulfat (MnSO4), dan 2 ml NaOH + KI. Penambahan
reagen-reagen ini juga dengan memasukan pipet dibawah permukaan air dalam botol. Tutup dengan hati-hati dan aduk dengan membolak-balik botol + 20 kali. Biarkan beberapa saat hingga endapan coklat terbentuk dengan sempurna.
d. Tambahkan 2 ml H2SO4 pekat dengan hati-hati (gunakan ruang asam), aduk
dengan cara yang sama hingga semua endapan larut. Kalau endapan belum larut semua, tambahkan lagi 0,5 ml H2SO4 pekat.
e. Ambil 100 ml air dalam botol BOD tersebut dengan menggunakan pipet mohr atau gelas ukur, masukkan ke dalam erlenmeyer usahakan jangan sampai terjadi nerasi.
f. Titrasi dengan Na-thiosulfat hingga terjadi perubahan warna dari kunimg tua ke kuning muda. Tambahkan 5 - 8 tetes indikator amylum hingga terbentuk warna biru. Lanjutkan titrasi dengan Na-thiosulfat hingga tepat tidak berwarna (bening).
Perhitungan:
Prosedur Pengukuran DO dengan Alat (DO-METER)
BOD adalah jumlah oksigen yang dibutuhkan oleh mikroorganisme dalam proses dekomposisi bahan organik (termasuk proses respirasi pada keadaan aerob). Jadi BOD menggambarkan suatu proses oksidasi bahan organik oleh mikroorganisme yang terjadi di perairan.
Ada yang menyebutkan kepanjangan dari BOD adalah Biological Oxygen Demand. Ini mungkin untuk lebih memudahkan membedakannya dengan COD (Chemical Oxygen Demand). Dalam hal BOD, proses yang terlibat sebenarnya tidaklah hanya proses biologi (oleh mikroorganisme), tetapi juga proses penguraian secara kimia. Sehingga akan lebih tepat bila disebut sebagai Biochemical Oxygen Demand atau Kebutuhan Oksigen Biokimia.
Proses dekomposisi bahan organik diperairan tidak terjadi sekaligus, tetapi terjadi secara bertahap, tergantung pada kadar bahan organik yang diuraikan (didekomposisi), mungkin hanya 10-25 % bahan organik yang dapat diuraikan setiap tahap. Oleh karena itu, untuk mencapai + 96 % bahan organik terurai, diperlukan waktu yang cukup lama yaitu sekitar 20 hari. Untuk keperluan pengamatan,waktu tersebut cukup lama, sehingga diambil standar waktu 5 hari. Pada hari ke-5 diperkirakan 75 % bahan organik telah terurai, dan ini cukup memadai sebagai gambaran nilai BOD. Rangkaian proses dekomposisi dapat digambarkan secara sederhana sebagai berikut :
Reaksi
- Bahan Organik + O2 CO2 + H2O + BO...25 % (1)
(BO) (mikroba)
- Bahan Organik + O2 CO2 + H2O + BO...50 % (2)
(BO) (mikroba)
- Bahan Organik + O2 CO2 + H2O + BO...75 % (3)
(BO) (mikroba)
Penentuan BOD ini dilakukan dengan cara menghitung kadar oksigen yang dibutuhkan oleh mikroorganisme untuk mendekomposisi bahan organik yang terlarut di perairan dalam waktu 5 hari. Jadi merupakan selisih kadar oksigen pada hari pertama dan hari kelima.
Metoda ini menggunakn botol gelap dan botol terang. Botol terang langsung ditentukan kadar oksigen terlarutnya, sedangkan botol gelap disimpan dalam BOD inkubator pada suhu 200c
selama 5 hari. Temperatur 200c dan waktu 5 hari merupakan temperatur dan waktu yang standar
dalam penentuan BOD karena dianggap dalam temperatur tersebut proses dekomposisi berjalan optimum dam sekitar 75% bahan organik telah terdekomposisi.
Prosedur Pengukuran BOD
a. Ambil air sampel sebanyak 1-2 liter. Apabila air terlalu keruh (terutama karena plankton), lanjutkan keprosedur b. Bila air tampak jernih, lanjutkan keprosedur c.
b. Encerkan 400-500 ml air sampel 5 sampai 100 kali, tergantung pada tingkat kepekatan sampel, dengan menggunakan akuades bebas biota.
c. Tingkatkan kadar oksigen air sampel tersebut dengan aerasi menggunakan aerator baterai selama + 5 menit. Peningkatan kadar oksigen juga dapat dilakukan dengan cara menuangkan air sampel dari botol satu kebotol yang lain. Dan sebaliknya, sebanyak 15 kali atau lebih (pada prinsipnya, maksud dari perlakuan pada prosedur 2 dan/atau 3 ini adalah agar tersedia oksigen yang berlebih untuk proses dekomposisi sampai hari terakhir inkubasi).
d. Pindahkan air sampel tersebut ke dalam botol BOD gelap dan terang sampai penuh. Air dalam botol BOD terang segera dianalisa kadar oksigen terlarutnya (DO1). Botol BOD gelap dan air sampel di dalamnya di inkubasi dalam BOD inkubator pada suhu 200c. Setelah 5 hari, tentukan kadar oksigen terlarut dalam botol gelap ini (DO
5).
Penentuan kadar oksigen terlarut ini bisa dilakukan secara titrimetrik atau dengan menggunakan DO-meter.
Perhitungan :
Karbon dioksida bebas yang dianalisa adalah karbondioksida yang berada dalam bentuk gas yang terkandung dalam air. Kandungan CO2 bebas diudara adalah sekitar 0.03%. Kandungan
CO2 dalam air murni pada tekanan 1 atm dan temperatur 250C adalah sekitar 0,4 ppm.
Karbondioksida yang terdapat di dalam air merupakan hasil proses difusi CO2 juga dihasilkan
oleh proses dekomposisi. Kandungan CO2 sebesar 10 mg/L atau lebih masih dapat ditolelir oleh
ikan bila kandungan oksigen perairan juga cukup tinggi. Kebanyakan spesies dari biota akuatik masih dapat hidup pada perairan yang memiliki kandungan CO2 bebas 60 mg/L.
Metode penentuan CO2 bebas yang umum digunakan adalah metoda titrimetrik dengan
sodium karbonat (Na2CO3).
Prinsip Analisa
Karbondioksida bebas bereaksi dengan Sodium Karbonat (Na2CO3) atau Sodium
Hidroksida (NaOH) standar, membentuk Sodium Bikarbonat. Dalam hal ini baik CO2, Na2CO3
maupun NaHCO3 merupakan senyawa-senyawa yang tidak berwarna. Oleh karena itu diperlukan
indikator phenolphthalein (pp) yang akan memberikan warna merah (pink) bila larutan menjadi basa (pH > 8,3). Sehingga kelebihan sedikit saja sodium karbonat atau sodium hidroksida, akan menyebabkan larutan berwarna merah yang menandai akhir titrasi.
Reaksi yang terjadi dalam titrasi adalah sebagai berikut :
CO2 + Na2CO3 + H2O 2 NaHCO3
CO2 + 2 NaOH Na2CO3 + H2O
Didalam perairan, CO2 jarang mengakibatkan pH perairan lebih rendah dari 5,5. Perairan
yang lebih asam dari pH 5,5 diduga bukan karena kandungan CO2 yang tinggi tetapi karena
kandungan mineral-mineral asam kuat. Oleh karena itu, sebelum dianalisa. pH air sampel perlu diketahui terlebih dahulu. Untuk mendapatkan hasil yang baik, penentuan CO2 bebas sebaiknya
dilakukan terhadap 2 air sampel yaitu yang dipanaskan dan yang tidak dipanaskan. Air sampel dipanaskan sambil diaduk sampai hampir mendidih untuk membebaskan CO2 ke udara. Air
sampel lain yang berasal dari stasiun yang sama dianalisa kadar CO2 tanpa perlakuan pemanasan.
Perbedaan hasil titrasi kedua air sampel tersebut menunjukan kadar CO2 bebas yang sebenarnya.
Sedangkan nilai CO2 yang didapat pada air sampel tanpa pemanasan menunjukan keasaman total
Terdapatnya sejumlah Allumunium (Al). Chromium (Cr), Copper (Cu) dan Besi (Fe) dapat mengakibatkan hasil pengukuran CO2 menjadi lebih tinggi dari kadar sesungguhnya.
Kandungan ion ferro (fe) sebaiknya tidak melebihi 1 ppm. Hasil yang lebih tinggi juga dapat disebabkan oleh amine, Ammonia, Borate, Nitrime, Phosphate, Silicate dan Sulfide. Asam-asam mineral dan garam-garam dari asam kuat atau basa lemah juga dapat mempengaruhi penetuan kadar CO2. Oleh karena itu, sebaiknya bahan-bahan tersebut terdapat dalam jumlah yang sangat
kecil, tidak lebih dari 5% dari kadar CO2 dalam air yang hendak dianalisa.
Pembuatan Pereaksi
a. Larutan Na2CO3 0,0454 N
Dua ekivalen Na2CO3 (1 mol) diperlukan untuk mengubah 1 mol CO2 membentuk
bikarbonat. Agar 1 ml Na2CO3 setara dengan 1 mg CO2, maka diperlukan 1/22 N atau 0,0454 L
larutan Na2CO3.
Timbang 2,407 gram Na2CO3 bebas air (yang telah dikeringkan dalam oven pada 1400
dan didinginkan dalam desikator). Larutkan dengan akuades dalam labu ukur menjadi 1.000 ml, Akuades yang digunakan harus sudah dididihkan selama sekitar 15 menit untuk membebaskan CO2 dan dibiarkan dingin. Larutkan Na2CO3 yang telah dibuat harus dismpan dalam botol yang
tertutup rapat, sehingga tidak terkontaminasi dengan CO2 dari udara.
b. Larutan NaOH 0,0227 N
Pipet 22,7 ml NaOH 1 N ke dalam labu ukur 1.000 ml. Tambahkan akuades bebas CO2
hingga volumenya mencapai 1.000 ml. Simpan larutan ini dalam botol yang tertutup rapat.
c. Indikator Phenolpthlein (pp)
Sebanyak 0,5 gram pp dilarutkan ke dalam 50 ml alkohol 95 %, kemudian tambahlan 50 ml akuades bebas CO2. Indikator ini berwarna pink dalam larutan basa (pH>8,3) dan tidak
berwarna dalam larutan asam.
d. Indikator Methyl Orange (m.o.) 0,05%
Larutkan 0,05 g methyl orange kadalam 100 ml akudes.
Ambil air sampel dan masukkan ke dalam 2 erlenmeyer masing-masing 25 ml. Tambahkan beberapa tetes indikator Methyl Orange (m.o) pada sampel pertama dan beberapa tetes pp pada sampel kedua. Pada sampel yang diberi m.o., apabila beberapa saat kemudian menjadi berwarna merah (pH sekitar 4,5 atau kurang), berarti keasaman disebabkan oleh asam yang lebih kuat dari CO2. Bila air sampel menjadi berwarna kuning setelah penambahan m.o atau
tidak berwarna setelah penambahan pp. Maka diperkirakan keasaman disebabkan oleh CO2.
Prosedur pengukuran CO2 bebas
a. Pengambilan air contoh harus diusahakan sedemikian rupa sehingga terhindari kontak antara air contoh dengan udara. Analisa harus dilakukan segera, yaitu dalam waktu 2-3 jam setelah pengambilan.
b. Pipet 25 ml air sampel dimasukan ke dalam Erlenmeyer dengan hati-hati, sedapat mungkin kurangi pengaruh aerasi.
c. Tambahkan 3-4 tetes indikator pp, jika berwarna pink berarti tidak ada CO2, jika tidak
berwarna berarti ada CO2 dan lanjutkan ke prosedur ke-4.
d. Titrasi segera dengan Natrium karbonat (Na2CO3) 0,0454 N atau Natrium hidroksida
(NaOH) 1,027 N sampai warna pink yang stabil selama 30 detik. Catat titrant yang digunakan.
Perhitungan :
a. Bila titrant yang digunakan Na2CO3 :
b. Bila titrant yang digunakan NaOH :
Alkalinitas menggambarkan jumlah basa (alkaline) yang terkandung dalam air yang dapat ditentukan dalam titrasi asam kuat (H2SO4 atau HCI) sampai pH tertentu. Alkalinitas juga dapat
disebut sebagai “ Daya Mengandung Asam “ (DMA) atau di Jerman disebut dengan “Saperstoff Bindung Vermogen” (SBV), yang artinya kemampuan air dalam menyerap asam. Garam-garan basa berasal dari kation Ca, Hg, Na, NH4, dan Fe3, atau Fe2 yang dapat bereaksi dengan
karbonat (CO3=), bikarbonat (HCO3- ataupun hidroksil (OH-).
Prinsip Analisa
Untuk perairan yang jernih dalam proses titrasi dapat digunakan indikator warna, tetapi untuk perairan yang keruh dan berwarna, dalam proses titrasi perlu digunakan pH meter untuk menentukan titik akhir titrasi.
Pada penentuan alkalinitas digunakan 2 jenis indikator yaitu : Phenolpthalein (pp) dan Methyl Orange (m.o.). Perubahan warna pada akhir titik titrasi dengan menggunakan indikator m.o. biasanya agak sulit diamati (tidak jelas). Untuk itu, m.o. bisa diganti dengan campuran Bromeresol Green dan Methyl Red (BOG + MR) atau campuran Xylene Cyanole dan Methyl Orange (XC + MO) yang memberikan perubahan warna yang lebih jelas pada akhir titrasi. Indikator pp berubah warna pada pH 8,3 untuk menetukan alkalinitas karbonat. Sedangkan indikator m.o. atau penggantinya berubah warna pada pH 4,5 untuk menentukan alkalinitas bikarbonat (alkalinitas total). Satuan alkalinitas dinyatakan dalam ppm CaCO3 atau mg CaCO3/L.
Reaksi-reaksi yang terjadi dalam titrasi alkalinitas (Rainwater dan Thatcher dalam Lind, 1995) adalah:
CO3= + H + HCO3- ... titrasi dengan indikator pp pH 8,3
HCO3- (dari CO3=) + H + H2O + CO2 ... titrasi dengan indikator m.o.
Sampai pH 4,5
HCO3- (dari air) + H + H2O + CO2 ... titrasi dengan indikator m.o.
Sampai pH 4,5
a. Akuades
Akuades yang digunakan harus memiliki tingkat kemurnian yang tinggi dan telah mengalami deionisasi. Didihkan selama 15 menit untuk membebaskan CO2 dan biarkan dingin.
b. Larutan Na2CO3 0,050 N
Keringkan 3 – 5 gr Na2CO3 bebas air dalam oven 250 oc selama 4 jam, lalu dinginkan
dalam desicator. Timbang sebanyak 2,5 g. Masukkan ke dalam gelas piala 1 liter dan tambahkan 300 ml akuades. Aduk dengan menggunakan pengaduk gelas. Pindahkan ke dalam labu takar 1000 ml, tambahkan lagi akuades hingga mencapai tanda tera, tutup dan aduk dengan menggunakan “magnetic stirer”.
c. Larutan HCl0,1 N
Pipet 8,3 ml HCI pekat (=11-12 N) dan masukan ke dalam takar 1000 ml yang berisi akuades; tambahkan akuades sampai tanda tera.
d. Larutan H2SO4 0,1 N
Pipet 2,8 ml H2SO4 pekat (=36 N), masukkan ke dalam takar 1000 ml berisi akuades,
tambahkan akuades sampai tanda tera.
Standarisasi larutan HCI atau H2SO4 (APHA,1989) adalah:
(a) Pipet 40,00 ml larutan Na2CO3 0,050 N, masukkan ke dalam erlenmeyer, tambahkan
60,00 akuades, aduk.
(b) Titrasi dengan 0,1 N HCI atau H2SO4 sampai pH 5 atau lebih dengan menggunakan
pH-meter, catat volume titran yang digunakan,
(c) Tutup erlenmeyer dengan gelas yng didihkan hati-hati selama 3-5 menit, dinginkan.
Untuk mendapatkan akurasi yang lebih baik, titik akhir titrasi ditentukan dengan pH-meter sebagai berikut:
Pada: pH 5,1 bila alk. Total sekitar 30 ppm CaCO3
pH 4,8 bila alk. Total sekitar 150 ppm CaCO3
Skema : Hubungan antar CO2, HCO3-,CO3=,OH-, dan alkalinitas total. Tambahkan 2 tetes
indikator BOG+MR lalu lanjutkan titrasi sampai warna merah kebiruan (bila menggunakan indikator Methyl orange, sampai berwarna orange).
e. Hitung kepadatan normalitas HCI dengan:
A = Banyaknya Sodium karbonat yang digunakan (gram) untuk membuat larutan 0,050 N.
B = Volume Sodium Karbonat yang dititrasi
C = Total volume HCI yang digunakan dalam titrasi.
f. Larutan HCI 0,02 N
Pipet 20 ml HCI 0,1 N, encerkan dengan akuades (hati-hati) sampai 100 ml. Distandarisasi dengan cara yang sama dengan prosedur 3 diatas.
g. Larutan H2SO4 0,02 N
Pipet 20 ml dari larutan 0,1 N H2SO4 dan encerkan menjadi 100 ml dengan akuades
(hati-hati).
Larutan ini dapat distandarisasi dengan cara sebagai berikut :
(a) Buat larutan Na2CO3 0,020 N dengan menimbang 1,0600g Sodium karbonat
bebas air (sudah dioven pada 140OC dan didinginkan dalam desikator), untuk
dilarutkan dalam 1000 ml akuades dalam labu takar.
(b) Pipet 10 ml Na2CO3 0,020 N, masukkan ke dalam erlenmeyer.
(c) Tambahkan 90 ml akuades dan 2-3 tetes indikator BOG+MR.
(d) Titrasi dengan H2SO4 0.02 N sampai terbentuk warna merah kebiruan (pH=4,5).
Dengan indikator Methyl Orange, pada titik akhir titrasi, satu tetes asam sulfat sudah mengakibatkan perubahan warna dari kuning ke Oranye (jingga).
(e) Normalitas H2SO4 dihitung dengan persamanan :
N1 x V2 = N2 X V2
C x 53
B A x
N = Normalitas ; V = Volume.
h. Indikator Bromeresol Green dan Methyl Red (BOG+MR)
Timbang 20 mg Methyl Red Sodium Salt dan 100 ml Bromeresol Sodium Salt. Masukkan ke dalam gelas piala. Tambahkan 100 ml akudes, aduk dengan pengaduk gelas. Dapat juga digunakan 100 ml Ethyl Alkohol 95% atau Isopropyl Alkohol 95% sebagai pengganti akudes.
i. Indikator Phenolphthalein (pp)
Lihat pada analisa CO2.
j. Indikator Methyl Orange 0,05
Lihat pada analisa CO2
k. Larutan Sodium Thiosulfat 0,1 N
Timbang 5 g Sodium Thiosulfate (Na2S2O3-5H20), masukkan ke dalam gelas piala.
Tambahkan 100 ml akuades aduk dengan gelas pengaduk. Masukkan ladu takar 200 ml, tambahkan akudes hingga tepat tanda tera.
Prosedur pengukuran Alkalinitas
Air sampel untuk analisa alkalinitas diambil dengan botol gelas atau botol polyethylene 300 ml. Diisi sampai penuh dan ditutup dengan rapat. Segera dianalisa dilapangan (in situ).
a. Pipet air sempal sebanyak 50 ml, masukkan ke dalam erlenmeyer.
b. Tambahkan 2 tetes indikator pp. Bila :
(a) Terbentuk warna pink, lanjutkan ke- c.
(b) Tidak berwarna, lanjutkan ke- d.
c. Titrasi dengan HCI atau H2SO4 0,02 N, hingga terjadi perubahan warna dari pink menjadi
tidak berwarna. Catat titrant yang digunakan (sebut saja = A ml).
Kesadahan pada dasarnya menggambarkan kandungan Ca++, mg dan ion-ion logam
polivalen lainnya seperti Al , Fe , Mn , Sr , Zn , dan H yang terlarut dalam air. Kation-kation tersebut terutama akan berikatan dengan anion bikarbonat, karbonat dan bila ada dengan sulfat. Tetapi karena hanya Ca++ dan Mg++ yang biasa terdapat dalam perairan alami dalam jumlah yang
relatif besar, sedangkan ion-ion logam lainnnya ada dalam jumlah sedikit (dapat diabaikan), maka biasanya kesadahan dapat dianggap hanya menggambarkan kandungan Calsium dan Magnesium yang terlarut dalam air. Dalam keadaan seperti ini nilai kesadahan total akan lebih kecil atau sama dengan alkalinitas total. Akan tetapi apabila kesadahan total lebih besar dari pada alkalinitas total, maka konsentrasi logam-logan lainnya, disamping Ca++ dan Mg++, juga ada
dalam jumlah cukup besar. Kelebihan kesadahan tersebut menunjukkan “ kesadahan non karbonat”.
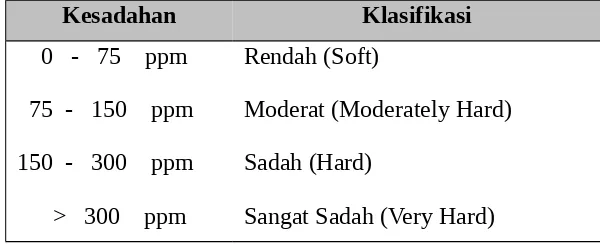
Tabel 1. Klasifikasi nilai kesadahan menurut Sawyer dan McCarty (1967) dalam Boyd, 1979
Kesadahan yang disebabkan oleh ion-ion Ca dan Mg yang berikatan dengan bikarbonat disebut kesadahan sementara (temporer). Kesadahan sementara ini akan hilang bila air dididihkan. Karena bikarbonat akan berubah menjadi karbonat dan Calsium serta Magnesium akan mengendap.
Pendidihan
Ca (HCO3)2 CaCO3 + CO2 + H2O
Pendidihan
Mg (HCO3)2 MgCO3 + CO2 + H2O
Kesadahan Klasifikasi
0 - 75 ppm
75 - 150 ppm
150 - 300 ppm
> 300 ppm
Rendah (Soft)
Moderat (Moderately Hard)
Sadah (Hard)
Kesadahan permanen adalah kesadahan yang disebabkan oleh garam-garam Ca dan Mg-karbonat (CaCO2 dan MgCO3) dan garam-garam dari asam anorganik (CaSO4).
Kesadahan total meliputi kesadahan permanen dan kesadahan sementara. Satuan kesadahan dinyatakan dalam ppm CaCO3 atau mg CaCO3/L.
Prinsip Analisa
“Ethylene-Diamine Tetraacetic Acid” dan garam-garam sodiumnya (Na-EDTA) akan membentuk senyawa kompleks bila ditambahkan ke dalam larutan kation logam (metal) tertentu. Jika sejumlah kecil “dye” seperti Eriochrome Black T ditambahkan ke dalam larutan yang mengandung ion-ion Ca EDTA ditambahkan sebagai titran, maka Calsium dan Magnesium akan diikat menurut senyawa kompleks. Apabila Calsium dan Magnesium telah habis diikat oleh EDTA maka larutan akan berubah warna menjadi biru cerah yang merupakan titik akhir titrasi.
Secara ringkas titrasi ini dapat digambarkan dalam persamaan reaksi sebagai berikut :
Ca++ + Mg++ + Ca&Mg-EBT kompleks + EDTA CaEDTA – EBT (biru)
(merah anggur)
Warna biru terjadi pada pH 8,5 -10,0. Oleh karena itu digunakan larutan buffer untuk mempertahankan pH antara 9,0 – 10,0. Hal ini penting, karena indikator EBT tersebut mempunyai dua perubahan warna yaitu:
Merah anggur Biru Orange
pH= 8,3 pH = 11,5
Lama proses titrasi dibatasi hingga tak lebih dari 5 menit untuk meminimalkan kecenderungan pengendapan CaCO3.
Beberapa ion logam seperti : Al, Ba, Cd, Co, Fe, dan sebagainya dapat menyebabkan titik akhir titrasi tidak jelas atau sulit dideteksi. Untuk mengurangi pengaruh senyawa pengganggu tersebut perlu ditambahkan inhibitor tertentu sebelum titrasi dengan EDTA (APHA, 1989). Adanya bahan organik tersuspensi atau koloid juga dapat mengganggu proses titrasi.
Pembuatan pereaksi
Timbang 67,5 gram NH4CI dan pipet 570 ml NH4OH peka b, kemudian larutkan dalam
akuades hingga 1000ml.
2. Indikator Eriochrome Block-T (EBT)
Sebanyak 0,50 gram Eriochrome Black-T dicampur dengan 4,5 g Hydroxylamine hydrochloride dan dilarutkan dalam 70% ethanol atau Isopropyl alkohol. Larutan ini dapat bertahan hingga 2-3 bulan. Untuk pembuatan indikator yang berupa “powder”, campurkan 0,5 gram EBT dengan 100 gram NaCI. Simpan dalam botol yang tertutup rapat.
3. Larutan CaCI2 0,010 M
Timbang 1000 gram CaCO3 murni dan masukkan ke dalam gelas piala 500 ml.
Tambahkan [1:1] HCI (= 50% HCI pekat + 50% akuades) perlahan-lahan sampai semua CaCO3
larut, dan encerkan dengan akuades sampai 200 ml kemudian didihkan 5-10 menit untuk membebaskan CO2, biarkan dingin. Tambahkan NH4OH 3N secukupnya hingga ph larutan
mencapai 7 (gunakan pH meter). Pindahkan ke dalam labu ukur 1.000 ml tambahkan akuades hingga tanda tera (1.000 ml).
4. Larutan Na-EDTA titran
Larutan 4,00 gram Disodium EDTA dan 100 mg MgCl2. 6H2O dalam akuades, aduk
hingga merata, kemudian tambahkan lagi akuades hingga volume 1000 ml. Larutan ini harus distandarisasi.
5. Standarisasi larutan Na-EDTA
Pipet 10,00 ml CaCl2 0,010 M standar, masukkan ke dalam Erlenmeyer 250 ml,
tambahkan 90 ml akuades. Tambahkan 8 tetes indikator EBT. Titrasi dengan EDTA sampai terjadi perubahan warna. Hitung molaritas EDTA dengan persamaan :
M2 * V2 = M1 * V1 M = molaritas; V = volume
Prosedur Pengukuran Kesadahan Total
1. Pipet sebanyak 100 ml air sampel, masukkan ke dalam Erlenmeyer.
2. Tambahkan 2 ml larutan buffer, aduk.
4. Titrasi dengan Na-EDTA hingga terjadi perubahan warna dari merah anggur kebiru.
Catatan :
1. Kesadahan total = Kesadahan Ca + Kesadahan Mg.
2. Titrasi harus dilakukan segera setelah penambahan larutan buffer dan indikator.
Air sampel untuk analisa kesadahan hanya bisa disimpan selama 1-2 hari
Perhitungan :
ml titran x M titran x 100,1 x 1000 Kesadahan total (mg/L CaCO3) =
ml sampel Kesadahan Ca
Prinsip penentuan Ca++ hampir sama dengan penentuan kesadahan total, hanya diperlukan
larutan buffer yang berbeda untuk mempertahankan pH yang lebih tinggi (yaitu pH 12-13) dan digunakan Murexide (AmmoniumPurpurate) sebagai indikator. Akhir titrasi ditandai denganperubahan warna dari pink ke ungu (purple).
Pembuatan Pereaksi
Larutan NaOH 1 N
Timbang 40 g NaOH dan larutkan dalam akuades. Larutan ini berfungsi sebagai
buffer.
1. Indikator Murexide.
Indikator ini biasanya sudah tersedia dalam bentuk kristal Campuran 200 g
Murexide dan 100 g NaCI, kemudian digerus simpan dalam botol gelap.
2. Larutan Na-EDTA standar, titran
(sama seperti yang digunakan untuk Kesadahan Total).
Prosedur Pengukuran Kesadahan Ca
1. Pipet 100 ml air sampel, masukkan ke dalam erlenmeyer.
3. Tambahkan 0,1-0,2 gram(+ seujung pengaduk) murexide, aduk sambil segera dititrasi dengan Na-EDTA dengan hati-hati sampai terjadi perubahan warna dari merah (pink) ke ungu (orchid purple). Akhir titrasi ditandai dengan penambahan satu tetes titran yang tidak lagi mengubah insensitas warna ungu-biru.
Perhitungan :
ml titran x M titran x 100,1 x 1000 Kesadahan Ca++ (mg/L CaCO
3) =
Analisa Nitrogen
Nitrogen di perairan terdapat dalam bentuk gas N2, NO2-, NO3-, NH3 dan NH4 + serta
sejumlah N yang berikatan dalam organik kompleks (Haryadi, 2003). Sumber nitrogen terbesar berasal dari udara, sekitar 80% dalam bentuk nitrogen bebas yang masuk melalui sistem fiksasi biologis dalam kondisi aerobik. Menurut Chester (1990), keberadaan nitrogen di perairan dapat berupa nitrogen anorganik dan organik.Nitrogen anorganik terdiri atas ion nitrit (NO2-), ion nitrat
(NO3-), ammonia (NH3), ion ammonium (NH4+) dan molekul N2 yang larut dalam air, sedangkan
nitrogen organik berupa protein, asam amino dan urea akan mengendap dalam air. 1.Ammonia-Nitrogen
Amonia adalah senyawa kimia berupa gas dengan bau tajam yang khas. Sumber ammonia pada wadah budidaya berasal dari limbah metabolisme ikan dan sisa pakan yang tidak dimakan. Dalam air ammonia berada dalam dua bentuk yaitu ammonia tidak terionisasi (NH3) dan ammonia terionisasi (NH4+). Jumlah total kedua bentuk ammonia ini disebut dengan total ammonia nitrogen atau TAN (Ebeling at al. 2006). Keberdaan NH3 diperairan sangat dihindari
karena bersifak toksik. Stickey (2005) menyatakan bahwa NH3 dalam media budidaya harus
lebih rendah dari 0,8 mg/L.
Prinsip analisa
Penentuan ammonia-nitrogen digunakan metode Indophenol (metoda phenate). Metoda ini memberikan hasil yang cukup baik untuk ananlisa air yang mempunyai nilai kesadahan total (400 mg/L dan konsentrasi nitrit-N <5 mg/L. Pereaksi yang digunakan adalah : phenate (phenol), chlorox (oxidizing solusion) dan mangan sulfat. Phenol dan hypochiorite (chlorox) bereaksi dalam kondisin larutan basa membentuk phenylquinone-monoimine yang selanjutnya akan bereaksi dengan ammonia membentuk idophenol yang berwarna biru. Kepekatan warna biru sebanding dengan kadar ammonia yang ada. Reaksi antara ammonia dan phenol dapat dilihat pada reaksi dibawah ini
Phenol + NH3 + 3C1O- Idophenol + CH2O + OH- +3CI
(Hypochlorite) (biru)
digunakan dan kondisi analisa. Oleh karena itu setiap melakukan penentuan ammonia, harus selalu disertai dengan penentuan standar ammonia dan blanko.
Kadar ammonia yang terukur pada metoda ini adalah ammonia total yaitu terdiri dari NH3
dan NH4-, karena pada larutan bersuasana basa kusat semua ammonia berada dalam bentuk NH3.
ini berarti, ammonia yang terukur adalah NH3 yang secara alami ada dalam air ditambah NH3
yang berasal dari mereduksi ammonium (NH4). Untuk mengetahui jumlah NH3 yang ada, dapat
ditentukan dari persamaan keseimbangan bila pH dan temperatur pada saat pengambilan sampel diketahui. Prosentase NH3 terhadap ammonia total sangat dipengaruhi oleh pH dan temperatur.
Boyd (1979) menyajikan tabel persentase NH3 dalam Total Ammonia Nitrogen (TAN) yang
diamati pada pH dan temperatur tertentu. Di air payau atau air laut. Persentase ammonia tersebut juga dipengaruhi oleh salinitas.
Pembuatan Pereaksi
1. Akuades bebas ammonia
Lewatkan akuades pada resin kation pengganti asam kuat (strong acid cation exchange resin). Akuades bebas ammonia ini harus dibuat baru tiap hari.
2. Phenate
Timbang 10,0 g phenol dan 2,5 g NaOH, kemudian larutkan dalam 100 ml akuades.
3. Mangan sulfat
Timbang 50 mg MnSO4, H2O, kemudian larutakan dalam 100 ml akuades bebas
ammonia.
4. Chlorox (Oxidizing Solution)
Sebanyak 20 ml chlorox (mengandung + chlorine) dilarutkan ke dalam 80 ml akuades, lalu tambahkan HCI (1+3) hingga ph menjadi sekitar 6,5-7,0. Buat yang baru setiap 4-5 hari.
5. Larutan Standar (NH4CI) 0,30 ppm
a. Timbang 1,9079 g NH4CI, karutkan dalam 500 ml akuades (1000 ppm).
b. Pipet 5 ml larutan (a. ), encerkan hingga volume 500 ml (10 ppm).
Prosedur Pengukuran ammonia total
1. Saring 25-50 ml air sampel dengan berkas saring Whatman no. 42 (jangan menggunakn “Vacuum pump”, agar tak ada amonia yang hilang).
2. Pipet 10,00 ml air sampel yang telah disaring, masukkan ke dalam gelas piala.
3. Sambil diaduk (sebaiknya dengan `magnetic stirer`), tambahkan 1 tetes MnSO4, 0,5
ml chlorox (oxidizing solution) dan 0,6 ml phenate. Phenate ditambahkan dengan segera dengan menggunakan pipet tetes yang telah dikalibrasi. Diamkan selama + 15 menit, sampai pembentukan warna stabil (warna akan tetap stabil sampai beberapa jam).
4. Buat larutan blanko dari 10,00 ml akuades. Lakukan prosedur 3.
5. Buat larutan standar dari 10,00 ml larutan standar ammonia (0,30 ppm). Lakukan prosedur 3.
6. Dengan larutan blanko pada panjang gelombang 630 nm, set Spektro fotometer (Gambar 4) pada Absorbance 0,000 (atau Transmittance 100%), kemudian lakukan pengukuran sampel dan larutan standar.
Catatan :
- Bila konsentrasi ammonia (TAN) melebihi 2 ppm, intensitas warna biru yang terbentuk jadi terlalu tinggi (warna terlalu biru), sehingga tak dapat diukur secara akurat dengan spektrofotometer. Bila terjadi, encerkan sampel seperlunya dengan akuades bebas ammonia, kemudian baru diambil 10 ml untuk analisa. Dalam perhitungan, faktor pengencer harus disertakan.
Perhitungan
Hitung konsentrasi ammonia-N total (TAN) dengan persamaan:
Abs Sampel – Abs blanko
[TAN] mg/L sebagai N = ppm NH3-N = X Cst
Abs standar - Abs blanko Keterangan
Cst = konsentrasi larutan standar (0,30 mg /L) Abs = nilai absorbance
Konsertasi ammonia yang terukur tersebut dinyatakan dalam kadar nitrogen (N) yang terdapat dalam ammonia (NH3). Untuk mengetahui konsentrasi ammonia yang dinyatakan dalam
mg NH3/L (-ppm NH3), nilai [TAN] diatas dikalikan dengan faktor seperti pada persamaan
berikut :
BM NH3
mg NH3/L = ppm NH3 –N X = ppm NH3-N x 1,216
BA N
Keterangan :
BM = berat molekul
BA = berat atom
2.Nitrit-Nitrogen
Nitrit merupakan hasil metabolisme dari siklus nitrogen. Bentuk pertengahan dari nitrifikasi dan denitrifikasi. nitrit adalah komponen yang mengandung nitrogen berikatan dengan dua atom oksigen. Diperairan alami kandungan nitrit berda dalam jumlah yang sedikit, karena tidak stabil dengan keberadaan oksigen. Kandungan nitrit yang tinggi dapat mengakibatkan terganggunya proses pengikatan oksigen oleh hemoglobin darah, yang selanjutnya membentuk met-hemoglobin yang tidak mampu mengikat oksigen (Effendi 2003).
Prinsip analisa
Metode yang digunakan dalam pengukuran nitrit adalah metode Sulfanilamide (APHA, 1989). Pereaksi yang dipakai adalah sulfanilamide sebagai `diazotizing reagent` dan NED (N-1-napthyl-ethylene-diamine-dihydrochloride) sebagai coupling reagent. Nitrit yang terdapat diperairan bereaksi dengan pereaksi-pereaksi ini membentuk garam-garam diazonium (diazonium salts). `Diazonum salts` bersama dengan amino atau kelompok hidroksil dari aromatik kompleks, membentuk senyawa “azo” yang berwarna merah terang (pink).
Pembuatan Pereaksi
1. Sulfanilamide (Diazotizing reagent)
Sebanyak 5 g sulfanilamide dan 50 ml HCI pekat dilarutkan ke dalam 300 ml akuades, aduk sampai larut. Encerkan hingga volume 500 ml.
2. NED (Coupling reagent)
Sebanyak 500 mg NED dilarutkan ke dalam 500 ml akuades, Simpan dalam botol gelap dan ditempat gelap. Larutan ini secara bertahap akan menjadi cokelat gelap. Harus dibuat yang baru setiap 2-1 minggu.
3. Larutan standar Nitrit-N 1,00 mg/L (1ppm)
Timbang 0,4925 g NaNO2 dan larutkan dengan akuades menjadi 1000 ml (100 ppm). Dari
larutan ini, pipet dengan tepat 10,0 ml dan encerkan sampai 1000 ml, sehingga didapat laruitan standar NO2-N 1 pppm.
Prosedur Pegukuran Nitrit
2. Pipet 10,00 ml air sampel yang telah disaring, masukkan ke dalam gelas piala.
3. Tambahkan 0,2 ml ( + 4 tetes) ‘diazotizing reagent’, aduk. Biarkan 2-4 menit (jangan lebih).
4. Tambahkan 0,2 ml NED, aduk. Biarkan 10 menit agar terbentuk warna merah (pink) dengan sempurna.
5. Buat larutan blanko dari 10 ml akuades.Lakukan prosedur 3 dan 4.
6. Buat satu seri larutan standar nitrit-N dengan konsentrasi (ppm) sebagai berikut: 0,025; 0,05; 0,01; 0,02; 0,04; 0,08 dari larutan standar 1 ppm, dengan pengenceran yang tepat. (gunakan pipet dan labu takar yang sesuai). Lakukan prosedur 2, 3, 4.
7. Dengan larutan blanko dan pada panjang gelombang 543 nm, set spektrofotometer pada ‘Absorbance’ = 0,000 kemudian ukur sampel dan larutan standar.
8. Untuk menentukan konsentrasi nitrit-nitrogen, buat grafik atau persamaan regresi (y = A + BX) dari larutan standar. Sumbu x sebagai konsentrasi (ppm) nitrit-nitrogen dan sumbu y sebagai nilai ‘absorbance’ (A) atau ‘transmittance’ (T). Nilai A atau T air sampel diplotkan pada grafik atau disubtitusikan dalam persamaan regresi, sehingga diperoleh kadar nitrit-nitrogen di perairan.
Konsentrasi (ppm) NO2-N yang terukur pada metoda ini adalah kadar nitrogen yang
terdapat pada nitrit (dalam satuan mg N per liter atau ppm NO2-N).
Perhitungan
Untuk mengetahui kadar nitrit sebagai mg NO2/L (ppm NO2) digunakan persamaan
berikut :
BM NO2
mg NO2-/L = ppm NO2-N x = ppm NO2-N x 3,28
NITRAT-NITROGEN
Nitrat (NO3) adalah bentuk utama nitrogen di perairan alami dan merupakan nutrient utama
bagi pertumbuhan tanaman dan algae. Nitrat sangat mudah larut dalam air dan bersifat stabil. Senyawa ini dihasilkan dari proses oksidasi sempurna senyawa nitrogen di perairan. Nitrifikasi yang merupakan proses oksidasi ammonia menjadi nitrit dan nitrat adalah proses yang penting dalam siklus nitrogen dan berlangsung pada kondisi aerob. Oksidasi ammonia menjadi nitrit dilakukan oleh bakteri Nitrosomonas,sedangkan oksidasi nitrit menjadi nitrat dilakukan oleh bakteri Nitrobacter. Kedua jenis bakteri tersebut merupakan bakteri kemotrofik, yaitu bakteri yang yang mendapatkan energi dari proses kimiawi.
Masuknya nitrat kedalam badan sungai disebabkan manusia yang membuang kotoran dalam air sungai dan kotoran banyak mengandung amonia. Kemungkinan lain penyebab konsentrasi nitrat tinggi ialah pembusukan sisa tanaman dan hewan, pembuangan industri, dan kotoran hewan. Nitrat menyebabkan kualitas air menurun, menurunkan oksigen terlarut dan penurunan populasi ikan.
METODE KOLOM
Prinsip analisa
Metode yang digunakan dalam pengukuran nitrat adalah metode Column (APHA 1989). Prinsip dari metode ini adalah nitrat akan direduksi menjadi nitrit setelah melewati Column yang berisi cadmium. Setelah larutan sampel tereduksi menjadi nitrit kemudian direaksikan dengan sulfanilamide yang berperan sebagai `diazotizing reagent` dan NED (N-1-napthyl-ethylene-diamine-dihydrochloride) sebagai coupling reagent. Nitrit yang terdapat diperairan bereaksi dengan pereaksi-pereaksi ini membentuk garam-garam diazonium (diazonium salts). `Diazonum salts` bersama dengan amino atau kelompok hidroksil dari aromatik kompleks, membentuk senyawa “azo” yang berwarna merah terang (pink). Pengukuran nitrat dengan mentode column direkomndasikan untuk perairan yang memiliki kandungan nitrat dibawah 0,1 mg/L.
Pembutan pereaksi 1.Larutan NH4Cl
Larutkan 100 g NH4Cl pada air yang telah didestilasi. Kemudian simpan pada botol kaca
atau plastic
Lubangi Cadmium murni dengan bahan yang keras, kemudian dibuat saringan dengan ukuran 2 mm namun mampu menahan benda-benda yang berkuran 0,5 mm. masukkan 300 g fiings dengan 300 ml HgCl2 (1 g HgCl2/ 100 ml)
3.Sulfanilamide (Diazotizing reagent)
Sebanyak 5 g sulfanilamide dan 50 ml HCI pekat dilarutkan ke dalam 300 ml akuades, aduk sampai larut. Encerkan hingga volume 500 ml.
4. NED (Coupling reagent)
Sebanyak 500 mg NED dilarutkan ke dalam 500 ml akuades, Simpan dalam botol gelap dan ditempat gelap. Larutan ini secara bertahap akan menjadi cokelat gelap. Harus dibuat yang baru setiap 2-1 minggu.
Prosedur pengukuran
Prosedur Pegukuran Nitrit
1. Saring sebanyak 100 ml air sampel dengan kertas saring Whatman no. 42 atau yang setara.
2. Pastikan pH air berada pada 8-9.
3. Masukkan 80 – 90 ml sampel pada erlemeyer dan tambahkan 2 ml larutan NH4Cl yang telah
diencerkan kemudian aduk
4. Masukkan sampel air diatas pada Column yang telah berisi cadmium.
5. Ambil 25 – 30 ml air yang telah melewati column dan dipindahkan pada Erlenmeyer baru.
6. Tambahkan 0,2 ml ( + 4 tetes) ‘diazotizing reagent’, aduk. Biarkan 2-4 menit (jangan lebih).
7. Tambahkan 0,2 ml NED, aduk. Biarkan 10 menit agar terbentuk warna merah (pink) dengan sempurna.
8. Ukuran larutan tersebuk pada spektrofotometer dengan panjang gelombang 543
9. Buat larutan standar nitrat yaitu dengan memasukkan 110 ml larutan standar nitrat pada Column. Setelah itu lakukan tahapan 5-8
Perhitungan
mg NO3- N/L = (Abs samel – Abs blanko) x F/L - C
mg NO3/ L = mg NO3- N/L X 4.43
Catatan F = Faktor koreksi L = panjang gelombang C = Konsentrasi NO2-N
*F = 0.2 / A A = Abs standar nitrat (0,2 mg/l)
Meode Brucin Prinsip analisa
Dalam penetuan nitrat-nitrogen digunakan metode Brucine (APHA, 1979), dengan preaksi-preaksi Brucine dan asam sulfat pekat. Reaksi Brucine dengan nitrat membentuk senyawa yang berwarna kuning. Kecepatan reaksi ini sangat dipengaruhi oleh tingkat panas larutan. Pemanasan larutan dilakukan dengan penambahan asam sulfat pekat. Metode ini hanya sesuai untuk air sampel yang kadar nitrat-nitrogennya 0,1 sampai 2 pm (Selang terbaik 0,1-1 ppm NO2-N). Bila diduga air sampel mengandung nitrat lebih besar atau lebih kecil dari selang
ini, disarankan untuk menggunakan metode sebagaimana yang disarankan dalam APHA (1989), antara lain ‘Cadmium Reduction Method’, ‘Ultraviolet Spectrophotometric Screening Method; atau ‘Nitrate Elektrode Method’.
Pembuatan Pereaksi
1. Larutan Brucine
- Timbang 250 mg Bruchine sulfat dan 25 mg sulfanilic acid, kemudian larutkan dalam 17,5 ml akuades panas.
- Tambahkan 1,2 ml HCI pekat, aduk hingga larut, biarkan dingin.
- Encerkan dengan akuades hingga volume 25 ml.
(Sudah tersedia, produk pabrik).
3. Larutan Standar Nitrat-N 5,00 mgN/L (5 ppm)
Timbang 0,6070 gram NaNO3 dan larutkan dengan akuades hingga tepat 1000 ml dalam
labu takar. Pipet 25,00 ml dari larutan ini, pindahkan ke cawan evaporasi dan uapkan hingga kering pada ‘steam bath’ atau dibawah lampu pemanas. Dinginkan cawan dan tambahkan 2,0 ml Phenoldisulfonic Acid (produk pabrik). Campurkan phenoldisulfonic dengan residu pada cawan dengan mengaduk gelas, lalu pindahkan isi cawan ke dalam labu takar 500 ml. Tambahkan akuades sampai tanda tera. Larutan ini permanen dan berisi 5 ppm NO3-N (sebagai N).
Prosedur Penentuan
Saring sebanyak 25-50 ml air sampel dengan kertas saring Whatman no. 42 atau yang setara .
1. Pipet 5 ml air sampel yang telah disaring, masukkan ke dalam gelas piala.
2. Tambahkan 0,5 ml Bruchine, aduk.
3. Tambahkan 5 ml asam sulfat pekat (gunakan ruang asam), aduk.
4. Buat larutan blanko dari 5 ml akuades. Lakukan prosedur 3 & 4.
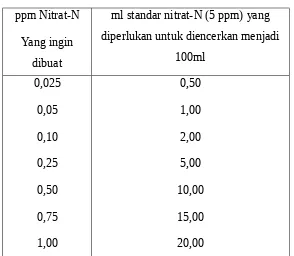
Tabel 2. Standar konsentrasi nitrat-nitrogen
ppm Nitrat-N
Yang ingin dibuat
ml standar nitrat-N (5 ppm) yang diperlukan untuk diencerkan menjadi
100ml
0,025
0,05
0,10
0,25
0,50
0,75
1,00
0,50
1,00
2,00
5,00
10,00
15,00
20,00
Sebelum pengenceran sampai 100 ml, tambahkan terlebih dahulu 20-30 ml akuades dan 8 ml NH4OH pekat, kemudian baru ditambahkan lagi akuades sampai tanda tera. Selanjutnya,
lakukan prosedur 3 & 4.
6. Dengan larutan blanko dan pada panjang gelombang 410 nm, set spektrofotometer pada 0,000 Absorbance, kemudian ukur sample dan larutan standar.
7. Buat persamaan regresi (y = A + BX) dari larutan standar untuk menentukan kadar nitrat-nitrogen air sampel.
Catatan :
Perhitungan
Untuk menentukan kadar nitrat dalam mg nitrat per liter (= ppmNO3-), digunakan
persamaan berikut :
BM NO3
mg NO3-/L = ppm NO3-N x = ppm NO3-N x 4,43
BAN
BAHAN ORGANIK TOTAL
Zat organik merupakan indikator umum bagi pencemaran air. Apabila kandungan zat organik yang dapat dioksidasi (BOD) dalam air besar, maka hal ini menunjukkan akan adanya pencemaran Penentuan bahan organik total (BOT) dilakukan menurut cara winkler yang disebut percobaan 10 menit. Prinsipnya adalah air yang dipaksa diberi larutan KMnO4 dalam waktu 10
menit akan tereduksi oleh bahan-bahan organik dalam air sampel. Voleme KMnO4 yang
digunakan merupakan ukuran banyaknya bahan-bahan organik yang larut dalam air itu. Pembuatan Larutan Induk Kalium Permanganat, KmnO4
Buat larutan induk kalium permanganat 0.1N dengan tahapan sebagai berikut :
1) larutan 3.1600 g kalium permanganat, KmnO4 dengan 500 ml air suling di dalam labu
ukur 1000 ml;
2) tambahkan air suling sampai tepat pada tanda tera;
3) simpan di dalam botol berwarna coklat.
Pembuatan Larutan Baku Kalium Permanganat, KmnO4
Buat larutan baku kalium permanganat yang mempunyai kenormalan kira-kira 0.01N dengan tahapan sebagai berikut:
1) pipet 10 ml larutan induk kalium permanganat 0.01N dan masukkan ke dalam labu ukur 100 ml;
Penetapan Kenormalan Larutan Baku Kalium Permanganat, KmnO4
Tetapkan kenormalan larutan baku kalium permanganat dengan tahapan sebagai berikut :
1) ukur 100 ml air suling secara duplo dan masukkan ke dalam labu erlenmeyer 300 ml, panaskan hingga 70oC;
2) tambahkan 5 ml larutan asam sulfat 8N bebas zat organik;
3) tambahkan 10 ml larutan baku asam oksalat 0.01N;
4) titrasi dengan larutan baku kalium permanganat sampai warna merah muda dan catat ml pemakaiannya;
5) apabila perbedaan pemakaian larutan baku kalium permanganat secara duplo lebih dari 0.1 ml ulangi penetapan, apabila kurang atau sama dengan 0.1 ml rata-ratakan hasilnya untuk perhitungan kenormalan larutan baku kalium permanganat;
6) hitung kenormalan larutan baku kalium permanganat dengan menggunakan rumus:
V1 x N1 = N2
Keterangan :
V1 = ml larutan baku asam oksalat
V2 = ml larutan baku kalium permanganat yang dipergunakan untuk titrasi;
N1 = kenormalan larutan baku asam oksalat;
N2 = kenormalan larutan baku kalium permanganat yang dicari.
Prosedur pengukuran bahan organic total
1. Ukurlah 25 ml sampel air, lalu masukkan ke dalam labu erlemeyer 2. Teteskan 0.5 ml asam sulfat
3. Tambahkan beberapa tetes KMnO4 0.01N sampai larutan berwarna sedikit merah jambu
4. Pipet 10 ml larutan KMnO4 0.01N lalu masukkan ke dalm erlemenyer berisi sampel tadi.
Larutan menjadi berwarna merah
5. Didihkan labu erlenmeyer tadi, catat waktu pada saat mendidih. Larutan mungkin menjadi lebih muda, setelah 10 menit angkat labu tadi dari api
6. Setelah suhunya turun menjadi kurang 800C, tambahkan 10 ml asam oksalat 0.01N
dengan pipet khusus. Larutan menjadi tidak berwarna karena jumlah asam oksalat ini berlebih
7. Pada konsdisis suhu tetap berkisar 700-800C. titrasi larutan ini dengan KMnO
4 0.01N
hingga warnanya menjadi merah jambu Perhitungan
A x N x 8000
BOT (mg O2/l) = ---
ml sampel
A : ml larutan KMnO4
N : Normalitas larutan KMnO Perhitungan
TOM = (ml titran x N KMnO4 x bst x / ml sampel ) x 1000
Keterangan :
SULFIDE
Sulfide merupakan gas alam belerang. Sulfide dapat berasal dari limbah industri atau dihasilkan dari proses dekomposisi bahan organik yaitu proses reduksi sulfat oleh bakteri pada kondisi anaerob.
SO4= + 8 H+ S= + 4 H2O
Penentuan kadar sulfide dibedakan menjadi Total sulfide, Sulfide terlarut (Dissolved Sulfide) dan H2S (Hidrogen Sulfide atau Unionized Hidrogen Sulfide). Sulfide dalam bentuk H2S
tak terionisasi (unionized H2S) bersifat sangat toxic dan korosiv terutama terhadap bahan-bahan
yang tersusun dari logam (metal). Kadar H2S tak terionisasi sebesar 0.025 – 0.25 g/l dalam air
bersih sudah menimbulkan bau telur busuk.
Sulfide di dalam air berada dalam reaksi kesetimbangan sebagai berikut :
H2S = = = HS- + H
-HS- = = = S= + H-
“Total sulfide” mencakup H2S, HS-, dan sulfide yang berkaitan dengan ion-ion logam
(metal) yang terdapat dalam bahan-bahan tersuspensi yang dapat dilarutkan dengan asam. Copper (Cu) dan Silver (Ag) Sulfide berada dalam bentuk yang tidak terlarut dengan asam, sehingga tidak termasuk dalam total sulfide. “Dissolved sulfide” adalah sulfide yang terlarut setelah bahan-bahan tersuspensi diendapkan. “Un-ionized hydrogen sulfide” dapat dihitung dari konsentrasi Dissolved Sulfide, bila pH dan temperatur air pada saat pengamatan diketahui (Boyd, 1989). Penentuan analitik sulfide (dalam hal ini Dissolved Sulfide) sebenarnya mencakup H2S
tak terionisasi, HS-dan S2.
Pembuatan Pereaksi
1) Zn-Acetate 2 N
Timbang 220 g Zn(C2H3O2)2 2H2O dan larutan ke dalam 1000 ml akuades.
2) NaOH (Sodium Hidroksida) 6 N
Sebanyak 240 g NaOH dilarutkan dalam 1000 ml akuades.
3) HCl (Hidro Chloric acid) 6 N
Encerkan 50 ml HCl pekat menjadi 100 ml dengan akuades (hati-hati).
4) Iodine 0.025 N
Larutkan 10 g KI dalam sedikit akuades. Kemudian tambahkan 1.8 g I2, aduk hingga
larut. Tambahkan akuades hingga volume 500 ml. Larutan ini harus distandarisasi.
Standarisasi Iodine :
a. Pipet 25,00 ml larutkan Iodine 0,025 N di atas, masukkan ke dalam erlenmeyer.
b. Tambahkan 2-3 tetes indikator amylum.
c. Titrasi dengan Na-thiosullfate hingga terjadi perubahan warna dari biru ke tidak berwarna (bening).
d. Normalitas Iodine yang sebenarnya dihitung dengan persamaan sebagai berikut :
RUMUS
5) Natrium Thiosulfate 0,025 N
Timbang 6,205 g Na2S2O3 dan larutkan dalam 1000 ml akuades. Larutan ini harus
distandarisasi.
Standarisasi Natrium Thiosulfate :
a. Timbang 2 g KI, masukkan ke dalam erlenmeyer 500 ml.
b. Tambahkan 100 ml aquadest.
c. Tambahkan 10 ml H2SO2 [ 1 + 9] atau 2,5 ml HCl pekat.
e. Encerkan hingga 200 ml dengan akuades.
f. Tambahkan 2 – 3 tetes indikator amylum
g. Titrasi dengan Natrium Thiosulfate 0,025 N sampai terjadi perubahan warna dari biru menjadi tidak berwarna (bening).
h. Perhitungan Normalitas Na-Thiosulfate:
RUMUS
Prosedur pengukuran
1. Ambil 25 ml sampel air dan masukkan pada Erlenmeyer
2. Titrasi dengan iodine sampai terjadi perubahan warna
3. Setelah itu titrasi dengan sodium thiosulfat sampai berubah warna menjadi biru
Perhitungan
Mg/l S = 400 (a-b) / ml sampel
Keterangan
a = ml titrasi 0.025 N iodine
Daftar Pustaka
Anonim. 2012. Suhu. http://wikipedia.com. [2 Febuari 2012]
APHA (American Public Health Association). 1989. Standard Methods for the examination of water and waste water, ….ed. Washington, DC : American Public Health Association.
Boyd CE. 1978. Water Quality Management for Pond Fish Culture. Elsivier Scientific Publising Company. New York.
Ebeling JM, Thomas MB, Bisogni JJ. 2006. Engineering analysis of the stoichiometry of photoautotrophic, autotrophic and heterotrophic removal of ammonia-nitrogen in aquaculture systems. Aquaculture 257 : 346 – 358
Hefni Efendi. 2003. Telaah Kualitas Air bagi Pengelolaan Sumber Daya dan Lingkungan Perairan. Kanisius, Yogyakarta.
Gufhran dkk. 2007. Pengelolaan Kualitas Air Dalam Budidaya Perairan. Rineka Cipta : Jakarta
New MB. 2002. Freshwater Prawn Farming, a Manual for the Culture of Macrobrachium rosenbergii. FAO Tech. Paper. P.125
Sajiah, L. 2003. Pengaruh Surfaktan detergen Linear Alkylbenzena Sulfonate (LAS) Terhadap Perkembangan Stadia Larva sampai dengan Juvenil Ikan Mas. Skripsi. Bogor: Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Stickney RR. 2005. Aquaculture : an introductory text. USA : CABI Publishing.
LAMPIRAN.
Pengoperasian Timbangan
Kalibrasi
1. Bersihkan timbangan, nolkan timbangan dengan menekan “Zero” kemudian tekan tombol “CAL”. Pada layar akan muncul “C”. Jika yang muncul pada layar “CE”, maka nolkan lagi timbangan dan tekan “CAL” lagi sampai “C”
2. Setelah beberapa detik, maka pada layar akan muncul “CC” dan diikuti dengan zero
3. Timbangan berbunyi merupakan tanda dari suksesnya kalibrasi.
Pengukuran
1. Gunakan ON/OFF untuk mematikan atau menghidupkan timbangan.
2. Indikasi bahwa timbangan menyala dengan sempurna adalah munculnya nilai 0,00000g di layarnya
3. Jika nilai 0,00000g tidak muncul, maka timbangan harus dinolkan dengan menekan tombol zero/terra
Teknik pengawetan dan waktu penyimpanan maksimum yang direkomendasikan
Parameter Wadah Pengawetan Waktu pengawetan maks
Pengujian Bahan Organik
Keasaman P, G Dingin, 40C 14 hari
Alkalinitas P, G Dingin, 40C 14 hari
Amonia P, G Dingin, 40C H
Bromida P, G Tidak diperlukan 28 jam
COD P, G Dingin, 40C H
2SO4
sampai pH<2
28 jam
Klorida P, G Tidak diperlukan 28 jam
Klor, residu total
P, G Tidak diperlukan Analisa segera
Warna P, G Dingin, 40C 48 jam
dan untuk klorinasi
sampai pH>12, 0.6 g asam askorbate
Flurida P, G Tidak diperlukan 28 jam
Kesadahan P, G HNO3 sampai pH<2 6 bulan
pH P, G Tidak diperlukan Analisa segera
Nitrogen
Parameter Wadah Pengawetan Waktu penyimpanan maks
Logamd
Botol G Tidak diperlukan Analisa segera
(komponen)
Parameter Wadah Pengawetan Waktu penyimpanan maks
Residu
Sulfit P, G Dingin, 40C Analisa segera
Surfaktan P, G Dingin, 40C 48 jam
Suhu P, G Tidak diperlukan Analisa segera