BAB 2
TINJAUAN PUSTAKA
2.1. Pasir Kuarsa
Pasir kuarsa dikenal dengan nama pasir putih merupakan hasil pelapukan batuan yang mengandung mineral utama seperti kuarsa dan feldsfar. Pasir kuarsa mempunyai komposisi gabungan dari SiO2, Al2O3, CaO, Fe2O3, TiO2, CaO, MgO, dan K2O yang berwarna putih
bening atau warna yang lain bergantung pada senyawa pengotornya (Siswanto, et al., 2012).
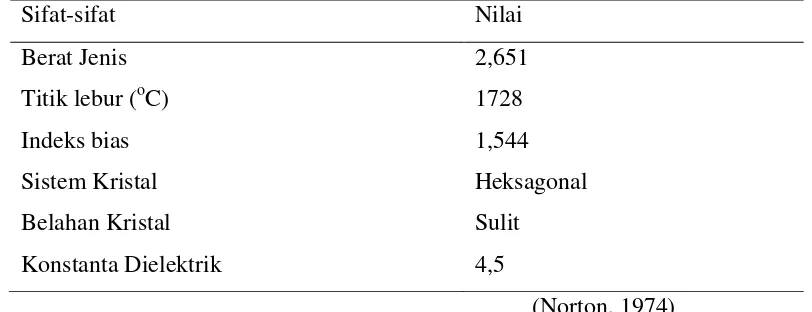
Gambar 2.1. Pasir Kuarsa Tabel 2.1. Sifat-sifat kuarsa
Sifat-sifat Nilai
Berat Jenis 2,651
Titik lebur (oC) 1728
Indeks bias 1,544
Sistem Kristal Heksagonal
Belahan Kristal Sulit
Konstanta Dielektrik 4,5
Pasir kuarsa biasanya dimanfaatkan untuk berbagai keperluan dengan berbagai ukuran tergantung aplikasi yang dibutuhkan seperti dalam industri ban, karet, gelas, semen, beton, keramik, tekstil, kertas, kosmetik, elektronik, cat, film, pasta gigi, dan lain-lain. Saat ini dengan perkembangan teknologi mulai banyak aplikasi penggunaan silika pada industri semakin meningkat terutama dalam penggunaan silika pada ukuran partikel yang kecil sampai ukuran mikron atau bahkan nanosilika. Kondisi ukuran partikel bahan baku yang diperkecil membuat produk memiliki sifat yang berbeda yang dapat meningkatkan kualitas (Siswanto, et al., 2012).
Pasir kuarsa digunakan secara luas dalam industri keramik dan metalurgi. Pasir kuarsa juga dapat digunakan dalam pembuatan batu bahan tahan api dan digunakan dalam skala besar sebagai pembentuk jaringan dalam industri kaca (McColm, 1983).
2.2. Silika (SiO2)
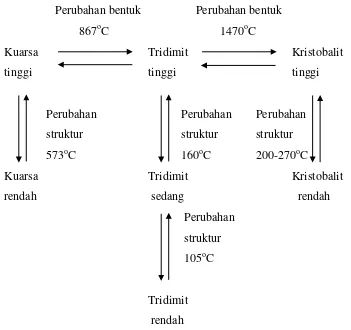
Silika merupakan salah satu dari modifikasi kristal yang paling dikenal sebagai kuarsa. Ada dua puluh dua fasa yang berbeda dari silika yang telah diidentifikasi. Pada suhu 573oC (1063oF) kuarsa yang biasa atau α-kuarsa dapat berubah struktur secara reversible menjadi β -kuarsa yang memiliki densitas yang lebih rendah dan pada suhu 867oC (1593oF), β-kuarsa berubah menjadi suatu modifikasi kristal yang berbeda yaitu β-tridimit yang masih lebih tinggi, pada suhu 1470oC (2678oF), β-tridimit menjadi suatu modifikasi ketiga yang disebut β-kristobalit (Iller, 2007).
Ada tiga bentuk polimorf dari silika berdasarkan kestabilannya terhadap kenaikan suhu tinggi (McColm, 1983), yaitu :
a. Kuarsa, sampai pada suhu 870oC
b. Tridimit, pada suhu 870-1470oC
c. Kristobalit, pada suhu 1470oC sampai titik leburnya 1730oC
sebagai sumber dari silika tetapi penting sebagai bahan yang ditambahkan pada keramik tahan api (Norton, 1974).
Masing-masing dari ketiga bentuk diatas memiliki perubahan pada suhu tinggi dan rendah dimana strukturnya hanya sedikit berubah oleh perubahan yang sederhana pada orientasi dari SiO4 yang relatif tetrahedral satu sama lain. Perubahan bentuk pada suhu tinggi
memiliki simetri yang lebih tinggi atau memiliki unit sel yang lebih kecil daripada perubahan bentuk pada suhu yang rendah (McColm, 1983).
Perubahan bentuk Perubahan bentuk
867oC 1470oC
Kuarsa Tridimit Kristobalit
tinggi tinggi tinggi
Perubahan Perubahan Perubahan struktur struktur struktur 573oC 160oC 200-270oC
Kuarsa Tridimit Kristobalit
rendah sedang rendah
Perubahan struktur 105oC
Tridimit rendah
Gambar 2.2. Perubahan Polimorf dari Silika (Barsoum,1997)
2.3. Silikon
mengalami pelapukan hanya mengandung 9% silikon. Tanah-tanah tropika ini seperti kebanyakan adalah Oxisols dan Ultisols, yang mengandung aluminium oksida dan besi oksida yang tinggi setelah silikon terlarut dan tercuci habis sewaktu proses pelapukan yang intensif. Silikon yang terlarut mengalami represipitasi sebagai mineral sekunder yang merupakan suatu proses penting dalam perkembangan tanah. Sumber utama silikon dalam tanah adalah mineral primer, skunder, dan kuarsa (SiO2). Kuarsa merupakan mineral utama
didalam tanah yang mengandung hingga 90-95% silicon dalam fraksi debu dan pasir (Makarim, at al., 2007)
Silikon tidak tersedia di alam bebas, biasanya bentuk silicon yang tersedia di alam bebas berikatan dengan oksigen (sebagai oksida) contohnya silikon oksida yang terdapat pada pasir kuarsa, batuan kuarsit, dll. Silikon biasanya diklasifikasikan kedalam tiga level kemurnian (Gustiono, et al., 2012), yaitu :
1. Metallurgical Grade Silicon (MG-Si)
Tingkat kemurnian dari Metallurgical Grade Silicon adalah 98%. Metallurgical Grade Silicon biasanya digunakan pada paduan aluminium maupun baju dan sebagai bahan baku untuk industri silikon yang sesuai untuk aplikasi PV.
2. Solar Grade Silicon (SG-Si )
Tingkat kemurnian dari Solar Grade Silicon adalah 99,9999% (biasanya disebut dengan 6N ataupun six nines pure). Solar Grade Silicon biasanya digunakan pada aplikasi PV.
3. Electronic Grade Silicon (EG-Si)
2.4. Metode Reduksi Silika
Ada beberapa motode reduksi silika, antara lain :
1. Reduksi Aluminotermik
Proses reduksi ini menggunakan aluminium sebagai agen pereduksi yang secara umum dikenal sebagai reduksi aluminotermik. Dikarenakan aluminium merupakan sebuah logam yang lebih aktif dari silikon maka, aluminium dapat mereduksi silikon dioksida sehingga dihasilkan silikon. Reaksi ini sangat eksotermik dan kalor yang dilepaskan tersebut cukup untuk mempertahankan reaksi dengan perambatan yang cepat terhadap pembakaran tanpa penambahan energi lagi. Penggunaan reduksi aluminotermik disarankan dalam memproduksi material-material komposit (Das, et al., 2002).
Sintesis material-material komposit dari alumina-aluminium silikon juga disarankan menggunakan reduksi aluminotermik dengan campuran dari Al dan SiO2 sesuai reaksi
berikut:
3 SiO2 + 4 Al Al2O3 + 3 Si
Reaksi ini dapat diterapkan untuk memproduksi silikon. Namun setelah alumina terbentuk melalui reaksi diatas dengan adanya silika, akan memungkinkan dua reaksi lain yang terjadi, yaitu pembentukan mullite dan reduksi silikon dari mullite.
3 Al2O3 + 2 SiO2 Al6Si2O13
8 Al + 3 Al6Si2O13 13 Al2O3 + 6 Si
Pembentukan mullite dan alumina sebagai hasil reduksi dari reduksi aluminotermik tidak cocok dalam suasana asam (Wang and Shi, 2002).
2. Reduksi Karbotermik
SiO2(s) + 4 C(s) Si(s) + 2 CO2(g)
Reaksi yang terjadi pada furnace dibedakan menjadi dua, yaitu reaksi pada inner hot zone dan outer cooler zone. Silikon cair dihasilkan pada inner zone yang mana temperaturnya berkisar antara 1900-2100oC, reaksi kimia yang terjadi adalah:
2 SiO2(l) + SiC(s) 3 SiO(g) + CO(g)
SiO(g) + SiC(s) 2 Si(l) + CO(g)
Pada outer zone dimana temperaturnya dibawah 1900oC, SiO(g) dan CO(g), yang
keluar dari inner zone akan bereaksi dengan karbon bebas (Gustiono, et al., 2012). Reaksinya adalah:
SiO(g) + 2 C(s) SiC(s) + CO(g)
2 SiO(g) Si(l) + SiO2(s)
3. Reduksi Kalsiotermik
Reduksi kalsiotermik sama dengan reduksi aluminotermik. Sebuah proyek penelitian pada reduksi dari silika amorf (yang diperoleh dari sekam padi) menjadi silikon dengan kemurnian yang wajar melalui proses reduksi kalsiotermik menggunakan kalsium telah dilakukan oleh Mishra, et al. (1985). Reaksi yang terjadi sebagai berikut :
SiO2 + 2 Ca 2 CaO + Si
Reduksi dari silika amorf menjadi silikon menggunakan kalsium yang telah dilakukan pada suhu 720oC. Kemurnian silikon akhir yang diperoleh setelah pencucian asam dengan
menggunakan HNO3 dan HF terkonsentrasi adalah sebesar 99.9 persen (Mishra, et al., 1985).
4. Reduksi Magnesiotermik
Silika (SiO2) dapat direduksi oleh magnesium untuk menghasilkan silikon dengan reaksi :
Reaksi dapat melibatkan pembentukan Mg2Si terlebih dahulu, diikuti dengan reduksi
silika oleh Mg2Si melalui reaksi kimia berikut :
SiO2(s) + 4 Mg(s) 2 MgO(s) + Mg2Si(s), ΔGo(900oC) = -308,5 kJ/mol
Mg2Si(s) + SiO2(s) 2 MgO(s) + 2 Si(s), ΔGo(900oC) = -181.8 kJ/mol
Dengan adanya kebihan Mg pada reaktan, Mg2Si akan lebih banyak terbentuk melalui
reaksi :
Si(s) + 2 Mg(s) Mg2Si(s) , ΔGo(900oC) = -308,5 kJ/mol
Bao, et al.(2007) melakukan konversi diatomik (SiO2) menjadi silikon nanokristal
berpori menggunakan Mg pada suhu 650oC, yang merupakan titik lebur Mg.
Dalam keadaan ini, reaksi reduksi terjadi dari lapisan permukaan ke bagian dalam partikel silika yang menghasilkan campuran MgO dan Si. Reduksi relatif secara lambat pada suhu 650oC dan pembentukan fase MgO terkait dengan produk silikon yang menghambat proses pengkasaran substansial dan proses pelengketan hasil silikon (Bao, et al., 2007).
Namun, belum ditemukan aplikasi industri yang luas untuk reduksi magnesiotermik dikarenakan reaksinya yang eksotermis yang menyebabkan peningkatan suhu secara berlebihan dan menghasilkan produk Magnesium Silisit (Mg2Si) dengan produk Si
(Zulumyan, et al., 2006).
Pembentukan Mg2Si dipengaruhi oleh Mg yang berlebih dan suhu reduksi.
Pengurangan jumlah magnesium mengakibatkan pengurangan Mg2Si dan dengan menaikkan
suhu pada perbandingan campuran Mg dan SiO2 akan meningkatkan pembentukan
Mg2Si. Namun dalam studi yang dilakukan oleh Kalem (2004), Mg2SiO4 dalam kondisi
tertentu tidak diperhitungkan. Selain itu, studi kuantitatif pada tahap reduksi hasil tidak dilakukan dan semata-mata didasarkan pada intensitas puncak dari Mg2Si, MgO dan Si
2.5. Pengaruh Suhu dan Waktu Terhadap Laju Reaksi
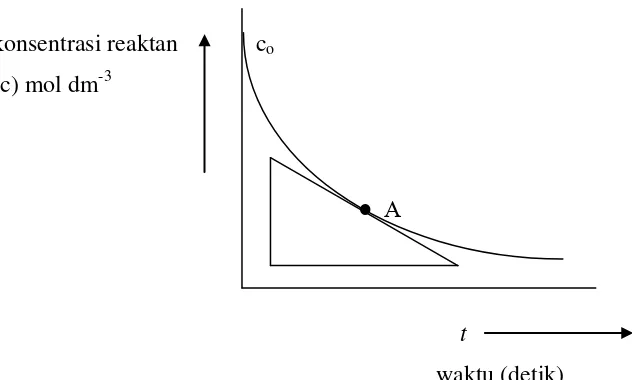
Laju reaksi kimia adalah jumlah mol reaktan per satuan volume yang bereaksi dalam satuan waktu tertentu. Jadi, laju reaksi misalnya dapat dinyatakan dalam satuan mol dm-3 det-1. Bila dibuat sebuah kurva penurunan konsentrasi reaktan sebagai fungsi waktu, maka akan diperoleh kurva yang bentuknya seperti pada Gambar 2.3., dimana dalam hal ini suhu selama reaksi berlangsung dianggap tetap.
konsentrasi reaktan co
(c) mol dm-3
● A
t
waktu (detik)
Gambar 2.3. Kurva konsentrasi sebagai fungsi waktu pada suhu tetap dimana:
co = konsentrasi awal reaktan
laju reaksi pada A = - 𝑑𝑐
𝑑𝑡
Dari kurva terlihat bahwa slop kurva pada setiap titik selalu negatif karena konsentrasi reaktan selalu menurun. Jadi laju reaksi pada setiap titik sepanjang kurva sama dengan – dc/dt. Tetapi, apabila laju reaksi dituliskan sebagai laju pembentukan produk, maka laju reaksi akan bernilai positif. Jika konsentrasi produk setelah reaksi berlangsung t detik adalah x mol dm-3, maka laju reaksinya adalah + dx/dt.
Pengukuran kinetika reaksi pertama kali dilakukan oleh Wilhelmy pada tahun 1850. Beliau menyimpulkan bahwa laju reaksi pada setiap waktu sebanding dengan konsentrasi reaktan yang tersisa pada waktu itu (c), secara matematik dapat ditulis:
-𝑑𝑐
𝑑𝑡 = k1 . c
𝑑𝑐
𝑑𝑡 sering kali disebut sebagai differential rate expression
k1 adalah konstanta laju reaksi (Bird, 1993)
Entalpi (H) merupakan kalor yang diberikan sejumlah dengan perubahan dalam sifat termodinamika yang lain dari sistem pada tekanan tetap. Entalpi suatu zat bertambah jika zat itu dipanaskan. Oleh karena itu, entalpi reaksi berubah dengan perubahan temperatur karena entalpi setiap zat dalam suatu reaksi bervariasi dengan cara yang khas (Atkins, 1996).
2.6. Difraksi Sinar X
Percobaan dengan menggunakan difraksi sinar X kebanyakan terbatas pada zat padat saja. Hasil yang paling baik akan diperoleh apabila digunakan satu kristal tunggal. Tetapi, percobaan difraksi sinar ini dapat pula dilakukan dengan menggunakan padatan dalam bentuk serbuk yang sebenarnya terdiri dari kristal-kristal yang sangat kecil. Atau dapat juga digunakan padatan dalam bentuk kumparan yang biasa digunakan untuk menentukan struktur molekul yang mempunyai ukuran sangat besar seperti DNA, protein, dan sebagainya.
Alat yang digunakan untuk mengukur dan mempelajari difraksi sinar X dinamakan Goniometer. Pada metode kristal tunggal, sebuah Kristal yang berkualitas baik diletakkan sedemikian rupa sehingga dapat berotasi pada salah satu sumbu kristalnya. Ketika kristal itu diputar pada salah satu sumbu Kristal, seberkas sinar X monokhromatik dipancarkan kearah kristal. Ketika kristal berputar, perangkat-perangkat bidang yang ada dalam kristal secara berurutan akan memantulkan berkas sinar X. Berkas sinar X yang dipantulkan ini kemudian direkam pada sebuah piringan fotografik.
menunjukkan struktur molekul yang kita perkirakan masih salah dan dengan membandingkan kedua pola difraksi, kita dapat membuat perbaikan-perbaikan sehingga akhirnya diperoleh struktur molekul yang tepat. Tetapi dalam beberapa kasus, misalnya apabila jumlah atom dalam unit sel sangat banyak, metoda diatas menjadi tidak praktis lagi. Dalam kasus seperti ini biasanya posisi atom atau ion ditentukan berdasarkan intensitas relatif dari spot yang dihasilkan.
Ketika sinar X menumbuk kristal, sebenarnya electron yang terdapat disekeliling atom atau ionlah yang menyebabkan terjadinya pemantulan. Makin banyak jumlah electron yang terdapat disekeliling atom pada suatu bidang, makin besar intensitas pantulan yang disebabkan oleh bidang tersebut dan akan menyebabkan makin jelas spot yang terekam pada film. Dengan menggunakan suatu metoda yang dikenal dengan nama metoda sintesis Fourier, kita dapat menghubungkan intensitas spot dengan kepekatan distribusi elektron yang terdapat dalam unit sel. Dengan mengamati kepekatan distribusi elektron dalam unit sel, kita dapat menduga letak atom dalam unit sel tersebut. Atom akan terletak pada daerah-daerah yang mempunyai kepekatan distribusi elektron maksimum.
Dengan menggunakan metoda difraksi sinar X, struktur molekul yang sangat kompleks dapat ditentukan. Misalnya saja struktur DNA yang sangat kompleks dapat ditentukan dengan metoda sinar X seperti yang telah dilakukan oleh Crick, Wilkins, dan Watson (Bird, 1993).
Ada beberapa faktor yang penting untuk dipertimbangkan dalam mempersiapkan sampel pada analisa kuantitatif XRD, yaitu :
1. Ukuran partikel (atau ukuran kristal)
a. Disarankan kurang dari 5 mikrometer pada diameter (idealnya 1 mikro)
b. Metode tidak harus mengubah struktur kristal (misalnya akibat pemanasan dengan menggiling jika diperlukan)
c. Tidak ada kerugian material
2. Orientasi yang disukai (mengubah intensitas puncak difraksi dapat berakibat buruk pada analisia kuantitatif)
b. Keadaan kristal (lembaran silikat seperti mika) c. Persentase dari orientasi mineral
d. Pegangan kemasan sampel (pada saat pengepakan kembali dan pada saat keadaan berguncang)
3. Pencampuran yang baik dari setiap standar internal yang ditambahkan a. Penambahan sebelum penggilingan
b. Pencampuran secara mekanik (Verrall, 2013)
2.7. Metode Kuantitatif dari Difraksi Sinar X
Ada beberapa metode kuantitatif dari difraksi sinar X, antara lain :
1. Metode berdasarkan kalibrasi sederhana Ci = Ii . Bi . µm
Dimana :
Ci = konsentrasi dari tahap “i”
Ii = Intensitas dari tahap “i”
Bi = Kalibrasi konstan
µm = massa koefisien absorpsi dari pencampuran
a. Metode ini dapat dimodifikasi, misalnya ketika µm adalah sama untuk semua sampel
(menghasilkan sampel)
b. Menggunakan jenis tabung yang benar dapat membantu mengurangi perubahan µm.
Contohnya menggunakan sebuah tabung Co untuk mengurangi variasi µm yang
disebabkan perubahan Fe.
2. Metode berdasarkan kalibrasi sederhana (Pembilasan Matriks)
a. Jika semua fasa diketahui, maka µm dapat ditiadakan sehingga dihasilkan persamaan
dengan rumus (Chung, 1974):
Ci = 𝛴IiI . Bi
b. Untuk mineralogi sederhana secara relatif dimana standar dapat diperoleh dan tumpang tindih bukan merupakan masalah yang besar ketika metode ini berjalan dengan baik.
c. USGS memiliki sebuah program (Rockjock) yang dihasilkan menggunakan Microsoft Excel untuk mengotomatisasikan metode ini.
3. Metode RIR (Reference Intensity Ratio)
a. RIR merupakan perbandingan intensitas dari puncak yang paling kuat pada fasa yang akan diukur dan puncak yang paling intens pada Korundum dalam campuran 50:50 dari fasa dengan Korundum
Bi = IIc
i = 1 RIRi
b. Metode RIR baik digunakan ketika ada satu puncak single dalam pencampuran kompleks yang menarik (periksa nilai RIR sebelum digunakan).
Ci = Ax IIi
x RIRx RIRi
(Keterangan : campuran dengan sejumlah A pada fasa X yang diketahui)
c. Nilai RIR yang tersedia dari ICDD untuk ribuan dari fasa yang paling umum termasuk kebanyakan mineral (hanya Cu)
d. Wp = Sp (ZMV)p / ∑𝑛𝑖=l 𝑆𝑖(ZMV)i