PENINGKATAN KEMURNIAN SILIKON DARI PASIR KUARSA SECARA
MAGNESIOTERMIK DENGAN VARIASI WAKTU
SKRIPSI
SABAM MIKEL SITORUS
090802029
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
PENINGKAKAN KEMURNIAN SILIKON DARI PASIR KUARSA SECARA MAGNESIOTERMIK DENGAN VARIASI WAKTU
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
SABAM MIKEL SITORUS 090802029
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : Peningkatan Kemurnian Silikon dari Pasir Kuarsa
Secara Magnesiotermik Dengan Variasi Waktu
Kategori : Skripsi
Nama : Sabam Mikel Sitorus
NomorIndukMahasiswa : 090802029
Program Studi : Sarjana (S1) Kimia
Departemen : Kimia
Fakultas : Matematika Dan Ilmu Pengetahuan Alam Universitas
Sumatera Utara
Disetujui di
Medan, Agustus 2014
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dra. Saur Lumban Raja. M.Si Dr. Andriayani, M.Si
NIP 195506231986011002 NIP 196903051999032001
Diketahui/Disetujui oleh:
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
PENINGKATKAN KEMURNIAN SILIKON DARI PASIR KUARSA SECARA MAGNESIOTERMIK DENGAN VARIASI WAKTU
SKRIPSI
S
aya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.Medan, Agustus 2014
PENGHARGAAN
Segala puji dan syukur penulis ucapkan kepada Tuhan Yesus Kristus atas segala berkat dan kasih karunia yang dilimpahkan-Nya sehingga penulis diberikan kesanggupan dalam menyelesaikan penelitian dan penyusunan skripsi ini dalam waktu yang telah ditetapkan-Nya.
Pertama, tiada kata yang indah selain ucapan syukur penulis kepada Tuhan Yesus Kristus yang telah memberikan ibunda yang terbaik, Nurbaya Lubis, S.Pd dan ayahanda terhebat, Rosen Sitorus yang telah mendidik penulis dengan penuh kasih dan sayang dan memberikan dukungan yang tiada taranya, adinda tersayang, Laura Jesiska Sitorus dan seluruh keluarga terkhususnya alm. Oppung H. Sitorus yang selalu mendukung melalui doa kepada penulis sehingga dapat menyelesaikan skripsi ini.
Kedua, penulis mengucapkan rasa terima kasih yang sebesar-besarnya kepada ibu Dr. Andriayani, S.Pd,M.Si selaku dosen pembimbing I dan ibu Dra. Saur Lumban Raja, M.Si selaku dosen pembimbing II yang selalu dengan sabar dan ikhlas memberikan bimbingan, saran, pengertian, bahkan bantuan dana kepada penulis dalam melaksanakan penelitian hingga penyelesaian skipsi ini. Begitu juga dengan ibu Dr. Rumondang Bulan, MS dan Bapak Albert Pasaribu, M.Sc selaku ketua dan sekretaris Departemen Kimia FMIPA USU, ibu Dra. Emma Zaidar Nasution, M.Si selaku dosen pembimbing akademik, bapak Dr. Nimpan Bangun, M.Sc selaku Kepala laboratorium Kimia Anorganik FMIPA USU serta seluruh staf dosen yang telah memberikan motivasi dan ilmu yang berguna bagi penulis selama menjadi mahasiswa di FMIPA USU.
Dan yang terakhir, penulis mengucapkan rasa terima kasih kepada Laboran Laboratorium Ilmu Dasar USU: K’ Ayu, asisten Laboratorium Kimia Anorganik, asisten Laboratorium Kimia Organik, asisten Laboratorium Kimia Analitik, Parry, Despita, Naomi, Junita, Iwan, Emilia, Reh Malem, Melda, Sheyla, Nora, Sudirman, dan Royman, Monica G. Samosir, Julfi, Ester, Ruben dan Monica Pangaribuan, Swandy, Swardy, Hardy, Geofry, Randy, Novi Triana, Jessy, Lina, teman-teman seperjuangan 2009 serta adik-adik stambuk 2010, 2011, dan 2012.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan karena keterbatasan yang dimiliki penulis. Semoga skripsi ini dapat bermanfaat bagi penelitian selanjutnya dan kemajuan ilmu pengetahuan.
Penulis,
ABSTRAK
Telah dilakukan penelitian tentang peningkatan kemurnian silikon dari pasir kuarsa secara magnesiotermik dengan variasi waktu. Pasir kuarsa diambil dari pantai Kecamatan Tanjung Tiram, Kabupaten Asahan, Sumatera Utara kemudian dicuci berulang kali sambil digosok-gosok dan dikeringkan. Lalu dihaluskan dan diayak menggunakan ayakan 100 mesh. Pasir kuarsa yang telah dihaluskan ditambahkan HCl dan H2SO4 sambil dipanaskan untuk
melarutkan zat-zat pengotor berupa oksida-oksida logam dan senyawa-senyawa organik sehingga menghasilkan silika (SiO2) berupa padatan berwarna putih kemudian
dikarakterisasi dengan XRD dan SEM. Lalu silika direduksi menjadi silikon secara magnesiotermik dengan perbandingan SiO2 : Mg adalah 1 : 2, pada suhu 800oC dengan
variasi waktu 4 jam, 5 jam, dan 6 jam. Campuran hasil reduksi dimurnikan melalui tiga tahap menggunakan HCl, CH3COOH, dan HF dengan pemanasan pada suhu 80oC selama 3
jam sehingga menghasilkan silikon yang kemudian dianalisa menggunakan XRD, dimana kemurnian silikon pada suhu 800oC selama 4 jam, 5 jam, dan 6 jam adalah 84,0%; 90,4%; dan 94,3%
THE IMPROVEMENT OF PURITY SILICON FROM QUARTZ BY MAGNESIOTERMIC METHOD WITH TIME VARIATION
ABSTRACT
The improvement of purity silicon from quartz by magnesiotermic method with time variation has been researched. Quartz sand was taken from the district of Tanjung Tiram beach, regency of Asahan, North Sumatera and then washed repeatedly with a rubbed and dried. Then it mashed and sieved using a 100 mesh sieve. The quartz sand that had been mashed was added HCl and H2SO4 while heated to dissolve the impurities in the form of
metal oxides and organic compounds to produce silica (SiO2) in the form of white solid and
then characterized by XRD. Then silica reduced to silicon by magnesiotermic method with ratio between silica : magnesium powder was 1 : 2 at the temperature of 800oC with time
variation of 4 hours, 5 hours, and 6 hours. The resulting mixture of reduction was purified through three stages using HCl, CH3COOH, and HF by heating at the temperature of 80oC for
DAFTAR ISI
1. Reduksi Aluminotermik 10
2. Reduksi Karbotermik 11
2.5. Pengaruh Suhu dan Waktu Terhadap Laju Reaksi 13
2.6. Difraksi Sinar X 15
2.7. Metode Kuantitatif dari Difraksi Sinar X 17
1. Metode Kalibrasi Sederhana 17
3.2. Prosedur Penelitian 21
3.2.1. Preparasi Pasir Kuarsa 21
3.2.2. Pemurnian Silika dari Pasir Kuarsa 21
3.2.3. Reduksi Silikon dari Silika 22
3.2.4. Tahap Pemurnian Silikon 22
3.2.4.1. Pemurnian Tahap I 22
3.2.4.2. Pemurnian Tahap II 22
3.2.4.3. Pemurnian Tahap III 22
3.3. Bagan Penelitian 23
BAB 4. HASIL DAN PEMBAHASAN
4.1. Preparasi Pasir Kuarsa 28
4.2. Pemurnian Silika dari Pasir Kuarsa 28
4.3. Reduksi Silika Menjadi Silikon 32
4.4. Tahap Pemurnian Silikon 33
4.4.1. Difraktogram Sinar X dari Silikon Suhu 800oC Selama 4 jam 34
4.4.2. Difraktogram Sinar X dari Silikon Suhu 800oC Selama 5 jam 37
4.4.3. Difraktogram Sinar X dari Silikon Suhu 800oC Selama 6 jam 39
BAB 5. KESIMPULAN DAN SARAN
5.1. Kesimpulan 43
5.2. Saran 43
DAFTAR PUSTAKA 44
DAFTAR TABEL
Tabel 2.1. Sifat-sifat Pasir Kuarsa 8
Tabel 4.1. Peak Difraktogram XRD Silika Ukuran 100 mesh dari Pasir Alam 29 Tabel 4.2. Komposisi Tingkat Kemurnian Silika Ukuran 100 Mesh dari Pasir
Alam Menggunakan Metode RIR 31
Tabel 4.3. Peak Difraktogram XRD Silikon Suhu 800oC Selama 4 jam 35 Tabel 4.4. Komposisi Tingkat Kemurnian Silikon Pada Suhu 8000C Selama
4 jam Menggunakan Metode RIR 35
Tabel 4.5. Peak Difraktogram XRD Silikon Suhu 800oC Selama 5 jam 37 Tabel 4.6. Komposisi Tingkat Kemurnian Silikon Pada Suhu 8000C Selama
5 jam Menggunakan Metode RIR 38
Tabel 4.7. Peak Difraktogram XRD Silikon Suhu 800oC Selama 6 jam 40 Tabel 4.8. Komposisi Tingkat Kemurnian Silikon Pada Suhu 8000C Selama
DAFTAR GAMBAR
Gambar 2.1. Pasir Kuarsa 6
Gambar 2.2. Perubahan Polimorf dari Silika 8
Gambar 2.3. Kurva Konsentrasi Sebagai Fungsi Waktu Pada Suhu Tetap 14 Gambar 4.1. Campuran Silika Dengan Zat-Zat Pengotornya 29 Gambar 4.2. Silika Hasil Pemurnian 29 Gambar 4.3. Difraktogram XRD Silika Ukuran 100 mesh dari Pasir Alam 29 Gambar 4.4. Difraktogram XRD Tingkat Kemurnian Silika (SiO2) dari Pasir Alam
Tanjung Tiram dengan Metode RIR 32
Gambar 4.5. Campuran Hasil Reduksi Silika 33
Gambar 4.6. Campuran Hasil Reduksi Pada Pemurnian Tahap III 34
Gambar 4.7. Silikon Hasil Pemurnian 34
Gambar 4.8. Difraktogram XRD Silikon Suhu 800oC Selama 4 jam 34 Gambar 4.9. Difraktogram XRD Tingkat Kemurnian Silikon Pada Suhu 8000C Selama
4 jam dengan Metode RIR 36
Gambar 4.10. Difraktogram XRD Silikon Suhu 800oC Selama 5 jam 37 Gambar 4.11. Difraktogram XRD Tingkat Kemurnian Silikon Pada Suhu 8000C Selama
5 jam dengan Metode RIR 39
Gambar 4.12. Difraktogram XRD Silikon Suhu 800oC Selama 6 jam 39 Gambar 4.13. Difraktogram XRD Tingkat Kemurnian Silikon Pada Suhu 8000C Selama
DAFTAR LAMPIRAN
ABSTRAK
Telah dilakukan penelitian tentang peningkatan kemurnian silikon dari pasir kuarsa secara magnesiotermik dengan variasi waktu. Pasir kuarsa diambil dari pantai Kecamatan Tanjung Tiram, Kabupaten Asahan, Sumatera Utara kemudian dicuci berulang kali sambil digosok-gosok dan dikeringkan. Lalu dihaluskan dan diayak menggunakan ayakan 100 mesh. Pasir kuarsa yang telah dihaluskan ditambahkan HCl dan H2SO4 sambil dipanaskan untuk
melarutkan zat-zat pengotor berupa oksida-oksida logam dan senyawa-senyawa organik sehingga menghasilkan silika (SiO2) berupa padatan berwarna putih kemudian
dikarakterisasi dengan XRD dan SEM. Lalu silika direduksi menjadi silikon secara magnesiotermik dengan perbandingan SiO2 : Mg adalah 1 : 2, pada suhu 800oC dengan
variasi waktu 4 jam, 5 jam, dan 6 jam. Campuran hasil reduksi dimurnikan melalui tiga tahap menggunakan HCl, CH3COOH, dan HF dengan pemanasan pada suhu 80oC selama 3
jam sehingga menghasilkan silikon yang kemudian dianalisa menggunakan XRD, dimana kemurnian silikon pada suhu 800oC selama 4 jam, 5 jam, dan 6 jam adalah 84,0%; 90,4%; dan 94,3%
THE IMPROVEMENT OF PURITY SILICON FROM QUARTZ BY MAGNESIOTERMIC METHOD WITH TIME VARIATION
ABSTRACT
The improvement of purity silicon from quartz by magnesiotermic method with time variation has been researched. Quartz sand was taken from the district of Tanjung Tiram beach, regency of Asahan, North Sumatera and then washed repeatedly with a rubbed and dried. Then it mashed and sieved using a 100 mesh sieve. The quartz sand that had been mashed was added HCl and H2SO4 while heated to dissolve the impurities in the form of
metal oxides and organic compounds to produce silica (SiO2) in the form of white solid and
then characterized by XRD. Then silica reduced to silicon by magnesiotermic method with ratio between silica : magnesium powder was 1 : 2 at the temperature of 800oC with time
variation of 4 hours, 5 hours, and 6 hours. The resulting mixture of reduction was purified through three stages using HCl, CH3COOH, and HF by heating at the temperature of 80oC for
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Pasir kuarsa dikenal dengan nama pasir putih yang merupakan hasil pelapukan batuan yang mengandung mineral utama seperti kuarsa dan feldsfar. Pasir kuarsa mempunyai komposisi gabungan dari SiO2, Al2O3, CaO, Fe2O3, TiO2, CaO, MgO, dan K2O yang berwarna putih
bening atau warna yang lain bergantung pada senyawa pengotornya (Siswanto, et al., 2012).
Pasir kuarsa banyak tersebar di Indonesia dan banyak ditemukan disepanjang pantai maupun laut. Di Sumatera, cukup banyak ditemukan pasir kuarsa, salah satunya di daerah pantai Kecamatan Tanjung Tiram, Kabupaten Asahan, Sumatera Utara. Pasir kuarsa memiliki banyak kegunaan, diantaranya bahan pembuatan gelas dan keramik dan dapat direduksi menjadi silikon yang memiliki lebih banyak kegunaan di bidang industri. Pada masa sekarang, banyak peneliti di dunia tertarik melakukan penelitian dalam meningkatkan kemurnian silikon dari pasir kuarsa yang berasal dari daerahnya dikarenakan kegunaan silikon yang sangat banyak dan berguna bagi manusia. Tetapi, di Indonesia belum banyak dilakukan penelitian mengenai pemurnian pasir kuarsa yang berasal dari pasir alam Indonesia.
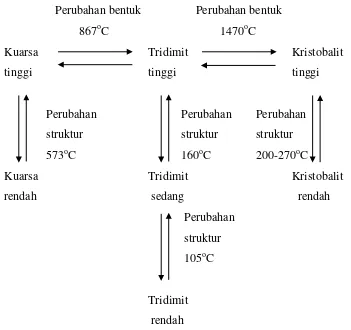
Silika dapat mengalami perubahan bentuk dari kuarsa menjadi tridimit pada suhu 867oC dan tridimit dapat berubah bentuk lagi menjadi kristobalit pada suhu 1470oC.
dan pada bentuk kristobalit, kristobalit dapat mengalami perubahan struktur dari kristobalit tinggi menjadi kristobalit rendah pada suhu 200o-270oC (Barsoum, 1997).
Tingkat kemurnian silikon dapat diklasifikasikan biasanya kedalam tiga level kemurnian, yaitu: 1. Metallurgical Grade Silicon, dengan tingkat kemurnian 98%; 2. Solar Grade Silicon, dengan tingkat kemurnian 99,9999%; dan 3. Electronic Grade Silicon, dengan tingkat kemurnian 99,999999% (Gustiono, et al., 2012).
Telah dilakukan penelitian untuk menghasilkan silikon dari silika melalui beberapa metode reduksi, yaitu: 1. Reduksi Aluminotermik, dimana digunakan logam aluminium yang bersifat lebih aktif dari silikon sehingga bersifat mudah terbakar (Das, et al., 2002); 2. Reduksi Karbotermik, dimana digunakan karbon pada suhu yang sangat tinggi biasanya mencapai suhu 2100oC (Gustiono, et al., 2012); 3. Reduksi Kalsiotermik, dimana digunakan logam kalsium, prosesnya sama dengan reduksi aluminotermik (Mishra, et al., 1985); dan 4. Reduksi Magnesiotermik, dimana digunakan logam magnesium yang digunakan pada suhu yang tidak terlalu tinggi (Sadique, 2010).
Sadique (2010) telah melakukan reduksi abu silika (fume silica) dengan metode reduksi secara magnesiotermik menggunakan tanur elektrik pada suhu optimum 750o-850oC yang menghasilkan kadar silikon yang mencapai 99%.
Email, et al. (2013) telah melakukan penelitian mengenai ekstraksi dan kuantifikasi silikon dari pasir silika yang diambil dari Sungai Zauma, Zamfara State, Nigeria , dimana dihasilkan kadar silika sebesar 81,5% dan kadar silikon sebesar 77%.
Manullang (2012) telah melakukan studi isolasi silikon dari pasir alam yang berasal dari Kecamatan Tanjung Tiram, Kabupaten Asahan, Sumatera Utara dimana ukuran partikel dari pasir kuarsa yang digunakan adalah 80-120 mesh, reaksi yang dilakukan pada proses pemurnian silika dari pasir alam dalam kondisi suhu kamar, pada proses reduksi silika menjadi silikon secara magnesiotermik pada tanur listrik menggunakan suhu 750oC selama 2
Berdasarkan penelitian terdahulu, maka peneliti akan melakukan optimalisasi kondisi reaksi pada proses isolasi silikon dari pasir alam yang berasal dari Kecamatan Tanjung Tiram, Kabupaten Asahan, Sumatera Utara. Pada proses pemurnian silika dari pasir alam dilakukan pemanasan pada suhu 80oC selama 30 menit, pada proses reduksi silika menjadi silikon secara magnesiotermik menggunakan suhu 800oC di dalam tanur dengan variasi
waktu 4 jam, 5 jam dan 6 jam dan pada tahap pelindian dilakukan pemanasan pada suhu 80oC
selama 3 jam.
1.2. Permasalahan
Yang menjadi permasalahan dari penelitian ini adalah:
1. Bagaimana pengaruh pemanasan pada tahap pemurnian silika dari pasir kuarsa terhadap tingkat kemurnian silika
2. Bagaimana pengaruh waktu pada proses reduksi silika dan pengaruh pemanasan pada tahap pemurnian silikon terhadap tingkat kemurnian silikon
1.3. Pembatasan Masalah
Peneliti menggunakan pasir kuarsa yang berasal dari Kecamatan Tanjung Tiram, Kabupaten Asahan, Sumatera Utara. Untuk mendapatkan silikon digunakan metode reduksi secara magnesiotermik pada suhu 800oC dengan variasi waktu 4 jam, 5 jam, dan 6 jam.
1.4. Tujuan Penelitian
Yang menjadi tujuan dari penelitian ini adalah:
2. Meningkatkan kemurnian silikon dengan melakukan variasi waktu pada proses reduksi silika dengan pemanasan pada suhu 800oC dan melakukan pemanasan pada tahap pemurniannya (tahap pelindian).
1.5. Manfaat Penelitian
Yang menjadi manfaat dari hasil penelitian ini adalah:
1. Meningkatkan nilai ekonomis dari pasir kuarsa yang berasal dari Kabupaten Asahan, Sumatera Utara.
2. Memberikan informasi teknik isolasi silika dari pasir kuarsa menggunakan proses reduksi secara magnesiotermik.
1.6. Lokasi Penelitian
Bahan pasir kuarsa diperoleh dari Kecamatan Tanjung Tiram, Kabupaten Asahan, Sumatera Utara. Penelitian ini dilakukan di Laboratorium Kimia Anorganik FMIPA USU, Medan, Laboratorium Ilmu Dasar USU, Medan dan Laboratorium Penelitian (LP) USU, Medan. Karakterisasi XRD dilakukan di Universitas Negeri Yogyakarta (UNY).
1.7. Metodologi Penelitian
Pasir kuarsa dibersihkan dan dibuat dalam ukuran partikel 100 mesh. Kemudian dimurnikan menjadi silika dengan penambahan HCl(p) dan H2SO4(p) untuk melarutkan zat-zat pengotor
berupa oksida-oksida logam dan senyawa-senyawa organik lalu dikarakterisasi dengan XRD. Silika yang diperoleh kemudian direduksi secara magnesiotermik menjadi silikon dimana silika ditambahkan serbuk magnesium dengan perbandingan 1:2 dan dicampur merata serta dipanaskan dalam tanur listrik pada suhu 800oC masing-masing selama 4 jam, 5 jam, dan 6
jam. Campuran hasil reduksi kemudian dimurnikan melalui 3 tahap, yaitu dengan penambahan HCl 2N, CH3COOH 25% dan HF 4,8%. Padatan hasil pemurniannya kemudian
BAB 2
TINJAUAN PUSTAKA
2.1. Pasir Kuarsa
Pasir kuarsa dikenal dengan nama pasir putih merupakan hasil pelapukan batuan yang mengandung mineral utama seperti kuarsa dan feldsfar. Pasir kuarsa mempunyai komposisi gabungan dari SiO2, Al2O3, CaO, Fe2O3, TiO2, CaO, MgO, dan K2O yang berwarna putih
bening atau warna yang lain bergantung pada senyawa pengotornya (Siswanto, et al., 2012).
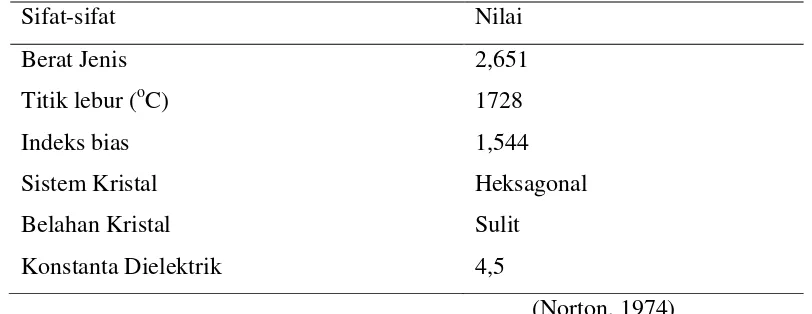
Gambar 2.1. Pasir Kuarsa Tabel 2.1. Sifat-sifat kuarsa
Sifat-sifat Nilai
Berat Jenis 2,651
Titik lebur (oC) 1728
Indeks bias 1,544
Sistem Kristal Heksagonal
Belahan Kristal Sulit
Konstanta Dielektrik 4,5
Pasir kuarsa biasanya dimanfaatkan untuk berbagai keperluan dengan berbagai ukuran tergantung aplikasi yang dibutuhkan seperti dalam industri ban, karet, gelas, semen, beton, keramik, tekstil, kertas, kosmetik, elektronik, cat, film, pasta gigi, dan lain-lain. Saat ini dengan perkembangan teknologi mulai banyak aplikasi penggunaan silika pada industri semakin meningkat terutama dalam penggunaan silika pada ukuran partikel yang kecil sampai ukuran mikron atau bahkan nanosilika. Kondisi ukuran partikel bahan baku yang diperkecil membuat produk memiliki sifat yang berbeda yang dapat meningkatkan kualitas (Siswanto, et al., 2012).
Pasir kuarsa digunakan secara luas dalam industri keramik dan metalurgi. Pasir kuarsa juga dapat digunakan dalam pembuatan batu bahan tahan api dan digunakan dalam skala besar sebagai pembentuk jaringan dalam industri kaca (McColm, 1983).
2.2. Silika (SiO2)
Silika merupakan salah satu dari modifikasi kristal yang paling dikenal sebagai kuarsa. Ada dua puluh dua fasa yang berbeda dari silika yang telah diidentifikasi. Pada suhu 573oC (1063oF) kuarsa yang biasa atau α-kuarsa dapat berubah struktur secara reversible menjadi β -kuarsa yang memiliki densitas yang lebih rendah dan pada suhu 867oC (1593oF), β-kuarsa berubah menjadi suatu modifikasi kristal yang berbeda yaitu β-tridimit yang masih lebih tinggi, pada suhu 1470oC (2678oF), β-tridimit menjadi suatu modifikasi ketiga yang disebut
β-kristobalit (Iller, 2007).
Ada tiga bentuk polimorf dari silika berdasarkan kestabilannya terhadap kenaikan suhu tinggi (McColm, 1983), yaitu :
a. Kuarsa, sampai pada suhu 870oC
b. Tridimit, pada suhu 870-1470oC
c. Kristobalit, pada suhu 1470oC sampai titik leburnya 1730oC
sebagai sumber dari silika tetapi penting sebagai bahan yang ditambahkan pada keramik tahan api (Norton, 1974).
Masing-masing dari ketiga bentuk diatas memiliki perubahan pada suhu tinggi dan rendah dimana strukturnya hanya sedikit berubah oleh perubahan yang sederhana pada orientasi dari SiO4 yang relatif tetrahedral satu sama lain. Perubahan bentuk pada suhu tinggi
memiliki simetri yang lebih tinggi atau memiliki unit sel yang lebih kecil daripada perubahan bentuk pada suhu yang rendah (McColm, 1983).
Perubahan bentuk Perubahan bentuk
867oC 1470oC
Kuarsa Tridimit Kristobalit
tinggi tinggi tinggi
Perubahan Perubahan Perubahan struktur struktur struktur 573oC 160oC 200-270oC
Kuarsa Tridimit Kristobalit
rendah sedang rendah
Gambar 2.2. Perubahan Polimorf dari Silika (Barsoum,1997)
2.3. Silikon
mengalami pelapukan hanya mengandung 9% silikon. Tanah-tanah tropika ini seperti kebanyakan adalah Oxisols dan Ultisols, yang mengandung aluminium oksida dan besi oksida yang tinggi setelah silikon terlarut dan tercuci habis sewaktu proses pelapukan yang intensif. Silikon yang terlarut mengalami represipitasi sebagai mineral sekunder yang merupakan suatu proses penting dalam perkembangan tanah. Sumber utama silikon dalam tanah adalah mineral primer, skunder, dan kuarsa (SiO2). Kuarsa merupakan mineral utama
didalam tanah yang mengandung hingga 90-95% silicon dalam fraksi debu dan pasir (Makarim, at al., 2007)
Silikon tidak tersedia di alam bebas, biasanya bentuk silicon yang tersedia di alam bebas berikatan dengan oksigen (sebagai oksida) contohnya silikon oksida yang terdapat pada pasir kuarsa, batuan kuarsit, dll. Silikon biasanya diklasifikasikan kedalam tiga level kemurnian (Gustiono, et al., 2012), yaitu :
1. Metallurgical Grade Silicon (MG-Si)
Tingkat kemurnian dari Metallurgical Grade Silicon adalah 98%. Metallurgical Grade Silicon biasanya digunakan pada paduan aluminium maupun baju dan sebagai bahan baku untuk industri silikon yang sesuai untuk aplikasi PV.
2. Solar Grade Silicon (SG-Si )
Tingkat kemurnian dari Solar Grade Silicon adalah 99,9999% (biasanya disebut dengan 6N ataupun six nines pure). Solar Grade Silicon biasanya digunakan pada aplikasi PV.
3. Electronic Grade Silicon (EG-Si)
2.4. Metode Reduksi Silika
Ada beberapa motode reduksi silika, antara lain :
1. Reduksi Aluminotermik
Proses reduksi ini menggunakan aluminium sebagai agen pereduksi yang secara umum dikenal sebagai reduksi aluminotermik. Dikarenakan aluminium merupakan sebuah logam yang lebih aktif dari silikon maka, aluminium dapat mereduksi silikon dioksida sehingga dihasilkan silikon. Reaksi ini sangat eksotermik dan kalor yang dilepaskan tersebut cukup untuk mempertahankan reaksi dengan perambatan yang cepat terhadap pembakaran tanpa penambahan energi lagi. Penggunaan reduksi aluminotermik disarankan dalam memproduksi material-material komposit (Das, et al., 2002).
Sintesis material-material komposit dari alumina-aluminium silikon juga disarankan menggunakan reduksi aluminotermik dengan campuran dari Al dan SiO2 sesuai reaksi
berikut:
3 SiO2 + 4 Al Al2O3 + 3 Si
Reaksi ini dapat diterapkan untuk memproduksi silikon. Namun setelah alumina terbentuk melalui reaksi diatas dengan adanya silika, akan memungkinkan dua reaksi lain yang terjadi, yaitu pembentukan mullite dan reduksi silikon dari mullite.
3 Al2O3 + 2 SiO2 Al6Si2O13
8 Al + 3 Al6Si2O13 13 Al2O3 + 6 Si
Pembentukan mullite dan alumina sebagai hasil reduksi dari reduksi aluminotermik tidak cocok dalam suasana asam (Wang and Shi, 2002).
2. Reduksi Karbotermik
SiO2(s) + 4 C(s) Si(s) + 2 CO2(g)
Reaksi yang terjadi pada furnace dibedakan menjadi dua, yaitu reaksi pada inner hot zone dan outer cooler zone. Silikon cair dihasilkan pada inner zone yang mana temperaturnya berkisar antara 1900-2100oC, reaksi kimia yang terjadi adalah:
2 SiO2(l) + SiC(s) 3 SiO(g) + CO(g)
SiO(g) + SiC(s) 2 Si(l) + CO(g)
Pada outer zone dimana temperaturnya dibawah 1900oC, SiO(g) dan CO(g), yang
keluar dari inner zone akan bereaksi dengan karbon bebas (Gustiono, et al., 2012). Reaksinya adalah:
SiO(g) + 2 C(s) SiC(s) + CO(g)
2 SiO(g) Si(l) + SiO2(s)
3. Reduksi Kalsiotermik
Reduksi kalsiotermik sama dengan reduksi aluminotermik. Sebuah proyek penelitian pada reduksi dari silika amorf (yang diperoleh dari sekam padi) menjadi silikon dengan kemurnian yang wajar melalui proses reduksi kalsiotermik menggunakan kalsium telah dilakukan oleh Mishra, et al. (1985). Reaksi yang terjadi sebagai berikut :
SiO2 + 2 Ca 2 CaO + Si
Reduksi dari silika amorf menjadi silikon menggunakan kalsium yang telah dilakukan pada suhu 720oC. Kemurnian silikon akhir yang diperoleh setelah pencucian asam dengan
menggunakan HNO3 dan HF terkonsentrasi adalah sebesar 99.9 persen (Mishra, et al., 1985).
4. Reduksi Magnesiotermik
Silika (SiO2) dapat direduksi oleh magnesium untuk menghasilkan silikon dengan reaksi :
Reaksi dapat melibatkan pembentukan Mg2Si terlebih dahulu, diikuti dengan reduksi
silika oleh Mg2Si melalui reaksi kimia berikut :
SiO2(s) + 4 Mg(s) 2 MgO(s) + Mg2Si(s), ΔGo(900oC) = -308,5 kJ/mol
Mg2Si(s) + SiO2(s) 2 MgO(s) + 2 Si(s), ΔGo(900oC) = -181.8 kJ/mol
Dengan adanya kebihan Mg pada reaktan, Mg2Si akan lebih banyak terbentuk melalui
reaksi :
Si(s) + 2 Mg(s) Mg2Si(s) , ΔGo(900oC) = -308,5 kJ/mol
Bao, et al.(2007) melakukan konversi diatomik (SiO2) menjadi silikon nanokristal
berpori menggunakan Mg pada suhu 650oC, yang merupakan titik lebur Mg.
Dalam keadaan ini, reaksi reduksi terjadi dari lapisan permukaan ke bagian dalam partikel silika yang menghasilkan campuran MgO dan Si. Reduksi relatif secara lambat pada suhu 650oC dan pembentukan fase MgO terkait dengan produk silikon yang menghambat proses pengkasaran substansial dan proses pelengketan hasil silikon (Bao, et al., 2007).
Namun, belum ditemukan aplikasi industri yang luas untuk reduksi magnesiotermik dikarenakan reaksinya yang eksotermis yang menyebabkan peningkatan suhu secara berlebihan dan menghasilkan produk Magnesium Silisit (Mg2Si) dengan produk Si
(Zulumyan, et al., 2006).
Pembentukan Mg2Si dipengaruhi oleh Mg yang berlebih dan suhu reduksi.
Pengurangan jumlah magnesium mengakibatkan pengurangan Mg2Si dan dengan menaikkan
suhu pada perbandingan campuran Mg dan SiO2 akan meningkatkan pembentukan
Mg2Si. Namun dalam studi yang dilakukan oleh Kalem (2004), Mg2SiO4 dalam kondisi
tertentu tidak diperhitungkan. Selain itu, studi kuantitatif pada tahap reduksi hasil tidak dilakukan dan semata-mata didasarkan pada intensitas puncak dari Mg2Si, MgO dan Si
2.5. Pengaruh Suhu dan Waktu Terhadap Laju Reaksi
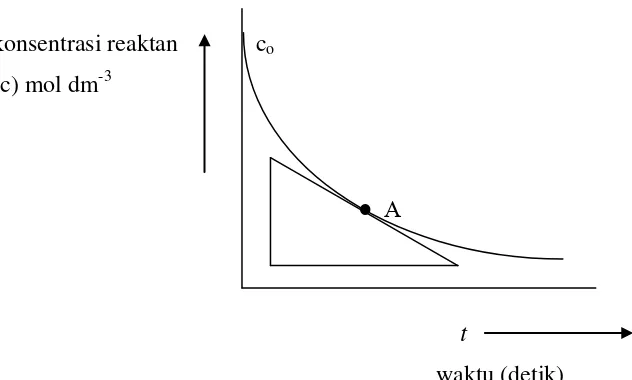
Laju reaksi kimia adalah jumlah mol reaktan per satuan volume yang bereaksi dalam satuan waktu tertentu. Jadi, laju reaksi misalnya dapat dinyatakan dalam satuan mol dm-3 det-1. Bila dibuat sebuah kurva penurunan konsentrasi reaktan sebagai fungsi waktu, maka akan diperoleh kurva yang bentuknya seperti pada Gambar 2.3., dimana dalam hal ini suhu selama reaksi berlangsung dianggap tetap.
Gambar 2.3. Kurva konsentrasi sebagai fungsi waktu pada suhu tetap dimana:
co = konsentrasi awal reaktan
laju reaksi pada A = - ��
��
Dari kurva terlihat bahwa slop kurva pada setiap titik selalu negatif karena konsentrasi reaktan selalu menurun. Jadi laju reaksi pada setiap titik sepanjang kurva sama dengan – dc/dt. Tetapi, apabila laju reaksi dituliskan sebagai laju pembentukan produk, maka laju reaksi akan bernilai positif. Jika konsentrasi produk setelah reaksi berlangsung t detik adalah x mol dm-3, maka laju reaksinya adalah + dx/dt.
Pengukuran kinetika reaksi pertama kali dilakukan oleh Wilhelmy pada tahun 1850. Beliau menyimpulkan bahwa laju reaksi pada setiap waktu sebanding dengan konsentrasi reaktan yang tersisa pada waktu itu (c), secara matematik dapat ditulis:
- ��
�� = k1 . c
��
�� sering kali disebut sebagai differential rate expression
k1 adalah konstanta laju reaksi (Bird, 1993)
Entalpi (H) merupakan kalor yang diberikan sejumlah dengan perubahan dalam sifat termodinamika yang lain dari sistem pada tekanan tetap. Entalpi suatu zat bertambah jika zat itu dipanaskan. Oleh karena itu, entalpi reaksi berubah dengan perubahan temperatur karena entalpi setiap zat dalam suatu reaksi bervariasi dengan cara yang khas (Atkins, 1996).
2.6. Difraksi Sinar X
Percobaan dengan menggunakan difraksi sinar X kebanyakan terbatas pada zat padat saja. Hasil yang paling baik akan diperoleh apabila digunakan satu kristal tunggal. Tetapi, percobaan difraksi sinar ini dapat pula dilakukan dengan menggunakan padatan dalam bentuk serbuk yang sebenarnya terdiri dari kristal-kristal yang sangat kecil. Atau dapat juga digunakan padatan dalam bentuk kumparan yang biasa digunakan untuk menentukan struktur molekul yang mempunyai ukuran sangat besar seperti DNA, protein, dan sebagainya.
Alat yang digunakan untuk mengukur dan mempelajari difraksi sinar X dinamakan Goniometer. Pada metode kristal tunggal, sebuah Kristal yang berkualitas baik diletakkan sedemikian rupa sehingga dapat berotasi pada salah satu sumbu kristalnya. Ketika kristal itu diputar pada salah satu sumbu Kristal, seberkas sinar X monokhromatik dipancarkan kearah kristal. Ketika kristal berputar, perangkat-perangkat bidang yang ada dalam kristal secara berurutan akan memantulkan berkas sinar X. Berkas sinar X yang dipantulkan ini kemudian direkam pada sebuah piringan fotografik.
menunjukkan struktur molekul yang kita perkirakan masih salah dan dengan membandingkan kedua pola difraksi, kita dapat membuat perbaikan-perbaikan sehingga akhirnya diperoleh struktur molekul yang tepat. Tetapi dalam beberapa kasus, misalnya apabila jumlah atom dalam unit sel sangat banyak, metoda diatas menjadi tidak praktis lagi. Dalam kasus seperti ini biasanya posisi atom atau ion ditentukan berdasarkan intensitas relatif dari spot yang dihasilkan.
Ketika sinar X menumbuk kristal, sebenarnya electron yang terdapat disekeliling atom atau ionlah yang menyebabkan terjadinya pemantulan. Makin banyak jumlah electron yang terdapat disekeliling atom pada suatu bidang, makin besar intensitas pantulan yang disebabkan oleh bidang tersebut dan akan menyebabkan makin jelas spot yang terekam pada film. Dengan menggunakan suatu metoda yang dikenal dengan nama metoda sintesis Fourier, kita dapat menghubungkan intensitas spot dengan kepekatan distribusi elektron yang terdapat dalam unit sel. Dengan mengamati kepekatan distribusi elektron dalam unit sel, kita dapat menduga letak atom dalam unit sel tersebut. Atom akan terletak pada daerah-daerah yang mempunyai kepekatan distribusi elektron maksimum.
Dengan menggunakan metoda difraksi sinar X, struktur molekul yang sangat kompleks dapat ditentukan. Misalnya saja struktur DNA yang sangat kompleks dapat ditentukan dengan metoda sinar X seperti yang telah dilakukan oleh Crick, Wilkins, dan Watson (Bird, 1993).
Ada beberapa faktor yang penting untuk dipertimbangkan dalam mempersiapkan sampel pada analisa kuantitatif XRD, yaitu :
1. Ukuran partikel (atau ukuran kristal)
a. Disarankan kurang dari 5 mikrometer pada diameter (idealnya 1 mikro)
b. Metode tidak harus mengubah struktur kristal (misalnya akibat pemanasan dengan menggiling jika diperlukan)
c. Tidak ada kerugian material
2. Orientasi yang disukai (mengubah intensitas puncak difraksi dapat berakibat buruk pada analisia kuantitatif)
b. Keadaan kristal (lembaran silikat seperti mika) c. Persentase dari orientasi mineral
d. Pegangan kemasan sampel (pada saat pengepakan kembali dan pada saat keadaan berguncang)
3. Pencampuran yang baik dari setiap standar internal yang ditambahkan a. Penambahan sebelum penggilingan
b. Pencampuran secara mekanik (Verrall, 2013)
2.7. Metode Kuantitatif dari Difraksi Sinar X
Ada beberapa metode kuantitatif dari difraksi sinar X, antara lain :
1. Metode berdasarkan kalibrasi sederhana Ci = Ii . Bi . µm
Dimana :
Ci = konsentrasi dari tahap “i”
Ii = Intensitas dari tahap “i”
Bi = Kalibrasi konstan
µm = massa koefisien absorpsi dari pencampuran
a. Metode ini dapat dimodifikasi, misalnya ketika µm adalah sama untuk semua sampel
(menghasilkan sampel)
b. Menggunakan jenis tabung yang benar dapat membantu mengurangi perubahan µm.
Contohnya menggunakan sebuah tabung Co untuk mengurangi variasi µm yang
disebabkan perubahan Fe.
2. Metode berdasarkan kalibrasi sederhana (Pembilasan Matriks)
a. Jika semua fasa diketahui, maka µm dapat ditiadakan sehingga dihasilkan persamaan
dengan rumus (Chung, 1974):
Ci = �IiI . Bi
b. Untuk mineralogi sederhana secara relatif dimana standar dapat diperoleh dan tumpang tindih bukan merupakan masalah yang besar ketika metode ini berjalan dengan baik.
c. USGS memiliki sebuah program (Rockjock) yang dihasilkan menggunakan Microsoft Excel untuk mengotomatisasikan metode ini.
3. Metode RIR (Reference Intensity Ratio)
a. RIR merupakan perbandingan intensitas dari puncak yang paling kuat pada fasa yang akan diukur dan puncak yang paling intens pada Korundum dalam campuran 50:50 dari fasa dengan Korundum
Bi = IIc
i =
1 RIRi
b. Metode RIR baik digunakan ketika ada satu puncak single dalam pencampuran kompleks yang menarik (periksa nilai RIR sebelum digunakan).
Ci = Ax IIi
x
RIRx
RIRi
(Keterangan : campuran dengan sejumlah A pada fasa X yang diketahui)
c. Nilai RIR yang tersedia dari ICDD untuk ribuan dari fasa yang paling umum termasuk kebanyakan mineral (hanya Cu)
d. Wp = Sp (ZMV)p / ∑��=l ��(ZMV)i
Dimana Wp merupakan fraksi berat relatif dari fasa “p” dalam pencampuran dari
BAB 3
METODE PENELITIAN
3.1. Alat dan Bahan
3.1.1. Alat-Alat
1. Alu dan lumpang -
2. Ayakan 100 mesh
3. Botol vial -
4. Cawan besi -
5. Difraktometer Sinar X Shimadzu
6. Gabus karet -
7. Hotplate stirrer Thermolyte
8. Kertas saring Whatman no. 42
9. Neraca analitis Ohauss
10.Magnetic stirrer -
11. Peralatan Gelas Pyrex
12. Pipet tetes -
13. Spatula -
14. Statif dan Klem -
15. Tanur Fisher
16. Termometer Boeco 360oC
3.1.2. Bahan-Bahan
1. HCl(p) p.a E’merck
4. CH3COOH(p) p.a E’merck
5. HF(p) p.a E’merck
6. Pasir kuarsa -
7. Akuades -
8. Akuabides -
3.2. Prosedur Penelitian
3.2.1. Preparasi Pasir Kuarsa
Pasir kuarsa dihaluskan dengan menggunakan alu dan lumpang kemudian diayak dengan menggunakan ayakan 100 mesh.
3.2.2. Pemurnian Silika dari Pasir Kuarsa
Pasir kuarsa ukuran 100 mesh sebanyak 100 g dipanaskan pada suhu 150-200oC selama 1 jam dan ditambahkan 200 mL H2SO4(p) sehingga diperoleh suspensi berwarna hitam kecokelatan.
Suspensi ini kemudian dipanaskan kembali pada suhu 150-200oC selama 45 menit, lalu didinginkan dan dicuci berulang kali. Padatannya ditambahkan 200 mL HCl(p), dipanaskan
pada suhu 80oC sambil distirer selama 30 menit lalu dicuci dengan akuades berulang kali. Padatannya kemudian ditambahkan 200 mL H2SO4(p) , dipanaskan pada suhu 80oC sambil
distirer selama 30 menit lalu dicuci dengan akuades berulang kali. Padatannya kemudian dikeringkan, ditimbang lalu dikarakterisasi dengan XRD.
3.2.3. Reduksi Silikon dari Silika
Silika sebanyak 10 g dan serbuk magnesium sebanyak 8 g dicampur merata didalam cawan besi. Campuran itu kemudian dipanaskan dalam tanur pada suhu 800oC dengan variasi waktu
3.2.4. Pemurnian Hasil Reduksi
3.2.4.1. Pemurnian Tahap I
Campuran hasil reduksi dimasukkan kedalam beaker glass dan ditambahkan 150 mL HCl 2N lalu dipanaskan pada suhu 80oC sambil distirer selama 3 jam kemudian didinginkan dan
disaring. Padatannya dicuci dengan 150 mL akuabides, dikeringkan dan ditimbang.
3.2.4.2. Pemurnian Tahap II
Padatan hasil pemurnian tahap I dimasukkan kedalam gelas beaker lalu ditambahkan 50 mL HCl 2N dan 150 mL CH3COOH 25% kemudian dipanaskan pada suhu 80oC sambil distirer
selama 3 jam, didinginkan dan disaring. Padatannya dicuci dengan 150 mL akuabides, dikeringkan dan ditimbang.
3.2.4.3. Pemurnian Tahap III
Padatan hasil pemurnian tahap II dimasukkan kedalam gelas beaker lalu ditambahkan 50 mL CH3COOH 25% dan 150 mL HF 4,8% kemudian dipanaskan pada suhu 80oC sambil distirer
3.3. Bagan Penelitian
3.3.1. Preparasi Pasir Kuarsa
Dicuci berulang kali sambil digosok-gosok Dikeringkan
Dihaluskan menggunakan alu dan lumpang Diayak dengan menggunakan ayakan 100 mesh
Pasir kuarsa
3.3.2. Pemurnian Silika dari Pasir Kuarsa
Dimasukkan kedalam labu leher tiga
Dipanaskan pada suhu 150-200oC selama 1 jam
Ditambahkan 200 ml H2SO4(p)
Dipanaskan pada suhu 150-200oC sambil distirer
selama 45 menit Didinginkan
Dicuci dengan akuades berulang kali
Ditambahkan 200 mL HCl(p)
Dipanaskan pada suhu 80oC sambil distirer selama 30 menit
Dicuci dengan akuades berulang kali
Ditambahkan 200 mL H2SO4(p)
Dipanaskan pada suhu 80oC sambil distirer selama 30 menit
Dicuci dengan akuades berulang kali
Dikeringkan Ditimbang
Dikarakterisasi dengan XRD 100 g pasir kuarsa (100 mesh)
Suspensi Hitam Kecokelatan
Filtrat
Padatan Silika Filtrat
Filtrat
Hasil Padatan Silika
3.3.3. Reduksi Silika Menjadi Silikon
Dicampur merata didalam cawan besi Dipanaskan dalam tanur pada suhu 800oC
selama 4 jam Dibiarkan 1 malam
Catatan : Dilakukan prosedur yang sama untuk variasi waktu 5 jam dan 6 jam
3.3.4. Tahap Pemurnian Silikon
a. Tahap I : Pelindian dengan penambahan HCl 2N
Dimasukkan kedalam gelas beaker Ditambahkan 150 mL HCl 2N
Dipanaskan pada suhu 80oC sambil distirer selama 3 jam
Didinginkan Disaring
Dicuci dengan 150 mL akuabides Dikeringkan
Ditimbang
Padatan Filtrat
Padatan
10 g Silika 8 g Magnesium Powder
b. Tahap II : Pelindian dengan penambahan HCl 2N dan CH3COOH 25%
Dimasukkan kedalam gelas beaker Ditambahkan 50 mL HCl 2N
Ditambahkan 150 mL CH3COOH 25%
Dipanaskan pada suhu 80oC sambil
distirer selama 3 jam Didinginkan
Disaring
Dicuci dengan 150 mL akuabides Dikeringkan
Ditimbang
Padatan Filtrat
Padatan Hasil Pemurnian Tahap I
c. Tahap III : Pelindian dengan penambahan CH3COOH 25% dan HF 4,8%
Dimasukkan kedalam gelas beaker Ditambahkan 50 mL CH3COOH 25%
Ditambahkan 150 mL HF 4,8% Dipanaskan pada suhu 80oC sambil
distirer selama 3 jam Didinginkan
Disaring
Dicuci dengan 150 mL akuabides Dikeringkan
Ditimbang
Dikarakterisasi dengan XRD
Padatan Filtrat
Hasil
BAB 4
HASIL DAN PEMBAHASAN
4.1. Preparasi Pasir Kuarsa
Pasir kuarsa yang berasal dari pantai kecamatan Tanjung Tiram, Kabupaten Asahan, Sumatera Utara, dicuci berulang kali dengan air keran sambil digosok-gosok agar diperoleh pasir kuarsa yang bersih lalu dikeringkan. Kemudian dihaluskan menggunakan alu dan lumpang untuk memperluas permukaannya dan diayak menggunakan ayakan 100 mesh sehingga dihasilkan pasir kuarsa yang berukuran 100 mesh.
4.2. Pemurnian Silika dari Pasir Kuarsa
Pasir kuarsa yang berukuran 100 mesh dipanaskan pada suhu 150-200oC untuk menghilangkan kadar airnya lalu dimurnikan dari zat-zat pengotornya berupa senyawa-senyawa organik dan oksida-oksida logam. Senyawa-senyawa-senyawa organik dilarutkan dengan penambahan H2SO4(p) sehingga akan terkarbonisasi dan dipisahkan dengan cara pencucian.
Sedangkan senyawa-senyawa anorganik berupa oksida-oksida logam dilarutkan dengan penambahan HCl(p) dan juga dipisahkan dengan cara pencucian. Pada tahap ini, dalam
penambahan H2SO4(p) dan HCl(p) dilakukan pemanasan pada suhu 800C. Hal ini dimaksudkan
Gambar 4.1. Campuran silika dengan Gambar 4.2. Silika hasil pemurnian zat-zat pengotornya
Silika hasil pemurnian kemudian dikarakterisasi menggunakan XRD sehingga dihasilkan difraktogram silika sebagai berikut:
Gambar 4.3. Difraktogram XRD Silika Ukuran 100 mesh dari Pasir Alam
Tabel 4.1. Peak Difraktogram XRD Silika Ukuran 100 mesh dari Pasir Alam
9 26.789(5) 3.3252(6) 35649(445) 0.107(8) 5563(101) 0.156(5) 1.2(2)
Setelah dibandingkan dengan difraktogram untuk standar silika (Lampiran 1), maka dapat disimpulkan bahwa puncak-puncak dominan yang muncul pada sudut 2θ = 21,265o; 2θ
= 26,789o ; 2θ = 36,58o ; 2θ = 40,342o ; 2θ = 41,629o ; 2θ = 42,95o ; 2θ = 50,959o ; dan 2θ
Kemudian silika dianalisa kuantitatif menggunakan XRD dengan metode RIR (Reference Intensity Ratio) sehingga dihasilkan komposisi dari silika yang ditunjukkan pada Tabel 4.2. dan Gambar 4.4. sebagai berikut:
Tabel 4.2. Komposisi Tingkat Kemurnian Silika Ukuran 100 Mesh dari Pasir Alam Menggunakan Metode RIR
Qualitative analysis results
Phase name Formula Figure of merit Phase reg. detail DB card number
Magnesium catena-silicate,
Protoenstatite Mg (SiO3) 1.746 ICDD 01-076-6775
quartz, low SiO2 1.124 User (COD) 7103014
Weight ratio
Phase name Content(%)
- Magnesium catena-silicate, Protoenstatite (MgSiO3) 64.4(18)
Mea
Magnesium catena- silicate, Protoenstatite, Mg ( Si O3 )
Magnesium catena- silicate, Protoenstatite, Mg ( Si O3 )Magnesium catena- silicate, Protoenstatite, Mg ( Si O3 ) Magnesium catena- silicate, Protoenstatite, Mg ( Si O3 ) Magnesium catena- silicate, Protoenstatite, Mg ( Si O3 ) Magnesium catena- silicate, Protoenstatite, Mg ( Si O3 )Magnesium catena- silicate, Protoenstatite, Mg ( Si O3 )
Magnesium catena- silicate, Protoenstatite, Mg ( Si O3 )
Magnesium catena- silicate, Protoenstatite, Mg ( Si O3 )Magnesium catena- silicate, Protoenstatite, Mg ( Si O3 ) Magnesium catena- silicate, Protoenstatite, Mg ( Si O3 ) Magnesium catena- silicate, Protoenstatite, Mg ( Si O3 )
Magnesium catena- silicate, Protoenstatite, Mg ( Si O3 ) Magnesium catena- silicate, Protoenstatite, Mg ( Si O3 )
Magnesium catena- silicate, Protoenstatite, Mg ( Si O3 ) Magnesium catena- silicate, Protoenstatite, Mg ( Si O3 ) Magnesium catena- silicate, Protoenstatite, Mg ( Si O3 ) Magnesium catena- silicate, Protoenstatite, Mg ( Si O3 )
Magnesium catena- silicate, Protoenstatite, Mg ( Si O3 ) Magnesium catena- silicate, Protoenstatite, Mg ( Si O3 ) Magnesium catena- silicate, Protoenstatite, Mg ( Si O3 ) Magnesium catena- silicate, Protoenstatite, Mg ( Si O3 ) Magnesium catena- silicate, Protoenstatite, Mg ( Si O3 ) Magnesium catena- silicate, Protoenstatite, Mg ( Si O3 )
quartz, low, O2 Si
quartz, low, O2 Si quartz, low, O
Gambar 4.5. Campuran hasil reduksi silika
Pada tahap ini, dilakukan reduksi pada suhu 8000C karena menurut Sadique (2010)
yang telah melakukan reduksi abu silika (fume silica) dengan metode reduksi secara magnesiotermik menggunakan tanur elektrik menyatakan suhu optimumnya 750o-850oC yang
menghasilkan kadar silikon yang mencapai 99%. Dalam hal ini juga dilakukan variasi waktu 4 jam, 5 jam dan 6 jam untuk mengetahui apakah kemurnian silikon akan meningkat seiring dengan bertambahnya waktu yang dilakukan dengan perlakuan yang sama.
4.4. Tahap Pemurnian Silikon
Campuran hasil reduksi diperkirakan mengandung pengotor seperti MgO, Mg2Si, Mg2SiO4,
dan SiO2 yang tidak bereaksi. Senyawa MgO dan Mg2Si dilarutkan dengan penambahan HCl
2N. Senyawa Mg2SiO4 dilarutkan dengan penambahan CH3COOH25%. Sedangkan senyawa
SiO2 yang tidak bereaksi dilarutkan dengan penambahan HF 4,8% sehingga akan dihasilkan
silikon murni. Pada saat penambahan HCl 2N, CH3COOH 25%, dan HF 4,8%, terjadi
gelembung gas dan terbentuk campuran larutan berwarna cokelat kehitaman yang keruh dan silikon hasil pemurnian berwarna hitam kecokelatan.
Pada tahap ini, dilakukan pemanasan 800C saat penambahan HCl 2N, CH3COOH
25%, dan HF 4,8%. Hal ini dimaksudkan agar reaksi pemurnian silikon berjalan dengan lebih baik dibandingkan reaksi yang dilakukan pada suhu kamar/tanpa pemanasan.
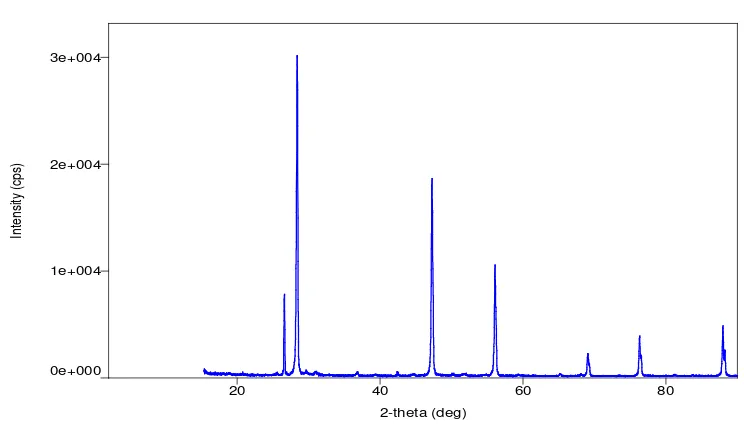
Silikon hasil pemurnian kemudian dikarakterisasi menggunakan XRD sehingga dihasilkan difraktogram silikon sebagai berikut:
4.4.1. Difraktogram Sinar X dari Silikon Suhu 800oC selama 4 jam
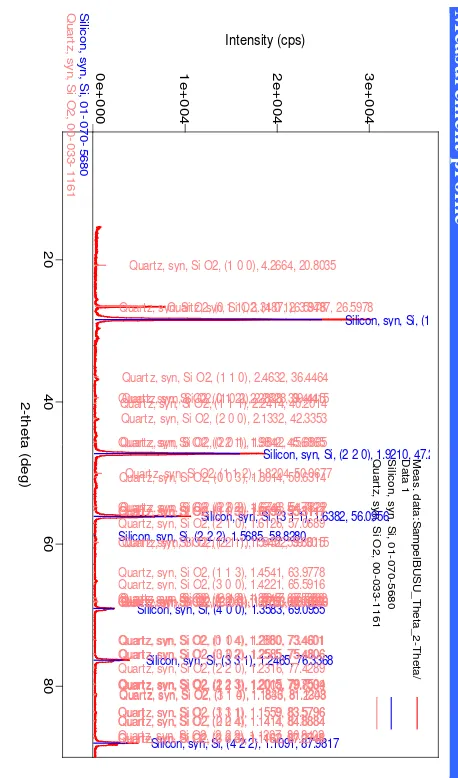
Gambar 4.8. Difraktogram XRD Silikon Suhu 800oC Selama 4 jam
Tabel 4.3. Peak Difraktogram XRD Silikon Suhu 800oC Selama 4 jam
Setelah dibandingkan dengan difraktogram untuk standar silikon (Lampiran 2), maka dapat disimpulkan bahwa puncak-puncak dominan yang muncul pada sudut 2θ = 28,435o; 2θ = 47,284o; 2θ = 56,087o; 2θ = 69,089o; 2θ = 76,332o; dan 2θ = 87,987o merupakan puncak-puncak yang menunjukkan refleksi bidang kristal silikon.
Kemudian silikon dianalisa kuantitatif menggunakan XRD dengan metode RIR (Reference Intensity Ratio) sehingga dihasilkan komposisi dari silikon yang ditunjukkan pada Tabel 4.4. dan Gambar 4.4. sebagai berikut:
Tabel 4.4. Komposisi Tingkat Kemurnian Silikon Pada Suhu 8000C Selama 4 jam Menggunakan Metode RIR
Qualitative analysis results
Phase name Formula Figure of merit Phase reg. detail DB card number
Mea
Silicon, syn, Si, (3 1 1), 1.6382, 56.0956 Silicon, syn, Si, (2 2 2), 1.5685, 58.8280
Silicon, syn, Si, (4 0 0), 1.3583, 69.0955
Silicon, syn, Si, (3 3 1), 1.2465, 76.3368
Silicon, syn, Si, (4 2 2), 1.1091, 87.9817
Quartz, syn, Si O2, (1 0 0), 4.2664, 20.8035
Quartz, syn, Si O2, (1 0 1), 3.3487, 26.5978 Quartz, syn, Si O2, (0 1 1), 3.3487, 26.5978
Quartz, syn, Si O2, (1 1 0), 2.4632, 36.4464 Quartz, syn, Si O2, (1 0 2), 2.2828, 39.4415 Quartz, syn, Si O2, (0 1 2), 2.2828, 39.4415Quartz, syn, Si O2, (1 1 1), 2.2414, 40.2014 Quartz, syn, Si O2, (2 0 0), 2.1332, 42.3353
Quartz, syn, Si O2, (2 0 1), 1.9842, 45.6865 Quartz, syn, Si O2, (0 2 1), 1.9842, 45.6865
Quartz, syn, Si O2, (1 1 2), 1.8204, 50.0677 Quartz, syn, Si O2, (0 0 3), 1.8014, 50.6314
Quartz, syn, Si O2, (2 0 2), 1.6743, 54.7822 Quartz, syn, Si O2, (0 2 2), 1.6743, 54.7822Quartz, syn, Si O2, (1 0 3), 1.6595, 55.3117 Quartz, syn, Si O2, (0 1 3), 1.6595, 55.3117 Quartz, syn, Si O2, (2 1 0), 1.6126, 57.0689 Quartz, syn, Si O2, (2 1 1), 1.5452, 59.8015 Quartz, syn, Si O2, (1 2 1), 1.5452, 59.8015
Quartz, syn, Si O2, (1 1 3), 1.4541, 63.9778 Quartz, syn, Si O2, (3 0 0), 1.4221, 65.5916 Quartz, syn, Si O2, (2 1 2), 1.3847, 67.5982 Quartz, syn, Si O2, (1 2 2), 1.3847, 67.5982Quartz, syn, Si O2, (2 0 3), 1.3763, 68.0669 Quartz, syn, Si O2, (0 2 3), 1.3763, 68.0669Quartz, syn, Si O2, (3 0 1), 1.3753, 68.1236 Quartz, syn, Si O2, (0 3 1), 1.3753, 68.1236
Quartz, syn, Si O2, (1 0 4), 1.2880, 73.4601 Quartz, syn, Si O2, (0 1 4), 1.2880, 73.4601 Quartz, syn, Si O2, (3 0 2), 1.2585, 75.4806 Quartz, syn, Si O2, (0 3 2), 1.2585, 75.4806 Quartz, syn, Si O2, (2 2 0), 1.2316, 77.4289 Quartz, syn, Si O2, (2 1 3), 1.2015, 79.7504 Quartz, syn, Si O2, (1 2 3), 1.2015, 79.7504Quartz, syn, Si O2, (2 2 1), 1.2008, 79.8039 Quartz, syn, Si O2, (1 1 4), 1.1846, 81.1243 Quartz, syn, Si O2, (3 1 0), 1.1833, 81.2308 Quartz, syn, Si O2, (3 1 1), 1.1559, 83.5796 Quartz, syn, Si O2, (1 3 1), 1.1559, 83.5796 Quartz, syn, Si O2, (2 0 4), 1.1414, 84.8884 Quartz, syn, Si O2, (0 2 4), 1.1414, 84.8884 Quartz, syn, Si O2, (2 2 2), 1.1207, 86.8402Quartz, syn, Si O2, (3 0 3), 1.1162, 87.2748 Quartz, syn, Si O2, (0 3 3), 1.1162, 87.2748
Tabel 4.5. Peak Difraktogram XRD Silikon Suhu 800oC Selama 5 jam
Setelah dibandingkan dengan difraktogram untuk standar silikon (Lampiran 2), maka dapat disimpulkan bahwa puncak-puncak dominan yang muncul pada sudut 2θ = 28,561o; 2θ
= 47,430o; 2θ = 56,234o; 2θ = 69,228o; 2θ = 76,447o; dan 2θ = 88,099o merupakan
puncak-puncak yang menunjukkan refleksi bidang kristal silikon.
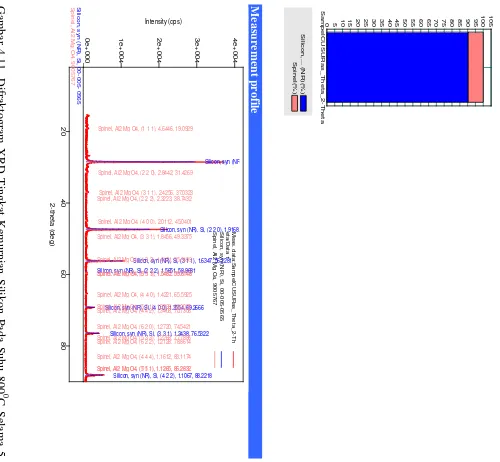
Kemudian silikon dianalisa kuantitatif menggunakan XRD dengan metode RIR (Reference Intensity Ratio) sehingga dihasilkan komposisi dari silikon yang ditunjukkan pada Tabel 4.6. dan Gambar 4.11. sebagai berikut:
Tabel 4.6. Komposisi Tingkat Kemurnian Silikon Pada Suhu 8000C Selama 5 jam
Menggunakan Metode RIR
Qualitative analysis results
Phase name Formula Figure of merit Phase reg. detail DB card number
Mea
Silicon, syn (NR), Si, (3 1 1), 1.6347, 56.2281 Silicon, syn (NR), Si, (2 2 2), 1.5651, 58.9681
Silicon, syn (NR), Si, (4 0 0), 1.3554, 69.2666
Silicon, syn (NR), Si, (3 3 1), 1.2438, 76.5322
Silicon, syn (NR), Si, (4 2 2), 1.1067, 88.2218
Spinel, Al2 Mg O4, (1 1 1), 4.6446, 19.0929
Spinel, Al2 Mg O4, (2 2 0), 2.8442, 31.4269
Spinel, Al2 Mg O4, (3 1 1), 2.4256, 37.0323 Spinel, Al2 Mg O4, (2 2 2), 2.3223, 38.7432
Spinel, Al2 Mg O4, (4 0 0), 2.0112, 45.0401
Spinel, Al2 Mg O4, (3 3 1), 1.8456, 49.3375
Spinel, Al2 Mg O4, (4 2 2), 1.6421, 55.9499
Spinel, Al2 Mg O4, (3 3 3), 1.5482, 59.6748Spinel, Al2 Mg O4, (5 1 1), 1.5482, 59.6748
Spinel, Al2 Mg O4, (4 4 0), 1.4221, 65.5925
Spinel, Al2 Mg O4, (5 3 1), 1.3598, 69.0095 Spinel, Al2 Mg O4, (4 4 2), 1.3408, 70.1306
Spinel, Al2 Mg O4, (6 2 0), 1.2720, 74.5421
Spinel, Al2 Mg O4, (5 3 3), 1.2268, 77.7886 Spinel, Al2 Mg O4, (6 2 2), 1.2128, 78.8614
Spinel, Al2 Mg O4, (4 4 4), 1.1612, 83.1174
Spinel, Al2 Mg O4, (7 1 1), 1.1265, 86.2832 Spinel, Al2 Mg O4, (5 5 1), 1.1265, 86.2832
4.4.3. Difraktogram Sinar X dari Silikon Suhu 800oC selama 6 jam
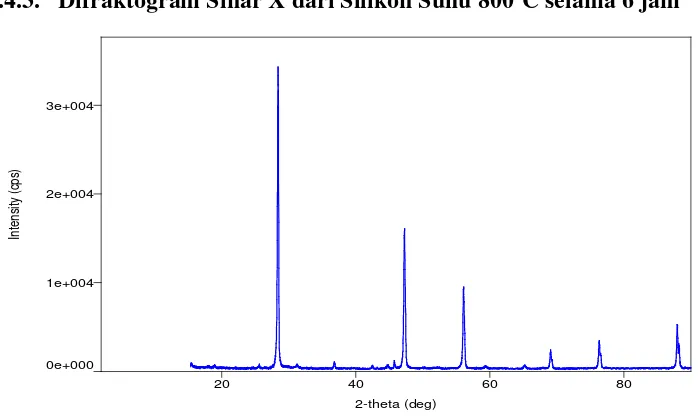
Gambar 4.12. Difraktogram XRD Silikon Suhu 800oC Selama 6 jam
Tabel 4.7. Peak Difraktogram XRD Silikon Suhu 800oC Selama 6 jam
Peak list
Setelah dibandingkan dengan difraktogram untuk standar silikon (Lampiran 2), maka dapat disimpulkan bahwa puncak-puncak dominan yang muncul pada sudut 2θ = 28,434o; 2θ = 47,280o; 2θ = 56,078o; 2θ = 69,078o; 2θ = 76,344o; dan 2θ = 87,983o merupakan
puncak-puncak yang menunjukkan refleksi bidang kristal silikon.
Kemudian silikon dianalisa kuantitatif menggunakan XRD dengan metode RIR (Reference Intensity Ratio) sehingga dihasilkan komposisi dari silikon yang ditunjukkan pada Tabel 4.8. dan Gambar 4.13. sebagai berikut:
Tabel 4.8. Komposisi Tingkat Kemurnian Silikon Pada Suhu 8000C Selama 6 jam Menggunakan Metode RIR
Qualitative analysis results
Phase name Formula Figure of merit Phase reg. detail DB card number
Measurement profile
Gambar 4.13. Difraktogram XRD Tingkat Kemurnian Silikon Pada Suhu 8000C Selama 6 jam dengan Metode RIR
Dari data diatas, dapat disimpulkan bahwa masih ada komponen pengotor dari silikon hasil pemurnian yaitu spinel (Al2MgO4), dimana kandungannya sebesar 5,7%; sedangkan
kandungan silikonnya sebesar 94,3%.
Dari data XRD silikon pada suhu 8000C untuk 4 jam, 5 jam dan 6 jam diperoleh hasil silikon murni masing-masing sebesar 84,0%; 90,4%; dan 94,3%. Hal ini menunjukkan bahwa semakin lama waktu yang digunakan, maka semakin banyak produk silikon yang dihasilkan sesuai dengan teori kinetika reaksi dimana waktu merupakan salah satu faktornya (Bird,1993). Jadi, silikon yang paling banyak dihasilkan adalah pada waktu 6 jam dengan suhu 8000C. Namun pada penelitian ini belum didapatkan waktu optimum untuk menghasilkan silikon yang lebih baik dan efisien.
Meas. data:SampelDUSU_Theta_2-Theta/ Data 1
Silicon, syn, Si, 01-070-5680 Spinel, syn, Mg Al2 O4, 01-075-4396
In
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
1. Dari hasil analisa XRD yang dilakukan terhadap silika hasil pemurnian dari pasir kuarsa adalah sebesar 35,6%.
2. Dari hasil analisa XRD yang dilakukan terhadap silikon hasil penelitian dimana pada proses reduksi silika menjadi silikon dalam tanur pada suhu 800oC dilakukan dengan variasi waktu 4 jam, 5 jam dan 6 jam dan dilakukan pemanasan pada tahap pemurnian silikon sehingga menghasilkan kemurnian silikon sebesar 84,0%; 90,4%; dan 94,3%.
5.2. Saran
DAFTAR PUSTAKA
Atkins, P. W. 1996. Kimia Fisika. Cetakan Kedua. Edisi Keempat. Erlangga. Jakarta.
Bao, Z., Weatherspoon, M. R., Shian, S., Cail, Ye, Graham, P. D., Allan, S. M., Ahmad, G., Dickerson, M. B., Church, B. C., Kang, Z., Abernathy, H. W., Summers, C. J., Liu, M., and Sandhage, K. H. 2007. Chemical Reduction of Three-Dimensional Silica Micro-assemblies into Microporous Silicon Replicas. Nature, 446/8 (2007) 172-175.
Barsoum, M. W. 1997. Fundamentals of Ceramics. McGraw-Hill Companies,Inc. New York.
Bird, T. 1993. Kimia Fisik Untuk Universitas. Cetakan Kedua. PT Gramedia Pustaka Utama. Jakarta.
Chung, F. H. 1974. Quantitative Interpretation of X-Ray Diffraction Patterns. Matrix-Flushing Method of Quantitative Multicomponent Analysis. Jour. Of Applied Crystallography. V. 7. P. 519-525.
Das, K., Bandyopadhyay, T. K., and Das, S. 2002. A Review on The Various Synthesis Routes of TiC Reinforced Ferrous Based Composites. J. of Mat. Sci., 37 (2002) 3881-3892.
Dinsdale, A. 1986. Pottery Science Material, Process, and Products. Ellis Horwood Limited. Chichester.
Email, I. W., Sani, N. A., Abdulsalam, A. K., Abdullahi, U. A. 2013. Extraction and Quantification of Silicon From Silica Sand Obtained From Zauma River, Zamfara State, Nigeria. European Scientific Journal. V. 9. No. 15. ISSN: 1857-7881.
Gustiono, D., Suratman, Nuryadi, R., Deni, Y., Roseno, S., Ulfa, I. M. 2012. Pembuatan Prototipe Polycrystalline Silicon Untuk Bahan Baku Industri Sel Surya. MT-7. Prosiding InSINas 2012.
Iller, R. K. 2007. Silicon Dioxide [serial online] http://en.wikipedia.org/wiki/silicon. [ 20 Okt, 2013].
Kalem, T. 2004. Gas-Solid Displacement Reactions for Converting Silica Diatom Frustules into MgO dan TiO2. Iowa State University (Master’s Thesis), USA (2004).
Makarim, A.K., Suhartatik, E., dan Kartohardjono,A. 2007. Silikon: Hara Penting Pada
Sistem Produksi Padi [serial online]
Manullang, S. B. 2012. Pembuatan Tetraetil Ortosilikat Menggunakan Silikon Hasil Isolasi dari Pasir Kuarsa. [Skripsi]. Medan: Universitas Sumatera Utara, Program Sarjana.
McColm, I. J. 1983. Ceramic Science for Materials Technologists. Leonard Hill. New York.
Mishra, P., Cakraverty, A., and Banerjee, H. D. 1985. Production and Purification of Silicon by Calsium Reduction of Rice-Husk White Ash. Journal of Materials Science, 20 (1985) 4387-4391.
NIOSH. 1997. Department of Health and Human Services, Public Health Service,
Centers for Disease Control and Prevention, National Institute for Occupational Safety and Health (DHHS) (NIOSH). Pocket guide to chemical hazards. Cincinnati, OH, US. Publication No. 97-140).
Norton, F. H. 1974. Elements of Ceramics. Second Edition. Addison-Wesley Publishing Company. London.
Sadique, S. E. 2010. Production and Purification of Silicon by Magnesiothermic Reduction of
Silica Fume [serial online]
Siswanto, Hamzah, M., Mahendra A., Fausiah. 2012. Perekayasaan Nanosilika Berbahan Baku Silika Lokal Sebagai Filler Kompon Karet Rubber Air Bag Peluncur Kapal Dari Galangan. TR-56. Prosiding InSINas 2012.
Wang, D., and Shi, S. 2002. Aluminothermic Reduction of Silica for The Synthesis Alumina-Aluminum-Silicon Composite. J. of Mat. Syn. and Proc., 9/5 (2002) 241-246.
Verral, M. 2013. Quantitative XRD [serial online] Jan, 2013].