BAB II
TINJAUAN PUSTAKA
2.1 Amonium Sulfat
Amonium sulfat biasa disebut pupuk ZA (Zwuafel Amonium) banyak dimanfaatkan sebagai pupuk nitrogen, terutama untuk tanaman industri dan perkebunan diantaranya tebu, tembakau, cengkeh, kopi, lada, kelapa sawit, dan teh. Sebagai pupuk, amonium sulfat merupakan jenis pupuk anorganik tunggal yang
terdiri dari unsur sulfur (24% berat) dalam bentuk ion sulfat dan unsur nitrogen (21% berat) dalam bentuk ion amonium.
Negara Indonesia merupakan negara agraris yang selalu membutuhkan amonium sulfat sebagai pupuk nitrogen. Keuntungan penggunaan amonium sulfat (pupuk ZA) dibandingkan pupuk nitrogen lainnya yaitu (Setyamidjaja, 1986):
1. Mengandung unsur nitrogen dan sulfur sedangkan unsur sulfur ini tidak dimiliki pupuk nitrogen lainnya, misal urea (CO(NH2)2), amonium nitrat
(NH4NO3) dan senyawa chili (NaNO3). Kedua unsur ini merupakan jenis unsur
hara yang dibutuhkan tanaman dalam jumlah besar atau disebut makronutrient. 2. NH4+ dapat diserap secara langsung oleh tanaman sehingga tidak
membutuhkan mikroorganisme tanah untuk mengurai senyawa NH4+ menjadi
unsur nitrogen, seperti pada pupuk urea (CO(NH2)2).
Selain sebagai pupuk, senyawa amonium sulfat juga digunakan dalam bidang industri antara lain:
1. Dalam industri penyamakan digunakan untuk proses deliming ataupun menghilangkan zat kapur dari kulit.
2. Dalam industri makanan digunakan dalam bumbu, penyedap rasa, isolasi protein, makanan ringan, selai, jeli, dan minuman non-alkohol.
3. Dalam industri tekstil digunakan sebagai aditif pada proses pewarnaan.
2.2 Sifat-Sifat Fisis dan Kimia Bahan Baku dan Produk 2.2.1 Bahan baku
2.2.1.1 Gypsum FGD/ Gypsum Sintetik (CaSO4.2H2O)
Gypsum sintetis diproduksi dari unit Flue Gas Desulfurization (FGD) pada pembakaran batu bara (PLTU). Gypsum sintetis memiliki kemurnian yang lebih tinggi diatas (96 %) dari gypsum alami (80 %) (Euro Gypsum, 2007).
Batubara yang dibakar di boiler akan menghasilkan tenaga listrik serta menghasilkan emisi seperti partikel SO2, NOx, dan CO2. Emisi tersebut dapat
dikurangi dengan menggunakan teknologi seperti denitrifikasi, desulfurisasi,
electrostratic precipitator (penyaring debu), dan separator CO2.
Teknologi FGD digunakan untuk mengurangi emisi SO2 yang dapat
mencemari air hujan menjadi hujan asam. Ada dua tipe FGD yaitu FGD basah (Wet Limestone Scrubbing) dan FGD kering (Dry Limestone Scrubbing). Pada FGD basah, campuran air dan gamping (batu kapur) disemprotkan dalam gas buang. Cara ini dapat mengurangi emisi SO2 sampai 70-95 %. Kalsium karbonat (CaCO3) dalam
batu kapur diubah terlebih dahulu menjadi kalsium sulfit (CaSO3). SO2 yang diserap
kemudian direaksikan dengan CaSO3 membentuk senyawa baru yaitu kalsium sulfat
(CaSO4) atau gypsum. FGD kering menggunakan campuran air dan batu kapur atau
gamping yang diinjeksikan ke dalam ruang bakar. Cara ini dapat mengurangi emisi
SO2 sampai 70-97 %. FGD kering menghasilkan produk sampingan gypsum yang
bercampur dengan limbah lainnya (Sugiono, 2000).
Gypsum alami merupakan mineral yang umumnya ditemukan di lapisan sedimen yang mengendap dan bersatu dengan halite, anhydrite, sulfur, calcite dan
dolomite. Gypsum merupakan mineral yang tidak larut dalam air dalam waktu yang lama, sehingga gypsum alami jarang ditemukan dalam bentuk butiran atau pasir. Gypsum yang paling umum ditemukan adalah jenis hidrat kalsium sulfat dengan rumus kimia CaSO4.2H2O. Gypsum terbentuk dalam kondisi berbagai kemurnian dan
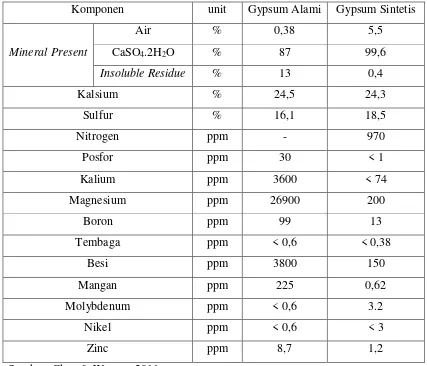
Gypsum sintetis dan gypsum alami memiliki rumus kimia yang sama yaitu CaSO4.2H2O. Tetapi keduanya memiliki perbedaan komposisi penyusun. Berikut ini
merupakan tabel perbedaan antara gypsum sintetis dan gypsum alami:
Tabel 2.1 Perbedaan Gypsum Sintetis dan Gypsum Alami
Komponen unit Gypsum Alami Gypsum Sintetis
Mineral Present
Air % 0,38 5,5
CaSO4.2H2O % 87 99,6
Insoluble Residue % 13 0,4
Kalsium % 24,5 24,3
Sulfur % 16,1 18,5
Nitrogen ppm - 970
Posfor ppm 30 < 1
Kalium ppm 3600 < 74
Magnesium ppm 26900 200
Boron ppm 99 13
Tembaga ppm < 0,6 < 0,38
Besi ppm 3800 150
Mangan ppm 225 0,62
Molybdenum ppm < 0,6 3.2
Nikel ppm < 0,6 < 3
Zinc ppm 8,7 1,2
Sumber: Chen & Warren, 2011
Adapun sifat fisis dan kimia dari gypsum sintetis adalah (MSDS, 2011): Sifat fisis:
Calsium sulfat dihidrat : 90-99 % wt
Spesifik grafity : 2,3 g/cm3
Titik didih : > 1000 oC
Padatan berwarna putih
Tidak larut di air
Terdekomposisi menjadi calsium oksida dan sulfur dioksida pada suhu
1450 oC
Sifat kimia:
Gypsum sintetik harus dihindarkan dari senyawa asam, diazometana,
posfor, logam aluminium dan agen pengoksidasi kuat.
Gypsum sintetik dan air menghasilkan sedikit panas.
2.2.1.2 Amonia (NH3) (Kirk Othmer, 1998)
Sifat fisis :
Berat molekul : 17,03 gr/mol
Titik didih : -33,35 oC
Titik Beku : -77,7 oC
Temperatur kritis : 133 oC
Tekanan kritis : 11,425 kPa
Panas spesifik
− 0 oC : 2097,2 J/(Kg K)
− 100 oC : 2226,2 J/(Kg K)
− 200 oC : 2105,6 J/(Kg K)
Kelarutan dalam air
− 0 oC : 42,8 wt%
− 20 oC : 33,1 wt%
− 40 oC : 23,4 wt%
− 60 oC : 14,1 wt%
Spesifik grafity
− -40 oC : 0,69
− 0 oC : 0,639
Sifat kimia:
Amonia sangat dibutuhkan dalam system netralisasi, terutama dalam
produksi pupuk seperti amonium sulfat, amonium nitrat dan amonium posfat.
Larut dalam air membentuk basa NH4OH
Bersifat menyerap air (higroskopis)
Bereaksi substitusi dengan asam anorganik dan organik
Bereaksi dengan CO2 lembab membentuk amonium karbonat
Bereaksi dengan larutan NaOCl membentuk hidrazine
Kelarutan amonia dalam air menurun terhadap peningkatan suhu.
Reaksi antara amonia dan air bersifat reversibel
NH3 + H2O ↔ NH4+ + OH
- Dengan bantuan katalis oksidasi berupa katalis platinum rhodium, amonia
akan membentuk asam nitrit dan air dalam waktu singkat pada suhu 650
o
C
4 NH3 + 5O2 → 4NO + 6 H2O
2NO + O2 → 2NO2
3 NO2 + H2O → 2HNO3 + NO
Amonia cair berperan sebagai precipitate basah dari metalic hydroxide
dari larutan garamnya dan membentuk ion kompleks dalam alur keluaran amonia
CuSO4 + 2NH3.H2O → Cu(OH)2 + (NH4)2SO4
Cu(OH)2 → Cu2+ + 2OH
2NH3 → Cu(NH3)4│2+
2.2.1.3 Karbon Dioksida (CO2) (Kirk Othmer, 1998)
Sifat fisis:
Temperatur kritis : 31,1 oC
Tekanan kritis : 7383 kPa
Densitas gas pada 273 K dan 101,3 kPa : 1,976 g/l
Panas laten penguapan
− triple point : 353,4 J/g
− 0 oC : 231,3 J/g
Panas pembentukan pada 298 K : 393,7 kJ/mol
Kelarutan di air (Perry & Green, 1999)
− 0 oC : 179,7 cc
− 20 oC : 90,1 cc
Sifat kimia:
Karbon dioksida tidak reaktif pada suhu kamar
Karbon dioksida dan air membentuk asam karbonat
Karbon dioksida membentuk karbon monoksida pada suhu 1700 oC
Larut dalam air membentuk asam lemah H2CO3, HCO3
- Bereaksi dengan air membentuk metana, gas hidrogen, karbon monoksida
pada suhu dan tekanan tinggi dengan bantuan katalis
Bereaksi dengan basa membentuk karbonat
Bereaksi dengan NH3 dalam air membentuk amonium karbonat
Bereaksi dengan NH3 kering membentuk karbamat (intermedit ke urea)
2.2.1.4 Air (H2O) (Kirk Othmer, 1998)
Sifat fisis:
Titik beku : 0 oC
Titik didih : 100 oC
Viskositas pada 25 oC : 0,8949 cP
Densitas pada 25 oC : 0,99987 g/cm3
Panas spesifik pada 25 oC : 4,17856 J/g K
Konduktivitas termal pada 20 oC : 0,00598 W/(cm K)
Sifat kimia:
Bereaksi dengan kalsium, magnesium, natrium dan logam-logam reaktif lain
membebaskan H2
Air bersifat amfoter
Bereaksi dengan kalium oksida, sulfur oksida membentuk basa kalium dan
asam sulfat.
Dengan anhidrid asam karboksilat membentuk asam karboksilat.
2.2.1.5 Asam Sulfat (H2SO4) (Kirk Othmer, 1998 dan Perry & Green, 1999)
Titik didih : 270 oC
Terdekomposisi : 340 oC
Titik leleh : 10,49 oC
Berat jenis (30 oC) : 1,8261 gr/cm3
Kerapatan : 1,84 gr/c
Berat molekul : 98 gr/mol
Kelarutan tak terhingga pada air dingin dan air panas
Terdekomposisi dalam etil alkohol 95%
Bersifat korosif
Cairan tidak berwarna pada suhu kamar
2.2.2 Produk
2.2.2.1 Amonium Sulfat ((NH4)2SO4)
Umumnya, amonium sulfat banyak digunakan sebagai pupuk, dengan pemanfaatan kandungan nitrogen dan sulfur didalamnya. Amonium sulfat merupakan pupuk yang cocok untuk tanaman padi, citrus, anggur, tanaman merambat serta khususnya untuk tanah ber-pH tinggi. Selain sebagai pupuk, amonium sulfat juga digunakan untuk makanan, fire control, pakan ternak dan tanning (penyamak), water treatment dan proses fermentasi (Kirk Othmer, 1998).
Sifat-sifat :
Wujud berupa kristal putih
Berat molekul : 132,14 gr/mol
pH : 5
Densitas padatan (20 oC) : 1,769
Panas kristalisasi (42% (NH4)2SO4 (aq)) : 11,6 kcal/kg
Kelarutan dalam 100 gr air
− 0 oC : 70,6 gr
− 100 oC : 103,8 gr
Spesifik grafitasi larutan jenuh
− 20 oC : 1,2414
− 93oC : 1,2502
Panas spesifik padatan pada 91oC : 0,345 cal/g.oC
Panas spesifik larutan jenuh cal/g.oC
− 20 oC : 0,67
− 100oC : 0,63
Titik lebur : 512,2 oC
Terdekomposisi : 280 oC
Pada sistem terbuka mulai terdekomposisi pada suhu 100 oC menghasilkan NH3 dan amonium bisulfat (NH4HSO4)
Diatas 300 oC terdekomposisi membentuk SO2, SO3, H2O, N2
2.2.2.2 Kalsium karbonat (CaCO3) (Kirk Othmer, 1998 dan Perry & Green, 1999)
Kalsium karbonat merupakan salah satu mineral pengisi serbaguna dan dikonsumsi dalam jumlah besar untuk produksi semen, kertas, cat, plastik, karet, tekstil, kapur, dan tinta printer. Kalsium karbonat dengan kemurnian tinggi biasanya digunakan untuk pangan, farmasi, pasta gigi, dan kosmetik.
Sifat-sifat:
Berat molekul : 100,09 gr/mol
Spesifik grafitasi : 2,6-2,75
Titik lebur pada 102,5 atm : 1339 oC
Terdekomposisi : 900 oC
Kelarutan dalam 100 gr air
− 25 oC : 0,0014 gr
2.3 Proses Pembuatan Amonium Sulfat 2.3.1 Proses Netralisasi Langsung
Amonium sulfat dibuat dalam suatu unit netralizer dan crystalizer dengan mereaksikan langsung gas amonia dengan asam sulfat yang masuk melalui alur
recycle slurry, direaksikan dan dipanaskan di slurry recycle. Slurry kemudian di
flash pada upper chamber dibawah tekanan vakum yaitu sekitar 55 - 58 mmHg. Panas reaksi yang terjadi dalam reaktor dikontrol dan dihilangkan dengan penambahan air atau pendinginan dengan udara ke dalam reaktor. Unit netralizer dan
crystalizer dibuat terpisah untuk memudahkan sistem operasi dan control proses. Kesetimbangan optimum antara energi udara pendingin dengan yield kristal diperoleh ketika unit crystalizer di- control pada suhu 63 – 66°C.
Pengontrolan pH selama operasional sangat penting dilakukan, yaitu berkisar 3-3,5, untuk menghindarkan yield minimum, dan kristal yang tipis. Kelebihan asam akan menyebabkan pertumbuhan kristal berlebih terutama di pipa, sehingga memerlukan pelarutan kembali kristal dengan steam. Sebaliknya, kekurangan asam menyebabkan mutu kristal yang rendah, sehingga akan menyebabkan sistem pencucian dan storage sulit, serta kandungan nitrogen juga rendah. Adapun reaksi proses netralisasi adalah sebagai berikut (Kirk Othmer, 1998):
2 NH3 (g) + H2SO4(aq)→ (NH4)2SO4(s) ∆H=-274 KJ/mol (-65,5 Kcal/mol)
2.3.2 Proses Karbonasi Batubara
Batubara bituminous digunakan untuk pabrikasi gas dan produksi coke
(arang). Batubara ini mengandung 1-2% nitrogen (N) dan dapat diperoleh 15-20% NH3, yaitu berkisar 2,5-3 kg NH3/ ton batubara. Gas NH3 yang diperoleh akan
digunakan sebagai bahan baku dalam pembuatan amonium sulfat. Amonium sulfat dapat diproduksi dari hasil samping pembakaran batubara (coke-oven gas) dengan 3
cara yaitu direct method, indirect method dan semi direct method. 1. Direct Method
sulfat. Kristal amonium sulfat yang terbentuk dalam cairan turun kemudian dipisahkan dan dicuci dalam centrifuge lalu dikeringkan. Kristal kering yang dihasilkan dikirim lewat conveyor untuk disimpan. Adapun kekurangan dari metode ini adalah bahwa di dalam kristal yang diperoleh didapati sejumlah tar dan pyridin, sehingga memerlukan rekristalisasi kembali sebelum dipasarkan, tingkat korosinya tinggi dan sulit untuk mengatur tingkat optimum asam bebas yang dibutuhkan untuk menekan impurities dan optimum pH untuk menaikkan pertumbuhan kristal.
2. Indirect Method
Pada proses ini, gas panas dari oven utama didinginkan dengan resirkulasi cairan pencuci dan water scrubbing. Campuran cairan kemudian dipanaskan dengan steam dalam kolom stripper tipe bubble untuk melepaskan amonia bebas dalam senyawa garam. Steam lewat melalui kolom kedua stripper
kemudian amonia dan cairan dicampur dengan uap sehingga diperoleh amonia mentah yang selanjutnya didestilasi ulang atau diubah menjadi amonium sulfat dalam saturator kristaliser. Adapun amonium sulfat yang diperoleh bebas dari impurities, proses fleksibel. Kekurangan dari metode ini adalah masalah limbah buangan dan amonia yang hilang besar karena reaksi dan absorpsi yang tidak sempurna.
3. Semi – Direct Method
Metode ini merupakan gabungan dari direct method dan indirect method. Dalam proses ini gas mula – mula didinginkan dan dicuci untuk menghilangkan sejumlah tar dan untuk memproduksi larutan kondensat yang banyak mengandung amonia bentuk gas. Kemudian amonia cair dipanaskan sampai suhu 700C dan diabsorbsi dengan asam sulfat encer 5 - 6% dan menghasilkan larutan amonium sulfat jenuh dengan suhu 50 – 70 oC. Semi
2.3.3 Hasil Samping Industri Caprolactam
Banyak amonium sulfat diproduksi dari berbagai hasil samping proses kimia antara lain caprolactam, acrylonitrile. Berikut ini merupakan reaksi pembentukan amonium sulfat sebagai hasil samping caprolactam (Othmer, 1998):
2HON(SO3NH4)2 + 4H2O → (NH2OH)2.H2SO4 + 2(NH4)2SO4 + H2SO4
Hydroxylamine Air Hydroxylamine Amonium Asam Sulfat Disulfonate Sulfonate Sulfat
2C6H11O + (NH2OH)2.H2SO4 + 2NH3 → 2C6H11NO + (NH4)2SO4 + 2H2O
Phenol Hydroxylamine Amonia Cyclohexanone Amonium Air
Sulfonate Oxime Sulfat
Cyclohexanone Oxime dikonversi menjadi caprolactam dengan penyusunan kembali dengan penambahan oleum. Reaksi ini dilangsungkan dengan suhu tinggi (400oC). Sedangkan amonium sulfat dari reaksi pembentukan caprolaktam dari oksidasi toluena dengan udara menjadi asam benzoic dan dilanjutkan dengan proses hidrogenasi dilangsungkan pada tekanan 10 atm dan suhu 160 - 170 oC. Amonium sulfat yang dihasilkan dipanaskan secara kontinu dan 40% mother liquour disirkulasi melalui draft tube-buffle crystallizer pada temperatur 77 - 82 oC dan tekanan 660 mmHg (12,8 psia). Uap air dilepas dari crystallizer dan dikondensasi melalui satu atau lebih heat exchanger. Amonium sulfat dikeluarkan dari crystallizer menuju
settling tank, disentrifuse, dikeringkan sebelum disimpan. Kelemahan dari proses ini adalah terdapat sisa caprolactam cair dalam produk kristal amonium sulfat, sehingga perlu ditambahkan senyawa anti caking amonium sulfat (EPA, 1985). Selain itu proses ini tidak ekonomis karena konsentrasi amonium sulfatnya rendah, diperoleh
1,8 - 4,0 ton amonium sulfat per ton caprolactam.
2.3.4 Reaksi antara Amonium Karbonat dengan Gypsum
Reaksi antara amonium karbonat dengan gypsum dikenal dengan proses Merseburg. Metode ini didasarkan pada penggabungan amonia dan karbon dioksida
karbonat direaksikan dengan gypsum (CaSO4.2H2O) sehingga diperoleh amonium
sulfat dan kalsium karbonat. Adapun reaksinya sebagai berikut: NH3 + H2O → NH4OH
2NH4OH + CO2 → (NH4)2CO3 + H2O
CaSO4.2H2O + (NH4)2CO3 → (NH4)2 SO4 + CaCO3 + 2 H2O
Reaksi-reaksi di atas bersifat eksotermik. Proses ini memiliki banyak keuntungan seperti kalsium karbonat sebagai hasil samping yang dapat digunakan untuk produksi semen, pupuk, proses ini juga tidak membutuhkan supply sulfur. Larutan amonium sulfat dievaporasi dalam kondisi vakum, kemudian dikristalisasi, disentrifuge dan dikeringkan (Cheremisinoff, 1995). Proses pembuatan amonium sulfat dari gypsum sintetik (hasil unit FGD) menghasilkan konversi 83% dan kemurnian hingga 99% (Chou, 1995).
2.4 Pemilihan Proses
Dari beberapa uraian proses pembuatan amonium sulfat diatas, maka akan dirancang pabrik amonium sulfat dengan proses Merseburg. Adapun pertimbangannya adalah:
1. Proses menggunakan bahan baku gypsum (Gypsum FGD) dari buangan PLTU batu bara yang berharga murah.
2. Proses reaksi pada suhu dan tekanan rendah.
3. Proses ini sangat cocok untuk negara yang tidak memiliki supply sulfur alam, sehingga gypsum baik dari alam yang ditambang langsung atau gypsum
byproduct FGD dapat digunakan sebagai bahan baku tanpa harus mengimpor dari luar.
2.5 Deskripsi Proses
(NH4)2CO3 + CaSO4.2H2O (NH4)2SO4 + CaCO3 + 2H2O
Reaksi ini dijalankan pada fase cair – padat dan merupakan reaksi yang irreversibel. Gypsum yang digunakan adalah gypsum hasil samping dari unit FGD. Konversi yang dicapai dari reaksi tersebut sebesar 83 % pada akhir reaksi dan kemurnian amonium sulfat yang dihasilkan 99% (Chou, 1995).
Selain terdapat reaksi utama, juga terdapat reaksi samping yaitu : (NH4)2CO3 NH3 + CO2 + H2O
Reaksi samping dapat terjadi karena dalam pembentukan (NH4)2CO3 sendiri
bersifat reversibel dan reaksi berlangsung eksotermis. Karena terjadi kenaikan suhu maka reaksi dapat bergeser ke arah pereaktan. Gas – gas hasil reaksi samping ditangkap oleh fan dan selanjutnya dimasukkan ke scrubber.
Langkah Proses
Pada perancangan ini yang digunakan adalah proses gypsum (Merseburg Process). Kondisi operasi adalah 65 – 70 oC dan tekanan 1 atm. Proses pengolahan sampai produk akhir, melewati beberapa tahap utama yaitu :
1. tahap penyiapan bahan baku 2. tahap karbonasi
3. tahap reaksi 4. tahap scrubbing 5. tahap filtrasi 6. tahap netralisasi 7. tahap evaporasi 8. tahap kristalisasi 9. tahap drying
Tahap Penyiapan Bahan Baku
amonia. Sedangkan gypsum diambil dari unit FGD PLTU disimpan dalam gudang penyimpanan.
Tahap karbonasi
Proses karbonasi dilakukan dengan mengalirkan karbon dioksida (CO2),
amonia (NH3) dalam air. Perbandingan amonia (NH3) dan karbon dioksida (CO2)
adalah 2:1 (mol/mol) dalam 1 liter air (H2O). Reaksi karbonasi ini bersifat
eksotermik dan reversibel. Suhu reaksi 44oC, waktu reaksi 1 jam, dan pH 9,1. Adapun reaksi karbonasi ditunjukkan sebagai berikut:
2NH3 + CO2 + H2O (NH4)2CO3
Reaksi di atas merupakan reaksi gas-cair yang terjadi dalam Carbonation Tower yang berisi packing – packing. Reaksi tersebut dilangsungkan pada suhu 44oC dan tekanan 1 atm. Oleh karena kelarutan amonia (NH3) pada suhu tersebut kecil
maka NH3 dibuat exess. Reaksi dilangsungkan selama 1 jam dgn pH berkisar 9,1.
Pengaturan pH sangat penting dilakukan untuk mengetahui batas reaksi selesai. CO2 dan NH3 berada pada fase cair sebelum masuk ke Carbonation Tower
dikondisikan terlebih dahulu. Dari tangki penyimpanan dialirkan ke vaporizer sampai semua komponen menguap lalu tekanannya diturunkan dengan ekspander. Suhu masuk ke Carbonation Tower 44 oC.
Gas – gas sisa yang tidak bereaksi dalam Carbonation Tower, ditangkap oleh fan untuk selanjutnya diumpankan ke scrubber dan direaksikan dengan “make up” air dan membentuk amonium karbonat encer.
Tahap reaksi
Reaksi dijalankan dalam reaktor CSTR dengan tekanan 1 atm dan suhu 70oC untuk reaktor 1. (NH4)2CO3 pekat dari Carbonation Tower dipompakan menuju
reaktor dan dicampurkan dengan slurry gypsum yang diangkut dari gudang dengan belt conveyor dan diumpankan melalui feeder.
Reaksi :
(NH4)2CO3 + CaSO4.2H2O (NH4)2SO4 + CaCO3 + 2H2O
(120%) (Abbas, 2011). Gas – gas hasil peruraian yang berupa ammonia, karbondioksida dan uap air pada reaktor ditangkap oleh fan dan diumpankan ke
scrubber. Berikut ini merupakan reaksi samping yang terjadi pada pembentukan amonium sulfat yaitu :
(NH4)2CO3 2NH3 + CO2 + H2O
Tahap scrubbing
Pada tahap ini terjadi penyerapan gas – gas sisa yang tidak bereaksi dari unit karbonasi dan unit reaksi yang berupa ammonia, karbondioksida dan uap air. Gas – gas sisa ini ditangkap oleh fan dan selanjutnya dimasukkan ke scrubber yang berisi
packing – packing tempat terjadinya reaksi cair-gas. Air yang digunakan berasal dari “make-up” water. Reaksinya adalah sebagai berikut :
2NH3 + CO2 + H2O (NH4)2CO3
Gas – gas sisa dari reaktor masuk pada suhu 44oC dan gas sisa dari Carbonation tower masuk pada suhu 440C. Air yang digunakan untuk “make up” masuk pada suhu 30oC.
Reaksi berlangsung pada suhu 44oC dan tekanan 1 atm. Amonium karbonat yang dihasilkan berupa amonium karbonat encer yang kemudian dipompakan menuju carbonation tower sebagai umpan.
Tahap filtrasi
Pada tahap ini terjadi penyaringan slurry yang terbentuk pada seksi reaksi dengan menggunakan “ Rotary Drum Vacum Filter”. Slurry yang terbentuk di reaktor dipompakan menuju filter. Hasil filtrasi berupa filtrat yang terdiri dari larutan (NH4)2SO4 dan sisa (NH4)2CO3. Sedangkan cake berupa CaCO3 dan sisa gypsum.
Suhu keluar filtrasi sebesar 70°C.
Tahap netralisasi
Pada tahap ini terjadi reaksi netralisasi antara amonium karbonat yang tidak bereaksi pada reaktor dengan asam sulfat sehingga membentuk amonium sulfat tambahan. Reaksi yang terjadi adalah sebagai berikut :
Asam sulfat yang digunakan dengan kadar 98 % masuk pada suhu 65oC. Reaksi terjadi pada tekanan 1 atm dan suhu 65oC. Hasil reaksi yang berupa karbondioksida dibuang langsung ke udara.
Tahap evaporasi
Pada tahap evaporasi terjadi pemekatan larutan amonium sulfat. Evaporator bekerja pada kondisi vakum tekanan 0,57 bar dan suhu 85oC. Sebagai tenaga pemanas digunakan steam. Air yang menguap ditangkap oleh barometric condensor. Alasan digunakannya sistem vakum yaitu karena pada suhu tinggi senyawa sulfat pada amonium sulfat akan terdekomposisi menjadi sulfit. Larutan pekat keluar pada suhu 85oC.
Tahap kristalisasi
Crystalizer beroperasi pada suhu 65oC dan tekanan 0,57 bar. Larutan jenuh yang berasal dari evaporator didinginkan secara tiba-tiba dengan air pendingin. Uap air dialirkan menuju barometric condenser. Suspensi kristal masuk ke centrifuge dimana kristal dipisahkan dari mother liquor. Kristal basah masuk ke dryer dan
mother liquor dialirkan kembali ke netralizer pada suhu 65oC.
Tahap Pengeringan
Kristal basah dari centrifuge dengan kandungan air 5% diangkut oleh screw conveyor untuk dimasukkan ke dryer. Dryer yang digunakan adalah jenis rotary dryer. Proses pengeringan dilangsungkan pada suhu 100oC . Sebagai tenaga pemanas adalah udara panas dan kering yang dipanaskan dengan menggunakan saturated steam dari unit utilitas. Kristal kering dengan kadar air tidak lebih dari 1 % (BSN, 2012) dan bebas dari asam bebas keluar dari rotary drier kemudian dimasukkan ke