BAB 2
TINJAUAN PUSTAKA
2.1. Air
Air merupakan suatu senyawa yang terdiri dari hidrogen dan oksigen dengan rumus kimia H2
Chang (2003) mengemukakan bahwa air merupakan pelarut yang sangat baik untuk berbagai senyawa ionik dan untuk berbagai zat lain yang mampu membentuk ikatan hidrogen. Untuk memahami tentang air maka perlu mengkaji struktur elektron molekul H
O ( Dumairy, 1992).
2O. Seperti yang terlihat dibawah ini :
Walaupun banyak senyawa yang mampu membentuk ikatan hidrogen antarmolekul, perbedaan antara H2O dan molekul polar yang lain seperti NH3
Air merupakan sumber daya alam yang diperlukan untuk hajat hidup orang banyak, bahkan oleh semua mahluk hidup. Oleh karena itu, sumber daya air harus dilindungi agar tetap dimanfaatkan dengan baik oleh manusia serta mahluk hidup yang lain ( Effendi, 2003).
dan HF adalah bahwa setiap atom oksigen dapat membentuk dua ikatan hidrogen, sama dengan jumlah pasangan elektron bebas pada atom oksigen.
:O: H H
Air merupakan kebutuhan yang tidak dapat ditinggalkan bagi kehidupan manusia, karena air diperlukan untuk kebutuhan bermacam-macam kegiatan seperti minum, pertanian dan industri. Air dapat diminum adalah air yang bebas dari bakteri berbahaya. Air minum harus bersih dan jernih, tidak berbau dan tidak berwarna serta tidak mengandung bahan tersuspensi atau kekeruhan. Manusia sejak dahulu kala sudah menyadari betapa pentingnya air. Secara global tubuh manusia dewasa mengandung air sebanyak 50-70% dari bobot tubuhnya. Bila tubuh kehilangan air sebanya 15% dari bobot tubuhnya maka akan mengakibatkan kematian
2.1.1. Air Baku
2.1.1.1 Defenisi Air Baku
Sumber air baku memegang peranan yang sangat penting dalam industri air minum. Air baku atau raw water merupakan awal dari suatu proses dalam penyediaan dan pengolahan air bersih. Defenisi air baku adalah “Air yang berasal dari sumber air pemukaan, cekungan air tanah dan atau air hujan yang memenuhi ketentuan baku mutu tertentu sebagai air baku untuk air minum”
Sumber air baku bisa berasal dari sungai, danau, sumur air dalam, mata air dan bisa juga dibuat dengan cara membendung air buangan atau air laut. Evaluasi dan pemilihan sumber air yang layak harus berdasar dari ketentuan berikut : 1. Kualitas dan kuantitas air yang diperlukan
2. Kondisi iklim
3. Tingkat kesulitan pada pembangunan intake
5. Ketersediaan biaya minimum operasional dan pemeliharaan untuk IPA
6. Kemungkinan terkontaminasinya sumber air pada masa yang akan datang
7. Kemungkinan untuk memperbesar intake pada masa yang akan datang
2.1.1.2. Karakteristik Air Baku
Penyediaan air bersih, selain kuantitasnya, kualitasnya pun harus memenuhi standar yang berlaku. Dalam hal air bersih, sudah merupakan praktek umum bahwa dalam menetapkan kualitas dan karakteristik dikaitkan dengan suatu baku mutu air tertentu (standar kualitas air). Untuk memperoleh gambaran yang nyata tentang karakteristik air baku, seringkali diperlukan pengukuran sifat-sifat air atau biasa disebut parameter kualitas air, yang beraneka ragam. Formulasi- formulasi yang dikemukakan dalam angka-angka standar tentu saja memerlukan penilaian yang kritis dalam menetapkan sifat-sifat dari tiap parameter kualitas air .
Standar kualitas air adalah baku mutu yang ditetapkan berdasarkan sifat-sifat fisik, kimia, radioaktif maupun bakteriologis yang menunjukkan persyaratan kualitas air tersebut. Peraturan Pemerintah Republik Indonesia No. 82 Tahun 2001 Tentang Pengelolaan Kualitas Air Dan Pengendalian Pencemaran Air, air menurut kegunaannya digolongkan menjadi :
Kelas I : Air yang peruntukannya dapat digunakan untuk air baku air minum atau peruntukan lain yang mempersyaratkan mutu air yang sama dengan kegunaan tersebut.
pertanaman atau peruntukan lain yang mempersyaratkan mutu air yang sama dengan kegunaan tersebut.
Kelas III : Air yang peruntukannya dapat digunakan untuk pembudidayaan ikan air tawar, peternakan, air untuk mengairi pertanaman atau peruntukan lain yang mempersyaratkan mutu air yang sama dengan kegunaan tersebut
2.1.2. Air Reservoir
Air reservoir adalah air yang telah melalui filter sudah dapat dipakai untuk air minum. Air tersebut telah bersih dan bebas dari bakteriologis dan ditampung pada bak reservoir untuk diteruskan pada konsumen ( Sutrisno, 2004).
2.2. Golongan Air
Peraturan pemerintah No. 20 tahun 1990 mengelompokkan kualitas air menjadi beberapa golongan menurut peruntukannya. Adapun penggolongan air menurut peruntukannya adalah sebagai berikut :
a) Golungan A, yaitu air yang dapat digunakan sebagai air minum secara langsung, tanpa pengolahan terlebih dahulu.
b) Golongan B, yaitu air yang dapat digunakan sebagai air baku air minum. c) Golongan C, yaitu air yang dapat digunakan untuk keperluan perikanan dan
peternakan.
2.3. Sifat Umum Air
Gabriel (2011) mengemukakan tentang sifat umum air yaitu : 1. Sifat Fisik
f. Panas penguapan 540 kal/gram C
g. Temperatur kritis 347 atm
h. Konduktivitas listrik spesifik (25oC) 1x10-17 i. Konstantya dielektrik (25
/ ohm-cm o
2. Sifat Kimia
C)
Sifat kimia dari air adalah sebagai berikut :
a. air dapat terurai oleh pengaruh arus listrik dengan reaksi dibawah ini :
H2O → H+ + OH
Gambar 2.2. Reaksi Penguraian Air -
b. air merupakan pelarut yang baik
c. air dapat bereaksi dengan asam kuat dan basa kuat
2.4. Sumber - sumber Air
Air yang berada di permukaan bumi ini dapat berasal dari berbagai sumber. Berdasarkan letak sumbernya, air dapat dibagi menjadi air angkasa (hujan), air permukaan dan air tanah.
1. Air angkasa (hujan)
Air angkasa atau air hujan merupakan sumber utama air di bumi. Walau pada saat presipitasi merupakan air yang paling bersih, air tersebut cenderung mengalami pencemaran ketika berada di atmosfer. Pencemaran yang terjadi langsung di atmosfer itu dapat disebabkan oleh partikel debu, mikroorganisme dan gas. Misalnya karbon dioksida, nitrogen dan ammonia.
2. Air permukaan
Air permukaan meliputi badan-badan air semacam sungai, danau, telaga, waduk, rawa, air terjun dan sumur permukaan. Sebagian besar berasal dari hujan yang jatuh ke permukaan bumi. Air hujan tersebut kemudian akan mengalami pencemaran baik oleh tanah, sampah, maupun yang lainnya.
Air permukaan merupakan salah satu sumber penting bahan baku air bersih. Faktor-faktor yang harus diperhatikan, antara lain :
a. Mutu atau kualitas baku b. Jumlah atau kuantitasnya c. Kontinuitasnya
3. Air tanah
Air tanah (ground water) berasal dari air hujan yang jatuh ke permukaan bumi yang kemudian mengalami perkolasi atau penyerapan kedalam tanah dan mengalami proses filtrasi secara alamiah. Proses-proses yang telah dialami oleh air hujan tersebut, didalam perjalanannya kebawah tanah, membuat air tanah menjadi lebih baik dan lebih murni dibandingkan air permukaan.
Air tanah memiliki beberapa kelebihan dibanding sumber air yang lain. Pertama, air tanah biasanya terbebas dari kuman penyakitdan tidak perlu mengalami proses purifikasi atau penjernihan. Persediaan air tanah juga cukup tersedia sepanjang tahun, saat musim kemarau sekalipun. Sementara itu air tanah juga memiliki beberapa kerugian atau kelemahan dibanding sumber air lainnya. Air tanah mengandung zat-zat mineral dalam konsentrai yang tinggi. Konsentrasi yang tinggi dari zat-zat mineral semacam magnesium, kalsium, dan logam berat seperti besi dapat mengakibatkan kesadahan air. Akibatnya apabila menggunakan air sadah untuk mencuci, sabun tidak akan berbusa dan bila diendapkan akan terbentuk endapan semacam perak. Selain itu untuk menghisap dan mengalirkan air ke atas permukaan diperlukan pompa (Chandra, 2007).
2.5. Pembagian Air Berdasarkan Analisis
Berdasarkan analisis air maka air digolongkan menjadi 3 (tiga), yaitu: 1. Air kotor/air tercemar
2. Air bersih
Air yang sudah terpenuhi syarat fisik, kimia, namun bakteriologinya belum terpenuhi. Air bersih ini diperoleh dari sumur gali, sumur bor, air hujan, air sumber yang dari mata air.
3. Air minum
Air minum ialah air yang sudah terpenuhi sifat fisik, kimia, maupun
bakteriologi serta level kontaminasi maksimum (LKM). Level kontaminasi maksimum meliputi kekeruhan, kandungan zat kimia organik atau anorganik, dan jumlah bakteri coliform ( Gabriel, 2001).
2.6. Karakteristik Air
Air memiliki karakteristik fisika, kimia dan biologis yang sangat mempengaruhi kualitas air tersebut. Oleh sebab itu, pengolahan air mengacu kepada beberapa parameter guna memperoleh air yang layak digunakan.
2.6.1. Karateristik Fisika Air
Karakter fisik air ialah karakter pada air yang dapat terlihat langsung melalui fisik air tanpa harus melakukan pengamatan yang lebih jauh pada air tersebut. Karakteristik fisik air meliputi:
1. Kekeruhan
2. Temperatur
Temperatur dalam air merupakan hal penting dalam kaitannya dengan tujuan penggunaan, pengolahan untuk menghilangkan bahan-bahan pencemar. 3. Warna
Air murni tidak berwarna. Warna didalam air diakibatkan oleh adanya material yang larut. Air yang mengalir melewati rawa atau tanah yang mengandung mineral dimungkinkan untuk mengambil warna material tersebut.
4. Bau dan rasa
Air murni tidak berbau dan berasa. Rasa dalam air biasanya diakibatkan oleh garam-garam terlarut. Bau dan rasa pada air terjadi karena kehadiran mikroorganisme, bahan mineral, dan bahan-bahan organik ( Suripin, 2002).
2.6.2. Karakteristik Kimia Air
Karakteristik kimia air meliputi banyaknya senyawa kimia yang terdapat di dalam air, sebagian diantaranya berasal dari alam secara alamiah dan sebagian lagi sebagai kontribusi aktivitas makhluk hidup. Karakteristik kimia air meliputi: 1. pH
2. DO (Dissolved Oxigen)
DO adalah jumlah oksigen terlarut yang berasal dari fotosintesa dan absorbsi atmosfer/udara. Semakin banyak jumlah DO maka kualitas air semakin baik. 3. BOD (Biological Oxigen Demand)
BOD adalah banyaknya oksigen yang dibutuhkan oleh mikroorganisme untuk menguraikan bahan-bahan organik (zat pencerna) yang terdapat di dalam air secara biologi.
4. COD (Chemical Oxigen Demand)
COD adalah banyaknya oksigen yang dibutuhkan untuk mengoksidasi bahan-bahan organik secara kimia.
5. Kesadahan
Kesadahan air yang tinggi akan mempersulit efektifitas pemakaian sabun, namun sebaliknya dapat memberikan rasa yang segar. Di dalam pemakaian untuk industri (air ketel, air pendingin, atau pemanas) adanya kesadahan dalam air tidaklah dikehendaki. Kesadahan yang tinggi bisa disebabkan oleh adanya kadar residu terlarut yang tinggi dalam air.
6. Senyawa-senyawa kimia yang bersifat racun didalam air
Zat-zat kimia yang larut dalam air yang dapat mengganggu bahkan membahayakan bagi kesehatan manusia antara lain :
1. Arsen
2. Barium
Kadar maksimum yang masih diperbolehkan dalam air 1,5 mg/l. Dikenal sebagai bahan kimia yang bersifat toksis terhadap hati, aliran darah dan nervous.
3. Cadmium
Kadar maksimum yang masih diperbolehkan dalam air 0,01 mg/l. Sebagai racun yang akut bagi manusia melalui makanan
4. Chromium
Kadar maksimum yang masih diperbolehkan dalam air 0,05 mg/l. Bersifat karsinogenik pada pernafasan. Bersifat kumulatif dalam daging tikus pada kadar mg/l.
5. Lead (timah hitam )
Kadar maksimum yang diperbolehkan dalam air 0,05 mg/l. Dikenal sebagai racun melalui makanan, air, udara dan menghisap rokok.
6. Merkuri
Kadar maksimum yang diperbolehkan dalam air 0,002 mg/l. Dikenal sebagai racun pada pekerja dan ikan. Terdapat didalam air kurang dari 1 mg/l. Terdapat di makanan 10-70.
7. Nitrat
8. Selenium
Kadar maksimum yang masih diperbolehkan dalam air minum 0,01 mg/l. Dikenal sebagai racun yang behubungan dengan pekerjaan. Dan menyebabkan keracunan pada anak bila lebih dari 3-4 mg/kg makanan masuk.
9. Silver (perak )
Kadar maksimum yang masih diperbolehkan dalam air minum 0,05 mg/l menyebabkan penyakit argria, warna kulit yang kelabu kebiru-biruan. 10. Sulfat
Konsentrasi maksimum yang masih diperbolehkan dalam air 250 mg/l. Menyebabkan laxative apabila kadarnya berupa maksimum dan sodium. 11. Besi
Konsentrasi maksimum yang masih diperbolehkan dalam air 0,3 mg/l. Besi berguna untuk metabolisme. Nilai ambang rasa 2 mg/l, menimbulkan warna, menyebabkan timbulnya koloidal yang berwarna dalam air.
12. Tembaga
Konsentrasi yang masih diperbolehkan dalam air 1 mg/l. Penting untuk metabolisme. Menyebabkan air mempunyai rasa tertentu. Nilai ambang rasa 1-5 mg/l.
13. Chlorida
14. Fluor
Kekurangan fluor di dala air dapat menyebabkan karies gigi, dan kelebihan fluor menyebabkan penyakit fluoresis. Kadar di dalam air minum 1-2 mg/l (Sutrisno, 2004).
2.6.3. Karakteristik Biologis Air
Berbagai macam organisme hidup dalam air lebih banyak ditemukan pada air permukaan daripada air tanah, karena proses penyaringan oleh lapisan tanah. Jenis-jenis organisme yang terdapat dalam air meliputi organisme mikroskopik dan makroskopik.
Organisme mikroskopik seperti bakteri dan coliform dapat ditemukan dalam air. Bakteri yang hidup di perairan umumnya uniseluler, tidak memiliki klorofil, berkembangbiak dengan pembelahan sel secara transversal atau biner, sebagian besar (± 80%) berbentuk batang. Secara umum hidupnya saprofitik pada sisa buangan hewan atau tanaman yang sudah mati, ada juga yang bersifat parasitik pada hewan dan manusia sehingga dapat menyebabkan penyakit.
Coliform tidak termasuk dalam taksonomi bakteri namun hanya istilah
Berdasarkan Peraturan Menteri Kesehatan no. 492/MENKES/PER/2010, coliform tidak boleh terdapat di dalam air minum. Organisme mikroskopik lainnya seperti; jamur, alga, dan virus juga terdapat di dalam air. Jamur adalah tanaman yang dapat tumbuh tanpa sinar matahari dan pada waktu tertentu dapat merajalela pada pipa-pipa air, sehingga menimbulkan rasa dan bau yang tidak enak. Sementara alga adalah tumbuhan kecil yang hidup di air yang jika dalam jumlah yang besar dapat mempengaruhi rasa, warna, dan bau pada air. Pertumbuhan alga yang berlebihan dapat dikontrol dengan penambahan tembaga sulfat. Dan virus adalah mikrooganisme penyebab infeksi dan ukurannya lebih kecil dari bakteri. Virus dalam air biasanya dikendalikan dengan klorinasi dikombinasikan dengan proses penonaktifan virus (Suripin, 2002).
2.7. Pencemaran Air
Pencemaran air dapat merupakan masalah, regional maupun lingkungan global dan sangat berhubungan dengan pencemaran udara serta penggunaan lahan tanah atau daratan. Pada saat udara yang tercemar jatuh ke bumi bersama dengan air hujan, maka air tersebut sudah tercemar. Beberapa jenis bahan kimia untuk pupuk dan pestisida pada lahan pertanian akan terbawa oleh air dan akan mencemari lokasi bersangkutan. Dengan demikian banyak sekali penyebab terjadinya pencemaran air ini (Darmono, 2001).
2.7.1. Indikator Pencemar Air
Situmorang (2007) mengemukakan beberapa indikator terhadap pencemaran air dapat diamati dengan melihat perubahan keadaan air yang meliputi :
1. Perubahan suhu air
Air dalam keadaan normal memiliki pH 6,0-7,5. Tingkat keasaman air dapat berubah disebabkan oleh hadirnya senyawa kimia buangan ke dalam air. Mahluk hidup harus beradaptasi terhadap kadar keasaman, tingkat basa dan kadar salinitas. Kemudian meningkatnya kadar basa di dalam air biasanya tidak berasal dari aktivitas manusia secara langsung, akan tetapi berasal dari pelapukan bahan mineral didalam tanah. Lalu salinitas air juga dapat meningkat yang disebabkan oleh penambhan pupuk kedalam air pertanian, kemudian dengan adanya musim kemarau akan meyebabkan kadar garam di dalam air menjadi meningkat karena proses perubahan konsentrasi.
3. Perubahan warna, bau dan rasa pada air
Air bersih dalam keadaan normal tidak berwarna, tidak berbau dan tidak berasa. Masuknya limbah kedalam air akan mengakibatkan perubahan warna, bau dan rasa pada air.
4. Terbentuknya endapan dan koloid
Terbentuknya endapan dan koloid dari bahan terlarut juga merupakan indikator pencemaran air. Bahan buangan dari industri bila tidak melarut sempurna didalam air maka akan mengakibatkan terbentuknya koloid dan ada pula membentuk endapan pada dasar air setelah didiamkan beberapa saat. 5. Mikroorganisme dalam air
2.8. Proses Pengolahan Air
Dalam proses pengolahan air ini lazimnya dikenal dengan dua cara yakni :
1. Pengolahan Lengkap atau Complete Treatment Process, yaitu air yang akan mengalami pengolahan lengkap, baik secara fisik, kimia dan bakteriologis.
a. Pengolahan Fisik, yaitu suatu tingkat pengolahan yang bertujuan untuk mengurangi atau menghilangkan kotoran-kotoran yang kasar, penyisihan lumpur dan pasir, serta mengurangi kadar zat-zat organik yang ada didalam air.
b. Pengolahan kimia, yaitu suatu tingkat pengolahan dengan menggunakan zat- zat kimia membantu proses pengolahan selanjutnya. Misalnya dengan pembubuhan kapur dalam proses pelunakan dan sebagainya.
c. Pengolahan bakteriologis, yaitu suatu tingkat pengolahan untuk membunuh atau memusnahkan bakteri-bakteri yang terkandung didalam air dengan cara membubuhkan kaporit ( zat desinfektan).
2. Pengolahan sebagian atau Partial Treatment Process
Misalnya dengan diadakan pengolahan kimia atau pengolahan bakteriologis saja. Pengolahan ini pada lazimnya dilakukan untuk: Mata air bersih dan air dari sumur yang dalam ( Sutrisno, 2004).
2.9.Ammonia
didalam air. Mikroorganisme tersebut akan mengoksidasi ammonium menjadi nitrit dan akhirnya menjadi nitrat.
Proses oksidasi ammonium menjadi nitrit dilakukan oleh jenis-jenis bakteri seperti Nitrosomonas
NH4 + O2 Nitrosomonas NO2 + 2H2
Gambar 2.3. Reaksi Nitrifikasi Menjadi Nitrit O
Selanjutnya nitrit oleh aktivitas bakteri dari kelompok nitrobacter akan dioksidasi lebih lanjut menjadi nitrat
2NO2 + O2 Nitrobacter 2NO
Gambar 2.4. Reaksi Nitrifikasi Menjadi Nitrat 3
(Jenie, 1993)
Terdapatnya ammonia didalam air erat hubungannya dengan siklus N di alam ini. Dengan melihat siklus N dapat diketahui bahwa ammonis dapat terbentuk dari :
d. Dekomposisi bahan-bahan organik yang mengandung N baik yang berasal dari hewan (misalnya feses) oleh bakteri
e. Hidrolisa urea yang terdapat pada urin hewan
f. Dekomposisi bahan-bahan organik dari tumbuh-tumbuhan yang mati oleh bakteri.
ditanah oleh hujan. Dengan melalui pembentukannya menjadi protein organik yang terjadi selanjutnya, dan oleh dekomposisi bakteri akhirnya akan terbentuk ammonia.
h. Dari reduksi NO2 (Sutrisno, 2004)
oleh bakteri
Ammonia (NH3
N organik + O
) dan garam-garamnya bersifat mudah larut dalam air. Ion ammonium adalah bentuk transisi dari ammonia. Ammonia banyak digunakan dalam proses produksi urea. Industri bahan kimia ( asam nitrat, ammonium sulfat, ammonium nitrat dan ammonium sulfat) serta industri bubur kertas dan kertas (pulp dan paper). Sumber ammonia diperairan adalah pemecahan nitrogen organik (protein dan urea) dan nitrogen anorganik yang terdapat didalam tanah dan air, yang berasal dari dekomposisi bahan organik ( tumbuhan dan biota akuatik yang telah mati) oleh mikroba dan jamur. Proses ini dikenal dengan istilah amonifikasi, ditunjukkan dalam persamaan reaksi :
2 → NH3-N + O2 → NO2-N + O2 Gambar 2.5. Reaksi Amonifikasi
→ NO3-N
Reduksi nitrat (denitrifikasi) oleh aktivitas mikroba pada kondisi anaerob, yang merupakan proses yang biasa terjadi pada pengolahan limbah, juga menghasilkan gas ammonia dan gas-gas lain, misalnya N2O, NO, NO2 dan N2.
bentuk gas dan membentuk kesetimbangan dengan gas amonium. Kesetimbangan antara gas ammonia dan gas ammonium ditunjukkan dalam persamaan reaksi :
NH3 + H2O → NH4+ + OH
Gambar 2.6. Reaksi Kesetimbangan Ammonia dan Ammonium
Selain terdapat dalam bentuk gas, ammonia membentuk kompleks dengan beberapa ion logam. Ammonia juga dapat terserap ke dalam bahan-bahan tersuspensi dan koloid sehingga mengendap di dasar perairan. Ammonia di perairan dapat menghilang melalui proses volatilisasi karena tekanan parsial ammonia dalam larutan meningkat dengan semakin meningkatnya pH. Hilangnya ammonia ke atmosfer juga dapat meningkat dengan meningkatnya kecepatan angin dan suhu.
Ammonia yang terukur di perairan berupa amonia total (NH3 dan NH4+
Ammonia bebas (NH
). Ammonia bebas tidak dapat terionisasi, sedangkan ammonium dapat terionisasi. Presentase ammonia bebas meningkat dengan meningkatnya pH di perairan. Pada pH 7 atau kurang, sebagian ammonia akan mengalami ionisasi. Sebaliknya, pada pH lebih besar dari 7, ammonia tidak terionisasi yang bersifat toksik terdapat dalam jumlah yang banyak.
mengganggu proses pengikatan oksigen oleh darah dan pada akhirnya akan mengakibatkan sufokasi. Akan tetapi, ammonia bebas ini tidak dapat diukur secara langsung ( Effendi, 2003).
Kosnsentrasi ammonia yang tinggi pada permukaan air akan menyebabkan kematian ikan yang terdapat pada perairan tersebut. Keasaman air atau nilai pH nya sangat mempengaruhi apakah jumlah ammonia yang akan bersifat racun atau tidak. Pengaruh pH terhadap toksisitas ammonia ditunjukkan dengan keadaan pada kondisi pH rendah akan bersifat racun bila jumlah ammonia banyak, sedangkan pada pH tinggi, hanya dengan jumlah ammonia yang rendah pun sudah akan bersifat racun. Toksisitas ammonia juga tergantung dari jumlah ammonia yang masuk dalam sel tumbuhan dan hewan ( Jenie, 1993).
2.10. Metode Penentuan Ammonia
2.10.1.Metode Penentuan Ammonia Dengan Titrasi
Pada metode ini dilakukan dengan menggunakan larutan H2SO4 0,2 N sampai larutan berwarna sama dengan larutan blanko yang terdiri dari air suling bebas ammonia dan H3BO3, yang volumenya sama dengan sampel.
2.10.2.Metode Penentuan Ammonia Dengan Menggunakan Elektroda
2.10.3.Metode Penentuan Ammonia Dengan Menggunakan
Spektrofotometer
Pada metode ini dilakukan dengan cara menyiapkan dua buah sampel agar teliti, standar dan blanko harus disiapkan secata serempak dan dengan menggunakan larutan reagen Nessler yang sama. Dengan menggunakan spektrofotometer, ukurlah panjang gelombang standar pada 400-425 nm terhadap blanko (Alaerst, 1984).
2.11. Spektrofotometer
Spektrofotometer sesuai dengan namanya adalah alat yang terdiri dari spektrometer dan fotometer. Spektrometer menghasilkan sinar dari spektrum panjang gelombang tertentu dan fotometer adalah adalah alat pengukur intensitas cahaya yang ditransmisikan atau diabsorpsi. Jadi spektrofotometer digunakan untuk mengukur energi secara relatif jika energi tersebut ditransmisikan, direflaksikan atau diemisikan sebagai fungsi dari panjang gelombang. Kelebihan spektrofotometer dibandingkan dengan fotometer adalah panjang gelombang dari sinar dengan panjang yang diinginkan diperoleh dengan berbagai filter dari berbagai warna yang mempunyai spesifikasi melewatkan trayek panjang gelombang tertentu. (Khopkar, 2003)
Mata manusia dapat mendeteksi 10.000 perbedaan gradasi warna. Pada maksimum spektrofotometer dapat mendeteksi lebih dari 2 juta gradasi warna.
Setiap spektrofotometer terdiri dari instrumen berikut: 1. Sumber cahaya
2. Perangkat untuk mendapatkan cahaya monokromatik 3. Sebuah sel penyerapan untuk sampel dan satu untuk blanko 4. Sarana mengukur perbedaan penyerapan antara sampel dan
(Snell And Cornelia, 1948)
blanko
2.11.1.Komponen Spektrofotometer
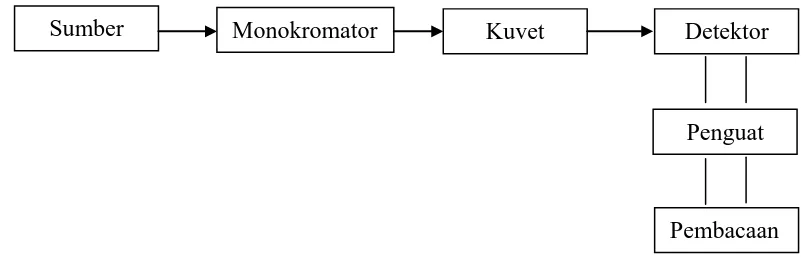
Komponen-komponen yang terpenting dari suatu spektrofotometer terdiri dari sumber spektrum, monokromator, sel pengabsorpsi dan detektor.
1. Sumber, sumber yang biasa digunakan pada spektrofotometri absorpsi adalah lampu wolfram. Arus cahaya tergantung pada tegangan lampu. Lampu hidrogen atau lampu deuterium digunakan untuk sumber pada daerah UV. Kebaikan lampu wolfram adalah energi radiasi yang dibebaskan tidak bervariasi pada berbagai panjang gelombang.
2. Monokromator, digunakan untuk memperoleh sumber, sinar yang monokromatis. Alatnya dapat berupa prisma ataupun grating. Untuk mengarahkan sinar monokromatis yang diinginkan dari hasil penguraian ini dapat digunakan celah.
digunakan. Sel yang biasa digunakan berbentuk persegi tetapi bentuk silinder dapat juga digunakan.
4. Detektor, peranan detektor penerima adalah memberikan respon terhadap cahaya pada berbagai panjang gelombang.
Day dan Underwood (2002) mengemukakan bahwa unsur-unsur spektrofotometer ditunjukkan secara skematik dalam gambar berikut :
Gambar 2.7. Skematik Spektrofotometer
2.11.2.Cara Kerja Spekrofotometer
Cara kerja spektrofotometer secara singkat adalah : tempatkan larutan pembanding, misalnya blanko dalam sel pertama sedangkan larutan yang akan dianalisis pada sel kedua. Kemudian pilih fotosel yang cocok 200 nm – 650 nm
(600-1100) agar daerah λ yang diperlukan dapat terliputi. Dengan ruang fotosel
dalam keadaan tertutup “nol” galvanometer dengan menggunakan tombol darkcurrent. Pilih yang diinginkan, buka fotosel dan lewatkan berkas cahaya pada
blangko dan “nol” galvanometer didapat dengan memutar tombol sensitivitas. Dengan menggunakan tombol transmitansi, kemudian atur besarnya pada 100 %. Lewatkan berkas cahaya pada larutan sampel yang akan dianalisis. Skala absorbansi menunjukkan absorbansi larutan sampel (Khopkar, 2003).
Sumber Monokromator Kuvet Detektor
Penguat