Informasi Dokumen
- Penulis:
- Rizkiyatul Auliyah
- Pengajar:
- Dr. Kusnoto, drh., M.Si
- Dr. Iwan Sahrial Hamid, drh., M.Si
- Prof. Dr. Setiawan Koesdarto, drh., M.Sc
- Arimbi, drh., M.Kes
- Sri Mumpuni Sosiawati, drh., M.Kes
- Sekolah: Universitas Airlangga
- Mata Pelajaran: Veterinary Medicine
- Topik: Gambaran Histopatologi Hepar Ayam Pedaging Yang Diinfeksi L 2 Toxocara vitulorum
- Tipe: thesis
- Tahun: 2016
- Kota: Surabaya
Ringkasan Dokumen
I. Introduction
This section introduces the significance of Toxocara vitulorum as a zoonotic pathogen affecting broiler chickens. The background highlights the economic impact of toxocariasis on livestock productivity, particularly in tropical and subtropical regions. The study aims to investigate the histopathological changes in the liver of infected chickens, addressing a gap in the literature regarding the organ's response to larval migration.
1.1 Background
The background discusses the prevalence of Toxocara vitulorum in livestock and its potential transmission to humans through undercooked meat. It emphasizes the need for understanding the histopathological effects of the parasite on the liver, which is crucial for both veterinary and public health.
1.2 Problem Statement
The problem statement articulates the primary research question: how does L2 Toxocara vitulorum infection affect the histopathology of the liver in broiler chickens? This sets the stage for a focused investigation into the specific changes observed post-infection.
1.3 Theoretical Framework
This section outlines the theoretical basis for the study, including the life cycle of Toxocara vitulorum and its pathogenic mechanisms. It provides context for the histopathological findings, linking them to the broader implications for animal health and zoonotic disease transmission.
1.4 Research Objectives
The objectives of the study are clearly defined, aiming to document and analyze the histopathological changes in the liver of infected chickens, thereby contributing to the understanding of toxocariasis in agricultural settings.
1.5 Significance of the Study
The significance emphasizes the potential benefits of the research for veterinarians, farmers, and public health officials. It highlights how the findings could inform management practices and reduce the risk of zoonotic transmission.
1.6 Research Hypothesis
The hypothesis posits that infection with L2 Toxocara vitulorum will lead to significant histopathological changes in the liver of broiler chickens, which will be tested through empirical analysis.
II. Literature Review
This section reviews existing literature on Toxocara vitulorum, its classification, morphology, life cycle, pathogenesis, clinical symptoms, diagnosis, and zoonotic aspects. It establishes a foundation for the study by summarizing relevant research findings and identifying gaps that the current study aims to address.
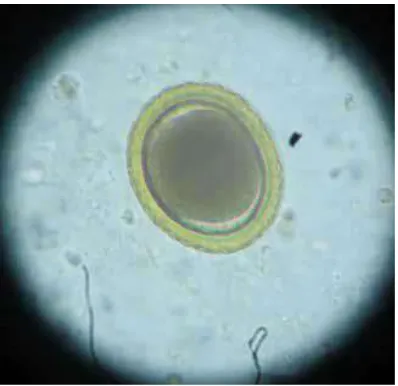
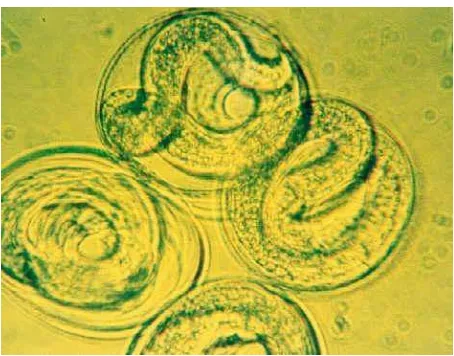
2.1 Toxocara vitulorum
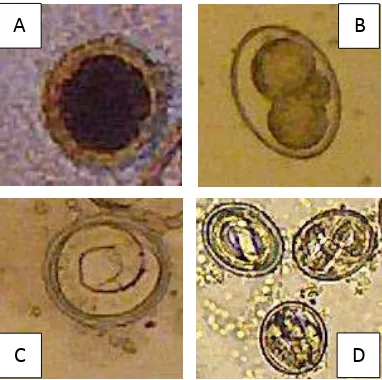
This subsection details the classification and characteristics of Toxocara vitulorum, providing insights into its biological behavior and ecological niche. It discusses the importance of understanding the parasite's morphology and life cycle for effective control measures.
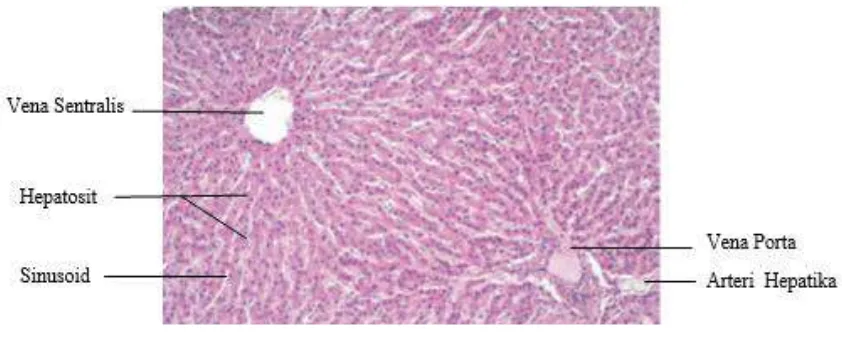
2.2 Liver of Chickens
This subsection focuses on the histological and physiological aspects of chicken liver, explaining its role in metabolism and detoxification. Understanding the normal structure and function of the liver is crucial for recognizing pathological changes caused by parasitic infections.
2.3 Broiler Chickens
This subsection defines broiler chickens and their significance in poultry production. It highlights their rapid growth and the economic implications of disease outbreaks in this sector, reinforcing the relevance of studying infections like toxocariasis.
III. Research Methodology
The methodology section outlines the experimental design, including the location, materials, and methods used to assess the histopathological changes in the liver of infected chickens. It details the procedures for infection, sample collection, and data analysis, ensuring reproducibility and scientific rigor.
3.1 Research Location and Time
This subsection specifies where and when the research was conducted, providing context for the experimental conditions and the relevance of the findings to the local agricultural context.
3.2 Study Design
The study employs a true experimental design, detailing how chickens were randomly assigned to treatment and control groups. This ensures the validity of the results and the ability to draw meaningful conclusions from the data.
3.3 Variables
This subsection identifies the dependent, independent, and controlled variables involved in the study. Clear definitions help clarify the focus of the research and the relationships being tested.
3.4 Operational Definitions
Operational definitions of key terms such as degeneration, necrosis, and cholangitis are provided to ensure clarity and consistency in the interpretation of results.
3.5 Materials and Instruments
A comprehensive list of materials and instruments used in the study is presented, including the specific types of equipment and reagents necessary for conducting the experiments and analyses.
3.6 Research Methods
Detailed procedures for isolating and preparing Toxocara vitulorum eggs, infecting the chickens, and collecting liver samples are described. This section emphasizes the scientific methods employed to ensure accurate and reliable results.
3.7 Data Analysis
The data analysis section outlines the statistical methods used to evaluate the results, including the Kruskal-Wallis test and Z-test. This ensures that the findings are statistically valid and can be interpreted with confidence.
IV. Results
The results section presents the findings from the histopathological examinations of the liver samples. It includes quantitative data on the degree of damage observed in different treatment groups, highlighting significant differences and trends over time.
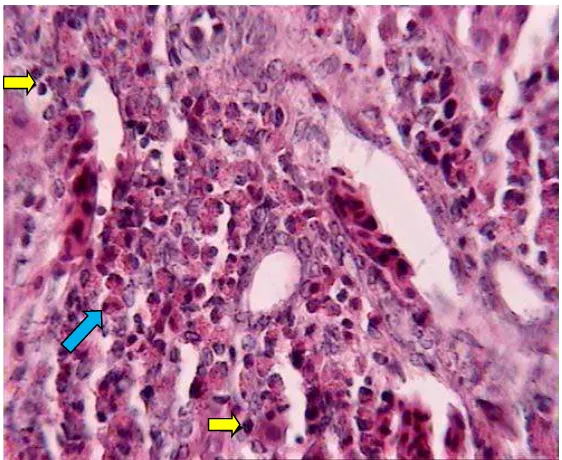
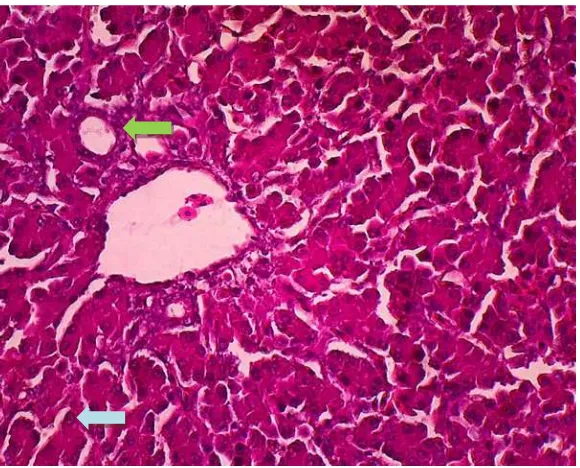
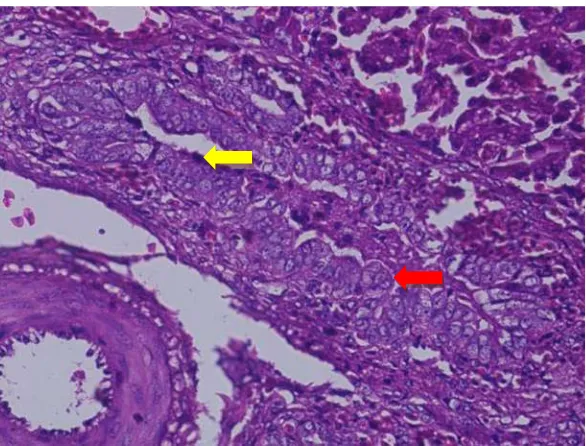
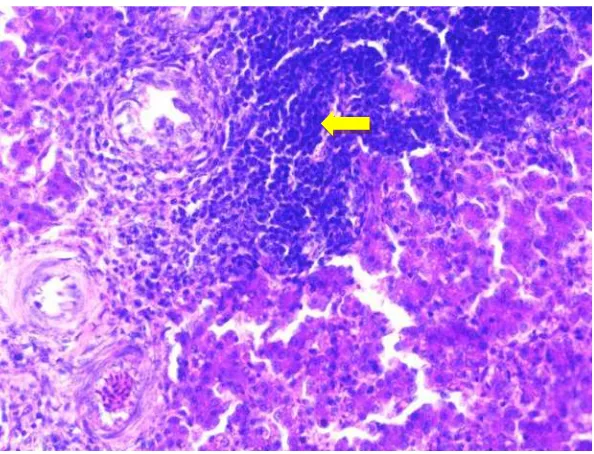
4.1 Histopathological Findings
This subsection summarizes the histopathological changes observed in the liver of infected chickens, including degeneration, necrosis, and inflammation. The findings are correlated with the duration of infection, emphasizing the progressive nature of the damage.
V. Discussion
In the discussion section, the implications of the findings are analyzed in relation to existing literature. The results are interpreted in the context of the pathogenesis of toxocariasis and its impact on poultry health and productivity.
5.1 Interpretation of Results
This subsection delves into the significance of the observed histopathological changes, discussing how these findings contribute to the understanding of Toxocara vitulorum's effects on broiler chickens and the potential risks for zoonotic transmission.
VI. Conclusion and Recommendations
The conclusion summarizes the key findings of the study, reinforcing the importance of monitoring and managing Toxocara vitulorum infections in poultry. Recommendations for future research and practical applications in veterinary medicine and public health are also provided.
6.1 Summary of Findings
This subsection encapsulates the main findings of the research, highlighting the critical histopathological changes observed in the liver of infected chickens.
6.2 Future Research Directions
Suggestions for future research are provided, emphasizing the need for further studies to explore the long-term effects of Toxocara vitulorum infections and potential control measures.