SKRIPSI
GAMBARAN HISTOPATOLOGI HEPAR MENCIT
(Mus musculus) YANG DIINFEKSIToxoplasma
gondii SECARA INTRAVAGINA
Oleh
VONNY PRASETYA IRGANTARA NIM 061111150
FAKULTAS KEDOKTERAN HEWAN UNIVERSITAS AIRLANGGA
SURABAYA 2015
Telah dinilai pada Seminar Hasil Penelitian Tanggal :24Agustus 2016
KOMISI PENILAI SEMINAR HASIL PENELITIAN
Ketua : Dr.EndangSuprihati, drh., M.S. Sekretaris : SuzanitaUtama, drh., M.Phil. Ph.D Anggota : Dr. EndangSuprihati, drh., M.S. Pembimbing Utama :Budiarto, drh., M.P.
HISTOPATHOLOGICAL CHANGES of Mus musculus LIVER INFECTED BY Toxoplasma gondii INTRAVAGINALLY
Vonny Prasetya Irgantara
ABSTRACT
The aim of this researchis to know the histopathological changes of mice liver which infected Toxoplasma gondii tachyzoites intravaginally. Experimental animal used eight female mice 2-3 month were divided randomly into two group treatment (n=9). P0 as a control group, gave NaCl physiology 0.2 ml intravaginally, and P1 was treated with 1x10³ of Toxoplasma gondiitachyzoites.Eight days post infection, mice sacrificed and liver of all mice were taken for histopathology preparations were made for further observation. Each of the liver of mice (Mus musculus) processed by Hematoxylin Eosin staining.The results of the observation and scoring degeneration and necrosis of the entire liver histopathology preparations of mice (Mus musculus) were analyzed statistically using the Mann whitney test.Base on the result of the statistical analysis test showed that there were significantly different result of degeneration and necrose in hepatocyte(p<0.05).
Keyword :Toxoplasma gondii, tachyzoites,liver histopathology,degeneration and
UCAPAN TERIMA KASIH
Puji Syukur kepadaTuhan Y.M.E atas limpahan rahmat, karunia dan kelancaran serta kemudahan yang diberikan sehingga penulis dapat menyusun dan menyelesaikan skripsi yang berjudul “Gambaranhistopatologiheparmencit (Musmusculus) yang diinfeksi stadium takizoitToxoplasma gondiisecaraintravagina”.
Pada kesempatan ini penulis mengucapkan terima kasih kepada :
Dekan Fakultas Kedokteran Hewan Universitas Airlangga Prof. Hj. Romziah Sidik. Ph.D., drh, atas kesempatan mengikuti pendidikan di Fakultas Kedokteran Hewan Universitas Airlangga Surabaya.
Budiarto, drh., M.P.selakudosenpembimbingpertamadanProf. Dr. Nunuk Dyah Retno L, drh., M.S.selakudosenpembimbingserta yang telahbersediameluangkanwaktudanpikiranuntukmembimbingpenulisdenganperhati andankesabaranhinggaterselesaikanskripsiini.
Dr. Mufasirin, drh., M.Si.selakuketuapenguji sekaligus dosen pembimbing
penelitian, Dr. EkaPramyrthaHestianah, drh.,
M.Kes.selakusekretarispengujidanDr. EndangSuprihati, drh., M.S.selakuanggotapenguji.
Prof. Dr. H. Fedik Abdul Rantam, drh. Selakudosenwali yang telahbanyakmemberikanmotivasidanbimbingan di bidangakademis, Prof. Dr. Lucia Tri Suwanti, drh., M.P. selakudosenpembimbingparasit (Toxoplasma
gondii) dan Dr. Thomas V. Widiyatno, drh., M.Siselakudosenpembimbingpatologi.
Segala hormat dan terima kasih tak terhingga penulis ucapkan kepada ayah tercinta BambangIrianto, S.Pd.(Alm) dan IbundaSetyowati,S.Pd., adik tercinta VannyApridityaIrgantaradanVikryAlvianIrgantarabeserta keluarga besar atasnasehat, bimbingan, motivasi, semangat dan doa yang tak pernah putus dalam penyusunan skripsi ini.
Terima kasih kepada R.P.HerviandoAryoatasmotivasi yang telahdiberikan, semua teman-teman yang banyak membantu dan mendukung penelitian ini, terutama teman satu kelompok penelitian TutukWahyuningtyas, FriscaTrisnaRosandy,Dimas Fajar S., Rossianawati, Febri Putra Aditya, DestyRenata, Maharani Yuliastina, Murtiningsih,Aditya Bayu S., serta teman-teman seperjuangan,Hana Cipka P.W., WahyuPutriFriska L., YeniPurbowati, Rusyida R.N., DhesyKartikasari, PhanjatMuktiUtomo, AgilRahmatAkbari, Ardi Budi P., RifqiNajwan, SyarulBasyarul, FaiqMudhaffar, Marsha Ramadhania,AndrianiDwiSiswarini, FauzyTaffinaPratama, BayuRizkyawan serta teman-teman yang namanya tidak mungkin disebutkan satu persatu yang telah membantu terselesaikannya skripsi ini.
Penulis menyadari bahwa penulisan ini masih jauh dari sempurna, sehingga kritik dan saran demi perbaikan serta kesempurnaan sangat diharapkan, semoga apa yang tertulis bermanfaat bagi ilmu pengetahuan.
Surabaya, 21Agustus2015
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PENGESAHAN... ii
HALAMAN PERNYATAAN ... iii
HALAMAN IDENTITAS ... iv
ABSTRACT... vi
UCAPAN TERIMA KASIH... vii
DAFTAR ISI... ix
DAFTAR GAMBAR ... xi
DAFTAR TABEL... xii
DAFTAR LAMPIRAN... xiii
SINGKATAN DAN ARTI LAMBANG ... xiv
BAB 1 PENDAHULUAN ... 1 1.1 Latar Belakang ... 1 1.2 Rumusan Masalah ... 3 1.3 Landasan Teori... 3 1.4 Tujuan Penelitian ... 5 1.5 Manfaat Penelitian ... 5 1.6 Hipotesis... 5
BAB 2 TINJAUAN PUSTAKA ... 6
2.1 Toxoplasma gondii ... 6
2.1.1 Klasifikasi Toxoplasma gondii ... 6
2.1.2 Morfologi Toxoplasma gondii ... 6
2.1.3 Siklus hidup Toxoplasma gondii ... 11
2.1.4 Penularan infeksi Toxoplasma gondii... 13
2.1.5 Patogenesis infeksi Toxoplasma gondii... 14
2.1.6 Gejala klinis Toxoplasma gondii ... 17
2.1.7 Diagnosis Toxoplasmosis ... 17 2.2 Intravaginal 2.2.1 Pengertianintravaginal... 20 2.2.2 Perjalananinfeksisuatupenyakitsecaraintravginal ... 20 2.3 Hepar ... 22 2.3.1 Pengertianhepar ... 22 2.3.2 Histologihepar ... 23
2.2.1 Klasifikasi mencit ... 25
BAB 3 MATERI DAN METODE... 26
3.1 Tempat dan Waktu Pelaksanaan Penelitian... 26
3.2 Bahan dan Materi Penelitian ... 26
3.2.1 Bahan penelitian ... 26
3.2.2 Alat-alatpenelitian... 26
3.2.3 Hewan percobaan... 27
3.3 Metode Penelitian... 28
3.3.1 Adaptasihewancoba ... 28
3.3.2 Perbanyakan isolat Toxoplasma gondiistadium takizoit... 28
3.3.3 Pelaksanaan penelitian... 29
3.3.4Pengambilan organ untuk pembuatan preparat histopatologi... 29
3.3.5 Pemeriksaanpreparathistopatologi ... 30 3.4 Variabel Penelitian ... 31 3.4.1 Variabel bebas ... 31 3.4.2 Variabel tergantung ... 31 3.4.3 Variabel kendali... 31 3.5 Rancanganpenelitian ... 32 3.6 Analisis data ... 32 3.7 Diagram alurpenelitian ... 33
BAB 4 HASIL PENELITIAN ... ...34
4.1 Hasil Pemeriksaan Histopatologi Degenerasi Hepatosit... 35
4.2 Hasil Pemeriksaan Histopatologi Nekrosis Hepatosit... 38
BAB 5 PEMBAHASAN ... ..41
BAB 6 KESIMPULAN DAN SARAN ... ..48
6.1 Kesimpulan... ..48
6.2 Saran ... ..48
RINGKASAN ... ..49
DAFTAR PUSTAKA ... ..51
DAFTAR GAMBAR
Gambar Halaman
2.1 Takizoit Toxoplasma gondii...7
2.2 Gambaran ultrastruktur takizoit Toxoplasma gondii ...7
2.3 Bradizoid Toxoplasma gondii di dalam kista jaringan ...8
2.4 Ookista Toxoplasma gondii ...9
2.5 Siklus hidup Toxoplasma gondii ...11
2.6 Histologi hepar ...23
3.1 Diagram alur penelitian ...33
4.1 Hepatosit mencit normal ...34
4.2 Hepatosit mencit yang mengalami degenerasi (P0) ...36
4.3 Hepatosit mencit yang mengalami degenerasi hidropik (P1) ...36
4.4 Hepatosit mencit yang mengalami degenerasi melemak (P0) ...37
4.5 Hepatosit mencit yang mengalami nekrosis (P0) ...39
4.5 Hepatosit mencit yang mengalami nekrosis (P1)...39
DAFTAR TABEL
TABEL Halaman
3.1 Acuan skoring hepar ... 31 4.2Gambaran histopatologi hepar terhadap tingkat degenerasi pada setiap
perlakuan mencit (Mus musculus)... 35 4.3Gambaran histopatologi hepar terhadap tingkat nekrosis pada setiap
DAFTAR LAMPIRAN
Lampiran Halaman
1. Perhitungandosisinfeksi 103takizoitToxoplasma gondii... 57
2. Prosedur Pembuatan Sediaan Histopatologi Hepar... 58
3. Skoring... 60
SINGKATAN DAN ARTI LAMBANG µm = mikrometer et al = et alii g = gram l = liter mg = miligram ml = mililiter mm = milimeter µl = mikroliter
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Toxoplasmosis adalah penyakit yang disebabkan oleh Toxoplasma gondii.
Toxoplasma gondiiadalah protozoa intraseluler dan bersifat parasit obligat yang
mempunyai hospes definitif kucing dan family felidae lain, sedangkan hospes perantara adalah semua hewan berdarah panas seperti ayam, sapi, kambing, babi dan domba. Toxoplasma gondiijuga dapat menginfeksi burung, rodensia, ikan paus dan manusia (Manahan dkk, 2013). Toxoplasmosis telah menyebar ke seluruh kepulauan di Indonesia dan menunjukkan prevalensi yang tinggi yaitu sekitar 43-88% pada manusia sedangkan pada hewan berkisar 6-70% (Van Der Veen et al., 1974 ; Subekti dan Nurfida, 2006).
Toxoplasmosis juga menyebabkan dampak merugikan hewan dan manusia (Dubey et al., 2004).Pada manusia, toxoplasmosis menyebabkan gejala abortus, kelahiran prematur, ensefalitis pada janin dan mumifikasi fetus (Gandahusada, 1995).Infeksi toksoplasmosis selalu mengancam para kaum wanita terutama mereka yang sedang hamil. Apabila infeksi toksoplasmosis terjadi secara kongenital dapat menyebabkan berupa perkapuran, korioretinitis,hidrosefalus, mikrosefalus, gangguan psikologis, gangguan perkembangan mental pada anaksetelah lahir dan kejang-kejang (Sasmita, 2006). Pada hewan toksoplasmosis dapat menyebabkan abortus, kematian dini dankelainan kongenital, sehingga dapat menimbulkan kerugian ekonomis yaitu
kehilangan janin, biaya perawatan dan penurunan produktifitas (Suwanti, 2005; Sasmita, 2006).
Toxoplasma gondiidapat menyerang semua organ dan jaringan tubuh hospes
yang berinti. Dominasi sel dan jaringan yang diinfeksi oleh takizoit sangat ditentukan oleh rute infeksi dan jenis inangnya (Subekti dan Arrasyid, 2006).Toxoplasma gondii
dapat menular melalui beberapa rute yaitu peroral dari makanan atau minuman yang kurang matang, transmisi kongenital atau melalui plasenta, susu yang tidak dipasteurisasi, transfusi darah, kecelakaan saat di laboraturium dan transplantasi organ yang terinfeksi(Premani, 2014).
Kerusakan yang terjadi pada jaringan tergantung pada umur, virulensi,strainToxoplasma gondii, jumlah parasit yang menginfeksi dan organ yang diserang (Lisawati dan Srisasi, 2008).Infeksi akut Toxoplasma gondiidapat menyerang jaringan dan pada infeksi buatan secara intraperitoneal takizoit dapat menyebabkan nekrosis hepar, lien dan pankreas. Hal ini disebabkan oleh multiplikasi interseluler dari takizoit Toxoplasma gondii(Riganti et al., 2003).
Penelitian mengenai penularan melalui intravagina dan pengaruh perubahan histopatologi organ/jaringan khususnya hepar belum pernah dilaporkan sebelumnya. Berdasarkan latar belakang diatas penulis ingin melakukan penelitian untuk mengetahui gambaran histopatologi hepar mencit (mus musculus) berupa degenerasi dan nekrosis yang diinfeksiToxoplasma gondii secara intravagina.
1.2 Rumusan Masalah
Berdasarkan latar belakang muncul suatu permasalahan apakah terdapat pengaruh infeksi Toxoplasma gondii stadium takizoit secara intravagina terhadap
gambaran histopatologiheparmencit (Mus musculus)?
1.3 Landasan Teori
Toxoplasma gondii mempunyai tiga bentuk stadium antara lain takizoit, kista
jaringan dan ookista. Stadium takizoit merupakan salah satu stadium infektif yang ditemukan selama infeksi akut (Soedarto, 2008).Beberapa uji coba mengenai akibat dari beberapa infeksiToxoplasma gondii telah dilaporkan sebelumnya, seperti yang disampaikan oleh Riganti et al. (2003) dan Amin (2013) melaporkan kerusakan pada hepar mencit (Mus musculus) yang diinfeksi takizoit Toxoplasma gondiisecara intraperitonealdan oral berupa terjadinya nekrosis pada hepatosit. Hal ini ditambahkan oleh Sasmita(2006) juga melaporkan bahwa kerusakan hepar mencit akibat toxoplasmosis meliputi penebalan kapsula hepar disertai dengan agregasi histiosit, limfosit kecil, fibrin dan nekrosis, selain itu terlihat juga adanya dilatasi dan kongesti sinusoid, vena sentralis dan vena portae, pembengkakan sel kupfer, perubahan degenerasi hepatosit, akumulasi histiosit dan sel limfosit kecil dalam kapsula Glisson dan Acini, sedangkanuji coba pada mencit jantan yang dilihat dalam aspek sistem reproduksi telah beberapa kali dilakukan salah satunya yang telah dilaporkan oleh Ayu (2012) yang menyatakan bahwa takizoit Toxoplasma gondii
dapat menginfeksi spermatozoa mencit (Mus musculus) baik takizoit yang menempel pada ekor maupun takizoit yang masuk ke dalam kepala spermatozoa dan menyebabkan penurunan viabilitas spermatozoa, hal ini ditambahkan oleh Arantes et almempelajari tentang inseminasi buatan dengan sampel semen positif Toxoplasma gondii dari anjing betina dan jantan. Hasilnya menunjukkan bahwa Toxoplasma gondii dapat ditularkan secara seksual pada anjing domestik dan domba jantan (Arantes et al., 2009).
Penelitan Sasmita (1991) memaparkan mekanisme kerusakan pada hepatosit mulai dari takizoit menginvasi sel parekim hepar dan kadang pada sel Kuppfer, kemudian takizoit memperbanyak diri di dalam parekim hepar setelah mencapai 16-32 takizoit, sel yang diinvasi akan hancur dan membebaskan takizoit lalu menginvasi sel parekim hepar. Hal tersebut berlangsung hingga membentuk daerah foki nekrosis yang lebih luas dibatasi dengan sel parekim hepar yang sehat (Sasmita, 2006).
Pada kondisi yang menyebabkan kerusakan hepar akan terjadi gangguan serius pada kehidupan (Martini, 1992). Gangguan kecil pada fungsi hepar dapat dengan cepat menyebabkan perubahan umum baik secara patologi anatomi maupun histologinya. Kelainan hepar yang bersifat lokal, sering ditemukan sebagai hasil dari perlawanan organ terhadap mikroorganisme dan parasit yang masuk melalui absorbsi usus (Kelly 1993).
1.4 Tujuan Penelitian
Tujuan penelitian ini adalah ingin mengetahui adanya pengaruh infeksi
Toxoplasma gondii stadium takizoit secara intravagina terhadap gambaran
histopatologiheparmencit (Mus musculus) berupa degenerasi dan nekrosis.
1.5 Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan manfaat tentang adanyapengaruh infeksi Toxoplasma gondii stadium takizoit secara intravagina terhadap gambaran
histopatologi heparmencit (Mus musculus) sehingga dapat memberikan informasi ilmiah kepada masyarakat mengenai rute penularan dan kerusakan hepar akibat infeksi takizoit Toxoplasma gondii secara histopatologi.
1.6 Hipotesis
Berdasarkan landasan teori diatas penulis dapat menarik hipotesis bahwa
infeksi Toxoplasma gondii stadium takizoit secara intravagina berpengaruh terhadap
BAB 2 TINJAUAN PUSTAKA
2.1 Tinjauan tentang Toxoplasma gondii 2.1.1 Klasifikasi
Toxoplasma gondii dimasukkan dalam golongan koksidia karena di dalam
siklus hidup mengalami perkembangan secara skizogoni, gametogoni dan sporogoni dan perkembangan tersebut terjadi di usus kucing, sebagai induk semang utama (Mufasirin dkk., 2012). Klasifikasi menurut Levine (1990)
Toxoplasma gondii adalah sebagai berikut :
Phylum : Apicomplexa Class : Sporozoa Sub Class : Coccidia Ordo : Eucoccidia Famili : Sarcocystidae Sub Famili : Toxoplasmatidae Genus : Toxoplasma Species : Toxoplasma gondii 2.1.2 Morfologi
Toxoplasma gondiimerupakan protozoa obligat intraseluler, terdapat
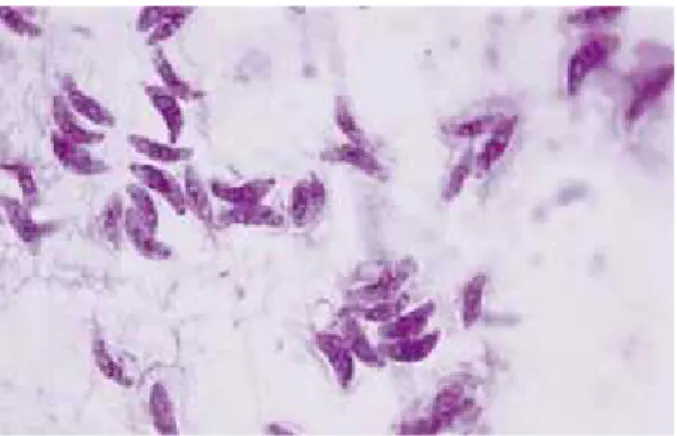
dalam tiga bentuk yaitu takizoit (bentuk proliferatif), kista (berisi bradizoit) dan ookista (berisi sporozoit). Bentuk takizoit menyerupai bulan sabit dengan ujung yang runcing dan ujung lain agak membulat (Gambar 2.1). Ukuran panjang 4-8 mikron, lebar 2-4 mikron dan mempunyai selaput sel, satu inti yang terletak di
tengah bulan sabit dan beberapa organel lain seperti ribosom, nukleus, komplek golgi, retikulum endoplasmik dan mitokondria (Gambar 2.2) (Sasmita, 2006).
Gambar 2.1 Takizoit Toxoplasma gondii(Tabbara, 2014)
Gambar 2.2 Gambaran ultrastruktur takizoit Toxoplasma gondii (Ajioka et al., 2001)
Takizoit dapat ditemukan dalam jaringan selama masa akut dari infeksi. Bila infeksi menjadi kronis takizoit dalam jaringan akan membelah secara lambat dan disebut bradizoit (Gambar 2.3). Bradizoit atau kista ini adalah bentuk kedua dari Toxoplasma gondiiyang dibentuk di dalam sel hospes definitif dengan ukuran yang berbeda-beda, ada yang berukuran kecil hanya berisi beberapa bradizoit dan ada yang berukuran 200 mikron berisi kira-kira 3000 bradizoit. Kista dalam tubuh hospes dapat ditemukan seumur hidup terutama di otak, otot jantung, dan otot tengah bulan sabit dan beberapa organel lain seperti ribosom, nukleus, komplek golgi, retikulum endoplasmik dan mitokondria (Gambar 2.2) (Sasmita, 2006).
Gambar 2.1 Takizoit Toxoplasma gondii(Tabbara, 2014)
Gambar 2.2 Gambaran ultrastruktur takizoit Toxoplasma gondii (Ajioka et al., 2001)
Takizoit dapat ditemukan dalam jaringan selama masa akut dari infeksi. Bila infeksi menjadi kronis takizoit dalam jaringan akan membelah secara lambat dan disebut bradizoit (Gambar 2.3). Bradizoit atau kista ini adalah bentuk kedua dari Toxoplasma gondiiyang dibentuk di dalam sel hospes definitif dengan ukuran yang berbeda-beda, ada yang berukuran kecil hanya berisi beberapa bradizoit dan ada yang berukuran 200 mikron berisi kira-kira 3000 bradizoit. Kista dalam tubuh hospes dapat ditemukan seumur hidup terutama di otak, otot jantung, dan otot tengah bulan sabit dan beberapa organel lain seperti ribosom, nukleus, komplek golgi, retikulum endoplasmik dan mitokondria (Gambar 2.2) (Sasmita, 2006).
Gambar 2.1 Takizoit Toxoplasma gondii(Tabbara, 2014)
Gambar 2.2 Gambaran ultrastruktur takizoit Toxoplasma gondii (Ajioka et al., 2001)
Takizoit dapat ditemukan dalam jaringan selama masa akut dari infeksi. Bila infeksi menjadi kronis takizoit dalam jaringan akan membelah secara lambat dan disebut bradizoit (Gambar 2.3). Bradizoit atau kista ini adalah bentuk kedua dari Toxoplasma gondiiyang dibentuk di dalam sel hospes definitif dengan ukuran yang berbeda-beda, ada yang berukuran kecil hanya berisi beberapa bradizoit dan ada yang berukuran 200 mikron berisi kira-kira 3000 bradizoit. Kista dalam tubuh hospes dapat ditemukan seumur hidup terutama di otak, otot jantung, dan otot
bergaris. Di otak bentuk kista lonjong atau bulat, tetapi di dalam otot bentuk kista mengikuti bentuk sel otot (Sasmita, 2006 ; Gandahusada, 2004). Keberadaan kista dibuktikan paling cepat 4-8 hari pascainfeksi di dalam jaringan hewan coba (Sasmita, 2006). Kista jaringan (dahulu disebut pseudokista) bersifat infektif bila tertelan oleh kucing (menyebabkan stadium seksual dalam usus dan produksi ookista) atau bila termakan oleh hewan lain akan dihasilkan lebih banyak lagi kista jaringan (Jewetz et al., 2008). Kista dapat bertahan selama beberapa bulan atau tahun bahkan seumur hidup dan dapat bertahan beberapa hari pada hospes definitif yang mati (Sasmita, 2006).
Gambar 2.3 Bradizoid Toxoplasma gondii di dalam kista jaringan (panah)(Tabbara, 2014)
Ookista merupakan bentuk ketiga, berbentuk oval dengan ukuran 9-11 µm x 11-14 µm akan keluar bersama feces. Ookista akan menghasilkan dua sporokista yang masing-masing mengandung empat sporozoit(Gambar 2.4) (Palgunadi, 2011). Ookista keluar bersama tinja dan puncak produksi ookista antara hari kelima dan kedelapan setelah infeksi. Ookista dihasilkan tinja dalam tujuh sampai dua belas hari (Sasmita, 2006).
bergaris. Di otak bentuk kista lonjong atau bulat, tetapi di dalam otot bentuk kista mengikuti bentuk sel otot (Sasmita, 2006 ; Gandahusada, 2004). Keberadaan kista dibuktikan paling cepat 4-8 hari pascainfeksi di dalam jaringan hewan coba (Sasmita, 2006). Kista jaringan (dahulu disebut pseudokista) bersifat infektif bila tertelan oleh kucing (menyebabkan stadium seksual dalam usus dan produksi ookista) atau bila termakan oleh hewan lain akan dihasilkan lebih banyak lagi kista jaringan (Jewetz et al., 2008). Kista dapat bertahan selama beberapa bulan atau tahun bahkan seumur hidup dan dapat bertahan beberapa hari pada hospes definitif yang mati (Sasmita, 2006).
Gambar 2.3 Bradizoid Toxoplasma gondii di dalam kista jaringan (panah)(Tabbara, 2014)
Ookista merupakan bentuk ketiga, berbentuk oval dengan ukuran 9-11 µm x 11-14 µm akan keluar bersama feces. Ookista akan menghasilkan dua sporokista yang masing-masing mengandung empat sporozoit(Gambar 2.4) (Palgunadi, 2011). Ookista keluar bersama tinja dan puncak produksi ookista antara hari kelima dan kedelapan setelah infeksi. Ookista dihasilkan tinja dalam tujuh sampai dua belas hari (Sasmita, 2006).
bergaris. Di otak bentuk kista lonjong atau bulat, tetapi di dalam otot bentuk kista mengikuti bentuk sel otot (Sasmita, 2006 ; Gandahusada, 2004). Keberadaan kista dibuktikan paling cepat 4-8 hari pascainfeksi di dalam jaringan hewan coba (Sasmita, 2006). Kista jaringan (dahulu disebut pseudokista) bersifat infektif bila tertelan oleh kucing (menyebabkan stadium seksual dalam usus dan produksi ookista) atau bila termakan oleh hewan lain akan dihasilkan lebih banyak lagi kista jaringan (Jewetz et al., 2008). Kista dapat bertahan selama beberapa bulan atau tahun bahkan seumur hidup dan dapat bertahan beberapa hari pada hospes definitif yang mati (Sasmita, 2006).
Gambar 2.3 Bradizoid Toxoplasma gondii di dalam kista jaringan (panah)(Tabbara, 2014)
Ookista merupakan bentuk ketiga, berbentuk oval dengan ukuran 9-11 µm x 11-14 µm akan keluar bersama feces. Ookista akan menghasilkan dua sporokista yang masing-masing mengandung empat sporozoit(Gambar 2.4) (Palgunadi, 2011). Ookista keluar bersama tinja dan puncak produksi ookista antara hari kelima dan kedelapan setelah infeksi. Ookista dihasilkan tinja dalam tujuh sampai dua belas hari (Sasmita, 2006).
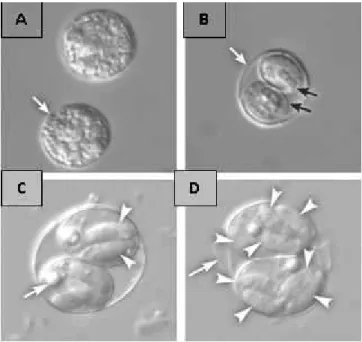
Gambar 2.4 Ookista Toxoplasma gondii. (A) Ookista unsporulasi.(B) Ookista bersporulasi, dinding ookista (panah putih) dan dinding sporokista (panah hitam). (C) Ookista bersporulasi dengan sporozoit (ujung panah) dan residual body (panah). (D) Ookista bersporulasi berisi dua sporokista dengan masing-masing sporokistaberisi empat sporozoit(Dubey, 2010).
2.1.3 Siklus hidup
Nama Toxoplasma gondii berasal dari dua suku kata, yaitu toxon (bahasa Yunani) yang berarti busur (bow) yang mengacu pada bentuk sabit (crescent shape) dari takizoit, nama gondii berasal dari kata Ctenodactylus gondii, seekor rodensia dari Afrika Utara dimana parasit tersebut untuk pertama kali diisolasi (Black dan Booturoyd, 2000). Siklus hidup Toxoplasma gondiidapat dibagi menjadi dua yaitu siklus seksual (intraintestinal) dan siklus aseksual (ekstraintestinal) (Gambar 2.5). Siklus hidup secara seksual dan aseksual terjadi pada hospes definitif, sedangkan pada mamalia atau hospes antara hanya mengalami stadium aseksual(Darcy dan Santoro, 1994;Dubey et al., 1998;Robert dan Janovy, 2000;Subekti dan Arrasyd, 2006).
Perkembangan aseksual terjadi karena pembelahan vegetatif yaitu organisme berkembang dengan membelah diri pada hospes definitif yaitu pada kucing(Robert and Janovy, 2000). Di dalam usus kecil kucing sporozoit menembus sel epitel dan tumbuh menjadi trofozoit. Inti trofozoit membelah menjadi banyak sehingga terbentuk skizon. Skizon matang pecah dan menghasilkan banyak merozoit (skizogoni). Daur aseksual ini dilanjutkan dengan daur seksual.
Siklus hidup seksual (intraintestinal) hanya terjadi pada induk semang utama yaitu kucing dan sebagainya, yang berperan besar dalam penularan toxoplasmosi pada hewan maupun manusia (Dubey dkk., 1998). Siklus hidup seksual terjadi karena adanya peleburan gamet yang masing-masing berisi kromosom haploid (Robert and Janovy, 2000). Merozoit masuk ke dalam sel epitel dan membentuk makrogametosit dan mikrogametosit yang menjadi makrogamet dan mikrogamet (gametogoni). Setelah terjadi pembuahan terbentuk ookista, yang akan dikeluarkan bersama tinja kucing. Di luar tubuh kucing, ookista tersebut akan berkembang membentuk dua sporokista yang masing-masing berisi empat sporozoit (sporogoni) (Krahenbuhl dan Remington, 1982). Bila ookista tertelan oleh mamalia seperti domba, babi, sapi dan tikus serta ayam atau burung, maka di dalam tubuh hospes perantara akan terjadi daur aseksual yang menghasilkan takizoit. Takizoit akan membelah, kecepatan membelah takizoit ini berkurang secara berangsur, kemudian terbentuk kista yang mengandung bradizoit. Bradizoit dalam kista biasanya ditemukan pada infeksi menahun (Chahaya, 2003).
Bila kucing sebagai hospes definitif memakan hospes perantara yang terinfeksi maka berbagai stadium seksual di dalam sel epitel usus akan terbentuk lagi. Jika hospes perantara yang dimakan kucing mengandung kista Toxoplasma
gondii, maka masa prepatennya 2 -3 hari. Tetapi bila ookista tertelan langsung
oleh kucing, maka masa prepatennya 20-24 hari. Dengan demikian kucing lebih mudah terinfeksi oleh kista dari pada oleh ookista(Cox, 1982;Levine, 1990).
Gambar 2.5 Siklus hidup Toxoplasma gondii, sumber infeksi pada manusia(Frenkel, 1989).
2.1.4 Penularan
Infeksi atau penularan Toxoplasma gondiidapat terjadi secara langsung atau melalui media utama, terjadi apabila manusia memakan daging mentah atau kurang matang yang mengandung kista. Infeksi ookista dapat ditularkan dengan vektor lalat, kecoa, tikus dan melalui tangan yang tidak bersih. Tikus dan burung sebagai hospes perantara yang merupakan binatang buruan kucing serta sejumlah
vektor seperti kecoa dan lalat yang dapat memindahkan ookista dari feses kucing ke makanan. Ternak domba, sapi, babi, ayam dan kuda terinfeksi Toxoplasma
gondiikarena pakan dan air minum yang tercemar ookista dari feses kucing(Seitz,
2009).
Penularan pada manusia secara tidak langsung oleh makanan mentah, sayuran dan buah-buahan serta bahan makanan lain yang terkontaminasi oleh tanah yang mengandung ookista infektif dan apabila termakan akan menular ke janin bila dalam keadaan bunting (Soedarto, 2008).Infeksi juga terjadi apabila di laboraturium para peneliti bekerja dengan menggunakan hewan percobaan yang terinfeksi dengan toxoplasmosis melalui jarum suntik dan alat laboraturium lainnya yang terkontaminasi dengan Toxoplasma gondii. Selain itu Susanto dkk (2008) juga menyatakan transplantasi organ, transfusi darah dan leukosit dari penderita toxoplasmosis dapat menyebabkan infeksi.Penularannya juga dapat terjadi secara vertikal atau kongenital melalui plasenta dari induk ke janin sewaktu dalam kandungan atau diperoleh setelah lahir (Robert dan Janovy, 2000).
2.1.5 Patogenesis
Setelah terjadi infeksi Toxoplasma gondiike dalam tubuh akan terjadi proses yang terdiri dari tiga tahap yaitu parasitemia, yaitu Toxoplasma gondiiyang tertelan melalui makanan akan menembus epitel usus dan difagositasis oleh makrofag atau masuk ke dalam limfosit kemudian terjadi penyebaran limfogen.
Toxoplasma gondii akan menyerang seluruh sel berinti, membelah diri dan
menimbulkan lisis, sel tersebut didestruksi akan berhenti bila sel hospes telah dilindungi oleh antibodi. Pada susunan syaraf dan mata, antibodi tidak dapat
masuk karena ada sawar (barier) sehingga destruksi akan terus berlangsung. Perbanyakan diri Toxoplasma gondiipaling banyak terjadi pada jaringan retikuloendotelial dan otak. Pembentukan antibodi merupakan tahap kedua setelah terjadi infeksi. Tahap ketiga merupakan fase kronik, kista terbentuk dan menyebar di jaringan otot dan saraf, mempunyai sifat menetap tanpa menimbulkan peradangan lokal (Chahaya, 2003).
Pengetahuan patogenesis yang ada dewasa ini menunjukkan bahwa pada dasarnya takizoit dapat menginfeksi hampir semua jenis set berinti berbagai jenis hewan dan manusia bahkan juga insekta (Black dan Bootfiroyd, 2000;Hakansson et al., 2001). Walaupun demikian, terdapat beberapa jenis sel dan organ yang dominan diinfeksi oleh takizoit. Dominasi sel dan jaringan yang diinfeksi oleh takizoit sangat ditentukan oleh rute infeksi dan jenis hospesnya (Subekti dan Arrasyid, 2006).
Adapun jaringan atau organ yang umumnya diinvasi pada ternak di antaranya adalah hepar, ginjal, otak, otot skeletal, diafragma, jantung, limpa, paru-paru, kelenjar limfe mesenterik maupun perifer (Dubey et al., 1998 ; Mordue et al., 2001). Proporsi masing-masing jaringan berbeda-beda di antara beberapa jenis ternak (Meyer et al., 2000).
Infeksi Toxoplasma gondiidapat bersifat akut, sub akut dan kronis, sedangkan infeksi yang paling berbahaya yaitu infeksi kongenital karena dapat menyebabkan keguguran, kematian janin dalam kandungan dan kelahiran bayi cacat. Toksoplasmosis juga dapat berbahaya terutama ada penderita AIDS yang
dapat menyebabkan kematian yang tinggi karena ensefelitas (Robet dan Janovy, 2002).
Usus merupakan lokasi infeksi Toxoplasma gondiiyang pertama. Infeksi yang berat akibat menelan oosista akan mengakibatkan lesi pada usus sampai terjadi kematian pada anak kucing atau hewan lain, sedangkan pada manusia biasanya terjadi pembengkakan limfoglandula (lgl) mesenterika dan terjadi degenerasi sel pada parenkim hepar. Selama stadium akut parasit (takizoit) akan mengalami replikasi dengan cepat dan siap mengadakan invasi serta melisiskan sel hospes(Gandahusada, 2000; Roberts dan Janovy, 2000).
Bentuk sub akut merupakan kelanjutan infeksi yang bersifat akut, dan merupakan infeksi yang lebih nyata akibat kerusakan sistem saraf pusat serta jaringan. Takizoit secara terus menerus akan merusak sel sehingga menyebabkan kerusakan secara ekstensif pada paru-paru, hepar, jantung, otak, mata, dan diperkirakan kerusakan juga terjadi di sistem saraf pusat karena sistem kekebalan pada jaringan ini rendah (Robert dan Janovy, 2000).
Infeksi kronis terjadi ketika sistem imun berkembang dan menghambat proliferasi takizoit sehingga terbentuk kista yang berisi bradizoit. Terbentuknya kista tersebut diduga karena adanya kekebalan humoral yang memicu terjadi kista jaringan di dalam otak dengan disertai respons kekebalan seluler yang mengontrol pembentukan kista jaringan tersebut. Pembentukan kista jaringan hanya mengakibatkan sedikit perubahan pada sel hospes tanpa memperlihatkan gejala klinis yang nyata sehingga biasanya infeksi ini bersifat asimtomatik. Kista yang pecah akan menimbulkan reaksi peradangan, terbentuknya nodul dan
menyebabkan ensefalitis kronik, miokarditis serta pneumonia. Bradizoit yang dibebaskan dari kista yang pecah selama infeksi kronis akan menginfeksi sel-sel baru dan dapat terjadi dalam periode yang lama (Robert dan Janovy, 2000).
Toxoplasma gondiitidak memproduksi toksin, nekrosis yang terjadi pada
sel induk semang disebabkan oleh multiplikasi interseluler dari takizoit
Toxoplasma gondii. Nekrosis terjadi pada usus dan limfoglandula mesenterika,
kemudian terjadi nekrosis fokal pada organ lain (Dubey, 1999). Kista Toxoplasma
gondiiyang terbentuk di dalam plasenta, berkembang menjadi tempat
penghancuran atau kematian sel tubuh (lokus nekrosis) dan dari tempat ini pula parasit menyerang ke peredaran darah fetus, menyebar luas dan mengakibatkan kelainan dan kerusakan (Sasmita, 2006).
Penyebaran takizoit sampai pada organ yang jauh disebabkan oleh dua faktor, pertama gerakan aktif dari takizoit maupun gerakan pasif dengan memanfaatkan leukosit yang menyebar ke berbagai jaringan melalui aliran darah (Subekti dan Arrasyid, 2006).
2.1.6 Gejala klinis
Toksoplasmosis jarang menimbulkan gejala klinis yang nyata, tetapi dengan uji serologis prevalensinya tinggi. Hal ini diduga berkaitan dengan virulensi parasit, kerentanan hospes terhadap infeksi, umur dan imunitas hospes (Hartanti, 2011). Garis besarnya sesuai dengan cara penularan dan gejala klinisnya, toksoplasmosis dapat dikelompokkan atas: toksoplasmosis akuisita (dapatan) dan toksoplasmosis kongenital. Baik toksoplasmosis dapatan maupun kongenital sebagian besar asimtomatis atau tanpa gejala. Keduanya dapat bersifat
akut dan kemudian menjadi kronik atau laten. Gejala yang nampak sering tidak spesifik dan sulit dibedakan dengan penyakit lain (Chahaya, 2003).
Toksoplasmosis dapatan biasanya tidak diketahui karena jarang menimbulkan gejala. Tetapi bila seorang ibu yang sedang hamil mendapat infeksi primer, ada kemungkinan bahwa 50% akan melahirkan anak dengan toksoplasmosis kongenital. Gejala yang dijumpai pada orang dewasa maupun anak-anak umumnya ringan. Gejala klinis yang paling sering dijumpai pada toksoplasmosis dapatan adalah limfadenopati dan rasa lelah, disertai demam dan sakit kepala (Zaman dan Keong, 1988).
Toksoplasmosis kongenital.Wanita yang terinfeksi Toxoplasma
gondiisecara akut selama masa kehamilan akan terjadi infeksi kongenital,dan
parasit dapat menginfeksi janin yang sedang berkembang. Meskipun toksoplasmosis kongenital pada manusia sering menyebabkan abortus dan bayi lahir cacat bahkan kematian, tetapi ibu yang terinfeksi Toxoplasma
gondiibiasanya tidak menunjukkan gejala klinis (Robert dan Janovy, 2000). Pada
infeksi kongenital pada hewan dapat mengakibatkan fetus yang dilahirkan mengalami gangguan pada sistem saraf pusat, meningoensefalitis, renitis, hidrosefalus, retardasi mental, epilepsi bahkan terjadi abortus (Mufasirin dkk, 2011).
Pada infeksi akut, limfadenopati sering dijumpai pada kelenjer getah bening daerah leher bagian belakang dan akan terjadi keradangan berbagai organ atau jaringan diantaranya limfadenitis, hepatitis, pneumitis, miokarditis dan ensefalitis. Bentuk kelainan pada kulit akibat toksomplasmosis berupa ruam
makulopapuler yang mirip kelainan kulit, sedangkan pada jaringan paru dapat terjadi pneumonia interstisial (Chahaya, 2003).
Menurut Robert dan Janovy (2000), infeksi sub akut merupakan kelanjutan dari infeksi akut, infeksi yang lebih nyata akibat kerusakan sistem saraf pusat serta jaringan. Takizoit terus menerus akan merusak sel sehingga menyebabkan kerusakan secara ekstensif pada paru, hepar, jantung, otak, mata dan diperkirakan kerusakan juga terjadi di sistem saraf pusat karena sistem kekebalan pada jaringan ini rendah.
2.1.7 Diagnosis
Diagnosis toksoplasmosis pada hewan maupun manusia berdasarkan gejala sulit ditentukan karena gejala klinis yang asimtomatis atau tidak khas, sehingga diperlukan pemeriksaan laboraturium sebab akurasi diagnosis toksoplasmosis mempunyai arti penting dalam penatalaksanaan pasien karena pengobatan memerlukan waktu lama, mahal dan kemungkinan efek toksik pada hospes. Pemeriksaan laboraturium yang paling tepat dalam kasus toksoplasmosis ialah diisolasinya Toxoplasma gondii. Isolat Toxoplasma gondiidapat berasal dari tinja, jaringan otak, otot, air liur dan darah (Gandahusada, 2000; Sasmita, 2006).
Menurut Soedarto (2008), diagnosis ditetapkan setelah melakukan
pemeriksaan mikroskopis histologis secara langsung, sel “buffy coat”, isolasi
organisme dalam kultur jaringan, autopsi atas jaringan penderita, pemeriksaan atau jaringan berasal dari hewan coba yang diinkolasi dengan bahan infektif . Hal ini lebih dijelaskan oleh Jewetz et al., (2008) pemeriksaan melalui spesimen dapat dilakukan dengan memeriksa darah hewan yang tertular toksoplasmosis (buffy
coat dari sampel yang diberi heparin), sputum, sumsum tulang, cairan serebrospinalis dan eksudat (materi biopsi dari kelenjar getah bening, tonsil dan otot lurik) serta cairan ventrikel (pada infeksi neonatus) mugnkin diperlukan.
Pemeriksaan laboraturium digunakan untuk menunjang serologis untuk mendeteksi antibodi antara lain Complement Fixation Test (CFT), metode tes warna Sabin dan Fielsmann, Emzyme Linked Immuno Sorbent Assay (ELISA), Indirect Flourescent Antibody Test (IFAT), Indirect Haemaglunation Test (IHA), Uji Fiksasi Komplemen, Tes Toksoplasmin (Sasmita, 2006; Soedarto, 2008).
Cara diagnosa yang paling tepat dengan cara menemukan Toxoplasma
gondiidalam tubuh hewan yang diduga tertular. Deteksi toksoplasmosis atau
antigennya dalam darah dan organ tubuh dapat dipergunakan tes Sabin-Fieldmann yang memberikan hasil postif 1- 3 hari setelah infeksi (Dharmana, 2007).
Cara diagnosis toksoplasmosis lainnya adalah pemeriksaan histopatologi jaringan tubuh seperti otot skelet, otot jantung, otak, limfogalndula mesenterika dan mata. Parasit juga mugnkin ditemukan pada pemeriksaan langsusng atau isolasi darah penderita, air liur, sputum, tinja, cairan serebrospinal dan cairan amnion (Sasmita, 2006). Menurut Robert dan Janovy (2000), Montoya dan Liesenfeld (2004), menyatakan diagnosis dapat dilakukan dengan teknik Polymerase Chain Reaction (PCR) untuk mendeteksi asam nukleat (DNA), cara ini banyak digunakan pada toksoplasmosis kongenital dan individu immunocompromised karena cukup sensitif dan spesifik. Selain PCR, teknik hibridisasi dot blot yang spesifik juga dapat digunakan, karena selain sederhana, bisa diterapkan pada jumlah besar.
2.2 Intravaginal 2.2.1 Pengertian
Penularan secara intravagina adalah penularan suatu penyakit melalui saluran reproduksi, hal ini dapat melalui kontak seksual atau kawin alam ataupun inseminasi buatan dari semen yang terinfeksi. Penularan toksoplasmosis melalui intravagina belum pernah dilakukan sebelumnya, tetapi berdasarkan beberapa penyakit yang menginfeksi melalui jalur reproduksi seperti penyakit yang disebabkan oleh Brucella dan Trichomonas foetus membuktikan bahwa jalur penularan penyakit melalui intravagina dapat mempengaruhi patofisiologi target organ. Seperti yang telah Arantes dan Lopes pelajari tentang inseminasi buatan dari anjing betina dan jantan masing-masing dengan Toxoplasma gondiisampel
semen positif. Hasilnya menunjukkan bahwa Toxoplasma gondiidapat ditularkan
secara seksual pada anjing domestik dan domba jantan (Arantes et al., 2009 ; Lopes et al., 2009). Ini menunjukkan bahwa Toxoplasma gondiidapat ditularkan
secara seksual dengan menembus ke aliran darah dan menyebar dalam tubuh host. 2.2.2 Perjalanan infeksi suatu penyakit secara intavaginal
Dalam siklus hidupToxoplasma gondii, setelah parasit termakan dan terjadi
proliferasi takizoit selama tahap akut, parasit biasanya terlokalisasi pada organ yang berbeda (Sharfian et al., 2003 ; Zare et al., 2006 ) termasuk organ reproduksi laki-laki dan perempuan dari host intermediate (Martinez et al., 1996 ; Nistal et al., 1986 ; Barreto et al., 2008 ; De Paepe et al., 1990 ; Crider et al., 1988 ; Haskell et al., 1989 ; Suresh et al., 2007) dalam Dalimi et al. (2013). Hal ini
membuktikan bahwa infeksi Toxoplasma gondiidapat menyebabkan beberapa
gangguan pada fungsi reproduksi.
Sebuah studi yang dilakukan oleh Dass et al. mengungkapkan bahwa
Toxoplasma gondiidapat menular melalui jalur seksual pada tikus (Dass et al.,
2011).Dalam penelitian ini, kista Toxoplasma gondiidiamati pada epididimis dan
semen dari tikus jantan yang terinfeksi delapan minggu pasca-infeksi.Kista juga diamati pada vagina tikus betina 12 jam setelah kawin dengan tikus jantan yang terinfeksi danmengakibatkan infeksi pada tikus betina. Selain itu, kista parasit terdeteksi di beberapa anjing betina yang telah dikawinkan. Observasi ini menunjukkanmengenai transmisi seksual dariToxoplasma gondiipada tikus.Selain
itu, perbandingan perilaku kawin pada tikus yang terinfeksi dan tidak terinfeksi menunjukkan bahwaToxoplasma gondiidapat meningkatkan daya tarik seksual
dari hewan yang terinfeksi dengan manipulasi perilaku birahi atau manipulasi hormonal, ini berarti bahwa tikus betina tidak terinfeksi disukai oleh tikus jantan yang terinfeksi. Jadi,Toxoplasma gondiimemperoleh kesempatan yang lebih besar
untuk transmisi kelamin.
Berdasarkan beberapa penyakit yang menginfeksi melalui jalur reproduksi seperti trichomoniasis, 4-9 hari sesudah perkawinan parasite berkembang di dalam vagina, dari vagina protozoa akan bermigrasi menuju uterus melewati servix dan setelah itu Trichomonas sp. dapat menghilang dari vagina atau menetap di dalam vagina. Berdasarkan penyebaran Toxoplasma gondii, jalur tersebut diteruskan
menembus sel dan membelah diri secara endodiogeni. Pembelahan ini terjadi setiap 4-5 jam disemua tipe sel dan pada akhirnya akan mengakibatkan kerusakan dan nekrosis pada sel (Stickland, 1991; Suwanti dkk., 1999; Sasmita, 2006). Takizoit Toxoplasma gondiidapat menuju ke organ heparkarena hepar mendapat
vaskularisasi ganda, yaitu dari vena porta dan venahepatika. Melalui vena porta masuk darah yang berasal dari saluran pencernaandan organ abdomen lain yaitu limpa, pankreas dan kantung empedu. Darah yangmasuk mengandung berbagai nutrisi yang baru diserap dan siap untuk diproses lebih lanjut oleh hepar (Lilis, 2008). Takizoit mulai menginvasi sel parekim hepar dimulai dari penetrasi dari usus menuju organ hepar melalui pembuluh darah vena sentralis mekanisme kerusakan pada hepatosit mulai dari takizoit menginvasi sel parekim hepar dan kadang pada sel kuppfer (Sasmita, 2006).
2.3 Hepar 2.3.1 Pengertian
Hepar merupakan kelenjar terbesar dan mempunyai fungsi yang penting bagi kehidupan. Hepar terletak pada bagian paling kranial dari abdomen tepat di belakang diafragma (Dyce et al. 2002). Hepar merupakan kelenjar eksokrin karena mensekresi cairan empedu yang dialirkan ke dalam duodenum. Selain itu juga merupakan kelenjar endokrin dan penyaring darah. Hepar mempunyai fungsi antara lain pembentukan dan sekresi empedu, metabolisme kolestrol dan lemak detoksifikasi berbagai macam obat dan racun dan membersihkan bakteri dalam darah (Lumongga, 2008).
2.3.2 Histologi hepar
Hepar mencit terdiri dari 4 lobus yang menyatu pada bagian dorsal, yaitu lobus median yang dibagi menjadi kiri dan kanan oleh bifurkatio, lobus lateral kiri, lobus lateral kanan yang dibagi secara horisontal menjadi anterior dan posterior dan lobus kaudal yang terdiri dari bagian dorsal dan ventral (Harada et
al., 1999). Organ ini diselubungi oleh kapsula fibrosa yang dilindungi peritoneum
visceral (Martini, 1992). Lobus hepar terdiri dari banyak unit fungsi hepar yang disebut lobulus. Tiap lobulus terdiri dari prisma polihedral jaringan hepatika yang mempunyai ukuran panjang antara 2 mm dan lebar 1 mm (Frappier, 1998). Lobulus berisi sel epitel khusus yang disebut hepatosit yang tersusun tidak teratur, bercabang-cabang dan selnya saling berhubungan mengelilingi vena sentralis (Gambar 2.5). Pada kapiler terdapat celah garis endotel yang disebut sinusoid yang merupakan tempat perlintasan darah. Pada sinusoid terdapat sel fagositosis yang disebut sel Kuppfer yang berfungsi menghancurkan leukosit dan sel darah merah yang rusak, bakteri dan benda asing lain pada aliran pembuluh darah vena dari traktus gastrointestinalis (Tortora, 2005). Lobulus hepar dibagi menjadi tiga zona, yaitu sentrolobular, midzonal dan periportal (Harada et al.,1999). Saluran portal dibentuk oleh kira-kira tiga sampai enam lobulus (Frappier, 1998).
Gambar 2.6 Histologi Hepar.Vena sentralis (a), sinusoid (b), hepatosit (c) dan sel endotel (d). Sumber: Dellmann dan Eurell (2006).
Kondisi hepar bergantung pada aliran darah dan susunan empedu. Perbandingan aliran darah ke parenkim sama dengan bagian hepar lainnya. Bila aliran darah dan saluran empedu rusak pada salah satu bagian, parenkim dari bagian tersebut akan mengalami atrofi. Perubahan-perubahan pada hepar terjadi sebagai respon dari kerusakan vaskular atau empedu (Kelly, 1993).
Pada kondisi yang menyebabkan kerusakan hepar akan mempengaruhi terjadinya gangguan serius pada kehidupan (Martini, 1992). Gangguan kecil pada fungsi hepar dapat dengan cepat menyebabkan perubahan umum baik secara patologi anatomi maupun histologinya. Kelainan hepar yang bersifat lokal, sering ditemukan sebagai hasil dari perlawanan organ terhadap mikroorganisme dan parasit yang masuk melalui absorbsi usus (Kelly 1993).
2.4 Mencit
2.4.1 Klasifikasi mencit
Mencit (Mus musculus) merupakan hewan mamalia hasil domestikasi dari mencit liar. Banyak keunggulan yang dimiliki oleh mencit sebagai hewan percobaan, yaitu memiliki keasaan fisiologis dengan manusia, siklus hidup yang relatif pendek, jumlah anak per kelahiran banyak, variasi sifatnya tinggi dan mudah dalam penanganan (Moriwaki et al., 1994).
Menurut Jordan dan Vena (1980) dalam Ayu, 2012 klasifikasi mencit sebagai berikut :
Kingdom : Animalia Phylum : Chordata Sub Phylum : Vertebrata Class : Mammalia Sub Class : Theria Ordo : Rodentia Sub Ordo : Myomorpha Family : Muridae Sub Family : Murinae Genus : Mus
Mencit membutuhkan makanan setiap hari sekitar 3-5 g dan air minum berkisar 4-8 ml. Mencit (Mus musculus) dewasa memiliki berat badan sekitar 20-40 g pada hewan jantan, sedangkan pada hewan betina 18-35 g (Smith et al., 1998).
Mencit merupakan salah satu hewan coba yang sangat peka terhadap
Toxoplasma gondiidan sangat bermanfaat dalam berbagai penelitian mengenai
berbagai penyakit termasuk toksoplasmosis mulai dari inokulasi buatan dengan tujuan isolasi, diagnotik, mempelajari insiden, patologis dan imunitas dari
Toxoplasma gondii. Pada mencit bentuk takizoit dapat membelah diri secara aktif,
BAB 3MATERI DAN METODE
3.1 Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboraturium Protozoologi Departemen Parasitologi Fakultas Kedokteran Hewan Universitas Airlangga Surabaya. Pembuatan sediaan histopatologi hepar dilakukan di Laboratorium Patologi Veteriner Fakultas Kedokteran Hewan Universitas Airlangga Surabaya pada bulan Novembersampai Desember 2014.
3.2 Bahan dan Materi Penelitian 3.2.1 Bahan penelitian
Bahan yang diperlukan dalam penelitian ini adalah, isolat Toxoplasma gondii stadium takizoit dari strain RH yang diperoleh dari Departemen Parasitologi Veteriner Laboraturium Protozoologi Fakultas Kedokteran Hewan Universitas Airlangga Surabaya, NaCl fisiologis, aquadest, pakan berbentuk pelet, sekam sebagai alas kandang, dan kapas steril, formalin 10%.
3.2.2 Alat-alat penelitian
Alat yang digunakan dalam penelitian ini adalah kandang mencit untuk tempat pemeliharaan berupa dua buah kandang dari bahan plastik beserta penutup dari kawat jala dengan ukuran 37 x 30 cm untuk masing-masing sembilan ekor mencit, tempat pakan, tempat minum, spuit,nampan sebagai wadah mencit, kamera, mikroskop, hemasitometer dan mikro pipet. Peralatan yang digunakan untuk insisi dan pembuatan sedian histopatologi meliputi, gunting bedah, skapel steril, pinset steril, object glass, cover glass, karton sebagai alas pada saat
pembedahan, penjepit, pot kecil sebagai tempat penyimpan organ, kamera dan mikroskop.
3.2.3 Hewan percobaan
Penelitian ini menggunakan hewan coba sebanyak 18 ekor mencit betina (Mus musculus) galur Balb/c betina umur 2-3 bulan. Mencit dengan umur tersebut merupakan mencit dewasa muda yang mempunyai keadaan fisiologis optimum. Mencit yang digunakan mempunyai berat badan antara 20-25 gram untuk perlakuan. Mencit diperoleh dari Pusvetma (Pusat Veteriner Farma)Jl. Ahmad Yani 68-70 Surabaya.Mencit yang dipilih adalah mencit yang sehat dengan ciri-ciri bulu bersih bercahaya, mata jernih bersinar, tingkah laku normal dan berat badan bertambah selama adaptasi (Rinayanti dkk, 2014).
Besar sampel yang akan digunakan ditentukan dengan rumus Federer dalam sesuai dengan rumus penentuan jumlah sampel oleh Kusriningrum (2008), yang dapat dijelaskan sebagai berikut :
Keterangan :
t : Jumlah perlakuan n : Jumlah ulangan
3.3 Metode Penelitian 3.3.1 Adaptasi Hewan Coba
Mencit (Mus musculus) betina 18 ekor dibagi secara acak kemudian dimasukkan ke dalam dua buah kandang dengan setiap kandang berisi sembilan ekor mencit kemudian selama satu minggu diadaptasikan dalam kandang plastik
beserta tutup kawat ram dengan hanya memberi pakan berupa pellet dan minum secara ad libitum agar dapat menyesuaikan diri terhadap kondisi lingkungan yang baru, pakan dan minum diberikan secukupnya pagi dan sore hari selain itu kandang harus diusahakan dalam keadaan bersih.
3.3.2 Perbanyakan Isolat Toxoplasma gondii stadium takizoit
Isolat Toxoplasma gondii stadium takizoit dari strain RH yang diperoleh dari Laboraturium Protozoologi Departemen Parasitologi Veteriner Fakultas Kedokteran Hewan Universitas Airlangga Surabaya, kemudian diperbanyak dengan cara dipasasekan ke mencit sehat. Perbanyakan takizoit Toxoplasma gondii dilakukan pada dua ekor mencit Balb/c berumur berat badan 20-25 gram dengan menginokulasikan sebanyak 0,3 ml takizoit dalam larutan NaCl fisiologis ke dalam tubuh mencit secara intraperitoneal. Mencit diinjeksi secara intraperitoneal dengan dosis injeksi1 x 10³ takizoit tiap mencit. Takizoit dipanen setelah menunjukan gejala : lemah, bulu berdiri, dan nafas tersengal-sengal.
Mencit dikorbankandikorbankan dengan cara dislokasio antara os. Cervicalis I dan II, kemudian dilakukan insisi pada bagian abdomen, lalu kulit dikuakkan ke arah cranial, kemudian ke dalamcavum peritoneal mencit ditambahkan sebanyak 3 ml larutan NaCl fisiologis steril dan cairan diambil kembali. Cairan diambil kembali dengan menggunakan spuit kemudian diperiksa dibawah mikroskop cahaya dengan perbesaran 100-400x untuk memastikan adanya takizoit Toxoplasma gondii dalam cairan peritoneum. Cairan peritonial hasil panen diencerkan dengan NaCl fisiologis dalam mikrotube. Hasil dari pengenceran ini dapat diinjeksikan kembali ke mencit lain untuk dilakukan
inokulasi (Suwanti, 2009). Sebelum takizoit diinokulasikan pada mencit perlakuan, parasit dalam cairan perotineal dihitung dengan hemositometerhingga didapatkan dosis infeksi 1x103takizoit. Perbanyakan takizoit dipergunakan untuk perlakuan (Mufasirin dkk, 2005).
3.3.3 Pelaksaan penelitian
Sehari setelah proses adaptasi, ke-18 ekor mencit betinasehat dibagi secara acak menjadi dua kelompokperlakuan dengan masing-masing sembilan ulangan. Berikut pembagian kelompok sesuai dengan perlakuan yang diberikan :
P0 : 20 µl/ekorNaCl fisiologis steril secara intravagina
P1 : 20 µl/ekortakizoit Toxoplasma gondiiberisi 1 x 10³ secara intravagina Pengaplikasian infeksi intravagina dengan menggunakan mikropipet. 3.3.4 Pengambilan organ untuk pembuatan preparat histopatologi
Delapan hari setelah dilakukan infeksi pada masing-masing mencit, dilakukan pengambilan organ hepar untuk selanjutnya dibuat preparat histologipatologinya. Pengambilan organ diawali dengan menganastesi mencit menggunakan cara dislokasi padaantara os. Cervicalis I dan II, kemudian mencit dibedah dan diambil organ heparnya.Organ yang diperoleh kemudian difiksasi kedalam formalin 10% sebelum akhirnya dibuat preparat histopatologi dengan pewarnaan Hematoxylin Eosin (HE) untuk pemeriksaan secara mikroskopis. Cara pembuatan preparat histopatologi serviks mencit (Mus musculus) dapat dilihat pada Lampiran 1. Pembuatan preparat histopatologi dilakukan di Laboraturium Patologi Veteriner Fakultas Kedokteran Hewan Universitas Airlangga Surabaya.
3.3.5 Pemeriksaan preparat histopatologi
Pemeriksaan preparat histopatologi dilakukan dengan menilai kerusakan hepar mencit yang digambarkan oleh degenerasi dan nekrosis dari masing-masing perlakuan. Pengamatan pada lima lapang pandang yang berbeda. Dimulai dari sudut kiri, kanan, bagian atas, bagian bawah dan bagian tengah dari preparat histopatologi hepar dengan menggunakan mikroskop cahaya pembesaran 400 kali. Cara pemberian skor histopatologi hepar adalah dengan menggunakan metode skoring dari Mordue, 2001 yang telah dimodifikasi yaitu dengan cara mengamati satu lapang pandang yang dibagi menjadi 4 bagian, jika satu bagian terdapat satu sel yang mengalami degenerasi atau nekrosis, maka bagian yang diamati tersebut diberi skor 1, jika degenerasi atau nekrosis yang terjadi pada dua bagian dari satu lapang pandang tersebut, maka bagian tersebut diberi skor 2, jika degenerasi atau nekrosis terjadi pada ketiga bagian dari satu lapang pandang tersebut, maka bagian tersebut diberi skor 3, jika pada keempat bagian tersebut terdapat degenerasi atau nekrosis, maka satu lapang pandang tersebut diberi skor 4.
Penilaian tingkat kerusakan pada hepar dalam satu lapang pandang menggunakan metode skoring Mordue (2001) berdasarkan terjadinya degenerasi dan nekrosis seperti pada Tabel 3.1
Tabel 3.1Tabel skor penilaian derajat histopatologi hepatosit (Mordue, 2001)
Skor 0 Satu lapang pandang tidak dijumpai degenerasi dan nekrosis pada bagian yang diamati
Skor 1 Satu lapang pandang dijumpai 1-20% degenerasi dan nekrosis pada bagian yang diamati.
Skor 2 Satu lapang pandang dijumpai 21-50% degenerasi dan nekrosis pada bagian yang diamati.
Skor 3 Satu lapang pandang dijumpai 51-75% degenerasi dan nekrosis pada bagian yang diamati (kerusakan ringan).
Skor 4 Satu lapang pandang dijumpai lebih dari 75% degenerasi dan nekrosis pada bagian yang diamati (kerusakan berat)
3.4 Variabel Penelitian 3.4.1 Variabel bebas
Dosis infeksi takizoit Toxoplasma gondii secara intravagina 3.4.2 Variabel tergantung
Nilai kerusakan hepar mencit yang berupa degenerasi yaitu terjadi proses penimbunan atau akumulasi cairan atau zat lain dalam organel seldan nekrosis yang meliputi perubahan morfologi pada inti sel berupa piknotis, karioreksis dan kariolisis pada preparat histopatologis hepar mencit (Mus musculus).
3.4.3 Variabel kendali
Jenis kelamin mencit, umur mencit, berat mencit, strain mencit, pakan, air minum,strain mencit BALB/c dankandang mencit beserta penutup jala kawat.
3.5 Rancangan penelitian
Penelitian ini bersifat eksperimental dengan dilakukan pengacakan terhadap 18 ekor mencit betina yang terbagi dalam dua perlakuan (t=2) dan tiap perlakuan terdapat sembilan ulangan (n=9). Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL) karena hanya ada satu sumber keragaman yakni perlakuan yang dibeda-bedakan di samping pengaruh acak (Kusriningrum, 2008).Pengacakan terhadap 18 ekor mencit dan variabel yang diamati yaitu gambaran histopatologi hepar.
3.6 Analisis Data
Data yang diperoleh berupa data semi kuantitatif yaitu metode analisis risiko yang menggunakan angka skala untuk setiap kategori kualitatif atau skor (Lampiran 2). Data hasil yang diperoleh berupa skor nilai dari tingkat perubahan gambaran histopatologi hepar mencit disusun dalam bentuk tabel untuk kemudian dianalisis statistik dengan menggunakan uji Mann-Whitney. Seluruh proses analisis dikerjakan dengan program SPSS 16 for Windows.
3.7 Diagram Alur Penelitian
Gambar 3.1 Gambar diagram alur penelitian
Pemeriksaan dan Skoring Histopatologi Hepar dengan Parameter Degenerasi dan Nekrosis Menggunakan Perbesaran 100x dan 400x
Dibagi Menjadi Dua Perlakuan dan Masing-masing Sembilan Ulangan
Dilakukan Pengamatan Cairan Intraperitoneal Mencit (Mus
musculus) untuk Mengetahui Adanya Takizoit
Dilakukan Pembedahan pada Mencit (Mus musculus)
Pembuatan Preparat
P1 : Diinfeksi Takizoit Toxoplasma gondii1 x10³ secara intravagina dengan menggunakan mikro pipet P0 : Diberi Nacl 20 µl sebagai Kontrol secara
intravagina dengan menggunakan mikro pipet
18 ekor mencit (Mus musculus) Betina Umur 2-3 Bulan Diadaptasi Selama Tujuh Hari
Dilakukan Pengambilan Organ Hepar dan Fiksasi dalam Formalin 10%
Analisis Data
Pewarnaan Preparat dengan Hematoxylin Eosin (HE) Diamati Selama Delapan Hari
BAB 4 HASIL PENELITIAN
Pengamatan terhadap perubahan histopatologi hepar dilakukan secara mikroskopis menggunakan preparat histopatolgi dengan pewarnaan H.E dari hepar mencit (Mus musculus) betina pada masing-masing kelompok perlakuanP0 yang disonde dengan 20 µl/ekorNaCl fisiologis steril melalui intravagina dan P1 yang diinfeksi 20 µl/ekortakizoit Toxoplasma gondiiberisi 1 x 10³ secara intravagina dengan menggunakan mikropipet.
Gambaran histopatologi hepar mencit normal dapat dilihat pada Gambar 4.1 berikut.
Gambar 4.1 Hepatosit mencit normal dengan pewarnaan H.E (). (pewarnaan H.E. pembesaran 400x)
4.1 Hasil Pemeriksaan Histopatologi Degenerasi Hepatosit
Berdasarkan hasil pemeriksaan dan pengamatan mikroskopis yang dilakukan pada dua kelompok perlakuan didapatkan perubahan histopatologi berupa degenerasi hepatosit. Hasil pengamatan dapat dilihat pada Tabel 4.1, Gambar 4.2, Gambar 4.3, Gambar 4.4 dan Lampiran 4.
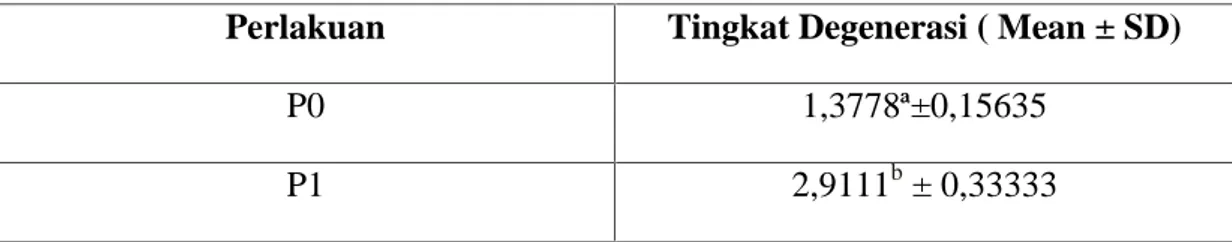
Tabel 4.1 Gambaran histopatologi hepar terhadap tingkat degenerasi pada setiap
perlakuan mencit (Mus musculus).
Perlakuan Tingkat Degenerasi ( Mean ± SD)
P0 1,3778ª±0,15635
P1 2,9111b± 0,33333
Keterangan : Superskrip yang berbeda pada kolom yang sama menunjukkan adanya perbedaan yang nyata (p<0,05).
Keterangan :
P0 =20 µl/ekorNaCl fisiologis steril secara intravagina
P1 = 20 µl/ekortakizoit Toxoplasma gondiiberisi 2 x 10³ secara intravagina dengan menggunakan mikropipet
Tabel 4.1 menjelaskan bahwa pada setiap kelompok perlakuan terlihat perbedaan yang nyata dalam histopatologi hepar mencit berupa degenerasi untuk jenis perhitungan menggunakan mean dan standar deviasi. Berdasarkan hasil analisis statistik dengan uji Mann Whitney menunjukkan bahwa terdapat hasil yang berbeda nyata pada masing-masing kelompok perlakuan (p<0,05).
Gambaran histopatologi hepar mencit yang mengalami degenerasi dengan pewarnaan H.E pembesaran 400x dapat dilihat pada Gambar 4.2 berikut.
Gambar 4.2Hepatosit mencit yang mengalami degenerasi (). (Pewarnaan H.E pembesaran 400x)
Gambar 4.3 Hepatosit mencit yang mengalami degenerasi hidropik ( ). (Pewarnaan H.E pembesaran 400x).
P0
Gambar hepatosit pada Gambar 4.3 menunjukkan bahwa sel mengalami degenerasi hidropik yang ditandai dengan sel tampak membengkak, sitoplasma mengandung vakuola jernih yang merupakan bentukan lemak, air atau glikogen. Vakuola jernih ini dapat mendesak inti sel ke pinggir yang tampak pada pemeriksaan mikroskopis.
Gambar 4.4 Hepatosit mencit yang mengalami degenerasi melemak yang ditandai dengan sel tampak membesar, terdapat vakuola lemak yang berwarna bening dan inti sel terdesak ( ). (Pewarnaan H.E pembesaran 400x).
Gambar hepatosit pada Gambar 4.4 terlihat adanya degenerasi melemak berupa droplet atau vakuola lemak yang berwarna bening, ukuran bervariasi bisa lebih dari satu vakuola dalam satu sitoplasma sehingga inti sel bergeser.
4.2 Hasil Pemeriksaan Histopatologi Nekrosis Hepatosit
Berdasarkan hasil pemeriksaan dan pengamatan mikroskopis yang dilakukan pada dua kelompok perlakuan didapatkan perubahan histopatologi berupa nekrosis hepatosit. Hasil pengamatan dapat dilihat pada Tabel 4.2, Gambar 4.5, Gambar 4.6 dan Lampiran 4.
Tabel 4.2 Gambaran histopatologi hepar terhadap tingkat nekrosis pada setiap
perlakuan mencit (Mus musculus).
Perlakuan Tingkat Nekrosis ( Mean ± SD)
P0 1,1778a±0,15635
P1 2,3778b± 0,61192
Keterangan : Superskrip yang berbeda pada kolom yang sama menunjukkan adanya perbedaan yang nyata (p<0,05).
Tabel 4.2 menjelaskan bahwa pada setiap kelompok perlakuan terlihat perbedaan yang nyata dalam histopatologi hepar mencit berupa nekrosis untuk jenis perhitungan menggunakan mean dan standar deviasi. Berdasarkan hasil analisis statistik dengan uji Mann Whitney menunjukkan bahwa terdapat hasil yang berbeda nyata pada masing-masing kelompok perlakuan (p<0,05).
Gambaran histopatologi hepar mencit yang mengalami nekrosis dengan pewarnaan H.E pembesaran 400x dapat dilihat pada Gambar 4.5 berikut.
Gambar 4.5Hepatosit mencit yang mengalami nekrosis. (A) Piknotis (B) Karioreksis dan (C) Kariolisis ( ). (Pewarnaan H.E pembesaran 400x).
Gambar 4.6 Hepatosit mencit yang mengalami nekrosis.(A)Piknotis, (B) Karioreksis dan (C) Kariolisis(). (Pewarnaan H.E pembesaran 400x).
P1
P0
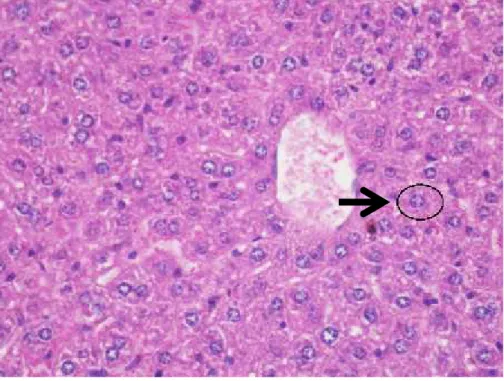
Gambar hepatosit pada Gambar 4.3 menunjukkan bahwa sel mengalami nekrosis ditandai dengan sel tampak membengkak. Terdapat beberapa perubahan morfologi yang tampak, yaitu piknotis(A), karioreksis(B) dan kariolisis(C). Ditemukan pula adanya stadiumtakizoit Toxoplasma gondii pada hepatosit mencit dengan pewarnaan H.E pembesaran 1000x dapat dilihat pada Gambar 4.7 berikut.
Gambar 4.7 Hasil pengamatan takizoit Toxoplasma gondii. Tanda panah ()menunjukkan takizoit Toxoplasma gondii yang menginvasi hepar (pewarnaan H.E, perbesaran 1000x).
BAB 5 PEMBAHASAN
Berdasarkan hasil pemeriksaan dan pengamatan mikroskopis yang telah dilakukan pada duakelompok perlakuan P0 yang disonde dengan 20 µl/ekorNaClfisiologissterilmelalui intravaginadan P1 yang diinfeksi20 µl/ekortakizoit
Toxoplasmagondiiberisi1 x 10³ secara
intravaginadenganmenggunakanmikropipetdidapatkan perubahan histopatologi berupa degenerasi dan nekrosis pada hepatositmencit (Mus musculus). Hasil skoring histopatologis hepar mencitmeliputi kelainan patologi degenerasi dan nekrosis dari hepatosit. Hasil tersebut menunjukkan bahwa semakin tinggi tingkat kerusakan yang ditimbulkan, semakin tinggi pula nilai skor yang dihasilkan.
Hasil statistik dengan Uji Mann Whitney menunjukkan bahwa terdapat perbedaan yang nyata pada degenerasi dan nekrosis pada kelompok P1, karena nilai skoring pada kelompok P1 terjadi perubahan yang sangat signifikan pada kedua aspek perubahan patologi yang diamati.
Jalur masuknya takizoit Toxoplasma gondiimelalui intravagina menuju ke
organ hepar adalah melalui vagina menuju ke uterus, disekitar uterus terdapat banyak pembuluh darah, beberapa diantaranya ada yang menuju ke jantung terlebih dahulumelalui vena porta dimana jantung sebagai organ utama sirkulasi darah, sebagian besar aliran darah dari jantung mengalir melalui pembuluhdarahdari usus dan lien kemudian dikumpulkan oleh vena porta (pembuluh gerbang) mengalir ke hepar dan dari hepar melalui vena hepatika ke kava inferior, di dalam hepar, vena ini
bercabang ke dalam sistem kapiler dan kemudian bersatu dengan kapiler-kapiler arteria hepatika. Arteri ini mengantarkan darah dari aorta ke hepar dan menjelajahi seluruh organ ini, siklusini disebut sistem siklus porta, dari jalur inilah takizoit
Toxoplasma gondiiakan menginfeksi hepatosit dan terjadi berbagai perubahan secara
makroskopis maupun mikroskopis.Toxoplasma gondiiakan menyerang seluruh sel
berinti, membelah diri dan menimbulkan lisis, sel tersebut didestruksi akan berhenti bila sel hospes telah dilindungi oleh antibodi(Chahaya, 2003). Infeksi ini bersifat akut, sehingga menyebabkan degenerasi sel pada parenkim hepar dan selama stadium akut parasit (takizoit) akan mengalami replikasi dengan cepat dan siap mengadakan invasi serta melisiskan sel hospes(Gandahusada, 2000; Roberts dan Janovy, 2000).
Hepatosit di zona satu (sekitar portalis) adalah zona paling dekat dengan sumber pasokan darah, semakin jauh dari portal pasokan oksigen akan semakin berkurang, sehingga daerah sentralobularis rentan terhadap hipoksia, akibatnya mudah mengalami jejas dan nekrosis. Apabila darah dari vena portal banyak membawa racun/toksin, maka zona pertama yang paling dekat dengan sumber pasokan darah yang pertama kali terkena zat toksit tersebut sehingga kerusakan sel paling banyak ditemukan pada sekitar portalis.
Pemeriksaan histopatologis seluruh lapangan pandang kelompok P1 terdapat degenerasi pada semua perlakuan yang diinfeksi takizoit Toxoplasmagondiidapat
dilihat pada Gambar 4.3danGambar 4.4,
leukosit yang menyebar ke berbagai jaringan melaui aliran darahbergerak dari tempat awal infeksi ke sistem peredaran darah di tubuh, kemudian menyebar ke berbagai organ yang dilewati oleh sistem sirkulasi darah, termasuk hepar,namun pada penelitian ini belum ditemukan fase bradizoit atau kista Toxoplasma gondii hal tersebut dikarenakan kecil kemungkinan Toxoplasma gondii membentuk kista sesuai pengamatan Baragan dan Sibley (2002) bahwa Toxoplasma gondii tipe RH merupakan tipe paling patogenik dan mampu mengakibatkan kematian secara cepat pada mencit yang diberi dosis rendah. Toxoplasma gondii tipe RH juga memiliki kemampuan menyebar ke dalam jaringan yang memiliki inti sel dan mampu bermigrasi secara cepat dari jaringan ke jaringan, setelah mencapai pada organ hepar, takizoit akan dapat menembus dinding hepatosit, kemudian akan merusak organel yang ada di dalamnya termasuk mitokondria yang berfungsi menghasilkan ATP, sehinggaproduksi ATP akanmenurundanakanterjadi proses penimbunan (storage) atau akumulasi cairan atau zat lain dalam organel sel.
Degenerasi adalah keadaan penurunan perubahan biokimia intraselular disertai perubahan morfologis akibat jejas nonfatal pada sel atau sebagai reaksi sel terhadap jejas yang masih reversible. Bentuk perubahan degeneratif sel adalah pembengkakan sel, penimbunan lipid intrasel dan partikel yang lain (Arimbi dkk,
2013).PadaGambar 4.3 menunjukkanbahwaselmengalamidegenerasihidropik yang
ditandaidenganseltampakmembengkak, halinikarenaseltidakmampumempertahankan homeostasis ionic dancairan, sitoplasmaselmengandungvakuolajernih yang
Vakuolajernihinidapatmendesakintiselkepinggir, sedangkanpadaGambar 4.4 menunjukkanbahwaselmengalamidegenerasimelemakberupa droplet
atauvakuolalemak yang berwarnabening,
ukuranbervariasidanbilaterdapatvakuoladenganjumlah yang lebihdarisatudalamsatusitoplasma, makaakandapatmendesakinti sel. Vakuolalemakdapatterlihatpadatepi, di pusat, di daerahpertengahanatau di seluruhlobuli.Menurut Arimbi dkk, 2013 proses normal perlemakan hepar umumnya terjadi karena asam lemak sampai ke hepar melalui plasma dalam dua bentuk yaitu trigliserida dari sel penyimpanan lemak dan dari usus. Beberapa faktor kerusakan pada sistem sintesa atau sekresi seperti karena adanya gangguan hepar, hepatotoksin, malnutrisi, anoksia dan kelaparan dapat menimbulkan akumulasi lemak dalam hepatosit dalam bentuk droplet lemak.
Hasil data uji statistik menunjukkan bahwa kelompok perlakuan P1 berbeda nyata (p<0,05) dengan kelompok perlakuan P0. Berdasarkan pengamatan terhadap preparat kelompok P1didapatkan perubahan berupa degenerasi hidropik dan degenerasi melemak, sedangkan pada kelompok perlakuan P0 juga terdapat degenerasi sel tetapi tidak signifikan dibanding dengan perubahan yang terjadi pada kelompok perlakuan P1. Terjadinya degenerasi ini akibat adanya jejas atau infeksi yang ditimbulkan oleh takizoit yang masuk ke dalam hepatosit.
Perubahan gambaran histopatologi hepar lainnya adalah nekrosis dapat dilihat pada Gambar 4.6. Nekrosis adalah kematian sel atau jaringan yang bersifat