PAPARAN KULIAH BAHAN BAKAR DAN PELUMAS
Disusun untuk perkuliahan Bahan bakar dan pelumas
Disusun Oleh: Drs. Supraptono, MPd.
TEKNIK MESIN FAKULTAS TEKNIK UNIVERSITAS NEGERI SEMARANG
2004
A. Nama dan Kode Mata Kuliah : Bahan Bakar dan Pelumas. B. Jurusan/Program Studi : PTM S1/TM S1/TM D3.
C. Deskripsi Mata Kuliah : Mahasiswa dapat menguasai tentang dasar pengertian yang berkaitan dengan bahan bakar dan pelumas beserta fungsi dan kegunaan bagi kehidupan.
D. Kegunaan Mata Kuliah : dapat mengetahui energi yang ditimbulkan oleh pembakaran bahan bakar yang meliputi pengenalan bahan bakar, hakekat bahan bakar, energi dan pembakaran, analisa pembakaran, kebutuhan udara pembakaran, pelumas dan sistem pelumasan, karakteristik minyak pelumas, dan sistem pelumasan.
E. Tujuan Instruksional Umum : mahasiswa dapat mengetahui tentang fungsi bahan bakar dan pelumas dalam pemakaian.
F. Susunan dan materi pengajaran: pengenalan bahan bakar, hakekat bahan bakar, energi dan pembakaran, analisa pembakaran, kebutuhan udara pembakaran, pelumas dan sistem pelumasan, karakteristik minyak pelumas, dan sistem pelumasan
G. Petunjuk Pelajaran Bagi Mahasiswa: pembelajaran dilakukan dengan multi media, buku ajar, diskusi, dan tugas-tugas sebagai pengayaan materi sehingga diharapkan mahasiswa mempersiapkan diri sebelum perkuliahan dilaksanakan. Untuk memperlajari mata kuliah ini mahasiswa harus sudah menempuh mata kuliah kimia teknik.
DAFTAR ISI PENGANTAR……….
DAFTAR ISI………… DAFTAR TABEL…… DAFTAR GAMBAR…
BAB I. PENGENALAN BAHAN BAKAR Pengertian bahan bakar
Macam-macam bahan bakar Cara perolehan bahan bakar
Syarat bahan bakar dalam pemakaian BAB II. HAKEKAT BAHAN BAKAR
Komposisi bahan bakar Sifat-sifat bahan bakar Tara kalor mikanik BAB III. ENERGI DAN PEMBAKARAN Dasar pengertian pembakaran
Unsur yang terkandung dalam bahan bakar Proses pembakaran dan hasilnya
BAB IV. ANALISA PEMBAKARAN Nomenklatur
Stoichiometri massa dan volume Emisi gas buang
BAB V. KEBUTUHAN UDARA PEMBAKARAN
Udara pembakar
Pengaruh pencemaran lingkungan Persyaratan kesehatan
BAB VI. PELUMAS DAN SISTEM PELUMASAN Dasar pengertian pelumasan
Macam minyak pelumas
Guna dan fungsi minyak pelumas
BAB VII. KARAKTERISTIK MINYAK PELUMAS Sifat fisika dan kimia minyak pelumas Aditif, fungsi dan kegunaannya Karakteristik minyak pelumas BAB VIII. SISTEM PELUMASAN
Macam-macam teknik pelumasan Pelumasan pada otomotif.
DAFTAR PUSTAKA BAB I.
PENGENALAN BAHAN BAKAR
Bahan bakar adalah bahan–bahan yang di gunakan dalam proses pembakaran. Tanpa adanya bahan bakar tersebut pembakaran tidak akan mungkin dapat berlangsung. Jenis bahan bakar yang dikenal dalam kehidupan sehari–hari, digolongkan berdasar asal bahan bakar dapat di bagi menjadi tiga, yaitu: (1) bahan bakar nabati, (2) bahan bakar mineral, dan (3) bahan bakar fosil. Berdasarkan bentuknya, digolongkan menjadi tiga bentuk, yaitu: (1) bahan bakar padat, (2) bahan bakar cair, dan (3) bahan bakar gas.
DESKRIPSI
Materi dalam bab 1. akan dipelajari tentang: (1) Pengertian bahan bakar, (2) Macam-macam bahan bakar, (3) Cara perolehan bahan bakar, dan (4) Syarat bahan bakar dalam pemakaian.
TUJUAN INSTRUKSIONAL KHUSUS
Setelah mempelajari materi pada bab 1. mahasiswa dapat mengetahui: (1) Dasar pengertian bahan bakar, (2) Macam-macam bahan bakar yang digunakan dalam kehidupan, (3) Cara perolehan bahan bakar, dan (4) Syarat-syarat yang harus dipenuhi bahan bakar dalam pemakaian.
BAB I. PENGENALAN BAHAN BAKAR
A. Pengertian Bahan Bakar
Bahan bakar adalah bahan–bahan yang di gunakan dalam proses pembakaran. Tanpa adanya bahan bakar tersebut pembakaran tidak akan mungkin dapat berlangsung. Banyak sekali jenis bahan bakar yang kita kenal dalam kehidupan kita sehari–hari. Penggolongan ini dapat dibagi berdasar dari asalnya bahan bakar dapat di bagi menjadi tiga golongan, yaitu: (1) bahan bakar nabati, (2) bahan bakar mineral, dan (3) bahan bakar fosil. Apabila dilihat dari bentuknya, maka bahan bakar di bagi menjadi tiga bentuk, yaitu: (1) bahan bakar padat, (2) bahan bakar cair, dan (3) bahan bakar gas. Namun demikian hingga saat ini bahan bakar yang paling sering di pakai adalah bahan bakar mineral cair. Hal ini dilakukan karena banyaknya keuntungan–keuntungan yang di perolah dengan menggunakan bahan bakar dengan jenis mineral tersebut.
Setiap bahan bakar memiliki karakteristik dan nilai pembakaran yang berbeda–beda. Karakteristik inilah yang menentukan sifat–sifat dalam proses pembakaran, dimana sifat yang kurang menguntungkan dapat di sempurnakan dengan jalan menambah bahan-bahan kimia ke dalam bahan bakar tersebut, dengan harapan akan mempengaruhi daya anti knocking atau daya letup dari bahan bakar, dan dalam hal ini menunjuk apa yang dinamakan dengan bilangan oktan (octane number). Proses pembakaran bahan bakar dalam motor bensin atau
mesin pembakaran dalam sangat di pengaruhi oleh bilangan tersebut, sedangkan di motor Diesel sangat di pengaruhi oleh bilangan setana (cetane number).
Adapun tujuan dari pembakaran bahan bakar adalah untuk memperoleh energi yang di sebut dengan energi panas (heat energy). Hasil pembakaran bahan
bakar yang berupa energi panas dapat di bentuk menjadi energi lain, misalnya : energi untuk penerangan, energi mekanis dan sebagainya. Dengan demikian setiap hasil pembakaran bahan bakar akan di dapatkan suatu bentuk energi yang lain yang dapat di sesuaikan dengan kebutuhan. Sisa–sisa hasil pembakaran dalam bahan bakar harus di perhatikan. Oleh karena itu sisa dari hasil pembakaran yang kurang sempurna akan dapat berpengaruh negatif terhadap lingkungan. Sisa
pembakaran ini akan mengandung gas-gas beracun, yang terutama di timbulkan oleh pembakaran pada motor bensin. Sedangkan hasil pembakaran yang di timbulkan oleh motor Diesel akan dapat menimbulkan gas asap yang berwarna gelap yang akan mengotori lingkungan. Namun pada kenyataanya, polusi yang di timbulkan oleh pembakaran pada motor Diesel ini tidak berbahaya bagi lingkungan, jika di bandingkan dengan gas sisa hasil pembakaran pada motor bensin.
B. Pengertian Bahan Bakar Minyak
Bahan bakar minyak adalah bahan bakar mineral cair yang di peroleh dari hasil tambang pengeboran sumur – sumur minyak, dan hasil kasar yang di peroleh di sebut dengan minyak mentah atau crude oil. Hasil dari pengolahan
minyak mentah ini akan menghasilkan bermacam bahan bakar yang memiliki kualitas yang berbeda-beda. Minyak dalam hal ini merupakan bahan bakar yang di Indonesia pemakaianya telah lama kita pergunakan dalam kehidupan sehari–hari. Sebelumnya, lebih banyak di gunakan orang dengan istilah minyak tanah, yang artinya minyak yang di hasilkan dari dalam tanah (R.P. Koesoemadinata : 1980).
Berdasar asal-muasalnya yaitu dengan di ketahuinya minyak tanah atau minyak mentah itu terdapat bersama–sama dengan gas alam, maka istilah yang lazim digunakan sekarang ini adalah minyak dan gas bumi.dalam beberapa bahasa lain, misalnya : petroleum (Bahasa Inggris) yang berasal dari kata “petro” yang
berarti batu dan “oleum” yang berarti minyak. Jadi dengan kata lain petrolium
berarti minyak yang berasal dari batu. Sebenarnya istilah minyak bumi lebih tepat digunakan, sebab minyak terdapat di bumi dan bukan dalam tanah, atau juga tepat apabila disebut sebagai minyak mentah, artinya minyak yang belum di kilang. Istilah lain yang biasa di pakai adalah natural gas atau gas alam.
Adapun istilah minyak tanah kita kenal sebagai kerosin, yaitu salah satu hasil pengilangan minyak bumi, yang juga sering di sebut sebagai minyak latung, yang dalam hal ini latung berarti batu, dengan demikian minyak latung sama pengertiannya petro-oleum.
Komposisi Minyak Bumi
Kebanyakan senyawa yang ditemukan dalam minyak bumi adalah gabungan dari hydrogen dan carbon. Material-material ini disebut hidrokarbon, senyawa lain yang ada seperti belerang, oksigen, dan nitrogen. Pengoperasian fisik dari kilang minyak seperti: penguapan, penggesekan, dan pendinginan untuk menentukan jenis hidrokarbon yang besar karena dalam material tersebut merupakan bagian yang penting dalam minyak, tetapi pengoperasian secara kimiawi, seperti: pengilangan dan penyaringan, hal ini dilakukan untuk mengelompokkan senyawa belerang, oksigen dan nitrogen, dengan metode yang sama seperti sejumlah hidrokarbon aktif untuk menyediakan senyawa-senyawa tersebut. Minyak mentah Rusia dan minyak “naphtane utama” sebagian besar
berisi oksigen. Oksigen yang terdapat di dalamnya sering berkombinasi dalam bentuk asam naphtene. Nitrogen juga sering ditemukan dalam “minyak naphtane
utama” dan pada umumnya seperti bentuk senyawa dasar yang mirip dengan alkil quiolin. Belerang yang ada biasanya merupakan belerang bebas, hydrogen sulfida
atau sebagai senyawa organic, seperti: thiophenes, asam sulfonik, mercaptan, alkil sulfida. Beberapa senyawa-senyawa belerang ditemukan di dalam minyak mentah,
tetapi senyawa-senyawa tersebut dihasilkan dari senyawa lain selama pengilangan dan destilasi. Senyawa belerang biasanya menyebabkan masalah karena bersifat korosif. Sebagian besar dari senyawa metal organic berisi besi, nikel, vanadium, arsenik dan lain-lain, senyawa-senyawa tersebut di antaranya ditemukan di dalam
minyak, beberapa diantaranya beracun dan bersufat katalis.
Berbagai jenis rangkaian dari hidrokarbon ditemukan pada minyak mentah dan jenis rangkaian lain dihasilkan dengan pemecahan dan hidroginasi. Banyak jenis rangkaian tersebut diantaranya adalah jenis yang telah teridentifikasi di dalam minyak dengan rumus kimia sebagai berikut: CnH2n+2, CnH2n, CnH2n-2, CnH2n-4, CnH2n-6, CnH2n-8, CnH2n-10, CnH2n-14, CnH2n-20. Beberapa dari senyawa tersebut mempunyai tingkatan yang tidak pernah dihasilkan secara sintetis atau untuk kepentingan penelitian, dalam hal komposisi n = 5 s/d 16 . Hal ini terdapat beberapa senyawa sebagai pembanding tingkatan dalam minyak. Namun pemisahan senyawa-senyawa murni sangat sulit karena sifat dari
masing-masing tingkatan tersebut berbeda dan titik didihnya berbeda, yang mana tidak bisa dipisahkan dengan fraksinasi dan prevalent. Kesulitan pemisahan dan
kemajemukan dari hidrokarbon tersebut menjadikan minyak sebagai obyek penelitian yang menarik di bidang kimia perminyakan.
Jenis rangkaian hidrokarbon, dari jenis rangkaian hidrokarbon yang terdapat dalam perminyakan hanya beberapa yang telah diteliti melalui pengembangan komersiil yang cukup berhasil. Jenis terbaik dan telah diketahui adalah paraffin, olefin, nephtane, aromatis, diolefin, dan asetilen.
Jenis rangkaian paraffin (CnH2n+2), senyawa ini mempunyai sifat yang stabil. Penamaan dalam senyawanya diakhiri dengan “ane” methane, ethane, hexane, dan hexadekane. Dalam suhu ruangan jenis-jenis ini tidak tereaksi oleh
penguapan asam belerang, terkonsentrasi alkali, asam nitris atau bahkan oleh asam krom oksida kuat, kecuali yang berisi sebuah atom karbon tersier. Mereka bereaksi secara lambat dengan klorin dalam sinar mata hari dan begitu juga blorin,
apabila terdapat katalis. Reaksi biasanya terjadi dari substitusi unsur dan senyawa kimia atom hydrogen. Tingkatan terendah telah teridentifikasi disebagian besar minyak mentah, tetapi menurut Mabery , bahwa Mahoning County, Ohio, minyak
mentah tidak berisi hidrokarbon paraffin. Jenis tingkatan paraffin yang lebih
tinggi dimungkinkan menghasilkan minyak yang lebih banyak walaupun minyak mentah itu masuk secara bebas dari bak yang tidak berisi hidro karbon paraffin
yang bertitik didih rendah. Bak paraffin mungkin terdiri dari urutan berantai
hidrokarbon paraffin lurus dan bercabang. Egloff, Schaad dan Lowry telah
membuat penelitian melalui pembusukan hidrokarbon paraffin.
Jenis rangkaian olefin atau etilen (CnH2n). Senyawa ini mempunyai komposisi hidro karbon tak jenuh contohnya jenis dari rangkaian ini memungkinkan mengelompok secara langsung dengan material yang lain seperti
klorin, bromin, asam hidroklorin dan asam belerang tanpa salah penempatan asam
hydrogen. Nama-nama dari hidrokarbon ini adalah berakhiran “ene”, sebagai etana (etilen), propena (propilen), dan butana (butilen). Senyawa-senyawa yang
tapi mereka berada dalam hasil yang terpecah. Egloff, Schaad dan Lowry teleh membuat penelitian yang sangat luar biasa dari literature hidrokarbon olefin.
Jenis rangkaian naptin (CnH2n) . Rangkaian ini mempunyai jenis rumus yang sama pada jenis olefin hanya saja pada senyawa ini mempunyai sifat-sifat yang berbeda. Naptin adalah senyawa lingkaran atau siklik, mengingat olefin
adalah senyawa rantai yang lurus, dimana dua ikatan tersebut menghubungkan atom-atom karbon. Naptin adalah senyawa-senyawa jenuh dan olefin adalah
senyawa tak jenuh. Senyawa tak jenuh dapat bereaksi dengan senyawa kombinasi serta bahan-bahan yang lain, tetapi senyawa jenuh hanya dapat bereaksi oleh penempatan hydrogen bahan-bahan lain. Banyak literatur kimia menyebutkan bahwa naptin disebut metilen. Contohnya, tetrametilen, pentametilen, dan heksametilen. Hal ini mengingat penamaan yang ada sekarang adalah siklobutana, siklopentana, dan sikloheksana. Sebagaimana contoh tersebut hubungan dari
rangkaian ke rangkaian siklik yang lain mempertimbangkan benzana dan sikloheksana. Baik senyawa-senyawa berisi enam (6) atom-atom karbon per molekul, tapi enam atom hydrogen itu harus ditambahkan benzana untuk menghasilkan sikloheksana. Molekul sikloheksana bersifat jenuh, tetapi molekul-molekul benzana adalah sangat tak jenuh, jadi molekul-molekul benzana tersebut
mempunyai tiga kombinasi dari tiga atom karbon. Ikatan-ikatan tripel yang terbentuk adalah benzana yang sangat aktif sehingga disebut bahan yang sangat
aktif, namun sikloheksana tidak mempunyai ikatan yang ganda dan juga tidak
bereaksi. Bagaimanapun kebanyakan dari reaksi-reaksi benzana adalah dengan
mensubstitusikan dari pada mengkombinasi. Naptana tidak seperti isomer-isomernya olefin, mereka tidak dapat larut dengan mudah dalam asam belerang.
Neptana telah banyak diketemukan di semua jenis minyak mentah. Tapi sekali lagi minyak mentah Mahoning County adalah sebuah pengecualian. Minyak mentah ini berisi rangkaian hidrokarbon CnH2n-2 dan CnH2n-4, tapi tidak ada paraffin atau neptana yang sederhana. Egloff, Bollman dan Levinson telah melakukan riset dari siklohidrokarbon yang menghasilkan formulasi sebagai terlihat pada gambar di bawah ini.
H H H H H H H H H H H H l l l l l l l l l l l l H – C – C – C – C – C – C – H H – C – C – C – C – C = C l l l l l l l l l l l H H H H H H H H H H H
Gb. (a) Normal Heksana C6H14 Gb. (b) Normal Heksana C6H12 H H H C H H H C C H C H – C C - H H – C C H H C C H C H H C H H H Gb. (c) Cycloheksana C6H12 Gb. (d) Benzena C6H6 H H H H H H H H H H H l l l l l l l l l l l C = C - C - C - C = C H – C - C - C - C - C - H l l l l l l l l H H H H H H H H H - C - H I H Gb. (e) Heksadiena –1,5, C6H10. Gb. (f) Isomeric isofarafin compound
Jenis rangkaian Aromatik (CnH2n-6), formula ini biasa disebut seri
benzena yang merupakan kimia aktif. Hidrokarbon ini mudah untuk melakukan
oksidasi dengan formasi asam organic. Aromatik tersebut bisa ditambahkan atau
disubstitusikan dengan produk tergantung pada reaksinya. Hanya beberapa jenis minyak mengandung sejumlah kecil dari aromatik bertitik didih rendah seperti benzena dan toluene. Mabery menemukan kuantitas relatif yang lebih banyak dari aromatik dalam minyak di Ventura, Coalinga, Poentehills dan Chalifornia.
Beberapa minyak mentah di bagian Sumatra dan Kalimantan juga kaya akan aromatik tersebut. Seri ini ditemukan pada bensin dengan katalis dan kandungan yang tinggi untuk kualitas anti ketukan (knocking).
Jenis rangkaian Diolefin (CnH2n-2), formula ini seperti pada jenis olefin
memiliki dua atom hydrogen untuk mengadakan dua ikatan ganda dalam molekul masing-masing. Ikatan ganda ini disebabkan karena sifatnya yang sangat reaktif.
Diolefin dikerjakan pada polimeresasi atau kombinasi dengan beberapa bentuk
ikatan molekul sangat berat dalam bentuk larutan padat diolefin dan karet, dari
proses ini tidak dikerjakan dengan pemecahan gaselin, tetapi kemungkinan tidak ditemukan dalam petroleum mentah. Proses polemerisasi dibuat dengan asam sulfur.
Jenis siklik dengan formulasi CnH2n-2, CnH2n-4, CnH2n-8. Masih ada beberapa formulasi lain dengan komposisi yang tak begitu dikenal, namun demikian banyak literature menyebutkan jenis-jenis yang menguasai dalam minyak dengan titik didih tinggi, minyak gas, dan minyak pelumas. Sebagian besar hidrokarbon dalam minyak pelumas adalah jenuh. Menurut Seyr bahwa antara 20 % dari minyak pelumas larut dalam sulfur dioksida. Berdasar penelitian
Doubtles menemukan bahwa sekitar 20 % terikat dalam hidrokarbon jenuh.
Kandungan isomeric. Kerancuan pada pemahaman sering muncul yang disebab kan adanya perbedaan kandungan tetapi memiliki formula molekul yang sama. Kandungan isomeric memiliki formula molekul yang sama karena
perbedaan internal dalam struktur. Kandungan dari formula tipe CnH2n bisa jenuh atau terserap. Formula dari kandungan jenuh cyclohehance dan kandungan terisap hexane-1 dapat dijelaskan bahwa formula dari n-hexane, 2-metil pentane, dan
2-dimetil butana, memiliki tipe formula yang sama yaitu CnH2n+2 atau C6H14 .
Kelompok atom seperti kelompok metil menurut kandungannya biasa disebut alkil group atau radikal. Bagian-bagian ini mengacu pada kelompok atom-atom karbon dan hidrogen yang berada dalam satu unit, karena atom ini berperan seperti kelompok dalam reaksi kimia. Atom-atom tersebut didefinisikan sebagai hidrokarbon menovalent yaitu kelompok yang memiliki formula secara umum CnH2n+1 . Biasanya kelompok radikal terdiri dari metil (CH3), etil (C2H5) dan propile (C3H7). Radikal-radikal tersebut bukan kelompok ikatan individu karena harus selalu ditarik radikal lainnya, elemen seperti kelompok atom lain.
Ada dua isomer butana yang mungkin yaitu viz n-butana dan 2-metil propana, 3 pentana, 5 heksana, 9 heptana. Jumlah isomer hidrokarbon yang
mungkin tersebut dapat meningkat secara cepat sesuai dengan jumlah atom-atom karbon yang meningkat, ikatan-ikatan dari atom-atom yang mempunyai jenis rumus kimia CnH2n-4 memungkinkan pembentukan isomer. Rangkaian ini mengindikasikan sejumlah isomer yang mungkin tapi tak jenuh, molekul hidrokarbon tinggi yang kuat dalam minyak yang mungkin sedikit atau isolasi dari ikatan tersebut adalah komplek yang membuktikan jumlah hidrokarbon isomer yang munkin (CnH2n+2) berupa rangkaian yang terpisah-pisah.
Sejumlah kemungkinan dari alifatik (CnH2n+2) hidrokarbon isomerik.
Atom Karbon Isomer
6 5 7 9 8 18 9 35 12 355 15 4.347 18 60.523 25 36.797.588 40 62.491.178.805.831
C. Macam–macam Bahan Bakar Minyak 1. Bensin
Bensin berasal dari kata benzana, lazim sebenarnya zat ini berasal dari gas
tambang yang mempunyai sifat beracun dan merupakan persenyawaan dari hidrokarbon tak jenuh, artinya dapat bereaksi dengan mudah terhadap unsur– unsur lain. Bentuk ikatan adalah rangkap, dan senyawa molekulnya di sebut alkina. Bahan bakar jenis ini biasa disebut dengan kata lain gasoline. Bensin pada
dasarnya adalah persenyawaan jenuh dari hidro karbon, dan merupakan komposisi
isooctane dengan normal-heptana.Serta senyawa molekulnya tergolong dalam
kelompok senyawa hidrokarbon alkana. Kualitas bensin dinyatakan dengan angka
oktan, atau octane number.
Angka oktan adalah prosentase volume isooctane di dalam campuran
antara isooctane dengan normal heptana yang menghasilkan intensitas knocking
atau daya ketokan dalam proses pembakaran ledakan dari bahan bakar yang sama dengan bensin yang bersangkutan. Isooctane sangat tahan terhadap ketokan atau
dentuman yang kita beri angka oktan 100, heptane yang sangat sedikit tahan
terhadap dentuman di beri bilangan 0. Pada motor percobaan, bermacam–macam bensin di bandingkan dengan campuran isooctane dan normal heptana tersebut.
Bilangan oktan untuk bensin adalah sama dengan banyaknya prosen isooctane
dalam campuran itu. Semakin tinggi ON bahan bakar menunjukkan daya bakarnya semakin tinggi. Bensin yang ada di pasaran di kenal ada tiga kelompok : (1)
Regular–grade, (2) Premium–grade, dan (3) Third-grade Gassoline. Adapun di
Indonesia pertamina mengelompokkanya menjadi : bensin, premium, aviation gas dan super 98.
2. Minyak Tanah
Minyak tanah merupakan campuran kompleks antara beratus- ratus macam hidro karbon dalam minyak tanah terdapat karbon tak jenuh, tetapi hasil kracking yaitu penyulingan pada suhu dan tekanan yang tinggi terjadi pula senyawa hidro karbon yang tidak jenuh. Adapun terjadinya minyak tanah ini berdasarkan pertimbangan geologis maupun dasar pertimbangan kimia yang telah di ketahui,
menyatakan bahwa minyak tanah terjadi dari sisa – sisa hewan dan tumbuhan. Hal ini nampak dalam beberapa fraksi minyak tanah mempunyai kegiatan optik dan terdapatmya porpirin yang ada hubunganya dengan khlorofil maupun hemin.
Sehingga dapat di simpulkan bahwa sisa–sisa tumbuhan mengandung khlorofil, sedang sisa–sisa hewan mengandung haemoglobin.
Pengambilan minyak tanah dilakukan dengan jalan pengeboran minyak bumi sampai dengan lapisan tertentu, kemudian di lakukan penyulingan. Hasil dari penyulingan meperoleh sejumlah fraksi yang berhasil di pisahkan,antara lain : (1) Petroleum eter, fraksi pertama yang mendidih antara 35°C sampai dengan
80°C, (2) Gassoline / bensin, fraksi kedua yang mendidih antara 50°C sampai
dengan 220°C, (3) Kerosin, fraksi ketiga yang mendidih antara 200°C sampai
dengan 300°C, (4) Parafin padat, cair, petroleum, fraksi yang mempunyai
temperatur tertinggi, dan (5) Residu, fraksi yang terakhir.
3. Minyak Solar
Minyak solar adalah bahan bakar minyak hasil sulingan dari minyak bumi mentah, bahan bakar ini mempunyai warna kuning cokelat yang jernih. Minyak solar ini biasanya digunakan sebagai bahan bakar pada semua jenis motor Diesel dan juga sebagai bahan bakar untuk pembakaran langsung di dalam dapur–dapur kecil yang menghendaki hasil pembakaran yang bersih. Minyak ini sering di sebut juga sebagai gas oil, ADO, HSD, atau Dieseline. Pada temperatur biasa, artinya pada suhu kamar tidak menguap, dan titik nyalanya jauh lebih tinggi dari pada bahan bakar bensin.
Kualitas solar dinyatakan dengan angka setane atau cetane number (CN).
Bilangan setane yaitu besar prosentase volume normal cetane dalam campuranya
dengan methylnapthalene yang menghasilkan karakteristik pembakaran yang
sama dengan solar yang bersangkutan (Drs. Warsowiwoho : 1976). Secara umum solar dapat diklasifikasikan sebagai berikut: (1) Light Diesel Fuel (LDF)
mempunyasi CN = 50, (2) Medium Diesel Fuel (MDF) mempunyasi CN = 50, dan
LDF dan MDF sering dikatakan sebagai solar no.1 dan 2. Kedua jenis solar ini sebenarnya letak perbedaanya adalah pada efek pelumasanya saja. LDF dalam hal ini lebih encer, jernih, dan ringan, sedang MDF lebih gelap, berat, dan dan dalam pemakaianya dealam motor bakar di perlukan syarat- syarat khusus.
4. Minyak Diesel
Minyak Diesel adalah bahan bakar minyak jenis penyulingan kotor yang mengandung fraksi–fraksi berat atau campuran dari jenis destilase dengan fraksi yang berat (residual fuel oil) dan berwarna hitam dan gelap, tetapi tetap cair pada
suhu rendah. Minyak Diesel ini banyak di gunakan sebagai bahan bakar mesin Diesel yang berputar sedang atau lambat dan juga sebagai bahan bakar untuk pembakaran langsung dalam dapur–dapur industri. Bagi kehidupan sehari-hari minyak ini sering disebut sebagai MDF (Medium Diesel Fuel).
5. Minyak Bakar
Minyak bakar adalah bahan bakar yang bukan berasal dari hasil penyulingan, tetapi jenis residu. Minyak ini mempunyai tingkat kekentalan yang tinggi dan juga titik tuang (pour point) yang lebih tinggi dari pada minyak Diesel,
serta berwarna hitam gelap. Bahan bakar jenis ini banyak di pergunakan sebagai bahan bakar pada sistem pembakaran langsung dalam dapur–dapur industri yang besar. Pembakaran langsung yang di maksud adalah pada sistem eksternal combustion engine atau mesin pembakaran luar, misalnya: pada mesin uap,
dapur-dapur baja, dan lain sebagainya. Minyak ini di sebut juga sebagai MFO (Medium Fuel Oil).
6. Bensol
Bensol adalah bahan bakar hasil tambahan dari pada industri gas batu bara
dan pabrik kokas. Bensol dapat di peroleh dengan cara mencuci gas yang keluar
dari dapur dengan ter yang ringan. Bahan bakar minyak ini sangat baik di gunakan pada kendaraan bermotor, karena sangat tahan terhadap knocking atau dentuman, sehingga memenuhi syarat pada motor dengan kompresi tekanan yang tinggi.
Kadang–kadang di pakai sebagai campuran bensin untuk mempertinggi sifat anti dentuman (knoking). Bensol membeku pada temperatur 5°C di bawah nol. Dengan menambahkan tuluol dan xylol titik beku dari bahan bakar ini dapat di
turunkan.
D. Cara Perolehan Bahan Bakar
1. Bahan bakar yang berasal dari tumbuhan
Sebenarnya bahan bakar, terutama bahan bakar minyak telah lama di kenal oleh bangsa Indonesia. Hanya saja pada saat itu minyak hanya di gunakan sebatas sebagai penerangan rumah tangga di waktu malam hari. Namun pengenalan minyak masih sangat sederhana, misalnya pada penggunaan obor, yang semua itu sebenarnya merupakan bahan bakar minyak yang di pergunakan dalam bentuk yang lain. Bahan bakar minyak ini dapat diperoleh melalui proses peragian atau dengan jalan penggilingan yang berasal dari tumbuh–tumbuhan yang telah terkubur sekian tahun lamanya. Adapun proses terjadinya adalah sebagai berikut, di tinjau bagaimana benih suatu tumbuhan mulai tumbuh dari lembaganya, maka benih tersebut keluar akar yang kemudian masuk ke dalanm tanah, sedagkan batangnya muncul di udara. Akar dari tumbuhan ini mengambil makanan dari dalam tanah. Daun pada batang mengambil makanan dari udara atau sebagai dapur untuk memasak makanan tersebut. Akan tetapi sebelumnya bibit kecil itu memerlukan persediaan makanan sedikir sekali sebagai bekalnya. Modal tumbuhan itu terdapat di dalam benihnya. Sesungguhnya makanan sebenarnya adalah sebagian besar merupakan benih tumbuhan, misalnya tanaman padi yang di tumbuk atau di giling menjadi beras, buah–buahan yang bertempurung seperti kelapa, pala, kemiri dan sebagainya adalah benih pohon atau selubung benih tempat makanan persediaan untuk tumbuhan tadi. Bahan makanan yang mengandung minyak mudah di simpan dan di timbun dalam jangka waktu yang cukup lama. Demikian juga pada tumbuh-tumbuhan yang menyimpan makananya dalam bentuk minyak pada bijihnya. Itulah sebabnya hampir semua bahan bakar yang berbentuk minyak nabati berasal dari benih tumbuh-tumbuhan. Apalagi benih tumbuhan yang mengandung minyak tadi, misalnya : kenari, kemiri, kacang
tanah dan sebagainya jika dikeringkan maka akan terdapat minyak yang dapat di bakar hingga memberi nyala api. Namun perlu di ketahui bahwa minyak jenis seperti itu sangatlah terbatas jumlahnya, sehingga bahan bakar yang demikian itu sangat mahal harganya di pasaran, maka sebagian orang tidak lagi menggunakan bahan bakar yang semacam itu karena dianggap kurang ekonomis. Untulk menanggulangi hal itu, maka sekarang ini banyak di produksi jenis minyak tersebut dengan jalan peragian (arsenium), misalnya tetes tebu, ketela pohon,
kentang dan sebagainya.
Bahan bakar jenis ini banyak di gunakan untuk bahan pembuatan alkohol. Walaupun pembuatanya menggunakan fasilitas yang relatif lebih murah, namun produksinya sangat rendah, sehingga kurang memadai apabila di bandingkasn dengan jumlah penggunanya. Bahan bakar yang di hasilkan dengan jalan seperti di atas sering di sebut sebagai bahan bakar alkohol dan spiritus.
2. Bahan bakar mineral
Bahan bakar minyak mineral ini di dapatn dari tambang sehingga sering juga di sebut sebagai minyak bumi ataun minyak mineral atau juga minyak tambang. Bahan bakar mineral ini sangat penting artinya bagi kehidupan manusia, karena dunia memerlukanya begitu banyak sehingga manusia mencari di mana-mana. Adanya kebutuhan yang banyak itu maka eksploitasi terhadap minyak bumi dilakukan secara besar-besaran. Keadaan yang seperti itu, dikhawatirkan akan memacu terjadinya kelangkaan minyak dunia. Teknologi modern tentang pengolahan minyak telah ditemukan dengan cara melakukan penyulingan terhadap minyak bumi. Proses dimulai dengan memasukkan saluran pipa ke dalam sumur galian yang di dalamnya mengandung minyak, gas dan air. Pipa tersebut kemudian di hubungkan dengan menara destilasi, yang mana di dalam menara itu minyak mentah dan gas alam akan di proses dengan temperatur yang tinggi agar mencair dan dapat dipisahkan menjadi jenis bahan bakar yang berbeda-beda.
E. Syarat Bahan Bakar dalam Pemakaian
Ada beberapa tipe bahan bakar dan pelumas yang digunakan pada kendaraan bermotor. Beberapa diantaranya berisi racun dan zat kimia yang mudah terbakar dan ini harus di tangani dengan hati–hati. Penggunaan tipe bahan bakar atau pelumas disesuaikan dengan karaktristik terhadap kebutuhan, agar tidak terjadi kesalahan yang menyebabkan kerusakan pada mesin pembangkit tenaga. Pemakaian bahan bakar yang tidak sesuai dengan karakter mesin mungkin dapat menyebabkan kerusakan pada sistem kerja mesin maupun efek yang lain, yaitu berupa polusi lingkungan. Oleh karena itu sangatlah penting bagi kita untuk mengetahui perbedaan tipe karakteristik pelumas dan bahan bakar, beserta cara penangananya yang benar. Sampai saat ini bahan bakar yang biasa di gunakan pada mobil dan sebagian kendaraan bermotor adalah bensin dan solar (Diesel), dan beberapa negara ada yang menggunakan alkohol, LPG dan bahan bakar lainya. Namun demikian secara garis besar penjelasan dan penggunaan tentang bahan bakar yang ada dipasaran umum, yaitu berupa bensin dan solar (Diesel).
1. Bahan bakar bensin
Bensin mengandung hidro karbon hasil sulingan dari produksi minyak mentah. Bensin mengandung gas yang mudah terbakar, umumnya bahan bakar ini di pergunakan untuk mesin dengan pengapian busi. Sifat yang di miliki bensin antara lain : (1) Mudah menguap pada temperatur normal, (2) Tidak berwarna, tembus pandang dan berbau, (3) Titik nyala rendah (-10° sampai -15°C), (4) Berat jenis rendah (0,60 s/d 0,78), (5) Dapat melarutkan oli dan karet, (6) Menghasilkan jumlah panas yang besar (9,500 s/d 10,500 kcal/kg), dan (7) Setelah di bakar sedikit meninggalkan karbon.
Adapun syarat–syarat bensin yang baik dan memberikan kerja mesin yang lembut, yaitu : (1) Mudah terbakar, artinya mampu tercipta pembakaran serentak di dalam ruang bakar dengan sedikit knocking atau dentuman, (2) Mudah menguap, artinya bensin harus mampu membentuk uap dengan mudah untuk memberikan campuran udara dengan bahan bakar yang tepat saat menghidupkan mesin yang masih dingin, (3) Tidak beroksidasi dan bersifat pembersih, artinya
sedikit perubahan kualitas dan perubahan bentuk selama di simpan. Selain itu juga bensin harus mencegah pengendapan pada sistem intake, (4) Angka octane, adalah suatu angka untuk mengukur bahan bakar bensin terhadap daya anti knock characteristic. Bensin dengan nilai oktan yang tinggi akan tahan terhadap timbulnya engine knocking.
2. Bahan bakar Diesel
Bahan bakar Diesel biasa juga di sebut debgan light oil atau solar, yaitu
suatu campuran dari hidro karbon yang telah di destilase setelah bensin dan minyak tanah dari minyak mentah pada temperatur 200°C sampai 340°C. Bahan bakar jenis ini atau biasa disebut sebagai bahan bakar solar sebagian besar di gunakan untuk menggerakkan mesin Diesel. Bahan bakar Diesel mempunyai sifat utama sebagai berikut : (1) Tidak berwarna atau sedikit kekuning-kuningan dan berbau, (2) Encer dan tidak menguap di bawah temperatur normal, (3) Titik nyala tinggi (40°C sampai 100°C), (4) Terbakar spontan pada 350°C, sedikit di bawah bensin, (5) Berat jenis 0,82 s/d 0,86, (6) Menimbulkan panas yang besar (10,500 kcal/kg), dan (7) Mempunyai kandungan sulfur yang lebih besar di banding dengan bensin.
Syarat–syarat pengunaan solar sebagai bahan bakar harus memperhatikan kualitas solar, antara lain adalah sebagai berikut: (1) Mudah terbakar, artinya waktu tertundanya pembakaran harus pendek/singkat, sehingga mesin mudah di hidupkan. Solar harus memungkinkan kerja mesin yang lembut dengan sedikit knocking, (2) Tetap encer pada suhu dingin (tidak mudah membeku), menunjukan Solar harus tetap cair pada suhu rendah sehingga mesin akan mudah di hidupkan dan berputar lembut, (3) Daya pelumasan, artinya Solar juga berfungsi sebagai pelumas untuk pompa injeksi dan nossel. Oleh karena itu harus mempunyai sifat dan daya lumas yang baik, (4) Kekentalan, berkait dengan syarat melumas dalam arti Solar harus memiliki kekentalan yang baik sehingga mudah untuk dapat di semprotkan oleh injektor, (5) Kandungan sulfur, karakteristik Sulfuir yang dapat merusak pemakaian komponen mesin sehingga mempersyaratkan kandungan sulfur solar harus sekecil mungkin (< 1 %), dan (6) Angka cetane, Yaitu suatu
cara untuk mengontrol bahan bakar solar dalam kemampuan untuk mencegah terjadinya knocking, tingkat yang lebih besar memiliki kemampuan yang lebih baik.
Ringkasan simpulan.
Berdasar uraian di atas dapat di ambil kesimpulan sebagai berikut: 1. Bahan bakar adalah bahan–bahan yang diperlukan untuk pembakaran
2. Bahan bakar yang di pakai di masyarakat beraneka macam, maka harus pandai memilih bahan bakar yang baik dan tepat untuk proses pembakaran.
3. Bahan bakar yang sering di pakai adalah bensin, solar dan minyak tanah. Untuk mengetahui bensin yang baik dengan melihat angka octan-nya, sedang
BAB II.
HAKEKAT BAHAN BAKAR
Komposisi bahan bakar, hingga saat ini bahan bakar cair merupakan bahan bakar yang banyak digunakan, mengingat segi keuntungan yang ada untuk keperluan-keperluan pada motor bakar pembakaran dalam (Internal Combustion Engine). Komposisi bahan bakar dapat dikenali dengan Nomenklatur Senyawa
Hidrokarbon.
Sifat-sifat bahan bakar, pada setiap bahan bakar mempunyai karateristik dan nilai pembakaran yang berbeda-beda. Bahan bakar minyak mempunyai nilai kalor tinggi, karaterisik ini menentukan sifat-sifat dalam proses pembakaran, dimana sifat yang kurang menguntungkan dapat disempurnakan dengan jalan menambah bahan-bahan kimia kedalam bahan bakar tersebut.
Tara kalor mikanik, tujuan pembakaran bahan bakar untuk memperoleh energi yang disebut energi panas (heat energy), yang dapat diubah menjadi bentuk energy mechanich. Sisa-sisa hasil pembakaran bahan bakar harus diperhatikan,
karena pembakaran yang kurang sempurna mengandung gas-gas beracun dapat berpengaruh negatip terhadap lingkungan.
DESKRIPSI:
Materi dalam bab II. akan dipelajari tentang: (1) Komposisi bahan bakar, (2) Sifat-sifat dan karakteristik bahan bakar, dan (3) Tara kalor mikanik.
TUJUAN INSTRUKSIONAL KHUSUS
Setelah mempelajari materi pada bab 1I. mahasiswa dapat mengetahui: (1) Komposisi struktur bahan bakar, (2) Sifat-sifat bahan bakar yang digunakan dalam kehidupan, dan (3) Kesetaraan energi dalam tara kalor mekanik.
BAB II. HAKEKAT BAHAN BAKAR
Pendahuluan
Bahan bakar adalah bahan-bahan yang digunakan dalam proses pembakaran. Jika ditinjau menurut asalnya, bahan bakar digolongkan menjadi tiga golongan, yaitu bahan bakar nabati, bahan bakar mineral dan bahan bakar fosil. Sedangkan ditinjau menurut bentuknya, maka bahan bakar dapat dibagi menjadi tiga kelompok yaitu bahan bakar berbentuk padat, cair dan gas.
Hingga saat ini bahan bakar cairlah yang merupakan bahan bakar yang banyak dipergunakan diseluruh dunia. Hal ini mengingat banyak segi keuntungan yang ada bahan bakar mineral cair ini sebagian besar dipergunakan untuk keperluan-keperluan pada motor bakar pembakaran dalam (Internal Combustion Engine)
Pada setiap bahan bakar mempunyai karateristik dan nilai pembakaran yang berbeda-beda. Karaterisik inilah yang akan menentukan sifat-sifat dalam proses pembakaran, dimana sifat yang kurang menguntungkan dapat disempurnakan dengan jalan menambah bahan-bahan kimia kedalam bahan bakar tersebut.
Adapun tujuan dari pembakaran bahan bakar adalah untuk memperoleh energi yang disebut energi panas. Sisa-sisa hasil pembakaran bahan bakar didalam motor bakar harus diperhatikan. Oleh karena itu sisa dari pembakaran yang kurang sempurna akan dapat berpengaruh negatip terhadap lingkungannya. Sisa pembakaran yang kurang sempurna akan mengandung gas-gas beracun, yang terutama ditimbulkan oleh pembakaran pada motor bensin.
A. Karakteristik Minyak
Penggunaan minyak sebagai bahan bakar memiliki beberapa keuntungan, baik ditinjau dari segi teknik maupun segi ekonomi. Keuntungan bahan bakar minyak dibanding dengan bahan bakar yang lain terutama disebabkan karena berbagai sifat fisika yang ada pada minyak tersebut. Adapun sifat-sifat minyak yang menguntungkan antara lain :
1. Sifat cair bahan bakar minyak
Sifat ini ditinjau dari segi teknik sangat menguntungkan, yaitu cairan mudah sekali mengalir dan mudah sekali menyesuaikan dengan tempat penampungan. Cairan mudah sekali ditransportasikan dengan memompakannya melalui pipa sehingga mengalir sendiri, mudah disimpan dalam bentuk tangki yang bagaimanapun. Misalnya saja pada pengilangan minyak, transportasi dengan kapal tangker yang relatif lebih praktis dan tidak memakan tempat. Sifat mengalir sendiri tidak memerlukann peralatan pembantu yang rumit dan perawatan yang relatif murah dibanding dengan bahan bakar padat. Jadi dengan sifat cair bahan bakar minyak cenderung lebih praktis dalam pemakaian.
2. Bahan bakar minyak mempunyai nilai kalor tinggi
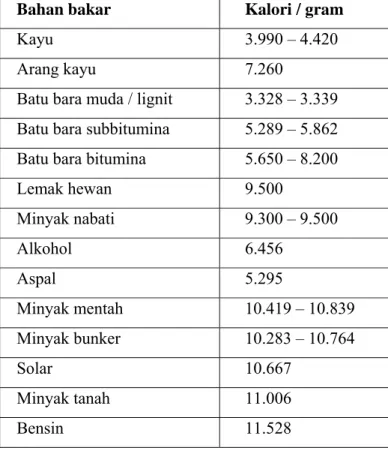
Bahan bakar minyak memiliki kalor yang tinggi dibandingkan bahan bakar yang lain dalam jumlah kg yang sama. Misalnya 1 kg solar akan menghasilkan kalori yang lebih tinggi dari pada 1 kg batu bara atau kayu.
Tabel 1 Nilai kalor macam-macam bahan bakar (RP. Koesoemadinata : 1980) Bahan bakar Kalori / gram
Kayu 3.990 – 4.420
Arang kayu 7.260
Batu bara muda / lignit 3.328 – 3.339 Batu bara subbitumina 5.289 – 5.862 Batu bara bitumina 5.650 – 8.200
Lemak hewan 9.500 Minyak nabati 9.300 – 9.500 Alkohol 6.456 Aspal 5.295 Minyak mentah 10.419 – 10.839 Minyak bunker 10.283 – 10.764 Solar 10.667 Minyak tanah 11.006 Bensin 11.528
Besarnya nilai kalor yang dihasilkan pada bahan bakar dapat dilihat pada tabel berikut di atas tersebut.
3. Minyak menghasilkan beberapa macam bahan bakar
Berdasar minyak mentah hasil pengeboran dapat diperoleh berbagai macam fraksi destilasi yang merupakan bahan bakar untuk keperluan bermacam-macam mesin pula. Hal ini sangat menguntungkan dalam perancangan model mesin termasuk sistem bahan bakarnya, sehingga kebutuhan bahan bakar dapat disesuaikan dengan masing-masing jenis mesin tersebut. Misalnya saja hasil dari penambangan explorasi yang dipisahkan dengan penyulingan diperoleh sejumlah fraksi-fraksi yaitu : fraksi 1 Petroleum eter, fraksi ke 2 Gasoline, fraksi ke 3 Kerosine, fraksi ke 4 Parafine cair, Petroleum dan Parafine padat, dan fraksi terakhir residu.
4. Minyak mineral dapat menghasilkan macam-macam pelumas
Perlu diketahui bahwa hasil dari penambangan minyak mineral dapat juga diperoleh berbagai minyak pelumas, yang memungkinkan pembuatan macam-macam jenis pelumas mesin, misalnya : pelumas motor bensin, pelumas motor diesel, pelumas veresneliing, pelumas gardan, pelumas pesawat dan macam-macam pelumas sebagai pencampur bahan bakar pada motor bakar.
5. Minyak pelumas dapat berfungsi sebagai bahan baku petrochemicals. Minyak dapat pula sebagai bahan petrokimia, yaitu bahan sintetis dalam pembuatan barang seperti bahan plastik, tekstil, dan lainya. Plastik sebagai alat pembungkus telah memegang peranan dalam kehidupan, praktis penggunaannya dan relatif lebih murah. Tekstil seperti nylon dan sebagainya dibuat dari bahan minyak mineral juga. Selain itu juga pipa-pipa dan bejana banyak yang terbuat dari plastik, bukan lagi dari besi.
B. Sifat Fisika Minyak Mineral
Seperti halnya zat cair, kuantitas bahan bakar minyak diukur berdasarkan volumenya. Adapun ukuran yang dipakai di Indonesia adalah M3 atau juga Ton, sedangkan pada perdagangan international digunakan satuan Barrel yang besarnya kira-kira 159 liter.
1. Berat Jenis
Berat jenis merupakan sifat minyak yang penting yang memiliki nilai dalam perdagangan. Berat jenis disebut juga grafitasi jenis atau specific grafity,
adalah suatu perbandingan berat dari bahan bakar minyak dengan berat dari air dalam volume yang sama, dengan suhu yang sama pula (600 F). Bahan bakar minyak pada umumnya mempunyai berat jenis antara 0,82 – 0,96 dengan kata lain minyak lebih ringan dari pada air.
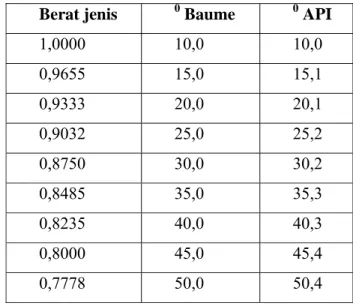
Dalam perdagangan international, berat jenis dinyatakan dalam API Grafity atau derajat API (American Petroleum Institute)
5 , 131 5 , 141 0 60 60 0 = − F beratjenis API
Api menunjukan kualitas dari minyak tersebut, makin kecil berat jenis atau makin tinggi derajat API berarti makin baik pula kualitasnya, karena lebih banyak mengandung bensin. Sebaliknya jika semakin rendah derajat API maka mutu minyak tersebut kurang baik karena banyak mengandung lilin/aspal residu. Selain derajat API dapat juga dipakai derajat Baume.
130 140 0 60 60 0 = − F beratjenis Baume
Tabel 2 Konversi Berat Jenis, 0API dan 0Baume Berat jenis 0 Baume 0 API
1,0000 10,0 10,0 0,9655 15,0 15,1 0,9333 20,0 20,1 0,9032 25,0 25,2 0,8750 30,0 30,2 0,8485 35,0 35,3 0,8235 40,0 40,3 0,8000 45,0 45,4 0,7778 50,0 50,4
Pada tabel berikut di atas dapat dilihat dengan jelas konversi dari berat jenis, 0API dan 0Baume pada suhu 600 F.
2. Viskositas
Viskositas adalah suatu ukuran dari besar perlawanan zat cair untuk mengalir atau ukuran dari besarnya tahanan geser dalam dari suatu bahan cair. Satuan viskositas adalah centi poise. Pada umumnya makin tinggi derajat API,
makin kecil viskositasnya, begitu pula sebaliknya. Cara mengukur viskositas dengan jalan menghitung lama waktu mengalirnya suatu minyak yang banyaknya telah ditentukan melalui lubang viskometer.
Viskositas/kekentalan sangat penting artinya bagi penggunaan bahan bakar minyak untuk motor bakar maupun mesin industri, karena akan berpengaruh terhadap bentuk dan tipe mesin yang menggunakan bahan bakar tersebut.
3. Nilai Kalori
Nilai kalori bahan bakar minyak adalah jumlah panas yang ditimbulkan oleh suatu gram bahan bakar tersebut dengan meningkatkan temperatur 1 gr air dari 3,50 C – 4,50 C, dengan satuan kalori (RP. Koesoemadinata : 1980). Dengan kata lain nilai kalor adalah besarnya panas yang diperoleh dari pembakaran suatu jumlah tertentu bahan bakar di dalam zat asam. Makin tinggi berat jenis minyak bakar, makin rendah nilai kalori yang diperolehnya. Misalnya bahan bakar minyak dengan berat jenis 0,75 atau grafitasi API 70,6 mempunyai nilai kalori 11.700 kal/gr.
4. Titik Tuang
Titik tuang suatu minyak adalah suhu terendah minyak yang keadaanya masih dapat mengalir karena berat sendiri. Titik tuang diperlukan sehubungan dengan kondisi dari pengilangan dan pemakaian dari minyak tersebut, sehingga diharapkan minyak masih dapat dipompakan atau mengalir pada suhu yang berada di bawah titik tuang.
5. Titik Didih
Titik didih minyak berbeda-beda sesuai dengan grafitasinya. Untuk wilayah dengan grafitasi API-nya rendah, maka titik didihnya tinggi karena mempunyai berat jenis yang tinggi. Sedangkan untuk grafitasi API-nya tinggi maka titik didihnya rendah.
6. Titik Nyala
Titik nyala adalah suhu terendah dari bahan bakar minyak yang dapat menimbulkan nyala api dalam sekejap apabila pada permukaan bahan bakar minyak tersebut dipercikan api. Pada bahan bakar minyak dengan grafitasi API tinggi maka titik didihnya rendah, sehingga titik nyalanya juga rendah artinya bahan bakar minyak tersebut akan mudah terbakar, demikian juga sebaliknya.
7. Kadar Abu
Kadar abu adalah sisa-sisa bahan bakar minyak yang ketinggalan setelah semua bagian yang dapat terbakar dalam proses pembakaran minyak terbakar habis. Berdasar kadar abu ini dapat diperkirakan banyaknya logam-logam yang terkandung dalam minyak maupun elemen-elemen yang ada.
8. Air dan Endapan
Air dan endapan yang dipersyaratkan dalam minyak tidak boleh lebih dari 0,5 %. Air yang banyak terkandung pada minyak bakar dapat menyebabkan pembakaran tidak sempurna, sedangkan endapan pada minyak akan dapat memperbanyak jumlah gas sisa pembakaran dan abu.
9. Warna
Warna pada bahan bakar minyak berhubungan dengan berat jenisnya. Untuk berat jenis tinggi, warnanya hijau kehitam-hitaman dan untuk berat jenis rendah warnanya coklat kehitam-hitaman. Warna ini disebabkan adanya berbagai kotoran dan endapan, misalnya senyawa Hidrokarbon yang disertai ikatan berbagai jenis unsur-unsur logam ataupun yang lainnya.
10.Bau
Bahan bakar minyak ada yang berbau sedap dan tidak sedap. Hal ini dipengaruhi oleh molekul aromat. Bahan bakar minyak yang berasal dari Indonesia biasanya berbau tidak sedap karena mengandung senyawa Nitrogen atau Belerang dan juga H2S.
C. Komposisi Bahan Bakar Minyak Mineral
Umumnya bahan bakar minyak atau hampir seluruhnya merupakan ikatan Hidrokarbon, yang terdiri dari unsur Carbon (C), dan Hidrogen(H) yang tergabung sebagai senyawa hidrokarbon. Jadi hal ini C dan H merupakan unsur yang pokok didalam bahan bakar minyak mineral. Di samping unsur C dan H didalamnya terdapat juga unsur-unsur lain seperti Sulfur (S), Nitrogen (N), Oksigen (O) dan logam - logam dalam jumlah kecil. Komposisi dari pada minyak yang telah dihilangkan air dan garamnya adalah terdiri dari unsur mayor Carbon (C) 83–87 % dan impuritis 0-5% Nitrogen (N) 0-1% dan Oksigen (O2) 0-1%.
Adapun senyawa–senyawa Hidrokarbon yang terdapat di dalam minyak dapat berbentuk:
1. Senyawa Hidro karbon parafinik (Cn H2n+2), yang jenis minyak ini Hidro karbon mempunyai rumus gabungan berbentuk lurus dan dapat bercabang. 2. Senyawa Hidrokarbon Naftenik atau Naphta (Cn H2n ) minyak jenis ini disebut
juga siklo parafin, yang ikatan Hidrokarbonya yang mempunyai rumus bangun membentuk suatu rangkaian tertutup atau siklus.
3. Senyawa Hidrokarbon aromatik, jenis ini rumus bangun dari ikatan Hidrokarbonnya merupakan ikatan tertutup dari benzena bersama dengan derivatif-derevatifnya.
Selain ketiga bentuk senyawa hidrokarbon tersebut di dalam produk bahan bakar minyak masih terdapat juga senyawa yang lain yaitu senyawa Hidrokarbon olifin (Cn H2n ) dan juga senyawa hidrokarbon diolifin (Cn H2n-2 ). Ikatan-ikatan ini dikenal dengan ikatan hidrokarbon tidak jenuh, dimana secara alamiah tidak ada pada minyak mentah. Di samping adanya penggolongan jenis bahan bakar minyak, yaitu minyak mineral dan yang lain, masih memiliki sifat-sifat yang
khusus. Sifat-sifat ini bergantung dari lokasi tempat di perolehnya bahan bakar minyak tersebut. Hal inilah yang kadang-kadang menyulitkan dalam menentukan sifat fisika maupun sifat-sifat kimianya.
D. Nomenklatur Senyawa Hidrokarbon.
Nomenklatur senyawa hidrokarbon dimulai dari molekul yang paling sederhana, yaitu senyawa hidrokarbon beratom C (satu) sampai molekul yang beratom C (empat) adalah memiliki nama yang khusus (CnH2n+2):
Untuk n = 1, dinamakan metana dan rumus molekulnya CH4 n = 2, dinamakan etana dan rumus amolekulnya C2H6 n = 3, dinamakan propana dan rumus molekulnya C3H8 n = 4, dinamakan butana dan rumus molekulnya C6H10
Kemudian selanjutnya, mulai senyawa hidrokarbon yang beratom C (lima) yaitu disebut alkana sampai dengan berikutnya penamaan dengan menggunakan bilangan Yunani. Kadang-kadang penamaan untuk hidrokarbon bercabang diberi nama sebagai derivatif dari metana, dimana hidrogen disubstitusi dengan gugusan alkali. Adapun rumus strukturnya adalah sebagai berikut:
Nama pentana, n = 5 untuk atom C
H H H H H ! ! ! ! ! H- C – C – C – C – C - H
! ! ! ! ! H H H H H Isomer dengan pentana
H H H H H ! ! ! ! H C H H- C - C – C – C – H H ! H ! ! ! ! H C – C – C H H HCH H H H ! H H H C H H
Iso pentana 2 metil butana neo pentana 2, 2 dimetil Dimetil etil metana propana tetra metil metana
Apabila diperhatikan dari anggota deret metana, rumus satu dengan lainnya, membentuk suatu deret yang masing-masing berbeda dengan CH2, dari deret tersebut yang masing-masng mempunyai sifat fisika dan kimia sama disebut deret homolok. Di samping itu dikenal pula adanya: (1) atom C primer, yaitu atom carbon tersebut hanya mengikat satu carbon lainnya, (2) atom C sekunder, yaitu atom carbon yang mengikat dua atom carbon lainnya, (3) atom C tertier, yaitu atom carbon yang mengikat tiga atom carbon lainnya, dan (4) atom C kwartener, yaitu atom Carbon yang mengikat empat atom carbon lainnya.
Contoh. C C 1 = atom C primer 4 ! ! 2 = atom C sekunder C -C – C - C – C – C 3 = atom C tertier ! 3 2 1 4 = atom C kwartener C
Apabila suatu hidrocarbon (alkana) kehilangan satu atom hidrogen maka membentuk suatu gugus yang disebut gugus radikal. Gugus radikal yang demikian biasa dinamakan gugus alkil. Gugus radikal yang lazim adalah:
CH3 – disebut gugus metil CH3 – CH2 disebut gugus etil
CH3 – CH2 – CH2 disebut gugus n- propil CH3
CH- CH3
CH3 – CH2 – CH2 - CH2 adalah gugus n – butil CH3 – CH2-CH – CH3 adalah gugus sekunder butil CH3 – CH- CH – adalah gugus isbutil
! CH3
CH3 !
CH3- C - adalah gugus tertier butil !
Penulisan dalam senyawa-senyawa organik gugus alkali tersebut biasanya ditulis dengan lambang huruf R, yang artinya radikal.
E. Tara Kalor Mekanik
Tara kalor mekanik adalah suatu panas sejumlah 1 kilo kalori setara dengan usaha sebesar 427 kgm, artinya untuk mengangkat beban seberat 427 kg dengan jarak lintasan 1 m, atau 1 kg beban sejauh 427 m diperlukan energy sebanyak 1 kilo kalori, dapat dikatakan bahwa 1 kkal sama dengan 427 kgm. Hal ini deapat diketahui bahwa:
Usaha = Gaya x Jarak , dalam hal ini Usaha (Joule), Gaya (Newton atau kgm /s2 ) dan Jarak (meter).
a. Bahan bakar bensin
Bensin merupakan bahan bakar motor, hasil dari pemurnian minyak kasar, bensin mempunyai Bj 0,7 dan nilai pembakarannya=10.000 kkal, artinya bila 1 kg bensin dibakar dengan sempurna menghasilkan kurang lebih 10.000 kilo kalori, jadi (10.000 x 427) kgm = 4.270.000 kgm. Aplikasi, karena bahan bakar ini menyala pada suhu yang rendah maka kompresi yang diijinkan pada motor bensin adalah terbatas yaitu antara (4 -5) atmosfir.
b. Bahan bakar gas
Menurut asalnya bahan bakar gas dapat dibedakan menjadi: (1) Gas dari sumber minyak. Bahan bakar ini sering disebut pula dengan gas bumi dan mempunyai nilai pembakaran 6500 kkal. Bahan bakar ini baik sekali digunakan untuk bahan bakar gas. Maka konversinya (6500 x 427) kgm = 2.775.500 kgm. (2) Gas air, Gas air adalah campuran dari monoksid arang (CO), dioksid arang (CO2) dan zat air (H2) untuk membuat gas air ini digunakan uap air yang dialirkan melalui kokas yang menyala pada suhu 1200o C – 1600o C dan mempunyai nilai pembakaran 2000 - 2200 kkal. Jadi nilai pembakaran gas air tersebut setara dengan (2000 x 427) kgm = 954.000 kgm dan atau sama dengan (2200 x 427) kgm = 939.400 kgm.
c. Gas generator.
Gas ini dapat diperoleh dari pembakaran kokas di dalam dapur generator. Hasil dari gas generator ini adalah sangat panas dan mempunyai nilai pembakaran 700-1000 kkal. Jadi nilai kalori dari pembakarannya, apabila disetarakan menjadi (700 x 427) kgm = 298.900 kgm, dan atau (1000 x 427) kgm = 427.000 kgm. Gas generator kebanyakan dipakai untuk pemggerak turbin gas.
Ringkasan/simpulan
Penggunaan minyak sebagai bahan bakar memiliki beberapa keuntumgan, baik ditinjau dari segi teknik maupun dari segi ekonomi. Setiap bahan bakar mempunyai karakteristik dan nilai pembakaran yang berbeda-beda. Karakteristik tersebut mementukan sifat-sifat dalam proses pembakaran, di mana sifat yang kurang menguntungkan dapat disempurnakan dengan jalan menambahkan bahan kimia ke dalam bahan bakar tersebut.
Adapun sifat-sifat yang menguntungkan antara lain adalah: (1) sifat cair sehingga di dalam pemakaian lebih praktis, (2) mempunyai nilai kalor tinggi dibandingkan dengan bahan bakar yang lain dalam jumlah kilogram yang sama, (3) dapat menghasilkan beberapa macam bahan bakar , dan (4) dapat berfungsi sebagai bahan baku petrochemical.
Sifat-sifat fisika bahan bakar minyak antara lain: (1) Berat jenis, bahan bakar minyak umumnya mempunyai berat jenis antara 0,82 sampai 0,96. Dunia perdagangan terutama yang dikuasai oleh perusahaan Amerika, dinyatakan dalam API (American Petroleum Institute), (2) Viskositas, adalah ukuran dari besar
perlawanan zat cair untuk mengalir, atau ukuran dari besarnya tahanan geser dalam dari suatu bahan cair, (3) Nilai kalori, yang dimaksud dengan niali kalori adalah jumlah panas yang ditimbulkan oleh pembakaran satu gram bahan bakar minyak tersebut untuk meningkatkan temperatur (3,50 s/d 4,50) Celcius pada satu gram air dan satuannya adalah kalori, (4) Titik tuang, titik tuang adalah suhu terendah minyak yang kadarnya masih dapat mengalir karena berat sendiri, (5) Titik didih, minyak dengan gravitas API rendah maka titik didihnya tinggi, sedang untuk gravitas tinggi maka titik didihnya rendah, (6) Titik nyala, flash point adalah suhu terendah dari bahan bakar minyak yang dapat menimbulkan
dipercikan api, (7) Kadar abu, adalah sisa-sisa pembakaran yang ditinggalkan setelah semua bagian yang dapat terbakar dalam minyak terbakar habis, kadar abu tidak boleh lebih (0,05 %) dari beratnya, (8) Air dan endapan yang terdapat dalam bahan bakar minyak adalah sangat sedikit yang dipersyaratkan tidak boleh lebih (0,5 %) dari beratnya, (9) Warna, bahan bakar minyak mempunyai macam-macam warna yaitu hitam dan ada kalanya justru tidak berwarna atau netral, (10) Bau, ada yang berbau sedap dan tak sedap (Indonesia) karena mengandung senyawa nitrogen ataupun belerang (sulphur), dan juga disebabkan adanya H2S.
Pada umumnya bahan bakar minyak merupakan ikatan hidrokarbon yang terdiri dari unsur karbon dan hidrogen. Di samping unsur C dan H juga terdapat unsur–unsur lain seperti sulfur (S), nitrogen (N2), oksigen (O2) dan logam-logam lain dalam jumlah yang kecil. Adapun senyawa-senyawa hidrokarbon dalam minyak dapat berbentuk: (1) senyawa hidrokarbon parafinik (Cn H2n +2 ), (2) senyawa hidrokarbon naftenik atau naphta ( Cn H2n ), (3) senyawa hidrokarbon aromatik. Memiliki tara kalor mekanik, yaitu bahwa dalam 1 kilo kalori mempuyai kesetaraan 427 kgm (bahwa usaha sama dengan gaya kali jarak).
BAB III.
ENERGI DAN PEMBAKARAN
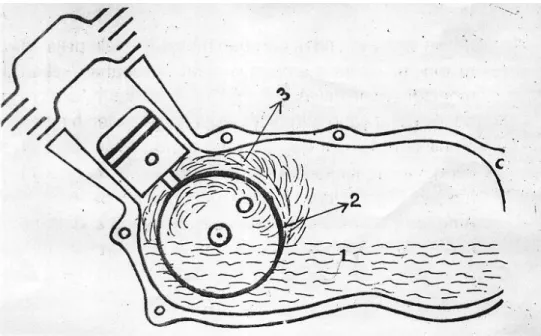
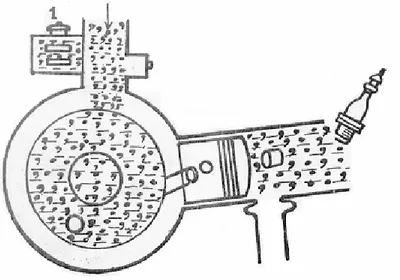
Pembakaran adalah persenyawaan secara kimia dari unsur-unsur bahan bakar dengan zat asam yang kemudian menghasilkan panas (heat energy). Oleh
karena itu pada setiap pembakaran diperlukan bahan bakar, zat asam dan suhu yang cukup tinggi untuk awal mulanya pembakaran. Pembakaran dapat berlangsung secara sempurna namun dapat juga berlangsung secara tidak sempurna. Hal ini tergantung dari unsur-unsur yang terkandung pada bahan bakar tersebut dan proses pembakarannya. Untuk memahami energi dan pembakaran harus diketahui pengertian pembakaran beserta unsur yang terkandung dalam bahan bakar dan kebutuhan udara dalam pembakaran dengan proses pembakaran dengan analisa massa dan analisa volume.
DESKRIPSI:
Materi dalam bab III. akan dipelajari tentang peri hal: (1) Pengertian Pembakaran, (2) Unsur yang terkandung dalam bahan bakar, (3) Udara, (4) Kebutuhan udara dalam pembakaran, dan (5) Proses pembakaran dengan analisa massa dan analisa volume.
TUJUAN INSTRUKSIONAL KHUSUS
Tujuan instruksional khusus, setelah mempelajari materi pada bab 1I. mahasiswa dapat: (1) Menyebutkan dasar pengertian tentang pembakaran, (2) Mengetahui unsur-unsur yang terkandung dalam bahan bakar, (3) Mengetahui tentang Udara pembakar, (4) Menghitung Kebutuhan udara dalam pembakaran, dan (5) Menganalisa proses pembakaran dengan analisa massa dan analisa volume.
BAB III. ENERGI DAN PEMBAKARAN
Pengertian Pembakaran
Pembakaran adalah persenyawaan secara kimia dari unsur-unsur bahan bakar dengan zat asam yang kemudian menghasilkan panas dan disebut heat energy. Oleh karena itu pada setiap pembakaran diperlukan bahan bakar, zat asam
dan suhu yang cukup tinggi untuk awal mulanya pembakaran.
Pembakaran dapat berlangsung secara sempurna namun dapat juga berlangsung secara tidak sempurna. Hal ini tergantung dari unsur-unsur yang terkandung pada bahan bakar tersebut dan proses pembakarannya. Apabila pada bahan bakar tidak mengandung unsur-unsur yang tidak dapat terbakar maka pembakaran akan berlangsung sempurna, sehingga hasil pembakaran berupa gas bekas pembakaran yang tidak berbahaya bagi kehidupan dan lingkungannya. Akan tetapi apabila pada bahan bakar tersebut mengandung unsur-unsur yang tidak terbakar, maka akan tersisa yang berakibat sisa-sisa pembakaran tersebut dapat menimbulkan gas yang berbahaya (beracun) bagi kesehatan dan lingkungan. Untuk mendapatkan pembakaran yang sempurna dilakukan usaha-usaha sebagai berikut: (1) Diusahakan dengan membuat ruang pembakaran sedemikian rupa sehingga tidak terdapat ruangan atau sudut-sudut mati yang disebut ruang rugi, (2) Pemasukan bahan bakar dalam silinder (untuk pembakaran dalam) diusahakan dalam bentuk kabut yang sangat halus sehingga bahan bakar dapat kontak lebih sempurna dengan udara pembakaran, (3) Diusahakan pencampuran yang baik (homogen) antara bahan bakar dengan udara sehingga pembakaran dapat ber-langsung dengan cepat, dan (4) Memberikan jumlah udara lebih dari jumlah kebutuhan minimal sehingga setiap bagian bahan bakar mendapat cukup udara
untuk dapat membakar dalam waktu yang cepat, dan (5) Mempertinggi kecepatan pembakaran yaitu memperpendek waktu pembakaran. Misalnya, untuk motor diesel kurang dari 0,1 detik dan untuk motor bensin kurang dari 0,005detik, dan untuk pembakaran pada ketel uap (external combustion) dengan cara memberikan
hembusan-hembusan udara pembakar melalui pemancar-pemancarnya.
Unsur yang terkandung dalam bahan bakar.
Kebanyakan bahan bakar terdiri atas hidrogen (H2) dan karbon (C) baik bahan bakar tersebut berbentuk padat (misalnya arang, batu bara), cair (misalnya minyak tanah, premium, solar) atau gas (misal gas bumi, bio gas). Bahan bakar berbentuk padat adalah sisa-sisa endapan tanaman dari zaman geologi yang silam. Komponen-komponennya yang dapat terbakar terutama adalah karbon (C), hidrogen (H2) dan sebagian kecil zat belerang (S). Akan tetapi kadang kala terdapat komponen yang tidak dapat terbakar berupa nitrogen (N), air (H2O) dan abu (As).
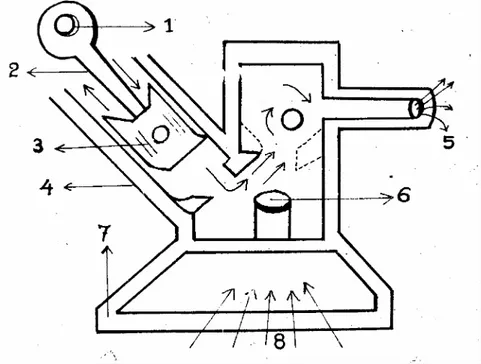
Bahan bakar cair merupakan campuran yang komplit dari sejumlah hidrokarbon, yang terdiri dari unsur karbon (C), dan hidrogen (H2). Kebanyakan bahan bakar cair adalah campuran hidrokarbon yang diperoleh dari minyak mentah melalui proses destilasi (penyulingan), dan pemecahan (cracking). Hasil yang diperoleh dapat berupa bensin, premium, kerosin, solar, minyak diesel, dan bahan bakar lain. Perbedaan antara jenis-jenis bahan bakar ini dapat dilihat dari kurva destikasi. Kurva destilasi diperoleh dengan memanaskan perlahan-lahan sejumlah bahan bakar hingga menguap, kemudian mengembangkannya dan memisahkan uap yang tertinggal. Penyulingan yang dilakukan pada minyak mentah dapat menghasilkan berbagai kualitas minyak terhadap pembakaran maupun energi yang dihasilkan oleh pembakaran minyak tersebut. Hal ini
dilakukan agar dalam pemakaian disesuaikan terhadap karakteristik peralatan yang digunakan dengan kepentingan yang diharapkan.
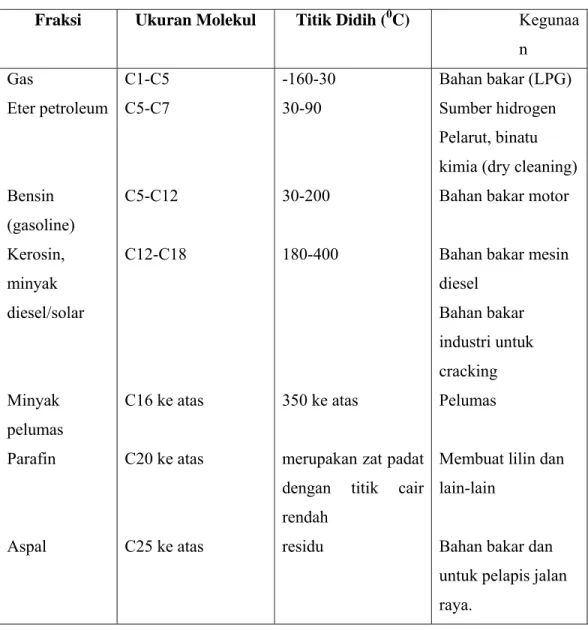
Gambar 2: Skema eksplorasi minyak dan alat penyulingan. Tabel 3. Fraksi hidrokarbon hasil penyulinagn minyak bumi
Fraksi Ukuran Molekul Titik Didih (0C) Kegunaa n Gas Eter petroleum Bensin (gasoline) Kerosin, minyak diesel/solar Minyak pelumas Parafin Aspal C1-C5 C5-C7 C5-C12 C12-C18 C16 ke atas C20 ke atas C25 ke atas -160-30 30-90 30-200 180-400 350 ke atas
merupakan zat padat dengan titik cair rendah
residu
Bahan bakar (LPG) Sumber hidrogen Pelarut, binatu kimia (dry cleaning) Bahan bakar motor
Bahan bakar mesin diesel
Bahan bakar industri untuk cracking Pelumas
Membuat lilin dan lain-lain
Bahan bakar dan untuk pelapis jalan raya.
Bahan bakar yang berbentuk gas, dapat diperoleh dari sumber-sumber gas alam dan proses pengolahan. Beberapa jenis hidrokarbon dalam endapan minyak
tanah terdapat dalam bentuk gas pada tekanan atmosfer. Contoh yang umum dijumpai adalah metana (CH4) yang dikenal sebagai gas rawa. Tetapi bahan bakar gas yang paling banyak digunakan adalah yang diperoleh dari pemanasan batu bara dan proses pembuatan berupa gas bio.
Proses pembakaran bahan bakar selalu menghasilkan heat energi atau
energi panas dan gas bekas yang dalam hal ini merupakan faktor/unsur-unsur tambahan yang ada pada setiap bahan bakar. Adanya unsur yang demikian sangat mempengaruhi panas yang dihasilkan beserta kadar abu sisa pembakaran. Panas tersebut biasa dihitung dalam satuan kalori atau kilo kalori, yang apabila diubah menjadi suatu bentuk usaha disebut tara kalor mekanik. Besaran kesetaraannya adalah bahwa untuk setiap kilo kalori dapat menghasilkan usaha kilogram meter sebesar 427 kgm, disingkat 1kkal = 427 kgm.
Adapun unsur-unsur lain yang terkandung dalam bahan bakar di dapati sangat kecil bila dibandingkan dengan dua unsur di atas. Namun demikian dapat menentukan proses pembakaran yang sedang berlangsung. Hal ini disebabkan unsur-unsur tadi ada yang menguntungkan (memperbesar nilai-nilai pembakaran) dan ada yang tidak menguntungkan (terjadi reduksi panas). Unsur-unsur yang dimaksud adalah: (1) Sulphur (S), (2) Oksigen (O2), (3) Hydrogen (H2), dan (4) Air (H2o). Dengan demikian setiap 1 kg bahan bakar mengandung unsur-unsur Karbon (zat arang), Hydrogen (zat air), Sulphur (belerang), Oksigen (zat asam), Nitrogen (zat lemas) dan air.
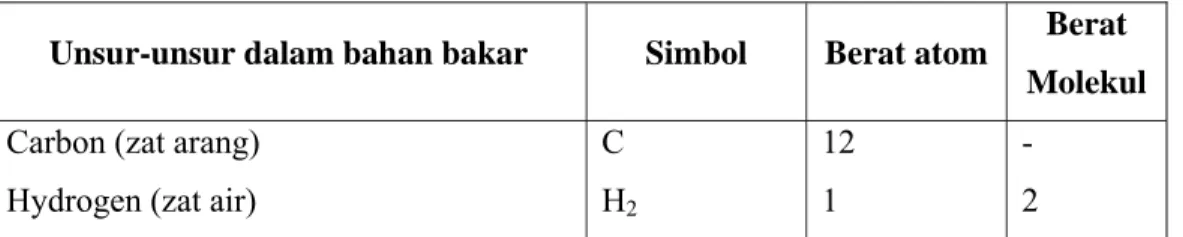
Table 4. Unsur-unsur yang terkandung dalam bahan bakar.
Unsur-unsur dalam bahan bakar Simbol Berat atom Berat Molekul Carbon (zat arang)
Hydrogen (zat air)
C H2 12 1 - 2
Sulphur (belerang) Oksigen (zat asam) Nitrogen (zat lemas) Water (air) Sebab O2 N2 H2O 32 16 14 - - 32 28 18 Udara.
Udara sangat dibutuhkan dalam proses pembakaran karena dalam udara terdapat zat pembakar. Udara tidak hanya terdiri dari zat pembakar (zat asam) saja tetapi juga gas lain. Prosentase menurut volume gas-gas yang terkandung pada udara:
a. zat pembakar (zat asam) ± 21 % b. zat lemas (nitrogen) ± 79 % c. gas + kotoran ± 1 %
Prosentase menurut beratnya gas-gas yang terkandung dalam udara: a. zat pembakar (zat asam) ± 23,2 %
b. zat lemas (nitrogen) ± 76,8 % c. gas lain + kotoran ± 1 %.
Udara yang dimasukkan untuk proses pembakaran harus sesuia dengan kebutuhan agar didapat campuran yang baik antara bahan bakar dan udara. Oleh karena itu mengetahui kebutuhan udara dalam proses pembakaran merupakan hal yang sangat penting.
Kebutuhan Udara dalam Bahan Bakar.
Kebutuhan udara tergantung dari unsur-unsur yang ada dalam bahan bakar. Apabila 1 kg bahan bakar mengandung unsur C %, H %, dan S %, maka:
Untuk pembakaran 1 kg C dibutuhkan 3 2
2 kg O2 atau 11,5 kg udara
Untuk pembakaran 1 kg H dibutuhkan 8 kg O2 atau 34,5 kg udara Reaksi pembakaran : 2H2 (g) + O2 (g) → 2H2O(l)
Untuk pembakaran 1 kg S dibutuhkan 1 kg O2 atau 4,3 kg udara Reaksi Pembakaran : S(s) + O2 (g) → SO2 (g)
Jadi kebutuhan O2 untuk pembakaran bahan bakar yang mengandung C %, H2 %, dan S % adalah = 2 ⅔ C + 8 H2 + S kg, kebutuhan O2 sebenarnya adalah kebutuhan O2 teoritis dikurangi O2 yang terkandung dalam bahan bakar. Kebutuhan O2 sebenarnya untuk setiap kg udara adalah:
25,5 % {(2 ⅔ C + 8 H2 + S)} – O2} kg. Kebutuhan udara untuk pembakaran adalah:
Gu = 233 , 0 1 {(2 ⅔ C + 8 H2 + S)} – O2} kg. Atau Gu = {(11,5 C + 3,4 H2 + 4,3 S)} – 4,3 O2} kg.
Proses Pembakaran dengan Analisa Massa dan Analisa Volume. 1. Pembakaran Hidrogen
Reaksi Pembakaran : 2 H2 (g) + O2 (g) → 2 H2 O Analisa massa:
Berat atom Hidrogen (H) = 1, Massa Hidrogen dalam proses 2 x 2 = 4 Berat atom Oksigen (O) = 16, Massa Oksigen dalam proses 2 x 16 =32 Massa air adalah 2 x (2 + 16) = 36, Dengan demikian dapat ditulis:
4 massa H2 direaksikan dengan 32 massa O2 menghasilkan 36 massa H2O atau 1 massa H2 direaksikan dengan 8 massa O2 menghasilkan 9 massa H2O Untuk perbandingan 1 kg H2 menjadi:
1 kg H2 + 8 kg O2 → 9 kg H2O
Kebutuhan udara untuk pembakaran 1 kg H2 adalah: Oksigen 23,3 % untuk pembakaran 8 kg O2
= 233 , 0 8 = 34,5 kg Udara.
Dari 34,5 kg udara terdapat 8 kg O2 maka besarnya nitrogen adalah = 34,5 kg – 8 = 26,5 kg N2
Dengan demikian untuk pembakaran 1 kg H2 dibutuhkan 34,5 kg udara akan menghasilkan 9 kg H2O dengan 26,5 kg zat lemas (nitrogen)
Analisa volume:
Reaksi pembakaran : 2 H2 + O2 → 2 H2 O
Menurut Avogadro perbandingan besarnya molekul sama dengan perbandingan volume, maka reaksi pembakaran dapat ditulis:
1 m3 H2 + 0,5 m3 O2 → 1 m3 H2 O
Udara terdapat 21 % dari volume maka kebutuhan 0,5 O2 dibutuhkan udara
= 21 , 0 5 , 0 = 2,38 m3
Dengan demikian nitrogen yang dihasilkan = 2,38 m3– 0,5 m3
= 1,88 m3 N2
Untuk pembakaran 1 m3 H2 akan menghasilkan 1 m3 H2 O, dan 1,88 m3 N2 .
2. Pembakaran Carbon Analisa massa :
Reaksi Pembakaran : C + O2 → CO2
Berdasarkan massa: {12} + {(2 x 16)} →{12 + (2 x 16)} Atau 1 + 2 ⅔ kg = 3 ⅔ kg CO2
= 233 . 0 3 2 2 kg = 11,5 kg
Besarnya nitrogen yang dihasilkan = 11,5 – 2 ⅔
= 11,5 – 2,66 = 8,84 kg
Dengan demikian untuk pembakaran 1 kg C dibutuhkan 11,5 kg udara akan menghasilkan 3,66 kg CO2 dengan 8,84 kg zat lemas (nitrogen)
Analisa volume :
Reaksi pembakaran : C + O2 → CO2
Berdasarkan volume 1 m3 C + 1 m3 O2 → 1 m3 CO2 1 m3 O2 dibutuhkan udara sebesar 1 / 0,21 = 4,76 m3 Nitrogen yang dihasilkan → 4,476 – 1 = 3,76 m3
Dengan demikian untuk membakar 1 m3 C dibutuhkan 4,76 m3 udara menghasilkan 1 m3 CO2 dan 3,76 m3 N2
3. Pembakaran Sulphur Analisa massa
Reaksi Pembakaran : S + O2 → SO2
Berdasarkan massa {32} + {2 x 16} → {(32) + (2 x 16)} 32 + 32 → 64
Jadi 1 kg S + 1 kg O2 → 2 kg SO2
Untuk 1 kg O2 dibutuhkan udara sebanyak: 1 / 0,233 = 4,3 kg
Besarnya nitrogen = 4,3 – 1 = 3,3 kg
Dengan demikian 1 kg S + 4,3 kg udara → 2 kg SO2 + 3,3 kg N2
Dengan demikian untuk pembakaran 1 kg S dibutuhkan 4,3 kg udara akan menghasilkan 2 kg SO2 dengan 3,3 kg zat lemas (nitrogen)
Analisa volume
Reaksi pembakaran : S + O2 → SO2
Berdasarkan volume 1 m3 S + 1 m3 O2→ 2 m3 SO2
1 m3 O2 dibutuhkan udara sebesar 1 / 0,21 = 4,76 m3
Jumlah nitrogen yang terdapat dalam udara pembakar : 4,76 – 1 = 3,76 m3 Dengan demikian 4,76 m3 udara untuk membakar 1 m3 sulphur akan menghasilkan 2 m3 SO2 ditambah hasil 3,76 m3 nitrogen (N2)
Ringkasan/simpulan
Pembakaran adalah persenyawaan secara kimia dari unsur-unsur bahan bakar dengan zat asam yang menghasilkan panas dan disebut heat energy. Oleh
karena itu pada setiap pembakaran diperlukan bahan bakar, zat asam dan suhu yang cukup tinggi untuk awal mulanya pembakaran.
Unsur-unsur yang ada dalam bahan bakar adalah: (1) Sulphur (S), (2) Oksigen (O2), (3) Hydrogen (H2), dan (4) Air (H2o). Dengan demikian setiap 1 kg bahan bakar mengandung unsur-unsur Karbon (zat arang), Hydrogen (zat air), Sulphur (belerang), Oksigen (zat asam), Nitrogen (zat lemas) dan air.
Udara sangat dibutuhkan dalam proses pembakaran karena dalam udara terdapat zat pembakar. Udara tidak hanya terdiri dari zat pembakar (zat asam) saja tetapi juga gas lain.