PENGGUNAAN RHIZOBIUM DAN MIKROB PELARUT
FOSFAT (MPF) UNTUK MEMPERBAIKI PERTUMBUHAN
BIBIT AKASIA (Acacia mangium dan Acacia crassicarpa)
Oleh
Risty Heryati Arsyad
A24103014
PROGRAM STUDI ILMU TANAH
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
PENGGUNAAN RHIZOBIUM DAN MIKROB PELARUT
FOSFAT (MPF) UNTUK MEMPERBAIKI PERTUMBUHAN
BIBIT AKASIA (Acacia mangium dan Acacia crassicarpa)
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada Fakultas Pertanian Institut Pertanian Bogor
Oleh
Risty Heryati Arsyad A24103014
PROGRAM STUDI ILMU TANAH
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : PENGGUNAAN RHIZOBIUM DAN MIKROB PELARUT FOSFAT (MPF) UNTUK MEMPERBAIKI PERTUMBUHAN BIBIT AKASIA (Acacia Mangium dan Acacia crassicarpa)
Nama Mahasiswa : Risty Heryati Arsyad Nomor Pokok : A24103014
Menyetujui,
Pembimbing I, Pembimbing II,
Prof. Dr Ir Iswandi Anas, M.Sc Dr Rahayu Widyastuti, M.Sc NIP. 130 607 613 NIP. 131 879 328
Mengetahui, Dekan Fakultas Pertanian
Prof. Dr Ir Didy Sopandie, M.Agr NIP. 131 124 019
RIWAYAT HIDUP
Penulis dilahirkan di Sukabumi pada tanggal 4 Juni 1985, dari pasangan Heri Mochamad Arsyad dan Yeti Slamet Sentosa, sebagai anak kedua dari lima bersaudara : Ricky Haryagraha Arsyad, Rifsy Hernayati Arsyad, Muhammad Yeris Arsyad dan Tsaqila Islami Arsyad.
Riwayat pendidikan penulis dimulai saat masuk TK Aisyiah 2 Sukabumi pada tahun 1990. Pada tahun 1997, penulis menyelesaikan pendidikan di SDN Ir. H. Juanda Sukabumi. Setelah itu menyelesaikan pendidikan SLTPN 2 Sukabumi pada tahun 2000. Pada tahun 2003, penulis menyelesaikan pendidikan di SMUN 3 Sukabumi. Penulis diterima di Institut Pertanian Bogor pada tahun 2003 di Departemen Ilmu Tanah dan Sumberdaya Lahan, Fakultas Pertanian melalui jalur USMI.
Selama mengikuti kuliah, penulis aktif di berbagai lembaga kemahasiswaan, seperti Bahan Eksekutif Mahasiswa (BEM) Fakultas Pertanian (periode 2004-2005) sebagai staf Departemen Advokasi dan Kesejahteraan Mahasiswa, Himpunan Mahasiswa Ilmu Tanah (HMIT) sebagai Ketua Biro Kemahasiswaan Departemen Pengembangan Sumberdaya Mahasiswa (periode 2005-2006). Penulis juga mendapat kesempatan menjadi asisten Geomorfologi dan Analisis Lansekap (periode 2005-2006 dan 2006-2007), Biologi Tanah (periode 2005-2006) dan Bioteknologi Tanah (periode 2005-2006).
SUMMARY
RISTY HERYATI ARSYAD. Improving Acacia seedling (Acacia mangium and
Acacia crassicarpa) Quality Through Inoculation with Local Rhizobium and
Phosphate Solubilizing Microbe (PSM) Under supervision of ISWANDI ANAS and RAHAYU WIDYASTUTI
The increasing of paper raw material requirement is caused by the development of raw material. Therefore, it is needed a method to produce a high quality and quantity of paper. Acacia is one of paper raw material. To increase the growth of acacia seed, an effective usage of Rhizobium and Phosphate Solubilizing Microbe (PSM) seedling inoculant is one of strategies to produce good acacia seeds. The Rhizobium and Phosphate Solubilizing Microbe seedling inoculant can reduce anorganic fertilizer usage and increase the growth of acacia seed.
The aims of this research were to select Rhizobium which has an ability to fix atmosphere N2 air and local Phosphate Solubilizing Microbe in dissolving
phosphate, also to test the ability of those isolates in increasing the growth of acacia seedling.
This research was conducted in the Soil Biotechnology Laboratory, Department of Soil and Land Resource Science, Faculty of Agriculture, Bogor Agricultural University and RAPP greenhouse (Pelalawan and Pangkalan Kerinci R&D Nursary) in Riau. Plant media is cocopit. The experiment consisted of 15
Rhizobium treatments isolated from peat soil, which was planted with A. crassicarpa, and mineral soil, which was planted with A. mangium; 16 Phosphate
Solubilizing Microbe treatments taken from peat and mineral soil with 5 replications.
The research resulted 2 Rhizobium isolates from 15 tested isolates, which could increase the growth of A. crassicarpa effectively, those were Rh Ac 5 and P05-R1S, and 2 Phosphate Solubilizing Microbe from 16 tested isolates, those were BPF 4 and FPF 5. While on A. mangium, there were 2 isolated out of 15
Rhizobium isolates which could increase the A. mangium growth effectively, those
were M32-M33-R2N and M45-R2N; also 3 isolates out of 16 Phosphate Solubilizing Microbe, those were M32-BP3, FRK2, and M33-FP2. The characteristic of effectiveness could be seen from the plant height, the amount of leaves, the dry root wight, the dry plant weight, the diameter of bar and the root compactness; so that the usage of Rhizobium inokulan, Rh Ac 5 and P05-R1S equal to the usage of 0.1 kg/l Monopotassiumphosphate fertilizer and better than control. Meanwhile the usage of MPF, BPF 4 and FPF5 equal to the usage of 0.5/l kg of Osmocote fertilizer and better than control.
RINGKASAN
RISTY HERYATI ARSYAD. Penggunaan Rhizobium dan Mikrob Pelarut Fosfat
(MPF) Untuk Memperbaiki Pertumbuhan Bibit Akasia (Acacia mangium dan
Acacia crassicarpa) Dibawah Bimbingan ISWANDI ANAS dan RAHAYU
WIDYASTUTI
Meningkatnya kebutuhan bahan baku kertas akibat perkembangan industri kertas yang berkembang pesat menyebabkan perlu adanya suatu cara untuk menghasilkan bahan baku kertas yang baik secara kualitas maupun kuantitas. Akasia merupakan salah satu bahan baku pembuatan kertas. Untuk meningkatkan pertumbuhan bibit akasia, maka penggunaan inokulan Rhizobium dan Mikrob Pelarut Fosfat (MPF) yang efektif merupakan salah satu strategi untuk menghasilkan bibit akasia yang baik. Penggunaan inokulan Rhizobium dan MPF tersebut dapat mengurangi penggunaan pupuk anorganik dan meningkatkan pertumbuhan bibit akasia.
Penelitian ini bertujuan untuk menyeleksi Rhizobium yang memiliki kemampuan menambat N2 udara dan Mikrob Pelarut Fosfat lokal dalam
melarutkan fosfat, serta menguji kemampuan isolat tersebut dalam meningkatkan pertumbuhan semai akasia.
Penelitian ini dilaksanakan di Laboratorium Bioteknologi Tanah, Departemen Ilmu Tanah dan Sumberdaya Lahan, Fakultas Pertanian, Institut Pertanian Bogor dan rumah kaca RAPP (Pelalawan dan Pangkalan Kerinci R&D Nursary), Riau. Media tanam yang digunakan adalah cocopit. Perlakuan percobaan terdiri dari 15 perlakuan Rhizobium dari tanah gambut dengan A.
crassicarpa dan tanah mineral dengan A. mangium dan 16 perlakuan mikrob
pelarut fosfat dari tanah gambut dan tanah mineral dengan 5 ulangan
Dari hasil penelitian diperoleh 2 isolat Rhizobium dari 15 isolat yang diuji, yang efektif meningkatkan pertumbuhan A. crassicarpa yaitu Rh Ac 5 dan P05-R1S serta 2 isolat Mikrob Pelarut Fosfat (MPF) dari 16 isolat yang diuji yaitu BPF 4 dan FPF 5. Sedangkan pada A. mangium, dari 15 isolat Rhizobium yang diuji diperoleh 2 isolat yang efektif meningkatkan pertumbuhan A. mangium yaitu M33-R2N dan M45-R2N serta 3 isolat MPF dari 16 isolat yang diuji yaitu M32-BP3, FRK2 dan M33-FP2. Sifat keefektifannya tersebut dapat dilihat dari tinggi tanaman, jumlah daun, bobot kering akar, bobot kering tanaman, diameter batang dan kekompakan akar, sehingga penggunaan inokulan Rhizobium yaitu Rh Ac 5 dan P05-R1S setara dengan penggunaan pupuk Monopotassiumphosphate 0.1 kg/l dan lebih baik dibanding kontrol. Sedangkan penggunaan MPF yaitu BPF 4 dan FPF 5 setara dengan penggunaan pupuk Osmocote 0.5 kg/l dan lebih baik dibanding kontrol.
I. PENDAHULUAN
1.1 Latar Belakang
Perkembangan industri kertas yang pesat menyebabkan kebutuhan bahan baku pembuatan kertas meningkat. Tetapi peningkatan kebutuhan bahan baku ini tidak diimbangi dengan peningkatan produktivitas tanaman hutan sebagai bahan utamanya. Dengan adanya penebangan hutan besar-besaran, pembakaran hutan dan konversi kawasan hutan menjadi lahan pertanian dan pemukiman mengakibatkan bahan baku pembuatan kertas semakin menipis. Oleh karena itu, perlu adanya suatu strategi untuk meningkatkan ketersediaan bahan baku tersebut baik secara kualitas maupun kuantitas.
Akasia merupakan salah satu tanaman yang dapat dijadikan sebagai bahan utama pembuatan kertas. Jumlah akasia yang terbatas di alam membuat industri kertas harus berupaya agar akasia tetap tersedia saat akan digunakan dengan cara dibudidayakan. Akasia memiliki keuntungan sebagai tanaman yang dibudidayakan sebagai bahan baku pembuatan kertas karena memiliki daya adaptasi yang luas dan toleransi yang tinggi terhadap kondisi lingkungan yang kurang menguntungkan. Akasia merupakan leguminosa yang tumbuh cepat (fast
growing species), dan dapat bersimbiosis dengan Rhizobium dalam menambat N2
udara.
Rhizobium merupakan mikrob penambat N2 yang hidup bersimbiosis pada
tanaman inang dari famili Leguminoceae dengan membentuk bintil pada akarnya. Bintil akar ini merupakan organ simbiosis yang aktif dalam melakukan fiksasi N2
dari udara. Untuk menunjang simbiosis yang efektif antara Rhizobium dan tanaman akasia, maka dapat dilakukan dengan menginokulasikan Rhizobium pada pembibitan akasia.
Penggunaan Rhizobium pada saat ini dalam pembibitan akasia belum dilakukan secara efektif karena masih memakai cara konvensional yaitu bintil akar yang mengandung mikrob penambat N dikumpulkan dari akar tanaman lalu disuspensikan dan disebarkan ke tanaman. Kelemahannya kualitas bintil akar tidak terjamin, sulit memperoleh jumlah inokulan yang diinginkan, tidak semua bintil adalah Rhizobium. Dengan demikian perlu adanya suatu upaya untuk
mendapatkan isolat Rhizobia yang efektif dalam menambat N sehingga dapat diaplikasikan di lapangan dalam pembibitan akasia. Hal ini diharapkan dapat meningkatkan pertumbuhan tanaman akasia dan mengurangi penggunaan pupuk anorganik.
Pembentukan bintil akar dalam pertumbuhan bibit akasia yang baik juga memerlukan fosfor. Pada tanaman legum, unsur P diperlukan untuk merangsang penambatan N2 melalui peningkatan jumlah bintil pada perakaran sehingga dapat
meningkatkan pertumbuhan tanaman. Ketersediaan fosfor dalam tanah gambut dan tanah mineral masam masih rendah. Hal ini disebabkan pH tanah rendah dan ketersediaan Al dan Fe dalam tanah tinggi sehingga mengikat P. Kekahatan fosfor merupakan salah satu kendala utama dalam peningkatan produksi pertanian. Masalah penting dari pupuk P adalah efisiensinya yang rendah karena fiksasi P yang cukup tinggi oleh tanah. Pemberian pupuk fosfat dalam jumlah besar oleh pengaruh waktu dapat berubah menjadi fraksi yang sukar larut. Fosfat dalam tanah sukar larut, sehingga sebagian besar tidak tersedia bagi tanaman. Usaha meningkatkan efisiensi pemupukan P antara lain dilakukan melalui berbagai cara. Salah satu diantaranya dengan memanfaatkan Mikrob pelarut fosfat. (Subba Rao, 1994).
Mikrob pelarut fosfat memiliki peranan penting dalam meningkatkan ketersediaan P di dalam tanah bagi tanaman. Dari beberapa hasil penelitian menunjukkan bahwa mikrob pelarut fosfat mampu meningkatkan ketersediaan P dalam tanah. Hal ini disebabkan mikrob pelarut fosfat dapat menghasilkan asam-asam organik yang selanjutnya akan bereaksi dengan alumunium fosfat, besi fosfat dan kalsium fosfat, sehingga fosfat yang tadinya sukar larut menjadi mudah larut dan tersedia bagi tanaman (Walker, 1975). Berdasarkan hasil penelitian Laboratorium Bioteknologi Tanah, Institut Pertanian Bogor diperoleh inokulan mikrob pelarut fosfat yang mampu meningkatkan ketersediaan P bagi tanaman diantaranya BBP-1, CKP2-3, CKP3-3 dan GP3-2 mampu meningkatkan ketersediaan P bagi tanaman tetapi belum mampu meningkatkan bobot kering tanaman (Elfiati, 2004).
Kendala pemupukan P yang kurang efektif dan penggunaan Rhizobium yang masih menggunakan cara konvensional mengakibatkan perlunya suatu upaya
untuk memperbaiki kondisi seperti itu. Hal itu dapat dilakukan dengan menginokulasikan Rhizobium yang mampu menambat N2 udara dan Mikrob
Pelarut Fosfat yang memiliki kemampuan melarutkan P sukar larut pada pembibitan akasia dengan tujuan mendapatkan bibit akasia yang berkualitas sehingga dapat mengurangi pupuk anorganik
1.2 Tujuan
1. Mengisolasi Rhizobium dari tanah gambut dan tanah mineral serta bintil akar tanaman A. mangium dan A. crassicarpa.
2. Mengisolasi Mikrob Pelarut Fosfat dari tanah gambut dan tanah mineral. 3. Menyeleksi Rhizobium lokal yang memiliki kemampuan dalam menambat
N2 udara dan Mikrob Pelarut Fosfat yang memiliki kemampuan
melarutkan P-sukar larut.
4. Menguji kemampuan isolat Rhizobium dan Mikrob Pelarut Fosfat dalam memperbaiki pertumbuhan bibit akasia (A. mangium dan A. crassicarpa).
1.3 Hipotesis
1. Rhizobium yang mempunyai kemampuan menambat N2 udara yang tinggi
dapat diisolasi dari tanah dan bintil akar tanaman akasia.
2. Mikrob Pelarut Fosfat yang mempunyai kemampuan dalam melarutkan P sukar larut dapat diisolasi dari tanah mineral masam dan tanah gambut. 3. Pertumbuhan akasia yang diberi inokulan memberikan respon yang positif
dibanding tanpa inokulan.
4. Kebutuhan pupuk anorganik dapat ditekan dengan penggunaan Rhizobium dan Mikrob Pelarut Fosfat.
II. TINJAUAN PUSTAKA
2.1 Acacia sp. 2.1.1 Acacia mangium Willd
Acacia mangium Willd termasuk ke dalam famili Leguminoceae,
sub-famili Mimosoidae, mulai dikenal secara luas di Indonesia setelah jenis ini banyak digunakan dalam kegiatan reboisasi dan rehabilitasi lahan. Akasia digolongkan ke dalam pohon leguminosa yang cepat tumbuh (fast growing species). Acacia
mangium Willd merupakan jenis leguminosa yang berdaur relatif pendek yaitu
sekitar 8-10 tahun dengan riap 25 m3/ha/thn, sedangkan tinggi pohon sekitar 15-30 m dengan dengan diameter lebih dari 20 cm pada umur 9 tahun (Retnowati, 1988).
Acacia mangium adalah jenis asli Indonesia Bagian Timur, Papua New
Guinea dan Australia (Negara Bagian Queesland). Penyebaran akasia dari papua pada 0050’LS sampai dengan Australia (Queesland) pada 19000’LS. Kondisi tegalan yang paling baik tumbuh di Australia pada elevasi <100 m dpl. (Nation Academy Science, 1983).
Persyaratan tumbuh Acacia mangium relatif lebih mudah. Akasia mampu
tumbuh pada lahan bekas tebangan, bekas perladangan liar, tanah yang jelek dan lahan yang ditumbuhi alang-alang. Akasia memiliki kemampuan adaptasi yang cukup tinggi dan mampu tumbuh pada tanah dengan pH 4.2 (tanah masam). Akasia akan tumbuh dengan sangat baik pada daerah dengan curah hujan yang tinggi yaitu 1500-4000 mm/thn dengan temperatur antara 13-340C (Retnowati, 1988).
Keistimewaan lain A. mangium yaitu mudah beradaptasi dengan struktur tanah mana pun, bahkan jenis pohon ini bisa menyuburkan tanah. Akasia ini memiliki resistensi tinggi terhadap hama dan penyakit serta tingkat pertumbuhan tinggi. Dalam industri kertas, akasia ini memiliki serat lebih baik dibanding pohon tropis lainnya (Suita et al., 2002).
Tetapi akasia memiliki masalah dalam pengembangannya yaitu, 1) Benih akasia rentan terhadap hama dan penyakit sehingga diharapkan tidak terjadi kawin kerabat karena akan menurunkan vigor dan pertumbuhan maka diperlukan tingkat
basis genetik yang luas. 2) Tegakan tanaman semacam A. mangium yang umumnya diusahakan secara monokultur menyimpan potensi adanya serangan hama penyakit sewaktu-waktu. Beberapa jenis hama dan penyakit ditemukan menyerang A. mangium baik dengan pola serangan yang terjadinya secara musiman (seperti Xyleborus sp.) maupun terus-menerus (ulat kantung). Penanggulangan jangka pendek menggunakan pestisida (jangka panjang beresiko) juga berpotensi menyebabkan resistensi hama dan penyakit. Selain pestisida, pengendalian secara mekanis (perangkap hama, pembersihan sarang), biologis (penggunaan patogen, parasit dan predator). Pengendalian yang paling efektif adalah perlakuan silvikultur intensif, mulai dari penggunaan klon unggul, penyiangan secara teratur, pengaturan jarak tanam yang tepat dan lain-lain (Suita
et al., 2002).
Akasia dapat digunakan sebagai kayu gergajian, mebel, arang, kayu bakar, papan partikel dan bubur kertas. Pemungutan hasil dilakukan pada umur tertentu sesuai dengan tujuan pengusahaan, misalnya tanaman umur 7 tahun dapat diambil untuk kebutuhan industri bubur kertas, sedangkan kebutuhan industri kayu pertukangan dapat diambil pada umur tanaman 15 tahun (Hardiyanto, 1989).
2.1.2 Acacia crassicarpa
A. crassicarpa A. Cun. ex Benth pertama kali dipublikasikan pada London
Journ, Bot 1: 379 pada tahun 1842. Acacia crassicarpa berarti tebal dan carpus yaitu buah. Jenis tanaman ini dikenal dengan nama Notrhern Wettle (Australia) &
Red Wattle (Papua New Guinea). Pohon ini termasuk famili leguminosa dengan
subfamili Mimosoidae (Doral dan Turnbull, 1997).
A. crassicarpa tumbuh pada ketinggian 5-200 m dpl. Menurut letak
astronomisnya A. crassicarpa banyak terdapat pada 8-120 LS dan secara alami terdapat di bagian timur Quessland, barat daya Papua New Guinea dan bagian tenggara Papua. Secara klimatologi, A. crassicarpa banyak dijumpai di daerah beriklim humid dan subhumid yang mempunyai suhu maksimum rata-rata musim panas sebesar 32-340C. Suhu minimum rata-rata pada musin dingin sebesar 12-210C dan suhu harian mencapai 320C. Kebanyakan daerah sebaran adalah bebas es yang mempunyai selang rata-rata curah hujan tahunan sebesar 1000-3000 mm. Jenis akasia ini juga dapat tumbuh dengan baik pada tanah masam (Podsolik
Merah Kuning), tanah-tanah kuning dan merah dengan bahan induk granit dan volkan dengan drainase baik maupun kurang baik seperti daerah rawa.
Menurut Doral dan Turnbull (1997) A. crassicarpa dapat digunakan sebagai pelindung dan naungan, fiksasi nitrogen udara dan perlindungan tanah dalam mencegah erosi. Kayunya dapat digunakan untuk bubur kertas, konstruksi bangunan, mebel, dan bahan baku pembuatan kapal.
2.2 Rhizobium 2.2.1 Karakteristik Rhizobium
Rhizobium merupakan jenis mikrob penambat N yang mampu
bersimbiosis dengan tanaman legum. Berdasarkan taksonominya, Rhizobium masuk ke dalam divisi Protophyta, kelas Schizomycetes, ordo Eubacteriales, famili Rhizobiceae dan genus Rhizobium. Klasifikasi Rhizobium berdasarkan pengelompokkan inokulasi silang. Prinsip pengelompokkan inokulasi silang didasarkan pada kemampuan suatu isolat Rhizobium untuk membentuk bintil pada genus-genus yang terbatas dari spesies legum yang satu sama lain berkerabat dekat. Rhizobium hidup bebas dalam tanah dan dalam daerah perakaran tumbuh-tumbuhan legum maupun bukan legum. Walaupun demikian, bakteri Rhizobium dapat bersimbiosis hanya dengan tumbuh-tumbuhan legum, hanya dengan menginfeksi akarnya dan membentuk bintil akar di dalamnya (Subba Rao, 1994).
Kelompok Rhizobia yang memiliki ciri menghasilkan asam, waktu tumbuh 2-3 hari, bentuk seperti tongkat dan tumbuh baik pada glukosa, manitol, dan sukrosa disebut Rhizobium seperti R. leguminosorum, R. phaseoli, R. trifolli, dan
R. Meliloti. Sedangkan Bradyrhizobium memiliki ciri menghasilkan basa, tumbuh
lambat, dan tumbuh baik pada medium yang mengandung pentosa seperti R.
lupini, R. japonicum, dan Rhizobium spp. (Somasegaran & Hoben,1985). Dalam
klasifikasi baru dikenal 3 genus Rhizobium yaitu genus I (Rhizobium) & genus II (Bradyrhizobium) termasuk Rhizobia sedangkan genus III termasuk agrobakteri (Somasegaran & Hoben, 1985).
2.2.2 Pembentukan Bintil Akar
Tanaman inang yang berperan sebagai makrosimbion dalam proses fiksasi sebagian besar adalah legum. Legum merupakan tanaman dikotil yang berasal dari
famili leguminoceae. Jumlah spesies legum yang tersebar di seluruh dunia mencapai 13.000 jenis. Legum dibagi menjadi 3 subfamili yaitu Papilionideae,
Caesalpinoideae, dan Mimosoideae (Alexander,1977).
Bintil akar tanaman legum memiliki bentuk dan ukuran yang berbeda-beda. Bintil dapat berbentuk bola, silindris, datar dan sering bundar atau dengan cabang seperti karang atau dapat juga memiliki bentuk tidak beraturan. Sebagian lagi disebabkan karakteristik dari interaksi antara strain bakteri terutama dengan varietas tanaman. Tidak semua legum dapat membentuk bintil pada akarnya. 10-12% tanaman legum telah diuji berkaitan pada pembentukan bintil (nodulasi), diketahui bahwa 10% Mimosoideae, 65% Caesalpinoideae & 6% Papilionoideae tidak memiliki bintil pada akarnya (Subba Rao, 1982).
Penelitian Elfiati (2004) pada tanaman sengon dengan menginokulasikan
Rhizobium dapat meningkatkan serapan N2 dan bobot kering tanaman. Hal ini
dapat dilihat pada isolat GR2-7, GR3-4 yang diinokulasikan cukup efektif pada Ultisol. Tanaman yang diinokulasi dengan Rhizobium terbukti bobot kering tanaman yang dihasilkan lebih tinggi dibanding tanaman yang diberi pupuk nitrogen. Hal ini sejalan dengan penelitian Wasis (1996) bahwa inokulasi dengan
Rhizobium dapat meningkatkan bobot kering tanaman sengon di persemaian,
meskipun setiap isolat memiliki efektivitas yang berbeda-beda.
Menurut Madigan et al., (2000) gen yang berperan dalam pembentukan
bintil akar oleh Rhizobium disebut dengan gen nod. Gen nod yang berperan dalam menginduksi terjadinya pembengkokan akar rambut dan pembelahan sel tanaman adalah gen nod ABC yang disebut sebagai faktor Nods.
Pembentukan bintil diawali oleh akar yang mengeluarkan triptofan dan senyawa lain yang menyebabkan peningkatan jumlah Rhizobium di sekitar akar. Triptofan digunakan oleh bakteri dan diubah menjadi asam indolasetat (IAA) dan dipengaruhi oleh asam-2-ketoglutarat & asam glutamat yang bertindak sebagai substrat. Subba Rao (1977) menyatakan bahwa IAA inilah yang menyebabkan bulu-bulu akar membengkok sebelum bakteri masuk kedalamnya.
Di dalam bintil akar, bakteri akan membentuk struktur yang menggembung serta dapat mengikat nitrogen dari udara yang dikenal dengan nama bakteroid. Bintil akar yang aktif menambat nitrogen umumnya besar dan
berwarna merah muda (karena leghemoglobin) dengan jaringan bakteroid yang berkembang dan terorganisasi dengan baik (Alexander,1978; Subba Rao, 1994; Graham, 1998).
Proses pembentukan bintil akar menurut Subba Rao (1977) secara ringkas yaitu rambut akar normal kemudian terjadi pengeluaran zat organik (eksudasi bahan-bahan organik/triptofan) oleh akar. Setelah itu terjadi akumulasi Rhizobia dalam rizosphere. Triptofan diubah menjadi asam indolasetat oleh bakteri dan terjadi penggulungan dan deformasi rambut akar. Kemudian masuknya
polysacharida dari Rhizobium ke dalam bulu-bulu akar, polysacharida bereaksi
dengan komponen sel-sel bulu akar membentuk suatu organiser. Organiser menyebabkan terbentuknya polygalacturonase diikuti oleh depolimerisasi pectin dinding sel. Kemudian Rhizobium masuk ke dalam dinding sel (invaginasi) membentuk suatu struktur benang infeksi. Benang-benang infeksi yang mengandung bakteri berbentuk tongkat diperluas masuk ke dalam sel bulu akar dipandu oleh nukleus sel bulu akar. Masuknya benang infeksi ke dalam akar dan bercabang dan membentuk nodul.
2.2.3 Faktor-faktor yang mempengaruhi nodulasi Temperatur dan cahaya
Temperatur dan cahaya dapat mempengaruhi pertumbuhan tanaman, bintil akar dan penambatan N. Pengaruh suhu terhadap tanaman legum bervariasi tergantung kepada jenis legumnya. Sistem simbiotik lebih sensitif terhadap suhu dibandingkan dengan pertumbuhan tanaman. Pada suhu yang rendah (<100C) proses pembelahan sel dari bakteri pada rizosfer akan terhambat sehingga menyebabkan terhambatnya proses infeksi dan menurunnya berat bintil, sedangkan pada suhu >240C merangsang infeksi rambut akar oleh Rhizobium. Rentang temperatur yang paling menguntungkan untuk pembentukan jaringan bakteroid di dalam bintil adalah 20-300C (Subba Rao, 1994).
Zat pengatur tumbuh
Zat pengatur tumbuh berupa asam indol asetat (IAA) dan giberelin telah dapat dideteksi dalam bintil akar. Bintil akar mengandung lebih banyak IAA daripada perakaran yang bersebelahan dengannya. Beberapa zat tumbuh
merangsang pembentukan bintil sedangkan yang lainnya menghambat, tergantung pada konsentrasi zat kimia yang digunakan. Timotiwu (1992) melaporkan bahwa pemberian N menyebabkan berkurangnya penetrasi Rhizobium membentuk bintil akar karena teracuninya R. japonicum dan terjadi kegagalan dalam pembentukan IAA sehingga aktivitas nitrogenase terhambat.
Kemasaman tanah
Kemasaman tanah berpengaruh terhadap perkembangan akar tanaman dan ketersediaan hara tanah. Pada pH yang rendah, beberapa jenis kacang-kacangan tidak dapat berkembang walaupun Rhizobium cukup toleran, sehingga proses pembentukan bintil terhambat. Jumlah dan ukuran bintil mungkin dipengaruhi oleh reaksi substrat tempat tumbuh legum. Kondisi masam di dalam tanah berakibat defisiensi kalsium, magnesium dan kalium. Seringkali kemasaman tanah berakibat berkurangnya pengambilan Mo yang dapat diperbaiki dengan pemberian kapur. Penambahan amonium nitrat atau kalsium karbonat ke dalam tanah dapat menetralkan pengaruh pH rendah dan dapat meningkatkan panen legum.
Faktor biologi
Faktor biologi dapat menjadi faktor pembatas seperti persaingan antara bakteri pengikat N, serangan nematoda maupun bakteri parasit lainnya.
Rhizobium juga memiliki musuh alami tertentu dalam tanah misalnya
streptomyces. Adanya musuh alami dapat menurunkan populasi Rhizobium dalam tanah.
Biasanya legum sangat hemat dalam penggunaan nitrogen tanah sehingga suatu tanaman berkadar protein tinggi dapat diperoleh atau dipanen tanpa terlalu banyak menguras N dari tanah. Sehingga legum dapat dikatakan sebagai penabung N, dan ini merupakan aksioma kesuburan tanah yang penting (Soepardi, 1983).
Faktor ekologis
Penggunaan pestisida merupakan usaha yang dilakukan untuk mengendalikan hama dan penyakit tanaman dan beberapa senyawa kimia ini mungkin mempengaruhi proses mikrobiologis dalam tanah. Tetapi dengan dosis yang direkomendasikan pestisida tidak mempengaruhi nodulasi. Sebaliknya,
herbisida mempengaruhi perbintilan fiksasi nitrogen pada legum. Pada percobaan menunjukkan bahwa penggunaan dalapon dapat mengurangi pembentukan bintil dan cenderung mengurangi efesiensi fiksasi nitrogen. Hal ini terlihat dari autoradiograf herbisida ditranslokasikan dengan cepat dan dapat dideteksi dalan daun dan bintil (Subba Rao, 1994).
2.3 Mikrob Pelarut Fosfat 2.3.1 Peranan Mikrob Pelarut Fosfat
Kadar P total dalam tanah umumnya rendah dan berbeda menurut jenis tanah. Jumlah fosfat yang tersedia di tanah-tanah pertanian biasanya lebih tinggi dibandingkan dengan kadarnya pada tanah-tanah yang tidak diusahakan. Hal ini diduga karena unsur ini bersifat immobil sehingga tidak mudah tercuci (residunya tinggi).
Mikrob Pelarut Fosfat mempunyai peranan sangat besar dalam membantu penyediaan unsur hara bagi tanaman karena mampu mengubah bentuk-bentuk fosfat yang tidak tersedia bagi tanaman menjadi bentuk yang tersedia. Fosfat tanah baru dapat dijadikan tersedia oleh mikrob tanah melalui sekresi asam organik. Pelarutan fosfat oleh mikrob tergantung pH tanah. Pada tanah netral atau basa yang memiliki kandungan kalsium yang tinggi, terjadi pengendapan kalsium fosfat. Mikrob dan perakaran tanaman mampu melarutkan fosfat seperti itu dan mengubahnya sehingga dengan mudah menjadi tersedia bagi tanaman. Sebaliknya, tanah yang masam umumnya miskin akan ion kalsium, dan karena fosfatnya diendapkan dalam bentuk senyawa besi atau aluminium yang tidak dengan mudah dapat dilarutkan oleh perakaran tanaman atau oleh mikrob tanah. Oleh sebab itu, mikrob tanah yang dapat melarutkan fosfat memegang peranan dalam memperbaiki tanaman budidaya yang mengalami defisiensi fosfor. Proses immobilisasi di dalam tanah menyebabkan fosfor tidak mudah tercuci sehingga terjadi defisiensi fosfor pada tanaman budidaya (Subba Rao,1994).
Pemberian pupuk fosfat dalam jumlah besar oleh pengaruh waktu dapat berubah menjadi fraksi yang sukar larut. Dari hasil percobaan menunjukkan pemupukan fosfat dalam jumlah besar pada tanah liat merah yang mempunyai daya ikat yang tinggi, dapat mempercepat terbentuknya fraksi fosfat alumunium dan fosfat besi. Keadaan ini dapat mengurangi kelarutan dan ketersediaan fosfat
yang berasal dari pupuk (Sarief, 1986). Penelitian Setiawati (1998) pada tanaman tembakau, dengan menginokulasikan bakteri pelarut fosfat dapat meningkatkan serapan P dan bobot kering tanaman.
Sastrahidayat et al., (2000) menyatakan bahwa aktivitas pelarutan senyawa P pada tanah-tanah masam oleh jasad renik tersebut memungkinkan konsentrasi P terlarut yang dapat diserap tanaman meningkat, bersamaan dengan itu juga ada kecenderungan peningkatan serapan N dan K. Hal ini sejalan dengan penelitian Prihatini dan Anas (1989) bahwa dari tanah Ultisol Rangkasbitung, Ciampea dan Ngawi telah diperoleh 5 isolat jasad mikrob pelarut fosfat yang sangat aktif dalam melarutkan P dari sumber P yang sukar larut dalam media Pikovskaya. Penelitian Elfiati (2004) pada tanaman sengon dengan menginokulasi bakteri pelarut fosfat terjadi peningkatan terhadap bobot kering sebesar 35% dibanding dengan kontrol. Meskipun mampu meningkatkan ketersediaan P, namun belum mampu untuk mempengaruhi bobot kering tanaman. Hal ini disebabkan karena P yang tersedia tidak mencukupi untuk meningkatkan bobot kering tanaman.
2.3.2 Jenis-Jenis Mikrob Pelarut Fosfat
Jenis-jenis mikrob pelarut fosfat yang dapat digunakan yaitu Klebsiella
terriguna, Pseudomonas putida, Pseudomonas flourescens, Bacillus subtilis dan Yersinia kritensenii. Mikrob-mikrob tersebut dapat meningkatkan efisiensi
pemupukan P dam memperbaiki pertumbuhan tanaman. Pseudomonas putida,
Pseudomonas flourescens dan Klebsiella terriguna mampu melarutkan Ca dan P
(Premono, 1994).
Banyak jamur dan bakteri (misalnya Aspergillus, Penicillium, Bacillus dan
Pseudomonas) yang merupakan pelarut potensial dari fosfat yang terikat. Bakteri
pelarut fosfat diketahui mereduksi pH substrat dengan mensekresi sejumlah asam organik seperti asam-asam format, asetat, propionat, laktonat, glikolat, fumatar dan suksinat. Beberapa dari asam organik ini membentuk khelat dengan kation-kation seperti Ca dan Fe dan khelasi semacam ini sehingga dapat melarutkan P sukar larut (Subba Rao,1994). Pada tanaman tebu, penggunaan bakteri pelarut fosfat (P. fluorescens dan P. Putida) dapat meningkatkan bobot kering tanaman sebesar 5-40% dan meningkatkan efisiensi penggunaan pupuk P asal TSP sebanyak 60-135% (Premono, 1994).
III. METODOLOGI PENELITIAN
3.1 Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Bioteknologi Tanah, Departemen Ilmu Tanah dan Sumberdaya Lahan, Fakultas Pertanian, Institut Pertanian Bogor dan penelitian lapang di rumah kaca Riau Andalan Pulp and Paper (RAPP), Pelalawan dan Pangkalan Kerinci R&D Nursary, Riau. Penelitian dimulai pada September 2006 sampai dengan Juni 2007.
3.2 Bahan dan Alat
Pada penelitian di laboratorium, bahan yang digunakan adalah tanah gambut Pelalawan-Riau P01-P14 dengan bintil akar Acacia crassicarpa dan tanah mineral Baserah-Riau M31-M45 dengan bintil akar Acacia mangium. Medium
Yeast Extract Manitol Agar (YEMA) yang ditambahkan Congo merah (Congo Red) digunakan untuk mengisolasi Rhizobium (Somasegaran dan Hoben, 1985).
Bromtimol Biru (Bromthymol Blue) untuk menguji reaksi isolat Rhizobium pada YEMA, Pikovcsaya untuk mengisolasi Mikrob Pelarut Fosfat (MPF). Gas
Chromatograph Simadhzu Model 17 adalah alat yang digunakan dalam uji Acetylene Reduction Assay (ARA) untuk mengetahui aktivitas nitrogenase dan
UV-VIS 1201 Spektrofotometer Shimadzu (660nm) untuk mengukur pelarutan P. Sedangkan bahan yang digunakan dalam penelitian di lapang yaitu cocopit sebagai carier. Cocopit merupakan bahan organik yang tingkat kematangannya masih rendah (fibrik) sehingga kemampuan menyerap air tinggi namun secara visual tidak terlihat, berasal dari limbah sabut kelapa dengan serat yang pendek (halus). Wadah bibit berupa tabung dan penampan seperti persemaian di lapangan. Tabung yang digunakan untuk A. mangium volumenya 65 ml cocopit, sedangkan untuk A. crassicarpa volume yang digunakan 90 ml cocopit. Pupuk yang digunakan adalah Osmocote dan Monopotassiumphosphate.
3.3 Metode Penelitian 3.3.1 Percobaan Laboratorium
3.3.1.1 Isolasi Rhizobium
Bintil akar diambil dari beberapa pohon Acacia mangium yang tumbuh pada tanah mineral dan Acacia crassicarpa pada tanah gambut. Pengumpulan isolat, pemurnian dan autentifikasi Rhizobium pada bintil akar menggunakan metode yang digunakan Somasegaran dan Hoben (1985).
Isolasi bintil akar dilaksanakan secara langsung dari bintil akar yang telah dikumpulkan. Pemurnian bintil disterilkan dengan mencelupkan bintil akar ke dalam larutan etanol 95% selama 10 detik, dan kemudian direndam dalam larutan H2O2 5% selama 3 menit. Setelah itu bintil dibilas dengan air steril sebanyak 5
kali. Bintil-bintil tersebut kemudian dimasukkan ke cawan petri yang telah ditetesi dengan 2 tetes larutan fisiologis steril (NaCl 0.85%) dan digerus dengan menggunakan batang pengaduk steril sampai terbentuk suspensi. Dengan menggunakan jarum ose, suspensi tersebut digoreskan ke cawan petri yang berisi YEMA yang telah diberi pewarna Congo Merah.
Sedangkan untuk isolasi dari tanah, sepuluh gram tanah yang akan diisolasi dilarutkan dalam 90 ml larutan fisiologis (larutan NaCl 0.85%), selanjutnya diencerkan secara serial sampai tingkat pengenceran 105 kali. Satu ml suspensi dibiakan pada agar cawan yang mengandung media YEMA yang telah diberi pewarna Congo Merah.
Cawan-cawan tersebut lalu diinkubasi pada suhu 25-280C selama 3-5 hari di dalam inkubator. Diantara koloni yang tumbuh dan menampakkan ciri-ciri morfologi khas Rhizobium seperti permukaan berlendir dengan elevasi cembung, sedikit atau tidak menyerap warna merah congo, dipilih koloni yang terpisah baik, lalu dimurnikan dengan menggunakan media agar yang sama. Koloni murni ditumbuhkan pada media agar YEMA yang diberi Bromthymol Blue. Warna kuning pada media yang dihasilkan oleh Rhizobium yang memiliki reaksi asam yang tumbuh cepat (2-3 hari) sedangkan warna biru dihasilkan oleh
Bradyrhizobium yang mempunyai reaksi basa dan tumbuh lama (7-10 hari).
Bromthymol Blue (warna kuning pada media) kemudian diambil dan disimpan
pada agar miring YEMA untuk digunakan pada uji autentifikasi.
Mikrob Pelarut Fosfat
Sepuluh gram tanah dimasukkan dalam 90 ml larutan fisiologis (larutan NaCl 0.85%), selanjutnya diencerkan secara serial sampai tingkat pengenceran 105 kali. Satu ml suspensi dibiakan pada agar cawan yang mengandung media Pikovskaya dan diinkubasi pada suhu kamar selama 3 hari pada suhu 25-280C di dalam inkubator. Koloni yang dikelilingi zona bening merupakan koloni yang memiliki kemampuan melarutkan fosfat sukar larut, selanjutnya dikoleksi dalam agar miring Pikovskaya.
3.3.1.2 Seleksi Rhizobium
Rhizobium yang berhasil diisolasi selanjutnya diseleksi kemampuannya
dalam menambat N udara bebas. Pada tahap seleksi, koloni yang terpisah dari hasil isolasi digoreskan pada medium YEMA yang baru. Biakan Rhizobium diinkubasi dalam inkubator selama 5-7 hari. Setelah biakan tumbuh, maka dilakukan pengujian berdasarkan kemampuannya menambat N2 melalui uji ARA
(Acetylene Reduction Assay). Isolat yang berhasil tumbuh dengan menggunakan jarum ose dimasukkan ke dalam YEMB (Yeast Extract Manitol Broth) lalu diinkubasi selama 24 jam. Masukkan 10 ml YEMB kedalam tabung dengan volume 20 ml kemudian tabung tersebut diinjekt dengan gas asetilen (C2H2) 10%
dari volume tabung, inkubasi selama 30 menit. Kemudian tabung tersebut diinjekt ke Gas Chromatograph Simadhzu Model 17 untuk mengetahui gas etilen yang dihasilkan (Somasegaran dan Hoben, 1985). Teknik reduksi asetilen-etilen digunakan untuk menentukan aktivitas nitrogenase. Sehingga dari teknik reduksi asetilen-etilen yang digunakan dapat diketahui bahwa jumlah etilen yang dihasilkan menunjukkan aktivitas nitrogenase, semakin tinggi aktivitas nitrogenase maka semakin tinggi pula kemampuan Rhizobium dalam menambat N2 dari udara bebas.
Mikrob Pelarut Fosfat
Mikrob pelarut fosfat yang berhasil diisolasi selanjutnya diseleksi kemampuannya dalam melarutkan senyawa P. Pada tahap seleksi, koloni yang terpisah pada saat isolasi digoreskan pada medium pikovscaya yang baru untuk bakteri, begitu pula untuk fungi hanya metode yang digunakan yaitu metode titik. Tahap ini menguji isolat dalam 3 sumber fosfat sukar larut yaitu Pikovscaya Ca3PO4, Pikovscaya Al3PO4 dan Pikovscaya Rock Phosphate RAPP (RP-RAPP).
Setelah biakan tumbuh, maka dilakukan pengukuran untuk menghitung pelarutan P dengan spektrofotometer pada panjang gelombang 660 nm.
3.3.2 Percobaan Lapang
3.3.2.1 Inokulasi Rhizobium dan Mikrob Pelarut Fosfat
Isolat Rhizobium yang terpilih berdasarkan uji ARA ditumbuhkan dalam media YEM selama 72 jam, kemudian dihitung jumlah sel dengan menggunakan haemacytometer. Setelah diketahuhi jumlah sel rhizobia, sel rhizobia diambil sebanyak 109 sel/ml media kemudian dimasukkan kedalam cocopit sebagai carrier dengan pengenceran 100x sehingga diperoleh jumlah rhizobia sebanyak 107 sel/ml carier. Inokulum disebarkan dengan menggunakan pipet dan diaduk secara merata. Sebanyak 25 ml isolat rhizobia diinokulasikan ke dalam 2500 ml cocopit. Begitu pula dengan MPF, isolat MPF terbaik ditumbuhkan kedalam media Pikovskaya cair selama 72 jam, kemudian dihitung jumlah MPF yang tumbuh pada media Pikovskaya dengan menggunakan haemacytometer. Inokulan dicampur dengan bahan pembawa (cocopit) yang sudah disterilkan terlebih dahulu dengan menggunakan autoklaf. Inokulan dibuat dengan kepadatan 107 sel/ml. Inokulum dalam cocopit dikeringkan di dalam laminar flow guna menghindari kontaminasi yang berlebihan. Sebelum digunakan terlebih dahulu cocopit disterilisasi selama 30 menit dengan menggunakan autoklaf.
3.3.2.2 Penyemaian Benih Akasia
Penyemaian benih dilaksanakan dengan pemecahan dormansi. Untuk A.
mangium pemecahan dormansi benih dilakukan dengan merendam benih dalam
air panas selama 12 jam setelah itu baru diaplikasikan diatas media sebelum ditutup dengan top dressing. Sedangkan untuk A. crassicarpa pemecahan
dormansi dilakukan dengan merendam benih dalam H2SO4 5% selama 15 menit,
setelah itu dicuci bersih dari H2SO4 lalu direndam air selama 12 jam dan
dikeringanginkan selama 1 jam (perendaman dilakukan dengan tujuan memecahkan dormansi benih sehingga benih cepat tumbuh).
3.3.2.3 Perlakuan Inokulasi
Perlakuan inokulasi Rhizobium dan Mikrob pelarut fosfat yang
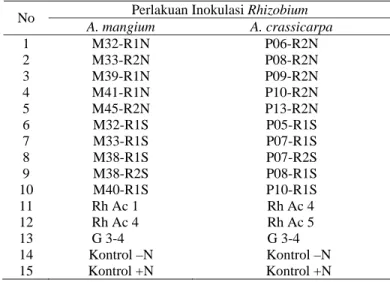
diaplikasikan pada pembibitan akasia seperti terlihat pada Tabel 1.
Tabel 1. Perlakuan inokulasi Rhizobium pada A. mangium dan A. crassicarpa
Perlakuan Inokulasi Rhizobium No A. mangium A. crassicarpa 1 M32-R1N P06-R2N 2 M33-R2N P08-R2N 3 M39-R1N P09-R2N 4 M41-R1N P10-R2N 5 M45-R2N P13-R2N 6 M32-R1S P05-R1S 7 M33-R1S P07-R1S 8 M38-R1S P07-R2S 9 M38-R2S P08-R1S 10 M40-R1S P10-R1S 11 Rh Ac 1 Rh Ac 4 12 Rh Ac 4 Rh Ac 5 13 G 3-4 G 3-4 14 Kontrol –N Kontrol –N 15 Kontrol +N Kontrol +N
Tabel 2. Perlakuan inokulasi Mikrob Pelarut Fosfat pada A. mangium dan A.
crassicarpa
Perlakuan Inokulasi Mikrob Pelarut Fosfat No A. mangium A. crassicarpa 1 M31-BP1 P07-BP1 2 M32-BP3 P07-BP3 3 M33-BP1 P07-BP4 4 M33-BP2 P08-BP1 5 M34-BP1 P08-BP4 6 M32-FP5 P07-FP5 7 M33-FP1 P08-FP5 8 M33-FP2 P08-FP6 9 M34-FP3 BPF3 10 M35-FP1 BPF4 11 G 3-2 FPF4 12 D3-3 FRK2 (17) 13 FPF5 FPF5 14 FRK2 (17) S3 (12) 15 Kontrol –P Kontrol –P 16 Kontrol +P Kontrol +P
3.3.2.4 Penanaman Bibit Akasia
Persiapan penanaman dilakukan dengan mengisi pipa pada penampan dengan media cocopit, setelah itu masukkan benih untuk A. mangium 1 benih untuk tiap lubang dan A. crassicarpa 2 benih untuk setiap lubang. Setelah itu carier (bahan pembawa berupa campuran inokulan dan cocopit) digunakan untuk tahap, akhir sebagai penutup benih pada tahap penanaman. Media tanam yang digunakan yaitu cocopit, kebutuhan media seperti pada Tabel 3.
Tabel 3. Kebutuhan media tanam yang digunakan pada pembibitan akasia
Perlakuan Kebutuhan media cocopit Kebutuhan media yang dipakai (l) Rhizobium (A. mangium dan A. crassicarpa)
Kontrol –N 2 x (5 penampan x 96 tabung x 90 ml=43.2 l) 100 Kontrol +N 2x (5 penampan x 96 tabung x 90 ml=43.2 l) 100 Isolat 2x (13 isolat x 5 penampan x 96 tabung x 90 ml = 561.2 l) 1200
Mikrob Pelarut Fosfat (tanah gambut dan tanah mineral)
Kontrol –P 2 x (5 penampan x 96 tabung x 90 ml=43.2 l) 100 Kontrol +P 2 x (5 penampan x 96 tabung x 90 ml=43.2 l) 100 Isolat 2 x (14 isolat x 5 penampan x 96 tabung x 90 ml=604.8 l) 1300
Tabel 4. Kebutuhan pupuk pada pembibitan akasia
Perlakuan
A. mangium Dosis
Perlakuan
A. crassicarpa Dosis
Isolat Rhizobium 4 kg/m3 Osmocote Isolat Rhizobium 5 kg/m3 Osmocote + 1 kg/m3 MOP Kontrol -N Tanpa Pupuk Kontrol -N 1 kg/m3 MOP
Kontrol +N 8 kg/m3 Osmocote Kontrol +N 10 kg/m3 Osmocote + 1 kg/m3 MOP Isolat MPF 4 kg/m3 Osmocote Isolat MPF 5 kg/m3 Osmocote + 0.5 kg/m3 MOP Kontrol –P Tanpa Pupuk Kontrol –P 5 kg/m3 Osmocote
Kontrol +P 8 kg/m3 Osmocote Kontrol +P 10 kg/m3 Osmocote + 1 kg/m3 MOP Ket : MOP : Monopotassiumphosphate
MPF : Mikrob Pelarut Fosfat 3.3.2.5 Perawatan dan Pemeliharaan
Benih yang baru ditanam diletakkan di daerah naungan (shady net) selama 3-4 MST dengan tujuan untuk mempermudah perawatan dan memaksimalkan pertumbuhan, akan tetapi karena kondisi lokasi pembibitan yang terbatas maka terjadi keterlambatan hingga 5 MST. Benih di pindahkan ke daerah terbuka (open
area) setelah umur 6-7 MST baru dikirim untuk ditanam di lapang. Selama di
daerah terbuka benih di siram empat kali sehari sesuai dengan standar operasional selain itu juga tergantung pada cuaca, sedangkan untuk pemupukan pada A.
3.3.2.6 Desain Penelitian
Perlakuan inokulasi dengan Rhizobium pada A. mangium ada 15 perlakuan yang diulang 5 kali sehingga diperoleh 75 satuan percobaan, sedangkan untuk perlakuan dengan inokulasi Mikrob Pelarut Fosfat ada 16 perlakuan dan diulang 5 kali sehingga diperoleh 80 satuan percobaan. Penempatan satuan perlakuan pada
A. mangium dilakukan di Pangkalan Kerinci R and D Nursary. Begitu pula pada A. crassicarpa, perlakuan dengan inokulasi Rhizobium ada 15 perlakuan yang
diulang 5 kali sehingga diperoleh 75 satuan percobaan, sedangkan untuk perlakuan dengan inokulasi Mikrob Pelarut Fosfat ada 16 perlakuan yang diulang 5 kali sehingga diperoleh 80 satuan percobaan dan penempatan satuan percobaan dilakukan di Pelalawan Nursary. Setiap satuan perlakuan ditempatkan menurut RAK (Rancangan Acak Kelompok). Data dianalisis secara statistik dengan menggunakan uji lanjut DMRT. Parameter yang diamati yaitu 1) Tinggi tanaman setiap minggu sampai 8 MST, 2) Bobot basah dan kering tanaman bagian atas umur 8 MST, 3) Bobot basah dan kering akar umur 8 MST, 4) Diameter batang umur 8 MST, 5) Kekompakan akar/viagra akar umur 8 MST.
IV. HASIL DAN PEMBAHASAN
4.1 Isolasi Rhizobium dan Mikrob Pelarut Fosfat
4.1.1 Isolasi Rhizobium dari Tanah dan Bintil Akar Akasia
Isolasi Rhizobium diambil dari 14 sampel tanah gambut dengan bintil akar
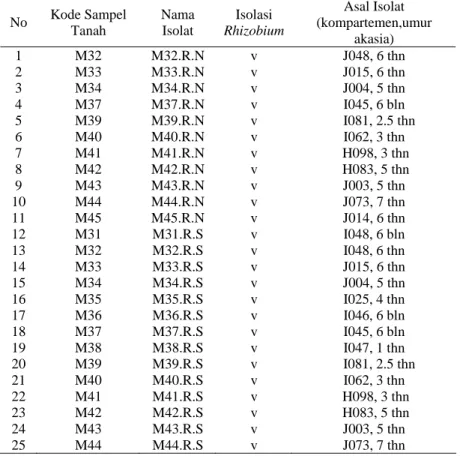
Acacia crassicarpa dan 15 sampel tanah mineral dengan bintil akar Acacia mangium. Berdasarkan Tabel 5, dari beberapa sumber isolat tanah gambut
tersebut diperoleh sebanyak 13 isolat. Dari ke-13 isolat, 9 isolat berasal dari bintil akar A. crassicarpa, 4 isolat dari tanah gambut. Sedangkan pada tanah mineral dari ke-25 isolat diperoleh, 11 isolat dari bintil akar A. mangium dan 14 isolat dari tanah mineral (Tabel 6).
Tabel 5. Isolasi Rhizobium dari Tanah Gambut daerah Pelalawan
No Kode Sampel Tanah Nama Isolat Isolasi Rhizobium Asal Isolat (kompartemen, umur akasia) 1 P05 P05.R.N v T11, 1 thn 2 P06 P06.R.N v T20, 1 thn 3 P07 P07.R.N v T16, 1.5 thn 4 P08 P08.R.N v N69, 3 thn 5 P09 P09.R.N v N55, 3 thn 6 P10 P10.R.N v N84, 9 bln 7 P11 P11.R.N v T51, 1 thn 8 P12 P12.R.N v X008, 2 thn 9 P13 P13.R.N v 1 thn, 4 bln 10 P05 P05.R.S v T11, 1 thn 11 P07 P07.R.S v T16, 1.5 thn 12 P08 P08.R.S v N69, 3 thn 13 P10 P10.R.S v N84, 9 bln
Dari Tabel 6 dapat dilihat tanah mineral menghasilkan paling banyak isolat. Hal ini disebabkan kemasaman tanah berpengaruh tehadap perkembangan akar dan ketersediaan hara tanah. Kondisi masam kurang baik untuk tanaman legume juga Rhizobium, pertumbuhannya dapat terhambat sehingga bintil akar yang dihasilkan berkurang atau sulit untuk membentuk bintil akar (Subba Rao, 1994). Setelah ditumbuhkan pada media YEMA, semua isolat Rhizobium yang diperoleh menunjukkan karakteristik 1) Berbentuk bundar, 2) Tampak berkilau dan licin, 3) Permukaan berlendir dengan elevasi cembung, 4) Berwarna putih atau putih susu. Kecepatan pertumbuhan isolat tidak sama, hal ini terlihat dari
jumlah populasi Rhizobia yang tumbuh pada sumber isolat tersebut bervariasi dan waktu kecepatan tumbuh yang berbeda, selain itu tidak semua sumber isolat menghasilkan isolat Rhizobium. Selanjutnya isolat tersebut diseleksi berdasarkan kemampuannya dalam menambat N melalui uji ARA (Asetylene Reduction
Assay).
Tabel 6. Isolasi Rhizobium dari Tanah Mineral daerah Baserah
4.1.2 Isolasi Mikrob Pelarut Fosfat dari Tanah
Isolasi Mikrob Pelarut Fosfat (MPF) diambil dari 15 sampel tanah mineral dan 14 sampel tanah gambut. Berdasarkan tabel 7, dari sumber isolat tanah gambut diperoleh sebanyak 5 isolat, 2 isolat Bakteri Pelarut Fosfat (BPF) dan 3 isolat Fungi Pelarut Fosfat (FPF). Sedangkan dari tanah mineral, dihasilkan sebanyak 5 BPF dan 5 FPF. Setelah ditumbuhkan pada media Pikovskaya, semua isolat mikrob pelarut fosfat yang diperoleh menunjukkan karakteristik mempunyai daerah zona bening pada koloninya. Selanjutnya ke-15 isolat tersebut diseleksi berdasarkan kemampuannya dalam melarutkan P untuk meningkatkan serapan P
No Kode Sampel Tanah Nama Isolat Isolasi Rhizobium Asal Isolat (kompartemen,umur akasia) 1 M32 M32.R.N v J048, 6 thn 2 M33 M33.R.N v J015, 6 thn 3 M34 M34.R.N v J004, 5 thn 4 M37 M37.R.N v I045, 6 bln 5 M39 M39.R.N v I081, 2.5 thn 6 M40 M40.R.N v I062, 3 thn 7 M41 M41.R.N v H098, 3 thn 8 M42 M42.R.N v H083, 5 thn 9 M43 M43.R.N v J003, 5 thn 10 M44 M44.R.N v J073, 7 thn 11 M45 M45.R.N v J014, 6 thn 12 M31 M31.R.S v I048, 6 bln 13 M32 M32.R.S v I048, 6 thn 14 M33 M33.R.S v J015, 6 thn 15 M34 M34.R.S v J004, 5 thn 16 M35 M35.R.S v I025, 4 thn 17 M36 M36.R.S v I046, 6 bln 18 M37 M37.R.S v I045, 6 bln 19 M38 M38.R.S v I047, 1 thn 20 M39 M39.R.S v I081, 2.5 thn 21 M40 M40.R.S v I062, 3 thn 22 M41 M41.R.S v H098, 3 thn 23 M42 M42.R.S v H083, 5 thn 24 M43 M43.R.S v J003, 5 thn 25 M44 M44.R.S v J073, 7 thn
melalui uji pelarutan P. Hasil isolasi Mikrob Pelarut Fosfat dari tanah gambut dan tanah mineral seperti terlihat pada Tabel 7.
Tabel 7. Isolasi Mikrob Pelarut Fosfat berdasarkan Indeks Pelarutan (IP)
No Kode Sampel
Tanah Kode BPF Kode FPF
Asal Isolat (kompartemen,umur akasia) 1 P04 - P04-FP J003, 3 thn 2 P07 P07-BP P07-FP T16, 1.5 thn 3 P08 P08-BP P08-FP N69, 3 thn 4 M31 M31-BP - I048, 6 bln 5 M32 M32-BP M32-FP I048, 6 thn 6 M33 M33-BP M33-FP J015, 6 thn 7 M34 M34-BP M34-FP J004, 5 thn 8 M35 - M35-FP I025, 4 thn 9 M43 - M43-FP J003, 5 thn 10 M44 M44-BP - J073, 7 thn
Keterangan : BPF : Bakteri Pelarut Fosfat FPF : Fungi Pelarut Fosfat
4.2 Seleksi Rhizobium dan Mikrob Pelarut Fosfat 4.2.1 Seleksi Isolat Rhizobium berdasarkan uji ARA
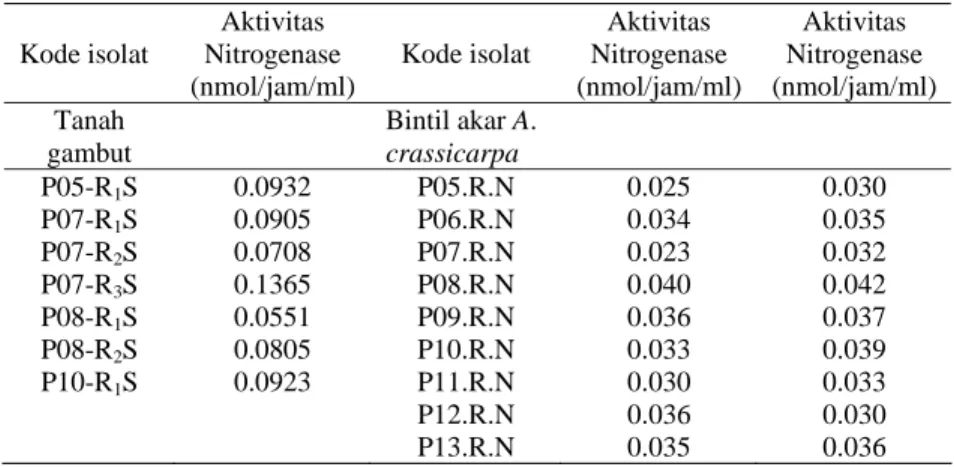
Dari Tabel 8 dapat dilihat bahwa dari tahap seleksi dihasilkan 7 isolat berasal dari tanah gambut dan 9 isolat dari bintil akar A. crassicarpa yang diuji dengan menggunakan metode uji ARA (Asetylene Reduction Assay).
Tabel 8. Aktivitas Nitrogenase Rhizobia dari Tanah Gambut dan bintil akar A.
crassicarpa
Hasil isolasi Rhizobium yang berasal dari beberapa sumber isolat diseleksi berdasarkan kemampuan menambat N melalui uji ARA (Acetylene Reduction
Assay). Teknik reduksi asetilen-etilen digunakan untuk menentukan aktivitas
nitrogenase dari berbagai fraksi bintil yang berbeda-beda. Sehingga dari teknik
Kode isolat Aktivitas Nitrogenase (nmol/jam/ml) Kode isolat Aktivitas Nitrogenase (nmol/jam/ml) Aktivitas Nitrogenase (nmol/jam/ml) Tanah gambut Bintil akar A. crassicarpa P05-R1S 0.0932 P05.R.N 0.025 0.030 P07-R1S 0.0905 P06.R.N 0.034 0.035 P07-R2S 0.0708 P07.R.N 0.023 0.032 P07-R3S 0.1365 P08.R.N 0.040 0.042 P08-R1S 0.0551 P09.R.N 0.036 0.037 P08-R2S 0.0805 P10.R.N 0.033 0.039 P10-R1S 0.0923 P11.R.N 0.030 0.033 P12.R.N 0.036 0.030 P13.R.N 0.035 0.036
reduksi asetilen-etilen yang digunakan dapat diketahui bahwa jumlah etilen yang dihasilkan menunjukkan aktivitas nitrogenase Rhizobia tanah. Semakin tinggi aktivitas nitrogenase maka semakin tinggi pula kemampuan Rhizobium dalam menambat N dari udara bebas. Aktivitas nitrogenase juga ditentukan oleh bobot bintil akar yang dihasilkan, semakin tinggi bobot bintil akar maka aktivitas nitrogenase juga semakin tinggi. Hal ini sesuai dengan pernyataan Somasegaran et
al., (1994) bahwa untuk menilai keefektifan suatu isolat dapat dilakukan
berdasarkan evaluasi terhadap bobot kering tanaman bagian atas, kandungan N total tanaman bagian atas dan bobot kering bintil akar. Jumlah bintil akar kurang memberikan indikasi keefektifan suatu isolat. Kandungan N total seringkali berkorelasi dengan bobot kering tanaman. Oleh karena itu, bobot kering tanaman dapat digunakan untuk mengukur keefektifan isolat dalam menambat N.
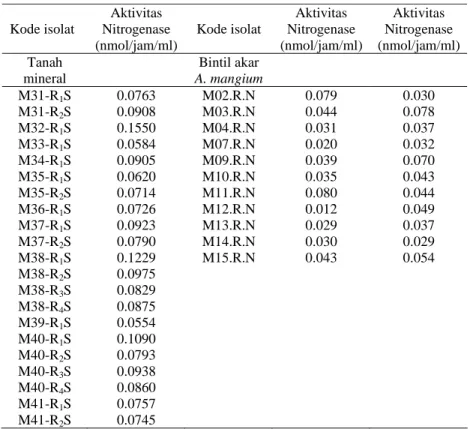
Tabel 9. Aktivitas Nitrogenase Rhizobia dari tanah mineral dan bintil akar A.
mangium
Dari Tabel 8 dan Tabel 9, dapat diketahui jumlah etilen yang dihasilkan dari setiap tanah dan bintil akar berbeda-beda sehingga aktivitasnya pun berbeda
Kode isolat Aktivitas Nitrogenase (nmol/jam/ml) Kode isolat Aktivitas Nitrogenase (nmol/jam/ml) Aktivitas Nitrogenase (nmol/jam/ml) Tanah mineral Bintil akar A. mangium M31-R1S 0.0763 M02.R.N 0.079 0.030 M31-R2S 0.0908 M03.R.N 0.044 0.078 M32-R1S 0.1550 M04.R.N 0.031 0.037 M33-R1S 0.0584 M07.R.N 0.020 0.032 M34-R1S 0.0905 M09.R.N 0.039 0.070 M35-R1S 0.0620 M10.R.N 0.035 0.043 M35-R2S 0.0714 M11.R.N 0.080 0.044 M36-R1S 0.0726 M12.R.N 0.012 0.049 M37-R1S 0.0923 M13.R.N 0.029 0.037 M37-R2S 0.0790 M14.R.N 0.030 0.029 M38-R1S 0.1229 M15.R.N 0.043 0.054 M38-R2S 0.0975 M38-R3S 0.0829 M38-R4S 0.0875 M39-R1S 0.0554 M40-R1S 0.1090 M40-R2S 0.0793 M40-R3S 0.0938 M40-R4S 0.0860 M41-R1S 0.0757 M41-R2S 0.0745
pula. Semakin tinggi jumlah etilen yang dihasilkan maka aktivitas nitrogenasenya semakin tinggi. Hal ini berkorelasi dengan kemampuan Rhizobia dalam menambat N bebas udara. Hasil pengukuran aktivitas nitrogenase dengan uji ARA dari tanah gambut dan tanah mineral berkisar antar 0.0551 sampai 0.1550 nmol/jam/ml. Isolat yang memiliki aktivitas nitrogenase tertinggi yaitu M32-R1S sebesar 0.1550 nmol/jam/ml dan isolat yang memiliki aktivitas nitrogenase terkecil yaitu P08-R1S sebesar 0.0551 nmol/jam/ml.
Hasil pengukuran aktivitas nitrogenase dengan uji ARA dari bintil A.
crassicarpa dan A. mangium berkisar antara 0.0120 sampai 0.080 nmol/jam/ml. Isolat yang memiliki aktivitas nitrogenase tertinggi yaitu M11-R.N sebesar 0.080 nmol/jam/ml dan isolat yang memiliki aktivitas nitrogenase terkecil yaitu M12-R.N sebesar 0.0120 nmol/jam/ml.
Penelitian Sihono (2004) menunjukkan jumlah dan bobot kering bintil akar pada tanah S1 (tanah steril) lebih baik dari pada S0 (tanah tidak steril). Hal ini menunjukkan bahwa daya infektif isolat Rhizobium pada tanah S1 lebih tinggi dari pada tanah S0, namun aktivitas nitrogenase bintil akar pada tanah S0 lebih baik dari pada tanah S1 sehingga daya efektivitasnya lebih besar pada tanah S1. Hal ini mungkin disebabkan karena adanya antagonisme antara isolat Rhizobium dengan mikroorganisme tanah lainnya.
4.2.2 Seleksi Isolat Mikrob Pelarut Fosfat berdasarkan Indeks Pelarutan (IP)
Hasil isolasi mikrob pelarut fosfat yang berasal dari beberapa sumber isolat diseleksi berdasarkan kemampuannya melarutkan P dengan melihat Indeks Pelarutan (IP). Seleksi kemampuan mikrob pelarut fosfat dalam melarutkan Al3PO4, CaPO4 dan Rock Phosphate RAPP seperti pada Tabel 10.
Kemampuan mikrob pelarut fosfat dalam melarutkan P dapat dilakukan dengan mengukur lebar zona bening dan mengukur indeks pelarutan (IP). Lebar zona bening yang dihasilkan menunjukkan kemampuan mikrob pelarut fosfat dalam melarutkan P. Untuk mengukur indeks pelarutan, lebar zona bening dibagi diameter koloni. Semakin tinggi nilai IP yang dihasilkan, kemampuan mikrob pelarut fosfat dalam melarutkan P juga tinggi.
Tabel 10. Indeks Pelarutan (IP) dalam P-sukar Larut Al, Ca, RP- RAPP
Kemampuan mikrob pelarut fosfat sangat beragam dalam melarutkan Ca3PO4, Al3PO4 dan RP-RAPP. Dari Tabel 10, dapat dilihat bahwa indeks
pelarutan P pada Ca3PO4, semua isolat memiliki kemampuan melarutkan P baik
bakteri maupun fungi. Isolat M32-MP2B menghasilkan IP tertinggi untuk bakteri
dan isolat M43-MP2F untuk fungi dibandingkan isolat lain. Hal ini menunjukkan
isolat tersebut memiliki kemampuan melarutkan P paling baik diantara isolat lain. Beberapa isolat tidak mampu melarutkan senyawa Al3PO4 dan RP-RAPP.
Hal ini menunjukkan ketidakstabilan karakter dalam melarutkan senyawa P. Sedangkan pada media Al3PO4, fungi memiliki kemampuan yang baik dalam
melarutkan P (Tabel 10). Hal ini karena media Al3PO4 memiliki pH rendah yang
sesuai untuk tumbuhnya fungi daripada bakteri.
Keterangan No Kode Isolat Al3PO4 Ca3PO4 RP-RAPP
1 M31-MP1B - 2.00 - 2 M32-MP1B - 2.01 - 3 M32-MP2B - 3.27 - 4 M32-MP3B - 2.35 - 5 M32-MP4B - 2.10 - 6 M33-MP1B 2.15 2.79 2.05 7 M33-MP2B - 2.25 - 8 M34-MP1B - 2.00 - 9 M34-MP2B 1.75 2.82 1.56 Bakteri pada tanah mineral 10 M44-MP1B - 2.75 - 11 P07-MP1B - 3.21 - 12 P07-MP2B - 2.30 - 13 P07-MP2B - 2.17 - 14 P07-MP3B - 2.02 -- 15 P08-MP1B - 2.32 - 16 P08-MP2B - 2.32 - 17 P08-MP3B - 2.46 - Bakteri pada tanah gambut 18 P08-MP4B 2.05 2.40 1.25 19 M33-MP3F 2.15 2.56 - 20 M33-MP4F 2.20 2.65 1.85 21 M35-MP1F - 2.05 - 22 M35-MP2F 2.25 2.68 - 23 M43-MP1F - 2.05 - 24 M43-MP2F 2.50 2.79 - 25 M43-MP3F 2.10 2.35 - 26 M34-MP3F 2.00 2.68 - 27 M32-MP5F 2.13 2.45 - Fungi pada tanah mineral 28 M34-MP4F 2.05 2.15 - 29 P07-MP5F - 2.30 - 30 P08-MP5F 2.35 2.78 2.00 Fungi pada tanah gambut 31 P08-MP6F 2.00 2.25 -
Begitu pula pada RP-RAPP, mikroba pelarut P sulit melarutkan P pada media tersebut karena media yang digunakan merupakan fosfat alam, sukar larut dalam air dan tidak cocok untuk media tumbuhnya mikrob pelarut P, sehingga hanya sebagian kecil dari isolat yang menghasilkan IP (Tabel 10).
4.3 Isolat Rhizobia Terpilih berdasarkan uji ARA dan Isolat Mikrob Pelarut Fosfat Terpilih berdasarkan Indeks Pelarutan (IP)
Berdasarkan hasil seleksi maka diperoleh Isolat Rhizobia dan Mikrob Pelarut Fosfat terpilih yang akan diaplikasikan pada pembibitan akasia seperti terlihat pada Tabel 11 dan 12.
Tabel 11. Isolat Rhizobia yang terpilih berdasarkan uji ARA
Asal
Tanah gambut Tanah mineral
Bintil A. crassicarpa Tanah Bintil A. mangium Tanah
P06-R2N P05-R1S M32-R1N M32-R1S
P08-R2N P07-R1S M33-R2N M33-R1S
P09-R2N P07-R2S M39-R2N M38-R1S
P10-R2N P08-R1S M41-R1N M38-R2S
P13-R2N P10-R1S M45-R2N M40-R1S
Tabel 12. Isolat Mikrob Pelarut Fosfat yang terpilih berdasarkan Indeks Pelarutan (IP)
Asal
Tanah gambut Tanah mineral
Bakteri Fungi Bakteri Fungi
P07-BP1 P07-FP5 M31-BP1 M32-FP5
P07-BP3 P08-FP5 M32-BP3 M33-FP1
P07-BP4 P08-FP6 M33-BP1 M33-FP2
P08-BP1 - M33-BP2 M34-FP3
P08-BP4 - M34-BP1 M35-FP1
Tabel 13. Isolat Rhizobium yang akan Diuji pada A. mangium dan
A. crassicarpa (RAPP-Riau)
Tanah Gambut Tanah Mineral
Bintil A.crassicarpa Tanah Isolat pembanding Bintil A.mangium Tanah Isolat pembanding P06-R2N P05-R1S Rh Ac 4 M32-R1N M32-R1S Rh Ac 1 P08-R2N P07-R1S Rh Ac 5 M33-R2N M33-R1S Rh Ac 4 P09-R2N P07-R2S G 3-4 M39-R2N M38-R1S G 3-4 P10-R2N P08-R1S M41-R1N M38-R2S P13-R2N P10-R1S M45-R2N M40-R1S
Tabel 14. Isolat Mikrob Pelarut Fosfat yang akan Diuji pada A. mangium dan
A. crassicarpa (RAPP-Riau)
Tanah Gambut Tanah Mineral
BPF FPF Isolat pembanding BPF FPF Isolat pembanding P07-BP1 P07-FP5 BPF3 FP4 M31-BP1 M32-FP5 D3-3 FP5
P07-BP3 P08-FP5 BPF4 FP5 M32-BP3 M33-FP1 G3-2 FRK2
P07-BP4 P08-FP6 FRK2 M33-BP1 M33-FP2
P08-BP1 - S3 M33-BP2 M34-FP3
P08-BP4 - M34-BP1 M35-FP1
Dari 15 jenis tanah mineral dan 14 jenis tanah gambut yang digunakan untuk mengisolasi Rhizobium dan Mikrob Pelarut Fosfat, maka diperoleh isolat terbaik yang akan digunakan untuk pengujian lapang pada persemaian A.
mangium dan A. crassicarpa (Tabel 11 dan 12).
Isolasi Rhizobium dan Mikrob pelarut P pada persemaian bibit akasia diharapkan dapat meningkatkan pertumbuhan akasia. Sehingga mampu menurunkan penggunaan pupuk anorganik karena Rhizobium memiliki kemampuan menambat N bebas dari udara, dan mikrob pelarut fosfat yang mempunyai kemampuan tinggi dalam melarutkan fosfat dan serapan P oleh tanaman.
Selain menginokulasikan Rhizobium dan mikrob pelarut fosfat yang diperoleh dari hasil isolasi dan seleksi di atas, digunakan pula isolat pembanding yang berasal dari koleksi laboratorium yang akan dilakukan pada pengujian lapang (Tabel 13 dan 14). Sehingga hasil yang diperoleh dapat dibandingkan, efektivitas mana yang paling baik digunakan untuk meningkatkan kualitas persemaian bibit akasia.
4. 4 Populasi Rhizobium, Mikrob Pelarut Fosfat Awal dan Reisolasi Inokulan yang akan di Uji Lapang dalam Carier
Data Populasi awal Rhizobium, Bakteri Pelarut Fosfat (BPF) dan Fungi Pelarut Fosfat (FPF) pada tanah mineral dan tanah gambut disajikan pada Tabel lampiran 1.
Populasi awal Rhizobia sebelum diisolasi berkisar antara 0.02 x 104 sampai 7.79 x 104 SPK/g BKM. Populasi tertinggi yaitu pada sampel tanah gambut P08 sebesar 7.79 x 104 SPK/g BKM. Sedangkan populasi Rhizobia terendah yaitu pada tanah mineral M39 sebesar 0.02 x 104 SPK/g BKM.
Populasi awal bakteri pelarut fosfat sebelum diisolasi berkisar antara 0.01 x 104 sampai 7.08 x 104 SPK/g BKM. Populasi bakteri pelarut fosfat tertinggi pada sampel tanah gambut M33 sebesar 7.08 x 104 SPK/g BKM. Sedangkan populasi terendah pada sampel tanah mineral M37, M38, M39 dan M40 sebesar 0.01 x 104 SPK/g BKM.
Menurut Paul dan Rao (1971) populasi bakteri pelarut fosfat dalam tanah berkisar 104 sampai 106 sel/g tanah. Ini menunjukkan bahwa tanah pada lokasi pengambilan sampel untuk isolat ini mempunyai potensi bakteri pelarut fosfat indigenous yang dapat dioptimalkan manfaatnya untuk eksploitasi P anorganik di dalam tanah. Dampak yang diharapkan dari peningkatan populasi bakteri pelarut fosfat dalam tanah adalah peningkatan ketersediaan P tanah.
Tidak semua sampel tanah yang digunakan untuk menghitung mikrob tanah menghasilkan fungi pelarut fosfat. Populasi awal fungi pelarut fosfat berdasarkan Tabel lampiran 1, berkisar antara 0.13 x 104 sampai 4.89 x 104 SPK/g BKM. Populasi tertinggi fungi pelarut fosfat diperoleh pada tanah mineral M33 sebesar 4.89 x 104 SPK/g BKM dan populasi terendah juga pada sampel tanah mineral M43 sebesar 0.13 x 104 SPK/g BKM. Jumlah fungi di dalam tanah berkisar antara 2.0 x 104 sampai 1.0 x 106 untuk tiap gram tanah. Populasi fungi sering dijumpai di sekitar perakaran tanaman (Alexander, 1977).
Setelah dilakukan penghitungan populasi mikrob tanah awal, maka dilakukan reisolasi inokulan mikrob tanah yang akan di uji lapang dalam carier. Carier yang digunakan yaitu cocopit.
Setelah dilakukan reisolasi inokulan pada carier cocopit maka populasi Rhizobia dalam carier cocopit berkisar 2.0 x 107 sampai 137.0 x 107 SPK/ml. Kepadatan populasi inokulan dalam pembawa cocopit tertinggi yaitu pada isolat Rh Ac 4 sebesar 137.0 x 107 SPK/ml sedangkan kepadatan populasi inokulan dalam pembawa cocopit terendah pada isolat M32-R1S sebesar 2.0 x 107 SPK/ml. Pada mikrob pelarut fosfat, kepadatan populasi inokulan dalam pembawa cocopit berkisar 2.9 x 107 sampai 336.0 x 107 SPK/ml. Kepadatan populasi inokulan dalam pembawa cocopit tertinggi pada isolat M33-BP1 sebesar 336.0 x 107 SPK/ml sedangkan kepadatan populasi inokulan dalam pembawa cocopit terendah pada isolat M34-BP1 sebesar 2.9 x 107 SPK/ml (Tabel lampiran 2).
4.5 Pertumbuhan Bibit Acacia crassicarpa dan Acacia mangium 4.5.1 Pengaruh Inokulasi Rhizobium
4.5.1.1 Tinggi Tanaman, Jumlah Daun, Bobot Kering Tanaman Bagian Atas (BKTBA), Bobot Kering Akar (BKA), Diameter Batang dan Kekompakan Akar A. crassicarpa
Hasil uji Duncan taraf 5% menunjukkan bahwa perlakuan isolat
Rhizobium berpengaruh nyata meningkatkan tinggi tanaman, jumlah daun,
BKTBA, BKA, diameter batang dan kekompakan akar. Pengaruh isolat
Rhizobium disajikan pada Tabel 15.
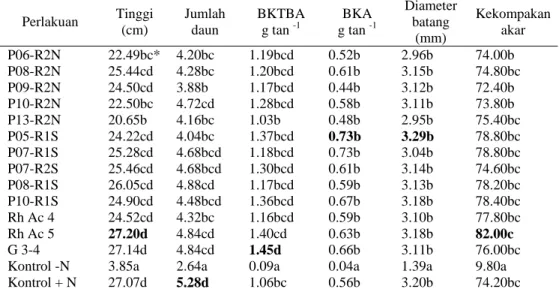
Dari Tabel 15 terlihat isolat Rh Ac 5 dan P08-R1S berpengaruh terhadap tinggi tanaman, jumlah daun, BKTBA, BKA, diameter batang dan kekompakan akar dibandingkan dengan kontrol –N, tetapi tidak berbeda nyata dengan kontrol +N. Besarnya peningkatan tinggi tanaman yaitu 606% dan 576%, tingginya nilai rataan tinggi tanaman diduga karena isolat tersebut mampu menghasilkan IAA yang dapat menunjang pertumbuhan tanaman. Menurut Rao (1994) bahwa IAA yang dihasilkan oleh isolat Rhizobium dapat mempengaruhi pemanjangan batang.
Tabel 15. Pengaruh inokulasi isolat Rhizobium terhadap beberapa parameter yang digunakan pada pertumbuhan bibit A. crassicarpa 8 MST.
Perlakuan Tinggi (cm) Jumlah daun BKTBA g tan -1 BKA g tan -1 Diameter batang (mm) Kekompakan akar P06-R2N 22.49bc* 4.20bc 1.19bcd 0.52b 2.96b 74.00b P08-R2N 25.44cd 4.28bc 1.20bcd 0.61b 3.15b 74.80bc P09-R2N 24.50cd 3.88b 1.17bcd 0.44b 3.12b 72.40b P10-R2N 22.50bc 4.72cd 1.28bcd 0.58b 3.11b 73.80b P13-R2N 20.65b 4.16bc 1.03b 0.48b 2.95b 75.40bc P05-R1S 24.22cd 4.04bc 1.37bcd 0.73b 3.29b 78.80bc P07-R1S 25.28cd 4.68bcd 1.18bcd 0.73b 3.04b 78.80bc P07-R2S 25.46cd 4.68bcd 1.30bcd 0.61b 3.14b 74.60bc P08-R1S 26.05cd 4.88cd 1.17bcd 0.59b 3.13b 78.20bc P10-R1S 24.90cd 4.48bcd 1.36bcd 0.67b 3.18b 78.40bc Rh Ac 4 24.52cd 4.32bc 1.16bcd 0.59b 3.10b 77.80bc Rh Ac 5 27.20d 4.84cd 1.40cd 0.63b 3.18b 82.00c G 3-4 27.14d 4.84cd 1.45d 0.66b 3.11b 76.00bc Kontrol -N 3.85a 2.64a 0.09a 0.04a 1.39a 9.80a
Kontrol + N 27.07d 5.28d 1.06bc 0.56b 3.20b 74.20bc
*=angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata menurut uji lanjut Duncan taraf α= 0.05%
Penelitian Elfiati (2004) tinggi tanaman sengon tertinggi akibat inokulasi isolat Rhizobium sebesar 67% pada tanah Ultisol. Dibandingkan hasil yang diperoleh dari penelitian Elfiati, penelitian ini terlihat hasilnya lebih tinggi.
Peningkatan bobot kering bagian atas tanaman relatif berpengaruh nyata pada semai dengan inokulasi P05-R1S dibandingkan kontrol –N tetapi pada inokulan G 3-4 berbeda nyata terhadap kontrol –N maupun kontrol +N (Tabel 15 dan Gambar 1). Besarnya peningkatan bobot kering tanaman akibat inokulasi G 3-4 yaitu 15 kali terhadap kontrol –N dan 37% terhadap kontrol +N, sedangkan pada isolat P05-R1S sebesar 14 kali kontrol -N. Dari persentase tersebut terlihat isolat pembanding (G 3-4) lebih baik daripada isolat yang diuji (P05-R1S). Bobot kering tanaman sangat dipengaruhi oleh absorbsi akar terhadap unsur hara yang tersedia dalam tanah. Inokulasi mikrob nyata dapat meningkatkan bobot kering bagian atas tanaman. Hal ini dapat dihubungkan dengan peningkatan serapan hara oleh akar yang sudah terinfeksi oleh mikrob. Selain itu peningkatan jumlah daun juga mempengaruhi BKTBA karena dapat meningkatkan hasil fotosintat dari proses fotosintesis. Dari tabel 15 dapat dilihat bahwa perlakuan kontrol +N memberikan peningkatan jumlah daun paling tinggi dibandingkan dengan pemberian isolat. Pengaruh isolat Rh Ac 5 berbeda nyata dengan kontrol –N tetapi tidak berbeda nyata dengan kontrol +N. Hal ini menunjukkan bahwa penggunaan isolat Rh Ac 5 setara dengan penggunaan pupuk Monophotasiumfosfat 0.1 kg/l dan lebih baik daripada kontrol -N.
Sedangkan penelitian Sihono (2005)pada tanaman A. crassicarpa dengan perlakuan isolat Rhizobium tidak berbeda nyata terhadap kontrol – N maupun kontrol + P tetapi terjadi peningkatan BKTBA sebesar 57.68%terhadap kontrol – N. Dibandingkan dengan hasil yang didapatkan Sihono (2005) terlihat bahwa hasil penelitian ini lebih tinggi.
Penelitian Elfiati (2004) pada tanaman sengon dengan menginokulasikan
Rhizobium dapat meningkatkan serapan N dan bobot kering tanaman. Hal ini
dapat dilihat pada isolat GR 2-7 dan GR 3-4 yang diinokulasikan cukup efektif pada tanah Ultisol. Hal ini terbukti dengan lebih tingginya bobot kering tanaman yang dihasilkan dibanding dengan tanaman yang diberi pupuk N.
Perbedaan tanggap pertambahan bobot kering tanaman bagian atas relatif semai A. Crassicarpa akibat inokulasi Rhizobium disajikan pada Gambar 2.
-0.10 0.20 0.30 0.40 0.50 0.60 0.70 0.80 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 isolat BKA -0,20 0,40 0,60 0,80 1,00 1,20 1,40 1,60 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 isolat BKT BA Keterangan : 1 = P06-R2N 6 = P05-R1S 11 = Rh Ac 4 2 = P08-R2N 7 = P07-R1S 12 = Rh Ac 5 3 = P09 R2N 8 = P07-R2S 13 = G 3-4 4 = P10-R2N 9 = P08-R1S 14 = Kontrol – N 5 = P13-R2N 10 = P10-R1S 15 = Kontrol + N
Gambar 1. Pengaruh inokulasi isolat Rhizobium terhadap BKA dan BKTBA bibit
A.crassicarpa umur 8 MST.
Perlakuan isolat Rhizobium juga berpengaruh positif terhadap peningkatan Bobot Kering Akar (BKA) akibat perlakuan P05-R1S dan G 3-4 sebesar 17 kali dan 15 kali kontrol -N (Tabel 15 dan Gambar 1). Dilihat dari kemampuan isolat meningkatkan BKA, isolat yang diuji P05-R1S lebih efektif daripada isolat pembanding G 3-4. Meningkatnya BKA pada tanaman yang diinokulasikan menunjukkan terjadinya peningkatan translokasi fotosintat ke akar yang lebih baik dibandingkan pada semai yang tidak diinokulasi. Hal ini sejalan dengan kekompakan akar dan diameter karena semakin kokoh akar suatu tanaman menunjukkan jumlah cadangan makanan yang disimpan dalam batang telah memadai dan bibit aksia telah siap dipindahkan ke lapangan. Perlakuan inokulasi
Rhizobium berpengaruh terhadap kekompakan akar. Isolat pembanding Rh Ac 5
memiliki kemampuan meningkatkan kekompakan akar lebih besar daripada isolat yang diuji P05-R1S, dilihat dari persentase peningkatan sebesar 737% akibat Rh Ac 5 dan 705% akibat P05-R1S dibanding kontrol -N. Sedangkan pada diameter batang isolat P05-R1S dan Rh Ac 5 meningkatkan diameter batang sebesar 137% dan 129% dibanding kontrol –N.
4.5.1.2 Tinggi Tanaman, Jumlah Daun, Bobot Kering Tanaman Bagian Atas (BKTBA), Bobot Kering Akar (BKA), Diameter Batang dan Kekompakan Akar A. mangium
Hasil uji Duncan taraf 5% menunjukkan bahwa perlakuan isolat
BKTBA, BKA, diameter batang dan kekompakan akar. Pengaruh isolat
Rhizobium disajikan pada Tabel 16.
Tabel 16. Pengaruh inokulasi isolat Rhizobium terhadap beberapa parameter yang digunakan pada pertumbuhan bibit A. mangium 8 MST.
Perlakuan Tinggi (cm) Jumlah daun BKTBA g tan -1 BKA g tan -1 Diameter batang (mm) Kekompakan akar M32-R1N 14.85b 1.24bc 0.76bc 0.37b 3.00b 53.00bcd M33-R2N 15.05b 1.80c 0.72bc 0.42b 2.18b 55.20bcd M39-R2N 12.50b 1.12bc 0.75bc 0.45b 2.14b 58.00cd M41-R1N 11.82b 1.00bc 0.77bc 0.42b 2.37b 51.60bcd M45-R2N 15.00b 1.48bc 0.94c 0.54b 2.75b 60.60d M32-R1S 12.51b 1.08bc 0.71bc 0.37b 2.69b 48.00bc M33-R1S 14.00b 0.96bc 0.66b 0.43b 2.61b 59.60d M38-R1S 13.37b 1.16bc 0.74bc 0.48b 2.83b 46.20b M38-R2S 14.16b 1.48bc 0.79bc 0.53b 2.76b 55.40bcd M40-R1S 14.50b 1.40bc 0.77bc 0.46b 2.72b 56.40bcd sRh Ac 1 12.52b 1.00bc 0.67b 0.48b 2.18b 51.80bcd Rh Ac 4 14.11b 0.88b 0.62b 0.40b 2.83b 55.20bcd G 3-4 13.13b 1.00bc 0.75bc 0.42b 2.86b 52.60bcd Kontrol -N 3.90a 0.00a 0.04a 0.04a 1.10a 10.00a
Kontrol +N 14.23b 1.56bc 0.66b 0.32b 2.19b 50.40bcd
*=angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata menurut uji lanjut Duncan taraf α= 0.05%
Dari Tabel 16 terlihat bahwa isolat yang diuji memiliki nilai rataan tertinggi daripada isolat pembanding. Hal ini dapat dilihat isolat M33-R2N berpengaruh nyata terhadap tinggi, jumlah daun, BKTBA, BKA, diameter batang dan kekompakan akar. Akan tetapi jika dibandingkan dengan inokulasi Rhizobium pada A. crassicarpa, nilai rataan terhadap parameter yang diamati pada A.
crassicarpa lebih tinggi daripada A. mangium.
Pertambahan tinggi semai berbeda nyata dengan perlakuan M33-R2N dan Rh Ac 4 sebesar 286% dan 262% terhadap kontrol –N tetapi tidak berbeda nyata terhadap kontrol +N (Tabel 16). Peningkatan ini diduga karena isolat tersebut mampu menghasilkan IAA yang lebih baik yang dapat menunjang pembentukan bintil akar yang lebih baik mengikat N2 dari udara sehingga menunjang
pertumbuhan tanaman.
Peningkatan bobot kering tanaman bagian atas memiliki hubungan dengan jumlah daun. Perlakuan isolat Rhizobium terhadap jumlah daun tidak berbeda nyata dengan kontrol +N, tetapi terjadi peningkatan jumlah daun sebesar 15% akibat inokulasi M33-R2N . Terbatasnya jumlah daun menyebabkan karbon hasil fotosintesis tidak dapat dialokasikan untuk simbion di akar, fotosintat lebih