A. Definisi Transportasi Ikan Secara Kering
Transportasi ikan hidup pada dasarnya adalah memaksa menempatkan ikan dalam suatu lingkungan baru yang berlainan dengan lingkungan asalnya dan disertai perubahan-perubahan sifat lingkungan yang sangat mendadak (Hidayah 1998). Ada dua sistem transportasi yang digunakan untuk hasil perikanan hidup di lapangan. Sistem transportasi tersebut terdiri dari transportasi sistem basah dan transportasi sistem kering (Junianto 2003).
Pada kesempatan kali ini, penyusun hanya akan membahas transportasi ikan secara kering. Menurut Achmadi (2005), transportasi ikan hidup tanpa media air (sistem kering) merupakan sistem pengangkutan ikan hidup dengan media pengangkutan bukan air. Pada transportasi ikan hidup tanpa media air, ikan dibuat dalam kondisi tenang atau aktivitas respirasi dan metabolismenya rendah. Transportasi sistem kering ini biasanya menggunakan teknik pembiusan pada ikan atau ikan dipingsankan (imotilisasi) terlebih dahulu sebelum dikemas dalam media tanpa air (Suryaningrum et al. 2007).
Pada transportasi ikan hidup sistem kering perlu dilakukan proses penenangan terlebih dahulu. Kondisi ikan yang tenang akan mengurangi stress, mengurangi kecepatan metabolisme dan konsumsi oksigen. Pada kondisi ini tingkat kematian selama transportasi akan rendah sehingga memungkinkan jarak transportasi dapat lebih jauh dan kapasitas angkut dapat ditingkatkan lagi. Metode penanganan ikan hidup dapat dilakukan dengan cara menurunkan suhu air atau dapat juga menggunakan zat anestesi. Perlu diperhatikan bahwa ikan yang akan dipingsankan ini nantinya akan dikonsumsi, sehingga pemilihan metode imotilisasi harus memperhatikan aspek kesehatan (Nitibaskara et al. 2006).
Syarat utama dalam pengangkutan ikan hidup adalah kesehatan ikan. Ikan harus dalam keadaan sehat, tidak berpenyakit dan dalam kondisi prima. Ikan yang sehat dan bugar biasanya sangat gesit, aktif, responsif sesuai dengan karakter masing-masing ikan (Nitibaskara et al. 2006). Menurut Achmadi (2005), ikan dalam keadaan hidup normal memiliki ciri-ciri reaktif terhadap rangsangan luar, keseimbangan dan kontraksi otot normal. Ikan yang kurang sehat atau lemah mempunyai daya tahan hidup yang rendah dan peluang untuk mati selama pemingsanan dan pengangkutan lebih besar (Sufianto 2008).
Menurut Achmadi (2005), ikan hidup yang akan dikirim dipersyaratkan dalam keadaan sehat dan tidak cacat. Pemeriksaan kondisi kesehatan ikan selalu dilakukan untuk mengurangi kemungkinan mortalitas yang tinggi, sedangkan adanya cacat seperti cacat sirip, mata, kulit rusak dan sebagainya dapat menurunkan harga.
B. Penanganan Pra Transportasi
Prinsip dari penanganan ikan hidup adalah mempertahankan kelangsungan hidup ikan semaksimal mungkin sampai ikan tersebut diterima oleh konsumen. Terdapat beberapa tahap penanganan untuk mencapai maksud tersebut yaitu penanganan ikan sebelum diangkut, selama pengangkutan dan setelah pengangkutan (Junianto 2003).
Menurut Arie (2000), terdapat beberapa kegiatan penanganan ikan hidup setelah dilakukan pemanenan, yaitu: penyeleksian, penimbangan, pemberokan dan pengangkutan.
1. Penyeleksian
Penyeleksian dilakukan karena dalam satu periode pemanenan biasanya ukuran ikan sangat beragam. Ikan perlu diseleksi dan dipisahkan menurut ukurannya. Ikan yang berukuran kecil sebaiknya dipelihara kembali dalam kolam pembesaran.
2. Penimbangan
Penimbangan ikan yang telah diseleksi ditimbang untuk mengetahui bobot ikan dari satu periode pemeliharaan, maka dari bobot tersebut dapat diketahui pendapatan dan keuntungan yang diperoleh.
3. Pemberokan
Pemberokan dapat diartikan sebagai kegiatan penyimpanan sementara sebelum ikan dipasarkan dengan tujuan untuk membuang kotoran dalam tubuh ikan. Pemberokan dapat dilakukan dalam bak, selama pemberokan ikan tidak diberi pakan. Pemberokan dilakukan selama 24 jam untuk perjalanan yang lebih dari 12 jam (Mangunkusumo 2009). Pemberokan dilakukan 1-2 hari untuk ikan ukuran konsumsi (Junianto 2003). 4. Pembiusan Ikan
Kondisi pingsan adalah kondisi tidak sadar yang dihasilkan oleh proses terkendali dari sistim syaraf pusat yang mengakibatkan turunnya kepekaan terhadap rangsangan dari luar dan rendahnya respon gerak dari rangsangan tersebut. Bahan pemingsan atau anestesi yang ideal adalah anestesi yang mampu memingsankan ikan kurang dari tiga menit dan menyadarkan kembali kurang dari lima menit.
5. Pengangkutan
Pengangkutan untuk ikan konsumsi dapat diangkut dengan berbagai cara, tergantung tujuan pasar lokal, luar daerah ataupun ekspor. Angkutan lokal biasanya menggunakan sistem basah, sedangkan untuk luar daerah yang jauh dan ekspor dilakukan dengan sistem kering.
C. Wadah dan Media Pengisi yang Digunakan
Wadah memegang peranan penting dalam transportasi ikan. Adanya wadah membantu mencegah dan mengurangi kerusakan, melindungi isi yang ada di dalamnya, melindungi dari pencemaran dan gangguan fisik. Selain itu pengemasan dalam wadah juga berfungsi untuk mempermudah penyimpanan, pengangkutan, dan distribusi ikan. Konstruksi wadah dan bahan isolasi yang dipakai untuk menyimpan dan mengangkut ikan memegang peranan penting dalam mempertahankan mutu ikan (Prasetiyo, 1993).
Kotak styrofoam digunakan sebagai wadah pengangkut dalam transportasi ikan hidup untuk menghindari penetrasi panas yang dapat merubah suhu di dalam kotak pengemas. Sifat insulator dari styrofoam ini terjadi karena konduktivitas dari styrofoam yang relatif rendah jika dibandingkan bahan-bahan lain yaitu sebesar 0,0433kg/m jam 0C (Ilyas, 1983).
Pengangkutan ikan hidup sistem media bukan air menggunakan bahan pengisi atau media. Macam bahan pengisi yang dapat digunakan antara lain sekam padi, serutan kayu, serbuk gergaji dan rumput laut. Fungsi utama bahan pengisi dalam pengangkutan hidup media bukan air adalah untuk mencegah udang atau lobster hidup agar tidak bergeser dalam kemasan, menjaga lingkungan suhu rendah agar udang tetap pingsan atau imotil dan memberi lingkungan udara yang memadai untuk kelangsungan hidup udang atau lobster. Bahan media kemasan yang digunakan harus memperhatikan kestabilan suhu media kemasan. Suhu media kemasan harus dapat dipertahankan serendah mungkin mendekati titik imotil. Hal ini disebabkan suhu media kemasan berperan dalam mempertahankan tingkat terbiusnya udang atau lobster selama pengangkutan sehingga ikut mempertahankan ketahanan hidup udang atau lobster dalam media bukan air (Junianto 2003). Menurut Suryaningrum et al. (1994), suhu akhir media ideal untuk transportasi sistem kering sebaiknya tidak lebih dari 200C.
Bahan pengisi yang paling efektif dan efisien dalam pengangkutan organisme hidup adalah serbuk gergaji karena teksturnya baik dan seragam. Serbuk gergaji yang akan digunakan diberi perlakuan terlebih dahulu untuk menghilangkan kotoran atau terpenten (bau) yaitu dengan pencucian dan perendaman (Junianto 2003).
Secara umum ketebalan serbuk gergaji yang digunakan berkisar antara 0,5 cm sampai 10 cm. Menurut Junianto (2003), pada dasar wadah diisi bahan pengisi yang disebar merata membentuk lapisan tipis dengan tebal 0,5-1 cm. Menurut Nitibaskara et al. (2006), lapisan dasar wadah ditaburkan serbuk gergaji dengan tebal 10-15 cm. Menurut Suryaningrum et al. (2004), di atas koran ditaburi serbuk gergaji dingin dengan ketebalan 5-10 cm, sehingga kontak langsung antara ikan dan es dapat dihindari.
Menurut Srikirishnadhas dan Kaleemur (1994), penggunaan serbuk gergaji sebagai media kemasan dapat dikombinasikan dengan jerami atau sisa potongan karung goni. Bahan-bahan tersebut sebelum digunakan didinginkan dalam freezer, setelah Bahan-bahan pengisi disiapkan maka perlu disiapkan es batu untuk membantu menjaga suhu kemasan tetap rendah. Pada lapisan dasar kotak pengemas disebarkan serbuk gergaji kira-kira 0,5 cm, kemudian di atasnya ditempatkan lapisan jerami.
D. Proses Immotilisasi
Menggunakan Suhu Rendah
Imotilisasi (pembiusan) merupakan salah satu metode yang diguanakan untuk menekan metabolisme ikan sehingga mampu mempertahankan hidup lebih lama dengan berkurangnya aktivias ikan selama transportasi. Metode ini menggunakan prinsip hibernasi, yaitu usaha untuk menekan metabolisme lobster sehingga masuk ke dalam metabolisme basal atau dapat bertahan dalam kondisi minimum (Junianto 2003). Imotilisasi dapat dilakukan salah satunya dengan menggunakan suhu rendah. Suhu air yang rendah dapat menurunkan aktifitas dan tingkat konsumsi oksigen ikan (Coyle et al. 2004).
Nitibaskara et al. (2006) menyatakan bahwa pemingsanan dengan suhu rendah dapat dibagi menjadi dua katagori, yaitu pemingsanan dengan penurunan suhu secara bertahap dan pemingsanan dengan suhu rendah secara langsung. Pemingsanan udang dengan penurunan suhu secara bertahap dilakukan dengan cara menurunkan suhu dengan kecepatan 50C/jam hingga mencapai suhu 150C, dan pada suhu ini udang dipertahankan selama 15 menit. Pada pemingsanan udang dengan suhu rendah secara langsung dilakukan dengan cara memasukkan udang secara langsung ke dalam air dingin bersuhu 180C selama 15 menit. Pada imotilisasi ikan dengan suhu rendah, suhu diturunkan sedemikian rupa sehingga diperoleh kondisi ikan dengan aktivitas ikan seminimal mungkin akan tetapi masih dapat hidup dengan sehat setelah mengalami pembugaran kembali (Wibowo 1993 dalam Prasasti 2010).
Imotilisasi dengan suhu rendah merupakan cara yang paling efektif, ekonomis dan aman dalam mempersiapkan transportasi lobster air tawar (Suryaningrum et al. 2007). Es batu sering digunakan sebagai bahan pembius karena harganya yang relaif murah, mudah didapat dan aman karena tidak mengandung bahan kimia yang dapat membahayakan manusia. Penurunan suhu dapat dilakukan dengan merendam es batu dalam kantong plastik pada air bak pemingsanan (Nitibaskara et al. 2006). Suhu dingin merupakan salah satu kunci dalam transportasi ikan hidup, pada kondisi ini tingkat metabolisme dan respirasi sangat
rendah sehingga ikan atau crustacea dapat diangkut dengan waktu yang lama dan tingkat kelulusan hidup yang tinggi (Berka 1986, diacu dalam Suryaningrum et al. 2007).
Lama pembiusan yang terjadi pada proses pembiusan berbeda-beda. Hal ini disebabkan fase panik yang terjadi saat proses pembiusan. Menurut Karnila dan Edison (2001), fase panik tersebut dipengaruhi oleh suhu pembiusan. Pada fase panik, respirasi akan meningkat dengan tajam kemudian turun sampai mencapai respirasi terendah yang menyebabkan ikan pingsan. Tingkat respirasi yang cukup rendah menyebabkan lobster terganggu keseimbangannya sehingga lobster tidak dapat menyangga tubuhnya sendiri dan jatuh dengan posisi tubuh miring (Suryaningrum et al. 2007). Pada kondisi shock, ikan banyak melakukan gerakan yang berlebihan pada saat proses pembiusan. Kondisi shock tersebut menyebabkan ikan cepat mengalami kematian karena ikan yang stres akan mengalami peningkatan asam laktat dalam darah. Jika asam laktat terakumulasi dalam darah cukup tinggi akan mempercepat terjadinya proses kematian (Afrianto dan Liviawaty 1989, dalam Prasasti, 2010).
Parameter penting dalam pembiusan pada suhu rendah yang cukup berpeluang dalam menunjang kelulusan hidup ikan adalah metode pembiusan, waktu pembiusan dan suhu pembiusan yang digunakan (Suryaningrum et al. 1994). Imotilisasi dengan suhu rendah memiliki keuntungan diantaranya ekonomis karena es mudah didapat dan aman karena tidak terdapat residu bahan kimia (Suryaningrum et al. 1997). Ada beberapa keuntungan dan kerugian metode imotilisasi dengan penurunan suhu langsung dan bertahap. Pemingsanan dengan penurunan suhu secara bertahap dapat menimbulkan stress pada ikan dan memerlukan waktu yang panjang hingga ikan pingsan, sedangkan dengan penurunan suhu secara langsung dapat mengurangi stress selama proses pemingsanan dan mempercepat proses pemingsanan (Nitibaskara et al. 2006).
Tingkat keberhasilan transportasi ikan hidup diukur dari besarnya nilai tingkat kelulusan hidupnya (survival) atau nilai kematiannya (mortalitas). Pada transportasi ikan hidup sistem kering, setelah ikan ditransportasikan kemudian ikan disadarkan kembali (proses pembugaran) dengan aerasi secara terus menerus untuk mengetahui tingkat kelulusan hidupnya. Proses pembugaran bertujuan untuk memulihkan kembali kondisi ikan. Suhu media pembugaran disesuaikan dengan habitat ikan (Achmadi 2005).
Beberapa komoditas hasil perikanan yang dapat ditransportasikan dalam keadaan hidup dan dikemas dalam media tanpa air (transportasi sistem kering) menggunakan metode pembiusan suhu rendah adalah ikan, lobster dan udang. Udang yang memiliki nilai jual yang tinggi di Jepang, yaitu Penaeus japonicas, karena udang tersebut ditransportasikan hidup
dengan pembiusan suhu rendah dalam kemasan serbuk gergaji dingin (Shigueno 1975, diacu dalam Salin 2005).
Beberapa Penaeid lainnya diantaranya adalah Penaeus esculentus (Haswell), P. monodon (Fabricus), P. semisulcatus (De Haan) dan Melicertus (Penaeus) plebejus (Hess) telah dicoba di Australia sebagai spesies alternatif untuk M. japonicus dalam pemasaran hidup ke Jepang (Goodrick, Paterson dan Grauf 1995, diacu dalam Salin 2005). Menurut Salin dan Vadhyar (2001) percobaan penyimpanan hidup P. monodon tanpa media air dengan suhu pembiusan 14 ± 10C dalam serbuk gergaji dingin telah sukses. Teknologi pengangkutan hidup yang sama tersebut juga telah dicobakan pada udang air tawar. Udang air tawar hidup biasanya masih menggunakan media pengangkutan air yang kurang aman, beresiko tinggi dan kurang efisien. Transportasi dengan sistem kering dapat menjadi pilihan tepat, apabila kondisi optimalnya diketahui dan merupakan cara yang efisien dan aman meskipun beresiko tinggi.
Menggunakan Anestesi
Anestesi merupakan suatu kondisi ketika sebagian atau seluruh tubuh kehilangan kemampuan kesadaran. Hal ini disebabkan oleh pengaruh zat atau obat yang dimasukkan ke dalam tubuh tersebut mempengaruhi sistem syaraf. Pada bagian tubuh yang diberikan suatu zat atau obat maka bagian tubuh tersebut akan kehilangan kemampuan untuk merespon rangsangan dari luar. Selain kehilangan respon, anestesi dapat pula menyebabkan kehilangan kesadaran. Zat atau obat anestesi dapat dimasukkan ke dalam tubuh dengan cara disuntik, dihisap, maupun bersinggungan secara langsung dengan anggota tubuh (Furlong 2004 dalam Nasution 2012).
Anestesi dapat disebabkan adanya pengaruh dari senyawa-senyawa kimia, suhu yang dingin, arus listrik, dan penyakit. Anestesi yang terjadi pada sistem syaraf pusat menyebabkan organisme tidak sadar atau pingsan (Achmadi 2005). Pengunaan bahan anestesi berupa zat anestesi yang diberikan pada ikan bekerja melalui impuls syaraf dengan menghambat pengiriman ion natrium selektif pada memban syaraf sehingga menurunkan tingkat metabolisme (Stoskopf 1993 dalam Abid et al 2014). Bahan anstesi yang digunakan merupakan bahan kimia organic tanman tingkat tinggi hasil metabolit sekunder seperti saponin dan retenone (Abid et al 2014).
Gangguan keseimbangan ionik yang disebabkan adanya sianida yang akan menginaktivasi enzim sitokrom dalam sel mitokondria dengan mengikat ion Fe3+/Fe2+ yang terkandung dalam enzim. Adanya pengikatan ion Fe3+/Fe2+ akan menyebabkan biota mati
rasa (pingsan) akibat kinerja syaraf kurang berfungsi. Pembiusan (anestesi) akan menyebabkan penurunan laju respirasi pada ikan, hal ini sangat menguntungkan dalam praktek transportasi (Franz, 2004 dalam Nasution, 2012).
Anestesi menurut Mckelvey dan Hollingshead (2003) ada 4 tahapan, tahap pertama atau sering disebut stadium analgesia, hewan masih sadar tetapi disorientasi dan menunjukkan sensitivitas terhadap rasa sakit berkurang, respirasi dan denyut jantung normal atau meningkat, semua reflek masih ada, hewan masih bangun dan dapat juga urinasi, defekasi. Tahap kedua yaitu kesadaran mulai hilang namun refleks masih ada, pupil membesar (dilatasi) tetapi akan menyempit (konstriksi) ketika ada cahaya masuk. Tahap kedua atau stadium eksitasi berakhir ketika hewan menunjukkan tanda-tanda otot relaksasi, respirasi menurun dan refleks juga menurun. Tahap ketiga atau stadium anestesi, pada stadium ini biasanya dilakukan operasi. Hewan kehilangan kesadaran, pupil mengalami konstriksi dan tidak merespon cahaya yang masuk, refleks hilang (refleks palpebrae). Tahapan keempat adalah pernafasan dan jantung terhenti, dan hewan mati. Indikator tahapan anestesi antara lain aktivitas refleks (refleks palpebrae, pedal refleks, cornea refleks, refleks laring, refleks menelan), relaksasi otot, posisi mata dan ukuran pupil, sekresi saliva dan air mata, respirasi dan denyut jantung.
Menurut Harms (1998), anestesi pada ikan dilakukan untuk pemeriksaan, transportasi, diagnostik dan operasi. Prosedurnya yaitu menyiapkan air, memeriksa kondisi ikan, mengistirahatkan ikan. Anestesi untuk ikan biasanya penggunaannya melalui air (perendaman), dan bisa juga dengan cara anestesi inhalasi (seperti anestesi gas pada mamalia). Anestesi melalui injeksi efektif digunakan pada mamalia dan tidak efektif pada ikan. Faktor-faktor yang mempengaruhi respon penggunaan anestetikum antara lain spesies, kualitas air dan status kesehatan ikan. Berbeda spesies berbeda juga responnya, spesies dengan berat badan yang berbeda akan menimbulkan respon yang berbeda pula. Ikan dengan berat badan yang lebih besar akan menimbulkan respon yang lebih efektif. Ikan dengan lapisan lemak yang tinggi, ikan yang berumur tua, dan ikan betina gravid (berproduksi) akan memperpanjang durasi dan recovery akan semakin lama apabila menggunakan anestetikum yang mudah larut seperti MS-222 atau benzocaine. Kualitas air seperti temperatur sangat mempengaruhi tetapi polanya tidak dapat dipercaya, misalnya MS-222 dan benzocaine memerlukan suhu tinggi untuk dosis yang tinggi. Keasaman juga mempunyai efek terhadap respon anestetikum, contohnya sebagian besar anestetikum bekerja pada air laut tetapi barbiturat bersifat antagonis terhadap ion Ca2+. Nilai pH juga mempengaruhi ionisasi obat
sehingga efek obat menjadi meningkat. Ikan yang sakit akan menjadi subjek yang jelek pada proses anestesi (Ferguson 1988).
Anestetikum yang digunakan pada ikan banyak jenisnya, misalnya ethanol, diethyl ether, halothane, lidocaine, tricaine methanesulfonate (MS-222), eugenol, ketamin, metomidate, propofol, and carbon dioxide. Dua diantaranya yang sering digunakan sekarang adalah tricaine methanesulfonate (MS-222) dan eugenol. Isofluran digunakan sebagai anestesi inhalasi pada mamalia dan burung, dapat juga untuk ikan dengan cara dicampurkan ke dalam air meskipun ada juga efek sampingnya (Harms 1998).
Berikut adalah klasifikasi respon dan tingkah laku ikan selama anastesi menurut Bowser (2001).
Tabel 1. Klasifikasi Respon dan Tingkah Laku Ikan selama Pembiusan
Tahapan Sinonim Respon tingkah laku ikan
0 Normal Kesadaran ada; opercular rate dan otot
normal
1 Awal Sedasi Mulai kehilangan kesadaran; opercular rate sedikit menurun; keseimbangan normal 2 Sedasi total Kehilangan kesadaran total; penurunan
opercular rate; keseimbangan menurun 3 Kehilangan
sebagian keseimbangan
Sebagian Otot mulai relaksasi; berenang tidak teratur; peningkatan opercular rate; bereaksi hanya ketika ada tactile yang kuat dan rangsangan getaran
4 Kehilangan
keseimbangan total
Kehilangan keseimbangan dan otot secara total; lambat tetapi teratur opercular rate; kehilangan refleks spinal
5 Kehilangan refleks Kehilangan kesadaran total; opercular lambat dan tidak teratur; denyut jantung sangat lambat; kehilangan refleks
6 Medulla kolaps (stadium asphyxia)
Opercular berhenti bergerak; jantung menahan biasanya diikuti dengan gerakan cepat.
E. Macam-Macam Metode Penurunan Suhu Rendah
Imotilisasi menggunakan suhu rendah memiliki dua metode yaitu imotilisasi dengan penurunan suhu bertahap dan imotilisasi dengan penurunan suhu langsung. Penurunan suhu sampai batas tertentu akan menurunkan tingkat metabolisme dan akhirnya akan menyebabkan ikan pingsan. Fase pingsan merupakan fase yang dianjurkan untuk pengangkutan ikan, karena pada fase ini aktivitas ikan relatif akan berhenti (Mc Farland 1959, diacu dalam Achmadi
Penurunan Suhu Secara Bertahap
Metode imotilisasi dengan penurunan suhu secara bertahap, yaitu ikan dimasukkan ke dalam air yang beraerasi kemudian diimotilisasi dengan menurunkan suhu air secara bertahap sampai suhu tertentu (Nitibaskara et al. 2006). Pada suhu tertentu yang dikehendaki, ikan dipertahankan di dalam air selama waktu tertentu sampai ikan imotil. Pada penurunan suhu bertahap ini ikan secara bertahap direduksi aktivitas, respirasi dan metabolismenya sampai mencapai titik imotil yang diperlukan (Nitibaskara et al. 2006). Selain itu, pada kondisi imotil tersebut aktivitas ikan sudah cukup rendah atau bahkan sudah pingsan sehingga mudah ditangani untuk transportasi (Suryaningrum et al. 2004).
Perubahan perilaku udang windu akibat pembiusan penurunan suhu secara bertahap hingga mencapai suhu pembiusan terbaik 150C disajikan pada tabel 2.
Tabel 2. Perubahan perilaku udang windu akibat pembiusan penurunan suhu secara bertahap Waktu (menit) Suhu (0C) Kondisi dan aktivitas udang
0 26,0 Udang normal, aktif dan berdiri kokoh
10 23,5 Udang masih berdiri, sebagian mulai lamban
19 20,0 Udang mulai tenang, tidak ada pergerakan
25 18,7 Udang melemah, respon mulai berkurang
29 17,5 Sebagian tenang dan lemah
37 16,3 Respon lemah, mulai limbung, sebagian miring 43 15,7 Udang mulai panik, kaki renang masih bergerak lemah
52 15,0 Udang merebah, semakin lemah, pingsan
Adapun respon fisiologis lobster air tawar terhadap penurunan suhu yang dilakukan secara bertahap disajikan pada Tabel 3.
Tabel 3. Respon aktivitas fisiologis lobster air tawar pada berbagai suhu
No Suhu (0C) Kondisi dan aktivitas udang
1 30,4 – 25,4 Lobster bergerak aktif, kaki jalan, kaki renang dan kaki capit bergerak aktif, lobster cenderung bergerombol (normal)
2 25,4 – 19,4 Aktivitas lobster mulai berkurang, kaki jalan, kaki renang dan kaki capit bergerak perlahan-lahan, ekor melipat ke dalam, lobster cenderung diam (tenang)
3 19,4 – 15,4
Lobster gelisah, bergerak tidak beraturan dengan menyentak-nyentakkan tubuhnya mundur ke belakang, setelah panik lobster tenang kembali, respon terhadap rangsang lemah (panik)
4 15,4 – 12,9
Lobster mulai hilang keseimbangan, gerakan lobster lemah, respon terhadap rangsangan lemah, ketika posisi tubuh dibalik tidak dapat tegak kembali
5 12,9 – 10,4 Lobster hilang keseimbangan, posisi tubuh rebah atau terbalik, kaki jalan dan kaki renang diam
6 10,4 – 9,8
Keseimbangan lobster tidak ada, posisi tubuh terbalik, kaki jalan, kaki renang dan capit kaku tidak bergerak, ekor melipat kea rah abdomen, respon terhadap rangsangan tidak ada (pingsan)
Sumber: Wibowo et al. (2005), diacu dalam Suryaningrum et al. (2007)
Menurut Setiabudi et al. (1995), perubahan-perubahan tingkah laku tersebut disebabkan adanya perubahan suhu. Menurut Phillips et al. (1980), diacu dalam Suryaningrum et al. (1997), laju konsumsi oksigen hewan air akan menurun dengan menurunnya suhu media. Penurunan konsumsi oksigen pada lobster akan mengakibatkan jumlah oksigen yang terikat dalam darah semakin rendah. Keadaan ini akan mengakibatkan suplai oksigen ke jaringan syaraf juga berkurang sehingga menyebabkan berkurangnya aktivitas fisiologis dan lobster menjadi lebih tenang (Suryaningrum et al. 1997).
Lama pembiusan yang terjadi pada proses pembiusan berbeda-beda. Hal ini disebabkan fase panik yang terjadi saat proses pembiusan. Menurut Karnila dan Edison (2001), fase panik tersebut dipengaruhi oleh suhu pembiusan. Ikan sangat sensitif dengan adanya perubahan suhu air (Subasinghe 1997). Pada fase panik, respirasi akan meningkat dengan tajam kemudian turun sampai mencapai respirasi terendah yang menyebabkan ikan pingsan. Tingkat respirasi yang cukup rendah menyebabkan lobster terganggu keseimbangannya sehingga lobster tidak dapat menyangga tubuhnya sendiri dan jatuh dengan posisi tubuh miring (Suryaningrum et al. 2008).
Pada kondisi shock, ikan banyak melakukan gerakan yang berlebihan pada saat proses pembiusan. Kondisi shock tersebut menyebabkan ikan cepat mengalami kematian karena ikan yang stres akan mengalami peningkatan asam laktat dalam darah. Jika asam laktat terakumulasi dalam darah cukup tinggi akan mempercepat terjadinya proses kematian (Afrianto dan Liviawaty 1989, diacu dalam Utomo 2001). Faktor lingkungan dapat menjadi salah satu faktor penyebab stress pada ikan (Lerner 2004).
Parameter penting dalam pembiusan pada suhu rendah yang cukup berpeluang dalam menunjang kelulusan hidup ikan adalah metode pembiusan, waktu pembiusan dan suhu pembiusan yang digunakan (Suryaningrum et al. 1994). Imotilisasi dengan suhu rendah memiliki keuntungan diantaranya ekonomis karena es mudah didapat dan aman karena tidak terdapat residu bahan kimia (Suryaningrum et al. 1997).
Penurunan Suhu Secara Langsung
Metode imotilisasi dengan penurunan suhu secara langsung, yaitu dilakukan dengan cara memasukkan ikan hidup dalam media air dingin pada suhu tertentu selama waktu
jenis ikan. Melalui imotilisasi dengan penurunan suhu secara langsung ini ikan akan mengalami shock dan langsung berada dalam tingkat aktivitas, respirasi dan metabolisme yang rendah. Selain itu, pada kondisi imotil tersebut aktivitas ikan sudah cukup rendah atau bahkan sudah pingsan sehingga mudah ditangani untuk transportasi (Nitibaskara et al. 2006).
Berikut adalah contoh tingkah laku ikan mas selama proses pemingsanan dengan suhu rendah 80C secara langsung dapat dilihat pada tabel 4.
Tabel 4. Tingkah laku ikan mas selama proses pemingsanan dengan suhu rendah 80C Waktu (menit) Suhu (0C) Kondisi dan aktivitas ikan mas
0 8 Aktivitas normal
5 8 Ikan kelihatan panik, bergerak tidak beraturan
10 8 Ikan shock ditandai dengan gerakan tak terkendali, kemudian ikan mulai oleng
15 8 Ikan rebah disertai operkulum bergerak lambat. Ikan tidak bergerak jika disentuh
20 8 Tidak ada aktivitas, operkulum bergerak lemah disertai terjadinya kekejangan otot yang mulai kaku
Sumber: Jailani (2000)
Ikan mas yang dipingsankan dengan suhu rendah secara langsung pada suhu 80C dan
dikemas dalam styrofoam berukuran 30x30x40 cm3 dengan kepadatan 5 ekor ikan selama 5 jam memiliki tingkat kelulusan hidup 40 % (Jailani 2000). Udang yang dipingsankan pada suhu 180C secara langsung selama 15 menit memiliki tingkat kelulusan hidup sebesar 40 %
setelah dikemas selama 22 jam (Nitibaskara et al. 2006). Udang windu tambak yang dibius menggunakan suhu rendah secara langsung pada suhu 17-190C dapat dipertahankan
kelangsungan hidupnya sebesar 93,75 % di dalam media serbuk gergaji dingin dalam uji transportasi selama 16 jam (Setiabudi et al. 1995). Lobster hijau pasir (Panulirus homarus) yang dibius menggunakan suhu rendah secara langsung pada suhu 14-15oC selama 20 menit
dapat bertahan hidup selama 20 jam dengan kelulusan hidup 100 % (Suryaningrum at al. 1994).
Pada proses pembugaran udang dan lobster yang hidup akan berenang, mula-mula udang atau lobster akan limbung tetapi kondisinya akan normal kembali setelah berada dalam air selama 30 menit (Suryaningrum et al. 2004). Menurut Achmadi (2005), ikan yang tidak menunjukkan adanya tanda-tanda pergerakan anggota tubuh setelah 10 menit waktu pembugaran dianggap tidak lulus hidup.
Ada beberapa keuntungan dan kerugian metode imotilisasi dengan penurunan suhu langsung dan bertahap. Pemingsanan dengan penurunan suhu secara bertahap dapat menimbulkan stress pada ikan dan memerlukan waktu yang panjang hingga ikan pingsan,
sedangkan dengan penurunan suhu secara langsung dapat mengurangi stress selama proses pemingsanan dan mempercepat proses pemingsanan (Nitibaskara et al. 2006).
F.Bahan Anastesi yang Digunakan
Zat anestesi alami yang dapat digunakan untuk pembiusan ikan adalah liamarin yang terkandung pada biji karet, ekstrak tembakau komersial, ekstrak rumput laut Caulerpa racemosa, dan minyak cengkeh. Ekstrak tembakau komersial mampu memingsankan benih ikan nila merah dan dapat dipulih sadarkan kembali dalam waktu tertentu, sehingga potensial digunakan untuk transportasi benih ikan. Pada konsentrasi 99,59; 125,59; 158,14; dan 200 mg/liter ekstrak tembakau komersil dapat memingsankan beih ikan nila dengan kepadatan 15 ekor per 20 liter media, masing-masing dalam waktu 109,70, 120,92, 136,16, dan 148,31 menit (Taurusman, 1996). Cairan ekstrak Caulerpa racemosa,dalam bentuk cair merupakan antimetabolik alami yang sangat berpengaruh terhadap aktifitas udang windu tambak (Panaeus monodon). Konsentrasi C.racemosa 13,2% merupakan batas terendah yang dapat mempengaruhi aktivitas udang, sedangkan 39,6% merupakan batas tertinggi yang masih dapat ditolerir dan sangat berpengaaruh terhadap aktivitas udang tetapi belum menyebabkan kematian (Hanum, 2000). Menurut Suryanti (1998), pemingsanan ikan nila merah hidup dengan menggunakan minyak cengkeh, konsentrasi terbaik adalah 20 ppm yang dapat memingsankan ikan dalam waktu 35 menit dan lamanya daya tahan hidup dengan kondisi pingsan dala air bersuhu 90C selama 10 jam. Menurut Kuschinsky dan Lullman, (1973) beberapa senyawa dikatakan sebagai bahan anastesik bila dapat memberi efek perubahan yang bersifat balik terhadap sistim syaraf pusat dan menyebabkan hilang kesadaran.
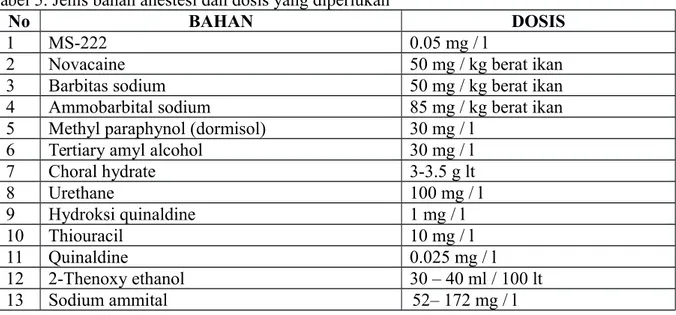
Ferguson (1988) menyatakan bahwa tipe anestesi dari bahan kimia dan anestetikum yang biasa digunakan antara lain anestesi irigasi atau perendaman, jenis anestetikumnya yaitu MS-222, 2-phenoxyethanol dan benzocaine. Anestesi parenteral contoh sediaan anestetikumnya adalah alphaxolone (saffan), propanidid (epontol), sodium pentobarbitone (Nembutal), ketamin hydrochloride (ketalar). Tipe anestesi yang lainnya yaitu dengan elektrik anestesi.
Anestetikum yang digunakan pada ikan banyak jenisnya, misalnya ethanol, diethyl ether, halothane, lidocaine, tricaine methanesulfonate (MS-222), eugenol, ketamin, metomidate, propofol, and carbon dioxide. Dua diantaranya yang sering digunakan sekarang adalah tricaine methanesulfonate (MS-222) dan eugenol. Isofluran digunakan sebagai anestesi inhalasi pada mamalia dan burung, dapat juga untuk ikan dengan cara dicampurkan ke dalam air (Harms 1998).
Tabel 5. Jenis bahan anestesi dan dosis yang diperlukan
No BAHAN DOSIS
1 MS-222 0.05 mg / l
2 Novacaine 50 mg / kg berat ikan
3 Barbitas sodium 50 mg / kg berat ikan
4 Ammobarbital sodium 85 mg / kg berat ikan
5 Methyl paraphynol (dormisol) 30 mg / l
6 Tertiary amyl alcohol 30 mg / l
7 Choral hydrate 3-3.5 g lt 8 Urethane 100 mg / l 9 Hydroksi quinaldine 1 mg / l 10 Thiouracil 10 mg / l 11 Quinaldine 0.025 mg / l 12 2-Thenoxy ethanol 30 – 40 ml / 100 lt 13 Sodium ammital 52– 172 mg / l G. Proses Transportasi
Hal utama yang paling menentukan keberhasilan kegiatan pemanenan ikan adalah proses transportasi yang sanggup mempertahankan kualitas produk hingga akhir tujuan (Serra et al. 2011). Selama proses transportasi berlangsung, ikan akan ditempatkan dalam lingkungan baru yang berlainan dengan lingkungan asalnya disertai perubahan-perubahan sifat lingkungan yang sangat mendadak. Perubahan lingkungan yang sangat mendadak dapat mengakibatkan ikan menjadi stres dan mengalami perubahan tingkah laku (hiperaktif) (Junianto, 2003), sehingga perlu dilakukan teknik dalam proses transportasi. Berikut adalah proses pengangkutan lobster secara kering:
Sistem pengangkutan kering jarak dekat
Sistem kering untuk jarak dekat membutuhkan bahan-bahan sebagai berikut : - Pasir laut halus berdiameter 0,3-0,5 mm.
- Styrofoam ukuran (48 x 33 x 28 cm) - Plastic ukuran 0,5-1 lt.
- Batu es
- Serbuk gergaji
Cara pengangkutan system kering untuk jarak dekat :
- Lobster hidup ditiriskan kemudian dilumuri pasir halus kering pada bagian perutnya.
- Pada dasar stryrofoam diberi batu es yang telah dibungkus kantong plastik kemudian dibungkus serbuk gergaji.
- Di atas bungkusan batu es ditutupi dengan serbuk gergaji sebanyak 2 lapis, kemudian lobster disusun berjejer diatasanya.
- Diatas lobster dilapisi lagi dengan serbuk gergaji.
- Demikian seterusnya jajaran lobster dan serbuk gergaji diatur secara berlapis-lapis. - Pada bagian paling atas setelah ditutup serbuk gergaji diletakan batu es yang
dibungkus plastic dan serbuk gergaji.
- Selanjutnya box stryrofoam ditutup lalu direkat dengan lakban. - Setiap box stryrofoam diisi lobster sebanyak ± 5 kg.
- Waktu pengangkutan selama 4 jam. Sistem pengangkutan kering jarak jauh
Sistem pengangkutan kering untuk jarak jauh membutuhkan bahan-bahan sebagai berikut : - Serbuk gergaji - Stryrofoam ukuran 48 x 33 x 28 cm. - Plastic ukuran 0.5-1 lt. - Batu es - Oksigen gas - Lakban - Thermometer
Cara pengangkutan system kering untuk jarak jauh :
- Lobster yang akan ditransportasikan diadaptasikan dalam air laut bersuhu 19 0C selam 15 menit, penurunan suhu dilakukan dengan menaruh batu es yang telah dibungkus dengan kantong plastic ke dalam wadah yang berisi lobster hidup, kecepatan penurunan suhu ± 2 0C per 10 menit.
- Kemudian lobster dikeluarkan dari wadah dan ditiriskan selama 10 menit, sementara itu boks Styrofoam harus disisapkan.
- Pada dasar boks diisi dengan batu es yang dibungkus plastic dan serbuk gergaji. - Diatas batu es tadi ditutupi lembaran serbuk gergaji.
- Setelah itu setiap lobster dikeringkan dengan lap, setiap ekor lobster yang telah kering kemudian dibungkus dengan serbuk gergaji dan disusun berjajar didalam boks stryrofoam.
- Pada bagian atas tumpukan lobster dilapisi dengan serbuk gergaji.
- Selanjutnya boks stryrofoam diisi dengan oksigen dan ditutup, lalu direkat dengan lakban.
- Setiap boks dapat diisi 10 kg lobster hidup. - Lama pengangkutan sekitar 8-10 jam.
Daftar Pustaka
Abid et al. 2014. Potensi Senyawa Metabolit Sekunder Infusum Daun Durian (Durio zibethinus) Terhadap Kelulushidupan Ikan NIla (Oreochromis niloticus) Pada Trasnportasi Ikan Hiu Sitem Kering. Jurnal Vo. 6 no. 1.
Achmadi D. 2005. Pembiusan ikan nila (Oreochromis niloticus) dengan tegangan listrik untuk transportasi sistem kering [skripsi]. Bogor: Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Arie U. 2000. Pembenihan dan Pembesaran Nila Gift. Jakarta: Penebar Swadaya
Berka, R. 1986. The Transport of Live Fish. A Review . EIFAC Tech. Pap., FAO (48) : 52p.Shigueno, K. 1975. Problem in Prawn Culture. Agriculture Series 19. Rotterdam
Bowser, PR. 2001. Anesthetic Options for Fish. Ithaca: International Veterinary Information Service; AI412.0701
Coyle SD, Durborow RM, Tidwell JH. 2004. Anesthetics in Aquaculture. Southern Regional Aquaculture Center. Publication No 3900.
Ferguson, H. 1988. Anesthesia and treatment. Proceeding Fish Disease 106 23-27 May 1988. The University of Sydney: Post Gradute Committee in Veterinary Science University Of Sydney.
Furlong MW. 2004. Anesthesia. USA: Microsoft Coorporation
Harms, CA. 1998. Anesthesia in fish. Di dalam: Fowler ME and Miller RE. Zoo & Wild Animal Medicine Current Therapy. Philadelphia: Saunders Company. Hlm: 158-163 Hidayah, A. M. 1998. Studi Penggunaan Gas CO2 sebagai bahan Pembius untuk Transportasi
Ikan Nila Merah (Oreochromis sp). Skripsi. FPIK. IPB. Bogor
Jailani. 2000. Mempelajari pengaruh penggunaan pelepah pisang sebagai bahan pengisi terhadap tingkat kelulusan hidup ikan mas (Cyprinus carpio) [skripsi]. Bogor: Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Junianto. 2003. Teknik Penanganan Ikan. Jakarta: Penebar Swadaya
Karnila R, Edison. 2001. Pengaruh suhu dan waku pembiusan bertahap terhadap ketahanan hidup ikan jambal siam (Pangasius sutchi F) dalam ransportasi sistem kering. Jurnal Natur Indonesia III (2): 151-167 (2001).
Kuschinsky, G dan H. Lullman, 1973. Textbook of Marine Farmakologi. Akademic Press. New York.
Lerner A. 2004. Guidelines for the Use of Fishes in Research. Publications Manager American Fisheries Society.
Mc Farland W. N. 1959. A Study of Effect of Anastetic on Behaviour and Phsycology of Fish. Publ. Ins. University of Texas
Mckelvey D, Hollingshead WK. 2003. Veterinary anesthesia and analgesia. United States: Mosby. 464 hal.
Mangunkusumo AS. 2009. Transportasi Ikan Hidup.
http://naksara.net/Aquaculture/Application/transportasi-ikan-hidup.html. [01 Januari 2009]
Nasution HS. 2012. Pemingsanan Lobster Air Tawar (Cherax quadricarinatus) Dengan Ekstrak Akar Tuba (Derris elliptica Roxb. Benth) dan Kelulusan Hidupnya Selama Penyimpanan Dalam Media Serbuk Gergaji. Skripsi. Institut Pertanian Bogor. Bogor.
Nitibaskara R, Wibowo S, Uju. 2006. Penanganan dan Transportasi Ikan Hidup untuk Konsumsi. Bogor: Departemen Teknologi Hasil Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Prasetyo. 1993. Kajian Kemasan Dingin untuk Transportasi Udang Hidup Secara Kering. Thesis pada Jurusan Teknologi Pangan dan Gizi, Fak. Teknologi Pertanian IPB. Bogor.
Salin KR, Vadhyar-Jayasree K. 2001. Effect of different chilling rates for cold anesthetization of Penaeus monodon (Fabricus) on the survival, duration and sensory quality under live storage in chilled sawdust. Aquaculture Research, Volume 32, Issue 2, P: 145. Salin KR. 2005. Live transportation of Macrobrachium rosenbergii (De Man) in chilled
sawdust. Aquaculture Research, Volume 36, Issue 3, P: 300.
Serra M, Wolkers C, Hoshiba MA, Urbinati EC. 2011. Physiological of piau (Leporinus friderici, Bloch 1794) to transportation. Revista Brasileira de Zootecnia 40(12):2641-2645
Setiabudi. E. Y, Sudrajat, M, D. Erlina dan S. Wibowo. 1995. Studi pengguna metoda pembiusan langsung dengan suhu rendah dalam transportasi sistem kering udang windu tambak (Panaeus monodon). J. Penelitian Pasca Panen Perikanan (84):8-21. Srikirishnadhas B, Kaleemur RMd. 1994. Packing of live lobster the Indian experience.
Infofish International (81): 6-21. India.
Subashingshe, S. 1997. Live Fish Handling and Transportation. INFOFISH International 2: 39 – 43.
Sufianto B. 2008. Uji transportasi ikan mas koki (Carassius auratus Linnaeus) hidup sistem kering dengan perlakuan suhu dan penurunan konsentrasi oksigen [tesis]. Bogor: Program Pasca Sarjana, Institut Pertanian Bogor.
Suryanti. 1998. Pemingsanan Ikan Nila Merah (Oreochromis sp) Hidup dengan Perlakuan Suhu Rendah dan Minyak Cengkeh dalam Transportasi Sistem Kering. Skripsi. FPIK. IPB. Bogor.
Suryaningrum TD, Setiabudi E, Muljanah I, Anggawati AM. 1994. Kajian penggunaan metode pembiusan secara langsung pada suhu rendah dalam transportasi lobster hijau pasir (Panulirus homarus) dalam media kering. Jurnal Penelitian Pasca Panen Perikanan 79: 56-72.
Suryaningrum TD, Setiabudi E, Erlina MD. 1997. Pengaruh penurunan suhu bertahap terhadap aktivitas dan sintasan lobster hitam (Panulirus penicullatus) selama transportasi sistem kering. Jurnal Penelitian Perikanan Indonesia 2: 63-70.
Suryaningrum TD, Bagus SSBU. 1999. Pengaruh suhu media serbuk gergaji dingin terhadap sintasan udang windu (Penaeus monodon) dalam kemasan kering. Di dalam: Penelitian dan Diseminasi Ekologi Budi Daya Laut dan Pantai. Prosiding Seminar
Nasional; Jakarta, 2 Desember 1999. Jakarta: Badan Penelitian dan Pengembangan Pertanian. hlm 325-334.
Suryaningrum TD, Syamsidi, Ikasari D. 2007. Teknologi penanganan dan transportasi lobster air tawar. Squalen. Vol 2 No. 2.
Suryaningrum TD, Ikasari D, Syamsidi. 2008. Pengaruh kepadatan dan durasi dalam kondisi transportasi sistem kering terhadap kelulusan hidup lobster air tawar (Cherax quadricarinatus). Jurnal Pascapanen dan Bioteknologi Kelautan dan Perikanan 2: 171-181.
Taurusman, A. A. 1996. Toksisitas dan Daya Anestesi Ekstrak Tembakau Komersil (Nicotiana tabacum) terhadap Benih Ikan Nila Merah. Sripsi. FPIK. IPB. Bogor Utomo SP. 2001. Penerapan teknik pemingsanan menggunakan bahan anestetik alga laut
Caulerpa sp. dalam pengemasan ikan kerapu (Epinephelus suillus) hidup tanpa media air [skripsi]. Bogor: Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Wibowo S. 1993. Penerapan Teknologi Penanganan dan Transportasi Ikan Hidup di
Indonesia. Jakarta: Sub Balai Penelitian Perikanan Laut, Departemen Kelautan dan Perikanan
Wibowo, S. 2001. Transportasi udang hidup sistem kering. Info Budidaya. BPPL Slipi. Jakarta.