KIMIA DASAR LARUTAN
KULIAH
SELASA 6-13 OKTOBER 2020
LARUTAN
PENGERTIAN
Larutan adalah campuran homogen dua atau lebih jenis zat murni BERDASARKAN FASA PENYUSUNNYA
PADAT CAIR GAS
PADAT PADUAN LOGAM LARUTAN GULA
CAIR LARUTAN GULA AIR - ALOKOHOL O2 DALAM AIR
GAS O2 DALAM AIR UDARA
BERDASARKAN PERANNYA DALAM MENYUSUN LARUTAN PELARUT: SOLVEN(T)
Adalah komponen larutan yang lebih dominan menentukan fasa dari larutan Contoh: 70% gula + 30% air : air tetap merupakan pelarut, karena fasa dari larutan lebih menyerupai air, bentuknya mengikuti tempat penampungnya.
ZAT TERLARUT: SOLUTE
Adalah komponen utama larutan, yang menentukan sifat kimia maupun sifat fisika larutan
Contoh: Larutan asam asetat. Kata asam asetat menunjukkan zat terlarutnya
Berbagai cara menyatakan konsentrasi (kadar) zat terlarut di dalam larutan
konsentrasi: menyatakan jumlah zat terlarut dalam sejumlah tertentu larutan (atau pelarut) 1. Massa per volume: g/100 ml, g/l
2. Molaritas : mol/l
3. Normalitas: mol ekuivalen/l *) ada penjelasan lebih lanjut 4. Molalitas : mol/1000 g pelarut **) untuk mengkaji sifat koligatif
5. % W/W (berat/berat) : NaOH 30% (tanpa deskripsi) selalu berarti % w/w:
contohnya Larutan NaOH 30% dibuat dengan melarutkan 30g NaOH + 70 g Air 6. % W/V (berat/volume): 30% w/v (30 gram dalam 100 ml larutan)
7. % V/V (volume/volume): N2 dalam udara 78% (100 l udara mgd 78 l N2) 8. ppm (part per million): 1 ppm = 1 mg dalam 1 liter atau 1ml dalam 1 lt
9. ppb (part per billion): 1 ppm = 1000 ppb (1mg dalam 1000 liter): contoh: air umpan boiler di perusahaan pembangkit listrik (mis: IPMOMI) kandungan oksigennya tidak boleh lebih besar dari pada 10 ppb
kesetaraan system satuan volume: 1ml = 1 cm3
NORMALITAS TIPE 1
Konsentrasi yang menyatakan kesetaraan dengan konsentrasi zat terlarut tertentu A. Untuk Larutan Asam dan Basa:
Normalitas menyatakan kesetaraan kadar Asam/Basa dengan konsentrasi molar ion H+ Contoh:
• Normalitas larutan HCl 1 M, adalah 1 N karena dalam larutan itu mengandung ion H+ dengan konsentrasi 1 mol/l
• Normalitas larutan H2SO4 1M, adalah 2N, karena dalam larutan itu mengandung ion H+ dengan konsentrasi 2 mol/l
• Normalitas larutan asam asetat (CH3COOH) 1 M, adalah 1 N, karena dalam reaksinya dengan basa kuat larutan asam itu dapat menyediakan ion H+ sebanyak 1 mol dalam setiap liter larutan.
• Normalitas Larutan NaOH 1 M adalah 1 N, karena 1 liter larutan itu dapat dinetralkan dengan larutan yang menyediakan 1 mol ion H+ (kata “yg menyediakan” berarti: mengandung atau masih melalui proses)
• Normalitas Larutan Ca(OH)2 1M adalah 2 N, karena 1 liter larutan itu dapat dinetralkan dengan larutan yang menyediakan 2 mol ion H+
• Normalitas larutan NH4OH 1M, adalah 1N, karena 1 lt lart. Itu dpt dinetralkan dg. 1 lt asam kuat 1N atau 1M
NORMALITAS TIPE 2
Konsentrasi yang menyatakan kesetaraan kadar larutan itu dengan konsentrasi (jumlah) zat tertentu yang terlibat dalam reaksi.
B. Untuk larutan pereaksi oksidasi/reduksi:
Normalitas menyatakan kesetaraannya dengan besarnya perubahan bilangan oksidasi (jumlah elektron yang ditransfer) dalam suatu reaksi redoks.
Contoh:
Normalitas larutan KMnO4 tergantung penggunaannya dalam reaksi redoks.
a. Untuk reaksi: MnO4− + Fe + H+ → Mn2+ + Fe2+ + H2O (dalam suasana asam) Oksidasi: (Fe → Fe2+ + 2e) 5
Reduksi: (Mn7+ + 5e → Mn2+ ) 2 Reaksi menjadi: 2MnO4− + 5Fe + 16H+ → 2Mn2+ + 5Fe2+ + 8H2O Jadi normalitas Larutan KMnO4 1 M adalah 5 N,
atau sebaliknya konsentrasi molar KMnO4 1 N adalah 0,2 M
b. Untuk reaksi: MnO4− + Fe → MnO2 + Fe2+ (dalam suasana reaksi basa) Reduksi : Mn7+ + 3 e → Mn4+
Jadi normalitas Larutan KMnO4 1 M untuk reaksi (b) adalah 3 N,
Larutan Elektrolit dan Larutan Non-elektrolit
Larutan elektrolit adalah larutan yang zat terlarutnya berupa ion-ion, atau dengan kata lain bahwa di dalam larutan elektrolit zat terlarut terionisasi menjadi ion-ion positif (kation) dan ion-ion negatif (anion).
Salah satu ciri dari larutan eletrolit adalah kemampuan meneruskan arus listrik.
Larutan elektrolit kuat: adalah larutan yang zat terlarutnya mengalami ionisasi secara sempurna. Derajat ionisasi (a) 100% (syaratnya: konsentrasi tidak pekat) Contoh: Larutan NaCl, Larutan HCl, Larutan NaOH
Larutan elektrolit lemah: adalah larutan yang zat terlarutnya mengalami ionisasi sebagian, atau membentuk kesetimbangan dengan yang tidak terionisasi
Contoh: larutan asam Asetat
CH3COOH CH3COO− + H+ (cara penulisan menurut Arhenius) CH3COOH + H2O CH3COO− + H3O+ (cara Bronsted Lowry)
Larutan Non elektrolit
Adalah larutan yang zat terlarutnya tidak terionisasi Contoh:
Larutan gula dalam air Larutan urea dalam air
Ciri larutan non elektrolit: tidak menghantarkan arus listrik
Sifat koligatif Larutan (sifat fisik)
Sifat koligatif adalah sifat larutan yang dipengaruhi oleh konsentrasinya, tidak oleh jenis zat terlarutnya.
Yang termasuk sifat koligatif larutan adalah 1. Kenaikan titik didih:
Adanya zat terlarut dapat menyebabkan kenaikan titik didih pelarut.
Di bawah tekanan udara 1 atm, air mendidih pada suhu 100oC. Tetapi kalau ke dalam air itu dilarutkan gula atau garam (NaCl) maka jika larutan itu dipanaskan sampai dengan 100oC larutan itu belum mendidih. Atau dengan kata lain untuk dapat mendidih, larutan itu harus dipanaskan sampai suhu melampaui 100oC.
Dapat dikatakan bahwa dengan adanya zat terlarut, air mengalami kenaikan titik didih.
Coba perhatikan diagram fase berikut ini
Diagram Fasa Air
(Suhu (y) vs kandungan kalor (x) fasa (padat-cair-gas) untuk H2O di bawah tekanan udara 760 mmHg)
• >100
oC uap
• 100
oC mendidih (cair → gas) air dipanaskan
• 0
oC leleh (padat → cair) padat (es)
• - 10
oC
→ Kalor yang ditambahkan dalam proses pemanasan
Penjelasan diagram
Sumbu y (vertikal) adalah sumbu untuk temperatur (suhu)
Sumbu x (horizontal) adalah sumbu untuk jumlah kalori yang ditambahkan
Garis miring menunjukkan bahwa penambahan kalori akan menyebabkan kenaikan suhu tetapi tidak mengubah fase
Garis miring 1 (paling bawah): penambahan kalori akan meningkatkan suhu es (H2O padat) dari – 10oC menjadi 0oC Catat: bentuk tetap es padat
Garis datar 1 (diatas garis miring 1): penambahan kalori tidak menaikkan suhu, tetapi digunakan untuk mengubah bentuk H2O padat menjadi H2O cair (pelelehan)
Garis miring 2 (tengah): penambahan kalori menaikan suhu H2O cair dari 0-100oC.
Pengamatan dilakukan di bawah tekanan udara 760 mmHg, sehingga H2O masih berbentuk cair sampai suhu 100oC
Garis datar 2 (diatas garis miring 2) penambahan kalor tidak menaikkan suhu, karena digunakan untuk mengubah bentuk (fasa) H2O dari cair menjadi gas (mendidih)
Garis miring 3 (paling atas), penambahan kalor akan menyebabkan kenaikan suhu uap, dan secara terus menerus juga digunakan untuk menambah jumlah uap sehingga
tekanannya juga naik (ini hanya bisa dilakukan jika air berada dalam ruang tertutup, misalnya ketel uap pada mesin PLTU, atau dulu pada mesin Lokomotif uap)
Tekanan Udara
Q: Apakah definisi Tekanan itu?
A: Menurut Ilmu Fisika, Tekanan adalah besarnya gaya per satuan luas.
P = F/A
dengan satuan dasar KgF/M
2, Bar, mmHg, atm, dsb Q: Apakah yang dimaksud dengan tekanan udara?
A : Adalah besarnya gaya berat yang disebabkan oleh partikel-partikel gas di dalam udara yang ditanggung oleh permukaan bumi (dan juga benda-
benda lain dipermukaan bumi di bawah udara)
Q: Apakah berarti Tekanan udara merupakan tekanan total?
A: Ya, sesuai dg. komposisi udara, jika di satu tempat tekanan udara 1 atm
dan suhu 25
oC, maka tekanan yang disumbangkan oleh gas N
2adalah
0,78atm, dan yang disumbangkan oleh gas O
2adalah 0,21atm.
Tekanan udara
Jadi,
P
udara= P
N2+ P
O2+ P
gas-gas lainP
total= P
1+ P
2+ P
3+ … P
1+ P
2+ P
3+ … disebut sebabagi tekanan partial
Q: Apakah adanya uap air juga akan menyumbang tekanan udara?
A: ya
Q: Berapa besarnya tekanan yang disumbangkan oleh uap air?
A: tergantung suhu air, dan ketersediaan H2O(l) yang berada dalam kesetimbangan dengan air dalam fasa gas itu.
Tabel berikut ini ditampilkan tekanan uap jenuh air murni pada berbagai suhu
Tekanan udara yang disebabkan oleh adanya uap air
NB:
Semua zat cair, selalu berada dalam
kesetimbangan
dengan fasa uapnya.
Jumlah uap diukur dengan tekanan uapnya.
Tekanan jenuh zat murni merupakan fungsi suhu
Q: Tabel tersebut tentang tekanan uap jenuh air murni, apa yang dimaksud dengan kata “jenuh”?
A: Tekanan Jenuh adalah tekanan maksimum yang dapat dicapai. Keadaan jenuh dapat dicapai jika di dalam ruang itu tidak ada partikel gas lain.
Syarat kedua, uap air itu berada dalam kesetimbangan dengan H
2O cair.
Q: Apakah yang dimaksud dengan air murni?
A: Air murni adalah air yang tidak melarutkan atau tidak bercampur dengan zat apapun?
Q: Bagaimana dengan tekanan di atas air jika air bercampur membentuk larutan dengan zat lain?
A: Ada dua kemungkinan, yaitu (a) jika air membentuk larutan dengan zat
yang dapat menguap, dan (b) jika air melarutkan zat yang tidak dapat
menguap.. Akan dijelaskan pada slide berikutnya
Tekanan total dan tekanan partial
1.
Besarnya tekanan di atas larutan yang terbentuk dari zat-zat dapat menguap adalah merupakan penjumlahan dari tekanan yang disebabkan oleh partikel-partikel gas dari penyusun larutan itu.(Ingat: semua zat cair selalu berada dalam kesetimbangan dengan fase gasnya)
Contoh: H
2O
(l) H
2O
(g)Air murni P
oH2ODi atas H2O cair hanya ada uap air
C
2H
5OH
(l) C
2H
5OH
(g)Alkohol murni P
oC2H5OHDi atas C2H5OH cair hanya ada uap C2H5OH
H
2O
(l)+ C
2H
5OH
(l) H
2O
(g)+ C
2H
5OH
(g)Larutan air-alcohol P
H2O+ P
C2H5OHDi atas larutan cair hanya ada uap dari komponen larutan itu
Tekanan uap jenuh zat murni dan tekanan partial
H
2O
(l) H
2O
(g)C
2H
5OH
(l) C
2H
5OH
(g)Zat murni uap jenuh zat murni H
2O
(l)+ C
2H
5OH
(l) H
2O
(g)+ C
2H
5OH
(g)Larutan air-alcohol tekanan total
( .tekanan
2partial)
Tekanan partial dari komponen larutan
P
H2O =(X
H2O) (P
oH2O)
P
C2H5OH =(X
C2H5OH) (P
oC2H5OH)
Tekanan total dan tekanan partial
(untuk larutan dengan zat terlarut tak menguap)
2.
Besarnya tekanan di atas larutan yang pelarutnya dapat menguap, dan zat terlarutnya tidak dapat menguap, merupakan tekanan yang disebabkan hanya oleh partikel-partikel pelarut saja.
Contoh: H
2O
(l) H
2O
(g)Air murni P
oH2ONaCl
(s) NaCl
(g)Natrium klorida
tidak menyumbang tekananH
2O
(l)+ NaCl
(aq) H
2O
(g)Larutan NaCl P
H2OAdanya zat terlarut tidak volatile, akan menurunkan tekanan uap, proporsional dengan fraksi mol pelarut.
Cara mengukur tekanan uap jenuh:
(1)
(2)
(3)
(5) (4)
Keterangan:
(1) Termometer
(2) Barometer (pengukur tekanan) (3) Pompa vakum
(4) Pemanas (dilengkapi dengan control/thermo-regulator (5) Zat cair murni atau larutan
Cara operasinya:
Setelah ketel diisi dengan zat cair murni atau larutan, semua alat (1) s.d. (4) terpasang dengan baik, kemudian dilakukan pengosongan udara, sampai tekanan terendah. Maka yang terbaca pada barometer adalah tekanan uap jenuh pada suhu tertentu (terbaca)
Titik didih
Apakah pengertian mendidih?
Suatu zat cair dikatakan mendidih jika tekanan udara di atas zat cair itu hanya disebabkan oleh partikel-partikel berfasa gas dari zat itu.
Atau dengan kata lain, suatu zat dikatakan mendidih, jika tekanan yang disebabkan oleh partikel-partikel gas dari zat itu sama dengan tekanan udara.
Ingat:
tebalnya udara di setiap tempat berbeda-beda,
akibatnya tekanan udara di suatu tempat dengan tempat lain juga berbeda,
tergantung dari ketebalan udaranya. Udara di permukaan laut adalah paling tebal Dengan demikian besarnya tekanan yang harus dicapai agar suatu zat berada dalam keadaan mendidih juga berbeda-beda. Pada hal tekanan adalah fungsi temperatur.
Dengan demikian dapat difahami bahwa titik didih suatu zat (katakanlah H2O) berbeda- beda di satu tempat dengan tempat lainnya, tergantung ketinggiannya dari atas
permukaan laut.
Mengapa adanya zat terlarut mempengaruhi titik didih suatu zat cair?
Misalkan kedua text box di bawah ini adalah tabung tertutup berisi larutan yang berada dalam kesetimbangan dengan fasa uapnya
Uap air dan uap alkohol P
tot= P
H2O+ P
alkohol
Larutan alkohol dan air (larutan cair)
Uap air saja P
tot= P
H2O+ P
gula
Pgula= 0Larutan gula dalam air
(air dapat menguap, gula tidak dapat menguap)
Larutan A + B PA = XAPoA Jika A pelarut dan B zat terlarut
P total = PA + PB PB = XB PoB Jika B non volatile, maka P total … (?)
Sifat koligatif Larutan
Sifat koligatif adalah sifat larutan yang dipengaruhi oleh konsentrasinya tidak oleh jenis zat terlarutnya.
Contoh untuk definisi itu
Air murni dibawah tekanan udara P atm mempunyai titik didih ToC
Jika ke dalam satu liter air (atau 1000 gram air) dilarutkan satu mol suatu zat apapun, maka titik didih air itu di bawah tekanan udara P atm akan menjadi (T+∆T)oC
Rumus (empirik) yang berlaku
∆Tb = Kb m (berlaku untuk zat non elektrolit)
(persamaan linier biasanya dinyatakan dengan persamaan y = a + bx)
Dengan
∆Tb : Kenaikan titik didih
Kb : Konstanta kenaikan titik didih
m : molalitas = jumlah mol zat terlarut dalam 1000 gram pelarut
DISKUSI
PELARUT YG DILARUTKAN JMLH YG DILARUTKAN KONSENTRASI PARTIKEL KENAIKAN TITIK DIDIH
1 LITER 1. GULA 1 MOL 1 MOL/1000 g AIR ∆T oC
(1000 g) 2. UREA 1 MOL 1 MOL/1000 g AIR ∆T oC
AIR 3. NaCl 1 MOL
2 MOL/1000 g AIR
( 1 mol Na+ dan 1 mol Cl-) i = 2
∆T oC >
4. FeCl2 1/3 Mol
1 MOL/1000 g AIR
(1/3 mol ion Fe2+ + 2/3 mol ion Cl-) i = 3
∆T oC T
Buatkan modifikasi Rumus ∆T untuk zat terlarut adalah zat elektrolit
∆Tb = Kb mi i = faktor van Hoff
(berlaku kalua ionisasinya sempurna), Kalau tidak sempurna bagaimana?
Bandingkan antara air murni dan larutan gula (gula = non volatile)
yang dipanaskan sampai suhu 100oC dibawah tekanan udara 760 mmHg
AIR MURNI (100% H2O)
Pada suhu 100
oC P
oH2O= 760 mmHg
= tekanan udara (mendidih)
AIR + GULA (X H2O = 0,8)
Pada 100
oC
P
H2O = XH2O x PoH2O = 760 x 0,8 <760mmHg< P udara
(belum mendidih)
agar mendidih suhu harus dinaikkan lagi. Mengalami kenaikan titik didih
Latihan:
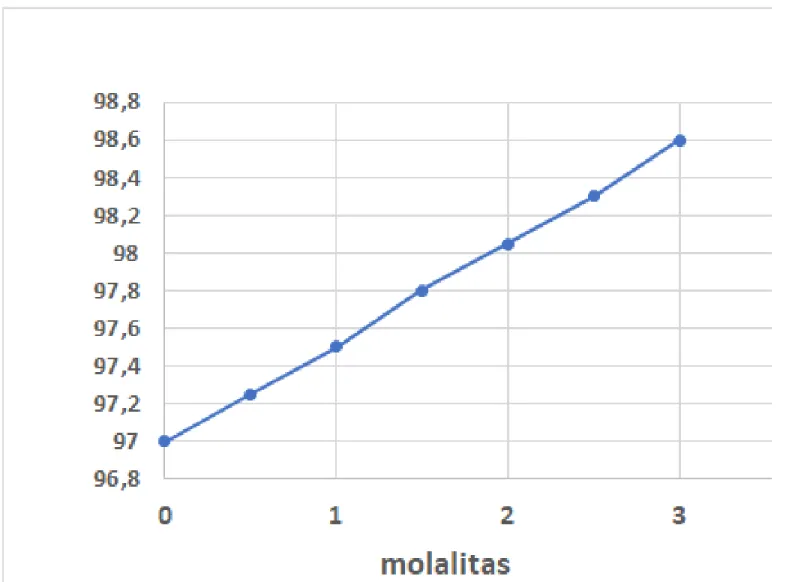
Hitung berapa besarnya Kb air, dari data pengamatan terhadap titik didih air dari berbagai konsentrasi molar zat non elektrolit sebagai berikut ini:
Tb = boiling point = titik didih Penyelesaian:
Buatlah grafik garis dengan sumbu x untuk molalitas, dan sumbu y untuk titik didih.
Maka:
y = a.x
a adalah slope dari grafik, diperoleh dari pembagian segmen x dengan segmen y Tb = m.Kb
molalitas 0 0,5 1 1,5 2 2,5 3
Tb
oC 97 97,25 97,5 97,8 98,05 98,3 98,6
Hitung slope dari grafik ini = Kb
Grafik ini dibuat dengan Microsoft Excel.
Persamaan garis liniernya dapat diketahui dengan menggunakan trendline- equation
Didapatkan
Y = 0,5321x + 96,988
Dari persamaan itu dapat diketahui:
Kb = 0,53
Tb = 96,988 (dari tabel data Tb= 97oC)
∆Tb = Y – (96,988)
∆Tb = 0,5321.x (∆Tb =Kb.m)
Titik Beku (T
f= freezing temperature)
Q: Apakah titik beku itu
A: Suhu mana suatu zat cair berada dalam kesetimbangan dengan fase padatnya.
Q: Mengapa adanya zat terlarut dapat menurunkan titik beku suatu zat cair?
A: Harus difahami terlebih dahulu, sebenarnya apa yang terjadi ketika suatu zat cair membeku.
Tidak sekedar berubah menjadi padat, tetapi padatan yang terbentuk adalah sistem kristal.
Sistem kristal hanya dapat terbentuk dari partikel-partikel zat murni tunggal.
Adanya zat lain (impurities/pengotor/zat terlarut) akan mengganggu proses pengkristalan.
Maka jika suatu zat akan mengkristal terlebih dahulu akan memurnikan dirinya dengan memisahkan diri dari impurities nya. Proses ini akan menyebabkan
perubahan konsumsi kalor yang akan terdeteksi sebagai perubahan temperatur bekunya.
Ceritakan pengalaman Anda ketika menikmati es lilin (dalam kantung plastic)
Perhitungan empirik Penurunan Titik beku
sama dengan perhitungan empirik kenaikan titik didih
∆T
f= K
f.m
Soal untuk dijawab saat kuis 2
Bagaimana cara melakukan percobaan pengamatan terhadap titik didih
sebagai fungsi konsentrasi, karena Ketika dilakukan pemanasan suatu
larutan (logikanya) konsentrasi larutan itu akan terus berubah (semakin
pekat atau semakin encer), karena salah satu dari komponen pelarut
(dan mungkin juga zat terlarut) akan berkurang karena penguapan?
Proses Osmosis
OSMOMETER
Tekanan Osmosis:
Tekanan yang harus diterapkan untuk mencegah terjadinya proses osmosis
REVERSE OSMOSIS
Tekanan Osmosis ( )
Tekanan osmosis adalah tekanan yang berkaitan dengan larutan, maka parameter konsentrasi menjadi penting:
Dari Persamaan PV = nRT
yang disusun ulang menjadi P =
𝑛𝑅𝑇𝑉
Dan disusun ulang lagi menjadi P =
𝑉𝑛 𝑅𝑇, dengan
𝑛𝑉
adalah konsentrasi atau C (konsentrasi molar)
Maka dapat dimodifikasi = C.R.T
Perhitungan tekanan osmosis
Dari peristiwa osmosis, tekanan osmosis di artikan sebagai tekanan yang harus diterapkan untuk mencegah terjadinya peristiwa osmosis itu
Jika pada gambar osmometer, adanya proses osmosis ditandai dengan
naiknya permukaan larutan dalam kapiler setinggi h, maka untuk mencegah terjadinya proses osmosis harus diterapkan tekanan sebesar
P = g h
= Atau g h
Dengan P = adalah tekanan
= massa jenis larutan
g = adalah percepatan gravitasi bumi
h = kenaikan permukaan dalam pipa kapiler
Contoh soal yang menggunakan tekanan osmosis
Tekanan osmosis dari suatu larutan yang mengandung 45 gram sukrosa per liter pada suhu 0°C adalah 2,96 atm. Hitunglah massa molekul relatif sukrosa.
Diket massa sukrosa = 45 gram
Suhu, T = 0oC = 273,15 K Tekanan Osmosis, = 2,96 atm
Dari rumus = C.R.T maka: C = ()/(R.T)
C = 2,96: (0,082x273,15) C = 0,132 mol/l
45 gram/liter = 0,132 mol/liter
Massa molekul relative sukrosa adalah 45/0,132 = 340.91 gram/mol
Pernyataan tekanan untuk soal di atas dapat juga harus dihitung sendiri (oleh Anda) dengan menggunakan data massa jenis () dan kenaikan level permukaan larutan (h), dan konsentrasi (g/l) zat yang dilarutkan
Reverse Osmosis (RO)
Kebalikan dari proses osmosis Silakan lihat skema ini
di mana aplikasi RO digunakan?
Penyediaan air bersih di kapal dan di pembangkit listrik tenaga uap
seperti di Paiton, menggunakan air laut
sebagai bahan mentah, yang dengan
proses RO diubah menjadi air bersih
Skema alat RO
membrane semi permeabel
Brine water brine water (inlet) lebih pekat
Contoh soal:
Berapa tekanan yang harus diaplikasikan agar air laut (inlet) yang
mengandung garam (anggap saja NaCl) dengan konsentrasi 3% w/v sehingga air pada sisi outlet konsentrasinya menjadi 3,5% w/V
Fresh water
Fresh water
Kran air bersih
Contoh soal:
a. Berapa tekanan yang harus diaplikasikan agar air laut (inlet) yang mengandung garam (anggap saja NaCl) dengan konsentrasi 3% W/V sehingga air pada sisi outlet konsentrasinya menjadi 3,5% w/V
Suhu Operasi adalah 27oC
a. Berapa liter air segar yang dihasilkan dari setiap 1000 liter air laut yang diproses?
Penyelesaian:
a. = C.R.T
Konsentrasi NaCl 3,5 gram/100 ml = 35 gram/liter = 35/58,5 = 0,5983 M Konsentrasi Partikel = 2x 0,5983 M = 1,1966
= C.R.T = 1,1966 x 0,082 x 300,15 = 29,45 atm
b. 30 gram/liter = 30.000 gram/1000 liter = 30 kg/1000 liter
35 kg/1000 liter = 30 kg/V2 liter V2 = (30 x 1000)/35 = 857,14 (??)
Jadi air segar yang dihasilkan dari pemrosesan 1000 liter air laut adalah = 1000-857,14
= 142,86 liter