INDUKSI PEMBENTUKAN SENYAWA SEKUNDER TANAMAN
SIDAGURI (
Sida rhombifolia
Linn) MELALUI PERLAKUAN CEKAMAN
AIR
Oleh
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2008
Judul : Induksi Pembentukan Senyawa Sekunder Tanaman
Sidaguri (
Sida rhombifolia
Linn) Melalui Perlakuan Cekaman Air
Nama : Annisaa Soeyono
NIM : G 34102057
Program Studi : Biologi
Menyetujui,
Pembimbing I Pembimbing II
Dr. Ir. Hamim, M. Si Dr. Dra. Dyah Iswantini, M. Agr, S. C
NIP 131878946 NIP 131956706
Mengetahui,
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
NIP 131578806
Tanggal Lulus :
ABSTRAK
ANNISAA SOEYONO. Induksi Pembentukan Senyawa Sekunder Tanaman Sidaguri (
Sida
rhombifolia
Linn) melalui Perlakuan Cekaman Air. Dibimbing oleh HAMIM dan DYAH
ISWANTINI.
Penelitian bertujuan mengetahui pengaruh cekaman kekeringan terhadap pembentukan
senyawa sekunder tanaman sidaguri. Sample yang digunakan meliputi 40 tanaman yang berumur 4
bulan dengan 4 perlakuan, yaitu tanaman control, cekaman 2 minggu, cekaman 3 minggu, dan
cekaman 4 minggu. Pengujian senyawa sekunder meliputi uji kualitatif dan uji kuantitatif.
Perlakuan cekaman kekeringan menyebabkan penurunan laju pertumbuahan, meliputi tinggi
tanaman, jumlah cabang, dan jumlah daun. Pada saat panen, terbukti cekaman kekeringan
menyebabkan rendahnya bobot kering tanaman. Senyawa sekunder yang diperoleh dari uji
kualitatif antara lain flavanoid, quinon, tannin, alkaloid, saponin, terpenoid, dan steroid.
Kandungan alkaloid dan tannin lebih besar daripada kandungan steroid dan flavanoid. Hasil dari
uji kualitatif menunjukan bahwa cekaman kekeringan dapat meningkatkan senyawa sekunder,
khususnya tanin. Kadar total fenol daun tanaman kontrol, cekaman 2 minggu, dan cekaman 3
minggu berturut-turut 2%, 3.3%, dan 8.67 %. Kadar total fenol cenderung meningkat dengan
bertambahnya cekaman kekeringan, tetapi ini tidak berlaku pada cekaman 4 minggu. Total fenol
tanaman yang mengalami cekaman 4 minggu menyusut secara signifikan. Hal ini dimungkinkan
karena tanaman sudah mencapai batas dimana cekaman tersebut sangat berat.
ABSTRAC
ANNISAA SOEYONO. Induction of secondary metabolite in Sidaguri (
Sida rhombifolia
Linn) by
drought treatment. Supervised by HAMIM and DYAH ISWANTINI
Concentration of alkaloid and tannin was higher than concentration of steroid and flavonoid in the
Sidaguri plant. Phenol concentration of control, 2 weeks, and 3 weeks drought plant were 2%,
3.3%, and 8.67 % respectively. Phenol concentration increased until 3 weeks drought, but this
decreased after weeks drought. Total phenol of plant that was experienced 4 weeks drought
decreased significantly. This is probably because the plant has encountered severe stressed.
PRAKATA
Puji syukur penulis panjatkan ke hadirat Allah SWT yang telah melimpahkan rahmat dan
karunia-Nya, sehingga karya ilmiah ini dapat diselesaikan. Karya ilmiah yang berjudul Induksi
Pembentukan Senyawa Sekunder Tanaman Sidaguri melalui Perlakuan Cekaman Air ini
dilaksanakan sejak bulan September 2007 sampai dengan Januari 2008 di Runah kaca Departemen
Biologi dan Laboratorium Kimia Fisik Departemen Kimia Dramaga IPB.
Ucapan terima kasih penulis haturkan kepada Bapak Dr, Ir, Hamim, M.Si dan Ibu Dr. Dra.
Dyah Iswantini, M. Agr selaku dosen pembimbing yang telah banyak memberikan saran serta
bimbingan kepada penulis selama pelaksanaan penelitian ini. Penulis juga menghaturkan ucapan
terima kasih kepada Ibu Dr. Ir. Nisa Rachmaniah selaku Dosen Penguji atas koreksi dan sarannya
dan (Almh) Ibu Ir. Theresia Prawitasari selaku dosen pembimbing pertama atas bimbingan selama
awal penelitian ini. Di samping itu, terima kasih juga penulis sampaikan kepada Bapak Nunu, Ibu
Nunung, Pak Djoni, Mba Yenny yang telah turut memberikan bantuan dan informasi.
Ungkapan terima kasih penulis ucapkan juga kepada Mala, Nira, Awi, Eki, Yusi, Isma,
serta rekan-rekan Biologi 39 yang senantiasa memberikan dukungan, motivasi, dan bantuannya
selama penelitian ini. Penghargaan dan terma kasih tertinggi penulis persembahkan untuk Bapak,
Ibu, adik-adiku dan seluruh keluarga atas dukungan doa dan kasih sayangnya selama ini
Semoga Karya Ilmiah ini bermanfaat bagi pembaca
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 21 Oktober 1984 di Bogor dan merupakan anak sulung dari
4 bersaudara dari pasangan Ir. Soeyono Karwondi dan Dr. Drh. Gunanti, MS.
Tahun 1991 penulis masuk bangku SD di SDN Pengadilan 5 Bogor kemudian pada tahun
1997-1999 penulis memiliki kesempatan untuk sekolah di SMP Negeri 4 Bogor. Penulis lulus dari
SMP Negeri 4 Bogor pada tahun 1999 dan melanjutkan sekolah di SMA Negeri 7 Bogor yang
lulus pada tahun 2002. Pada tahun yang sama penulis diterima sebagai mahasiswa IPB lewat jalur
USMI di Program Studi Biologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan
Alam.
Tahun 2007, penulis mengikuti kegiatan Praktek Lapang di PT Phytochemindo Reksa.
Pada Tahun 2004-2005 penulis pernah menjabat sebagai Bendahara dari Organisasi
DAFTAR ISI
Halaman
DAFTAR TABEL ………...… viii
DAFTAR GAMBAR ………... .. viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN 1
Latar Belakang ……… 1
Tujuan ……… 2
Waktu dan Tempat ………. 2
BAHAN DAN METODE 2
Bahan dan Alat ... 2
Metode Penelitian ... 2
Persiapan Media Tanam ... 2
Penyiraman dan Perlakuan Cekaman Kekeringan ... 3
Pengamatan ... 3
Ekstraksi ... 3
Uji Kualitatif ... 3
Uji Total Fenol ... 4
Pemanenan ... 4
Analisis Data ... 4
HASIL 4
Laju Pertumbuhan ... 4
Uji Fitokimia secara Kualitatif ... 6
Uji Total Fenol secara Kuantitatif ... 6
Pertumbuhan Tanaman terhadap Perlakuan Cekaman ... 8
Pengaruh Perlakuan Cekaman terhadap Kandungan Metabolit
Sekunder ... 9
SIMPULAN DAN SARAN 9
Simpulan ... 9
Saran ... 10
DAFTAR PUSTAKA ... 10
LAMPIRAN ... 12
DAFTAR TABEL
1 Kandungan kualitatif tanaman sidaguri sebelum dan
setelah perlakuan cekaman... 7
2 Pengaruh cekaman air terhadap kandungan fenol
tanaman sidaguri... 7
DAFTAR GAMBAR
1 Pengaruh cekaman air terhadap laju pertumbuhan
tanaman sidaguri ... 5
2 Pengaruh cekaman air terhadap produktivitas dan panjang akar
tanaman sidaguri... 6
2 Hasil Analisis Tanah ………... 13
3 Kriteria Penilaian Sifat-sifat Tanah ………... 14
4 Rataan Laju Pertumbuhan Tanaman Sidaguri ………... 15
5 Rataan Produktivitas Tanaman Sidaguri ... 17
6 Klasifikasi Tanaman Sidaguri... ………... 18
7 Keadaan Tanaman selama Penelitian... 19
PENDAHULUAN
Latar Belakang
Indonesia merupakan negara kepulauan tropika basah yang kaya akan spesies flora penghasil obat
tradisional. Sebagai negara yang dikenal dengan megabiodiversity, Indonesia memiliki keanekaragaman
hayati flora dan fauna. Dari 28.000 jenis tumbuhan yang ditemukan, kurang lebih 7.000 jenis diantaranya berupa tumbuhan obat (Kassahara & Hemm 1986). Tumbuhan obat adalah kelompok tumbuhan yang umumnya digunakan sebagai bahan obat di samping sebagai sumber untuk bahan baku obat. Pemanfaatan lain dari tumbuhan obat ialah sebagai bumbu masak, makanan, minumam, kosmetik, dan parfum (Wahid 1993).
Pemanfaatan tumbuhan obat dengan tujuan pencegahan dan pengobatan penyakit telah dikenal di Indonesia sejak zaman nenek moyang sampai sekarang, tetapi penggunaanya masih banyak dilakukan berdasarkan pada dugaan dan pengalaman yang diwariskan secara turun-temurun dan belum dibuktikan secara ilmiah. Tumbuhan obat yang digunakan biasanya dalam bentuk simplisia yang berupa akar, daun,
Sidaguri termasuk tumbuhan perdu liar dengan tinggi sekitar 0,2-2 m, batangnya agak liat dan bercabang-cabang dengan daun berbentuk bulat memanjang yang letaknya berseling. Umumnya dapat ditemukan di tempat-tempat yang terkena sinar matahari cerah (Heyne 1987). Bunganya tunggal berbentuk bulat telur dan berwarna kuning, yang berada di ketiak daun (Dharma 1985). Buah sidaguri berbentuk batu dan berwarna hijau jika tua, sedangkan bijinya berbentuk bulat, berwarna hitam dan berukuran kecil. Akarnya tunggang dengan warna putih kotor dan kuat.
Menurut Depkes RI tahun 1995, kandungan kimia yang terdapat pada marga Sida, antara lain
alkaloid, leukoantosianidin, flavanoid, tanin, steroid, dan triterpenoid. Khasiat sidaguri dalam menyembuhkan berbagai macam penyakit berhubungan dengan kandungan senyawa kimia yang
dimilikinya, antara lain alkaloid, kalsium oksalat, tanin, saponin, fenol, asam amino, minyak atsiri, steroid, dan zat efedrine (Wijayakusuma et al 1994).
Beberapa penyakit yang dapat disembuhkan dengan cara mengkonsumsi seluruh bagian tanaman,
antara lain nyeri pada pinggang, punggung, bahu, tangan maupun kaki ( Wijayakusuma et al 1994),
antiinflamasi dan hepatoprotektif, mengatasi radang lambung, mencret, disentri, inflamasi, iritasi, bisul, dan
borok (Wijayakusuma et al 1994). Sidaguri dapat juga digunakan untuk mengobati berbagai macam
peradangan dan iritasi pada sistem pernafasan dan sistem urin (Bushell 1998). Berdasarkan penelitian, sidaguri juga dapat digunakan sebagai obat anti gout. Bahan aktif sidaguri dapat menghambat kerja enzim xantin oksidase yang berperan penting dalam menghasilkan asam urat (Iswantini 2004).
Senyawa sekunder merupakan bahan alam yang dihasilkan dari metabolit primer seperti fotosintesis dan respirasi. Beberapa jenis senyawa sekunder tanaman antara lain alkaloid, terpenoid, flavanoid, hormon pertumbuhan, lignin, dan kutikula (Vickery & Vickery 1981). Senyawa sekunder, meskipun tidak penting bagi kelangsungan hidup suatu tanaman, sering berperan dalam kelangsungan hidup suatu spesies sebagai pertahanan untuk berkompetisi dengan spesies lain dan lingkungannya (Manitto 1981). Senyawa sekunder tersebut dibentuk, terutama melalui jalur asetat mevalonat dan asam sikhimat dengan glukosa 6 fosfat sebagai prekusor utamanya (Vickery & Vickery 1981).
Produk utama penyimpanan pada tanaman ialah sukrosa dan pati (Salissbury & Ross 1992). Beberapa penelitian menyebutkan bahwa faktor-faktor seperti iklim, edaphic, zat polutan buatan, dan kompetisi dengan makhluk hidup lain, dapat mempengaruhi pembentukan senyawa sekunder (Harborne 1988). Kondisi kekeringan menyebabkan laju fotosintesis dan pergerakan hormon pertumbuhan menurun, seiring dengan semakin rendahnya potensial air (Harjadi & Yahya 1988). Hal ini menyebabkan tanaman mulai menghidrolisis sukrosa menjadi glukosa dan fruktosa bebas yang akan digunakan sebagai cadangan energi dan pembentukan senyawa sekunder. Volume dan kecepatan aliran sukrosa pada floem menurun, tetapi konsentrasinya semakin meningkat ketika ditranspor ke daun (Harjadi & Yahya 1988). Gupta (2005) melaporkan bahwa kekeringan menyebabkan tanaman lebih banyak memproduksi senyawa sekunder pada daun untuk mempertahankan diri, kemudian di transpor melalui floem ke jaringan tanaman. Belum
diketahui apakah hal yang demikian itu berlaku pada tanaman secara umum, termasuk sidaguri. Distribusi setiap senyawa sekunder pada tanaman berbeda-beda, bergantung pada jenis senyawa, jenis tanaman, dan faktor lingkungan (Harborne 1988).
Tujuan
Penelitian ini bertujuan untuk mengetahui pengaruh cekaman air terhadap pertumbuhan dan perkembangan serta kandungan senyawa sekunder pada tanaman sidaguri. Hipotesis yang diajukan ialah bahwa cekaman air dapat meningkatkan kandungan senyawa sekunder tanaman sidaguri.
Waktu dan Tempat
Plastik Departemen Biologi dan Laboratorium Kimia Analitik Departemen Kimia IPB Dramaga.
BAHAN DAN METODE Bahan dan Alat
Tanaman sidaguri yang berumur 4 bulan, media tanah dan sekam, pupuk kandang dan NPK, alkohol
70%, sapranin, gliserin, reagen folin-ciocalteau 50%, Na2CO3 5%, etanol 70% dan 95%, air bebas ion,
CHCl 2 N, NH4OH, H2SO4 2M, H2SO4 pekat, Pereaksi Dragendorf, Pereaksi Wagner,Pereaksi Mayer,
eter, asam asetat anhidrat, HCl pekat, amil alkohol, FeCL310%, dan NaOH 1N. Polybag ukuran Besar,
penggaris, timbangan, mikroskop okuler, gelas objek dan cover, botol film, gabus, silet, alat tulis, kertas label, termometer, rotavor, oven, dan spektromotometer.
Metode Penelitian
Persiapan Media Tanam
Tanaman yang akan digunakan ialah tanaman yang sudah berumur 4 bulan di lapangan dan
berkualitas baik. Sebelum dipindahkan ke dalam polibag yang berukuran 5 kg, tanaman dipangkas terlebih dahulu yang bertujuan mengurangi laju penguapan. Media tanam yang digunakan ialah campuran tanah, sekam, dan pupuk kandang dengan perbandingan 4:2:1. Tanah untuk penanaman ialah tanah yang diambil dari Kebun Percobaan Cikabayan Biofarmaka, Bogor. Tanah disaring, kemudian dikeringkan di bawah sinar matahari. Setelah cukup kering, contoh tanah diambil untuk dianalisis sifat-sifat fisik dan kimianya di Laboratorium Analisis Tanah, Departemen Ilmu Tanah, Fakultas Pertanian IPB, Dramaga. Sifat fisik yang dianalisis meliputi kadar air tanah pada keadaan kapasitas lapang dan titik layu permanen, sedangkan sifat kimianya yang dianalisis meliputi kandungan hara dan pH tanah sebagaimana terlampir pada Lampiran 1. Berdasarkan analisis sifat fisik dan kimia tanah, menurut Hardjowigeno (1995), tanah yang diambil dari Kebun Percobaan Cikabayan, Bogor tersebut memenuhi kebutuhan media tanam Sidaguri. Setelah
dipindahkan, polybag diletakan dalam rumah plastik. Untuk masa adaptasi, tanaman tetap diberikan air dua kali untuk setiap harinya selama 1 minggu, yakni pada pukul 8-9 pagi dan pukul 3-4 sore sebelum
mendapatkan perlakuan.
Penyiraman dan Perlakuan Cekaman Kekeringan
Perlakuan kekeringan diberikan dengan cara mengurangi jumlah air penyiraman menjadi seperempat dari tanaman kontrol ( 1/4 dari kapasitas lapang), yang diberikan setiap hari antara jam 8-9 pagi. Waktu
pemberian air bergantung pada tingkatan perlakuan kekeringan. Setiap perlakuan diulang sebanyak 10 kali, sehingga terdapat 40 unit perlakuan.
Pengamatan
Parameter yang diamati antara lain laju pertumbuhan dan kandungan senyawa sekunder.
Pengamatan dilakukan setelah tanaman mendapat perlakuan cekaman, bergantung pada tingkatan perlakuan kekeringan. Kandungan senyawa sekunder diukur sebelum tanaman diberi perlakuan, sesudah diberi
perlakuan, dan sesudah tanaman dikembalikan pada keadaan sebelum cekaman.
Ekstraksi
Sampel sidaguri yang digunakan ialah bagian batang dan daun. Untuk batang, diambil kira-kira 15 cm dari permukaan tanah. Untuk daun, diambil dari bagian tajuk tanaman. Sampel sidaguri dibersihkan,
dirajang, dan dikeringkan dengan oven sampai kadar air tinggal 10% pada suhu 95° C. Setelah kering,
INDUKSI PEMBENTUKAN SENYAWA SEKUNDER TANAMAN
SIDAGURI (
Sida rhombifolia
Linn) MELALUI PERLAKUAN CEKAMAN
AIR
Oleh
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2008
Judul : Induksi Pembentukan Senyawa Sekunder Tanaman
Sidaguri (
Sida rhombifolia
Linn) Melalui Perlakuan Cekaman Air
Nama : Annisaa Soeyono
NIM : G 34102057
Program Studi : Biologi
Menyetujui,
Pembimbing I Pembimbing II
Dr. Ir. Hamim, M. Si Dr. Dra. Dyah Iswantini, M. Agr, S. C
NIP 131878946 NIP 131956706
Mengetahui,
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
NIP 131578806
Tanggal Lulus :
ABSTRAK
ANNISAA SOEYONO. Induksi Pembentukan Senyawa Sekunder Tanaman Sidaguri (
Sida
rhombifolia
Linn) melalui Perlakuan Cekaman Air. Dibimbing oleh HAMIM dan DYAH
ISWANTINI.
Penelitian bertujuan mengetahui pengaruh cekaman kekeringan terhadap pembentukan
senyawa sekunder tanaman sidaguri. Sample yang digunakan meliputi 40 tanaman yang berumur 4
bulan dengan 4 perlakuan, yaitu tanaman control, cekaman 2 minggu, cekaman 3 minggu, dan
cekaman 4 minggu. Pengujian senyawa sekunder meliputi uji kualitatif dan uji kuantitatif.
Perlakuan cekaman kekeringan menyebabkan penurunan laju pertumbuahan, meliputi tinggi
tanaman, jumlah cabang, dan jumlah daun. Pada saat panen, terbukti cekaman kekeringan
menyebabkan rendahnya bobot kering tanaman. Senyawa sekunder yang diperoleh dari uji
kualitatif antara lain flavanoid, quinon, tannin, alkaloid, saponin, terpenoid, dan steroid.
Kandungan alkaloid dan tannin lebih besar daripada kandungan steroid dan flavanoid. Hasil dari
uji kualitatif menunjukan bahwa cekaman kekeringan dapat meningkatkan senyawa sekunder,
khususnya tanin. Kadar total fenol daun tanaman kontrol, cekaman 2 minggu, dan cekaman 3
minggu berturut-turut 2%, 3.3%, dan 8.67 %. Kadar total fenol cenderung meningkat dengan
bertambahnya cekaman kekeringan, tetapi ini tidak berlaku pada cekaman 4 minggu. Total fenol
tanaman yang mengalami cekaman 4 minggu menyusut secara signifikan. Hal ini dimungkinkan
karena tanaman sudah mencapai batas dimana cekaman tersebut sangat berat.
ABSTRAC
ANNISAA SOEYONO. Induction of secondary metabolite in Sidaguri (
Sida rhombifolia
Linn) by
drought treatment. Supervised by HAMIM and DYAH ISWANTINI
Concentration of alkaloid and tannin was higher than concentration of steroid and flavonoid in the
Sidaguri plant. Phenol concentration of control, 2 weeks, and 3 weeks drought plant were 2%,
3.3%, and 8.67 % respectively. Phenol concentration increased until 3 weeks drought, but this
decreased after weeks drought. Total phenol of plant that was experienced 4 weeks drought
decreased significantly. This is probably because the plant has encountered severe stressed.
PRAKATA
Puji syukur penulis panjatkan ke hadirat Allah SWT yang telah melimpahkan rahmat dan
karunia-Nya, sehingga karya ilmiah ini dapat diselesaikan. Karya ilmiah yang berjudul Induksi
Pembentukan Senyawa Sekunder Tanaman Sidaguri melalui Perlakuan Cekaman Air ini
dilaksanakan sejak bulan September 2007 sampai dengan Januari 2008 di Runah kaca Departemen
Biologi dan Laboratorium Kimia Fisik Departemen Kimia Dramaga IPB.
Ucapan terima kasih penulis haturkan kepada Bapak Dr, Ir, Hamim, M.Si dan Ibu Dr. Dra.
Dyah Iswantini, M. Agr selaku dosen pembimbing yang telah banyak memberikan saran serta
bimbingan kepada penulis selama pelaksanaan penelitian ini. Penulis juga menghaturkan ucapan
terima kasih kepada Ibu Dr. Ir. Nisa Rachmaniah selaku Dosen Penguji atas koreksi dan sarannya
dan (Almh) Ibu Ir. Theresia Prawitasari selaku dosen pembimbing pertama atas bimbingan selama
awal penelitian ini. Di samping itu, terima kasih juga penulis sampaikan kepada Bapak Nunu, Ibu
Nunung, Pak Djoni, Mba Yenny yang telah turut memberikan bantuan dan informasi.
Ungkapan terima kasih penulis ucapkan juga kepada Mala, Nira, Awi, Eki, Yusi, Isma,
serta rekan-rekan Biologi 39 yang senantiasa memberikan dukungan, motivasi, dan bantuannya
selama penelitian ini. Penghargaan dan terma kasih tertinggi penulis persembahkan untuk Bapak,
Ibu, adik-adiku dan seluruh keluarga atas dukungan doa dan kasih sayangnya selama ini
Semoga Karya Ilmiah ini bermanfaat bagi pembaca
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 21 Oktober 1984 di Bogor dan merupakan anak sulung dari
4 bersaudara dari pasangan Ir. Soeyono Karwondi dan Dr. Drh. Gunanti, MS.
Tahun 1991 penulis masuk bangku SD di SDN Pengadilan 5 Bogor kemudian pada tahun
1997-1999 penulis memiliki kesempatan untuk sekolah di SMP Negeri 4 Bogor. Penulis lulus dari
SMP Negeri 4 Bogor pada tahun 1999 dan melanjutkan sekolah di SMA Negeri 7 Bogor yang
lulus pada tahun 2002. Pada tahun yang sama penulis diterima sebagai mahasiswa IPB lewat jalur
USMI di Program Studi Biologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan
Alam.
Tahun 2007, penulis mengikuti kegiatan Praktek Lapang di PT Phytochemindo Reksa.
Pada Tahun 2004-2005 penulis pernah menjabat sebagai Bendahara dari Organisasi
DAFTAR ISI
Halaman
DAFTAR TABEL ………...… viii
DAFTAR GAMBAR ………... .. viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN 1
Latar Belakang ……… 1
Tujuan ……… 2
Waktu dan Tempat ………. 2
BAHAN DAN METODE 2
Bahan dan Alat ... 2
Metode Penelitian ... 2
Persiapan Media Tanam ... 2
Penyiraman dan Perlakuan Cekaman Kekeringan ... 3
Pengamatan ... 3
Ekstraksi ... 3
Uji Kualitatif ... 3
Uji Total Fenol ... 4
Pemanenan ... 4
Analisis Data ... 4
HASIL 4
Laju Pertumbuhan ... 4
Uji Fitokimia secara Kualitatif ... 6
Uji Total Fenol secara Kuantitatif ... 6
Pertumbuhan Tanaman terhadap Perlakuan Cekaman ... 8
Pengaruh Perlakuan Cekaman terhadap Kandungan Metabolit
Sekunder ... 9
SIMPULAN DAN SARAN 9
Simpulan ... 9
Saran ... 10
DAFTAR PUSTAKA ... 10
LAMPIRAN ... 12
DAFTAR TABEL
1 Kandungan kualitatif tanaman sidaguri sebelum dan
setelah perlakuan cekaman... 7
2 Pengaruh cekaman air terhadap kandungan fenol
tanaman sidaguri... 7
DAFTAR GAMBAR
1 Pengaruh cekaman air terhadap laju pertumbuhan
tanaman sidaguri ... 5
2 Pengaruh cekaman air terhadap produktivitas dan panjang akar
tanaman sidaguri... 6
2 Hasil Analisis Tanah ………... 13
3 Kriteria Penilaian Sifat-sifat Tanah ………... 14
4 Rataan Laju Pertumbuhan Tanaman Sidaguri ………... 15
5 Rataan Produktivitas Tanaman Sidaguri ... 17
6 Klasifikasi Tanaman Sidaguri... ………... 18
7 Keadaan Tanaman selama Penelitian... 19
PENDAHULUAN
Latar Belakang
Indonesia merupakan negara kepulauan tropika basah yang kaya akan spesies flora penghasil obat
tradisional. Sebagai negara yang dikenal dengan megabiodiversity, Indonesia memiliki keanekaragaman
hayati flora dan fauna. Dari 28.000 jenis tumbuhan yang ditemukan, kurang lebih 7.000 jenis diantaranya berupa tumbuhan obat (Kassahara & Hemm 1986). Tumbuhan obat adalah kelompok tumbuhan yang umumnya digunakan sebagai bahan obat di samping sebagai sumber untuk bahan baku obat. Pemanfaatan lain dari tumbuhan obat ialah sebagai bumbu masak, makanan, minumam, kosmetik, dan parfum (Wahid 1993).
Pemanfaatan tumbuhan obat dengan tujuan pencegahan dan pengobatan penyakit telah dikenal di Indonesia sejak zaman nenek moyang sampai sekarang, tetapi penggunaanya masih banyak dilakukan berdasarkan pada dugaan dan pengalaman yang diwariskan secara turun-temurun dan belum dibuktikan secara ilmiah. Tumbuhan obat yang digunakan biasanya dalam bentuk simplisia yang berupa akar, daun,
Sidaguri termasuk tumbuhan perdu liar dengan tinggi sekitar 0,2-2 m, batangnya agak liat dan bercabang-cabang dengan daun berbentuk bulat memanjang yang letaknya berseling. Umumnya dapat ditemukan di tempat-tempat yang terkena sinar matahari cerah (Heyne 1987). Bunganya tunggal berbentuk bulat telur dan berwarna kuning, yang berada di ketiak daun (Dharma 1985). Buah sidaguri berbentuk batu dan berwarna hijau jika tua, sedangkan bijinya berbentuk bulat, berwarna hitam dan berukuran kecil. Akarnya tunggang dengan warna putih kotor dan kuat.
Menurut Depkes RI tahun 1995, kandungan kimia yang terdapat pada marga Sida, antara lain
alkaloid, leukoantosianidin, flavanoid, tanin, steroid, dan triterpenoid. Khasiat sidaguri dalam menyembuhkan berbagai macam penyakit berhubungan dengan kandungan senyawa kimia yang
dimilikinya, antara lain alkaloid, kalsium oksalat, tanin, saponin, fenol, asam amino, minyak atsiri, steroid, dan zat efedrine (Wijayakusuma et al 1994).
Beberapa penyakit yang dapat disembuhkan dengan cara mengkonsumsi seluruh bagian tanaman,
antara lain nyeri pada pinggang, punggung, bahu, tangan maupun kaki ( Wijayakusuma et al 1994),
antiinflamasi dan hepatoprotektif, mengatasi radang lambung, mencret, disentri, inflamasi, iritasi, bisul, dan
borok (Wijayakusuma et al 1994). Sidaguri dapat juga digunakan untuk mengobati berbagai macam
peradangan dan iritasi pada sistem pernafasan dan sistem urin (Bushell 1998). Berdasarkan penelitian, sidaguri juga dapat digunakan sebagai obat anti gout. Bahan aktif sidaguri dapat menghambat kerja enzim xantin oksidase yang berperan penting dalam menghasilkan asam urat (Iswantini 2004).
Senyawa sekunder merupakan bahan alam yang dihasilkan dari metabolit primer seperti fotosintesis dan respirasi. Beberapa jenis senyawa sekunder tanaman antara lain alkaloid, terpenoid, flavanoid, hormon pertumbuhan, lignin, dan kutikula (Vickery & Vickery 1981). Senyawa sekunder, meskipun tidak penting bagi kelangsungan hidup suatu tanaman, sering berperan dalam kelangsungan hidup suatu spesies sebagai pertahanan untuk berkompetisi dengan spesies lain dan lingkungannya (Manitto 1981). Senyawa sekunder tersebut dibentuk, terutama melalui jalur asetat mevalonat dan asam sikhimat dengan glukosa 6 fosfat sebagai prekusor utamanya (Vickery & Vickery 1981).
Produk utama penyimpanan pada tanaman ialah sukrosa dan pati (Salissbury & Ross 1992). Beberapa penelitian menyebutkan bahwa faktor-faktor seperti iklim, edaphic, zat polutan buatan, dan kompetisi dengan makhluk hidup lain, dapat mempengaruhi pembentukan senyawa sekunder (Harborne 1988). Kondisi kekeringan menyebabkan laju fotosintesis dan pergerakan hormon pertumbuhan menurun, seiring dengan semakin rendahnya potensial air (Harjadi & Yahya 1988). Hal ini menyebabkan tanaman mulai menghidrolisis sukrosa menjadi glukosa dan fruktosa bebas yang akan digunakan sebagai cadangan energi dan pembentukan senyawa sekunder. Volume dan kecepatan aliran sukrosa pada floem menurun, tetapi konsentrasinya semakin meningkat ketika ditranspor ke daun (Harjadi & Yahya 1988). Gupta (2005) melaporkan bahwa kekeringan menyebabkan tanaman lebih banyak memproduksi senyawa sekunder pada daun untuk mempertahankan diri, kemudian di transpor melalui floem ke jaringan tanaman. Belum
diketahui apakah hal yang demikian itu berlaku pada tanaman secara umum, termasuk sidaguri. Distribusi setiap senyawa sekunder pada tanaman berbeda-beda, bergantung pada jenis senyawa, jenis tanaman, dan faktor lingkungan (Harborne 1988).
Tujuan
Penelitian ini bertujuan untuk mengetahui pengaruh cekaman air terhadap pertumbuhan dan perkembangan serta kandungan senyawa sekunder pada tanaman sidaguri. Hipotesis yang diajukan ialah bahwa cekaman air dapat meningkatkan kandungan senyawa sekunder tanaman sidaguri.
Waktu dan Tempat
Plastik Departemen Biologi dan Laboratorium Kimia Analitik Departemen Kimia IPB Dramaga.
BAHAN DAN METODE Bahan dan Alat
Tanaman sidaguri yang berumur 4 bulan, media tanah dan sekam, pupuk kandang dan NPK, alkohol
70%, sapranin, gliserin, reagen folin-ciocalteau 50%, Na2CO3 5%, etanol 70% dan 95%, air bebas ion,
CHCl 2 N, NH4OH, H2SO4 2M, H2SO4 pekat, Pereaksi Dragendorf, Pereaksi Wagner,Pereaksi Mayer,
eter, asam asetat anhidrat, HCl pekat, amil alkohol, FeCL310%, dan NaOH 1N. Polybag ukuran Besar,
penggaris, timbangan, mikroskop okuler, gelas objek dan cover, botol film, gabus, silet, alat tulis, kertas label, termometer, rotavor, oven, dan spektromotometer.
Metode Penelitian
Persiapan Media Tanam
Tanaman yang akan digunakan ialah tanaman yang sudah berumur 4 bulan di lapangan dan
berkualitas baik. Sebelum dipindahkan ke dalam polibag yang berukuran 5 kg, tanaman dipangkas terlebih dahulu yang bertujuan mengurangi laju penguapan. Media tanam yang digunakan ialah campuran tanah, sekam, dan pupuk kandang dengan perbandingan 4:2:1. Tanah untuk penanaman ialah tanah yang diambil dari Kebun Percobaan Cikabayan Biofarmaka, Bogor. Tanah disaring, kemudian dikeringkan di bawah sinar matahari. Setelah cukup kering, contoh tanah diambil untuk dianalisis sifat-sifat fisik dan kimianya di Laboratorium Analisis Tanah, Departemen Ilmu Tanah, Fakultas Pertanian IPB, Dramaga. Sifat fisik yang dianalisis meliputi kadar air tanah pada keadaan kapasitas lapang dan titik layu permanen, sedangkan sifat kimianya yang dianalisis meliputi kandungan hara dan pH tanah sebagaimana terlampir pada Lampiran 1. Berdasarkan analisis sifat fisik dan kimia tanah, menurut Hardjowigeno (1995), tanah yang diambil dari Kebun Percobaan Cikabayan, Bogor tersebut memenuhi kebutuhan media tanam Sidaguri. Setelah
dipindahkan, polybag diletakan dalam rumah plastik. Untuk masa adaptasi, tanaman tetap diberikan air dua kali untuk setiap harinya selama 1 minggu, yakni pada pukul 8-9 pagi dan pukul 3-4 sore sebelum
mendapatkan perlakuan.
Penyiraman dan Perlakuan Cekaman Kekeringan
Perlakuan kekeringan diberikan dengan cara mengurangi jumlah air penyiraman menjadi seperempat dari tanaman kontrol ( 1/4 dari kapasitas lapang), yang diberikan setiap hari antara jam 8-9 pagi. Waktu
pemberian air bergantung pada tingkatan perlakuan kekeringan. Setiap perlakuan diulang sebanyak 10 kali, sehingga terdapat 40 unit perlakuan.
Pengamatan
Parameter yang diamati antara lain laju pertumbuhan dan kandungan senyawa sekunder.
Pengamatan dilakukan setelah tanaman mendapat perlakuan cekaman, bergantung pada tingkatan perlakuan kekeringan. Kandungan senyawa sekunder diukur sebelum tanaman diberi perlakuan, sesudah diberi
perlakuan, dan sesudah tanaman dikembalikan pada keadaan sebelum cekaman.
Ekstraksi
Sampel sidaguri yang digunakan ialah bagian batang dan daun. Untuk batang, diambil kira-kira 15 cm dari permukaan tanah. Untuk daun, diambil dari bagian tajuk tanaman. Sampel sidaguri dibersihkan,
dirajang, dan dikeringkan dengan oven sampai kadar air tinggal 10% pada suhu 95° C. Setelah kering,
dengan pelarut etanol 70%. Kemudian di maserasi dalam lemari es selama 24 jam atau hingga bening. Selanjutnya, disaring dan diuapkan pelarutnya dengan rotary evaporator vakum, sehingga diperoleh ekstrak kental etanol. Ekstrak etanol ini akan digunakan untuk uji kualitatif dan uji kuantitatif.
Uji Kualitatif Uji Alkaloid
Sebanyak 1 gram serbuk sidaguri dilarutkan dengan 10 ml kloroform dan beberapa tetes NH4OH kemudian disaring ke dalam tanung reaksi tertutup. Ekstrak kloroform dalam tabung reaksi dikocok dengan 10 tetes
H2SO4 2 M dan lapisan asamnya dipisahkan ke dalam tabung reaksi yang lain. Lapisan asa ini diteteskan
pada lempeng tetes dan ditambahkan pereaksi Mayer, Wagner, Dragendorf yang akan menimbulkan
endapan warna berturut-turut putih, cokelat, dan merah jingga(Fransworth 1966).
Uji Tanin
Sebanyak 1 gram ekstrak kasar ditambahkan dengan 100 ml air, kemudian dididihkan selama 5 menit dan
disaring. 10 ml filtrat diambil dan ditambahkan larutan FeCl3 1%. Jika terbentuk warna hijau kehitaman
atau biru, menunjukan adanya tanin(Fransworth 1966).
Uji Steroid dan Triterpenoid
Sebanyak 2 gram serbuk sidaguri dilarutkan dengan 25 ml etanol panas (50°C) kemudian disaring ke dalam
pinggan porselin dan diuapkan sampai kering. Residu ditambah eter dan dipindahkan ke dalam lempeng
tetes lalu ditambahkan 3 tetes anhidrida asam asetat dan 1 tetes H2SO4 pekat (Uji Lieberman-Buchard).
Warna merah atau ungu menunjukan adanya triterpenoid dan warna hijau biru menunjukkan adanya steroid (Harborne 1987).
Persiapan pengujian Flavanoid dan Saponin
Sebanyak 1 gram ekstrak kasar ditambahkan air secukupnya sampai zat terendam semua, dan dipanaskan pada penangas air selama 5 menit. Setelah dingin, kemudian disaring dan filtratnya digunakan untuk pengujian.
Uji Flavanoid
Sebanyak 10 ml filtrat ditambahkan 0,5 gram serbuk magnesium 2 ml alkohol klorhidat (campuran HCI 37% dan etanol 95% dengan volume yang sama), dan 20 ml amil alkohol kemudian dikocok dengan kuat. Terbentuknya warna merah, kuning, dan jingga pada lapisan amil alkohol menunjukan adanya flavanoid (Harborne 1987).
Uji Saponin
Sebanyak 10 ml filtrat dikocok kuat dalam tabung reaksi yang tertutup selama 10 detik hingga terbentuk busa. Adanya saponin ditunjukan dengan timbulnya busa setinggi 1 cm yang stabil selama 10-15 menit (Depkes RI 1995).
Uji Total Fenol
Sebanyak 5 mg ekstrak kering dilarutkan dalam 2 ml etanol 95%, kemudian ditambahkan 5 ml aquades dan
0,5 ml reagen folin-ciocalteau 50% (v/v), lalu didiamkan 5 menit. Setelah itu ditambahkan 1 ml Na2CO3
5% (b/v), lalu dihomogenisasi dan diinkubasi dalam gelap selama 1 jam. Kemudian dihomogenisasi kembali dan diukur dengan spektrofotometer pada panjang gelombang 725 nm.
Pemanenan
tanaman sudah mengalami recovery setelah perlakuan cekaman.
Analisis Data
Data hasil pengamatan dianalisis menggunakan sidik ragam Rancangan Acak Lengkap dengan 4 perlakuan
dan 10 ulangan. Untuk mengetahui pengaruh nyata dari perlakuan cekaman, maka digunakan uji F pada α =
5%. Bila terdapat pengaruh nyata dari perlakuan terhadap peubah yang diamati maka setiap taraf perlakuan dibandingkan dengan menggunakan uji lanjut DMRT dengan taraf kesalahan 5%.
HASIL Laju Pertumbuhan
Hasil analisis tanah (Lampiran 1) menunjukkan bahwa kandungan unsur N total rendah, yakni 0,11% dan untuk P tersedia rendah yakni 3,1 ppm. Kandungan unsur K, Ca, Mg, dan Na juga tergolong rendah, yakni 0,08 ; 5,02 ; 2,64 ; 0,12 (me/100g). Tanah yang digunakan tergolong Asam, yakni memiliki pH 5,50. dengan kandungan partikel pasir 10,89%, debu 20.86%, dan liat 68.25 %. Berdasarkan tekstur di atas, tanah termasuk kategori tanah Liat (Pusat Penelitian Tanah 1983).
Kondisi lapangan secara umum (di Dermaga), cukup baik untuk pertumbuhan tanaman obat sidaguri
(Widiana 2004). Suhu harian berkisar 22-32°C, dengan rata-rata kelembaban 80,9% dan curah hujan 20
mm. Penelitian dilaksanakan di rumah plastik, dengan fluktuasi suhu antara 27-29°C.
Keadaan tanaman yang mendapatkan cekaman kekeringan berbeda dengan tanaman kontrol, yaitu warna daun yang berubah menjadi merah tua hingga kuning keemasan, bentuk daun menjadi mengkerut dan kering, warna batang menjadi kecoklatan dan mengering.
Cekaman kekeringan selama 2 minggu menyebabkan penurunan tinggi tanaman, jika dibandingkan dengan tanaman kontrol (Gambar 1). Penurunan tinggi tanaman merata antar tanaman. Adapun fluktuasi yang terjadi pada penurunan pertumbuhan tanaman berkaitan dengan fluktuasi cuaca yang terjadi selama
percobaan. Suhu ruangan di rumah plastik pada umumnya selalu lebih tinggi antara 3-5°C. Hal ini juga
Gambar 1 Pengaruh cekaman air terhadap laju pertumbuhan tanaman sidaguri.
Gambar 2 Pengaruh cekaman kekeringan terhadap produktivitas dan panjang akar tanaman sidaguri.
Ket : Data recovery dihitung 1 minggu setelah cekaman
Cekaman kekeringan juga menyebabkan tidak bertambahnya jumlah cabang dan daun, bahkan berkurang karena beberapa cabang mengering. Hal ini disebabkan karena tanaman cenderung mengurangi laju fotosintesis dan transpirasi, sebagai respon terhadap cekaman yang terjadi (Gambar 1).
Berdasarkan nilai rata-rata, perlakuan cekaman air menyebabkan terjadinya penurunan bobot kering tanaman. Semua tanaman mengalami penurunan pertumbuhan jumlah daun, jumlah batang, dan panjang akar akibat cekaman air (Gambar 3). Penurunan juga terjadi pada pertumbuhan panjang akar. Pertumbuhan panjang akar tanaman yang mendapat perlakuan cekaman menurun secara signifikan jika dibandingkan tanaman kontrol, yakni sebesar 30%.
Uji Fitokimia secara Kualitatif
Pengujian fitokimia dilakukan untuk mengetahui golongan senyawa tertinggi yang terkandung dalam sidaguri. Uji yang dilakukan meliputi uji alkaloid, flavanoid, saponin, tanin, dan steroid/triterpenoid. Penapisan senyawa metabolit ini menggunakan bagian tanaman sidaguri yang sudah dikeringkan dan ekstrak kasar, yakni bagian daun dan batang. Pengujian ini dilakukan pada tanaman sidaguri yang belum mendapatkan perlakuan. Berdasarkan uji kualitatif, daun dan batang sidaguri mengandung bahan aktif alkaloid, flavanoid, quinon, terpenoid, steroid, tanin dan saponin (Tabel 1). Kandungan bahan aktif daun dan batang sidaguri pada dasarnya sama, yang membedakan hanya pada konsentrasinya. Kadar bahan aktif pada batang lebih tinggi konsentrasinya jika dibandingkan pada daun untuk sampel segar yang sudah dikeringkan. Bahan aktif yang terdeteksi dalam jumlah yang relatif tinggi meliputi steroid, tanin, dan saponin (Tabel 1)
Metode ekstraksi untuk menarik senyawa kimiawi tanaman sidaguri yang digunakan ialah maserasi dengan menggunakan pelarut etanol 75%. Hasil analisis fiokimia dari ekstrak kasar menunjukan bahwa kandungan alkaloid dan tanin semakin terlihat jelas dengan perlakuan cekaman 4 minggu (Tabel 2). Senyawa kimia yang terkandung pada daun dan batang juga hampir sama jika dibandingkan dengan sampel segar, yang membedakan hanya pada konsentrasinya saja.
Tabel 1 Kandungan kualitatif tanaman Ssidaguri sebelum dan setelah cekaman air
Senyawa Kontrol 4 Minggu Keterangan
Daun Batang Daun Batang
Alkaloid - * *** ****
Flavanoid * * * *
Quinon * * * *
Terpenoid * * * **
Steroid ** ** * **
Tanin * ** *** ***
Saponin * ** * *
* : Positif Lemah ** : Positif
*** : Positif kuat **** : Positif sangat kuat
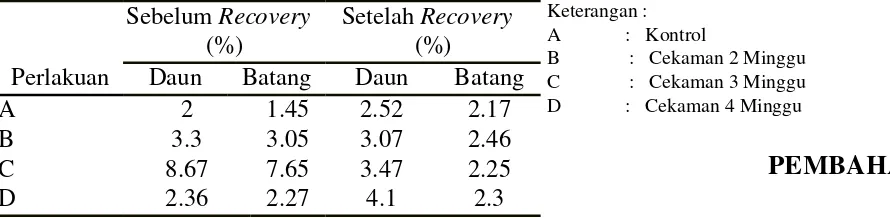
Uji Total Fenol secara Kuantitatif
Perlakuan cekaman kekeringan memberikan
[image:26.612.11.456.251.360.2]pengaruh yang nyata terhadap total fenol daun dan batang. Berdasarkan data yang diperoleh, total fenol daun dan batang meningkat untuk setiap perlakuan, yakni sebesar 50% dari total fenol awal. Ketika tanaman memasuki masa recovery, total fenol mengalami sedikit penurunan, sebelum kemudian naik kembali (Tabel 2)
Tabel 2 Pengaruh cekaman air terhadap kandungan fenol tanaman sidaguri
Perlakuan
Sebelum Recovery (%)
Setelah Recovery (%)
Daun Batang Daun Batang
A 2 1.45 2.52 2.17
B 3.3 3.05 3.07 2.46
C 8.67 7.65 3.47 2.25
D 2.36 2.27 4.1 2.3
Keterangan : A : Kontrol
B : Cekaman 2 Minggu C : Cekaman 3 Minggu D : Cekaman 4 Minggu
PEMBAHASAN
Pertumbuhan Tanaman terhadap Perlakuan Cekaman
Cekaman dapat meliputi segala sesuatu perubahan lingkungan yang mungkin akan menurunkan atau merugikan pertumbuhan dan perkembangan suatu tanaman (Salisbury & Ross 1992). Salah satu jenis
cekaman tersebut adalah cekaman kekeringan yang berkaitan dengan ketersediaan air yang merupakan salah satu faktor pembatas bagi fungsi normal tanaman (Passarakli 2002).
Suatu respon fisiologi yang cukup penting ialah kemampuan tanaman mempertahankan tekanan turgor dengan menurunkan potensial osmotik sebagai mekanisme toleransi terhadap cekaman kekeringan
(Hamim et al 1996). Banyak proses fisiologi dan biokimia dalam tanaman yang sangat dipengaruhi oleh
perubahan tekanan turgor.
Terdapat berbagai macam strategi yang dimiliki oleh tanaman untuk dapat beradaptasi pada kondisi
cekaman kekeringan (Street & Opik 1984). Tanaman dengan tipe dehydration toleran akan memiliki tingkat efisiensi penggunaan air yang tinggi, yang ditunjukan dengan rendahnya produksi berat kering dari tanaman tersebut (Taiz & Zeiger 2002).
Penurunan rata-rata jumlah tinggi tanaman diduga berkaitan dengan rendahnya aktivitas fotosintesis akibat adanya penutupan stomata sebagai respon pertama dari tanaman yang tercekam kekeringan (Gambar 1).
Menurut Tang et al (2002), terjadinya penurunan fiksasi CO2 karena adanya penutupan stomata berdampak
terhadap rendahnya sintesis ATP sebagai produk fotokimia dari fotositem II.
Cekaman kekeringan menyebabkan penekanan perkembangan tajuk tanaman daripada perkembangan akar. Hal ini menyebabkan terhambatnya pertumbuhan tanaman. Cekaman juga menyebabkan meningkatnya produksi hormon Asam Absisat (ABA). Produksi hormon absisat yang tinggi mengakibatkan mereduksinya dinding sel tanaman dan terhentinya perluasan daun, disamping penutupan stomata.
akar. Hal ini diduga berkaitan dengan upaya tanaman dalam mempertahankan status air dengan cara tetap
mempertahankan perkembangan akarnya sehingga mampu mensuplai air dengan cukup (Hamim et al
1996).
Berdasarkan hasil yang diperoleh, laju rata-rata pertumbuhan akar relatif rendah (Gambar 2). Hal ini diduga berkaitan dengan media tanam yang digunakan relatif kecil. Meskipun demikian, rambut-rambut akar dari masing-masing tanaman berkembang sangat baik. Rambut-rambut akar ini diduga berkaitan dengan upaya tanaman untuk mempertahankan status air.
Menurut Lin & Wang (2002) kondisi cekaman kekeringan yang berlangsung dalam waktu cukup lama dapat berdampak dalam waktu cukup lama dapat berdampak terhadap perubahan fisiologi tanaman, dan
berpengaruh terhadap metabolisme tanaman dalam pengambilan nutrisi. Agustina (2003) menyatakan bahwa unsur N dan P merupakan salah satu unsur-unsur yang dibutuhkan tanaman dalam pembentukan biji. Pada kondisi cekaman kekeringan, pengambilan unsur N dan P oleh tajuk tanaman mengalami penurunan akibat rendahnya rata-rata transpirasi yang berperan dalam transpor N dan P dari akar ke tajuk tanaman (Passarakli 2002). Semua tanaman yang mendapat perlakuan cekaman kekeringan mengalami gejala defisiensi unsur hara. Gejala defisiensi unsur hara ini ditunjukan oleh kondisi daun yang berwarna kuning pucat, berukuran kecil tidak berkembang dengan ujung daun menyempit, dan memiliki bercak-bercak hijau kebiruan pada permukaan daunnya. Menurut Bennet (1993), gejala-gejala yang dimiliki oleh tanaman tersebut merupakan gejala yang timbul akibat tanaman kekurangan unsur N dan P yang dibutuhkan selama pertumbuhannya.
Pengaruh Perlakuan Cekaman Air terhadap Kandungan Metabolit Sekunder
Bahan-bahan metabolit sekunder seperti alkaloid, polifenol, flavanoid, golongan terpenoid, dan saponin, dipengaruhi oleh lingkungan tumbuh, pemupukan, umur tanaman saat dipanen, waktu panen, dan pasca panen. Analisis fitokimia merupakan uji pendahuluan untuk mengetahui adanya senyawa-senyawa metabolit sekunder tersebut, terutama bila dilihat pada umur yang berbeda. Selain itu, ingin diketahui perbedaan kandungannya antara simplisia dan ekstrak yang dipekatkan.
Berdasarkan data yang diperoleh, tanaman mengandung alkaloid dan tanin dalam jumlah yang relatif besar. Sedangkan saponin dan steroid dalam jumlah yang kecil. Hal ini disebabkan saponin umumnya bersifat larut dalam air, namun sedikit atau tidak sama sekali larut dalam pelarut etanol dan metanol pekat (Muchtadi 1989). Sama halnya dengan steroid yang mempunyai sifat nonpolar, sehingga kemungkinan telarut dalam pereaksi (Koolman & Rohm 2000).
Kandungan metabolit sekunder antara simplisia dan ekstrak kasar pada dasarnya sama. Perbedaan hanya terletak pada jumlah yang dapat terdeteksi. Hal ini disebabkan karena proses ekstraksi dengan pelarut etanol telah merusak vakuola sel-sel daun yang mengandung senyawa metabolit sekunder, sehingga
mempermudah melarutkanya (Harborne 1987).
Kandungan alkaloid yang tinggi disebabkan karena tanaman yang mengalami kekeringan cenderung mengsekresikan asam absisat dan prolin dalam jumlah yang tinggi, sebagai akibat dari penutupan stomata (Harborne 1988). Prolin termasuk dalam derivat asam glutamat, yang merupakan prekusor utama dari biosintesis ornitin (Vickery & Vickery 1981). Ornitin adalah bahan dasar alkaloid yang banyak terdapat pada tanaman. Alkaloid banyak disintesis di bagian tajuk, sehingga banyak terdapat pada batang.
Fenol merupakan senyawa metabolit sekunder yang paling banyak terdapat dalam tanaman. Fenol disusun dari asam hidroksibenzoat dan fenilpropanoid melalui jalur asam sikhimat (Gerats & Martin 1992).
Senyawa yang tergolong dalam fenol antara lain flavanoid, quinon, dan saponin (Harborne 1988).
senyawa metabolit primer ke dalam alur metabolit sekunder dan menjadi pusat kontrol alur metabolit secara terus-menerus (Edwards & Gatehouse 1999). Senyawa fenol berasal dari fenilopropanoid, dimana enzim penting yang dapat mengkatalisis reduksi deaminatif dari fenilpropanoid menjadi phenylpropanoid trans-cinnamik adalah PAL (Penilalanin amonialiase).
PAL merupakan enzim cabang penting bagi banyak senyawa metabolit sekunder dan telah dipelajari hingga taraf protein dan gen. Aktivitas PAL dapat menjadi pokok yang membedakan respon tanaman terhadap stres, seperti ketika fenilpropanoid akan digunakan untuk pembentukan lignin atau flavanoid, bergantung kebutuhan.
Ketika tanaman mengalami cekaman kekeringan, tanaman akan memberikan respon dengan menurunkan aktivitas enzim PAL. Hal ini menyebabkan tanaman tidak mempunyai enzim yang cukup untuk
melanjutkan ke jalur metabolit sekunder, sehingga tanaman hanya memproduksi senyawa tanin saja. Flavanoid dan quinon memerlukan PAL sebagai prekusor untuk reaksi pembentukannya. Hal ini
menyebabkan hanya kandungan tanin saja yang tinggi, sedangkan kandungan flavanoid dan quinon relatif sedikit jumlahnya (Edwards & Gatehouse 1999).
SIMPULAN DAN SARAN
Simpulan
Perlakuan cekaman kekeringan menyebabkan penurunan laju pertumbuahan, meliputi tinggi tanaman, jumlah cabang, dan jumlah daun. Pada saat panen, terbukti cekaman kekeringan menyebabkan rendahnya bobot kering tanaman. Secara umum kandungan kualitatif sidaguri adalah flavanoid, quinon, tanin, alkaloid, saponin, terpenoid, dan steroid. Perlakuan cekaman kekeringan dapat meningkatkan total fenol pada tanaman, yakni Tanin. Fenol merupakan senyawa metabolit sekunder yang merupakan bahan aktif untuk pembuatan obat.
Saran
Perlu dilakukan penelitian lanjutan dengan memperhatikan komposisi media tanam sebagai tambahan perlakuan.
DAFTAR PUSTAKA
Agustina EF. 2003. Pengaruh Pemberian Pupuk Zeorea pertumbuhan, Produksi dan Kandungan
Protein Kedelai (Glycine max (L.) Merril) [skripsi]. Bogor : Fakultas Matematika dan Ilmu
Pengetahuan Alam, IPB
Bennet WF. 1993. Nutrient Deficiencies & Toxicities in Crop Plants. St Paul : APS Pr
BMG. 2004. Data Klimatologi. Balai Wilayah II, Stasiun Klimatologi Klas I. Bogor : Badan
Meteorologi dan Geofisika
Bushell J. 1998. Australian herbalMedicine Classnote. http:/www.ann.com.aul. herbs/monographs/ sida. Htm. [20 Februari 2008]
Dharma AP. 1985. Tanaman Obat Tradisional Indonesia. Jakarta: Grafindo Press
Gerats AG, Martin C. 1992. Phenolic Metabolisme in Plants, ed Stafford HA & Ibrahim RK.
Secondary Metablilsm hlm 201-210 New York: Plenum Press
Gupta US. 2005. Physiology of Stressed Crops Vol III. United States of America : Science
Publishers Inc
Edwards R, Gatehouse JA.1999. Secondary Metabolism. Ed Lea PJ & Leegood RC. Plant
Biochemical & Molecular Biology 2nd. Hlm 309-315 New York : John Wiley & San Inc
Fransworth NR. 1966. Biological and Phytochemical Screening of Plants. Journal of
Pharmaceutical Science 55(3): 253-264
Hahlbrock K, Scheel D. 1989. Physiology and Molecular Biology of Plants Physiology of
Phenylpropanoid Metabolism. Ann Rev Plants Physiol Plant Molec Biol 40:347-369
Hamim, Jusuf M, Sopandie D. 1996. Beberapa karakteristik morfologi dan fisiologi kedelai toleran
dan peka terhadap cekaman kekeringan. Hayati 1:30-34
Harborne JB. 1988. Introduction of Ecological Biochemistry. Edisi Ketiga . London : Academic Press
Harjadi SS, Yahya S. 1988. Fisiologi Stress Lingkungan. PAU Bioteknologi Institut Pertanian Bogor
Heyne K. 1981. Tumbuhan Berguna Indonesia. Jakarta : Yayasan Sarana Wana Jaya Departemen Kehutanan
Iswantini D, Rahmawati M, Januwati M. 2004. Bioprospeksi Sidaguri dan Seledri : Formulasi Obat Gout danAktivitas Inhibisisnya terhadap Xantin Oksidase. Bogor : Laporan Akhir RUT X
Kassahara S, Hemmi S. 1986. Medicinal Herb Index in Indonesia. Ed ke- 2. Jakarta : PT Eisai Indonesia
Koolman J, Rohm KH. 2000. Atlas Berwarna dan Teks Biokimia. Septelia Inawati, penerjemah.
Jakarta : Hipokrates
Lewis NG, Yamamoto E. 1988. Tannins, Their Place in Plant Metabolisme, in Chemistry and Significan of Conndenses Tannin. Ed Hemmingway RW & Karchesy JJ. New York: Plenum Press
cultivars than in Tolerant cultivars in sprinn Wheat. Plant Sci 163 : 627- 637
Manitto P.1981. Biosintesis Produk Alami. Terjemahan Koensoemardiyah Dra. England: Ellis Horwood Limited
Muchtadi D. 1989. Aspek Biokimia dan Gizi dalam Keamanan Pangan. Bogor :Pusat Antar Universitas Pangan dan Gizi, Institut Pertanian Bogor
Passarakli M. 2002. Handbook of Plant and Crop Stress, 2nd edition. New York: Marcel Dekker
Pusat Penelitian Tanah. 1983. Kriteria Penilaian Sifat-sifat Tanah. Departemen Tanah, Fakultas pertanian, IPB. Bogor
Salissbury FB, Ross CW. 1992. Fisiologi Tumbuhan Jilid 2. Bandung : Institut Teknologi Bandung
Salissbury FB, Ross CW. 1992. Fisiologi Tumbuhan Jilid 3. Bandung : Institut Teknologi Bandung
Steenis VC. 1987. Flora untuk Sekolah di Indonesia. Cetakan ke- 4, Terjm Moeso Surjowinoto. Jakarta : PT Pradya Pratama
Street HE, Opik H. 1984. The Physiology of Flowering Plants: Their Growth and Development,
3rd edition. London: Edward Arnold
Taiz L, Zeiger E. 2002. Plant Physiology. Canada: The Benjamin Cummings
Tang AC, Kawamitsu Y, Kanechi M, Boyer JS. 2002. Pothosynthetic oxygen evolution at low water potential in leaf discs lacking an epidermis. Ann of Bot 89: 861- 870
Valkenburg JLCH van, N Bunyapraphatsara. 2001. Plant Resources of South-East Asia. No 12 (2). Medicinal and Poisonous Plants 2. Backhuys Publishers. Leiden.
Vickery B, Vickery ML. 1981. Secondary Plant Metabolism. London : The Macmillan Press LTD
Wahid L. 1993. Medicinal and Aromatic Plants in Indonesia. Proceeding Medicinal and Aromatic Plants in Asia. Thailand: RAPA Publication. Food and Agliculture Organization of the United Nations.
Lampiran 5 Keadaan Tanaman selama Penelitian
Gambar 4 Akar Sidaguri
[image:34.612.4.321.114.316.2]Gamabar 3 Keadaan setelah perlakuan
Gambar 5 Tanaman Kontrol Gambat 6 Buah Sidaguri
Lampiran 4 Rataan Laju Pertumbuhan Tanaman Sidaguri
Sebelum
Recovery
Perlakuan
Tinggi (cm)
Jumlah Cabang
Jumlah Daun
(helai)
Kontrol
48
±
2,79cd
14,8
±
1,2bcd
171,6
±
13,60bcd
2 Minggu
43,2
±
2,79d
11,8
±
1,2ad
140
±
13,60ad
3 Minggu
39,2
±
2,79a
9,7
±
1,2a
113,3
±
13,60a
4 Minggu
35,4
±
2,79ab
7,4
±
1,2ab
88,3
±
13,60ab
Keterangan: Angka yang diikuti dengan huruf abjad berbeda nyata berdasarkan uji Duncan dengan
Setelah
Recovery
Perlakuan
Tinggi (Cm)
Jumlah Cabang
Jumlah Daun (helai)
Kontrol
71,3
±
4,53cd
15
±
1,54cd
138
±
12,2
2 Minggu
62,5
±
4,53d
12,5
±
1,54
76
±
12,2
3 Minggu
57
±
4,53a
10,16
±
1,54a
67
±
12,2
4 Minggu
50,6
±
4,53ab
9,3
±
1,54a
67
±
12,2
Keterangan: Angka yang diikuti dengan huruf abjad berbeda nyata berdasarkan uji Duncan dengan
λ
= 5%
Rataan Pertumbuhan Panjang Akar
Perlakuan
Cekaman
Recovery
Kontrol
31
±
2,9bcd
36,25
±
7,1cd
2 Minggu
23,5
±
2,9ad
23,75
±
7,1
3 Minggu
19
±
2,9ad
15,75
±
7,1a
4 Minggu
12,5
±
2,9abc
10,25
±
7,1a
Keterangan: Angka yang diikuti dengan huruf abjad berbeda nyata berdasarkan uji Duncan dengan
Lampiran 5 Rataan Produktivitas Tanaman Sidaguri
Bobot Basah
Perlakuan
Cekaman
Recovery
Panen
Kontrol
70
±
3,85bcd
92,1
±
7,3cd
100,6
±
7,28cd
3 Minggu
44,1
±
3,85ab
75,1
±
7,3a
82,9
±
7,28a
4 Minggu
36,8
±
3,85ab
66,6
±
7,3a
74,56
±
7,28cd
Keterangan: Angka yang diikuti dengan huruf abjad berbeda nyata berdasarkan uji Duncan dengan
λ
= 5%
Bobot Kering
Perlakuan
Cekaman
Recovery
Panen
Kontrol
46,1
±
3,65cd
50
±
2,43bcd
50,86
±
8,83cd
2 Minggu
37,8
±
3,65d
42
±
2,43ad
35,1
±
8,83a
3 Minggu
29,63
±
3,65a
37,36
±
2,43ad
21,9
±
8,83a
4 Minggu
25,5
±
3,65ab
31,6
±
2,43abc
19,7
±
8,83a
Keterangan: Angka yang diikuti dengan huruf abjad berbeda nyata berdasarkan uji Duncan dengan
λ
= 5%
Bobot Pasca Panen
Perlakuan
Tinggi
J. Cabang
J. Daun
2 Minggu
80,5
±
4,54d
25
±
1,32acd
100
±
5,28acd
3 Minggu
72,8
±
4,54a
21,6
±
1,32abd
86,6
±
5,28abd
4 Minggu
68
±
4,54ab
17
±
1,32abc
68
±
5,28abc
Keterangan: Angka yang diikuti dengan huruf abjad berbeda nyata berdasarkan uji Duncan dengan
λ
= 5%
Lampiran 6 Klasifikasi Menurut Stennis (1987)
Kingdom : Plantae
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledoneae
Ordo : Malvales
Famili : Malvaceae
Genus :
Sida